Ванадий. Свойства ванадия. Применение ванадия
Описание и свойства ванадия
Ванадий первоначально был обнаружен мексиканцем А.М. Дель Рио в рудах бурого цвета, содержащих свинец, которые при нагревании давали красноватый цвет.

Но официальное признание элемент получил позднее, когда его обнаружил химик из Швеции Н.Г.Сефстрем при исследовании железной руды из местного месторождения и дал ему название Ванадий созвучное с именем Ванадис, которое носила древнегреческая богиня красоты.
По внешнему виду металл напоминает сталь своим серебристо-серым цветом. Но на этом сходство заканчивается. Строение ванадия: кубическая объемноцентрированная решетка с параметрами a=3,024A и z=2. Плотность составляет 6,11 г/ см3.
Плавится он при температуре 1920о С, а кипеть начинает при 3400оС. А вот нагревание на открытом воздухе до температуры выше 300оС снижает пластические свойства металла и делает его хрупким, повышая при этом твердость. Понять такое поведение помогает строение атома металла.
Ванадий элемент, имеющий атомный номер 23 и атомную массу 50,942, он относится к V группе четвертого периода системы Д. Менделеева. А это означает, что атом ванадия состоит из 23-х протонов, 23-х электронов и 28-ми нейтронов.

Несмотря на то что это элемент V группы, валентность ванадия не всегда равна 5. Она бывает 2, 3. 4 и 5 с положительным знаком. Разные значения валентности объясняются разными вариантами заполнения электронных оболочек, при которых они приходят в стабильное состояние.
Известно, что положительное значение валентности определяется числом отданных атомом химического элемента электронов, а отрицательное – числом электронов, присоединенных к внешнему энергетическому уровню для формирования его стабильности. Электронная формула ванадия — 1s 22s 22p 63s 23p64s 23d3.
Он может легко отдать два электрона с 4-го подуровня, при этом его степень окисления обусловлена 2-х валентным положительным проявлением. Но атом этого элемента способен отдавать еще 3 электрона с предшествующей внешнему подуровню орбиты и проявить максимальную степень окисления, равную +5.
Оксиды этого элемента с валентностью от 2-х до 5 различны по своему химическому проявлению. Оксиды VO и V2O3 имеют основной характер, VO2 – амфотерный и V2O5 – кислотный.

Чистый металл отличается своей пластичностью и поэтому хорошо обрабатывается ковкой, штамповкой, прессованием и прокаткой. Обработка сваркой и резкой должны проходить в инертной среде, т. к. при нагревании теряется пластичность.
При обработке металл практически не подвержен наклепу и может выдержать большие нагрузки при обжатии в холодном виде без промежуточного отжига. Он устойчив к коррозии и не изменяется под влиянием воды, в том числе и морской, а также слабых растворах некоторых кислот, солей и щелочей.
Месторождения и добыча ванадия
Ванадий химический элемент, достаточно распространенный в земных породах, но в чистом виде не встречается, присутствуя в минералах в рассеянном состоянии. Скопления его в породах присутствуют очень редко. Это редкий металл. Руда с содержанием 1% чистого вещества относится к категории богатой.
В промышленности не пренебрегают даже рудами с содержанием 0,1% дефицитного элемента. В малых концентрациях он встречается более чем в сорока минералах. Значимыми для промышленности можно назвать роскоэлит, называемый ванадиевой слюдкой, в котором содержится до 29% пятиокиси V2O5, карнотит (урановая слюдка), содержащий 20% V2O5, и ванадинит с содержанием 19% V2O5.

Крупные месторождения руд, содержащие металл, находятся в Америке, ЮАР, России, Финляндии и Австралии. Большое месторождение есть в горах Перу, где он представлен патронитом V2S5, содержащим серу. При его обжиге образуется концентрат, содержащий до 30% V2O5.
Найден минерал в Киргизии и Казахстане. Знаменитое Кызылординское месторождение является одним из крупнейших. В России его добывают в основном в Краснодарском крае (Керченское месторождение) и на Урале (Гусевогорское месторождение титаномагнетитов).
Технология извлечения металла зависит от требований к его чистоте и области использования. Основные методы, применяемые в технологии его получения – это йодидный, кальцетермический, алюминотермический, углетермический в вакууме, хлоридный.
В основе технологии йодидного метода лежит термическая диссоциация йодида ванадия. Распространенным является получение металла восстановлением V2O5 термическим методом с применением кальция или алюминия.
При этом происходит реакция по формуле: V2O5+5Ca = 2V+5CaC+1460 кДж с выделением тепла, которого достаточно для расплавления образовавшегося V, что позволяет ему стекать и собираться в твердом виде. Чистота металла, полученного таким способом, достигает 99,5%.
Современный способ извлечения V — это восстановление оксидов в условиях вакуума углеродом при температуре от 1250о С до 1700о С. Метод хлоридной добычи заключается в восстановлении VCl3 жидким магнием.
Применение ванадия
Одно из основных применений металл нашел в качестве легирующей добавки — феррованадия для улучшения качества сталей. Добавление ванадиевой лигатуры повышает прочностные параметры сталей, а также ее вязкость, износостойкость и другие характеристики.
При этом добавка выполняет функцию как раскислителя, так и карбидообразующего компонента. Карбиды равномерно располагаются в сплаве, предотвращая структурный рост зерен стали при нагревании. Легированный ванадием чугун также способствует улучшению его качеств.
Применяется ванадий для улучшения сплавов на основе титана. Есть сплавы титана, в составе которых содержится до 13% этой легирующей добавки. Присутствует ванадий также в сплавах ниобия, тантала и хрома, используемых в авиационной промышленности, а также алюминиевых, титановых и других материалах авиации и ракетостроения.
Уникальность элемента позволяет использовать его в атомной отрасли при производстве канальных труб ТВЭЛов для атомных станций, т. к. он, как и цирконий, обладает свойством малого поперечного захвата тепловых нейтронов, что важно при протекании ядерных реакций. В атомно-водородной технологии используют хлорид ванадия для термохимического взаимодействия с водой.
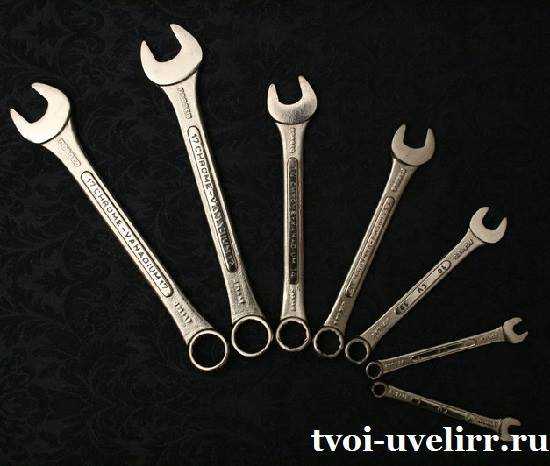
Используют ванадий в химической и сельскохозяйственной отрасли, медицине, стекольном производстве, текстильной области, лакокрасочном производстве и изготовлении аккумуляторов. Широко распространены ручные инструменты и оснастка из сплава хром ванадий, отличающиеся своей прочностью.
Одно из последних направлений — это электроника. Особенно интересным и перспективным является материал на основе диоксидов титана и ванадия. Соединенные определенным образом, они создают систему, обладающую способностью значительно увеличивать память и скорость компьютеров и других электронных устройств.
Цена ванадия
В качестве готового сырья ванадий выпускают в виде слитков, прутков, кругов, а также оксидов. В ассортименте многих предприятий, занимающихся производством этого тугоплавкого металла, представлены сплавы различных марок. Цена во многом зависит от назначения, чистоты металла, способа производства, а также вида продукции.

Например, Екатеринбургское предприятие НПК «Специальная металлургия» реализует слитки по цене 7 тыс. за кг, лом — по цене от 440 до 500 тыс. за тонну, слитки марки ВНМ-1 по цене 500 тыс.за тонну. Цена может меняться также в зависимости от рыночных условий и спроса на продукцию.
tvoi-uvelirr.ru
Металл ванадий — свойства и стоимость ванадия
Элемент, открытый учеными дважды, сегодня мы знаем как ванадий. Википедия детально раскрывает перипетии его обнаружения, поэтому остается добавить, что название этого пластичного металла могло быть совсем иным. Действительно, мексиканскому профессору минералогии А. Мануэлю, первым выделившим неизвестный доселе металл из свинцовых руд, на заре XIX века не хватило исключительно уверенности в собственной правоте.
Содержание статьи:
1. Свойства металла
2. Соединения ванадия
3. Производство
3.1. Промышленный выпуск чистого ванадия
4. Прокат ванадия
5. Применение ванадия – от ярких красок до составляющей пороха
6. Ванадий в современных реалиях
6.1. Стальной удел элемента
6.2. С прицелом на будущее
7. Стоимость ванадия -средние цены
8. Лом ванадия
9. Видео — интересное о ванадие
Поэтому, окончательное наименование элемент получил тремя декадами позже, когда в 1830 году швед Н. Сефстрем обнаружил его в железной руде. Привлекающая взор окраска соединения на базе V подтолкнула химика к национальному фольклору, а именно, богине любви и красоты Ванадис. Так, мифологический скандинавский персонаж дал имя реальному металлу, ставшему полноправным членом Периодической системы элементов.
Свойства ванадия
На внешний вид, элемент обладает сходством со сталью, также имея серебристо-серый оттенок. Однако, в отличие от низкоуглеродистого железа, металл ванадий характеризуется пластичностью. Это свойство сохраняется у вещества до температуры 300 0С, превышение которой резко снижает пластичность и металл становится хрупким. Аналогичный эффект оказывают примеси водорода, азота или кислорода в металле.

На фото: металл ванадий
Ванадий относится к тугоплавким металлам, с соответствующим температурным пределом – 1887 0С. Это объясняет его низкую жаростойкость – свойство, характерное для переходных элементов, вследствие рыхлости оксидов, формируемых на их основе. Ванадий устойчив к деформации ползучести вплоть до температуры 675 0С, чему способствует пятиокись ванадия. Пленка этого соединения образуется при окислении металла, сохраняя прочную связь с его поверхностью до указанного температурного предела.

Ванадий в таблице Менделеева
Ванадий — химический элемент V, относящийся соответственно собственной валентности к пятой группе Периодической системы. Его атомные характеристики: номером – 23, масса – 50.9. В природе различают два изотопа элемента: наиболее распространенный –51V и радиоактивный – 50V, доля которого составляет 0.25%. Радиоактивность изотопа 50V выражена достаточно слабо, фактически его можно считать стабильным, поскольку период полураспада существенно превышает триллионы лет.
Кристаллическая структура ванадия характеризуется объемно-центрированной кубической решеткой, что также свойственно тугоплавким металлам. Его плотность 6.11 грамм на куб. см. Металл ковок, прост в обработке давлением.
Содержание V внутри земной коры достигает 0.0015%, что характеризует его как распространенный элемент. С другой стороны, ванадий – рассеянный металл, поскольку не имеет самостоятельных минералов или концентрированных залежей. Обнаружить вещество можно в его сульфиде — патроните, ванадините, а также ряде других пород: роскоэлит, деклуазит, карнотит.
Соединения ванадия
Электронная формула ванадия — KL3s23p64s23d3, где валентными оказываются 5 электронов на внешних 4s- и 3d-орбиталях. Это обуславливает степень окисления металла: +2 – +5. При этом кислотной базой обладает только пентоксид ванадия – V2O5. Остальные его соединения с кислородом: имеют основной – VO, V2O3 или амфотерный – оксид ванадия VO2, характер.
Наиболее ценным из окислов металла считается пятиокись ванадия, цена которой формируется, соответственно ее интенсивному применению для производства мощных литиевых аккумуляторов. Там, порошкообразное вещество со слабым оранжевым оттенком – пятиокись ванадия используется в качестве анода.
Среди прочих соединений ванадия, практическое применение нашли:
- Сульфиды. Пятивалентный V2S5 – известен как природный минерал патронит и представляет собой черный порошок.
- Фториды. Двухвалентные VF2 – фиолетовые кристаллы, тогда как пятивалентный VF5 – белое твердое вещество, способное разъедать стекло.
- Хлориды. Из трехвалентного VCl3 путем восстановления получают металлический элемент.
Впрочем, наибольшее промышленное использование остается за ванадиевыми окислами, в частности V2O5.

Соединения ванадия
Производство ванадия
Важным промышленным источником пластичного металла выступают три вида руд:
- титаномагнетитовые;
- медно-свинцово-цинковые.
Дополнительные источники ванадия – это ранее перечисленные минералы, а также урановое сырье, горючие сланцы. Во втором случае, металл выступает побочным продуктом, получаемым в результате переработки основного сырья.

Бруски ванадия
Существует несколько способов извлечения ванадия, суть которых сводится к получению окислов металла:
- Выщелачивание руды, водными растворами, кислотами. Предварительно, исходное сырье отжигают. На следующей стадии выполняют выщелачивание основой или кислотной средой. Последний этап состоит в выделении гидратированного оксида ванадия из растворов методом гидролиза.
- Изначально, железные или другие ванадийсодержащие руды плавят в домне. Процесс характеризуется переходом V в чугун. Переработка черного металла в сталь сопровождается образованием шлаков, содержащих до 16% пентоксида ванадия. Выделение пятиокиси происходит в два этапа. Предварительно, шлаки обжигают с поваренной солью. Далее, полученный продукт выщелачивают: вначале водой, после разбавленной серной кислотой.
Результирующий продукт – V2O5 используется для получения металлического ванадия или его сплавов с железом. Феррованадий характеризуется широкой вариацией V в соединении от 35 до 70%.

Феррованадий FeV50
Промышленный выпуск чистого металла
Металлический ванадий реализуется в двух физических состояниях: твердом – куски и порошкообразном. Слитки ванадия изготавливают методом выплавки внутри электроннолучевых печей. Это современная установка, оборудованная двумя видами пушек: термоэлектронные и ВТР. Непосредственно рабочий процесс получения слитков, происходит согласно технологии капельной плавки в охлаждаемый водой кристаллизатор. Он изготовлен из меди и устанавливается вертикально.
По степени чистоты различают три марки ванадия в слитках:
Все они производятся согласно ТУ 48-4-272-73, обладают цилиндрической формой с габаритами по длине: 20 – 80 см; и диаметру 80, 100, 120 и 150 мм. Вес бруска колеблется от 8 до 80 кг.
Порошкообразный металл изготавливается посредством электролитического рафинирования. В качестве исходного сырья выступает алюминотермический V. Результирующий электролитический порошок ванадия также имеет три степени чистоты, определяемых его маркой:
Исходный кусковой металлический ванадий, получаемый алюминотермической технологией, характеризуется более низкой чистотой. Его состав: V – свыше 95%, Al менее 2% и Fe до 0.3%.
Прокат ванадия
Сегодня, металл доступен не только слитками, кусками или порошком. Ванадий купить реально в виде изделий проката, производимых согласно ТУ 48-4-373-76. Основные виды реализации – это:
- трубчатый профиль.
Аналогично слиткам, проволока из ванадия также выпускается тремя сортами ВнПр-0, 1 и 2. Их чистота аналогична соответствующим маркам металла в слитках. Наряду с прутками, проволокой, а также листовым прокатом, высоким спросом пользуется трубка из ванадия.
Полоса ванадия выпускается двух марок ВнПл-1 и ВнПл-2, отличающихся степенью чистоты базового металла. Листовая продукция металла отличается оригинальность исполнения. Например, лента ванадия имеет широкую вариацию по ширине и толщине, а также обладает закругленными краями в целях безопасности. Дополнительно, ленточный прокат может иметь специальное покрытие под эксплуатацию в неблагоприятных климатических условиях.
Применение ванадия – от ярких красок до составляющей пороха

Ванадий 5 окись (пятиокись ванадия)
Толчком для использования пластичного металла человеком стали исследования Н. Зинина. Описанный химиком синтез анилина из нитробензола предоставил новые перспективы разработки синтетических красителей. Именно в этой отрасли, соединения ванадия с их яркой окраской, оказались более чем к месту. Как результат, металл начал интенсивно использоваться в производстве не только красок, но и цветной керамики, стекла. Это подняло спрос на пятиокись ванадия, купить которую было выгодно по следующим соображениям: одной весовой порции V2O5 достаточно для преобразования бесцветной анилиновой соли (200 тысяч аналогов по массе) в красящее вещество. Подобную эффективность ванадий показал и в окрашивании индиго, что нашло применение металлу под производство цветных тканей из шелка и ситца.
Новый интерес к металлу возник с началом XX и связан с первой мировой войной. Причина тому, высокая потребность в серной кислоте, как сырья для нитроклетчатки – базового компонента боевых порохов. Естественно, производство h3SO4 не требует ванадия напрямую. Однако, оксиды и соли этого элемента способны значительно ускорять крайне медленную реакцию взаимодействия сернистого ангидрида с кислородом. Именно она лежит в основе производства серной кислоты. Ванадий вытеснил более дорогой катализатор – платину. Преимущества пятиокиси V2O5 – очевидны, она существенно дешевле платины и требуется в меньших количествах.

Ванадий в современных реалиях
Области современной эксплуатации тугоплавкого металла по-прежнему включают использование катализаторов на его основе. Расширилась только сфера применения: наряду с производством серной кислоты, ванадиевые соединения задействованы для крекинга нефти, например. Также с их участием происходит получение уксусной кислоты, прочие технологические процессы промышленной химии.

Катализатор ванадий-содержащий
Остальные сферы промышленного применения ванадия в корне отличаются от его изначального использования. Основные акценты использования V и соединений на его основе, сегодня включают:
- производство стали;
- изготовление химических источников тока;
- агротехнический сектор;
- атомно-водородная энергетика.
О применении пятиокиси ванадия в качестве анода для мощных литиевых аккумуляторов уже упоминалось ранее. Другое соединение – ванадат серебра, напротив, используется под катоды резервных батарей.
Малая величина поперечного сечения неупругого рассеивания нейтронов обуславливает эксплуатацию элемента для нужд атомно-водородной энергетики. Например, ванадий используется в качестве материала для ядерных реакторов на быстрых нейтронах. Альтернативно, хлорид этого металла – компонент процесса термохимического разложения воды.
Сельское хозяйство начинает использовать ядохимикаты и даже микроудобрения, в составе которых присутствуют соединения пластичного металла.
Стальной удел элемента
Наибольшая сфера реализации ванадия, несомненно, черная металлургия. Как бытовой пример, можно привести гаечный ключ, маркированный известной многим пометкой – хром ванадий.

Гаечный ключ хром-ванадий
В производстве высокопрочных сталей – ванадий оказывается широко востребованной легирующей добавкой. Промышленное начало использованию элемента V для создания сталей, обладающих одновременно улучшенной твердостью, вязкостью и легкостью, положила лаборатория Форда еще в начале XX века.
Одновременно с этим, французские инженеры легировали ванадием сталь для изготовления бронирующих плит, а впоследствии пушек военных самолетов. Внедрение V на уровне десятых долей процента совместно с хромом привело к созданию облегченной стали, с улучшенными показателями прочности. Дополнительные преимущества хромованадиевых марок стали – вязкость, повышенная износоустойчивость.
Сегодня, сталь марок «хром-ванадий» интенсивно используется при изготовлении различного обрабатывающего: резцы, сверла; и прочего инструмента. Машиностроение использует этот материал под стенки цилиндров дизельных моторов, благодаря его высокой устойчивости к истиранию, продлевающей эксплуатационный ресурс деталей.

Цилиндры дизельного мотора
Среди цветных металлов, легированных ванадием выделим:
- Алюминий. Включение в метал 3% V привело к созданию марки «Вавилиом». Этот алюминий обладает высокой твердостью, устойчив к влаге и даже воздействию соленой воды. 2-процентное легирование алюминия ванадием применяется в производстве духовых музыкальных инструментов.
- Медь. Металл, содержащий 8% V, выступает в качестве сырья для получения медных сплавов. Те же латунь и бронза, с добавкой ванадия до половины процента приобретают механические свойства аналогичные стали, вследствие чего используются в производстве ответственных деталей, узлов оборудования.
- Никель. Его сплав с ванадием (20%) отличается высокой химической стойкостью. Подобная инертность способствует изготовлению лабораторной посуды.
Дополнительно, элементом V легируют сплавы титана, и даже благородные металлы, золото, например.
Резюмируя важность пластичного металла в промышленном прокате, достаточно отметить один факт. Современное производство ванадия до 80% ориентировано на нужды металлургии, преимущественно под производство нержавеющих и инструментальных сталей.
С прицелом на будущее
Отличительной особенностью легирования стали ванадием, от добавок других тугоплавких металлов, молибдена, например, выступает установленный характер улучшения свойств базового материала. Внедрение ванадия в расплавленную сталь приводит к его активному взаимодействию с азотом и кислородом, о чем уже упоминалось ранее. Как результат, газы, поглощенные расплавленным металлом, не остаются внутри него после застывания. Кислород и азот, прореагировавшие с ванадием, преобразуются в жидкий шлак, выводимый на поверхность расплава и удаляемый в процессе плавки.
Вторая важная особенность – ванадий взаимодействует с углеродом. Это приводит к изменению структуры черного металла: на место растворенного углерода приходят карбиды ванадия, характеризуемые повышенной твердостью и жаростойкостью. Одновременно с этим, карбиды слабо растворимы в железе, что отражается в их неравномерном распределении по объему металла. Этот фактор препятствует созданию крупных кристаллических структур внутри стали, делая ее мелкозернистой. Подобная мелкокристаллическая структура обуславливает высокую ударную вязкость, делая сталь ковкой и одновременно твердой, а также улучшая характеристики износа металла.
Четкое понимание механизма улучшения параметров стали ванадием, способствует дальнейшему технологическому прогрессу в легировании черных металлов.
Стоимость ванадия
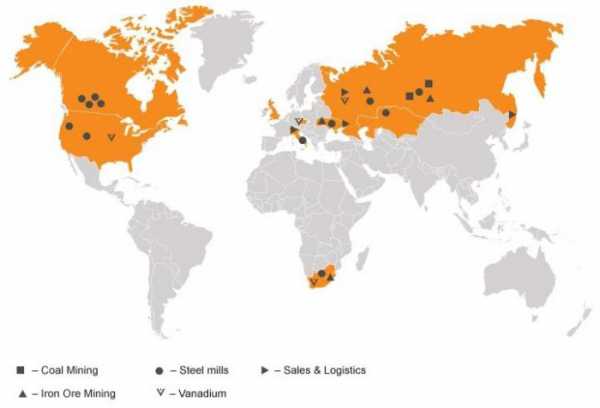
Основные месторождения тугоплавкого металла расположены в США, Китае, России, ЮАР и Армении. Современный уровень годового производства ванадия составляет порядка 90 тысяч тонн. Лидерство по выпуску металла удерживает Китай, на долю которого приходится более половины предложений. Как результат, именно Поднебесная оказывается основным регулятором цены на ванадий.

Добыча ванадиевой руды на месторождениях в России
Современная тенденция роста стоимости ванадия сохраняется уже не одну декаду. Это связано с ростом потребления металла. Основной вклад в востребованность элемента вносит растущее производство легированных сталей. Как считают эксперты, цена на ванадий сегодня, еще не обрела собственного максимума, ее рост прогнозируется минимум до 2020 года. Эти перспективы достаточно консервативны, поскольку объем использования конструкционных сталей ежегодно увеличивается. Таким образом, продать ванадий будет несложно еще несколько десятков лет.
Говоря языком цифр, можно выделить еще одну особенность металла – ванадий. Цена за кг его определяется видом продукции.
Так, наиболее дорогостоящим оказывается прокат: полоса, проволока – около $2000. На сотню долларов дешевле пруток. Непосредственно слитки металла марки ВнМ-1 стоят $200, что на порядок дешевле проката. Стоимость пятиокиси ванадия, и того меньше: $35 – 40 за килограмм. Цифры приведены с учетом расценок на металл к началу 2017 года.
Лом ванадия
Отходы чистого металла принимаются достаточно редко. Это связано со спецификой использования элемента, 80% которого расходуется на легирование стали, прочие отрасли металлургии. Основные источники лома ванадия:
- легированная сталь, марка которой содержит Ф в наименовании;
- ванадийсодержащие отходы, включая сплавы, приборы, конструкционные элементы узлов оборудования;
- соединения на базе металла.
Сегодня, даже используя интернет, достаточно непросто определить сколько стоит лом ванадия. Цена отходов, содержащих этот металл, определяется его процентным вхождением и в большинстве случаев указывается, как договорная. С другой стороны, практически все пункты приема, не откажутся от любого лома, в составе которого присутствует ванадий. Цена за грамм металла может быть рассчитана самостоятельно, по итогам сделки с приемщиком. Впрочем, это скорее дело интереса.
Видео — про металл ванадий
xlom.ru
свойства, атомная масса, формула, применение :: SYL.ru
Ванадий представляет собой химический элемент, обозначаемый символом «V». Атомная масса ванадия 50,9415 а. е. м., атомный номер – 23. Это твердый серебристо-серый, ковкий и плавкий металл, редко встречающийся в природе. Входит в состав более чем 60 минералов и даже может содержаться в ископаемом топливе.

Непризнанное открытие
Металл ванадий впервые был обнаружен мексиканским минерологом испанского происхождения Андресом Мануэлем Дель Рио в 1801 году. Исследователь извлек новый элемент из образца добытой в Мексике «коричневой» свинцовой руды. Как оказалось, соли металла обладают большим разнообразием цветов, поэтому Дель Рио первоначально назвал его «panchromium» (от греческого «παγχρώμιο» — «разноцветный»).
Позже минеролог переименовал элемент в erythronium (от греческого «ερυθρός» — «красный»), потому что большая часть солей приобретала красной оттенок при нагревании. Казалось бы, невероятная удача улыбнулась малоизвестному в Европе ученому. Открытие нового химического элемента ванадия сулило если не славу, то, как минимум, признание коллег. Однако из-за отсутствия весомого авторитета в научном мире достижение мексиканца проигнорировали.
В 1805 году французский химик Ипполит Виктор Колле-Декотильс предположил, что новый элемент, исследованный Дель Рио, был всего лишь образцом хромата свинца с примесями. В конечном итоге мексиканский исследователь, чтобы окончательно не потерять лицо перед ученой братией, принял утверждение Колле-Декотиля и отказался от своего открытия. Впрочем, его достижение не кануло в небытие. Сегодня Андрес Мануэль Дель Рио признан как первооткрыватель редкого металла.
Повторное открытие
В 1831 году швед Нильс Габриэль Сефстрём вновь обнаружил химический элемент ванадий в оксиде, полученном им при работе с железной рудой. В качестве его обозначения ученый выбрал литеру «V», которая еще не была присвоена ни одному элементу. Сефстрём назвал новый металл из-за его красивой и богатой окраски в честь древнескандинавской богини красоты Ванадис.
Новость вызвала повышенный интерес в научном сообществе. Сразу вспомнили о работах мексиканского минеролога. В том же 1831 году Фридрих Вёлер перепроверил и подтвердил предыдущее открытие Дель Рио. А геолог Джордж Уильям Фезерстонхауп даже предложил назвать металл «рионием» в честь первооткрывателя, но инициатива поддержана не была.

Неуловимый
Выделение металла ванадия в чистом виде оказалось затруднительным. До этого ученые работали лишь с его солями. Именно поэтому истинные свойства ванадия били неизвестны. В 1831 году Берцелиус сообщил о получении металлизированного вещества, но Генри Энфилд Роско доказал, что Берцелиус фактически произвел нитрид ванадия (VN). В конечном итоге Роско произвел металл в 1867 году путем восстановления хлорида ванадия (VCl2) под действием водорода. С 1927 года чистый ванадий получают путём восстановления пентаоксида ванадия с участием кальция.
Первое серийное промышленное использование элемента относится к 1905 году. Металл добавляли в стальной сплав для изготовления шасси гоночных автомобилей, а позже – в Ford Model T. Характеристики ванадия позволяют снизить вес конструкции, одновременно увеличивая прочность на растяжение. Кстати, немецкий химик Мартин Хенце обнаружил ванадий в клетках крови (или целомических клетках) морских обитателей – акцидий – в 1911 году.

Физические свойства
Ванадий представляет собой ковкий серо-синий металл средней твёрдости со стальным блеском и плотностью 6,11 г/см³. Некоторые источники описывают материал как мягкий, имея ввиду его высокую пластичность. Кристаллическая структура элемента сложнее большинства металлов и сталей.
Ванадий обладает хорошей устойчивостью к коррозии, щелочам, серной и соляной кислотам. Он окисляется на воздухе при температуре около 660°С (933К, 1220°F), хотя пассивация оксида происходит даже при комнатной температуре. Плавится данный материал при достижении температуры 1920°С, а при 3400°С — закипает.
Химические свойства
Ванадий под воздействием кислорода образует четыре типа оксидов:
Цвет | Плотность | Кипение | Плавление | |
VO (II) | Чёрный | 5,76 г/см³ | 3100°C | 1830°C |
V2O3 (III) | Чёрный | 4,87 г/см³ | 3000°C | 1967°C |
VO2 (IV) | Тёмно-синий | 4,65 г/см³ | 2700°C | 1542°C |
V2O5 (V) | Оранжевый | 3,357 г/см³ | 2030°C | 670°C |
Соединения ванадия типа (II) являются восстановителями, а соединения типа (V) — окислителями. Соединения (IV) часто существуют как производные катиона ванадила.
Оксид
Наиболее коммерчески важным соединением является пятиокись ванадия. Это коричнево-жёлтое твёрдое вещество, хотя при свежевыпакованном осаждении из водного раствора его цвет является тёмно-оранжевым.

Оксид используется в качестве катализатора для получения серной кислоты. Это соединение окисляет диоксид серы (SO2) в триоксид (SO3). В этой окислительно-восстановительной реакции сера окисляется от +4 до +6, а ванадий снижается с +5 до +4. Формула ванадия выглядит следующим образом:
V2O5 + SO2 → 2VO2 + SO3
Катализатор регенерируется окислением кислорода:
2VO2 + O2 → V2O5
Аналогичные процессы окисления используются в производстве малеинового ангидрида, фталевого ангидрида и нескольких других объемных органических соединений.
Этот оксид также применяют при получении феррованадия. Его нагревают с железом и ферросилицием с добавлением извести. При использовании алюминия получают железо-ванадиевый сплав вместе с оксидом алюминия в качестве побочного продукта. Из-за высокого коэффициента теплового сопротивления оксид ванадия (V) находит применение в качестве материала-детектора в болометрах и микроболометрических массивах в тепловизионных приборах.
Характеристики
Редкий металл имеет следующие характеристики:
- Кристаллическая структура: кубическая объёмно-центрированная.
- Звукопроводность: 4560 м/с (при 20°C).
- Валентность ванадия: V (реже IV, III, II).
- Тепловое расширение: 8,4 мкм/(м·К) (при 25°С).
- Теплопроводность: 30,7 Вт/(м·К).
- Электрическое сопротивление: 197 nΩ·м (при 20°C).
- Магнетизм: парамагнитный.
- Магнитная восприимчивость: +255·10-6 см3/моль (298K).
- Модуль упругости: 128 ГПа.
- Модуль сдвига: 47 ГПа.
- Объёмный модуль упругости: 160 ГПа.
- Коэффициент Пуассона: 0,37.
- Твёрдость по шкале Мооса: 6,7.
- Твердость по Виккерсу: 628-640 МПа.
- Твердость по Бринеллю: 600-742 Мпа.
- Категория элемента: переходный металл.
- Электронная конфигурация: 3d3 4s2.
- Теплота плавления: 21,5 кДж/моль.
- Теплота испарения: 444 кДж/моль.
- Молярная теплоёмкость: 24,89 Дж/(моль·К).
Ванадий в таблице Менделеева находится в 5-й группе (подгруппа ванадия), 4-м периоде, d-блоке.
Распространение
Ванадий в масштабах Вселенной составляет примерно 0,0001% от общего объёма вещества. Он распространён так же часто, как медь и цинк. Метал обнаружен в спектральном свечении Солнца и других звёзд.
Элемент является 20-м по распространённости в земной коре. Металл ванадий в кристаллической форме достаточно редок, но соединения этого материала встречаются в 65 различных минералах. Экономически значимыми из них являются патронит (VS4), ванадинит (Pb5(VO4)3Cl) и карнотит (K2(UO2)2(VO4)2·3H2O).
Ионы ванадила в изобилии распространены в морской воде и имеют среднюю концентрацию 30 нМа. Некоторые источники минеральной воды также содержат данные ионы в высоких концентрациях. Например, источники возле горы Фудзи содержат до 54 мкг/л.
Добыча
Большую часть этого редкого металла получают из ванадиевого магнетита, обнаруженного в ультраосновных магматических габбровых породах. Сырьё добывается главным образом в Южной Африке, северо-западном Китае и на востоке России. В 2013 году эти страны произвели более 97 % всего ванадия (79 000 тонн в весовом выражении).
Металл также присутствует в бокситах и месторождениях сырой нефти, угля, горючих сланцев и битуминозных песков. В сырой нефти сообщалось о концентрациях до 1200 промилле. Из-за окислительных свойств ванадия (некоторых его оксидов) после сжигания таких нефтепродуктов остатки элемента могут вызвать коррозию в двигателях и котлах.
По оценкам, 110 000 тонн вещества ежегодно попадает в атмосферу путем сжигания ископаемого топлива. Сегодня разрабатываются технологии по извлечению ценного вещества из углеводородов.
Производство
В основном ванадий используется в качестве добавок к стальным сплавам, называемым ферросплавами. Феррованадий получают непосредственно путем восстановления смеси из оксида ванадия с валентностью (V), оксидов железа и чистого железа в электрической печи.
Металл получают с использованием многоступенчатого процесса, который начинается с обжига измельченной ванадий-магнетитовой руды с добавлением хлорида натрия (NaCl) или карбоната натрия (Na2CO3) при температуре около 850°С с получением метаванадата натрия (NaVO3). Водный экстракт этого вещества подкисляют, получая поливанадатную соль, которая восстанавливается кальциевым металлом. В качестве альтернативы мелкосерийному производству пятиокись ванадия восстанавливается водородом или магнием.
Также используются многие другие методы, во всех из которых ванадий производится как побочный продукт других процессов. Его очистка возможна иодидным методом, разработанным Антоном Эдуардом ван Аркелем и Яном Хендриком де Бором в 1925 году. Он подразумевает образование иодида ванадия (III) и его последующее разложение с получением чистого металла:
2 V + 3I2 ⇌ 2 VI3
Достаточно экзотический способ получения этого элемента придумали японцы. Они разводят на подводных плантациях асцидии (тип хордовые), которые поглощают ванадий из морской воды. Затем их собирают и сжигают. Из образовавшегося пепла извлекают ценный метал. Кстати, его концентрация в этом случае гораздо выше, чем на самых богатых месторождениях.

Сплавы
Что собой представляют сплавы ванадия? Приблизительно 85 % производимого редкого металла используют для получения феррованадия или в качестве добавки к стали. В начале XX века было обнаружено, что даже небольшое количество ванадия значительно увеличивает прочность стали. Данный элемент образует стабильные нитриды и карбиды, что приводит к улучшению характеристик сталей и сплавов.
С этого времени отмечено применение ванадия в осях, рамах, коленчатых валах, шестернях и других важных компонентах колесного транспорта. Существуют две группы сплавов:
- Высокоуглеродистые с содержанием от 0,15 % до 0,25 % ванадия.
- Быстрорежущие инструментальные стали (HSS) с содержанием от 1% до 5% данного элемента.
Для сталей марки HSS может быть достигнута твердость выше HRC 60. Они используются в хирургических инструментах. В порошковой металлургии сплавы могут содержать до 18 % ванадия. Высокое содержание карбидов в этих сплавах значительно повышает износостойкость. Из них изготавливают инструменты и ножи.
Благодаря своим свойствам, ванадий стабилизирует бета-форму титана, повышает его прочность и температурную стабильность. Смешанный с алюминием в титановых сплавах, он используется в реактивных двигателях , высокоскоростных летательных аппаратах и зубных имплантатах. Наиболее распространенным сплавом для бесшовных труб является титан 3/2,5, содержащий 2,5 % ванадия. Данные материалы широко распространены в аэрокосмической, оборонной и велосипедной промышленности. Другим распространенным сплавом, выпускаемым главным образом в листах, является титан 6AL-4V, где 6 % алюминия и 4% ванадия.
Несколько ванадиевых сплавов демонстрируют сверхпроводящие свойства. Первый фазовый сверхпроводник А15 представлял собой соединение ванадия V3Si, которое было получено в 1952 году. Ванадиево-галлиевая лента используется в сверхпроводящих магнитах. Структура сверхпроводящей фазы A15 V3Ga аналогична структуре более распространенных сверхпроводников: станнида триниобия (Nb3Sn) и ниобий-титана (Nb3Ti).
Недавно учёные выяснили, что в Средние века в некоторые образцы дамасской и булатной стали добавляли небольшое количество ванадия (от 40 до 270 частей на миллион). Это улучшало свойства клинков. Однако неясно, где и как добывали редкий металл. Возможно, он входил в состав некоторых руд.
Применение
Помимо металлургии, ванадий используется и для других задач. Сечение теплового нейтронного захвата и короткий период полураспада изотопов, образующихся при захвате нейтронов, делают данный металл подходящим материалом для использования внутри термоядерного реактора.
Наиболее распространенный оксид ванадия — пентаоксид V2O5 — используется в качестве катализатора при производстве серной кислоты и в качестве окислителя в производстве малеинового ангидрида. Пеноксид ванадия используется при изготовлении керамических изделий.
Металл является важным компонентом смешанных металлоксидных катализаторов, используемых при окислении пропана и пропилена в акролеин, акриловую кислоту или аммоксидирование пропилена до акрилонитрила. Другой оксид ванадия – двуокись VO2 – используется при производстве стеклянных покрытий, которые блокируют инфракрасное излучение при определенной температуре.
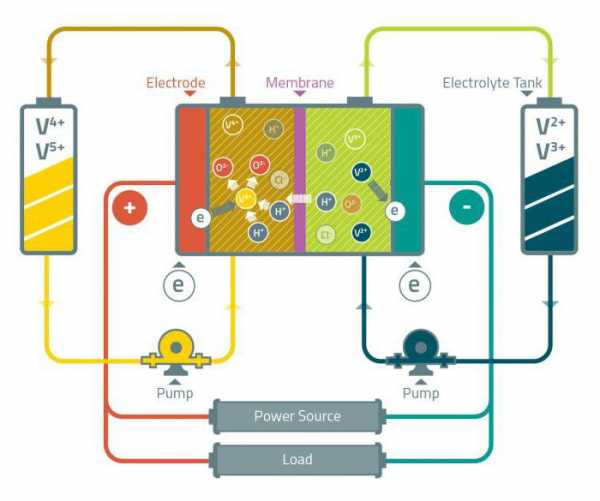
Ванадиевая редокс-батарея представляет собой гальванический элемент, состоящий из водных ионов ванадия в различных состояниях окисления. Батареи такого типа были впервые предложены в 1930 годах, а коммерческое использование началось с 1980-х. Ванадат можно использовать для защиты стали от коррозии.
Ванадий имеет важное значение для здоровья человека. Он помогает регулировать углеродный и липидный обмен, участвует в выработке энергии. В сутки рекомендовано потреблять 6-63 мкг (данные ВОЗ) вещества, поступающего с пищевыми продуктами. Его вполне достаточно в крупах, бобовых, овощах, зелени, фруктах.
www.syl.ru
Внимание! Если Вы обнаружили ошибку на сайте, то выделите ее и нажмите Ctrl+Enter.
|
|
www.metotech.ru
Ванадий (V, Vanadium) — влияние на организм, польза и вред, описание
История ванадия
Химический элемент с «божественным» названием Ванадий (от древнескандинавской Vanadis, дочери Ванов, которая была богиней любви и красота у скандинавских народов) был открыт дважды. В самом начале XIX столетия новый металл открыл Андрес Мануэль Дель Рио, профессор минералогии из Мехико в свинцовых рудах мексиканских горных пород. Но для химиков из Европы это открытие показалось сомнительным.
В 1830 году Нильс Сефстрём (химик из Швеции) открыл ванадий в железной руде. За необыкновенную красоту соединений, образуемых новым металлом, его назвали Ванадий.

Общая характеристика ванадия
Ванадий – химический элемент с атомным номером 23, занимает место в побочной подгруппе V группы IV периода периодической системы химических элементов Д.И. Менделеева. Пластичный ковкий металл серебристо-стального цвета,
Нахождение ванадия в природе
Ванадий является рассеянным элементом, встречается в осадочных и магматических породах, сланцах и железных рудах. Месторождения ванадия имеются в Австралии, Перу, Турции, Англии, ЮАР и США (calorizator). На территории России ванадий добывают в Ферганской долине, на Урале, в Киргизии, центральном Казахстане, Красноярском крае и Оренбургской области.
В организме человека ванадий присутствует в жировой ткани, костях и подкожных иммунных клетках.
Физические и химические свойства ванадия
Внешний вид ванадия больше всего напоминает сталь, это пластичный металл с температурой плавления 1920˚С. Не подвержен действию воздуха, морской воды и щелочных растворов при нормальной температуре.
Суточная потребность в ванадии
Суточная потребность 6-63 мкг/сутки (ВОЗ, 2000). Всего 1% поступающего извне ванадия всасывается в организме, остальное выводится с мочой.
Продукты питания богатые ванадием
Дополнительный приём препаратов, содержащих ванадий, обычно не назначается, суточная потребность в микроэлементе покрывается за счёт продуктов питания. Ванадий содержат злаки (рожь и овёс, пшеница и ячмень), крупы (неочищенный рис и гречка), бобовые (горох, фасоль), а также некоторые овощи, фрукты и ягоды (салат, редис, свекла, морковь и картофель, груши, вишня и земляника).

Полезные свойства ванадия и его влияние на организм
Ванадий играет заметную роль в регулировании липидного и углеводного обмена, принимает участие в активной выработке энергии. Медики отмечают, что уменьшение уровня холестерина связано с количеством поступающего в организм ванадия. Является стимулирующим фактором для движения кровяных клеток, которые поглощают болезнетворные микробы (фаоцитов).
Взаимодействие ванадия с другими
Токсичность ванадия снижается при его взаимодействии с хромом и белками. Обратный эффект дают соединения железа и алюминия, а также витамин С.
Признаки нехватки ванадия
Дефицит ванадия представлен единичными случаями ванадийдефицитной шизофрении, а также связан с патологией углеводного обмена.
Признаки избытка ванадия
Избыток ванадия значительно более распространен и связан с производством асфальта, стекла, топливной продукции (мазут, бензин, и т.д.). Обладает гипертензивным действием (ВОЗ, 1997). Установлена связь генеза маниакально-депрессивных состояний и невротической реактивной депрессии с повышением уровня ванадия в крови. Описана ванадиевая природа эндемичного рассеянного склероза — жирорастворимые комплексы ванадия техногенного происхождения кумулируются в миелиновых оболочках и в коре мозга, приводя к развитию рассеянного склероза.
Применение ванадия в жизни
Основным потребителем ванадия является металлургическая промышленность. Введение ванадия в состав сплавов нержавеющей, быстрорежущей и инструментальной стали увеличивается прочность и износоустойчивость стали.
Также ванадий применяется в атомно-водородной энергетике, в производстве серной кислоты, как химический источник тока.

Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
www.calorizator.ru
Применение ванадия в промышленности и металлургии
 В основную химическую
промышленность ванадий пришел не сразу. Его служба человечеству началась в
производстве цветного стекла, красок и керамики. Изделия из фарфора и продукцию
гончарных мастеров с помощью соединений ванадия покрывали золотистой глазурью, а
стекло окрашивали солями ванадия в голубой или зеленый цвет. В красильном деле
ванадий появился вскоре после опубликования в 1842 г. сообщения
выдающегося русского химика Н.Н. Зинина о получении им анилина из
нитробензола. Реакция Зинина открывала новые возможности для развития
производства синтетических красителей. Соединения ванадия нашли применение в
этой отрасли химии и принесли ей значительную пользу. Ведь достаточно всего
одной весовой части V2O5, чтобы перевести 200 тыс.
весовых частей бесцветной соли анилина в красящее вещество – черный анилин.
Столь же эффективным оказалось применение соединений ванадия в индиговом
крашении. Так элемент №23 пришел в ситцепечатание, в производство цветных
хлопчатобумажных и шелковых тканей.
В основную химическую
промышленность ванадий пришел не сразу. Его служба человечеству началась в
производстве цветного стекла, красок и керамики. Изделия из фарфора и продукцию
гончарных мастеров с помощью соединений ванадия покрывали золотистой глазурью, а
стекло окрашивали солями ванадия в голубой или зеленый цвет. В красильном деле
ванадий появился вскоре после опубликования в 1842 г. сообщения
выдающегося русского химика Н.Н. Зинина о получении им анилина из
нитробензола. Реакция Зинина открывала новые возможности для развития
производства синтетических красителей. Соединения ванадия нашли применение в
этой отрасли химии и принесли ей значительную пользу. Ведь достаточно всего
одной весовой части V2O5, чтобы перевести 200 тыс.
весовых частей бесцветной соли анилина в красящее вещество – черный анилин.
Столь же эффективным оказалось применение соединений ванадия в индиговом
крашении. Так элемент №23 пришел в ситцепечатание, в производство цветных
хлопчатобумажных и шелковых тканей.
Промышленность нуждалась в ванадии и его соединениях, но руд, богатых этим элементом, было немного. Инженеры французской сталелитейной фирмы «Крезо», видимо, обратили внимание на то, что первые соединения ванадия Сефстрем получил не из руды, а из металлургических шлаков, и в 1882 г. наладили их производство на той же основе. На протяжении 10 лет завод «Крезо» ежегодно выбрасывал на мировой рынок по 60 т пятиокиси ванадия V2O5. Однако вскоре спрос на соединения ванадия для получения черного анилина резко упал, и производство их значительно сократилось.
Но в начале первой мировой войны химикам вновь пришлось обратиться к элементу №23. В эти годы сражающимся странам потребовались громадные количества серной кислоты. Ведь без нее невозможно получить нитроклетчатку основу боевых порохов. Известно, что серная кислота получается окислением сернистого ангидрида SO2 серный ангидрид SO3 с последующим присоединением воды. Однако SO2 непосредственно с кислородом реагирует крайне медленно. Окисление сернистого ангидрида может происходить при восстановлении двуокиси азота (на этой реакции основан нитрозный способ производства серной кислоты), но более чистая и концентрированная кислота получается, если реакцию окисления SO2 в SO3, проводить в присутствии некоторых твердых катализаторов (контактный метод производства).
Первым катализатором сернокислотного контактного производства была дорогостоящая платина. Ее, естественно, не хватало, требовались заменители. Ими оказались пятиокись ванадия V2O5 и некоторые соли ванадиевых кислот, например Ag3VO4. Они почти с таким же успехом, как и платина, ускоряют окисление SO2, в SO3, но обходятся значительно дешевле, да и требуется их меньше. И главное, они не боятся контактных ядов, выводящих из строя платиновые катализаторы. Катализаторы на основе ванадия играют большую роль и в современной химии. Их по-прежнему можно встретить в большинстве цехов по производству серной кислоты, не обходятся без них и такие важные процессы, как крекинг нефти, получение уксусной кислоты путем окисления спирта многие другие.
Применение ванадия для изготовления стали
Если химическая промышленность нуждается, прежде всего, в соединениях ванадия, то металлургии необходимы сам металл и его сплавы. Ванадий – один из главных легирующих элементов.
Поучительный, но, в общем-то, случайный опыт шведских металлургов с «плохими» и «хорошими» донами не стал основной для широкого внедрения ванадия в металлургию. Произошло это значительно позже.
В 1905 г., на заре автомобилестроения, во время гонок в Англии одна из французских машин разбилась вдребезги. Один из обломков двигателя этой машины попал в руки Генри Форда, присутствовавшего на состязаниях. Обломок удивил будущего «автомобильного короля»: металл, из которого он был изготовлен, сочетал исключительную твердость с вязкостью и легкостью. Вскоре лаборатория Форда установила, что этот металл – сталь с добавками ванадия.
Не считаясь с затратами, Форд организовал исследования. После нескольких неудач из его лаборатории вышла ванадиевая сталь необходимого качества. Она сразу дала возможность облегчить автомобили, сделать новые машины прочнее, улучшить их ходовые качества. Снизив цены на автомобили благодаря экономии металла, Форд смог привлечь массу покупателей. Это дало ему повод сказать: «Если бы не было ванадия, то не было бы и моего автомобиля».
Однако еще за 10 лет до того, как Форд узнал о существовании ванадиевой стали, французские инженеры выплавляли ее и получали высококачественные броневые плиты. Из этой стали были сделаны и первые пушки, установленные на самолетах.
Необходимость броневой защиты для пехоты и артиллерийских расчетов стала особенно очевидной в ходе первой мировой войны, когда пришлось столкнуться с орудийным и пулеметно-ружейным огнем невиданной прежде интенсивности. Первоначально для изготовления касок и щитов орудий применяли сталь с большим содержанием кремния и никеля, но испытания на полигоне показали ее непригодность. Сталь, содержащая всего 0,2% ванадия, оказалась более прочной и вязкой. К тому же она была легче. Хромованадиевая сталь еще прочнее. Она хорошо сопротивляется удару и истиранию. Кроме того, она обладает достаточно высокой усталостной прочностью. Поэтому со стали широко применять в военной технике: для изготовления коленчатых валов корабельных двигателей, отдельных деталей торпед, авиамоторов, бронебойных снарядов.
Стали, содержащие ванадий, не утратили своего значения и поныне. Элемент №23 придает стали такие качества как прочность, легкость, устойчивость к воздействию высоких температур, гибкость. Чем объяснить столь широкий диапазон полезных свойств? Ответить на этот вопрос помогает сам ванадий. Он – один из «откровенных» металлов. Как это понимать?
Известно, что наилучшую прокаливаемость стали придает молибден, наибольшую вязкость сталь приобретает от введения никеля, а ее магнитные свойства усиливаются присутствием кобальта. Далеко не всегда можно точно сказать, почему та или иная легирующая добавка придает стали определенные качества. А вот о причинах улучшения свойств стали ванадием многое известно достаточно полно и достоверно.
Давно установлено, что расплавленная сталь поглощает много газов, прежде всего кислорода и азота. Когда металл остывает, газы остаются в слитках в виде мельчайших пузырьков. При ковке пузырьки вытягиваются в нити (волосовины) и прочность слитка в разных направлениях становится неодинаковой. Ванадий, введенный в сталь, активно реагирует с кислородом и азотом, продукты этих реакций всплывают на поверхность металла жидким шлаком, который удаляется в процессе плавки. Тем самым повышается прочность отливок, оставшийся ванадий раньше других элементов взаимодействует с растворенным в стали углеродом, образуя твердые и жаростойкие соединения – карбиды. Карбиды ванадия плохо растворяются в железе и неравномерно распределяются в нем, препятствуя образованию крупных кристаллов. Сталь получается мелкозернистой, твердой и ковкой. Структура ванадиевой стали сохраняется и при высоких температурах. Поэтому резцы из нее меньше подвержены деформациям в процессе обработки детали на больших скоростях, а штампы незаменимы для горячей штамповки. Мелкокристаллическая структура обусловливает также высокую ударную вязкость и большую усталостную прочность ванадиевой стали. Практически важно еще одно ее качество – устойчивость к истиранию. Это качество можно наглядно проиллюстрировать таким примером: за тысячу часов работы стенки цилиндров дизель-моторов, изготовленных из углеродистой стали, изнашиваются на 0,35…0,40 мм, а стенки цилиндров из ванадиевой стали, работавших в тех же условиях, – лишь на 0,1 мм.
Но не только сталь облагораживается ванадием. Свойства других металлов также улучшаются при введении в них элемента №23. Стоит добавить 3% ванадия в алюминий, как этот металл становится очень твердым. «Вавилиом» – так называется этот сплав – хорошо противостоит разрушающему действию влажного воздуха и соленой воды.
Из подобного же сплава (но с 2% ванадия) изготовляют духовые музыкальные инструменты. Хорошо известен сплав меди с 8% ванадия. Он используется как исходное сырье для получения сплавов меди с другими металлами. Бронзы и латуни, содержащие 0,5% ванадия, не уступают по механическим свойствам стали и поэтому идут на изготовление ответственных узлов и деталей сложного профиля. Химическая стойкость сплава никеля с 18…20% ванадия соизмерима с инертностью благородных металлов, поэтому из него делают лабораторную посуду. Добавки ванадия в золото придают последнему несвойственную ему твердость. В последнее время довольно много ванадия идет в сплавы на основе титана.
Сегодня 80 % всего производимого ванадия находит применение в сплавах, в основном для нержавеющих и инструментальных сталей.
Применение ванадия в атомно-водородной энергетикеХлорид ванадия применяется при термохимическом разложении воды в атомно-водородной энергетике (ванадий-хлоридный цикл «Дженерал Моторс»,США). В металлургии ванадий обозначается буквой Ф
Химические источники токаПентаоксид ванадия широко применяется в качестве положительного электрода(анода) в мощных литиевых батареях и аккумуляторах. Ванадат серебра в резервных батареях в качестве катода.
www.protown.ru
Полное описание, свойства и функции. Показания и противопоказания к применению
Элемент ванадий был назван в честь эпического персонажа — богини красоты Ванадис. Давая ему такое «имя», исследователи были под впечатлением от красоты и необычности кристаллов этого минерала. Однако позже выяснилось, что полученное название подходит ему вдвойне. Элемент красив не только сам по себе; вдобавок одна из функций ванадия заключается в том, что он регулирует процессы в организме, отвечающие за поддержание привлекательного внешнего вида. Велико и его воздействие на здоровье.
Содержание ванадия в продуктах (на 100г):
Неочищенный рис 400 мкг
Фасоль 190 мкг
Редис 180 мкг
Салат 170 мкг
Горошек 150 мкг
Морковь 100 мкг
Свекла 70 мкг
Земляника 9 мкг
Что собой представляет ванадий?

В организме человека присутствует ничтожно малое количество ванадия, всего порядка 0,1 мг.
Несмотря на это он оказывает свои ценные эффекты в отношении здоровья человека.
Ванадий накапливается в жировой ткани, клетках иммунной системы, в костях.
Чтобы определить его количество в организме, берут на исследование мочу, кровь и волосы.
Среди всех химических элементов ванадий является одним из наименее изученных.
Продукты питания, богатые ванадием
Ванадий преобладает в составе растительной пищи , но и в животных продуктах элемент тоже присутствует. Наиболее богатый животный источник — морепродукты: в них вообще очень часто можно найти редкие микроэлементы, которые в «наземной» пище встречаются нечасто.
Также разные дозировки ванадия содержатся в крупах (рис, пшено, ячмень, овсяные хлопья), бобовых (соя, фасоль), овощах (редис, зеленый салат, картофель), грибах, специях (черный перец), петрушке, оливках, меде, растительных маслах, питьевой воде.
Такая пища как макароны и кондитерские изделия лишена этого элемента.
Суточная потребность в ванадии
Дозировки ванадия, необходимые для жизнедеятельности человека каждый день, точно не установлены. Предположительно человеку требуется от 10 до 25 мкг этого микроэлемента.
Увеличение потребности в ванадии
Ситуации, при которых возрастает потребность в этом элементе, не определены.
Усвоение ванадия из пищи
При здоровом пищеварении всасывание ванадия происходит хорошо.
Биологическая роль ванадия
 В ходе исследования элемента было установлено наличие следующих функций ванадия:
В ходе исследования элемента было установлено наличие следующих функций ванадия:
• Принимает участие в обмене углеводов, способствует снижению сахара в крови
• Принимает участие в метаболизме жиров, помогает контролировать вес, снижает холестерин крови, что замедляет развитие атеросклероза и защищает человека от заболеваний сердца и сосудов
• Улучшает функциональность нервной системы
• Ускоряет деление клеток, что помогает организму вовремя заменять старые структуры тканей, в том числе кожи, новыми
• Оптимальное содержание ванадия в организме способствует тому, что улучшается состояние волос и ногтей
• Повышает работоспособность клеток иммунитета, улучшает функции фагоцитов, способствует повышению защиты организма от болезней
• Улучшает самоочищение организма, избавление его от токсинов
• Замедляет старение организма
• Способствует полноценному формированию костной ткани и эмали зубов, укрепляет их, препятствует развитию кариеса, остеопороза
• Обладает противораковыми свойствами
• Улучшает работу печени и поджелудочной железы
• Положительно влияет на функционирование желез внутренней секреции
• Поддерживает оптимальный баланс электролитов, регулирует содержание натрия и калия, предотвращает отеки и уменьшает их выраженность.
• Улучшает кроветворение.
Признаки нехватки ванадия
Так как организм человека требует крайне малых количеств этого микроэлемента, а содержание ванадия в составе различных продуктов достаточно высоко, нехватка минерала возникает достаточно редко.
У человека признаки недостатка ванадия не описаны. В экспериментах у лабораторных животных при скармливании им пищи, лишенной ванадия, у них замедлялся рост, ухудшалось состояние зубов, становились более хрупкими кости, повышался уровень холестерина в крови, страдала способность к размножению.
Установлена взаимосвязь между дефицитом ванадия и сахарным диабетом. При одновременном недостатке хрома и цинка риск диабета увеличивается еще больше.
Признаки избытка ванадия
Элемент полезен лишь в том случае, если в организм поступают его микродозы, а при чрезмерном применении ванадий может проявить свои токсические свойства. Если в организм попадет доза всего лишь 2 мг, есть вероятность, что человек погибнет. При передозировке минерала наблюдается нарушение кроветворения, тошнота, рвота, аллергические реакции, ухудшение состояния кожи и волос. Учащаются заболевания дыхательных путей и других органов.
Факторы, влияющие на содержание в продуктах ванадия
Оптимальное содержание минерала обнаруживается в качественной сельскохозяйственной продукции, которая выращивается с применением микроудобрений на основе ванадия.
Избыток ванадия, вредный для здоровья, возможен при потреблении пищи, «добытой» в экологически неблагополучных областях.
Почему возникает избыток ванадия
 Чаще всего избыток элемента возникает при контакте человека с вредными производственными факторами и загрязнениями воздуха и воды.
Чаще всего избыток элемента возникает при контакте человека с вредными производственными факторами и загрязнениями воздуха и воды.
Ванадий: цена и продажа
Микродозы ванадия необходимы для красоты и здоровья. По этой причине многие комплексные биодобавки содержат его небольшие количества. Чтобы купить ванадийсодержащие комплексы, можете воспользоваться нашими услугами.
В интернет-магазине, на страницах которого Вы сейчас находитесь, представлен широкий ассортимент самых качественных добавок от российских и зарубежных производителей по наиболее приемлемым ценам. Ванадий в БАДах содержится в таких дозировках, что он оказывает только полезные эффекты на здоровье человека.
Чтобы приобрести выбранный препарат, можете набрать номер телефона магазина или положить средство в корзину.
Для регионов действует бесплатный номер 8 800 550-52-96.
www.transferfaktory.ru
