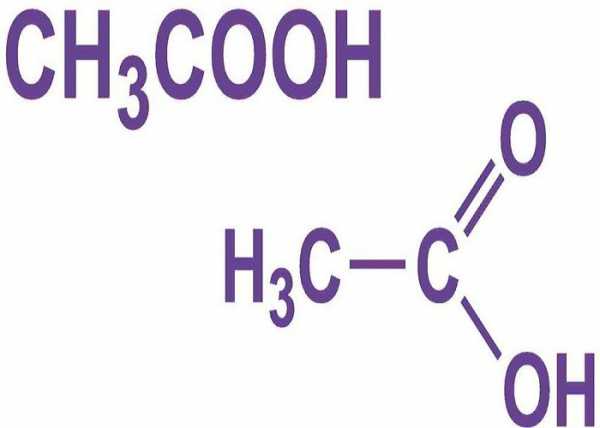
Общая характеристика уксусной кислоты
Синонимы: этановая кислота, ледяная уксусная кислота, Acetic acid, CH3COOHЭто органическое соединение. Имеет характерный кислый вкус и едкий запах. Хотя она классифицируется как слабая кислота, но концентрированная уксусная кислота вызывает коррозию.
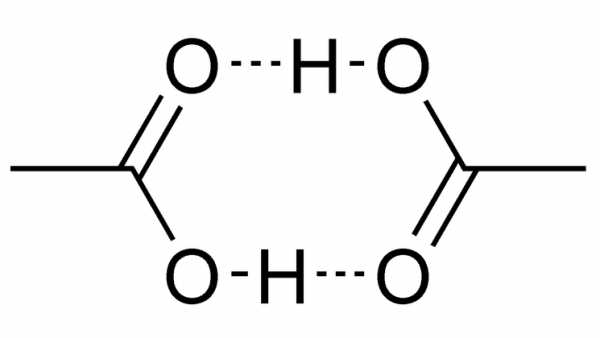
В твердом состоянии молекулы уксусной кислоты образуют пары (димеры), соединенные водородными связями. Жидкая уксусная кислота представляет собой гидрофильный (полярный) протонный растворитель, подобный этанолу и воде. При умеренной относительной статической диэлектрической проницаемости (диэлектрическая постоянная) 6,2, она растворяет не только полярные соединения, такие как неорганические соли и сахара, но и неполярные соединения, такие как масла, и элементы, такие как сера и йод. В уксусной кислоте водородный центр располагается в карбоксильной группе (-СООН) как и в других карбоновых кислотах, его можно отделить от молекулы путем ионизации:
CH3CO2H → CH
Уксусная кислота может вступать в типичные для карбоновых кислот химические реакции. При взаимодействии с основанием, она преобразуется в ацетат металла и воды. Восстановление уксусной кислоты дает этанол. При нагревании выше 440°C, уксусная кислота разлагается с получением двуокиси углерода и метана, или кетенов и воды:
CH3COOH → CH4 + CO2
CH3COOH → CH2CO + H2O
Получение уксусной кислоты
Уксусную кислоту выделяют уксуснокислые бактерии (Acetobacter рода Clostridium и acetobutylicum):C2H5OH + O2 → CH3COOH + H2O
Около 75% уксусной кислоты синтезируют для использования в химической промышленности путем карбонилирования метанола. В этом процессе, метанол и монооксид углерода реагируют с получением уксусной кислоты:
CH3OH + CO → CH3COOH
Применение уксусной кислоты
Уксусная кислота является химическим реагентом для производства химических соединений. Чаще всего уксусную кислоту используют в производстве мономера винилового ацетата (VAM). Уксусная кислота используется в качестве растворителя при производстве терефталевой кислоты (ТФК), сырье для полиэтилентерефталата (ПЭТ).Эфиры уксусной кислоты обычно используют как растворитель для чернил, красок и покрытий. Сложные эфиры включают этилацетат, н-бутилацетат, изобутилацетат, и пропилацетат.
Ледяная уксусная кислота используется в аналитической химии для оценки слабощелочных веществ, таких как органические амиды. Ледяная уксусная кислота намного слабее, чем вода, поэтому амид ведет себя как сильное основание в этой среде.
Уксус (4-18% уксусной кислоты) используется непосредственно в качестве приправы.
Примечание
Концентрированная уксусная кислота вызывает ожоги кожи и раздражение слизистых оболочек. Резиновые перчатки не защищают, поэтому необходимо использовать специальные перчатки, например, сделанные из нитрильного каучука. Концентрированная уксусная кислота может воспламеняться (если температура окружающей среды превышает 39°C). Из-за несовместимости, рекомендуется, хранить уксусную кислоту отдельно от хромовой кислоты, этиленгликоля, азотной кислоты, хлорной кислоты, перманганата, пероксидов и гидроксилов.Характеристики уксусной кислоты
| Характеристики | Показатели |
| CAS — номер | 64-19-7 |
| Молекулярная формула | CH3COOH |
| Молекулярный вес , г/моль | 60,05 |
| Плотность, г/см3 | 1,0492 |
| Температура плавления, °C | 16,75 |
| Растворимость в воде (КТ), г/л | ~400 |
Автор: Виктор Епифанов
unibrom.ru
| Уксусная кислота | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Этановая кислота |
| Традиционные названия | Уксусная кислота |
| Хим. формула | C2H4O2 |
| Рац. формула | CH3COOH |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Поверхностное натяжение | 27,1 ± 0,01 мН/м[1], 24,61 ± 0,01 мН/м[1] и 22,13 ± 0,01 мН/м |
| Динамическая вязкость | 1,056 мПа·с[2], 0,786 мПа·с[2], 0,599 мПа·с[2] и 0,464 мПа·с[2] |
| Энергия ионизации | 10,66 ± 0,01 эВ[3] |
| Термические свойства | |
| Т. плав. | 16,75 °C |
| Т. кип. | 118,1 °C |
| Т. всп. | 103 ± 1 °F[3] и 39 ± 6 °C[4] |
| Т. свспл. | 427 ± 1 °C[5] |
| Пр. взрв. | 4 ± 0,1 об.%[3] |
| Кр. точка | 321,6 °C, 5,79 МПа |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) |
| Энтальпия образования | −487 кДж/моль |
| Д | |
ru-wiki.ru
Чем отличаются понятия вещество и тело?
Физическое тело — это каждый окружающий нас предмет. (Ручка, груз на пружине, мел, солнце, автомобиль) Вещество — это всё то, из чего состоят физические тела. (Вода, металл, пластмасса) Например: яблоко, собака, человек — физические тела Они состоят из веществ — белков, жиров, углеводов, нуклеиновых кислотВсе тела состоят из веществ, некоторые тела состоят из одного вещества, но в большинстве случаев тело состоит из большого колличества разнообразных по природе веществ, чем в конечном случае и определяются его (тела) свойства.
вещество—химический аспект материи или внутренние свойства материи тело-физический аспект материи или внешние свойства матери
физическое тело — это все предметы даже те у которых нет формы вещество — это материя которая воспринимаеться нашыми органамиВещество, это то, из чего состоит тело. Тело состоит из веществ)) Вещества: резина, пластмасса, стекло Тела: мяч (из резины), игрушка (из пластмассы), ваза (из стекла) Вещество-это то, из чего состоят физические тела. Вещества существуют в природе. Например: кислород, водород, углеводы, жиры, белки и т. д. Также вещества получают искусственно в хим. лабораториях. Например: сода, фарфор, уксус, капрон и т. д. Тело-это отдельный предмет в пространстве, а также часть пространства, заполненая материей. Т. е. то, что нас окружает. Например: стул, стол, гвоздь и т. д.
почему!? почему стекло это вещество? оно же из песка и других веществ состоит?
touch.otvet.mail.ruУксусная кислота — Циклопедия
| Уксусная кислота | |
| Общие | |
|---|---|
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Т. плав. | 16,75 °C |
| Т. кип. | 118,1 °C |
| Кр. точка | 321,6 °C, 5,79 МПа |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) |
| Энтальпия образования | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 Уксусная кислота Химия 41. Состав уксуса. Уксусная кислота — Академия занимательных наук
Уксусная кислота Химия 41. Состав уксуса. Уксусная кислота — Академия занимательных наукУксусная кислота (этановая кислота, метанкарбоновая кислота) — одноосновная органическая карбоновая кислота, имеющая формулу CH3COOH.
Открытие уксусной кислоты приписывают Марии Гебре, Джабир ибн Хайяну, но первым её и её некоторые свойства описал Теофраст.
[править] Физические свойства
Уксусная кислота — бесцветная, растворимая в воде жидкость с острым характерным запахом. Молярная масса = 60,05 г/моль. Плотность = 1,0492 г/см³. Температура плавления = + 16,75 °C. Температура кипения = + 118,1 °C.
[править] Химические свойства
При взаимодействии с активными металлами образует соли — ацетаты.
Например, ацетат свинца (II):
PbО + 2СН3СООН → (СН3СОО)2Pb + H2O
Ацетат калия:
2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O
Ацетат магния:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
Ацетат кальция:
CaO + 2CH3COOH → (CH3COO)2Ca + H2O
Ацетат натрия:
CH3COOH + NaOH → CH3COONa + H2O
При нагревании ацетатов с этанолом в присутствии серной кислоты H2SO4 происходит реакция этерификации с образованием уксусно-этилового эфира (этилацетата):
СН3СООН + С2Н5ОН → СН3СООC2H5 + 2H2O
При взаимодействии с такими газами как хлор, водород замещается:
CH3COOH + Cl2 → CH2ClCOOH + HCl
Получилась хлоруксусная кислота. Аналогично, водород может замещаться например на фтор, с образованием фторуксусной кислоты CH2FCOOH или иод с образованием иодуксусной кислоты CH2ICOOH.
Горение этой кислоты разлагает её на углекислоту и воду:
CH3COOH + 2O2 → 2CO2 + 2H2O
Уксусную кислоту получают окислением ацетальдегида кислородом в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
2CH3CHO + O2 → 2CH3COOH
Либо окисление н-бутана при температуре 150—200 °C и давлении 150 атм., с использованием в качестве катализатора ацетата кобальта:
2C4H10 + 5O2 → 4CH3COOH + 2H2O
Другим способом получения данной кислоты является карбонилирование метанола (метиловый спирт CH3OH) моноксидом углерода (CO):
CH3OH + CO → CH3COOH
Также можно окислить этанол (этиловый спирт С2Н5ОН):
С2Н5ОН + О2 → СН3СООН + Н2О
[править] Аналитический анализ
Для выявления присутствия уксусной кислоты при проведении анализа (см. Аналитическая химия), проводят реакцию с хлоридом железа (III) FeCl3, при этом к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
8СН3СОО− + 3Fe3+ + Н2О → [Fe3(ОН)2(СН3СОО)6]+ + 2СН3СООН
[править] Медицинский аспект
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. При попадании концентрированной (свыше 30 %) уксусной кислоты на кожу и ткани, она способна вызывать химические ожоги, с развитием коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
При попадании в желудочно-кишечный тракт концентрированной уксусной кислоты возникает тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка. Возможны ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлым желудочно-кишечным кровотечением. Из-за потери плазмы через обожжённую слизистую оболочку, возникает значительное сгущение крови, что может вызвать шок. Опасными осложнениями отравления уксусной эссенцией является острая почечная недостаточность и токсическая дистрофия печени.
Предельно допустимая концентрация уксусной кислоты — 5 мг/м3. При работе с этой кислотой нужно применять фильтрующие противогазы для защиты от паров.[1]
cyclowiki.org
Физические свойства уксусной кислоты, формула
Обычная бутылка пищевого уксуса, которую можно найти на кухне у любой домохозяйки, имеет в составе множество других кислот и витаминов. Добавление пары капель продукта в приготовленную пищу, салаты вызывает естественное усиление вкуса. Но мало кто из нас всерьез задумывался о свойствах и реальных масштабах применения основного компонента – уксусной кислоты.
Что это за вещество?
Формула уксусной кислоты СН3СООН, что относит ее к ряду жирных карбоновых кислот. Присутствие одной карбоксильной группы (СООН) относит ее к одноосновным кислотам. Вещество встречается на земном шаре в органическом виде и получается синтетическим путем в лабораториях. Кислота является самым простым, но не менее важным представителем своего ряда. Легко растворяется в воде, гигроскопична.
Физические свойства уксусной кислоты и плотность меняются в зависимости от температурного режима. При комнатной температуре в 20оС кислота находится в жидком состоянии, обладает плотностью 1,05 г/см3. Имеет специфический запах и кисловата на вкус. Раствор вещества без примесей твердеет и переходит в кристаллы на температуре ниже 17оС. Процесс кипения уксусной кислоты начинается при температуре свыше 117оС. Метиловая группа (СН3) формулы уксусной кислоты получается при взаимодействии спиртов с кислородом: брожение спиртовых веществ и углеводов, скисание вин.
Немного истории
Открытие уксуса было одним из первых в ряду кислот и совершалось поэтапно. Вначале уксусную кислоту стали добывать путем перегонки арабские ученые 8-го века. Однако еще в древнем Риме это вещество, полученное из скисшего вина, использовалось в качестве универсального соуса. Само название с древнегреческого переводится как «кислый». В 17 веке ученым Европы удалось добыть чистую субстанцию вещества. На тот момент они вывели формулу и обнаружили необычную способность – уксусная кислота в парообразном состоянии воспламенялась голубым огнем.
Вплоть до 19-го века ученые находили присутствие уксусной кислоты только в органическом виде — как часть соединений солей и эфиров. В составе растений и их плодов: яблок, винограда. В организме людей и животных: потовые выделения, желчь. В начале 20-го века русские ученые случайным образом добыли уксусный альдегид из реакции ацетилена с окисью ртути. На сегодня потребление уксусной кислоты на столько велико, что ее основная добыча происходит только синтетическим способом в огромных масштабах.
Способы добычи
Будет ли уксусная кислота чистого вида или с наличием примесей в растворе зависит от метода добычи. Пищевая уксусная кислота получается биохимическим методом в процессе брожения этанола. В промышленности выделяют несколько способов добычи кислоты. Как правило, реакции сопровождаются высокой температурой и наличием катализаторов:
- Метанол в реакции с углеродом (карбонилирование).
- Окислением фракции нефти кислородом.
- Пиролизом древесины.
- Окислением ацетальдегида кислородом.

Промышленный способ эффективнее и экономичнее биохимического. Благодаря промышленному способу, объем производства уксусной кислоты в 20-м и 21-м столетии вырос в сотни раз, по сравнению с 19-м веком. На сегодня синтез уксусной кислоты карбонилированием метанола дает боле 50% от всего производимого объема.
Физические свойства уксусной кислоты и влияние ее на индикатор
В жидком состоянии уксусная кислота бесцветна. Уровень кислотности pH 2,4 легко проверяется лакмусовой бумажкой. Уксусная кислота при попадании на индикатор окрашивает его в красный цвет. Физические свойства уксусной кислоты меняются визуально. Когда температура опускается ниже 16оС, вещество принимает твердую форму и напоминает мелкие кристаллы льда. Она легко растворяется в воде и взаимодействует с широким спектром растворителей, кроме сероводорода. Уксусная кислота снижает общий объем жидкости при разбавлении ее водой. Самостоятельно опишите физические свойства уксусной кислоты, ее цвет и консистенцию, которые вы наблюдаете на следующем изображении.

Вещество воспламеняется при температуре от 455оС с выделением теплоты в 876 кДж/моль. Молярная масса составляет 60,05 г/моль. Физические свойства уксусной кислоты как электролита в реакциях проявляются слабо. Диэлектрическая проницаемость равна 6,15 при комнатной температуре. Давление, как и плотность, – переменная величина физического свойства уксусной кислоты. При давлении 40 мм. рт. ст. и температуре 42оС начнется процесс кипения. Но уже при давлении в 100 мм. рт. ст. кипение произойдет только при 62оС.
Химические свойства
Вступая в реакцию с металлами и оксидами, вещество проявляет свои кислотные свойства. Прекрасно растворяя в себе более сложные соединения, кислота образует соли, которые называются ацетаты: магния, свинца, калия и др. Значение pK кислоты составляет 4,75.
При взаимодействии с газами уксус вступает в реакцию замещения с последующим вытеснением и образованием более сложных кислот: хлоруксусной, йодоуксусной. Растворяясь в воде, кислота диссоциирует с выделением ацетат-ионов и протонов водорода. Степень диссоциации равна 0,4 процента.
Физические и химические свойства молекул уксусной кислоты в кристаллическом виде создают диамеры на водородных связях. Также ее свойства необходимы при создании более сложных жирных кислот, стероидов и биосинтезе стеринов.
Лабораторные испытания
Обнаружить уксусную кислоту в растворе можно за счет выявления ее физических свойств, например запаха. Достаточно добавить в раствор более сильную кислоту, которая начнет вытеснять соли уксуса с выделением ее паров. Путем лабораторной перегонки CH3COONa и H2SO4 возможно получить уксусную кислоту в сухом виде.
Проведем опыт из школьной программы по химии 8 класса. Физические свойства уксусной кислоты ярко демонстрирует химическая реакция расстворения. Достаточно добавить в раствор к веществу оксид меди и слегка нагреть его. Оксид полностью растворяется, делая раствор голубоватого цвета.
Производные вещества
Качественные реакции вещества со многими растворами образуют: эфиры, амиды и соли. Однако во время производства других веществ, требования к физическим свойствам уксусной кислоты остаются высокими. Она всегда должна иметь высокую степень растворения, а значит, не иметь сторонних примесей.
В зависимости от концентрации уксусной кислоты водного раствора выделяют ряд ее производных. Концентрация вещества более 96% имеет название — ледяная уксусная кислота. Уксусную кислоту в 70-80% можно приобрести в продуктовых магазинах, там она будет называться – уксусная эссенция. Столовый уксус имеет концентрацию 3-9 %.
Уксусная кислота и повседневная жизнь
Помимо пищевых особенностей, уксусная кислота обладает рядом физических свойств, которым человечество нашло свое применение в быту. Раствор вещества невысокой концентрации легко удаляет налет с металлических изделий, поверхности зеркал и окон. Способность впитывать влагу также играет на пользу. Уксус хорошо устраняет запахи в затхлых помещениях, удаляет пятна от овощей и фруктов на одежде.
Как выяснилось, физическое свойство уксусной кислоты – устранять жир с поверхности — может найти применение в народной медицине и косметологии. Слабым раствором пищевого уксуса обрабатывают волосы для придания им блеска. Вещество широко применяется для лечения простудных заболеваний, удаления бородавок и кожных грибков. Набирает темп использование уксуса в составе косметических обертываний для борьбы с целлюлитом.
Использование в производстве
В соединениях солей и других сложных веществ уксусная кислота выступает незаменимым элементом:
- Фармацевтическая отрасль. Для создания: аспирина, антисептических и антибактериальных мазей, фенацетина.
- Производство синтетических волокон. Негорючие пленки, ацетилцеллюлоза.
- Пищевая отрасль. Для успешной консервации, приготовления маринадов и соусов, в качестве пищевой добавки E260.
- Текстильная отрасль. Входит в состав красителей.
- Производство косметики и средств гигиены. Ароматические масла, крема для улучшения тонуса кожи.
- Изготовление протрав. Используется как инсектицид и протрава от сорняков.
- Производство лаков. Технические растворители, производство ацетона.

Ежегодно производство уксусной кислоты увеличивается. На сегодня его объем в мире составляет более 400 тысяч тонн в месяц. Транспортировка кислоты осуществляется в прочных цистернах из стали. Хранение в пластиковой таре на многих производствах в связи с высокой физической и химической активностью уксусной кислоты запрещено либо ограничено сроком до нескольких месяцев.
Безопасность
Уксусная кислота высокой концентрации имеет третью степень воспламенения и выделяет токсичные пары. Рекомендуется надевать специальные противогазы и другие средства индивидуальной защиты в процессе работы с кислотой. Смертельная доза для человеческого организма от 20 мл. В момент попадания вещества внутрь кислота в первую очередь обжигает слизистую оболочку, а затем поражает остальные органы. В таких случаях нужна немедленная госпитализация.
После попадания кислоты на открытые участки кожи рекомендуется сразу промыть их проточной водой. Поверхностный ожог кислотой может вызвать некроз тканей, что также требует госпитализации.
Интересные факты
Ученые физиологии выяснили, что человеку вовсе не обязателен прием уксусной кислоты — без пищевых добавок можно обойтись. Зато людям с непереносимостью кислоты, а также с проблемами желудка, вещество противопоказано.

Уксусная кислота используется в книгопечатании.
Вещество в небольшом количестве было найдено в меде, бананах и пшенице.
Охладив уксусную кислоту и резко взболтав с ней емкость, можно наблюдать ее резкое застывание.
Небольшая концентрация уксусной кислоты может снизить болевой симптом от укуса насекомых, а также мелких ожогов.
Прием в пищу продуктов с малым содержанием уксусной кислоты снижает уровень холестерина в организме. Вещество хорошо стабилизирует уровень сахара у диабетиков.
Употребление белковой и углеводной пищи вместе с небольшим количеством уксусной кислоты повышает их усвояемость организмом.
Если еда пересолена, достаточно добавить пару капель уксуса, чтобы сгладить солоноватость.
Напоследок
Тысячелетия использования уксусной кислоты привели к тому, что ее физические и химические свойства находят свое применение на каждом шагу. Сотни возможных реакций, тысячи полезных веществ, благодаря которым человечество идет дальше. Главное знать все особенности уксусной кислоты, ее положительные и отрицательные качества.
Не стоит забывать о пользе, но всегда надо помнить какой вред может причинить неосторожное обращение с уксусной кислотой высокой концентрации. По своей опасности она стоит рядом с соляной и серной кислотой. Всегда помните о технике безопасности при использовании кислоты. Правильно и осторожно разбавляйте эссенцию водой.
fb.ru
Уксусная кислота – свойства, области применения, пищевая добавка Е-260
Одной из первых кислот, которая стала известна людям еще в древности, стала уксусная кислота. Обнаружено это было случайно – вследствие появления уксуса при скисании вина. В 1700 году Шталь получил концентрированную разновидность химической разновидности жидкости, а в 1814 – Берцелиус установил точный его состав.
Получение уксусной кислоты возможно разными путями, а применяется она достаточно широко во многих направлениях хозяйственной деятельности.
Что такое уксусная кислота?
Уксусная кислота является синтетическим продуктом брожения углеводов и спиртов, а также естественного скисания сухих виноградных вин. Принимая участие в процессе обмена веществ в организме человека, данная кислота является пищевой добавкой, используемой для приготовления маринадов и консервации.
Производными кислоты считаются уксус – 3-9%, и уксусная эссенция – 70-80%. Эфиры и соли уксусной кислоты называются ацетатами. В состав обычного уксуса, к которому привыкла каждая хозяйка, входит аскорбиновая, молочная, яблочная, уксусная кислоты. Ежегодно в мире производится почти 5 миллионов тонн уксусной кислоты.
Транспортировка кислоты на разные расстояния осуществляется в железнодорожных или автомобильных цистернах, изготовленных из специализированных марок нержавеющей стали. В складских условиях она хранится в герметичных емкостях, контейнерах, бочках под навесами или в помещениях. Заливать и хранить вещество в полимерной таре можно в течение одного календарного месяца.
Качественные характеристики уксусной кислоты
Бесцветная жидкость с кислым привкусом и резковатым запахом, которой является уксусная кислота, имеет ряд определенных преимуществ. Конкретные свойства делают кислоту незаменимой во многих химических соединениях и продуктах бытового назначения.
Уксусная кислота, как одна из представителей карбоновых, имеет способность к проявлению высокой реакционной способности. Вступая с самыми разными веществами в реакции, кислота становится инициатором соединений с функциональными производными. Благодаря подобным реакциям, становится возможным:
- Образование солей;
- Образование амидов;
- Образование сложных эфиров.
К уксусной кислоте предъявляется ряд определенных технических требований. Жидкость должна растворяться в воде, не иметь механических примесей и иметь установленные пропорции качественных составляющих.
Основные области применения уксусной кислоты Е-260
Разнообразие сфер, в которых применима уксусная кислота, достаточно велико. Данная кислота является непременным компонентом многих лекарственных препаратов – например, фенацетина, аспирина и других разновидностей. Ароматические амины Nh3-группы защищаются в процессе нитрования введением ацетильной группы СН3СО – это также одна из наиболее распространенных реакций, в которые вступает уксусная кислота.
Довольно важную роль играет вещество при изготовлении ацетилцеллюлозы, ацетона, различных синтетических красителей. Не обходится без ее участия производство разнообразной парфюмерии и негорючих пленок.

Часто применима уксусная кислота в пищевой промышленности – в качестве пищевой добавки Е-260. Консервирование и бытовая кулинария также являются успешным полем действия и применения качественной натуральной добавки.
При крашении основные типы солей уксусной кислоты играют роли специальных протрав, обеспечивая стабильную связь текстильных волокон с красителем. Эти соли часто применяются в борьбе с самыми стойкими разновидностями растений-вредителей.
Меры предосторожности при работе с уксусной кислотой
Уксусная кислота считается легковоспламеняющейся жидкостью, которой присвоен третий класс опасности – в соответствии с классификацией веществ по степени опасного воздействия на организм. При любых работах с данным видом кислоты специалисты пользуются индивидуальными современными средствами защиты (фильтрующими противогазами).

Даже пищевая добавка Е-260 может оказаться токсичной для человеческого организма, однако зависеть степень воздействия будет от качества разбавления водой концентрированной уксусной кислоты. Растворы, концентрация кислоты в которых превышает уровень в 30%, считаются опасными для жизни. Соприкасаясь с кожей и слизистыми оболочками, уксусная кислота высокой концентрации вызовет сильнейшие химические ожоги.
При этом способ получения кислоты не играет особой роли в ее токсикологической направленности, а смертельной может быть доза от 20 мл. Различные последствия могут стать губительными для многих человеческих органов – начиная от ротовых слизистых и дыхательных путей и заканчивая желудком и пищеводом.
При неосторожном попадании кислоты внутрь важно пить как можно больше жидкости до приезда медиков, но ни в коем случае не вызывать рвоту. Повторное прохождение веществ по организму может повторно обжечь органы. В дальнейшем необходимым будет промывание желудка при помощи зонда и госпитализация.
www.sciencedebate2008.com
Уксусная кислота и уксус — Справочник химика 21
Испытуемую посуду наполняют 4 /о уксусной кислотой (уксусом), добавляют 1 /о хлористого натрия и кипятят в течение часа. Жидкость выпаривают в фарфоровой чашке . Остаток растворяют в нескольких каплях воды, испытывают на свинец (стр. 111) и производят при достаточном количестве его колориметрическое или объемное определение. [c.115]Многие из кислот, приведенных в табл. 4.3, встречаются в природе, одни в виде производных (амиды или сложные эфиры), другие в свободном состоянии. Аминокислоты (гл. 24) входят в состав белков, из которых состоят мышцы и ткани животных. Многие кислоты играют важную роль в метаболизме и синтезе жиров с помощью ферментных систем, другие являются промежуточными или конечными продуктами в микробиологических процессах. Уксусная кислота (уксус) — это конечный продукт в ферментации большинства сельскохозяйственных продуктов и общий знаменатель многих процессов синтеза и деструкции, связанных с метаболизмом пищи и построением тканей млекопитающих. [c.76]
Уксусная H .HjO, Пищевой уксус (обычно 5%-ный раствор уксусной кислоты) [c.67]
Уксусная кислота (содерн(ится в уксусе) [c.218]
Чистая вода не растворяет грязь и жир. Если вы смешивали уксус и масло (уксус — водный раствор уксусной кислоты) при приготовлении салатов, то вы знакомы с этой проблемой. Перемешивайте эту. смесь сколько хотите, но после того, как вы остановитесь, она разделится вновь. Жир и вода не смешиваются и в том случае, когда вы моетесь без мыла. Вот почему одной только водой смыть грязь не удается. [c.464]
Раствор триацетата целлюлозы в виде сиропа насосом подается в гидролизеры 8, 9, в которые поступает 30%-ная уксусная кислота при 60°С. По достижении заданного содержания связанной уксус- [c.99]
Если [ разлитое вещество кислота ] и («разлив пахнет уксусом ), то [ разлитое вещество -уксусная кислота ) [c.166]
ПП-7. ЕСЛИ (разлитое вещество пахнет уксусом) И (разлитое вещество — кислота), ТО (разлитое вещество — уксусная кислота) [c.166]
Биохимический метод производства уксусной кислоты используют только для производства натурального пищевого уксуса. [c.311]
Номенклатура. Карбоновые кислоты чаще всего называют согласно тривиальной номенклатуре. Названия эти обычно связаны с источниками, из которых они были выделены впервые например, муравьиная кислота — из муравьев, уксусная кислота — из уксуса, масляная кислота — из масла н т. д. Карбоновые кислоты можно рассматривать как производные уксусной кислоты и называть по рациональной номенклатуре [c.140]
Уксусная кислота (этановая) СНз—СООН при обычной температуре— бесцветная жидкость с резким запахом. Безводная уксусная кислота, замерзающая при 16,6°С, называется ледяной. Водный раствор (70—80%) уксусной кислоты называется уксусной эссенцией, а 3—5%-ный водный раствор — столовым уксусом. [c.150]
Применение. Уксусная кислота под названием уксус известна с глубокой древности. Ее используют в быту в качестве пищевой приправы, для приготовления маринадов. [c.346]
Уксус представляет собой 8%-ный раствор уксусной кислоты. Сколько о-ной кислоты необходимо взять для приготовления 20 кг уксуса [c.90]
Разбавленные водные растворы уксусной кислоты (5— 7%), известные под названием уксуса, широко применяются в пищевой промышленности. Уксусная кислота в больших количествах расходуется на приготовление красителей, лекарственных препаратов, для получения искусственных материалов (ацетатный шелк), пластмасс. Некоторые соли уксусной кислоты (алюминиевые, хромовые и др.) нашли применение в крашении тканей, в фотографии. Ацетат свинца идет на изготовление свинцовых белил. [c.160]
Уксусная кислота (этановая кислота) — бесцветная, прозрачная жидкость, с характерным резким запахом уксуса. Безводная уксусная кислота существует в виде кристаллов, имеющих температуру плавления 16,6 °С. Поэтому такую кислоту называют ледяной уксусной кислотой. С водой смешивается во всех соотношениях. [c.344]
Уксусную кислоту (СНзСООН) получают окислением ацетальдегида или окислением низших углеводородов (бутана, бутенов, бензина) кислородом воздуха. Заслуживает внимания способ получения уксусной кислоты присоединением оксида углерода к метанолу в присутствии карбонила родия и ионов иода при нормальном давлении. Уксусная кислота образуется также при микробиальном окислении водных растворов этанола (5—8%-ный водный раствор уксусной кислоты, так называемый винный уксус). Это наиболее важная карбоновая кислота в химической промышленности. Большое значение имеют также ее соли, применяющиеся в производстве красителей и в медицине. [c.271]
Уксусноизоамиловый эфир (изоамилацетат, изоамиловый эфир уксусной кислоты, изопентиловый эфир уксусной кислоты, уксус-ноизопентиловый эфир) — бесцветная жидкость с фруктовым запахом, смешивается с этиловым спиртом, диэтиловым эфиром, хлороформом, трудно растворяется в воде (0,31 г в 100 мл). Т. кип. 142°С, pf=0,8720, 1,4053. [c.168]
Кислоты, попавшие на кожу человека или на одежду, нейтрализуются щелочами (сода, нашатырный спирт) едкие щелочи (гидраты окиси калия и натрия) нейтрализуются разведенной уксусной кислотой (уксусом). Запас этих нейтрализирующих веществ всегда надо иметь в кабинете на легко доступном для всех месте. Самым категорическим образом должно быть запрещено нюхание реактивов, а тем более проба их на вкус. Если реактив попал в рот, надо заставить учащегося прополоскать рот водой. В случае, если реактив проглочен, необходимо вызвать врача, а до его прихода поить пострадавшего молоком нли давать ему сырые яйца. [c.411]
Маринование. 1 онсервирующее средство — пищевая уксусная кислота (уксус) концентрации 1,2—1,8%. При мариновании овощей добавляется соль. Для сохраняемости продуктов их герметически укупоривают, а затем пастеризуют при 85° С в течение 55—70 мин. [c.147]
Самым талантливым и прославленным арабским алхимиком был Джабир ибн Хайян (721—815), ставший известным в Европе позднее под именем Гебер. Он жил во времена наивысшего расцвета арабской империи (при Гарун аль-Рашиде, прославленном в Тысяча и одной ночи ). Многочисленные труды Джабира написаны достаточно понятным языком. (Многие книги, приписанные ему, правда, могли быть написаны и позднее другими алхимиками.) Джабир описал нашатырный спирт и показал, как приготовить свинцовые белила. Он перегонял уксус, чтобы получить уксусную кислоту — самую сильную из известных в то время кислот. Ему удалось получить слабый раствор азотной кислоты. [c.21]
Если сидр (и любое другое вино), постояв на воздухе, становится кислым из-за образования в нем уксусной кислоты, обычно говорят, что он прокис, в древности и в средние века, когда вино изготовляли самым примитивным способом, оно, особенно дешевые его сорта, почти всегда было кислым. На старофранцузском языке кислое вино называется Vin egre ( вэн эгр ), отсюда произошло французское слово Vinaigre ( винэгр ) —уксус, а от него винегрет . В том уксусе, который мы покупаем в магазине и добавляем в винегрет, от 3 до 6 процентов уксусной кислоты, она и придает уксусу его характерный запах и кислоту. [c.156]
По мере того как химики пытались вывести формулы для новых и новых соединений, становилась все более очевидной ошибочность принятых Дальтоном атомных масс и его правила простоты. Никто не мог предложить надежный метод определения химических формул. Из трех возможных источни
www.chem21.info
