Формула Триптофана структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C11H12N2O2
Химический состав Триптофана
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 11 | 64,7% |
| H | Водород | 1,008 | 12 | 5,9% |
| N | Азот | 14,007 | 2 | 13,7% |
| O | Кислород | 15,999 | 2 | 15,7% |
Молекулярная масса: 204,228
Триптофан,
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата, имеют название trp-гены и у бактерий объединены в триптофановый оперон. Схематично строение триптофанового оперона Escherichia coli можно выразить записью: —trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор— Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В реакции высвобождается неорганический пирофосфат (в присутствии пирофосфатазы реакция протекает практически необратимо). У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат, претерпевая перегруппировку Амадори, изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, происходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB).
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
Триптофан является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина. Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана. Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии и депрессии, но клинические испытания не дали окончательных результатов. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин, или 5-HT). В связи с преобразованием 5-HTP в серотонин в печени есть значительный риск появления пороков сердца из-за влияния серотонина на сердце.
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли. В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода → индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Одним из лучших источников триптофана является арахис, причем как цельные орехи, так и арахисовая паста. Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан. Таблица содержания триптофана в продуктах
| 1 | красная икра | 960 |
| 2 | чёрная икра | 910 |
| 3 | сыр голландский | 780 |
| 4 | арахис | 750 |
| 5 | миндаль | 630 |
| 6 | кешью | 600 |
| 6 | соевые бобы | 600 |
| 7 | сыр плавленый | 500 |
| 8 | кедровые орехи | 420 |
| 9 | халва | 360 |
| 10 | мясо кролика, индейки | 330 |
| 11 | кальмары | 320 |
| 12 | ставрида | 300 |
| 13 | семечки подсолнуха | 300 |
| 14 | фисташки | 300 |
| 15 | курица | 290 |
| 16 | горох, фасоль | 260 |
| 17 | сельдь | 250 |
| 18 | телятина | 250 |
| 19 | говядина | 220 |
| 20 | лосось | 220 |
| 21 | треска | 210 |
| 22 | баранина | 210 |
| 23 | творог жирный | 210 |
| 24 | яйца куриные | 200 |
| 25 | минтай | 200 |
| 26 | шоколад | 200 |
| 27 | свинина | 190 |
| 28 | творог нежирный | 180 |
| 29 | карп | 180 |
| 30 | палтус, судак | 180 |
| 31 | творог нежирный | 180 |
| 32 | крупа гречневая | 180 |
| 33 | пшено | 180 |
| 34 | окунь морской | 170 |
| 35 | скумбрия | 160 |
| 36 | крупа овсяная | 160 |
| 37 | курага | 150 |
| 38 | грибы | 130 |
| 39 | крупа ячневая | 120 |
| 40 | крупа перловая | 100 |
| 41 | хлеб пшеничный | 100 |
| 42 | картофель жаренный | 84 |
| 43 | финики | 75 |
| 44 | рис отварной | 72 |
| 45 | картофель отварной | 72 |
| 46 | хлеб ржаной | 70 |
| 47 | чернослив | 69 |
| 48 | зелень (укроп, петрушка) | 60 |
| 49 | свекла | 54 |
| 50 | изюм | 54 |
| 51 | капуста | 54 |
| 52 | бананы | 45 |
| 53 | морковь | 42 |
| 54 | лук | 42 |
| 55 | молоко, кефир | 40 |
| 56 | помидоры | 33 |
| 57 | абрикосы | 27 |
| 58 | апельсины | 27 |
| 59 | гранат | 27 |
| 60 | грейпфрут | 27 |
| 61 | лимон | 27 |
| 62 | персики | 27 |
| 63 | вишня | 24 |
| 64 | клубника | 24 |
| 65 | малина | 24 |
| 66 | мандарины | 24 |
| 67 | мёд | 24 |
| 68 | сливы | 24 |
| 69 | огурцы | 21 |
| 70 | кабачки | 21 |
| 71 | арбуз | 21 |
| 72 | виноград | 18 |
| 73 | дыня | 18 |
| 74 | хурма | 15 |
| 75 | клюква | 15 |
| 76 | яблоки | 12 |
| 77 | груши | 12 |
| 78 | ананасы | 12 |
Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии (Eosinophilia–myalgia syndrome). Огласке эта проблема подверглась в 1989, после того как личные врачи трёх американок, обсудив между собой ситуацию, подняли тревогу. Впоследствии масштаб той вспышки оценили как приблизительно равный 60 000 случаев, из которых около 1500 случаев привели к инвалидизации и не менее 27 закончились смертельным исходом. Было установлено, что практически все заболевшие принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах выявили более 60 различных примесей. Эти примеси, среди которых особенно подозрительными оказались EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни у одной из них не выявили способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии. Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты пытались оценить вероятность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан. Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привело к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали этому примеру. В феврале 2001 FDA ослабил ограничения, но все же выразил беспокойство: «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.» Перевод: «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными факторами».
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для инфицированных вирусом или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте.
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20 протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Гипотеза о том, что при депрессивных расстройствах уменьшается содержание в мозге серотонина, привела к терапевтическому использованию L-триптофана при депрессии. Он применяется как в качестве монотерапии, так и в сочетании с традиционными антидепрессантами. Имеются данные контролируемых испытаний, согласно которым добавление L-триптофана может усиливать терапевтический эффект антидепрессантов группы ИМАО. Назначение L-триптофана рекомендуется для дополнительного потенцирования серотонинергических эффектов комбинаций «литий + ИМАО» и «литий + кломипрамин»(«серотониновый коктейль»). Также L-триптофан используется при обсессивно-компульсивном расстройстве. Дополнительное введение L-триптофана в дозе 68 г в сутки особенно оправданно при снижении синтеза или истощении запасов серотонина, например вследствие длительного применения серотонинергических антидепрессантов. При этом у части больных терапевтический эффект L-триптофана при длительном лечении склонен истощаться. Кроме того, препараты L-триптофана назначаются при расстройствах сна, чувстве страха и напряжения, дисфории. Показаниями к применению также являются комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90%. Побочными действиями L-триптофана являются гипотензия, тошнота, поносы и рвота, анорексия. Кроме того, он вызывает сонливость днём, а если принимать его вечером — может улучшать ночной сон. Сочетанное применение серотонинергических антидепрессантов и L-триптофана может вызывать серотониновый синдром. Триптофан также применяется для сбалансирования кормов для животных.
formula-info.ru
Триптофан. Свойства, особенности, сфера применения
Триптофан
CAS номер: 72-22-3Брутто формула: C11h22N2O2
Внешний вид: кристаллический порошок белого цвета без запаха
Химическое название и синонимы: L-Tryptophan, L(-)-Tryptophan; (S)-2-Amino-3-(1H-indol-3-yl)propanoic acid; L-alphs-Amino-3-indolepropionic acid; Indole-3-alanine; Trp.
Физико-химические свойства:
Молекулярная масса 204.23 г/моль
pH (1% раствор / вода): 5,5-7,0
Плотность 1,34
Температура разложения: 289 ° C (552,2 ° F)
Температура плавления 280-285 °С
alpha -31,1 º (c = 1, h30)
Растворимость:
Амикацин растворим в горячей воде. Частично растворим в холодной воде. Нерастворим в диэтиловом эфире. Слабо растворим в уксусной кислоте.
Растворимость в воде: 0,23 г / л при 0 °. C; 11,4 г / л при 25 ° С; 17,1 г / л 50 град. C; 27,95 г / л при 75 град. C; 49,9 г / л при 100 град. C Нерастворим в хлороформе. Растворим в горячем спирте и растворах разбавленных кислот и щелочных гидроксидов.
Описание:
Триптофан — незаменимая аминокислота, участвует в синтезе белков. Организмом триптофан не вырабатывается, поэтому запасы триптофана необходимо пополнять с пищей, поэтому он и является незаменимой аминокислотой. Содержится он в достаточно большом количестве продуктов животного и растительного происхождения. Это такие продукты как красное мясо, шоколад, молочные продукты (йогурт, молоко, творог), а также в орехах, овсе, рыбе, финиках, бананах, спирулине, семенах и во множестве других.
Непосредственно триптофан участвует в построении и укреплении мембраны клетки. К тому же триптофан является прекурсором множества важнейших биохимических соединений: серотонина, мелатонина, витамина В3. Ауксины (класс фитогормонов) образуются из триптофана.
Кишечные бактерии у людей способны превращать триптофан на несколько веществ: индол и скатол. Недостаточность триптофана в организме при нормальном поступлении его в пищу, иногда обуславливается нарушением мальабсорбции фруктозы и непереносимости лактозы, которое за собой влечет неправильное поглощение триптофана в кишечнике, снижение уровня триптофана в крови и зачастую к депрессии.
В начале 90 годов 20 столетия импорт L-Tryptophan был запрещен в Соединенных Штатах Америки после случаев смертельной аутоиммунной болезни, называемой синдромом эозинофилии-миалгии, из-за приема населением неправильно приготовленной партии триптофана. Хотя L-Tryptophan был выделен на одной японской фабрике, которая позволила токсичным бактериальным метаболитам в процессе очистки, запрет был сохранен, а доступность триптофана ограничена рецептурным препаратом (триптан), детскими смесями и продуктами для энтерального питания. С 1994 года L-Tryptophan выпускается и продается в качестве БАДа в США, в то время как импортируемый продукт остается ограниченным специальными правилами.
Применение:
Триптофан используют в качестве пищевой добавки в пищевой промышленности. В медицине триптофан входит в ряд фармацевтических средств выпускаемых в различных препаративных формах для перорального и парентерального введения.
Применение триптофана несет положительное влияние на некоторые важнейшие функции организма, из-за его способности увеличивать уровни серотонина в мозге (успокаивающий нейротрансмиттер при наличии в умеренных количествах) и / или мелатонин (индуцирующий сон гормон, выделяемый шишковидной железой в ответ на темноту или низкие уровни освещенности). Клинические исследования, как правило, подтверждают эффективность триптофана при некоторых нарушениях сна и других патологических состояниях организма, обычно связанных с недостаточным содержанием серотонина в организме. Учитывая свойства и функции триптофана, его также используют в качестве самостоятельного антидепрессанта, так и в сочетании с другими препаратами помогающими бороться с депрессией у людей.
Используют триптофан и в процессе отказа от курения. Согласно испытаниям, триптофан (50 мг / кг / день) использовался в качестве дополнительной терапии для прекращения курения. Во время двухнедельного исследования субъекты, получавшие триптофан, испытывали меньше симптомов отмены никотина и могли воздерживаться или курить меньше сигарет, чем контрольные.
Получение:
Способ получения L-триптофана, включающий культивирование бактерий, продуцирующих коринеформную глутаминовую кислоту, трансформированных вектором экспрессии, способным реплицировать и экспрессировать функционально связанный ген фосфорибозилтрансферазы антраниловой кислоты, выделенный из бактерии, продуцирующей глутаминовую кислоту brevibacterium(бревибактерии рода актиномицетов), с выращиванием трансформантов в культуральной среде, для продуцирования L-триптофана и извлечения L-триптофана, накопленного в культуральной среде.
Еще способ получения L-триптофана включает взаимодействие индола с серином в присутствии триптофан-синтетазы или триптофаназы, где используют DL-серин или D-серин, а фермент рацемизации серина включен в реакционную систему и реагирует с серином.
Действие на организм:
Наиболее исследованным аспектом метаболизма триптофана является серотониновый путь, который включает последующее образование мелатонина. Гидроксилаза триптофана является ограничивающим скорость ферментом для производства серотонина и включает превращение триптофана в 5-гидрокситриптофан (5-HTP). Этот фермент может быть ингибирован стрессом, резистентностью к инсулину, дефицитом магния или витамина B6 или увеличением возраста. Декарбоксилирование 5-HTP до серотонина зависит от присутствия активной формы витамина B6, пиридоксаль-5′-фосфата, тогда как дальнейшее превращение в мелатонин требует S-аденозил-L-метионина (SAMe). Триптофан и 5-HTP проникают через гематоэнцефалический барьер, хотя триптофан требует активного транспорта и конкурирует за те же рецепторы с другими нейтральными аминокислотами — тирозином, фенилаланином, валином, лейцином и изолейцином. Фактически, лучший предиктор данного влияние приема пищи на мозг триптофан и уровни серотонина — это соотношение триптофана в сыворотке к пулу крупных нейтральных аминокислот. Клинически, однако важно, что уровни серотонина повышаются при поглащении углеводов, поскольку высвобождение инсулина ускоряет удаление сыворотки конкурирующего валина, лейцина и изолейцина. Точно так же более высокий процент белка в диете замедляет повышение уровня серотонина.
Хотя триптофан можно найти в сыворотке крови свободным, большинство из его молекул связано с альбумином. Метаболиты триптофана в моче включают 3-гидроксикинуренин, ксантуреновую кислоту и кинуренин. Однако сывороточный кинуренин метаболизируется в ниацин (витамин В3). Это преобразование неэффективно, поскольку для синтеза 1 мг ниацина требуется 60 мг триптофана, что также истощает запасы витаминных кофакторов В1, В2 и В6.
Основным механизмом действия триптофана является его роль в качестве метаболического предшественника нейротрансмиттера серотонина. Также было показано, что другие нейротрансмиттеры и химические вещества центральной нервной системы (ЦНС), такие как мелатонин, дофамин, норэпинефрин и бета-эндорфин, увеличиваются после перорального введения триптофана. Имеются ограниченные данные, связывающие модуляцию триптофана эндокринной системой. Эффекты триптофана на уровень кортизола были противоречивыми . Хотя внутривенный триптофан стимулирует секрецию пролактина и гормона роста, но такая связь не проверялась при пероральном введении.
Токсикологические данные:
LD50 при оральном применении, крыса > 16 000 мг / кг.
biopax.ru
Триптофан [LifeBio.wiki]
Молекула L-триптофана
Фармакологическая группа: Аминокислоты
Триптофан (ИЮПАК-МСБХМБ аббревиатура: Trp или W; ИЮПАК аббревиатура: L-Trp или D-Trp; продается для медицинского использования под названием Tryptan) – одна из 22 стандартных аминокислот, незаменимая в рационе человека. В стандартном генетическом коде кодируется кодоном UGG. В структурных или ферментных белках используется только L-стереоизомер триптофана. D-стереоизомер иногда может встречаться в естественно производимых пептидах (например, морском ядовитом пептиде контрифане). Структурно триптофан интересен тем, что он содержит индольную функциональную группу. [[аминокислоты|Аминокислота]] является незаменимой, о чем говорит ее воздействие на рост у крыс.
Изоляция триптофана
В 1901 году Фредерик Хопкинс впервые осуществил выделение триптофана с использованием гидролиза казеина. Из 600 г неочищенного казеина можно выделить 4-8 грамм триптофана.
Биосинтез и промышленное производство
Растения и микроорганизмы обычно синтезируют триптофан из шикимовой или антраниловой кислоты. Последняя конденсируется с фосфорибоцилпирофосфатом (PRPP), генерируя пирофосфат как побочный продукт. После раскрытия кольца фрагмента рибозы и последующего восстановительного декарбоксилирования, производится индол-3-глицеринфосфан, который, в свою очередь, превращается в индол. На последней стадии триптофан-синтаза катализирует образование триптофана из индола и аминокислоты серина. В промышленности триптофан также производится биосинтетическим путем, основанным на ферментации серина и индола с использованием натуральных или генетически модифицированных бактерий, таких как B. amyloliquefaciens, B. subtilis, C. glutamicum или E. coli. Эти штаммы либо производят мутации, предотвращающие обратный захват ароматических аминокислот, либо сверхэкспрессию триптофановых оперонов. Преобразование катализируется ферментом триптофансинтазы.
Функция
Для многих организмов (включая человека), триптофан является незаменимой, то есть жизненно важной, аминокислотой, которая не может быть синтезирована в организме и, следовательно, должна составлять обязательную часть рациона. Аминокислоты, в том числе триптофан, выступают в качестве строительных блоков в биосинтезе белка. Кроме того, триптофан действует как биохимический предшественник для следующих соединений:
Серотонин (нейротрансмиттер), синтезируется через гидроксилазу триптофана. Серотонин, в свою очередь, может быть преобразован в мелатонин (нейрогормон) через N-ацетилтрансферазу и 5-гидроксииндол-O-метилтрансферазу. Никотиновая кислота синтезируется из триптофана, при этом кинуренин и хинолиновая кислота выступают в качестве ключевых промежуточных соединений биосинтеза. Ауксин (фитогормон), при преобразовании ситовидных элементов апоптоза триптофана в ауксины.
Нарушения всасывания фруктозы и непереносимость лактозы являются причиной неправильного поглощения триптофана в кишечнике, снижения уровня триптофана в крови и депрессии. У бактерий, синтезирующих триптофан, высокие клеточные уровни этой аминокислоты активируют белок-репрессор, который связывается с триптофановым опероном. Связывание этого репрессора с опероном предотвращает транскрипцию ДНК, которая кодирует ферменты, участвующие в биосинтезе триптофана. Таким образом, высокие уровни триптофана предотвращают синтез триптофана через цепь отрицательной обратной связи, и при сокращении уровней триптофана в клетках возобновляется транскрипция из триптофанового оперона. Генетическая организация триптофанового оперона позволяет, таким образом, жестко регулировать и быстро реагировать на изменения во внутренних и внешних клеточных уровнях триптофана.
Триптофан в продуктах питания
Триптофан является обычным составляющим большинства белковых пищевых продуктов или пищевых белков. Он содержится в особенно больших количествах в шоколаде, овсе, сушеных финиках, молоке, йогурте, твороге, сыре, красном мясе, яйцах, рыбе, птице, кунжуте, горохе, семенах подсолнечника, семенах тыквы, спирулине, бананах и арахисе. Несмотря на распространенное мнение, что индейка содержит особенно большое количество триптофана, это вещество в равной мере присутствует в организме большинства птиц. Существует также миф, что в растительном белке триптофан присутствует в недостаточном количестве; на самом деле, триптофан имеется в значительных количествах почти во всех формах растительного белка, а в некоторых – даже в очень больших количествах.
Использование в качестве пищевой добавки и лекарственных препаратов
Существуют доказательства того, что уровни триптофана в крови мало зависят от изменения диеты, однако некоторое время назад триптофан был доступен в магазинах здорового питания в качестве пищевой добавки. Клинические исследования показали смешанные результаты в отношении эффективности триптофана в качестве снотворного, особенно у нормальных пациентов. Триптофан показал некоторую эффективность при лечении различных других заболеваний, обычно связанных с низким уровнем серотонина в мозгу. В частности, триптофан в отдельности оказывал некоторое антидепрессивное воздействие, а при применении совместно с другими антидепрессантами действовал как их усилитель. Тем не менее, надежность этих клинических испытаний была поставлена под сомнение из-за отсутствия формального контроля. Кроме того, триптофан сам по себе не может применяться для лечения депрессии или других серотонин-зависимых состояний, однако может быть полезен для понимания химических путей, которые могут дать новый импульс в исследовании фармацевтических препаратов.
Метаболиты
Метаболит триптофана, 5-гидрокситриптофан (5-HTP), был предложен в качестве средства для лечения эпилепсии и депрессии, хотя клинические испытания считаются неубедительными и недостаточными. 5-HTP способен легко проникать через гематоэнцефалический барьер и, кроме того, быстро декарбоксилировать серотонин (5-гидрокситриптамин или 5-НТ). Тем не менее, серотонин имеет относительно короткий период полураспада, поскольку он быстро метаболизируется моноаминоксидазой. В связи с преобразованием 5-HTP в серотонин в печени, воздействие серотонина на сердце может вызывать значительный риск заболеваний сердечного клапана. Первичным продуктом фермента печени триптофан диоксигеназы является кинуренин. Он продается в Европе для лечения депрессии под торговыми марками Cincofarm и Tript-OH. В Соединенных Штатах 5-HTP продается без рецепта, как его продажа осуществляется в рамках Закона о пищевых добавках. Поскольку качество биологически активных добавок теперь регулируется FDA США, производители могут осуществлять продажу продуктов, ингредиенты которых соответствуют маркировке, однако это не гарантирует эффективность таких продуктов.
Триптофан добавки и СЭМ
В 1989 году была зафиксирована крупная вспышка синдрома эозинофилии-миалгии (СЭМ), связанная с применением триптофана, вызвавшая 1500 случаев постоянной инвалидности и, по крайней мере, 37 случаев смерти. Некоторые эпидемиологические исследования показали, что вспышка эпидемии связана с применением L-триптофана, поставляемого японским производителем Showa Denko К. К. Кроме того, предполагалось, что во время производства триптофана было допущено попадание в продукт некоторых примесей, что и вызвало развитие эпидемии. Сам факт того, что для получения L-триптофана компания Showa Denko использовала генетически модифицированные бактерии, породило массу домыслов о том, что генная инженерия ответственна за возникновение подобных неприятностей. Тем не менее, была подвергнута критике методология, используемая в начальных эпидемиологических исследованиях. Альтернативное объяснение вспышки СЭМ 1989 года состоит в том, что большие дозы триптофана могут производить метаболиты, ингибирующие нормальную деградацию гистамина, а избыток гистамина, в свою очередь, может вызывать СЭМ. В 1991 году большая часть триптофана была выведена из продажи в США, и другие страны последовали этому примеру. Однако триптофан по-прежнему продавался для производства детского питания. Во время запрета FDA не знало, или не указывало, что эпидемия СЭМ была вызвана загрязненной партией, и все же, даже когда загрязнение было обнаружено и был запущен процесс очистки, FDA по-прежнему утверждало, что L-триптофан является небезопасным. В феврале 2001 года FDA ослабило ограничения на маркетинг L-триптофана (но не на его импорт), однако все же выразило следующую озабоченность:
"Основываясь на научных данных, доступных в настоящее время, мы не можем с уверенностью определить, что возникновение СЭМ у восприимчивых людей, потребляющих добавки L-триптофана, наблюдается из-за содержания L-триптофана, примесей, содержащихся в L-триптофане, либо из-за пока неизвестных внешних факторов».
С 2002 года L-триптофан продавался в США в своем первоначальном виде. Существует несколько высококачественных источников L-триптофана, которые продаются во многих крупнейших магазинах здорового питания по всей стране. Триптофан продолжает использоваться в клинических и экспериментальных исследованиях. В последние годы в США рецептурные аптеки и некоторые продавцы, работающие по почте и продающие товары в розницу, начали продажи триптофана для широкой публики. Триптофан также остается на рынке как рецептурный препарат (Tryptan), который некоторые психиатры продолжают выписывать, в частности, как средство для увеличения реакции на антидепрессанты.
Мясо индейки и сонливость
Существует мнение, что чрезмерное употребление мяса индейки приводит к сонливости, в связи с высоким уровнем содержащегося в ней триптофана. Тем не менее, количество триптофана в индейке сопоставимо с его содержанием в большинстве других видов мяса. Кроме того, сонливость, возникающая после приема пищи, может быть связана с тем, какую еще пищу, помимо индейки, съел человек и, в частности, какие углеводы. В опытах на животных и человеке было показано, что прием пищи, богатой углеводами, вызывает высвобождение инсулина. Инсулин, в свою очередь, стимулирует поглощение мышцами больших нейтральных аминокислот с разветвленной цепью (branched-chain amino acids, ВСАА), а не триптофан (ароматическую аминокислоту), увеличивая тем самым соотношение триптофана к BCAA в кровотоке. Полученное в результате увеличение такого соотношения триптофана к BCAA в крови снижает конкуренцию у транспортеров больших нейтральных аминокислот (транспортирующих как BCAA, так и ароматические аминокислоты), что приводит к поглощению триптофана через гематоэнцефалический барьер в цереброспинальной жидкости (ЦСЖ). После попадания в ЦСЖ триптофан превращается в серотонин в месте соединения ядер на нормальном ферментативном пути. Полученный в результате серотонин далее метаболизируется шишковидной железой в мелатонин. Таким образом, данные показывают, что «сонливость после приема пищи» может быть результатом приема тяжелой, богатой углеводами, пищи, которая косвенно увеличивает производство мелатонина, который в свою очередь способствует засыпанию.
Доступность:
триптофан.txt · Последние изменения: 2015/09/25 17:53 (внешнее изменение)
lifebio.wiki
Триптофан Википедия
| Триптофан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | 2-амино-3-(1H-индол-3-ил)пропионовая кислота |
| Сокращения | Три, Trp, W UGG |
| Хим. формула | C₁₁H₁₂N₂O₂ |
| Рац. формула | C11H12N2O2 |
| Физические свойства | |
| Молярная масса | 204,23 г/моль |
| Химические свойства | |
| pKa | 9,39[1] |
| Классификация | |
| Рег. номер CAS | 73-22-3 |
| PubChem | 6305 |
| Рег. номер EINECS | 200-795-6 |
| SMILES | |
| InChI | |
| ChEBI | 16828, 57912 и 21407 |
| ChemSpider | 6066 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Триптофа́н (β-(β-индолил)-α-аминопропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах, L и D, и в виде рацемата (рацемической смеси) (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
История
Впервые в 1890 г. триптофан выделил из пищеварительного фермента трипсина и описал его свойства немецкий химик Рихард Ноймайстер и он же дал название аминокислоте. Греческий суффикс «фан» означает «указывающий на»[2].
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата, имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В реакции высвобождается неорганический пирофосфат (в присутствии пирофосфатазы реакция протекает практически необратимо). У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат, претерпевая перегруппировку Амадори, изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, происходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB)[3].
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
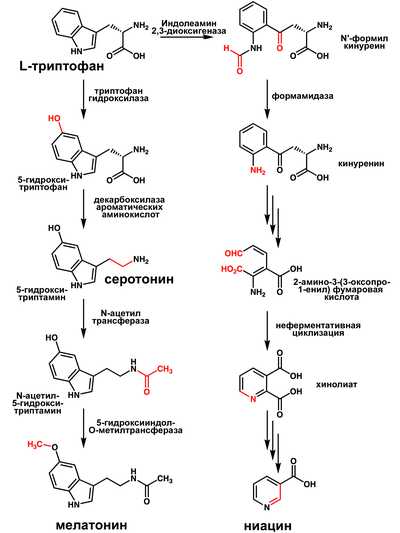
Триптофан является биологическим прекурсором серотонина[4] (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[5] и депрессии, но клинические испытания не дали окончательных результатов[6]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин, или 5-HT)[7].
В связи с преобразованием 5-HTP в серотонин в печени есть значительный риск появления пороков сердца из-за влияния серотонина на сердце[8][9].
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли.[10] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как сыр, рыба, мясо, бобовые, творог, грибы[источник не указан 1721 день], овёс, сушёные финики[источник не указан 1721 день], арахис, кунжут, кедровый орех, молоко, йогурт.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Арахис является отличным источником триптофана, однако в арахисе его меньше чем в продуктах животного происхождения.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[11].
Таблица содержания триптофана в продуктах
Основной источник: [12]| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | красная икра | 960 |
| 2 | чёрная икра | 910 |
| 3 | сыр голландский | 780 |
| 4 | арахис | 285[13] |
| 5 | миндаль | 630 |
| 6 | кешью | 600 |
| 7 | соевые бобы | 600 |
| 8 | сыр плавленый | 500 |
| 9 | кедровые орехи | 420 |
| 10 | халва | 360 |
| 11 | мясо кролика, индейки | 330 |
| 12 | кальмары | 320 |
| 13 | ставрида | 300 |
| 14 | семечки подсолнуха | 300 |
| 15 | фисташки | 300 |
| 16 | курица | 290 |
| 17 | горох, фасоль | 260 |
| 18 | сельдь | 250 |
| 19 | телятина | 250 |
| 20 | говядина | 133 |
| 21 | лосось | 220 |
| 22 | треска | 210 |
| 23 | баранина | 210 |
| 24 | творог жирный | 210 |
| 25 | яйца куриные | 200 |
| 26 | минтай | 200 |
| 27 | шоколад | 200 |
| 28 | свинина | 190 |
| 29 | творог нежирный | 180 |
| 30 | карп | 180 |
| 31 | палтус, судак | 180 |
| 32 | крупа гречневая | 180 |
| 33 | пшено | 180 |
| 34 | окунь морской | 170 |
| 35 | скумбрия | 160 |
| 36 | крупа овсяная | 160 |
| 37 | курага | 150 |
| 38 | грибы | 130 |
| 39 | крупа ячневая | 120 |
| 40 | крупа перловая | 100 |
| 41 | хлеб пшеничный | 100 |
| 42 | картофель жаренный | 84 |
| 43 | финики | 75 |
| 44 | рис отварной | 72 |
| 45 | картофель отварной | 72 |
| 46 | хлеб ржаной | 70 |
| 47 | чернослив | 69 |
| 48 | зелень (укроп, петрушка) | 60 |
| 49 | свекла | 54 |
| 50 | изюм | 54 |
| 51 | капуста | 54 |
| 52 | бананы | 45 |
| 53 | морковь | 42 |
| 54 | лук | 42 |
| 55 | молоко, кефир | 40 |
| 56 | помидоры | 33 |
| 57 | абрикосы | 27 |
| 58 | апельсины | 27 |
| 59 | гранат | 27 |
| 60 | грейпфрут | 27 |
| 61 | лимон | 27 |
| 62 | персики | 27 |
| 63 | вишня | 24 |
| 64 | клубника | 24 |
| 65 | малина | 24 |
| 66 | мандарины | 24 |
| 67 | мёд | 24 |
| 68 | сливы | 24 |
| 69 | огурцы | 21 |
| 70 | кабачки | 21 |
| 71 | арбуз | 21 |
| 72 | виноград | 18 |
| 73 | дыня | 18 |
| 74 | хурма | 15 |
| 75 | клюква | 15 |
| 76 | яблоки | 12 |
| 77 | груши | 12 |
| 78 | ананасы | 12 |
Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии (Eosinophilia-myalgia syndrome). Огласке эта проблема подверглась в 1989, после того как личные врачи трёх американок, обсудив между собой ситуацию, подняли тревогу. Впоследствии масштаб той вспышки оценили как приблизительно равный 60 000 случаев, из которых около 1500 случаев привели к инвалидизации и не менее 27 закончились смертельным исходом.
Было установлено, что практически все заболевшие принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах выявили более 60 различных примесей. Эти примеси, среди которых особенно подозрительными оказались EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни у одной из них не выявили способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии.
Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты пытались оценить вероятность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан.
Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привело к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали этому примеру. В феврале 2001 FDA ослабил ограничения, но все же выразил беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»[14]
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными факторами».
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для клеток, инфицированных вирусом, или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте[15].
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20 протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Гипотеза о том, что при депрессивных расстройствах уменьшается содержание в мозге серотонина, привела к терапевтическому использованию L-триптофана при депрессии[4]. Он применяется как в качестве монотерапии, так и в сочетании с традиционными антидепрессантами[4].
Имеются данные контролируемых испытаний, согласно которым добавление L-триптофана может усиливать терапевтический эффект антидепрессантов группы ИМАО. Назначение L-триптофана рекомендуется для дополнительного потенцирования серотонинергических эффектов комбинаций «литий + ИМАО» и «литий + кломипрамин»(«серотониновый коктейль»)[16].
Также L-триптофан используется при обсессивно-компульсивном расстройстве. Дополнительное введение L-триптофана в дозе 6—8 г в сутки особенно оправданно при снижении синтеза или истощении запасов серотонина, например вследствие длительного применения серотонинергических антидепрессантов. При этом у части больных терапевтический эффект L-триптофана при длительном лечении склонен истощаться[17].
Кроме того, препараты L-триптофана назначаются при расстройствах сна[18], чувстве страха и напряжения, дисфории, предменструальном синдроме[источник не указан 1422 дня]. Показаниями к применению также являются комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечение биполярного аффективного расстройства и депрессии, связанной с менопаузой[источник не указан 1422 дня]. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Побочными действиями L-триптофана являются гипотензия, тошнота, поносы и рвота[18], анорексия. Кроме того, он вызывает сонливость днём, а если принимать его вечером — может улучшать ночной сон[4]. Сочетанное применение серотонинергических антидепрессантов и L-триптофана может вызывать серотониновый синдром[17].
Триптофан также применяется для сбалансирования кормов для животных.
Примечания
- ↑ CRC Handbook of Chemistry and Physics (1st student edition) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Леенсон И. А. Язык химии. Этимология химических названий. — М.: АСТ, Corpus, 2016. — 464 с. — ISBN 978-5-17-095739-2.
- ↑ Бокуть С. Б., Герасимович Н. В., Милютин А. А. Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации / под ред. Мельник Л. С., Касьяновой Л. Д.. — Минск: Вышэйшая школа, 2005. — 463 с. — 3000 экз. — ISBN 985-06-1045-X.
- ↑ 1 2 3 4 Гельдер М., Гэт Д., Мейо Р. Оксфордское руководство по психиатрии: Пер. с англ. — Киев: Сфера, 1999. — Т. 2. — 436 с. — 1000 экз. — ISBN 966-7267-76-8.
- ↑ Kostowski W, Bidzinski A, Hauptmann M, Malinowski JE, Jerlicz M, Dymecki J (1978). “Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study”. Pol J Pharmacol Pharm. 30 (1): 41—7. PMID 148040. (англ.)
- ↑ Turner EH, Loftis JM, Blackwell AD (2006). “Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan”. Pharmacol Ther. 109 (3): 325—38. DOI:10.1016/j.pharmthera.2005.06.004. PMID 16023217. (англ.)
- ↑ Hardebo JE, Owman C (1980). “Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface”. Ann NeurolAnn Neurol. 8 (1): 1—31. DOI:10.1002/ana.410080102. PMID 6105837. (англ.)
- ↑ Gustafsson BI, Tømmerås K, Nordrum I, Loennechen JP, Brunsvik A, Solligård E, Fossmark R, Bakke I, Syversen U, Waldum H (March 2005). “Long-term serotonin administration induces heart valve disease in rats”. Circulation. 111 (12): 1517—22. DOI:10.1161/01.CIR.0000159356.42064.48. PMID 15781732. (англ.)
- ↑ Xu J, Jian B, Chu R, Lu Z, Li Q, Dunlop J, Rosenzweig-Lipson S, McGonigle P, Levy RJ, Liang B (December 2002). “Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells”. Am. J. Pathol. 161 (6): 2209—18. DOI:10.1016/S0002-9440(10)64497-5. PMC 1850896. PMID 12466135. (недоступная ссылка) (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
- ↑ Под ред. М. Ф. Нестерина и И. М. Скурихина. Химический состав пищевых продуктов..
- ↑ Information Paper on L-Tryptophan and 5-hydroxy-L-tryptophan, FDA, February 2001 (англ.)
- ↑ H. Ooka, P. E. Segall, P. S. Timiras. Histology and survival in age-delayed low-tryptophan-fed rats (англ.) // Mechanisms of Ageing and Development : Научный журнал. — 1988. — Vol. 43, no. 1. — P. 79—98. — ISSN 0047-6374. — DOI:10.1016/0047-6374(88)90099-1. — PMID 3374178.
- ↑ Быков Ю. В. Резистентные к терапии депрессии. — Ставрополь, 2009. — 74 с.
- ↑ 1 2 Мосолов С.Н. Современные тенденции в терапии обсессивно-компульсивного расстройства: от научных исследований к клиническим рекомендациям // Биологические методы терапии психических расстройств (доказательная медицина — клинической практике) / Под ред. С.Н. Мосолова. — Москва : Издательство «Социально-политическая мысль», 2012. — С. 669—702. — 1080 с. — 1000 экз. — ISBN 978-5-91579-075-8.
- ↑ 1 2 Тёлле Р. Психиатрия с элементами психотерапии / Пер. с нем. Г. А. Обухова. — Минск: Вышэйшая школа, 1999. — 496 с. — 4000 экз. — ISBN 985-06-0146-9.
| |||
| |||
| |||
| |||
| Данные по лекарственным препаратам приведены в соответствии с реестром зарегистрированных ЛС и ТКФС от 15.10.2008 (* — препарат изъят из оборота) Поиск по базе данных ЛС (неопр.). ФГУ НЦ ЭСМП Росздравнадзора РФ (28 октября 2008). Дата обращения 12 ноября 2008. | |||
wikiredia.ru
Триптофан
Введение: Триптофан относится к незаменимым для человека и животных аминокислотам, поскольку является предшественником ряда важных биологически активных веществ, в частности серотонина и рибонуклеотида никотиновой кислоты. Серотонин в организме подвергается окислительному дезаминированию с образованием индолилук-сусной кислоты, которая выделяется с мочой. Содержание этой кислоты в моче повышено при поражениях кишечника злокачественными карци-ноидами, когда около 60 % триптофана окисляется по серотониновому пути. Содержание триптофана в организмах невелико. Но потребность в триптофане значительно меньше, чем в лизине и глутаминовой кислоте. Триптофан в небольших количествах используется в животноводстве, медицине и при различных биохимических исследованиях. Вместе с тем это очень важная аминокислота, она входит в белки и участвует в многочисленных превращениях соединений, имеющих циклическую структуру. Отсутствие этой аминокислоты или нарушение процессов синтеза ее ведет к тяжелым заболеваниям организма.
Обнаружен впервые в 1901 г. Гопкинсом и Колом в казеине.
Трехбуквенные и однобуквенные коды: Trp, W
Химическая формула:
Физико-химические свойства
Систематическое наименование: 2-амино-3-(1H-индол-3-ил)пропионовая кислота
Брутто формула: C11h22N2O2
Молекулярная масса: 204
Номер в PubChem: 6305
pKa с изображениями всех соответствующих (де)протонированных форм и именами тяжелых атомов
| pKa = 7.38 (at 25 °C) |
| pK1 = 2.38 /SRC: carboxylic acid/; |
| pK2 = 9.39 /SRC: primary amine/ |
Страница находится в стадии разработки © Гавриш Глеб, Чистяков Василий 2016 |
kodomo.fbb.msu.ru
Триптофан — это… Что такое Триптофан?
Триптофа́н — (β-индолиламинопропионовая, или α-2-амино-3-(1H-индол-3-ил)пропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах — L и D и в виде рацемата (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В рекции высвобождается неорганический пирофосфат. У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, роисходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB).[1]
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
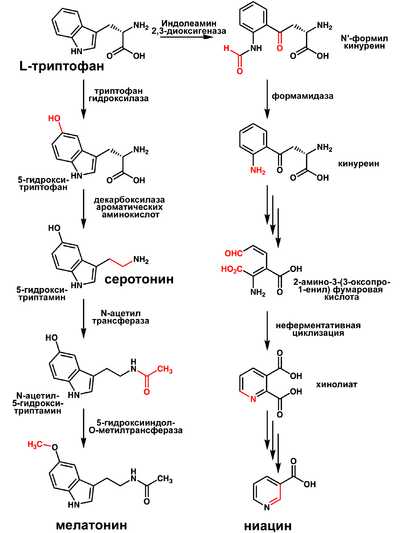
Триптофан является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[2] и депрессии, но клинические испытания не дали окончательных результатов[3]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин или 5-HT)[4].
В связи с преобразованием 5-HTP в серотонин в печени, есть значительный риск появления пороков сердца от влияния серотонина на сердце[5][6].
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометил-индол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D/L-триптофан обычно в форме натриевой соли.[7] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как грибы, овёс, бананы, сушёные финики, арахис, кунжут, кедровый орех, молоко, йогурт, творог.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Одним из лучших источников триптофана является арахис, причем как цельные орехи, так и арахисовое масло.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[8].
Таблица содержания триптофана в продуктах
- Основной источник: [9]
| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | Горох, фасоль | 260 |
| 2 | Мука пшеничная (1-й сорт) | 120 |
| 3 | Крупа гречневая | 180 |
| 4 | Рис | 80 |
| 5 | Пшено | 180 |
| 6 | Крупа овсяная | 160 |
| 7 | Крупа перловая | 100 |
| 8 | Хлеб ржаной | 70 |
| 9 | Хлеб пшеничный | 100 |
| 10 | Макаронные изделия | 130 |
| 11 | Молоко, кефир | 40 |
| 12 | Творог нежирный | 180 |
| 13 | Творог жирный | 210 |
| 14 | Сыр голландский | 790 |
| 15 | Сыр плавленый | 500 |
| 16 | Говядина I категории | 210 |
| 17 | Говядина II категории | 230 |
| 18 | Баранина, свинина мясная | 200 |
| 19 | Мясо кролика | 330 |
| 20 | Колбаса молочная | 160 |
| 21 | Куры I категории | 290 |
| 22 | Яйца куриные | 200 |
| 23 | Карп | 180 |
| 24 | Окунь морской | 170 |
| 25 | Палтус, судак | 180 |
| 26 | Сельдь | 250 |
| 27 | Скумбрия | 160 |
| 28 | Ставрида | 300 |
| 29 | Треска | 210 |
| 30 | Паста «Океан» | 220 |
| 31 | Капуста белокочанная | 10 |
| 32 | Картофель | 30 |
| 33 | Морковь | 10 |
| 34 | Свекла | 10 |
Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии. Огласке эта проблема подверглась в 1989, после того, как личные врачи трёх американок, обсудив между собой ситуацию, забили тревогу. В настоящее время масштаб той вспышки оценивают в 60000 случаев, из которых около 1500 случаев закончились инвалидизацией, не менее 27 закончились смертельным исходом. Было установлено, что заболевших связывало то, что практически все они принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах было выявлено более 60 различных примесей. Эти примеси, среди которых особенно подозрительными были EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни для одной из них не была установлена способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии. Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты рассматривали возможность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан. Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привели к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали примеру. В феврале 2001 FDA ослабил ограничения, но все ещё выразил следующее беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными, факторами.»
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для инфицированных вирусом или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте.
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20-ти протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Триптофан применяется для сбалансирования кормов для животных. Препараты L-триптофана назначаются при расстройстве сна, чувстве страха и напряжения, дисфории, предменструальном синдроме. Показаниями к применению также являются: комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечения маниакальной депрессии и депрессии, связанной с менопаузой. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Примечания
- ↑ Бокуть С. Б. и соавт. — «Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации»; Минск, «Вышэйшая школа», 2005 г. — ISBN 985-06-1045-X
- ↑ Kostowski W, Bidzinski A, Hauptmann M, Malinowski JE, Jerlicz M, Dymecki J (1978). «Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study». Pol J Pharmacol Pharm 30 (1): 41–7. PMID 148040. (англ.)
- ↑ Turner EH, Loftis JM, Blackwell AD (2006). «Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan». Pharmacol Ther 109 (3): 325–38. DOI:10.1016/j.pharmthera.2005.06.004. PMID 16023217. (англ.)
- ↑ Hardebo JE, Owman C (1980). «Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface». Ann NeurolAnn Neurol 8 (1): 1–31. DOI:10.1002/ana.410080102. PMID 6105837. (англ.)
- ↑ Gustafsson BI, Tømmerås K, Nordrum I, Loennechen JP, Brunsvik A, Solligård E, Fossmark R, Bakke I, Syversen U, Waldum H (March 2005). «Long-term serotonin administration induces heart valve disease in rats». Circulation 111 (12): 1517–22. DOI:10.1161/01.CIR.0000159356.42064.48. PMID 15781732. (англ.)
- ↑ Xu J, Jian B, Chu R, Lu Z, Li Q, Dunlop J, Rosenzweig-Lipson S, McGonigle P, Levy RJ, Liang B (December 2002). «Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells». Am. J. Pathol. 161 (6): 2209–18. DOI:10.1016/S0002-9440(10)64497-5. PMID 12466135. (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
dic.academic.ru
Триптофан — Справочник химика 21
Заметим, что именно аминокислоты фенилаланин, тирозин и триптофан обусловливают спектры поглощения белков в ультрафиолетовой области спектра. Обычно считают, что максимум поглощения белков соответствует 280 нм. [c.30]
Человеческое тело может синтезировать 12 из 20 аминокислот. Остальные восемь должны поступать в организм в готовом виде вместе с белками пищи, поэтому они называются незаменимыми. Незаменимые аминокислоты включают изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и (для детей) гистидин. При ограниченном поступлении такой аминокислоты в организм она становится лимитирующим веществом при построении любого белка, в состав которого она должна входить. Если такое случается, то единственное, что может предпринять организм, — это разрушить собственный белок, содержащий эту же аминокислоту. [c.262]
Триптофан входит в состав многих белков, но обычно лишь в незначительных количествах. Определение его облегчается применением различных цветных реакций, характерных для этой аминокислоты. При кислом гидролизе протеинов он разлагается, но при ферментативном расщеплении белка может быть выделен в лсвовращающей форме. [c.990]
Тот факт, что а-аминокислоты суть составляющие белков, придает им особое значение. Восемь аминокислот называют незаменимыми , потому что млекопитающие не могут их синтезировать и должны получать вместе с пищей. Это изолейцин, лейцин, лизин, метионин, валин, треонин, фенилаланин и триптофан. Они все обладают ь-конфигурацией, и располагать способом получения таких аминокислот весьма важно. Десять лет назад с этой целью использовали в основном биохимические методы, основанные на разделении рацемических смесей. [c.93]
Из изомасляного альдегида так же получают лейцин, а из индол- i-альдегида—триптофан и т. д. [c.485]
Гидролиз пептидов (и белков) приводит к освобождению аминокислот, участвовавших в их построении. Расщепление проводят, как правило, кипячением с соляной или серной кислотами. При этом все аминокислоты выделяются в виде солей, например хлоргидратов. Исключение составляет триптофан, который разрушается в ходе гидролиза, и поэтому для его определения требуются иные способы. Щелочи также гидролизуют пептиды (и белки), но этот процесс протекает менее гладко и приводит к значительной рацемизации аминокислот. Гидролиз полипептидов до аминокислот можно проводить и при помощи ферментов (трипсин, эрепсин). [c.383]
Трипсин 383, 398, 399, 910 Триптамин 1059, 1120, 1127 Триптофан 351, 352% 355, 356, 363, 383, [c.1205]
Нитроспирты, полученные из низкомолекулярных нитропарафннов, могут быть использованы также в качестве растворителей. Они проявляют, напрцмер, специфическую растворимость для клейковины, маисового проламина, которые содержат триптофан или цистин и лизин и имеют все более увеличивающееся применение в промышленности синтетического волокна [172]. Кроме того, нитроспирты могут служить мягкими окислителями и все чаще используются как сырье для производства эмульгирующих и флотационных средств и далее для производства высококипящих мягчительных средств (для отпуска стали при отжиге — прим. переводч.). Их свойства снижать термочувствительность каучуковых латексов будет также использовано в технике. [c.327]
В фенилаланине или триптофане. У эластазы карман специфичности довольно мелкий (рис. 21-19, в). Эластаза обладает меньшей избирательностью по сравнению с двумя другими ферментами, но благоприятствует разрыву пептидной связи, следующей за маленькими радикальными группами, как у аланина или валина. [c.323]
На основе -ЦПА получают и другие аминокислоты — триптофан, лизиц и орнитин. [c.264]
В животном организме введенные с пищей аминокислоты подвергаются различным реакциям расщепления под влиянием кишечных бактерг.й. Тирозин превращается в фенол и крезол, триптофан — в скатол (его присутствием обусловлен запах экскрементов) или индоксил, который обнаруживается в виде индоксилсерной кислоты в моче травоядных животных. В случае тирозина процесс распада [c.355]
Тироциднн В отлич
www.chem21.info
