биосинтез и функции аспарагиновой кислоты и аспарагина
Аспарагиновая кислота иначе аспартат вместе с большим братом глутаминовой кислотой (глутаминатом) относят к дикарбоновым аминокислотам, т.е. соединениям, имеющим два кислотных хвоста СООН. Важность этих соединений такова, что они вместе с амидами составляют половину всего аминного азота тканей, а в нервной системе они составляют 70% всех аминокислот.
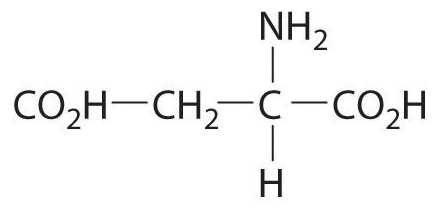
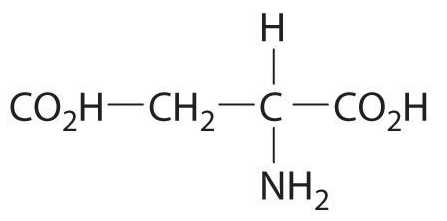
Аспарагиновая кислота (аспартат) имеет 2 оптических изомера, которые условно называются L-аспартат и D-аспартат. Природная протеиногенная аминокислота относится к L – изомерам, D- изомер встречается в организме человека в свободном виде, но выполняет свои специфические функции и в состав белка не входит. Далее речь пойдет об L-аспарагиновой кислоте и ее производном аспарагине.
Структурные формулы
 |  |  |
| L-аспарагиновая кислота | D- аспарагиновая кислота | аспарагин |
Благодаря наличию двух кислотных хвостов, ее относят к кислым аминокислотам. Кислотные хвосты придают аминокислоте гидрофильные свойства, т.е. она хорошо растворяется в воде. Это имеет значение, т.к. все ферментативные реакции идут в водной среде, а аспарагиновая кислота – весьма активный участник биохимического конвейера. Аспарагин представляет собой амид аспарагиновой кислоты, т.е. у второго кислотного хвоста атом водорода замещен на вторую аминную группу, получается, как бы вторая голова, притороченная к хвосту, в мире химических соединений этим никого не удивишь.
Аспарагиновая кислота входит в состав практически всех белков организма. Так как атомы водорода на кислотных хвостах очень подвижны, они обеспечивают водородные связи, которые формируют вторичную и третичную структуру белковых молекул, стабилизируя их в водной среде.
На наше счастье аспарагиновая кислота и аспарагин относятся к заменимым соединениям, т.е. организм сам синтезирует их на своей биохимической фабрике из соединений-предшественников, которые всегда имеются в достатке.
Аспарагиновая кислота и аспарагин относятся к глюкогенным соединениям, в процессе биосинтеза они превращаются в оксалацетат, который либо сгорает с образованием энергии, либо идет на синтез гликогена.
Функции аспарагиновой кислоты
- Структурная – входит в состав практически всех белков
- Участвует в синтезе пуриновых и пиримидиновых оснований – соединений, формирующих информационные матрицы ДНК и РНК
- Энергетическая: при распаде образуется оксалацетат, который либо сгорает с образованием энергии, либо идет на синтез глюкозы
- Непосредственно участвует в синтезе АТФ – вещества, несущего химическую энергию для работы биохимического конвейера.
- Является депо аминных групп
- Переносит аминные группы по организму
- Переносит ионы калия и магния
- Участвует в обезвреживании аммиака
- Является нейромедиатором
- Иммунная активность
Биосинтез аспарагиновой кислоты и аспарагина
Аспарагиновая кислота непрерывно образуется в организме. Еще бы, ведь она вместе с глутаминовой кислотой является этаким складом аминных групп. 11 заменимых аминокислот превращаются друг в друга в реакциях переаминирования. При поступлении в организм, ферменты трасферазы рубят аминные головы и насаживают их, нет, не на колья, а синтезируя глутамат и аспарагинат. Активным участником реакции переаминирования является пиридоксальфосфат или витамин В 6, он заставляет работать фермент трансферазу, принимая на себя аминную голову от глутамата и передавая ее оксалацетату, который превращается в аспарагиновую кислоту.
В таком виде аминные группы переносятся по кровяному руслу туда, где в них есть нужда, и на месте синтезируются те аминокислоты, которые необходимы вот прямо сейчас. Так происходит перераспределение азота в организме.
В первую очередь, при недостатке белка, утилизируются белки крови: транспортные и иммунные. Если их не хватает, мобилизуются белки печени, почек, селезенки и кишечника. Обычно это временная мера, и как только белки поступают с пищей, организм латает образовавшиеся дыры, но бывают экстремальные ситуации, например, белковое голодание. А еще экстремальные физические нагрузки, которые устраивают себе спортсмены – профи, в погоне за рекордами без адекватного питания. За счет перераспределения азота печень и почки могут серьезно пострадать, ибо их белки будут идти на строительство мышечной ткани.
Кроме того аспарагиновая кислота может образовываться из гомосерина — продукта превращения незаменимой кислоты треонина, а также при отщеплении аминной группы у аспарагина.
Аспарагиновая кислота является связующим звеном между обменом сахаров и белковым обменом: промежуточным продуктом обоих биохимических конвейеров является оксалацетат. Он может синтезироваться из глюкозы и при необходимости не сгорать в топке, а идти на синтез аспарагиновой кислоты, которая перенесет аминный азот туда, где в нем есть необходимость. С другой стороны избыток аспарагиновой кислоты, коль скоро он образовался, превратится в оксалацетат и далее пойдет то ли в топку, то ли на синтез глюкозы.
Аспартат является предшественником другой дикарбоновой аминокислоты – глутаминовой (глутамата). В организме постоянно происходит переброс аминных групп с аспартата на глутамат и наоборот. Переброс осуществляется через небезызвестный оксалацетат при участии фермента трансферазы и пиридоксальфосфата (витамина В).
Обезвреживание аммиака
При богатой белками пище аминокислот оказывается больше, чем их необходимо для синтеза белка. Избыток отправляется на плаху, каковая находится в печени. Ферменты рубят аминные головы, скелеты отправляются на переработку в цикл глюконеогенеза, а вот аминная голова начинает жить жизнью зомби, превращаясь в аммиак – клеточный яд. Та же страсть происходит и при интенсивной мышечной работе. Работа – это энергия, для энергии нужна глюкоза, чтобы получить глюкозу…. Ну вы поняли. Блуждающие аминокислотные головы в форме аммиака, которые опасны не менее сказочных упырей, необходимо обезвредить. Аспарагиновая кислота – один из участников этой героической саги.
Во-первых, она присоединяет аммиак к себе, благо аспартат имеется всегда в избытке. И превращается в аспарагин – транспортную форму переноса аммиака. Далее путь героя расходится на две тропки: первая – на известное лобное место в печени, вторая – в почки, где фермент аспарагиназа отрубает обе аминные головы, образовавшийся аммиак соединяется с неорганическими солями и выводится с мочой.
В печени происходит совсем другое магическое действо, где образующийся аммиак обезвреживается через каскад реакций, в одной из которых непосредственное участие принимает аспарагиновая кислота, заканчивается все это волшебство образованием неопасной мочевины, которая выводится через почки. Половина азота, освобождающего в процессах биохимических трансформаций аминокислот, не образует аммиака, а сразу улавливается аспарагиновой кислотой и вовлекается в синтез мочевины.
Аспарагиновая кислота вместе с глутаминовой кислотой связывают, транспортируют и утилизируют биологически активный азот. Фактически, через две эти аминокислоты проходит весь азот, задействованный в обмене веществ. Аспарагиновая кислота способствует поддержанию азотистого равновесия в организме.
Продолжение об аспарагиновой кислоте читайте здесь: http://zaryad-zhizni.ru/asparaginovaya-kislota-i-golovnoy-mozg/
zaryad-zhizni.ru
Аспарагин — это… Что такое Аспарагин?
| Аспарагин | |
| Общие | |
|---|---|
| Систематическое наименование | 2-амино-3-карбамоилпропановая кислота |
| Сокращения | Асн, Asn, N AAU,AAC |
| Традиционные названия | аспарагин |
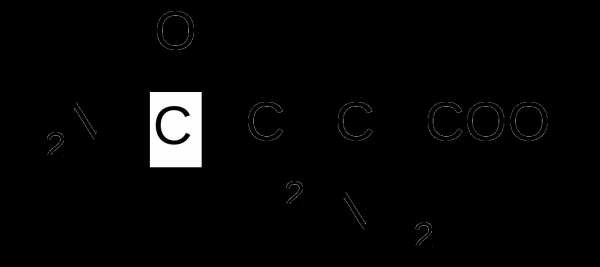
| Химическая формула | HOOC-CH(NH2)-CH2-CONH2 |
| Эмпирическая формула | C4H8N2O3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Примеси | L, D, LD |
| Отн. молек. масса | 132,12 а. е. м. |
| Термические свойства | |
| Температура плавления | 220 моногидрат, 233 L, 182 LD °C |
| Химические свойства | |
| pKa | 2,02 и 8,84 |
| Растворимость в воде | растворим в воде г/100 мл |
| Вращение [α]D | + 21° |
| Изоэлектрическая точка | 5,41 |
| Классификация | |
| Рег. номер CAS | [70-47-3] |
| SMILES | N[C@@H](CC(N)=O)C(O)=O |
Аспараги́н (принятые сокращения: Асн, Asn, N) — амид аспарагиновой кислоты (2-амино-бутанамид-4-овая кислота, Asx
или B). Одна из 20 наиболее распространённых аминокислот природного происхождения. Их кодоны AAU и AAC.История
Аспарагин был выделен из сока спаржи (англ. Asparagus) в 1806 году французским химиком Луи-Никола Вокленом и помощником Пьером Жаном Робике[1], став первой полученной человеком аминокислотой. В составе спаржи аспарагин содержится в больших количествах, соответственно он получил своё имя. Характерный запах мочи некоторых людей после употребления спаржи относят к различным метаболитам аспарагина.[2] Несколько лет позже, в 1809, Робике[1] снова обнаружил в корне лакрицы вещество похожее на аспарагин, затем Plisson в 1828 подтвердил это.
Бетаиновая структура
Аспарагин легко образует внутреннюю соль — бетаин.
(S)-Аспарагин (слева) и (R)-аспарагин (справа) в цвитерионной форме при нейтральном рН.Благодаря наличию хирального центра, существует два энантиомера (S), участвующих в построении белков, (R) и их смеси, вплоть до смеси с равным количеством — рацемат.
Так как в аспарагине боковые ответвления в виде карбоксамидной группы могут образовывать водородные связи с пептидной цепью, аспарагиновые остатки часто находят в начале и конце пептидной цепи(альфа-спираль), и в свою очередь для β-листы[3]. Его роль может быть обозначена как «закупорка» водородных связей взаимодействий, которые в другом случае могли связываться с основной полипептидной структуры. Глутамины, с дополнительной метиленовой группы, имеют большую конформационную энтропию и из-за этого они менее полезны в этом отношении. Аспарагин также обеспечивает ключевыми местами для N-связанного гликозилирования модификацию протеиновой цепи с добавлением цепи углеводородов.
Свойства
С XIX века известны обе формы аспарагина. L-аспарагин имеет сладкий вкус, D-напротив горький. При наличии в пище сахара при нагревании с аспарагином образуется акриламид — потенциальный канцероген.
Нахождение в природе
Аспарагин не является незаменимой аминокислотой, что означает способность синтезировать его основными метаболитическими путями в человеке, и не требуется в диете. Он находится в значительных количествах в:животных источниках: молоко, сыворотка, мясо, домашняя птица, яйца, рыба, морепродукты
растительных источниках: спаржа, помидор, бобовые, орехи, семена, соя, цельные зёрна.
В живых клетках присутствует в свободном виде и в составе белков. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Биосинтез
Прекурсором к аспарагину является оксалоацетат. Оксалоацетат конвертируется в аспартат, используя энзим трансаминазы. Энзимы переносят аминогруппу с глутамата на оксалоацетат, производя α-кетоглутарат и аспартат. Энзим аспарагин синтетаза производит аспарагин,АМФ, глутамат и питофосфат из аспартата, глутамина и АТФ. В аспарагин синтетазы реакции, АТФ используется для активации аспартата, образуя формил-β-аспартил-AMФ. Глутамин даёт аминогруппу, которая реагирует с β-аспартил-AMФ, образуя аспарагин и свободную АМФ.
Биосинтез аспраргина из оксалоацетата
Расщепление
Аспартат — это глюкогенная аминокислота. L-аспарагиназы гидролизует амидную группу, образуя аспартат и аммиак. Трансаминаза конвертирует аспартат в оксалоацетат, который может быть далее использован в цикле трикарбоновых кислот или глюконеогенезе.
Функция
Нервной системе для нормального функционирования требуется аспарагин. Он также играет важную роль в синтезе аммиака.
Примечания
Ссылки
dic.academic.ru
Аспарагин [LifeBio.wiki]
Фармакологическая группа: Аминокислоты
Аспарагин (сокращенно Asn или N), одна из 20 наиболее распространенных в природе аминокислот. В качестве функциональной группы боковой цепи аспарагин имеет карбоксамид. Это аминокислота не является незаменимой. Ее кодоны ААУ и AAC.
История
Впервые аспарагин в кристаллической форме был выделен в 1806 году французскими химиками Луи-Николя Вокленом и Пьером Жаном Робике (в то время выступавшего в качестве молодого помощника) из сока спаржи (asparagus), где вещество содержалось в изобилии — отсюда и название. Аспарагин был первой аминокислотой, которую удалось изолировать.
Несколько лет спустя, в 1809 году, Пьер Жан Робике снова выделяет, на сей раз из корня солодки, вещество со свойствами, которые он квалифицировал как очень близкие к свойствам аспарагина, однако в 1828 году Плиссон выяснил, что это вещество и было аспарагином.
Структурная функция аспарагина в белках
Поскольку боковая цепь аспарагина может образовывать водородную связь с пептидной цепью, аспарагин часто встречается в начале и конце альфа-спирали, и на витках бета-листов. Его можно рассматривать в качестве «блокатора» водородной связи, что в случае его отсутствия могло бы быть осуществлено при помощи полипептидного остова. Глутамины, имеющие дополнительную метиленовую группу, обладают большей конформационной энтропией и, следовательно, в этом отношении менее полезны.
Аспарагин также обеспечивает ключевые участки для N-связанного гликозилирования, изменения белковой цепи с добавлением углеводных цепей.
Пищевые источники аспарагина
Аспарагин не является незаменимой для человека аминокислотой, то есть он может быть синтезирован из центральных промежуточных продуктов метаболизма и не требуется в питании. Аспарагин может содержаться в:
Животные источники: молочные продукты, сыворотка, говядина, птица, яйца, рыба, лактальбумин, морепродукты
Растительные источники: спаржа, картофель, бобовые, орехи, семена сои, цельные зерна
Биосинтез аспарагина
Предшественником аспарагина является оксалоацетат. Оксалоацетат преобразуется в аспартат с использованием фермента трансаминазы. Фермент передает аминогруппу от глутамата к оксалоацетату, производя альфа-кетоглютарат и аспартат. Фермент синтетазы аспарагина производит аспарагин, аденозинмонофосфат (АМФ), глутамат и пирофосфат из аспартата, глутамина и АТФ. В реакции синтетазы аспарагина АТФ используется для активации аспартата, образуя бета-аспартил-AMP. Глютамин жертвует аммониевую группу, которая вступает в реакцию с бета-аспартил-AMP, формируя аспарагин и свободный АМФ.
Распад
Аспартат является глюко-аминокислотой. L-аспарагиназа гидролизирует амидную группу, образуя аспартат и аммоний. Трансаминаза преобразует аспартат в оксалоацетат, который затем может метаболизироваться в цикле лимонной кислоты или глюконеогенезе.
Функции аспарагина
Аспарагин необходим для функционирования нервной системы. Он также играет важную роль в синтезе аммиака.
Недавно было обнаружено, что эта аминокислота принимает участие в регуляции эндокринной системы, они регулирует высвобождение некоторых гормонов. Важным открытием в бодибилдинге явилось свойство D-аспарагиновой кислоты взаимодействовать с некоторыми участками гипоталамуса, что приводит к усилению секреции гонадотропин-рилизинг-гормона, который в свою очередь усиливает выработку гонадотропина. Последний же способствует увеличению продукции тестостерона . Кроме того, данная аминокислота усиливает секрецию пролактина и гормона роста. Также ученые обнаружили, что D-аспарагиновая кислота вовлечена в процесс высвобождения тестостерона и прогестерона яичками.
Доступность:
аспарагин.txt · Последние изменения: 2015/09/25 17:52 (внешнее изменение)
lifebio.wiki
АСПАРАГИН — Большая Медицинская Энциклопедия
АСПАРАГИН (β-амид аспарагиновой кислоты; β-аминосукцинамовая кислота) — природная аминокислота, играющая важную роль в азотистом обмене. Структурная формула: CONH2.

Плавится с разложением при t° 236°, удельное вращение плоскости поляризации света в воде при t° 25° составляет —7,4. Изоэлектрическая точка = 5,4. Аспарагин впервые получен Вокленом и Робике (L. N. Vauquelin, P. J. Robiquet) в 1806 году из сока спаржи. Аспарагин — первая аминокислота (см.), полученная из природного источника. Широко распространен в природе как в составе белков, так и в свободном состоянии. Аспарагин играет важную роль в азотистом обмене (см.). В организмах аспарагин синтезируется из аспарагиновой кислоты и аммиака при участии АТФ под действием фермента аспарагинсинтетазы (аспартат-аммиак-лигазы; К. Ф. 6. 3. 1. 1):

Аспарагин участвует в реакциях переаминирования (см.), перенося аминную группу на кетокислоты и превращаясь при этом в альфа-кетосукцинамовую кислоту (β-амид α-кетоянтарной кислоты), которая далее распадается до щавелевоуксусной кислоты и аммиака. Под действием фермента аспарагиназы (L-аспарагин-амидогидролаза; К.Ф.3.5.1.1) Аспарагин отщепляет аммиак и образует аспарагиновую кислоту, которая используется в ряде важнейших реакций обмена веществ.
Аспарагин синтезируется тканями животных и, таким образом, относится к заменимым аминокислотам; некоторые лимфоидные опухоли человека и животных неспособны синтезировать аспарагин и нуждаются в поступлении его извне. В связи с этим для лечения лейкозов стали применять аспарагиназу, которая, расщепляя аспарагин, нарушает синтез белков в опухоли.
См. также Амиды.
Библиография: Биохимия растений, под ред. Дж. Боннера и Дж. Варнера, пер. с англ., с. 209, 598 и др., М., 1968; Greenstein J. P. a. Winitz M. Chemistry of the amino acids, v. 3, p. 1856, N. Y.— L., 1961, bibliogr.
И. Б. Збарский.
xn--90aw5c.xn--c1avg
природная аминокислота, играющая важную роль в азотистом обмене
Аспарагин
-В-амид аспарагиновой кислоты; В-аминосукцинамовая кислота. Природная аминокислота,играющая важную роль в азотистом обмене. Структурная формула:
CONh3
½
Ch3
½
CHNh3
½
COOH
Плавится с разложением при t°=236°, удельное вращение плоскости поляризации света в воде при t°=25° составляет –7,4. Изоэлектрическая точка = 5,4. Аспарагин впервые получен Вокленом и Робике ( L. N. Vauquelin, P. J. Robiquet) в 1868г. из сока спаржи. Аспарагин- первая аминокислота, полученная из природного источника. Широко распространен в природе как в составе белков, так и в свободном состоянии. Аспарагин играет важную роль в азотистом обмене. В организмах Аспарагин синтезируется из аспарагиновой кислоты и аммиака при участии АТФ под действием фермента аспарагин-синтетазы (аспартат-аммиак-лигазы; К. Ф. 6.3.1.1.) :
COOH—CHNh3—Ch3—COOH+Nh4+АТФ®HOOC—CHNh3—Ch3—CONh3+АМФ+пирофосфат
Аспарагин участвует в реакциях переаминирования, перенося аминную группу на кетокислоты и превращаясь при этом в кетосукцинамовую кислоту (амид кетоянтарной кислоты) , которая далее распадается до щавелевоуксусной кислоты и аммиака. Под действием фермента аспарагиназы (L-аспарагин-аминогидролаза; К. Ф. 3.5.1.1) Аспарагин отщепляет аммиак и образует аспарагиновую кислоту, которая используется в ряде важнейших реакций обмена веществ.
Аспарагин синтезируется тканями животных и, т. о., относится к заменимым аминокислотам; некоторые лимфоидные опухоли человека и животных неспособны синтезировать Аспарагин и нуждаются в поступлении его извне. В связи с этим для лечения лейкозов стали применять аспарагиназу, которая, расщепляя Аспарагин, нарушает синтез белков и опухоли.
Аспарагиновая кислота
(аминоянтарная кислота, 1-аминоэтан-1,2-дикарбоновая кислота) – природная аминокислота; важнейшая составная часть белков. Структурная формула:
COOH
½
CHNh3
½
Ch3
½
COOH
L-аспарагиновая кислота вращает плоскость поляризации света вправо:
В воде и в 5н. HCL. Из всех природных аминокислот у Аспарагиновой кислоты наиболее выражены кислотные свойства, её изоэлектрическая точка лежит при pH = 2,8; соответственно, константы кислотной диссоциации — pK=1,88, pK2 = 3,65. Аспарагиновая кислота впервые была получена при кислотном гидролизе амида Аспарагиновой кислоты – аспарагина, а затем и из гидролизатов белков ( Риттгаузен, 1868) ; формула Аспарагиновой кислоты установлена Либихом в 1833 г. Аспарагиновая кислота наряду с другими аминокислотами является важнейшей составной частью белков. В составе белков, в свободном состоянии, а также в виде аспарагина и других производных широко распространена в органах и тканях различных организмов. Среди производных Аспарагиновой кислоты следует упомянуть N-ацетил-аспаргиновую кислоту, которая в заметных количествах содержится в тканях мозга, а также в других тканях. Аспарагиновая кислота может синтезироваться в организме человека и животных из других веществ и, т. о., относится к заменимым аминокислотам. Однако для некоторых микроорганизмов Аспарагиновая кислота является необходимым фактором роста и обязательно должна присутствовать в питательной среде. Являясь одним из промежуточных продуктов обмена азотистых веществ, Аспарагиновая кислота играет важнейшую роль в обмене веществ. Особенно большую роль наряду с глутаминовой кислотой она играет в реакциях переаминирования, перенося аминогруппы на кетокислоты, образуя ряд других аминокислот, превращаясь при этом в щавелевоуксусную кислоту и связывая, т. о., пути азотистого обмена с окислительными превращениями безазотистых соединений. В этих же реакциях Аспарагиновая кислота образуется из щавелевоуксусной кислоты после присоединения к ней аминогруппы, отдаваемой какой-либо из других аминокислот.
Образуя Аспарагин, Аспарагиновая кислота выполняет важную роль, связывая, обезвреживая и перенося аммиак в тканях животных и растений. При расщеплении аспарагина под действием фермента аспарагиназы выделяется аммиак и образуется Аспарагиновая кислота.
У бактерий Аспарагиновая кислота распадается на аммиак и фумарат или синтезируется из названных продуктов под действием фермента аспартазы.
CONh3 COOH COOH
½ ½ ½
Ch3 Ch3 CH
½ ¾¾¾® ½ ¾¾¾®½½
CHNh3 CHNh3 CH
½ ½ ½
COOH COOH COOH
Аспарагин Аспартат Фумарат
У микроорганизмов распространено также декарбоксилирование Аспарагиновой кислоты под действием декарбоксилаз Аспарагиновой кислоты.
Аспарагиновая кислота участвует в образовании в организме ряда биологически важных соединений. Так, Аспарагиновая кислота является источником 3-го (азотного) и 4, 5 и 6-го (углеродных) атомов пиримидинового кольца, которое образуется из Аспарагиновой кислоты и карбамилфосфата через стадиикарбамиласпарагиновой, дигидроортовой и ортовой кислот. При образовании пуриновых нуклеотидов Аспарагиновая кислота в присутствии ГТФ аминирует инозиновую кислоту, превращая её в адениловую кислоту (АМФ) с промежуточным образованием аденилянтарной кислоты. В цикле образования мочевины Аспарагиновая кислота аминирует цитруллин, образуя аргининянтарную кислоту, которая далее распадается на аргинин и фумаровую кислоту.
Аспарагин играет в организме чрезвычайно важную роль, он служит сырьем для производства аспарагиновой кислоты, которая участвует в работе иммунной системы и синтезе ДНК и РНК (основные носители генетической информации). Кроме того, аспарагиновая кислота способствует превращению углеводов в глюкозу и последующему запасанию гликогена. Аспарагиновая кислота служит донором аммиака в цикле мочевины, протекающем в печени. Повышенное потребление этого вещества в фазе восстановления нормализует содержание аммиака в организме. Аспарагиновая кислота и аспарагин могут встречаться во фруктовых соках и овощах: так, в яблочном соке ее около 1 г/л, в соках тропических фруктов – до 1,6 г/л. В справочной литературе приводятся суммарные значения для обеих аминокислот.
Хорошие источники аспарагина
и аспарагиновой кислоты:
– Картофель
– Кокос
– Люцерна
– Арахис
– Яйца
– Мясо .
vunivere.ru
АСПАРАГИНОВАЯ КИСЛОТА — Большая Медицинская Энциклопедия
АСПАРАГИНОВАЯ КИСЛОТА (α-аминоянтарная кислота, 1-аминоэтан-1,2-дикарбоновая кислота) — природная аминокислота; важнейшая составная часть белков. Структурная формула:

L-аспарагиновая кислота вращает плоскость поляризации света вправо: |а|25 D = + 6,7° в воде и +33,8° в 5н. HCl. Из всех природных аминокислот у аспарагиновой кислоты наиболее выражены кислотные свойства, ее Изоэлектрическая точка лежит при pH = 2,8; соответственно, константы кислотной диссоциации — рК=1,88, рК2 = = 3,65. Аспарагиновая кислота впервые была получена при кислотном гидролизе амида аспарагиновой кислоты — аспарагина (см.), а затем и из гидролизатов белков [Риттгаузен (H. Ritthausen), 1868]; формула аспарагиновой кислоты установлена Либихом (J. Liebig) в 1833 году аспарагиновая кислота наряду с другими аминокислотами является важнейшей составной частью белков. В составе белков, в свободном состоянии, а также в виде аспарагина и других производных широко распространена в органах и тканях различных организмов. Среди производных аспарагиновой кислоты следует упомянуть N-ацетил-аспарагиновая кислота, которая в заметных количествах содержится в тканях мозга, а также в других тканях. Аспарагиновая кислота, может синтезироваться в организме человека и животных из других веществ и, таким образом, относится к заменимым аминокислотам (см.). Однако для некоторых микроорганизмов аспарагиновая кислота является необходимым фактором роста и обязательно должна присутствовать в питательной среде. Являясь одним из промежуточных продуктов обмена азотистых веществ, аспарагиновая кислота играет важнейшую роль в обмене веществ. Особенно большую роль наряду с глутаминовой кислотой она играет в реакциях переаминирования (см.), перенося аминогруппы на кетокислоты, образуя ряд других аминокислот, превращаясь при этом в щавелевоуксусную кислоту и связывая, таким образом, пути азотистого обмена с окислительными превращениями безазотистых соединений (см. Азотистый обмен, Окисление биологическое). В этих же реакциях аспарагиновая кислота образуется из щавелевоуксусной кислоты после присоединения к ней аминогруппы, отдаваемой какой-либо из других аминокислот.
Образуя аспарагин, аспарагиновая кислота выполняет важную роль, связывая, обезвреживая и перенося аммиак в тканях животных и растений. При расщеплении аспарагина под действием фермента аспарагиназы (К.Ф.3.5.1.1) выделяется аммиак и образуется аспарагиновая кислота.
У бактерий аспарагиновая кислота распадается на аммиак и фумарат или синтезируется из названных продуктов под действием фермента аспартазы (L-аспартат-аммиак-лиазы; К .Ф.4.3.1.1).
У микроорганизмов распространено также декарбоксилирование аспарагиновой кислоты под действием декарбоксилаз аспарагиновой кислоты. (см. Декарбоксилирование).
Аспарагиновая кислота участвует в образовании в организме ряда биологически важных соединений. Так, аспарагиновая кислота является источником 3-го (азотного) и 4, 5 и 6-го (углеродных) атомов пиримидинового кольца, которое образуется из аспарагиновой кислоты и карбамилфосфата через стадии карбамиласпарагиновой, дигидрооротовой и оротовой кислот. При образовании пуриновых нуклеотидов аспарагиновая кислота в присутствии ГТФ аминирует инозиновую кислоту, превращая ее в адениловую кислоту (АМФ) с промежуточным образованием аденилянтарной кислоты. В цикле образования мочевины аспарагиновая кислота аминирует цитруллин, образуя аргининянтарную кислоту, которая далее распадается на аргинин и фумаровую кислоту.
Библиография: Браунштейн А. Е. Биохимия аминокислотного обмена, с. 173, М., 1949; Майстер А. Биохимия аминокислот, пер. с англ., М., 1961; G гееп-stein J. P. a. W i n i t z M. Chemistry of the amino acids, v. 3, N.Y.—L., 1961; Meister A. Biochemistry of the amino acids, N. Y.— L., 1965.
И. Б. Збарский.
xn--90aw5c.xn--c1avg
Аспарагин формула — Справочник химика 21
Установлен ряд аминокислот по их комплексообразующей способности цистеин > гистидин > аспарагин > метионин > глицин, аланин, валин, фенилаланин. Определен состав твердых соединений, выделенных из золотосодержащих растворов гистидина и фенилаланина золото в них находится в состоянии окисления (I), состав соединений отвечает формулам с соотношением золота к аминокислоте 1 1. Методом ИК-спектроскопии установлены связь металла с карбоксильной и аминогруппами в соединении золота с фенилаланином и связь металла с аминогруппой и азотом имидазольного кольца в соединении с гистидином. [c.154]Согласно данным Фишера, из правовращаюш,его (не природного) аспарагина (IV) (при гидролизе он превращается в левовращающую аспарагиновую кислоту III) в результате перегруппировки Гофмана была получена та же самая левовращающая диаминопропионовая кислота (II), что и из (+)-серина. В соответствии с этим конфигурации аспарагина и аспарагиновой кислоты изображаются следующими проекционными формулами [c.246]
Содержание аспарагина рассчитывают по формуле Ас=[с — (а + Ь) 9,42, [c.12]
Пример расчета. В гидролизате определено 112,0 мг% азота, в исследуемом продукте 26,5 мг% азота N 13. Содержание азота в глютамине составляет 45,0 мг%. Подставляем полученные величины в формулу и определяем содержание- аспарагина в продукте [c.12]
Установлено, что важными составляющими белков являются двадцать три аминокислоты. Названия этих кислот приведены в табл. 14.1 там же указаны формулы характеристических групп К. Некоторые аминокислоты имеют дополнительную карбоксильную группу или дополнительную аминогруппу. Так, имеется двухосновная диаминокислота — цистин, очень близкая к простой аминокислоте цистеину. Четыре из указанных в таблице аминокислот содержат гетероциклические кольца (кольца, состоящие из атомов углерода и одного или нескольких атомов других элементов, в данном случае атомов азота). Две из приведенных аминокислот — аспарагин и глутамин — родственны двум другим — аспарагиновой и глутаминовой кислотам, от которых аспарагин и глутамин отличаются только тем, что имеют вместо дополнительной карбоксильной группы амидную группу [c.385]
В природе встречается свыше 70 аминокислот, но только 20 из них играют важную роль в живых системах. Названия этих кислот (и их сокращения, которые также часто используются) вместе со структурными формулами приведены в табл. 25-1. Все аминокислоты, за исключением пролина и окси-пролина (см. табл. 25-1), имеют структуру К— И(NИ2) 02И различия между аминокислотами определяются природой радикала. В некоторых случаях отличия между радикалами незначительны так, а-аминокислоты глутамин и аспарагин являются моноамидами соответственно глутаминовой и аспарагиновой кислот. [c.382]
За исключением триптофана и аминодикарбоновых кислот, названия аминокислот имеют окончания -ин, что подчеркивает их принадлежность к аминам. Аминоацильные остатки общей формулы NHj- HR- O- называют, добавляя к корню слова окончание -ил. Поскольку у аспарагиновой и глутаминовой кислот и их полуамидов одинаковые корневые слова, остатки глутамина и аспарагина называют обычно глутаминил и аспараги-нил , остатки же глутаминовой и аспарагиновой кислот получили названия глутамил и аспарагил . [c.11]
При необходимости описать строение более длинных молекул можно также воспользоваться однобуквенньпл кодом, в котором каждой аминокислоте присвоена одна заглавная буква латинского алфавита аланин — А, аспарагин — N, аспарагиновая кислота О, аргинин — Я, валин — V, гистидин — Н, глицин — О, глутамин О, глутаминовая кислота — Е, изолейцин — I, лейцин — Ь, лизин — К, метионин — М, пролин — Р, серии — 8, тирозин — V, треонин Т, триптофан — фенилаланин — Р, цистеин » С. С использованием этого кода вместо громоздкой структурной формулы, написанной в начале страницы, можно записать УЯМ. [c.54]
Какие структурные формулы имеют следующие аминокислоты и их производные а) а-аминомасляная, б) 7-аминомасля-ная, в) р-аминовалериановая, г) у-аминовалериановая, д) ос-амино-изовалериановая, е) р-аминоглутаровая, ж) у-аминокапроновая, з) р-окси-а-аминопропионовая, и) а-аминоадипиновая, к) а-амино-Р,7,б-триметилкапроновая,, л) а,6-диаминовалериановая, м) а-аминоизокапроновая (лейцин), н) моноамид а-аминоянтар-ной кислоты (аспарагин), о) этиловый эфир гликоколя, п) нитрил 7-аминомасляной кислоты, р) а,е-диаминокапроновая кислота (лизин). [c.221]
Рассматривая структурные формулы оптически активных веществ, неизменно убеждались в том, что в молекуле таких веществ обязательно имеется асимметрический атом. В качестве примеров известных в то время оптически активных веществ можно назвать винную, молочную, яблочную, сахарную, фенил-гликолевую кислоты, аспарагин, лейцин, глюкозу, а .1иловый спирт. Этот список можно было бы продолжить. Были известны, однако, и несколько случаев, когда оптическая активность приписывалась веществу, не имеющему асимметрического атома. Так, стирол СбНаСН =СНг некоторое время считали оптически активным. Однако вскоре Вант-Гофф показал, что в действительности [c.33]
Таким образом, аспарагин образуется в растениях из формальдегида и аммиака. В белке 72HJJ2N gS0 2 (формула Либеркюна) атомы углерода и азота находятся в отношении 4 1. Следовательно, то же самое отношение должно существовать в группах атомов, образующих при конденсации молекулу белка. Однако растения, питающиеся избытком аммиачных солей, накапливают в качестве азотистого резерва аспарагин, содержащий один лишний атом азота и не обладающий резко выраженной способностью конденсироваться. Чтобы отвести это возражение, Лев высказывает предположение, что из аммиака и формальдегида образуется сначала не аспарагин, а его гипотетический альдегид. Этот а.льдегид частично конденсируется в бело1л% частично соединяется с аммиаком, превращается путем окисления в аспарагин, который и накапливается в клетке в виде азотистого резерва. Соответственно, прежде чем участвовать в синтезе белка, аспарагин, существующий уже в растениях, должен превратиться путем восстановления в соответствующий альдегид. [c.200]
Имеются, однако, факты, противоречащие этим формулам. Так, при действии на ликомаразмин (64) гипобромита и последующем гидролизе не удается обнаружить аспарагиновой кислоты, тогда как эта кислота может быть легко найдена, если аналогичному воздействию подвергается соединение (65). Это наблюдение противоречит формуле (66), так как указывает на наличие в молекуле ликомаразмина остатка аспарагина, а не аспарагиновой кислоты. Формула (66) не согласуется также и со способностью ликомаразмина отщеплять при действии гипоиодита СШз. Изложенным фактам не противоречит формула (67), согласно которой ликомаразмин построен из остатков аспарагина, глицина и гипотетической а-замещенно11 а-аминокислоты — а-окси-а-аланина . Однако наличие последней кислоты в молекуле ликомаразмина еще нельзя считать убедительно доказанным. Что касается циклической формулы ( 68), то она была отвергнута в результате синтетических исследований, выявивших ее несостоятельность 2 . Таким образом, вопрос о строении ликомаразмина следует пока считать в значительной мере открытым. [c.70]
Расположение дисульфидных связей было установлено путем ферментативного гидролиза неокисленного инсулина.
www.chem21.info
