Круговорот Оксигена в природе. Биологическая роль кислорода » Народна Освіта
Понятие о круговороте химических элементов
Почти все элементы и вещества в природе совершают круговорот. Из курса природоведения вам уже знаком круговорот воды в природе: вода испаряется из океанов, образует облака, а потом, выпадая на землю в виде дождя, с водой рек снова попадает в Мировой океан.
Таким же образом могут совершать круговорот и атомы разных элементов. Только атомы, благодаря химическим процессам в живой и неживой природе, постепенно переходят из молекул одних веществ в другие. Впервые учение о круговороте элементов в природе разработал выдающийся украинский и российский ученый, первый президент Украинской академии наук В. И. Вернадский.
Выдающийся российский и украинский ученый, академик Петербургской академии наук, первый президент Украинской академии наук. Основная научная деятельность Вернадского связана с минералогией. Основатель геохимии, биогеохимии, радиогеологии. Автор учения о биосфере и ее эволюции, о влиянии человека на окружающую среду и о превращении современной биосферы в ноосферу — сферу разума. Первым отметил огромную роль живых организмов в круговороте, концентрации и рассеивании химических элементов. По его мнению, решающим фактором развития биосферы должна стать разумная деятельность человека.
Связывание атомов Оксигена в другие соединения
Кислород — одно из самых важных веществ на Земле, обеспечивающее возможность существования жизни. Почти все живые организмы используют кислород для дыхания, и только некоторые микроорганизмы могут без него обходиться.
Почему же кислород так необходим живым организмам? При окислении органических веществ выделяется большое количество энергии, которую организмы используют для своей жизнедеятельности. Один из основных процессов, происходящих в организме при участии кислорода,— дыхание можно схематично изобразить уравнением:
При дыхании животных и растений выделяется углекислый газ и вода, т. е. атомы Оксигена из молекул кислорода переходят в состав углекислого газа и воды.
Но не только живые организмы потребляют атмосферный кислород. Большое количество кислорода тратится при гниении и горении различных веществ, особенно во время лесных пожаров и извержений вулканов (рис. 109а).
За последние сто лет значительно возросли объемы потребления кислорода человечеством. Тепловые электростанции, автомобили, самолеты и другие виды транспорта расходуют огромное количество кислорода при сжигании топлива — бензина, керосина и мазута (рис. 1096).
Образование кислорода
При современных объемах потребления кислорода весь его запас в атмосфере очень быстро исчерпался бы, если бы не происходило его восстановление и пополнение. Главный поставщик кислорода на Земле — это растения. Они образуют и выделяют кислород в атмосферу в процессе фотосинтеза.
Фотосинтез происходит с использованием энергии солнечного света. Растения поглощают углекислый газ из атмосферы и воду из почвы, а из них синтезируют глюкозу и кислород. Фотосинтез, как и дыхание, является очень сложным процессом и состоит из огромного числа реакций. Схематически его суммарное уравнение можно записать таким образом:
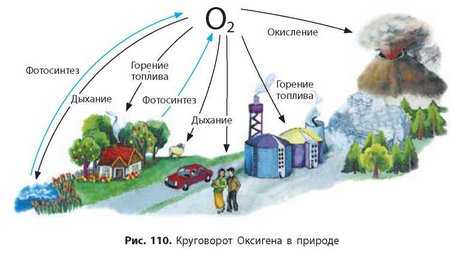
В процессе фотосинтеза атомы Оксигена из молекул углекислого газа и воды частично переходят в молекулы кислорода. Таким образом они совершают круговорот в природе (рис. 110). В этом круговороте также принимают участие атомы Карбона, Гидрогена и некоторых других элементов.
Круговорот атомов Оксигена сопровождается поглощением или выделением энергии. В результате фотосинтеза энергия Солнца переходит в энергию химических связей в молекуле глюкозы. Глюкоза, «сгорая» в живых организмах, высвобождает эту энергию для их жизнедеятельности. Это значит, что круговорот Оксигена в природе обеспечивает «транспортировку» энергии Солнца к живым организмам.
Итак, Оксиген вместе с Карбоном и Гидрогеном являются теми элементами, которые обеспечивают существование жизни на Земле.
Средний ав
narodna-osvita.com.ua
Кислород биологическая роль — Справочник химика 21
Роль кислорода в природе и его применение в технике. При участии кислорода совершается один из важнейших жизненных процессов—дыхание. Окисление кислородом углеводов, жиров и белков служит источником энергии живых организмов. В организме человека содержание кислорода составляет 61% от массы тела. В виде различных соединений он входит в состав всех органов, тканей, биологических жидкостей. Человек вдыхает в сутки 20—30 м воздуха. [c.199]Для поддержания жизни, как показано в настоящее время, существенное значение имеют около 20 элементов, хотя живая ткань часто содержит в следовых количествах все элементы, находящиеся в окружающей среде. Основные элементы живых систем — это водород, углерод, азот и кислород (2—60 ат. %). Установлено, что из всех элементов, присутствующих в следовых количествах (0,02—0,1 ат. %), фосфор, сера, хлор, натрий, калий, магний и кальций необходимы для поддержания процессов жизнедеятельности. Некоторые из элементов, присутствующих в сверхмалых количествах (менее 0,001 ат. %), также относятся к числу необходимых. Это марганец, железо и медь. Весьма вероятно, что ванадий, кобальт, молибден, бор и кремний также имеют общее биологическое значение, однако показать, что тот или иной элемент, присутствующий в сверхмалых количествах, биологически необходим, часто весьма трудно. В отдельных случаях биологическая роль элемента для растений и животных может быть установлена по тем последствиям, которые вызывает его отсутствие в почве. Так, отсутствие меди в почве некоторых районов Австралии вызвало нарушения в нервной системе овец и привело к заболеванию их анемией и к выпадению шерсти. Утверждалось также, что недостаток в почве бора приводит к аномалиям в развитии свеклы и сельдерея и к ухудшению качества
Все основные биохимические процессы, связанные с Ж1)зне-де.чтельностью любого организма, происходят в клетке. Ткани, выреза1 кые из организма, продолжают некоторое время дышать поглощать кислород и выделять углекислоту. Отсюда н возникло понятие о клеточном и тканевом дыхании. Биологическая роль дыхания заключается в извлечеыпн энергии за счет окисления и распада органических веществ, которая используется клетками для выполнения тех или иных видов физиологической работы (непрерывное обновление организма, рост и движение клеток и тканей, работа сердца, сокращение мышц, секреция желез и т. д.). Следовательно, химизм аэробного клеточного дыхания обусловлен биологическими окислительно-восстановительными процессами, протекающими в живых клетках организма. [c.354]
Окисление — восстановление — один из важнейших процессов природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд биологических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления — восстановления. Получение простых веществ, например железа, хрома, марганца, никеля, кобальта, вольфрама, меди, серебра, цинка, серы, хлора, иода и т. д., и ценных химических продуктов, например аммиака, щелочей, сернистого газа, азотной, серной и других кислот, основано на окислительно-восстановительных реакциях. Производство строительных материалов, пластических масс, удобрений, медикаментов и т. д. было бы невозможно без использования окислительно-восстановительных процессов. На процессах окисления — восстановления в аналитической химии основаны методы объемного анализа пер-манганатометрия, иодометрия, броматометрия и др., играющие важную роль при контролировании производственных процессов и выполнении научных исследований.
Железо играет исключительно важную биологическую роль, так как входит в состав гемоглобина и некоторых ферментов. Гемоглобин, связывая кислород, переносит его из легких к мышцам, где они передаются миоглобину, после чего, связывая СО2, переносит его в легкие. Нехватка железа в организме приводит к таким заболеваниям, как анемия и малокровие. [c.262]
При гликолизе высвобождается только небольшая часть всей энергии, заключенной в молекуле глюкозы. Общее изменение стандартной свободной энергии при полном окислении глюкозы до СО2 и HjO составляет — 686 ккал/моль (табл. 14-3). Следовательно, выход свободной энергии при гликолитическом расщеплении глюкозы на две молекулы лактата (AG° = — 47,0 ккал/моль) равен всего лишь (47/686)-100 = 6,9% того количества энергии, которое может высвободиться при полном окислении глюкозы до СО2 и Н2О. Большая часть биологически доступной энергии, заключенной в молекуле глюкозы, сохраняется в продуктах гликолиза-двух молекулах лактата. Она может высвободиться только в том случае, если продукты гликолиза подвергнутся полному окислению до СО2 и HjO молекулярным кислородом, играющим роль акцептора электронов (об этом мы будем подробно говорить в следующей главе). И тем не менее этот
Элементы неметаллического типа — углерод, азот, кислород — имеют фундаментальное значение для всего хода естественного развития химических систем, но роль таких типичных неметаллов, как галогены, также существенна. Наиболее резко выражен неметаллический характер у фтора и поэтому мы опишем его сравнительно подробно, хотя биологическая роль хлора и иода представляется более важной. [c.146]
Биологическая роль кислорода в значительной мере определяется его способностью прочно связывать электроны. В состав пищи разнообразных организмов входят вещества, в молекулах которых электроны находятся на более высоком энергетическом уровне, чем в кислороде. Поэтому переход электронов от пищевых веществ (углеводы, жиры и иногда у некоторых бактерий различные неорганические вещества — сероводород, метан, даже железо) к кислороду может доставить организму энергию, необходимую [c.187]
Кислород входит в состав ДНК. Его биологическая роль в значительной степени определяется способностью прочно связывать электроны. В состав пищи организмов входят вещества, в молекулах которых электроны находятся на более высоком энергетическом уровне, чем в кислороде. Поэтому переход электронов от пищевых веществ к кислороду доставляет организму энергию, необходимую для движения, химических синтезов и др. Кислород в виде О2 нетоксичен. Токсичен озон. При концентрации его в воздухе больше чем 1 10 он сильно раздражает слизистые оболочки и представляет опасность для жизни. [c.365]
Биологическая роль гемоглобина заключается в осуществлении процесса дыхания — переносе кислород а в животном организме от легких к тканям. Гемоглобин, в котором гем является активным центром, образует с кислородом нестойкое молекулярное соединение —
НО также и потому, что в гемопротеинах имеется необычайно тонкое равновесие между состояниями с максимальной и минимальной спиновой мультиплетностью. Можно предположить, что изменение спинового состояния железа определяется стереохимическими факторами. Изменение спинового состояния при переносе электрона между уровнями eg и t2g сопровождается изменением ионного радиуса катиона железа и изменением длин связей металл —
www.chem21.info
Какое значение для клетки представляют кислород
Какое значение для клетки представляют кислород
Каждая клетка содержит множество химических макроэлементов,участвующих в различных химических реакциях.Одних химических элементов в клетке больше, других — меньше.
К макроэлементам относят кислород (65-75 %), углерод (15-18 %), водород (8-10 %), азот (2,0-3,0 %), калий (0,15-0,4 %) и т.д.
Кислород — входит в состав практически всех органических веществ клетки. Образуется в ходе фотосинтеза при фотолизе воды. Для аэробных организмов служит окислителем в ходе клеточного дыхания, обеспечивая клетки энергией. В наибольших количествах в живых клетках содержится в составе воды.
Для наших клеток необходимо примерно семь процентов углекислоты и два-три процента — кислорода. Воздух, окружающий нас, содержит примерно три сотых процента углекислоты, в двести раз меньше необходимого, и двадцать процентов кислорода, что в десять раз превышает норму. Значит, окружающий воздух стал ядовитым для нас.
Еще 200 лет назад в воздухе было 38% кислорода и 1% углекислого газа, а сейчас из- за загрязнений среды и других факторов количество кислорода снизилось до 21%. Кроме того наши внутренние проблемы, стресс, гельминтоз, бактериальные, вирусные, грибковые инфекции, загрязнение прямой кишки, неправильные и вредные наклонности в еде, неправильная осанка, дыхание неполным объемом легких, приводят к прибавлению случаев кислородной недостаточности.
Кислород играет важнейшую роль в процессе обмена веществ, регулирует кровообращение, функции выделения, повышения иммунитета. Одновременно кислород оказывает успокаивающее воздействие на всю нервную систему, борется со стрессами.
Причиной кислородной недостаточности, как считает известный американский врач Пол Брейк, это поверхностное, неполное дыхание, которое не дает организму нужную энергию и приводит к раннему старению. Кроме того, наш организм приспособлен к существованию при наличии высокого процента кислорода.
Дыхательная техника «Аерофлекс» – это метод сочетания особых физических дыхательных упражнений, при помощи которых кислород избирательно окисляет излишки жировых, солевых и токсических отложений, разрушает и выводит их из организма. Одновременно подтягивается мышечный корсет, восстанавливаются соединительные и хрящевые ткани, возвращается жизненный тонус.
Дыхание и правильная работа мышц, легких, суставов, сознания. Эта методика разработана и многочисленными положительными результатами подтверждена физиологом и специалистом по дыхательной физкультуре А. Григоряном. Имеет как спортивный, так и оздоровительный эффект.
Данная программа показана при малоподвижном образе жизни, для людей разных возрастов и разными проблемами со здоровьем.
АЭРОФЛЕКС Центр физического совершенствования и дыхательной гимнастики
|
Адрес |
Армения, 0012, Ереван, Арабкир, Грачья Кочар ул., 21 дом (в здании поликлиники №11) |
|
| Телефон | +374 10 27 15 50 | |
| Адрес |
Армения, 0002, Ереван, Кентрон, Конд ул., 8 дом |
|
| Телефон | +374 10 52 13 63 | |
|
Веб-сайт |
http://www.aeroflex.am |
|
04.05.2014 5000 Показ Фотография. polismed.com
Администрация сайта med-practic.com не несет ответственности за содержание информации
www.med-practic.com
|
ТОП 10: |
Оксиген грає виключно важливу роль в природі. За участю оксигену здійснюється один з найважливіших життєвих процесів — дихання. Окислення оксигеном вуглеводів, жирів та білків служить джерелом енергії для живих організмів. Важливе значення має і інший процес, в якому бере участь оксиген, — тління і гниття загиблих тварин і рослин; при цьому складні органічні речовини перетворюються на простіші (зрештою в СО2, Н2О і N2), а останні знов вступають в загальний круговорот. Єдиним джерелом, що поповнює атмосферу оксигеном, є життєдіяльність зелених рослин (процес фотосинтезу). Тому серйозною екологічною проблемою є збереження рослинного світу нашої планети. Сполуки оксигену з гідрогеном Вода Вода — найпоширеніша на Землі речовина. Поверхня земної кулі на 3/4 покрита водою (океани, морить, озера, льодовики). У великих кількостях вода також знаходиться в атмосфері і земній корі. Наша планета буквально просочена водою і оповита водяною парою. Загальні запаси вільної води на Землі складають 1,4 млрд. км3. Майже стільки ж води знаходиться у фізично та хімічно зв’язаному стані, наприклад в природних кристалогідратах: глауберовій солі Nа2SО4 • 10Н2O, бокситах А12О3 • nН2O та ін. Проте запаси прісної води, придатної для пиття і побутових потреб вельми обмежені. Тому в даний час охорона водних ресурсів і очищення стічних вод стали найбільш актуальними екологічними проблемами, що стоять перед людством. Організми, тварин і рослин містять від 50 до 90 % води. У організмі людини вона складає близько 65 % від маси тіла. Реакції гідратації — це приєднання води до речовини. При гідратації кислотних оксидів утворюється кислота :
SO2 + h3O = H2SO4 ; P2O5 + 3H2O = 2H3PO4
При гідратації основних оксидів утворюються основи :
Na2O + H2O = 2NaOH ; BaO + H2O = Ba(OH) 2
Реакції гідролізу — це процес розкладання речовини в результаті обмінної взаємодії між молекулами речовини і молекулами води
Гідроліз солей ( розглядатись буде окремо). Гідроліз карбідів металів
CaC2 + H2O = Ca(OH)2 + C2H2↑ Карбід кальцію ацетилен
Перекис гідрогену. Н2О2 — є безбарвною рідиною. Дуже вибухонебезпечна. У продаж поступає рідше 30% розчин — перигидроль, частіше 3% розчин. Застосування Н2О2 в медицині . Розчин перекису гідрогену (2,7-3,3 % ) є фармакопейним препаратом, застосовується як бактерицидний і кровоспинний засіб. Бактерицидна дія пояснюється розкладанням Н2О2 в тканинах під дією ферменту каталази із звільненням молекулярного кисню, що окисляє різні органічні сполуки (зокрема, білки протоплазми мікроорганізмів), що приводить до загибелі мікроорганізмів. Кровоспинна дія Н2О2 пояснюється рясним утворенням бульбашок кисню, на поверхні яких прискорюється процес переходу фібріногена у фібрин. Що утворюється при розкладанні Н2О2 піна відносить з поверхні шкіри і з ранових порожнин частинки чужорідних тіл, згустки крові, гній, сприяючи механічному очищенню ран.
Сульфур та його сполуки. Відносна електронегативність сульфуру набагато нижче, ніж у оксигену, тому порівняно з ним окислювальна здатність сульфура значною мірою ослаблена. Проте, сульфур утворює стійкі сполуки з гідрогеном і металами, в яких знаходиться в ступені окислення -2. Але, на відміну від оксигену , сульфур існує в сполуках і в позитивному ступені окислення. До найбільш важливих сполук , що утворюються сульфуром, відносять : H2S (S-2) — сульфіди, S (S0) — вільна сірка SO2 (S+4) — сульфіти, SO3 (S+6) — сульфати . Сульфур — хімічно активний неметал. Відомі сполуки майже зі всіма елементами, окрім інертних. Найважливішою сполукою сульфуру є сірчана кислота Н2SO4, де сульфур знаходиться у найвищому ступені окислення +6. Найбільше значення мають середні солі Н2SO4 — сульфат кальцію СаSO4 (СаSO4 .2Н2О — гіпс) і зовсім нерозчинна сіль ВаSO4, яка виявляє сульфат — іони в розчинах ( це якісна реакція на сульфат- іони) : SO4-2 + Ва+2 = ВаSO4↓
Значення тіосульфат- іонів (S2O3-2 ) При нагріванні розчину Nа2SО3 з порошком сульфуру утворюється натрій тіосульфат: Nа2SО3 + S = Nа2S2О3 З розчину виділяється кристалогідрат — Nа2S2О3.5Н2О -натрій тіосульфат — сіль тіосірчаної кислоти Н2S2О3. Тіосірчана кислота дуже нестійка і розкладається на Н2О, SO2 і S. Натрій тіосульфат Nа2S2О3.5Н2О застосовують в медичній практиці як протитоксичний, протизапальний і дезінфікуючий засіб. Як протитоксичний засіб, натрій тіосульфат використовують при отруєннях сполуками ртуті, свинцю, синильною кислотою і її солями. Механізм дії препарату, очевидно, пов’язаний з окисленням тіосульфат-іона до сульфіт-іона і елементного сульфуру : S2О3-2 → SO3-2 + S0 Іони свинцю і ртуті, що потрапляють в організм з їжею або повітрям, утворюють погано розчинні нетоксичні сульфіти: Pb+2 + So3-2 → PbSO3↓ Цианід-іони взаємодіють з елементною сіркою, утворюючи менш отруйні тіоцианати: CN— + S0 → NCS— Застосовують натрій тіосульфат і для лікування корости. Після втирання в шкіру розчину Nа2S2О3 роблять повторні втирання 6 %-ного розчину НСl. В результаті реакції з НС1 натрій тіосульфат розпадається на сульфур і діоксид сульфуру:
Nа2S2О3 + 2НС1 = 2NaС1 + SО2 + S↓ + Н2О які і надають згубну дію на коростявих кліщів.
8.3 Інші біологічно важливі р-елементи (Селен. Іод, Бром, Флуор, Бор, Силіцій, Алюміній. Станум, Плюмбум, Арсен).
Біологічна роль елементів ІІІА групи та їх застосування в медицині Бор Вміст Бору в організмі людини становить 10-5% мас. Концентрується він головним чином у легенях (0,34 мг), щитовидній залозі (0,30 мг), селезінці (0,26 мг), печінці, мозку (0,22 мг), нирках, серцевому м’язі (0,21 мг). Біологічне значення Бору ще не з’ясовано. Встановлено, що Бор бере участь у вуглеводно-фосфорному обміні, взаємодіє з рядом біологічно активних сполук, наприклад вуглеводами, ферментами, вітамінами, гормонами. Вживання харчових продуктів з великим вмістом Бору порушує в організмі обмін вуглеводів і білків, призводить до розвитку ендемічних ентеритів. Сполуки, що містять Бор, мають антисептичну і протизапальну дію. При прийомі усередину проявляють протиепілептичну дію. Із сполук Бору, застосовуваних у медицині, слід виділити борну кислоту. Це фармакопейний препарат із слабкими дезінфікуючими властивостями, тому у вигляді розчинів, очних і вушних крапель, присипок, мазей і т.д. застосовується в офтальмології, отоларингології і дерматології. У комплексі з йодидом Калію, сульфатом Купруму і вітамінотерапією борну кислоту застосовують для лікування гіпотрофій. Крім того, борна кислота в якості наповнювача входить до складу формоліта, що застосовується в зубопротезній справі при відливі сталевих зубів. Борат Натрію з гідроксидом Алюмінію входять до складу стоматологічних паст, застосовуваних як клей-прошарок для зубних протезів. Тетраборат Натрію (бура) (фармакопейний препарат) — антисептичний засіб, застосовується зовнішньо як протимікробний і протизапальний засіб для спринцювань, полоскань, примочок. Алюміній Алюміній відноситься до незамінних для живого організму мікроелементів. Загальний його вміст в організмі людини становить 10-5 % мас., і в основному концентрується в сироватці крові, легенях, печінці, кістках, нирках, він входить також у структуру оболонок нервових клітин головного мозку людини. Добова потреба організму в Алюмінію 49 мг. Його біологічна роль вивчена мало. В організмі алюміній відіграє опорну роль, він бере участь у побудові епітеліальної і сполучної тканин, що складають близько 50 % маси всього тіла, у процесах регенерації кісткової тканини, в обміні Фосфору. Сульфат Алюмінію в дозах 0,001-0,1 мг підвищує активність панкреатичної амілази, а в більш високих концентраціях (від 1 до 20 мг) —цілком її дезактивує. Іони Алюмінію А1+3 і препарати Алюмінію мають в’яжучу, протизапальну, кровоспинну і протимікробну дію. Алюмінієва фольга застосовується в медицині для лікування і захисту опікових і виразкових поверхонь, оскільки Алюміній сприяє також нормалізації окисно-відновних процесів. Гідроксид Алюмінію — фармакопейний препарат, застосовується зовнішньо у виді присипок, паст, мазей як адсорбуючий і обволікаючий засіб у дерматології. Усередину призначається як препарат, що зменшує кислотність у шлунку (антиацидний препарат). Гідроксид Алюмінію входить до складу пломбуючих рідин, що застосовуються у стоматології. Сульфат калію-алюмінію (галуни) КА1(3О4)2.12Н2О застосовується у вигляді водних розчинів як в’яжучий, протизапальний і кровоспинний засіб (у дерматології, стоматології, офтальмології і т.д.), а кровоспинні олівці (галунів — 20 %, сульфату Алюмінію — 78 %, оксиду Кальцію — 2 %) — як в’яжучий і кровоспинний засіб при дрібних порізах, саднах. Сульфат Алюмінію (разом з ацетоном) використовують для виділення ферментів, тому що він не денатурує білкові речовини. Оксид Алюмінію є складовою частиною цементу для фіксації постійних протезів, а також силікатного цементу, що застосовуються в стоматологічній практиці для пломбування зубів і фіксації одиноких коронок, мостів, протезів, що не знімаються, тощо. Алюмосилікати (К2О.А12О3.6SіО2) входять до складу силікатного цементу, що застосовується як пломбуючий матеріал. Каолін (А12О3 .2SіО2 .2Н2О, або Н4А12Si2О9) також широко застосовується в стоматологічній практиці, в зубопротезній справі. Токсична дія Оксид Бору та борна кислота відносяться до сильнодіючих токсинів. Вони легко проникають крізь плаценту і мають ембріотоксичну дію. Токсичність Алюмінію проявляється у його впливі на обмін речовин, Функцію нервової системи, у здатності діяти безпосередньо на розмноження та ріст. Велика комплексоутворююча здатність Алюмінію веде до зниження активності ряду ферментів. Алюміній проявляє конкуруючу дію з Кальцієм і Фосфором, що веде до зменшення їх вмісту в організмі. Доведено також конкуруючу дію Алюмінію та Феруму. Високий вміст Алюмінію в організмі призводить до виникнення психічних розладів.
Біологічна роль елементів ІVА групи та їх застосування в медицині Силіцій Вміст Силіцію в організмі людини становить 10—3 % мас. Більше всього силіцію знаходиться в печінці, наднирниках, волоссі, кришталику ока. В організм людини попадає не тільки через травний канал, але й через легені у вигляді оксиду Силіцію (IV). Силіцій і його сполуки впливають на формування і нормальне функціонування епітеліальних і сполучних тканин, надаючи їм міцність, еластичність і непроникність. Сполуки Силіцію перешкоджають проникненню ліпідів у плазму крові і відкладанню їх на стінках судин. З порушенням обміну Силіцію зв’язують виникнення багатьох патологічних процесів в організмі (гіпертонія, ревматизм, виразка шлунка, гепатит, недокрів’я, деякі захворювання шкіри, кісток і т.д.). Вміст Силіцію в плазмі крові при інфекційному гепатиті збільшується, що може служити діагностичним тестом. Силіцій і його сполуки знаходять застосування в медичній практиці. У кількості 2,5 % кремній входить до складу нержавіючої хромонікелевої сталі, що застосовується в ортопедичній практиці. Карбід Силіцію (зелений або чорний) застосовується в стоматології для шліфування пломб і пластмасових протезів. Оксид Силіцію (IV) входить у склад силаура (пакувальна маса), що використовується в ортопедичній практиці для виготовлення форм при відливці дрібних золотих зуболікарських виробів: вкладок, зубів, дужок і т.д. Крім того, оксид Силіцію є складовою частиною багатьох цементів, які застосовуються в стоматологічній практиці для пломбування зубів під коронки, для фіксації одиночних коронок, мостів, постійних протезів і т.д. Германій, Станум, Плюмбум Загальний вміст цих елементів в організмі людини становить відповідно 10—6, 10—4 і 10—6% мас. Біологічна роль цих елементів не вивчена. Плюмбум і його сполуки дуже отруйні і викликають хронічні отруєння. Станум в кількості 28 % входить до складу порошку (сплав, у який входять Аргентум, Купрум і Станум), що застосовується в стоматології для одержання «Амальгами срібної», тобто металевих пломб. Крім того, Станум входить до складу цементу і рідини (евтектичного сплаву Талій — Станум), що використовуються для одержання металевих пломб без Н§. Із сполук Плюмбуму з медицині знаходять застосування такі, як оксид Плюмбуму (II), ацетат Плюмбуму (II) (фармакопейні препарати), свинцева вода [2 %-ний розчин основного ацетату свинцю (СН3СОО)(ОН)Рb], пластир свинцевий простий, їх застосовують у дерматології для примочок і спринцювань як в’яжуючі, протизапальні і антимікробні засоби.
Токсична дія Оксид Силіцію (SіО2) проявляє загальнотоксичну дію, найбільш уражаючи дихальні шляхи та печінку, викликаючи силікоз. Токсичну дію проявляють також азбести, слюди та тальк, які викликають різні типи пневмонікозу. При гострих отруєннях GеО2 спостерігають некрози слизової оболонки трахеї, набряк легенів. GеСl4 викликає подразнення шкіри. Дія сполук Стануму викликає порушення в роботі шлунково-кишкового тракту. Інгаляційні попадання пилу стануму можуть викликати форму пневмонікоза — станноз. Сполуки Плюмбуму уражають центральну і периферичну нервову систему, кістковий мозок, кров, генетичний апарат клітини, порушують синтез білка, тобто мають загальнотоксичну дію. Дія всіх сполук Плюмбуму в основному схожа. Токсичність сполук Плюмбуму зростає з підвищенням їх розчинності. В основі дії, як правило, лежить блокування -SН-груп білків та ферментів.
Біологічна роль елементів VА групи та їх застосування в медицині Арсен Вміст Арсену в організмі людини становить 10-6 % мас. Він накопичується в печінці, нирках, селезінці, легенях, у волоссі і кістках. Арсен затримується на роки (що має значення для судової експертизи). Однак максимальна концентрація Арсену спостерігається в мозковій тканині і м’язах. Арсен відноситься до дуже важливих мікроелементів, що беруть активну участь у біохімічних процесах живого організму. Арсен впливає на процеси кровотворення, він концентрується в еритроцитах і бере участь у синтезі гемоглобіну. Протианемічний ефект Арсену, як вважають, визначається безпосереднім впливом його на кістковий мозок. Крім того, Арсен бере активну участь в окисно-відновних процесах, а також у процесах нуклеїнового обміну. Однак у великих дозах Арсен і його солі — найсильніші отрути. Встановлено пригнічуючу дію Арсену на активність біологічних каталізаторів — ферментів. У медицині знаходить застосування оксид Арсену Аs2О3 (миш’яковистий ангідрид), білий миш’як (фармакопейний препарат). При місцевому застосуванні білий миш’як некротизує патологічне змінені тканини (шкірні покриви, пульпу зуба), тому застосовується в дерматології, у стоматологічній практиці у вигляді паст. При введенні миш’яковистого ангідриду усередину він стимулює процеси кровотворення, підвищує анаболічні процеси, нормалізує функцію нервової системи і поліпшує трофічні процеси в шкірних покривах. Застосовується при анеміях, неврастенії, виснаженні. Арсенат Натрію кристалічний Nа3АsО3, динатрієва сіль миш’якової кислоти Nа2НАsОз і 1 %-ний розчин арсенату Натрію для ін’єкцій є фармакопейними препаратами. У малих дозах вони стимулюють еритропоетичну функцію кісткового мозку, підвищують анаболічні процеси, поліпшують трофіку шкіри, у великих кількостях пригнічують лейкопоез. Застосовуються при неврозах, анемії, виснаженні, у великих дозах — при лейкозі. Дія розчину арсеніту Калію (фармакопейний препарат) аналогічна дії розчину арсенату Натрію. Його призначають при лікуванні лейкозів. У біології і медицині використовуються також нукліди Арсену, наприклад радіоактивні нукліди 71Аs і 74Аs. Вони застосовуються при хворобах крові, а також з діагностичною метою для уточнення локалізації пухлини мозку. Арсен входить до складу багатьох органічних сполук, що є лікарськими препаратами, наприклад неосальварсана-914, що застосовується для лікування сифілісу і поворотного тифу. Токсична дія Аміак викликає подразнення очей та верхніх дихальних шляхів. Оксиди Нітрогену при контакті з вологою поверхнею легенів утворюють нітратну та нітритну кислоти, що може призвести до набряку легенів. При потраплянні у шлунок порушується кислотно-лужний баланс. При отруєннях оксидами Нітрогену в крові утворюються нітрати та нітрити, які викликають розширення судин і зниження артеріального тиску. Нітрити та N0, попадаючи у кров, блокують гемоглобін. Нітрат-іони проявляють потрійну токсичність: власна токсичність нітрат-іона, вторинна — пов’язана з утворенням нітрит-іона, і третинна — пов’язана з утворенням з нітритів нітрозосполук. Нітратна кислота, як окиснювач, при попаданні на шкіру викликає опіки. Білий фосфор сильний токсикант, червоний — малотоксичний за рахунок нерозчинності в біологічних рідинах. Сильною отрутою є фосфін, який діє переважно на нервову систему та обмін речовин. Хлориди Фосфору сильно подразнюють очі та дихальні шляхи (у 5-10 разів сильніше ніж НС1). Арсен викликає ряд розладів: порушення тканинного дихання та зниження енергетичних ресурсів клітини, загальний ацидоз, обезводнення організму, порушення транспортування кисню, він є канцерогеном. У давнину Арсен та його сполуки були найсильнішими отрутами.
Біологічна роль елементів VIА групи та їх застосування в медицині Селен Біологічна роль Селену ще остаточно не вивчена. Але відомо, що він бере активну участь у багатьох ланках біологічних процесів. Селен концентрується у тканинах і органах з високою функціональною активністю (печінці, нирках, серці, гіпофізі, кісткових м’язах). Значні кількості Селену знаходяться в сітківці ока (близько 7 мкг), у зв’язку з чим виникає питання про його роль в процесах сприйняття світла. Не виключено також присутність селену у білковій частині молекули родопсину. Доведено, що Селен накопичується в тих частинах ока, що активно беруть участь у зоровому акті, тобто в клітинах пігментного епітелію й у прилягаючих до них рецепторах, де селен перетворює світлову енергію в енергію електричного потенціалу сітківки ока. Від останнього залежить подальше зорове сприйняття дійсності. Селен впливає на функції статевих залоз, наприклад, він необхідний для нормального плину вагітності. Сполуки Селену отруйні і при прийомі усередину діють подібно Арсену. Однак мікродози препаратів Селену останнім часом набули більш широкого застосування в медицині, наприклад для попередження захворювань некротичного характеру, для лікування деяких захворювань очей, печінки, підшлункової залози, дистрофічних процесів у різних тканинах, а також для електрофорезу, особливо в стоматологічній практиці. Сульсенове мило (містить Сульфур і Селен) застосовується в дерматології для лікування шкірних захворювань.
Біологічна роль елементів VIIА групи та їх застосування в медицині Флуор Вміст Флуору в організмі людини становить 10—5 % мас. Він міститься у всіх органах і тканинах організму, але більше всього його у волоссі, кістках, зубах. Добова потреба організму у Флуорі 1-2 мг. Основна біологічна роль Флуору зв’язана з його участю в процесах утворення кісток, формування зубної емалі і дентину. Флуор використовується для профілактики карієсу зубів. Надлишок Флуору в організмі може викликати захворювання зубів — флюороз. Препарати Флуору (NаF, КF та ін.) застосовуються при лікуванні тиреотоксикозів, ендемічного зоба, а також у стоматологічній практиці. Крім того, Флуор і його сполуки входять до складу силікатних цементів. Хлор Вміст Хлору в організмі людини становить 10—2% мас. Він знаходиться переважно в позаклітинній рідині. Добова потреба організму в Хлорі 4-6 г. В організмі іони Хлору сприяють відкладенню глікогену в печінці, беруть участь в утворенні буферної системи крові, у регуляції осмотичного тиску і водно-сольового обміну. Хлор входить до складу багатьох ферментних систем, він активує амілазу, що секретується слинними залозами. Іон Хлору входить до складу хлоридної кислоти, що відіграє важливу роль у травленні. У шлунковому соку здорової людини утримується близько 0,5 % хлоридної кислоти. При різних захворюваннях шлунка вміст хлоридної кислоти в шлунковому соку відхиляється від норми. Тому визначення хлоридної кислоти в шлунковому соку має важливе діагностичне і клінічне значення. Атоми Хлору взаємодіють з аміногрупами амінокислот мікробних клітин і руйнують їхню структуру, викликаючи тим самим загибель мікроорганізмів. Ці властивості Хлору використовуються для дезінфекції, знезаражування води тощо. Хлор входить до складу багатьох органічних сполук, що мають наркотичні й анестезуючі властивості і широко застосовуються в медицині. Розбавлена хлоридна кислота (8,2-8,4 %) — фармакопейний препарат, необхідний для початкових стадій травлення. Крім того, хлоридна кислота стимулює виділення секретів підшлункової залози і печінки, сприяє всмоктуванню Феруму із стравоходу, має протимікробну дію. Призначається при анацидному й гіпоцидному гастритах, диспепсії. У медицині знаходять широке застосування солі хлорвмісних кислот (NаСІ, КС1, NаСlO, СаОС12 та ін.). Хлорид Натрію використовують для приготування фізіологічного розчину та лікування катаральних хвороб слизових оболонок, гіпохлорит Натрію NaClO (0,5 %-ний розчин) — для зрошення ран. Велике значення мають хлорорганічні сполуки, які застосовують як розчинники та ліки. Бром Загальний вміст Брому в організмі людини становить 10-4 % мас. Він знаходиться у всіх органах і тканинах. За допомогою мічених атомів встановлено, що більше всього Брому в мозковому шарі нирок, щитовидній залозі, гіпофізі, крові і сечі. Добова потреба організму в бромі (0,8 мг). Бром підсилює процеси гальмування центральної нервової системи, в цьому полягає його найважливіша цілюща дія на нервову систему. Препарати Брому (солі Натрію, Калію, амонію) у малих дозах концентрують і підсилюють процеси гальмування в корі головного мозку. При підвищеній збудливості центральної нервової системи вони можуть відновлювати рівновагу між процесами збудження і гальмування. У великих дозах броміди пригнічують процеси збудження в центральній нервовій системі, включаючи спинний мозок, але майже не впливають на центр довгастого мозку. Бром бере участь у біосинтезі статевих гормонів (тестостерону) і регулює функцію статевих залоз. Багато сполук Брому (солі Натрію, Калію, амонію й ін.) є фармакопейними препаратами і призначаються при розладах вищої нервової діяльності, у тому числі епілепсії, неврастенії, істерії, нервовому безсонні, білій гарячці, розумовій перевтомі, а також при гіпертонії, виразковій хворобі і т.д. Радіоактивний нуклід Брому 82Вr знаходить застосування в експериментальних і клінічних дослідженнях. Йод Йод — відомий антисептичний і кровоспинний засіб. Крім того, він входить до складу багатьох фармацевтичних препаратів. Йод відноситься до групи життєво необхідних мікроелементів і постійно знаходиться в організмі людини у кількості 10-4 % мас., або 20-25 мг. З них 15 мг утримується в щитовидній залозі, інші — у м’язах, шкірі, кістках, печінці, нирках, головному мозку, крові тощо. Постійна концентрація Йоду в крові людини (10-6 — 10-5 %) є «йодним дзеркалом» крові. Йод надходить в організм із їжею і водою. Добова потреба організму в йоді 0,2 мг. Основна біологічна роль Йоду полягає в тому, що він бере участь у синтезі гормону щитовидної залози — тироксину і є його незамінним структурним компонентом. При недостачі Йоду в організмі порушується діяльність щитовидної залози, розвивається захворювання — ендемічний зоб. Йод бере участь у водно-солевому обміні, впливаючи на концентрацію в організмі іонів Натрію і Калію. Йод і його сполуки у визначених концентраціях впливають на фагоцитарну активність лейкоцитів, знижують шкірну проникність, тобто Йод позитивно впливає на імуногенез. Йод і його сполуки підвищують активність деяких статевих гормонів. Бром і Йод виділяються з організму головним чином із сечею, тому кількісне визначення їх у сечі і крові має діагностичне і клінічне значення. Спиртовий розчин йоду (5 і 10%-ний), або йодна настойка, є фармакопейним препаратом, має місцеву антисептичну, дратівну, відволікальну і протизапальну дії. Використовується в хірургії для обробки рук хірурга, ран операційного поля, при фурункульозі; усередину — при гіпо- і гіпертиреозі, ендемічному зобі, атеросклерозі, бронхіті, бронхіальній астмі, ревматизмі, а також при отруєнні Меркурієм, Плюмбумом і т.д. Мікройод (йоду -0,0005 г, йодиду Калію — 0,005 г, кореня валеріани — 0,05 г) є заспокійливим засобом. Сполуки Йоду застосовуються також для електрофорезу при лікуванні гіпертонічної хвороби. Йод затримує проходження рентгенівських променів, тому його препарати в якості рентгеноконтрастних засобів широко використовуються для рентгенологічних досліджень нирок, сечовивідних шляхів, кровоносних судин і серця, жовчного міхура і печінки і т.д. Радіоактивний нуклід Йоду 131І у вигляді йодиду Натрію служить для дослідження стану щитовидної залози і для лікування при тіреотоксикозі, радіоактивний Йод — при лікуванні раку щитовидної залози. Останнім часом радіоактивний Йод 125І застосовується для ранньої діагностики вагітності. Метод дуже простий, витрати часу мінімальні — всього одна година: вагітність діагностується на шостий день після її настання. Токсична дія Іон Флуору F— паралізує ряд ферментів, пригнічує процеси обміну вуглеводів, жирів, а також дихання тканин і гальмує діяльність щитовидної залози, викликає хворобу флюороз. НF викликає опіки слизистих оболонок та шкіри, а також деструкцію слизистих оболонок бронхів та легенів. Хлор виявляє подразнюючу та припікальну дії. За рахунок доброї розчинності у воді, насамперед уражає слизову оболонку верхніх дихальних шляхів та бронхів. Гідрогенхлорид за рахунок повної дисоціації у воді виділяє протон, який має каталітичні властивості і реагує з органічними молекулами. Цим пояснюється некроз клітин, який викликає гідроген-хлорид. Хлорвмісні кислоти викликають опіки. Бром відносять до подразнюючих речовин, що мають сильну припікальну дію. Бром та його сполуки можуть порушувати структуру подвійної спіралі ДНК і викликати її денатурацію. Антагонізм Брому та Йоду у їх впливі на щитовидну залозу проявляється лише при високих концентраціях першого. Пари йоду мають сильну подразнюючу дію. Надлишок Йоду в організмі порушує обмін інших мінеральних речовин. Йод, як і Бром, може порушувати структуру подвійної спіралі ДНК і викликати її денатурацію. Гідрогенйодид діє на організм майже як і гідрогенхлорид, а йодиди пригнічують синтез білка.
|
infopedia.su
28. Альтернативные пути биологического окисления, оксигеназный путь. Микросомальные монооксигеназы.
В организме возможен и ОКСИГЕНАЗНЫЙ путь биологического окисления. Он не снабжает клетку энергией. Ферменты этого пути включают кислород и субстрат.
Стадии ОКСИГЕНАЗНОГО ПУТИ:
1.Связывание кислорода с активным центром фермента.
2.Восстановление кислорода и перенос его на субстрат.
Выделяют 2 типа ОКСИГЕНАЗ:
1.ДИОКСИГЕНАЗЫ — ферменты, включающие в субстрат молекулу кислорода. А + О2 = АО2
В живых тканях этот процесс практически не встречается.
2.МОНООКСИГЕНАЗЫ — они катализируют включение в субстрат 1 атома кислорода, др. атом кислорода восстанавливается до воды. Для реакций катализируемых МОНООКСИГЕНАЗАМИ необходим КОСУБСТРАТ — донор электронов.
А-Н + О2 + Zh3 А-ОН + Z + Н2О, где А-Н – субстрат, Zh3 – КОСУБСТРАТ, А-ОН — окисленный субстрат.
В организме есть несколько видов МОНООКСИГЕНАЗ и прежде всего МИКРОСОМАЛЬНЫЕ МОНООКСИГЕНАЗЫ, содержащие ЦИТОХРОМ Р-450.Т.к. образуется -ОН группа, то это реакции ГИДРОКСИЛИРОВАНИЯ. МИКРОСОМАЛЬНАЯ система участвует в деградации многих умеренно токсических соединений, лекарственных веществ. Восстановленным КОСУБСТРАТОМ в этих реакциях является НАДФ*Н2. Этот путь окисления иногда называют ГИДРОКСИЛАЗНЫМ ЦИКЛОМ.
29. Свободнорадикальное окисление. Токсичность кислорода. Активные формы кислорода. Антиокислительная защита. Роль сро в патологии.
Свободные радикалы — это молекулярные частицы, у которых на внешней оболочке имеется неспаренный электрон. Они могут образовываться: при окислении (отрывании атома водорода) при восстановлении О2 + е О2—
Атомарный кислород имеет на внешнем электронном уровне 2 неспареных электрона. Он не слишком активный, но может образовывать высоко активные формы. О2+4е + 4Н 2Н2О
О2 + е = 02— — СУПЕРОКСИДНЫЙ АНИОН
2-02 + 2е = 022- — ПЕРОКСИДНЫЙ АНИОН
НО, — ГИДРОКСИЛ РАДИКАЛ
Н2О2, О2—, О22-, ОН, — активные формы кислорода (АФК). Они образуются в организме при различных физиологических и патологических процессах. Все свободные радикалы в организме классифицируют:
1. Первичные радикалы (О2, N,O). Они образуются в результате ферментативных реакций. Они являются физиологическими. Способствуют образованию вторичных радикалов.
2. Вторичные радикалы (ОН, ЛИПИДНЫЕ радикалы – L,, LO,, LOO,). Это патологические продукты.
3. Третичные радикалы (АНТИОКСИДАНТЫ) — образуются под влиянием вторичных радикалов.
СУПЕРОКСИДНЫЙ АНИОН легко присоединяет Н+, е. Он хорошо растворяется в жирах, легко взаимодействует с ЛИПИДАМИ мембран, и с ПОЛИНЕНАСЫЩЕННЫМИ ЖИРНЫМИ КИСЛОТАМИ, отнимая у них водород. Этот процесс называется ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ (ПОЛ). Это патологическое явление, приводящее к нарушению целостности мембран клеток. Поэтому в организме есть система, которая предотвращает ПОЛ — АНТИОКИСЛИТЕЛЬНАЯ СИСТЕМА (АОС), препятствующая образованию свободных радикалов.
Она включает:
1 .Фермент — СУПЕРОКСИДДИСМУТАЗА (СОД), ГЛУТАТИОНПЕРОКСИДАЗА.
2.Альфа- ТОКОФЕРРОЛ (вит. Е) — основной не ферментный АНТИОКСИДАНТ.
3.УБИХИНОН.
4.МОЧЕВАЯ К-ТА.
5.БИЛИРУБИН.
6.ГЛУТАТИОН.
7.КОМПЛЕКСОНЫ ЖЕЛЕЗА.
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация ПОЛ характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей, старении, ишемии.
studfiles.net
Роль углекислого газа в КЛЕТКАХ ВАШЕГО организма
Автор — доктор биологических наук, профессор А.В. Кузин
Учитывая важную роль участия углекислоты в развитии обменных нарушений, авторы считают необходимым подробно осветить биологическую роль углекислоты в живом организме, а также остановиться на свойстве живой материи фиксировать углекислый газ для обеспечения анаболических процессов.
Известно, что интенсивность процессов аэробного окисления, так же как и степень энергопродукции, непосредственно зависит от количества поглощенного клеткой кислорода. Значительно меньше известна биологическая роль углекислоты.
Еще в 1921 году А.Н. Лебедевым был обнаружен эффект ассимиляции углекислоты гетеротрофными организмами, а позднее доказана способность клеток, как простейших, так и высших животных, включая и человека, использовать углекислоту для синтеза углеводов, белков, жиров и нуклеиновых кислот, однако и сегодня господствует мнение, что углекислый газ является конечным и вредным продуктом обмена, подлежащим удалению из организма.
В результате многочисленных исследований было установлено, что CO2 является естественным регулятором дыхания, кровообращения, обмена веществ, электролитного баланса, кислотно-основного состояния, возбудимости нервных клеток, тонуса гладкой мускулатуры, бронхов, сосудов, мочевыводящих путей и т.д. Сообщается о стимулирующем влиянии бикарбонатов и CO2 на секрецию инсулина бета-клетками.
Биохимические процессы в организме происходят постоянно
Как уже отмечалось, в живой материи постоянно и одновременно проходит множество биохимических процессов, имеющих катаболическую или анаболическую направленность. Результатом катаболических реакций является потеря углерода путем распада углеродных связей и выделение этого элемента из организма в форме углекислого газа. Ведущим проявлением анаболических реакций, наоборот, являются процессы накопления и фиксации углерода. Процесс фиксации углекислоты у гетеротрофных организмов, включая животных и человека, непосредственно осуществляется с помощью реакций карбоксилирования, то есть присоединения к органическим веществам двуокиси углерода (CO2) с образованием карбоксильной группы. Карбоксилирование занимает одно из центральных мест в обмене веществ и круговороте углерода в биосфере. У различных микроорганизмов, а также в тканях животных и человека открыто более 20 реакций карбоксилирования. Характерно, что у зеленых растений с помощью тех же самых реакций осуществляются процессы фотосинтеза.
Важнейшая отличительная особенность процессов фиксации углекислоты между аутотрофами (в данном случае растениями) и гетеротрофами заключается лишь в механизмах генерирования макроэргических соединений (АТФ, НАД, НАДФ и т.д.). Если у аутотрофов основным источником генерирования этих макроэргов является фотолиз воды, то у гетеротрофов эти энергоемкие соединения образуются в процессе окисления органических субстратов (углеводов, жиров, белков).
Виды реакций карбоксилирования
Существует довольно большой спектр различных реакций карбоксилирования. У гетеротрофных организмов различают следующие реакции:
1) Реакции карбоксилирования, протекающие за счет энергии АТФ.
В эту группу входят карбоксилирование пропионил-КоА, пирувата, ацетил-КоА, бета-метил-кротонил-КоА, геранил-КоА, мочевины, образование карбамилфосфата. Простетической группой этих карбоксилаз является биотин. Благодаря реакциям карбоксилирования стимулируются процессы липогенеза, образования оксалоацетата, биосинтеза пиримидиновых оснований и мочевины.
2) Реакции карбоксилирования, протекающие за счет энергии окисления восстановленных форм пиридиннуклеотидов.
Сюда входит карбоксилирование альфа-кетоглутарата, пирувата, рибулезо-5-фосфата, серина, глутамата, ацетата.
3) Реакции карбоксилирования, протекающие без использования энергии извне:
5-аминоимидазолриботидкарбоксилазная (для синтеза мочевой кислоты, пуринов, гипоксантина), фосфоэнолпируваткарбоксилазная (образование оксалоацетата), фосфоэнолпируваткарбокситрансфосфорилазная (образование оксалоацетата и С-дикарбоновых кислот).
Уникальное значение углекислоты для организма
В последние годы выявлена прямая взаимосвязь между уровнем метаболизма и скоростью карбоксилирования в организме животных. Результаты экспериментальных исследований подтвердили положение А.И. Опарина о том, что фиксация углекислоты является процессом совершенно универсальным, а потому и очень древним, заложенным в самой основе организации обмена веществ у всех живых существ. «Уникальность физиологического значения углекислоты определяется тем, что она участвует в реакциях биосинтеза важнейших компонентов клетки: липидов, углеводов, белков, азотистых оснований нуклеотидов, а значит, и нуклеиновых кислот. Синтез таких аминокислот, как серии, цитруллин, глутаминовая, аспарагиновая кислоты, полностью зависит от интенсивности карбоксилирования. Учитывая, что четыре из девяти промежуточных членов трикарбонового цикла (оксалоацетат, малат, изоцитрат, сукцинат) образуются путем карбоксилирования соответствующих субстратов (пирувата, фосфоэнолпирувата, альфа-кетоглутарата и пропионил-КоА), становится вполне очевидным, что функционирование самого цикла также зависит от процессов карбоксилирования». Как заключает академик М.Ф.Гулый, «если жизнь без свободного кислорода возможна (факультативные и облигатные анаэробы), то без СО2 она абсолютно немыслима».
Скорость аккумуляции CO2 служит показателем анаболического потенциала в организме, в то время как скорость потребления кислорода свидетельствует об интенсивности катаболических окислительных процессов. Соотношение CO2 и O2, как в организме в целом, так и на различных уровнях его организации, характеризует доминирующую направленность метаболических процессов в сторону диссимиляции или ассимиляции.
Увеличение интенсивности процессов карбоксилирования сопровождается повышением синтеза органических соединений, а ослабление тканевой фиксации CO2 может явиться причиной угнетения пластического обмена у животных.
Как растет человек
Сказанное можно проиллюстрировать на примере онтогенеза человека. Известно, что новорожденные достаточно быстро растут, не требуя повышенного количества кислорода. Наблюдения над их продолжительным нырянием показали, что они значительное время могут обходиться без кислорода. Наоборот, лица пожилого возраста, у которых фиксация CO2, то есть анаболический показатель, значительно снижена, нуждаются в постоянном и достаточном кислородном обеспечении.
Можно заключить, что весь путь человека от рождения до смерти представляет собой процесс прогрессирующего снижения фиксации углекислого газа и увеличения зависимости от потребленного кислорода для компенсации сниженного резерва углекислоты.
Особенности возникновения жизни на Земле
Описанные закономерности имеют и филогенетическую обусловленность, связанную с особенностями возникновения жизни на Земле.
Согласно теории эволюции первичная атмосфера Земли сформировалась около четырех миллиардов лет назад, основную ее часть составлял углекислый газ и недоокисленные продукты углерода, в то время как чистый кислород в атмосфере практически отсутствовал. Жизнь первично возникла в бескислородной среде, а само живое вещество образовалось путем случайного структурного синтеза из длинных цепей и замкнутых колец, образованных атомами углерода. Избыток углекислоты и способность ее фиксации живыми организмами обеспечили эволюцию живой материи. Так, благодаря уникальным свойствам углерода, возник единственный на Земле углеводный тип жизни. В последующем свойство примитивных растений фиксировать углекислоту и при этом выделять кислород способствовало последовательному увеличению содержания последнего в атмосфере, что, в свою очередь, требовало от живых организмов определенной коррекции обмена веществ. Суть ее свелась к тому, что по мере уменьшения в атмосфере запасов углекислого газа и увеличения количества кислорода у гетеротрофных организмов сформировались механизмы не только активной фиксации углекислоты с помощью процессов фотосинтеза, но и направленной внутриклеточной ее продукции с последующей фиксацией благодаря реакциям карбоксилирования. Это благоприобретенное свойство поставило их в более выгодные по сравнению с растениями условия существования, в меньшей степени, зависящие от непосредственного влияния солнечной энергии, что существенно повысило адаптационные возможности примитивных организмов. Одновременно резко увеличился собственный, независимый от внешней среды вклад организма в процессы поддержания энергетического баланса. Выполнение этой задачи было обеспечено путем объединения в клетке процессов регенерации углекислоты с механизмами ресинтеза АТФ.
При этом можно говорить о реципрокных отношениях между интенсивностью фиксации углекислоты и ее резервами и скоростью потребления кислорода.
Роль СО2 в клетке
Ослабление продукции и клеточной фиксации CO2, а также уменьшение его резерва способствуют повышению в клетке потребности в кислороде и ускорению окислительных процессов с целью возобновления внутриклеточных запасов CO2. И наоборот, чем лучше развиты процессы фиксации углекислоты, тем меньше потребность в кислороде. В физиологических условиях, как отмечал П. Альбицкий, действие углекислоты сводится к снижению интенсивности окислительных процессов.
Активизация процессов окисления, которая происходит при повышенном выделении CO2 с выдыхаемым воздухом, и снижение его резерва в клетке в первую очередь обусловлены повышением содержания вне- и внутриклеточного содержания водородных ионов (Н+), являющихся непосредственными субстратами для энергопродукции, так как, повышая запрос на кислород, они ускорят процессы окислительного фосфорилирования. Образующаяся в процессе окисления углекислота, связывая ионы водорода, блокирует скорость окислительных реакций и соответственно утилизацию кислорода.
Из сказанного следует, что существование живых организмов, так же как и растений, обеспечивается благодаря механизмам поддержания резерва CO2 путем фиксации и регенерирования углекислоты в организме, что является универсальным условием существования живой материи. Интенсивность снижения резерва углекислоты является показателем напряжения компенсаторных окислительных процессов в организме, о скорости которых можно судить по количеству потребленного кислорода.
Продолжительность задержки дыхания при нырянии у разных видов животных
(по Гаданцеву В.П., 1977). Вид животных — время ныряния, мин:
Морская змея (Acalyptophis pcroni) До 150
Бутылконос (Hyperoodon ampullatus) 120
Кашалот (Physeter catodon) 75
Черепаха бахромчатая (Chelus firnbriata) 65
Блювал (Balaenoptera musculus) 50
Тюлень Уэдделла (Leptonychotes weddelli) До 45
Финвал (Balaenoptera physalus) 30
Тюлень обыкновенный (Phoca vitulina) 25
Ужи (Natrix erythogaster, N. fasciata, N. rhombifera) 25
Иловая змея (Faranacia abacura) 22
Пингвин императорский (Aptenodytes forsteri) 18
Афалина (Tursiops truncatus) 15
Бобр обыкновенный (Castor fiber) 15
Утка домашняя (Anas domestica) До 15
Ондатра (Ondatra zibethica) 12
Утконос (Ornithorhynchus anatinus) До 10
Нутрия (Myocastor coypus) 7
Пингвин субантарктический (Pygoscelis papua) 7
Калан (Enhydra lutris) До 4,5
Бегемот (Hippopotamus amhibius) До 3,5
Белый медведь (Ursus maritimus) До 2
Человек:
тренированный (ловцы жемчуга) 2-4
нетренированный до 1
Таким образом, для обеспечения жизнедеятельности организма, его роста и развития необходимо поддержание в нем следующих ведущих процессов, связанных с потреблением и предложением CO2: постоянной фиксации углекислоты с помощью реакций карбоксилирования, а также регенерации углекислого газа при непосредственном участии кислорода. Если первый механизм достаточно известен, то значение второго еще ждет своего осмысления. Формулой его является: потребление кислорода прямо пропорционально снижению резерва углекислого газа в клетках.
Основным источником углекислоты в организме является эндогенный углекислый газ. В физиологических условиях у взрослого человека за сутки при дыхании образуется в среднем 300-400 л углекислоты, которая выводится из организма легкими. Парциальное давление рCO2 в артериальной крови составляет 5,32 кПа (40 мм рт. ст.), а в тканях — 6,12 кПа (46 мм рт. ст.).
Логично предположить, что организм животных и человека для поддержания своей жизнедеятельности должен обладать значительными резервами углекислоты. Это было экспериментально подтверждено исследованиями N.Cherniak и G.Longobardo, которые, исследуя резервы O2 и CO2. У человека весом 70 кг установили, что, если суммарный в организме составляет около 2 литров, то резервы CO2 значительно превышают запасы кислорода, достигая 120 и более литров. Отсюда напрашивается вывод о том, что если резервы углекислого газа в 60 раз превышают резервы кислорода, то, следовательно, устаревшее представление о CO2 как о конечном продукте метаболизма, «шлаке», ускоренно выделяемом из организма, является глубоко ошибочным, поскольку не соответствует принципам биологической целесообразности живой материи.
Резервы O2 и CO2 в организме человека
|
Исследуемый объект |
Резервы O2, кол-во, л, форма |
Резервы CO2, кол-во, л, форма |
|
Легкие |
0.5 Физически растворенный газ |
0.2 Газ в остаточной емкости, бикарбонат в легочной ткани |
|
Кровь |
1.2 Физически растворенный газ, оксигемоглобин |
2.7 Физически растворенный газ, бикарбонат, карбаминогруппа |
|
Ткани |
0.3 Физически растворенный газ, оксигемоглобин |
120.0 Физически растворенный газ, бикарбонат, карбонат (в кости), карбаминогруппа |
|
Всего |
2.0 |
122.9 |
Примечание. Масса тела человека 70 кг.
Углекислота в организме присутствует в следующих формах: растворенный углекислый газ (CO2), угольная кислота, бикарбонаты, карбонаты, карбаматы (P-NH-COOH).
При различных физиологических или патофизиологических условиях возникает повышение проницаемости мембран (митохондрий, клеток), что в свою очередь приводит к ускорению выведения CO2 из клетки, снижению его тканевых запасов, уменьшению фиксации и повышению выделения углекислого газа с выдыхаемым воздухом. Поскольку CO2 является в организме основным субстратом для анаболических реакций, то, следовательно, снижение пула CO2 в клетке способствует активизации процессов метаболизма различных субстратов для регенерации CO2 и восполнения этого дефицита. Необходимым условием поддержания активности катаболических реакций является достаточное потребление кислорода, повышение которого, наблюдаемое при различных стрессовых состояниях, является следствием не «кислородного голода», а снижения внутриклеточного резерва CO2 и направлено в первую очередь на его возобновление.
Сказанное подтверждается положительным влиянием различных методов лечебного использования углекислоты на лечение многих системных заболеваний.
В нормальных условиях в покое отмечается превышение величины потребления кислорода над величиной выделения углекислого газа, что характеризует процессы накопления CO2 в организме. В условиях стресса при динамическом газовом анализе регистрируется увеличение выделения CO2 с выдыхаемым воздухом, соответствующее количеству потребленного кислорода, а также связанное с этим повышение основного обмена. При этом, как только во время проведения физической нагрузки уровень выделения СО2 начинает превышать уровень потребления кислорода, то есть когда активизация метаболических реакций под воздействием кислорода не компенсирует образование CO2 de novo, тогда и регистрируется отказ испытуемого от нагрузки.
Характерно, что снижение резерва CO2 в организме не только активизирует потребление кислорода, но и, блокируя окисление субстратов в цикле Кребса в результате дефицита CO2, способствует переходу на анаэробное, гликолитическое расщепление углеводов с образованием молочной кислоты и высвобождением дополнительного количества CO2 из бикарбонатного буфера. Как отмечает М.Ф.Гулый, «развивающаяся при сахарном диабете гипергликемия, ингибирование трикарбонового цикла и другие нарушения, являются, по крайней мере, отчасти, следствием не только дефицита инсулина, но и снижения уровня углекислоты в тканях, что обычно имеет место при этом заболевании».
Следовательно, существует тесная взаимосвязь между интенсивностью внутриклеточного окислительного фосфорилирования, количеством вновь образуемого углекислого газа и активностью синтетических процессов. Принимая во внимание концепцию структурной энергии Э. Бауэра, можно сделать заключение, что необходимость предварительного, структурного синтеза, как обязательного условия адекватной энергопродукции, реализуется в том, что в условиях ограниченного энергообразования снижение резерва углекислоты, как энергоемкого субстрата, еще больше закрепляет состояние внутриклеточного энергодефицита. Все это способствует ограничению энергозависимых синтетических процессов, снижению анаболического потенциала, нарушению жизненно важных функций клетки, что будет существенно отражаться на функциональной активности органов и систем и на состоянии организма в целом. При этом компенсаторные возможности организма, направленные, прежде всего, на сохранение его структурной целостности, определяются состоянием системы нейро-гормонально-гуморальной регуляции и непосредственно зависят от генетических и конституциональных особенностей метаболизма.
http://www.rebenok-zdorov.ru/clinic/scientific_articles/biologicheskaya_rol_uglekisloty_v_organizme.html
subscribe.ru
Энергетический обмен- расщепление органических веществ в цитоплазме без участия оксигена и в митохондриях с участием оксигена.Гликолиз
⇐ ПредыдущаяСтр 8 из 11Следующая ⇒
Энергетический обмен (катаболизм, диссимиляция) — совокупность реакций расщепления органических веществ, сопровождающихся выделением энергии. У аэробных организмов (живущих в кислородной среде) выделяют три этапа энергетического обмена: подготовительный, бескислородное окисление и кислородное окисление; у анаэробных организмов (живущих в бескислородной среде) и аэробных при недостатке кислорода — два этапа: подготовительный, бескислородное окисление.
Этот этап заключается в дальнейшем расщеплении органических веществ, образовавшихся во время подготовительного этапа, происходит в цитоплазме клетки и в присутствии кислорода не нуждается. Главным источником энергии в клетке является глюкоза. Процесс бескислородного неполного расщепления глюкозы — гликолиз.
Следует отметить, что биологическое окисление в клетках может происходить как с участием кислорода, так и без его участия, за счет переноса атомов водорода от одного вещества к другому, или за счет переноса электронов.
Гликолиз — сложный многоступенчатый процесс, включающий в себя десять реакций. Во время этого процесса происходит дегидрирование глюкозы, акцептором водорода служит кофермент НАД+ (никотинамидадениндинуклеотид). Глюкоза в результате цепочки ферментативных реакций превращается в две молекулы пировиноградной кислоты (ПВК), при этом суммарно образуются 2 молекулы АТФ и восстановленная форма переносчика водорода НАД·Н2
Дальнейшая судьба ПВК зависит от присутствия кислорода в клетке. Если кислорода нет, у дрожжей и растений происходит спиртовое брожение, при котором сначала происходит образование уксусного альдегида, а затем этилового спирта
29.Вирусы. Роль в природе и жизни человека. Профилактика ВИЧ и других вирусных заболеваний
Вирус— неклеточный инфекционный агент, который может воспроизводиться только внутри живых клеток
В одних случаях вследствие перенесенного заболевания или благодаря прививке организм приобретает стойкий иммунитет к определенному виду вируса (оспа, корь, энтерит, и чумка собак и т.п.), а в других — возможно повторное заболевание (грипп).
Вирусы в природе регулируют численность своих хозяев. Считают, что вирусы играют определенную роль в эволюции прокариот, поскольку могут передавать наследственную информацию от одной бактериальной клетки к другой, как внутри одного вида, так и между разными видами, встраиваясь в ДНК клетки-хозяина.
В жизни человека вирусы играют преимущественно негативную роль. Они вызывают много различных заболеваний человека, домашних животных и культурных растений. У человека вирусы поражают органы дыхания , пищеварения, нервную систему, кожу и слизистые оболочки, клетки различных систем органов, подавляют иммунные реакции (СПИД), приводят к некоторым видам раковых заболеваний. В домашних животных они вызывают ящур парнокопытных, энтерит и чумка собак, чума кур и другие заболевания, некоторые из них опасны и для человека.
Вирусы являются возбудителями опасных заболеваний культурных растений — мозаичность, пятнистость, отмирание органов, опухоли.
ВИЧ — вирус иммунодефицита человека, вызывающий заболевание — ВИЧ-инфекцию, последняя стадия которой известна как синдром приобретённого иммунодефицита (СПИД) — в отличие от врождённого иммунодефицита.
Одной из самых эффективных профилактических мер ВИЧ-инфекции является безопасный секс.
Еще одной мерой профилактики ВИЧ-инфекции является отказ от наркотиков, так как заражение данным заболеванием очень часто происходит при введении иголок от шприцов.
Не стоит забывать и о том, что ВИЧ-инфекцию можно подцепить и в различных медицинских учреждениях.
30. Бактерии. Роль в природе и жизни человека. Профилактика бактериальных заболеваний
Бактерии— домен (надцарство) прокариотных (безъядерных) микроорганизмов, чаще всего одноклеточных.
Роль бактерий в природе:
1) Бактерии гниения и брожения являются санитарами природы, разрушают в качестве редуцентов, мертвую органику до минеральных веществ участвуют в круговороте веществ.
2) Паразиты регулируют численность своих хозяев.
3) Участвуют в процессе почвообразования.
4) Серо- и железобактерии в ходе эволюции образовали залежи серных и железных руд.
В жизни человека:
1) Болезнетворные бактерии вызывают различные заболевания человека.
2) Применяются в производстве молочно-кислых продуктов, в квашении овощей, в производстве спирта, уксуса, приготовлении кормов для скота (силоса и сенажа).
3) В микробиологической промышленности используют для получения лекарств, гормонов, витаминов, кормовых белков, ферментов.
4) Нефтяные бактерии используются для очистки водоемов и почвы от нефтяных загрязнений.
5) Используются при очистке сточных вод в составе активного ила.
6) Вызывают порчу продуктов питания, гниение построек, книг и т.д.
7) Бактерии – симбионты человека, обитающие в пищеварительных органах и половых путях помогают нормальному пищеварению и поддерживают определенную среду в половых путях (поэтому при злоупотреблении антибиотиками, наступает нарушение пищеварения – дисбактериоз)
Одна из мер профилактики — если существует токсин, то необходимо, чтобы в организме человека постоянно (!) циркулировал антитоксин, т.е. противоядие. Именно поэтому детям делают прививки — вводят очень сильно ослабленные токсины , а, в результате, организм ребенка формирует вполне приличный иммунитет, поскольку вырабатывается антитоксин.
Есть такое понятие, как ворота инфекции.
Это значит, что бактерии проникают в организм определёнными способами.
через воду, пищу, половым путем, через воздух, через общие предметы, грязные руки, через раны, через укусы блох, вшей клопов.
Профилактика заключается в том, чтобы не допустить бактерий к их воротам.
Это такие важные мероприятия:
1. Изоляция источника инфекции (больного человека, выделяющего бактекрии).
2. Дезинфекция (убивание микробов)
3. Личная гигиена — ношение масок, мойка рук, избегание контактов с больными.
31.Стволовые клетки
Стволовые клетки — недифференцированные (незрелые) клетки, имеющиеся во всех многоклеточных организмах. Стволовые клетки способны самообновляться, образуя новые стволовые клетки, делиться посредством митоза и дифференцироваться в специализированные клетки, то есть превращаться в клетки различных органов и тканей.
Все стволовые клетки обладают двумя неотъемлемыми свойствами:
1. Самообновление, то есть способность сохранять неизменный фенотип после деления (без дифференцировки).
2. Потентность (дифференцирующий потенциал), или способность давать потомство в виде специализированных типов клеток.
Стволовые клетки можно разделить на три основные группы в зависимости от источника их получения: эмбриональные, фетальные и постнатальные (стволовые клетки взрослого организма).
Стволовых клеток в нашем организме очень мало: у эмбриона — 1 клетка на 10 тысяч, у человека в 60-80 лет — 1 клетка на 5-8 миллионов[источник не указан 782 дня].
Стволовые клетки растений также называют камбиальными.
Стволовые клетки способны к асимметричному делению, при котором одна из дочерних клеток остается стволовой, а другая дает начало специализированным клеткам того или иного типа.
32.Ткани растений
Ткань — группа клеток, которые имеют общее происхождение, выполняют одну или несколько функций и занимают свойственное им положение в организме растения. Органы растения образованы разными тканями.
Ткани высших растений это:
1. Образовательная.
2. Основная.
3. Проводящая.
4. Покровная.
5. Механическая.
1) Все образовательные ткани делятся митозом.
У нее нет вторичной клеточной стенки. Максимально простое строение. Меристема находится под защитой.
Клетки меристемы постоянно делятся.
У нее нет цветных пластидов, следовательно она прозрачная.
Меристема бывает первичная и вторичная.
2) Паренхима (основная) выполняет соединительную, запасающую, механическую, проводящую, защитную, секретирующую, фотосинтезирующую функции и функцию деления.
У этой ткани толстая первичная клеточная стенка, а вторичная клеточная стенка без лигнина.
3) Проводящие ткани выполняют основную роль передачи информации в организме растения. Они обеспечивают быстрый транспорт воды по растению. Проводящие ткани делятся на ксилему и флоэму. Она выполняет проводящую и механическую функции.
4) Покровная выполняет защитную функцию и функцию обеспечения транспорта. У неё утолщенная клеточная стенка и на ее поверхности есть слой воска или кутикула.
Покровные ткани делятся на первичные и вторичные.
5) Механические ткани делятся на колленхиму и склеренхиму. Они придают растению прочность.
Благодаря колленхиме растения могут передвигать свои части. Она твердая, но упругая. Склеренхима — это мертвая ткань растений, у нее толстые вторичные клеточные стенки. Эта ткань делится по структуре на волокна, обеспечивающие прочность, и склереиды — защита от удара.
stydopedya.ru
