Получение глюкозы | khimie.ru
Получение глюкозы. Как вам известно, крахмал является полисахаридом с формулой (С6Н10О5)n. Поэтому, чтобы из него получить моносахарид глюкозу, формула которой С6Н1206 необходимо гидролизовать крахмал.
(С6Н10О5)n + Н2O = nС6Н12O6.
В результате получается n молекул глюкозы.
Гидролиз крахмала происходит только при температуре не ниже 100 °C в присутствии катализатора. Наилучшими катализаторами являются серная или соляная кислоты.
Процесс гидролиза можно вести при атмосферном давлении в открытых котлах и при увеличенном давлении до 2,5 атмосфер в автоклавах.
В колбу емкостью 1 л всыпьте 200 г сухого крахмала и прилейте 400 мл воды. Колбу встряхните несколько раз. Образуется крахмальное молоко. В эмалированную или медную кастрюлю или медный котелок налейте 600 мл воды и нагрейте ее до кипения. В кипящую воду влейте осторожно тонкой струей 2,2 мл химически чистой серной кислоты (уд. вес 1,84), затем осторожно из колбы приливайте крахмальное молоко. Если кипение жидкости прекратится, приостановите вливание крахмального молока, иначе начнется клейстеризация. Если произойдет клейстеризация, нужно прекратить вливание крахмального молока и продолжать кипятить массу до тех пор, пока не исчезнет клейстер. Только после этого постепенно приливайте крахмальное молоко. Как только жидкость снова закипит, начинайте медленно вливать крахмальное молоко, все время помешивая. Крахмальное молоко необходимо взбалтывать, иначе крахмал осядет на дно колбы.
По окончании вливания крахмального молока заметьте время и продолжайте кипятить жидкость в течение полутора часов. В случае выкипания жидкости прибавляйте воду, сохраняя первоначальный объем.
Через полтора часа возьмите ложкой или пипеткой немного жидкости и влейте ее в маленькую фарфоровую чашечку, дайте остыть, а затем прилейте 1-2 капли раствора йода. Наблюдайте за изменением цвета жидкости. Если жидкость окрасилась в синий цвет, нагревание продолжайте не менее получаса, так как крахмал еще не весь гидролизовался. Если же жидкость приняла красно-бурую или бурую окраску, значит, крахмал гидролизовался, но в растворе имеется декстрин, в этом случае нагревание продолжайте еще 15-20 минут, после чего возьмите пробу в маленький стаканчик, в котором налито немного чистого этилового спирта, и наблюдайте. Появление мути указывает на наличие следов декстрина. Нагревайте раствор еще 5 минут и процесс получения глюкозы на этом заканчивайте.
Патока готова, но в ней находится свободная серная кислота, которую необходимо удалить; это достигается нейтрализацией при помощи карбоната кальция. 2 г чистого мела и 3 г тонко размолотого мрамора разболтайте в воде и по ложечке прибавляйте в раствор патоки, все время размешивая. Происходит вскипание и шипение раствора. Приливание продолжайте до тех пор, пока не прекратится шипение и вскипание. Затем возьмите пробу на лакмус или конго красное.
По окончании нейтрализации жидкость оставьте отстаиваться. Осветленный раствор осторожно слейте с осадка на полотняный фильтр. Осадок фильтруйте отдельно. Если жидкость получится мутная, ее профильтруйте еще раз через полотняный фильтр, предварительно хорошо промытый в горячей воде.
Прозрачную бесцветную жидкость слейте в какой-либо широкий сосуд (большую фарфоровую чашку, миску и т. п.) и выпаривайте, подложив под дно чашки асбестированную сетку. Прокладка необходима для того, чтобы нагревание шло равномерно и патока не подгорала. Выпаривание проводите до тех пор, пока удельный вес патоки будет равен 1,45. Если не представляется возможным определить удельный вес патоки при помощи ареометра, определение ее готовности можно сделать на глаз. После того как жидкость упарится до половинного объема, возьмите немного патоки на ложечку, дайте ей остыть, затем осторожно сливайте ее и наблюдайте за падением капель. Если капля падает с ложки и тянет за собой нить жидкости, которая после падения капли подтягивается вверх к ложечке, то патока готова.
Патока, выпускаемая заводами, должна иметь удельный вес не ниже 1,42 и не выше 1,47. Кислотность допускается до 0,04 %, но вообще этого нужно избегать и давать совершенно нейтрализованную патоку. Наличие глюкозы определяется при помощи фелинговой жидкости.
Для того чтобы получить кристаллическую глюкозу, необходимо жидкость после окончательного вливания крахмального молока кипятить еще 3-4 часа и только после этого нейтрализовать.
После выпаривания и доведения жидкости до удельного веса 1,45 масса густеет, а через сутки кристаллизуется и затвердевает.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
План
1. Общие сведения
2.
а) D-глюкоза
— a-D-глюкоза
— b-D-глюкоза
б) L-глюкоза
3. Нахождение в природе
4. Получение
5. Применение
6. Физические свойства
7. Химические свойства
8. Рибоза и дезоксирибоза
9. Некоторые интересные факты
1. Общие сведения
Формула глюкозы C6H12O6.
Глюкоза — моносахарид, одна из восьми изомерных альдогексоз. Молярная масса 180 г/моль.
2.
Глюкоза в виде D-формы (декстоза, виноградный сахар) является самым распространённым углеводом. D-глюкоза (обычно её называют просто глюкозой) встречается в свободном виде и в виде олигосахаридов (тростниковый сахар, молочный сахар), полисахаридов (крахмал, гликоген, целлюлоза, декстран), гликозидов и других производных. В свободном виде D-глюкоза содержится в плодах, цветах и других органах растений, а также в животных тканях (в крови, мозгу и др.). D-глюкоза является важнейшим источником энергии в организмах животных и микроорганизмов. Как и другие моносахариды D-глюкоза образует несколько форм. Кристаллическая D-глюкоза получена в 2-х формах: a-D-глюкоза (рисунок 1) и b-D-глюкоза (рисунок 2).
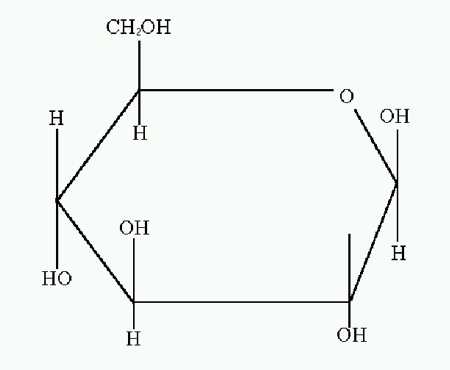
Рисунок 1 (a-D-глюкопираноза)
Рисунок 2 (b-D-глюкопираноза)
a-D-глюкоза
tпл 146°С [a]D= + 112,2° (в воде), кристаллизируется из воды в виде моногидрата с tпл 83°С.
b-D-глюкоза
Получают кристаллизацией D-глюкозы из пиридина и некоторых других растворов. tпл 148-150°С, [a]D= + 18,9° (в воде).
В водном растворе устанавливается равновесие между несколькими взаимопревращающимися формами D-глюкозы: a- и b-пиранозными , a- и b-фуранозными, открытой альдегидной
(рисунок 3) и гидратной формой. В равновесной системе в воде [a]D= + 52,7°.
CHO
|
HCOH
|
HOCH
|
HCOH
|
HCOH
|
CH2OH
Рисунок 3 (альдегидо-D-глюкоза)
L-глюкоза
L-глюкоза получена синтетически, восстановлением лактона L-глюконовой кислоты. a-L-глюкоза — кристаллы tпл 142-143°С [a]D= — 95,5° (в воде) и — 51,4° (равновесная система в воде). Химические свойства L-глюкозы такие же, как у D-глюкозы.
3. Нахождение в природе
В особом виде глюкоза содержится почти во всех органах зелёных растений. Особенно её много в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой.
В организме человека глюкоза содержится в мышцах, в крови (0.1 — 0.12 %) и служит основным источником энергии для клеток и тканей организма. Повышение концентрации глюкозы в крови приводит к усилению выработки гормона поджелудочной железы — инсулина, уменьшающего содержание этого углевода в крови. Химическая энергия питательных веществ, поступающих в организм, заключена в ковалентных связях между атомами. В глюкозе количество потенциальной энергии составляет 2800 кДж на 1 моль (то есть на 180 грамм).
4. Получение
Первый синтез глюкозы из формальдегида в присутствии гидроксида кальция был произведён А. М. Бутлеровым в 1861 году:
O
// Ca(OH)2
6H—C → C6H12O6
\\
H
Глюкоза может быть получена гидролизом природных веществ, в состав которых она входит. В производстве её получают гидролизом картофельного и кукурузного крахмала кислотами.
H2SO4, t
(C6H10O5)n + nH2O → nC6H12O6
Полные синтезы глюкозы, осуществлённые, исходя из диброма кролеина, а также из глицеринового альдегида и диоксиацетона, имеют лишь теоретический интерес.
В природе глюкоза наряду с другими углеводами образуется в результате реакции фотосинтеза:
хлорофилл
6CO2 + 6H2O → C6H12O6 + 6O2 — Q
В процессе этой реакции аккумулируется энергия Солнца.
5. Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Этот процесс протекает ступенчато, и поэтому энергия выделяется медленно.
Глюкоза также участвует во втором этапе энергетического обмена животной клетки (расщепление глюкозы). Суммарное уравнение выглядит так:
C6H12O6 + 2H3PO4 + 2АДФ → 2C3H6O3 + 2АТФ + 2H2O
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке , она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и гликоновых кислот, для синтеза ряда производных сахаров и т.д.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
6. Физические свойства
Глюкоза — бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора она выделяется в виде кристаллогидрата C6H12O6 · H2O. По сравнению со свекловичным сахаром она менее сладкая.
7. Химические свойства
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами:
Свойства, обусловленные наличием в молекуле | Специфические свойства | |
гидроксильных групп | альдегидной группы |
|
1. Реагирует с карбоновыми кислотами с образованием сложных эфиров (пять гидроксильных групп глюкозы вступают в реакцию с кислотами) | 1. Реагирует с оксидом серебра (I) в аммиачном растворе (реакция “серебряного зеркала”): CH2OH(CHOH)4-COH + Ag2O → CH2OH(CHOH)4-CO2H + 2Ag | Глюкоза способна подвергаться брожению: а) спиртовое брожение C6H12O6 → 2CH3-CH2OH+ CO2 б) молочнокислое брожение C6H12O6 → 2CH3-CHOH-COOH молочная кислота |
2. Как многоатомный спирт реагирует с гидроксидом меди (II) c образованием алкоголята меди (II) | 2.Окисляется гидроксидом меди (II) (с выпадением красного осадка) 3. Под действием восстановителей превращается в шестиатомный спирт | в) маслянокислое брожение C6H12O6 → C3H7COOH + 2H2 + 2CO2 масляная кислота |
D-глюкоза даёт общие реакции на альдозы, она является восстанавливающим сахаром, образует ряд производных за счёт альдегидной группы (фенилгидразон, n-бромфенилгидразон и др.). Озазон глюкозы идентичен озанону маннозы, которая является эпимером глюкозы, и озазону фруктозы. При восстановлении глюкозы образуется шестиатомный спирт сорбит; при окислении альдегидной группы глюкозы — одноосновная D-глюконовая кислота, при дальнейшем окислении — двухосновная D-сахарная кислота. При окислении только вторичной спиртовой группы глюкозы (при условии защиты альдегидной группы) образуется D-глюкуроновая кислота. Образование D-глюкуроновой кислоты из D-глюкозы может происходить при действии ферментов оксидаз или дегидрогеназ глюкозы. При пиролизе D-глюкозы образуются гликозаны: a-гликозан и левоглюкозан (b-глюкозан).
Для количественного определения глюкозы применяются калориметрические, иодометрические и другие методы.
8. Рибоза и дезоксирибоза
Из пентоз большой интерес представляют рибоза и дезоксирибоза, ибо они входят в состав нуклеиновых кислот. Структурные формулы рибозы и дезоксирибозы с открытой цепью следующие:
H H H H O H H H H O
| | | | // | | | | //
H — C — C — C — C — C H — C — C — C — C — C
| | | | \ | | | | \
OH OH OH OH H OH OH OH H H
рибоза дезоксирибоза
9. Некоторые интересные факты
Некоторые лягушки нашли применение глюкозе в своём организме — любопытное, хотя и гораздо менее важное. В зимние время иногда можно найти лягушек, вмёрзших в ледяные глыбы, но после оттаивания земноводные оживают. Как же они ухитряются не замёрзнуть насмерть? Оказывается, с наступлением холодов в крови лягушки в 60 раз увеличивается количество глюкозы. Это мешает образованию внутри организма кристалликов льда.
Гликолиз
Герои романа Жюля Верна “Дети капитана Гранта” только собирались поужинать мясом подстреленной ими дикой ламы (гуанако), как вдруг выяснилось, что оно совершенно не съедобно.
“Быть может, оно слишком долго лежало?” — озадаченно спросил один из них.
“Нет, оно, к сожалению, слишком долго бежало! — ответил учёный-географ Паганель — Мясо гуанако вкусно только тогда, когда животное убито во время отдыха, но если за ним долго охотиться и животное долго бежало, тогда его мясо несъедобно.”
Вряд ли Паганель сумел бы объяснить причину описанного им явления. Но, пользуясь данными современной науки, сделать это совсем нетрудно. Начать придётся, правда, несколько издалека.
Когда клетка дышит кислородом, глюкоза “сгорает” в ней, превращаясь в воду и углекислый газ, и выделяет энергию. Но, предположим, животное долго бежит, или человек быстро выполняет какую-то тяжёлую физическую работу, например, колет дрова. Кислород не успевает попасть в клетки мышц. Тем не менее клетки “задыхаются” не сразу. Начинается любопытный процесс — гликолиз (что в переводе означает “расщепление сахара”). При распаде глюкозы образуется не вода и углекислота, а более сложное вещество — молочная кислота. Каждый, кто пробовал кислое молоко или кефир, знаком с её вкусом.
Энергии при гликолизе выделяется в 13 раз меньше, чем при дыхании. Чем больше молочной кислоты накопилось в мышцах, тем сильнее человек или животное чувствует их усталость. Наконец, все запасы глюкозы в мышцах истощаются. Необходим отдых. Поэтому, перестав колоть дрова или взбежав по длинной лестнице, человек обычно “переводит дух”, восполняя недостаток кислорода в крови. Именно молочная кислота сделала невкусным мясо животного, подстреленного героями Жюля Верна.
referati-besplatno.ru
|
ТОП 10: |
Содержание Введение Глава 1. Обзор литературы 1.1. Получение глюкозы 1.2. Физико-химические свойства глюкозы 1.3. Подлинность 1.4. Испытание на чистоту раствора глюкозы 1.5. Количественное определение 1.6. Применение раствора глюкозы 1.7. Выводы по обзору литературы Глава 2. Практическая часть. Валидационная оценка методик качественного и количественного анализа раствора глюкозы для инъекций 5% 2.1. Валидационная оценка методик анализа раствора глюкозы для инъекций по показателю «Специфичность» 2.2. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Линейность» 2.3. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Прецизионность» 2.4. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Правильность» Общие выводы Список литературы
Введение Валидация – экспериментальное доказательство пригодности методики для решения поставленной задачи. Валидация методик проводится на этапе подготовки НД на новые ЛС или пересмотре их в дальнейшем. Цель работы: провести валидационную оценку методик качественного и количественного анализа раствора глюкозы для инъекций по нескольким показателям. Задачи: — изучить показатели качества раствора глюкозы для инъекций по литературным источникам; — экспериментально провести валидационную оценку методик качественного и количественного анализа раствора глюкозы для инъекций по показателям: «специфичность», «линейность», «прецизионность», «правильность»; — подвести итоги валидационной оценки методик качественного и количественного анализа раствора глюкозы для инъекций.
Глюкоза
Получение глюкозы Углеводы содержаться в растительном и животном сырье. Глюкоза находится в виноградном соке, в плодах и других органах различных растений. Основным источником получения глюкозы в промышленности является крахмал, который гидролизуют в присутствии минеральных кислот: (C6H10O5)n+nH2O → nC6H12O6 Глюкозу также можно получить гидролизом сахарозы с участием спиртового раствора хлороводорода. Глюкоза выкристаллизовывается, а фруктоза остается в растворе. Раствор глюкозы для инъекций готовят следующим образом: к 50, 100, 250 или 400 г глюкозы безводной добавляют раствор соляной кислоты 0,1 М до рН 3,0 – 4,0; 0,26 г натрия хлорида и воды для инъекций до 1 л. Раствор фильтруют, разливают в ампулы из нейтрального стекла по 10, 20, 25 или 50 мл и стерилизуют паром при температуре 100о С в течение 60 минут или насыщенным паром при температуре 119-121оС в течение 5-7 минут.
Физико-химические свойства глюкозы Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде, трудно растворим в 95% этаноле, практически нерастворим в эфире и хлороформе. Удельное вращение от +52 до +53о (10% водный раствор).
Подлинность Реакция подлинности на глюкозу основана на ее способности окисляться. К раствору 0,2 г препарата в 5 мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично-красный осадок. Под воздействием минеральных кислот или щавелевой кислоты глюкоза превращается при нагревании в пробирке на пламени горелки в фурфурол или его производые: Фурфурол или оксиметилфурфурол, являясь летучими соединениями, взаимодействуют с анилином или прокаином, нанесенным на фильтровальную бумагу, которой накрывают пробирку. Вначале образуется основание Шиффа, имеющее светло-желтую окраску, а затем фурановый цикл раскрывается и получается полиметиновый краситель – производное оксиглютаконового альдегида (малиново-фиолетовое окрашивание):
Количественное определение Количественное содержание препарата определяют иодиметрически: точную навеску глюкозы (0,500 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят растворителем до метки. К 5мл полученного раствора прибавляют 10 мл 0,1 М раствора иода, 10-15 мл 1% раствора натрия гидроксида и оставляют на 10-15 мин. Затем к раствору добавляют 10 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата в присутствии крахмала до обесцвечивания раствора. 1 мл 0,05 М раствора иода соответствует 0,0099 г водной глюкозы. Параллельно проводят контрольный опыт. Содержание глюкозы (Х) в лекарственном средстве рассчитывают по формуле: ,где Vk— объем титранта, пошедший на титрование в контрольном опыте, V-объем титранта, пошедший на титрование в исследуемом образце, К- поправочный коэффициент, Т- титр титранта по определяемому веществу, а- навеска исследуемого образца.
Применение раствора глюкозы В медицинских целях применяют изотонические (4,5-5%) и гипертонические (10-40%) растворы. Изотонический раствор используют для возмещения дефицита воды в организме, вместе с тем он является источником легко усвояемого организмом ценного питательного материала. При сгорании глюкозы в тканях выделяется значительное количество энергии, которая служит для осуществления функций организма. При введении в вену гипертонических растворов повышается осмотическое давление крови, усиливается ток жидкости из тканей в кровь, стимулируются процессы обмена веществ, улучшается детоксикационная функция печени, возрастает сократительная деятельность сердечной мышцы, расширяются сосуды, увеличивается диурез. Растворы глюкозы широко применяют в медицинской практике при гипогликемии, болезнях печени (гепатите, дистрофии печени), токсикоинфекциях, разных интоксикациях (отравлениях наркотиками, синильной кислотой и ее солями, окисью углерода, анилином, мышьяковистым водородом, фосгеном и другими веществами) и иных патологических состояниях, а также при шоке и коллапсе; кроме того, они являются компонентами различных кровезамещающих и противошоковых жидкостей и используются для разведения ЛС при введении их в вену. Изотонические растворы применяют подкожно (300-500 мл и более), внутривенно капельно (до 2-6 л в сутки) и в клизмах (300-500 мл). Гипертонические растворы вводят вводят внутривенно по 20-50 мл; при необходимости капельно – до 1-3 л в сутки. Часто глюкозу назначают в сочетании с аскорбиновой кислотой. Таблица 3. – Результаты титрования
Строим градуировочный график: 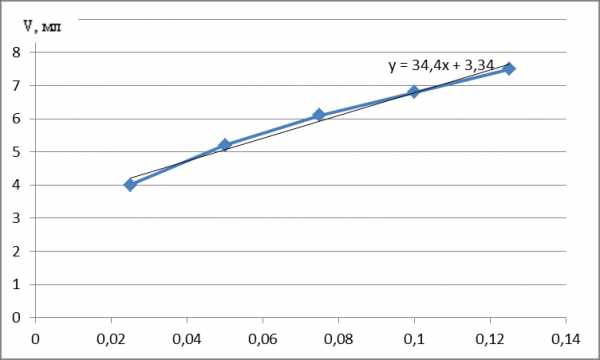 График 1. Зависимость объема титранта от концентрации. Рассчитываем коэффициент корреляции: r=0,992513 Заключение: Таким образом результаты оценки методики показывают, что зависимость объема титранта от концентрации глюкозы в растворе является линейной. Таблица 4. Результаты испытаний
; ; SD=1,9095; ; RSD=1,9% Заключение: полученные результаты показывают, что методика является валидной по показателю «Прецизионность» в условиях повторяемости; случайная ошибка незначительна (1,9%). Таблица 5. – Приготовление модельных растворов глюкозы.
Раствор А1. Точную навеску глюкозы (0,4 г) помещают в мерную колбу вместимостью 10 мл, растворяют в 5 мл воды очищенной, добавляют 0,1 М раствор кислоты хлористоводородной до pH 3,0-4,0 и доводят водой до метки. Раствор А2. Точную навеску глюкозы (0,5 г) помещают в мерную колбу вместимостью 10 мл, растворяют в 5 мл воды очищенной, добавляют 0,1 М раствор кислоты хлористоводородной до pH 3,0-4,0 и доводят водой до метки. Раствор А3. Точную навеску глюкозы (0,6 г) помещают в мерную колбу вместимостью 10 мл, растворяют в 5 мл воды очищенной, добавляют 0,1 М раствор кислоты хлористоводородной до pH 3,0-4,0 и доводят водой до метки. Растворы Б1, Б2, Б3. В три колбы для титрования переносят по 1,0 мл раствора А1, прибавляют 10 мл воды, 10 мл 0,05 М раствора иода, 3 мл 10% раствора натрия гидроксида. Закрывают склянку пробкой и оставляют на 5 минут в темном месте. Затем прибавляют 5 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания раствора (индикатор — крахмал). Растворы Б4, Б5, Б6. В три колбы для титрования переносят по 1,0 мл раствора А2, прибавляют 10 мл воды, 10 мл 0,05 М раствора иода, 3 мл 10% раствора натрия гидроксида. Закрывают склянку пробкой и оставляют на 5 минут в темном месте. Затем прибавляют 5 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания раствора (индикатор — крахмал). Растворы Б7, Б8, Б9. В три колбы для титрования переносят по 1,0 мл раствора А3, прибавляют 10 мл воды, 10 мл 0,05 М раствора иода, 3 мл 10% раствора натрия гидроксида. Закрывают склянку пробкой и оставляют на 5 минут в темном месте. Затем прибавляют 5 мл кислоты серной разведенной и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания раствора (индикатор — крахмал). 1 мл 0,05 М раствора иода соответствует 0,0099 г водной глюкозы. Параллельно проводят контрольный опыт. Расчет содержания глюкозы провели по формуле: Xнайдено= ×K×T, где Vk— объем титранта, пошедший на титрование в контрольном опыте, V-объем титранта, пошедший на титрование в исследуемом образце, К- поправочный коэффициент, Т- титр титранта по определяемому веществу. Результаты оценки методики количественного определения по показателю «Правильность» занесли в таблицу 6. Таблица 6. – Результаты испытаний
; ; SD=1,752; ; =1,52 < (2,31). Заключение: сравнивая полученные результаты с табличными значениями можно сделать вывод о том, что методика является валидной по показателю «Правильность».
Общие выводы: Глюкоза — это очень важный углевод, применяемый в самых различных областях. Важное место глюкоза занимает в медицине, как детоксикант и средство для парентерального питания. В литературном обзоре были рассмотрены характеристика и свойства глюкозы, её получение, качественные реакции и методы количественного определения, а также практическое применение. В экспериментальной части приведена валидационная оценка методик качественного и количественного анализа раствора глюкозы для инъекций по показателям: «специфичность», «линейность», «прецизионность», «правильность». Полученные результаты позволяют сделать вывод, что представленные методики пригодны для практического использования и могут быть использованы для качественного и количественного анализа раствора глюкозы для инъекций.
Список литературы 1. Беликов, В.Г. Фармацевтическая химия. В 2 ч.: Ч.1. Общая фармацевтическая химия; Ч.2. Специальная фармацевтическая химия: Учеб. для вузов. – Пятигорск, 2003. – 720 с. 2. Машковский, М.Д. Лекарственные средства. – 16-е изд., перераб., испр., и доп. – М.: Новая волна: Издатель Умеренков, 2010. – 1216 с. 3. ОФС 42-0113-09 «Валидация аналитических методик» 4. Государственная фармакопея СССР. – Х изд. 5. Руководство к производственной практике по внутриаптечному контролю качества лекарственных средств: учебное пособие / Е.В. Компанцева, Т.Т. Лихота, Г.И. Лукъянчикова, Г.В. Сенъчукова / под редакцией Е.В. Компанцевой. – Пятигорск, 2006.-268 с. 6. Арзамасцев, А.П. Валидация аналитических методов / А.П. Арзамасцев, Н.П. Садчикова, Ю.Я. Харитонов // Фармация. -2006. –Т.55, №4. – С.8-12.
Содержание Введение Глава 1. Обзор литературы 1.1. Получение глюкозы 1.2. Физико-химические свойства глюкозы 1.3. Подлинность 1.4. Испытание на чистоту раствора глюкозы 1.5. Количественное определение 1.6. Применение раствора глюкозы 1.7. Выводы по обзору литературы Глава 2. Практическая часть. Валидационная оценка методик качественного и количественного анализа раствора глюкозы для инъекций 5% 2.1. Валидационная оценка методик анализа раствора глюкозы для инъекций по показателю «Специфичность» 2.2. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Линейность» 2.3. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Прецизионность» 2.4. Валидационная оценка методик титриметрического анализа раствора глюкозы для инъекций по показателю «Правильность» Общие выводы Список литературы
Введение Валидация – экспериментальное доказательство пригодности методики для решения поставленной задачи. Валидация методик проводится на этапе подготовки НД на новые ЛС или пересмотре их в дальнейшем. Цель работы: провести валидационную оценку методик качественного и количественного анализа раствора глюкозы для инъекций по нескольким показателям. Задачи: — изучить показатели качества раствора глюкозы для инъекций по литературным источникам; — экспериментально провести валидационную оценку методик качественного и количественного анализа раствора глюкозы для инъекций по показателям: «специфичность», «линейность», «прецизионность», «правильность»; — подвести итоги валидационной оценки методик качественного и количественного анализа раствора глюкозы для инъекций.
Глюкоза
Получение глюкозы Углеводы содержаться в растительном и животном сырье. Глюкоза находится в виноградном соке, в плодах и других органах различных растений. Основным источником получения глюкозы в промышленности является крахмал, который гидролизуют в присутствии минеральных кислот: (C6H10O5)n+nH2O → nC6H12O6 Глюкозу также можно получить гидролизом сахарозы с участием спиртового раствора хлороводорода. Глюкоза выкристаллизовывается, а фруктоза остается в растворе. Раствор глюкозы для инъекций готовят следующим образом: к 50, 100, 250 или 400 г глюкозы безводной добавляют раствор соляной кислоты 0,1 М до рН 3,0 – 4,0; 0,26 г натрия хлорида и воды для инъекций до 1 л. Раствор фильтруют, разливают в ампулы из нейтрального стекла по 10, 20, 25 или 50 мл и стерилизуют паром при температуре 100о С в течение 60 минут или насыщенным паром при температуре 119-121оС в течение 5-7 минут.
Физико-химические свойства глюкозы Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде, трудно растворим в 95% этаноле, практически нерастворим в эфире и хлороформе. Удельное вращение от +52 до +53о (10% водный раствор).
Подлинность Реакция подлинности на глюкозу основана на ее способности окисляться. К раствору 0,2 г препарата в 5 мл воды прибавляют 10 мл реактива Фелинга и нагревают до кипения; выпадает кирпично-красный осадок. Под воздействием минеральных кислот или щавелевой кислоты глюкоза превращается при нагревании в пробирке на пламени горелки в фурфурол или его производые: Фурфурол или оксиметилфурфурол, являясь летучими соединениями, взаимодействуют с анилином или прокаином, нанесенным на фильтровальную бумагу, которой накрывают пробирку. Вначале образуется основание Шиффа, имеющее светло-желтую окраску, а затем фурановый цикл раскрывается и получается полиметиновый краситель – производное оксиглютаконового альдегида (малиново-фиолетовое окрашивание):
|
infopedia.su
Углеводы. Глюкоза. Химические свойства глюкозы. Применение глюкозы на основе свойств
Доброе время суток, уважаемые десятиклассники!
Мы начинаем знакомиться с новой группой органических соединений — углеводами.Углеводы… А это те самые сладости, которые вы так любите, (фрукты, торты, конфеты, варенье, шоколад и т.д., особенно много углеводов содержит виноград). Углеводы жизненно важные вещества, которые необходимы каждому организму. Эти вещества расходуются, и человек должен постоянно пополнять их запасы. Понятно, что вещества, входящие в состав тканей организма, не похожие на те, которые он употребляет в пищу. Организм человека перерабатывает пищевые продукты и в процессе своей жизнедеятельности постоянно расходует энергию, которая, как мы знаем, выделяется при окислении в тканях организма, углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
Животные и человек не синтезируют углеводы. В зеленых растениях при участии хлорофилла и солнечного света осуществляется ряд процессов преобразования поглощенной из воздуха углекислого газа и впитанной из почвы воды. Конечным продуктом этих процесса – фотосинтеза, является сложная молекула углевода.
Углеводы – важный источник энергии для организма, участвуют в обмене веществ. Основными источниками углеводов являются растительные продукты.
Физиологи установили, что при физической нагрузке, которая в 10 раз превышает привычную, человек, соблюдающий жировую диету, лишается сил уже через полчаса. А вот углеводная диета позволяет выдержать такую же нагрузку в течение четырех часов. Оказывается, получение организмом энергии из жиров – процесс длительный. Это объясняется малой реакционной способностью жиров, особенно их углеводородных цепей. Углеводы же, хотя и дают меньше энергии, чем жиры, однако выделяют ее намного быстрее. Поэтому, если предстоит основательная нагрузка, предпочтительнее подкрепиться сладким, а не жирным.
Классификация углеводов.
Углеводы – обширный класс природных соединений.Обратимся к схеме 1. “Классификация углеводов”. В зависимости от числа остатков моносахаридов в молекуле делятся на моносахариды, дисахариды и полисахариды.
Моносахариды (простые углеводы) – углеводы, которые не гидролизуются. В зависимости от числа атомов углерода подразделяются на триозы, тетрозы, пентозы, гексозы. Для человека наиболее важны глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза.
Дисахариды – углеводы, которые гидролизуются с образованием двух молекул моносахаридов. Наиболее важны для человека сахароза, мальтоза и лактоза.
Полисахариды – высокомолекулярные соединения – углеводы, которые гидролизуются с образованием множества молекул моносахаридов. Они делятся на перевариваемые и неперевариваемые в желудочно-кишечном тракте. К перевариваемым относят крахмал и гликоген, из вторых для человека важны клетчатка, гемицеллюлоза и пектиновые вещества.
Углеводы часто называют сахаристыми веществами или сахарами. Они могут быть безвкусными, сладкими и горькими. Если сладость раствора сахарозы принимать за 100 %, то сладость фруктозы – 173 %, глюкозы – 81 %, мальтозы и галактозы – 32 %, лактозы – 16 %.
Качественный состав углеводов.
Углеводы – органические соединения, состоящие из углерода, водорода и кислорода, причем водород и кислород входят в соотношении (2 : 1) как в воде, отсюда и название.
На основе этой аналогии русский химик К. Шмидт в 1844 г. предложил термин углевода (углерод и вода), а общая формула углеводов Сn(Н2О)m
Итак, важнейшим представителем моносахаридов является глюкоза. При изучении, каких некоторых тем мы встречались с вами с этим веществом в курсе химии и биологии: химия – альдегиды, спирты; биология – фотосинтез, строение клетки.
Получение глюкозы.
1. Реакция фотосинтеза.6СО2 + 6H2O –> С6Н12 О6 + 6О2 +Q
2. Реакция полимеризации.
3. Гидролиз крахмала.
(С6Н10О5)n + nH2O –> nС6Н12О6
Физические свойства:
бесцветное кристаллическое вещество, хорошо растворимо в воде, сладкое на вкус, температура плавления 146оС.
Строение молекулы глюкозы. Изомерия.
Вывод: таким образом, глюкоза – альдегидоспирт, точнее – многоатомный альдегидоспирт.Установлено, что в растворе глюкозы находится не только её альдегидная форма; но и молекулы циклического строения.Установлено, что у третьего атома углерода группа – ОН расположена иначе, чем у других атомов углерода распространённое строение глюкозы выглядит так:

Превращение молекулы линейного строения в молекулу циклического строения объяснимо, если вспомнить что атомы углерода могут вращаться вокруг сигма -связей. Альдегидная группа может приблизиться к гидроксильной группе 5-го атома углерода, поскольку атом кислорода карбонильной группы несёт на себе частичный – заряд, а атом водород гидроксильной группы – частично + заряд.
Осуществляется своеобразный химический процесс: происходит разрыв -связи карбонильной труппы, к атому кислорода присоединяется атом водорода, а атом кислорода гидроксильной группы с атомом углерода замыкают цепь. Циклические формы находятся в равновесии, превращаясь альфа и бетту форму. Таким образом, в водном растворе глюкозы находятся три изомерные формы. Молекула кристаллической глюкозы альфа -форма, при растворении в воде – открытая форма, а затем снова циклическая бетта-форма. Такая изомерия называется динамической (таутомерия).
Химические свойства глюкозы.
Моносахариды вступают в химические реакции, свойственные карбонильной и гидроксильной группам.
1) Реакция “серебряного зеркала”
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН)4 – СООН + 2Ag
(Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений).
2) Взаимодействие глюкозы с гидроксидом меди (II)
3) Гидрирование глюкозы
Альдегидная группа может быть восстановлена в гидроксильную группу действием водорода в присутствии катализатора.
4) Специфические свойства.Большое значение имеют процессы брожения глюкозы, происходящие под действием органических катализаторов-ферментов (они вырабатываются микроорганизмами).
а) спиртовое брожение (под действием дрожжей)
С6Н12О6= 2С2Н5 ОН + 2СО2
б) молочнокислое брожение (под действием молочнокислых бактерий)
в) маслянокислое брожение
Применение глюкозы.
Глюкоза находит применение в различных отраслях промышленности:- в кондитерской промышленности при изготовлении мягких конфет, десертных сортов шоколада, тортов и различных диетических изделий;
- в хлебопечении глюкоза улучшает условия брожения, придает пористость и хороший вкус изделиям, замедляет очерствение;
- в производстве мороженого она занижает точку замерзания, увеличивает его твердость;
- при производстве фруктовых консервов, соков, ликеров, вин, безалкогольных напитков, так как глюкоза не маскирует аромата и вкуса;
- в молочной промышленности при изготовлении молочных продуктов и продуктов детского питания рекомендуется использовать глюкозу в определенной пропорции с сахарозой для придания этим продуктам более высокой питательной ценности;
- в ветеринарии;
- в птицеводстве;
- в фармацевтической промышленности.
Кристаллическую глюкозу целесообразно использовать для питания больных, травмированных, выздоравливающих, а также людей, работающих с большими перегрузками.
Медицинскую глюкозу применяют в антибиотиках и других лекарственных препаратах, в том числе для внутривенных вливаний, и для получения витамина С. Техническая глюкоза находит применение в качестве восстановителя в кожевенном производстве, в текстильном – при производстве вискозы, в качестве питательной среды при выращивании различных видов микроорганизмов в медицинской и микробиологической промышленности.
Закрепление:
Источник: http://festival.1september.ru/articles/532403/
alximiki.blogspot.com
Глюкоза: формула, строение и свойства
Строение глюкозы
Название «углеводы» сохранилось с тех времен, когда строение этих соединений еще не было известно, но был установлен их состав, которому соответствует формула Cn(H2O)m. Поэтому углеводы относили к гидратам углерода, т.е. к соединениям углерода и воды – «углеводам». В наше время большинство углеводов выражают формулой CnH2nOn.
1. Углеводы используются с глубокой древности — самым первым углеводом (точнее смесью углеводов), с которой познакомился человек, был мёд.
2. Родиной сахарного тростника является северо-западная Индия-Бенгалия. Европейцы познакомились с тростниковым сахаром благодаря походам Александра Македонского в 327 г. до н.э.
3. Свекловичный сахар в чистом виде был открыт лишь в 1747 г. немецким химиком А. Маргграфом.
4. Крахмал был известен ещё древним грекам.
5. Целлюлоза, как составная часть древесины, используется с глубокой древности.
6. Термин слова “сладкий” и окончание — оза- для сахаристых веществ было предложено французским химиком Ж. Дюла в 1838 г. Исторически сладость была главным признаком, по которому то или иное вещество относили к углеводам.
7. В 1811 г. русский химик Кирхгоф впервые получил глюкозу гидролизом крахмала, а впервые правильную эмпирическую формулу глюкозы предложил шведский химик Я. Берцемус в 1837 г. С6Н12О6
8. Синтез углеводов из формальдегида в присутствии Са(ОН)2 был произведён А.М. Бутлеровым в 1861 г.
Глюкоза является бифункциональным соединением, т.к. содержит функциональные группы – одну альдегидную и 5 гидроксильных. Таким образом, глюкоза — многоатомный альдегидоспирт.
Структурная формула глюкозы имеет вид:
Сокращённая формула имеет вид:
Молекула глюкозы может существовать в трех изомерных формах, причем две из них являются циклическими, одна – линейной.
Все три изомерных формы находятся в динамическом равновесии между собой:
циклическая [(альфа-форма) (37%)] <—> линейная (0,0026%) <—> циклическая [(бета-форма) (63%)]
Циклические альфа- и бета- формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В альфа-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в бета-глюкозе – в цис-положении.
Химические свойства глюкозы:
Свойства, обусловленные наличием альдегидной группы:
1. Реакции окисления:
а) с Cu(OH)2:
C6H12O6 + Cu(OH)2↓ ——> ярко-синий раствор
2.Реакция восстановления:
c водородом H2:
В этой реакции может принимать участие лишь линейная форма глюкозы.
Свойства обусловленные наличием нескольких гидроксильных групп (ОН):
1. Реагирует с карбоновыми кислотами с образованием сложных эфиров (пять гидроксильных групп глюкозы вступают в реакцию с кислотами):
2. Как многоатомный спирт реагирует с гидроксидом меди (II) c образованием алкоголя-та меди (II):
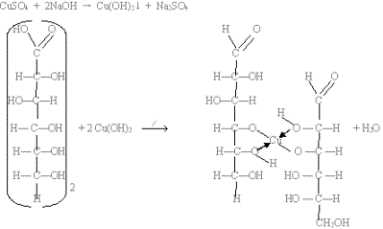
Специфические свойства
Большое значение имеют процессы брожения глюкозы, происходящие под действием органических катализаторов-ферментов (они вырабатываются микроорганизмами).
а) спиртовое брожение (под действием дрожжей):
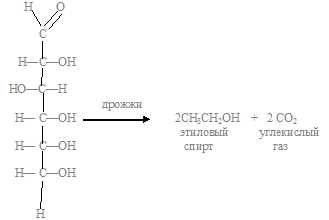
б) молочнокислое брожение (под действием молочнокислых бактерий):
в) уксуснокислое брожение:
г) лимоннокислое брожение:
д) ацетон-бутанольное брожение:
Получение глюкозы
1.Синтез глюкозы из формальдегида в присутствии гидроксида кальция (ре-акция Бутлерова):
2. Гидролиз крахмала (реакция Киргофа):
Биологическое значение глюкозы, её применение
Глюкоза — необходимый компонент пищи, один из главных участников обмена веществ в организме, очень питательна и легко усваивается. При её окислении выделяется больше трети используемой в организме энергий ресурс — жиры, но роль жиров и глюкозы в энергетике разных органов различна. Сердце в качестве топлива используется жирные кислоты. Скелетным мышцам глюкоза нужна для “запуска”, а вот нервные клетки, в том числе и клетки головного мозга работают только на глюкозе. Их потребность составляет 20-30% вырабатываемой энергии. Нервным клеткам энергия нужна каждую секунду, а глюкозу организм получает при приёме пищи. Глюкоза легко усваивается организмом, поэтому ее используют в медицине в качестве укрепляющего лечебного средства. Специфические олигосахариды определяют группу крови. В кондитерском деле для изготовления мармелада, карамели, пряников и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, также как и при силосовании кормов. На практике используется и спиртовое брожение глюкозы, например, при производстве пива.
Углеводы действительно самые распространенные органические вещества на Земле, без которых невозможно существование живых организмов. В живом организме в процессе метаболизма глюкоза окисляется с выделением большого количества энергии:
buzani.ru
Получение — глюкоза — Большая Энциклопедия Нефти и Газа, статья, страница 1
Получение — глюкоза
Cтраница 1
Получение глюкозы гидролизом полисахаридов ставится позднее в связи с изучением химических свойств крахмала и клетчатки, когда процесс лучше может быть понят учащимися. [1]
Для получения глюкозы гидролиз целлюлозы разбавленными кислотами проводится при повышенных температурах. [2]
Организуется получение глюкозы и других продуктов из растительных материалов методом гидролиза концентрированной соляной кислотой на крупных пром. Предусмотрено окончание разработки в опытно-пром. [3]
Источником получения глюкозы является крахмал или клетчатка. Применяется глюкоза в пищевой промышленности как дешевый заменитель тростникового сахара, в ряде производств — как восстановитель, а также в медицине. [4]
При получении глюкозы проводят более глубокий гидролиз суспензии крахмала, получая гидролизаты с высоким содержанием глюкозы. Осаха-ренный сироп упаривают и направляют на кристаллизацию. Продукт, полученный в результате затвердевания очищенных и уваренных гидролизатов, называют крахмальным сахаром, а выделенные кристаллы глюкозы — кристаллической глюкозой. [6]
Источником для получения глюкозы являются крахмал или клетчатка. Применяется глюкоза в пищевой промышленности как дешевый заменитель тростникового сахара, в ряде производств как восстановитель, а также в медицине. [7]
Источником для получения глюкозы является крахмал или клетчатка. Применяется глюкоза в пищевой промышленности как дешевый заменитель тростникового сахара, в ряде производств — как восстановитель, а также в медицине. [8]
Технологическая линия получения глюкозы ферментативным путем включает как новые биотехнологические, так и известные технологические стадии. К биотехнологическим стадиям относятся получение целлюлаз, ферментативный гидролиз, регенерация ферментов, обработка гидролизата целлобиазой для увеличения выхода глюкозы. [9]
Описаны методы получения глюкозы гидролизом неполностью разложившейся клетчатки молодого торфа, сульфитных щелоков бумажно-целлюлозного производства и синтеза этилового спирта гидратацией этилена, содержащегося в газах крекинга и пиролиза нефти, в газах коксования, а также этилена, получаемого частичным восстановлением ацетилена. [10]
Технологическая линия получения глюкозы ферментативным [ утем включает как новые биотехнологические, так и извест-сые технологические стадии. К биотехнологическим стадиям тносятся получение целлюлаз, ферментативный гидролиз, ре-енерация ферментов, обработка гидролизата целлобиазой для увеличения выхода глюкозы. [11]
Итак, для получения глюкозы из опилок требуются четыре операции: варка опилок с раствором серной кислоты, нейтрализация кислоты, фильтрование и выпаривание. Так и делают глюкозу из опилок на заводах, только в других масштабах. [12]
Основной промышленный способ получения глюкозы заключается в гидролизе полисахарида — крахмала — с помощью минеральных кислот при повышенных температуре и давлении. [13]
Гидролиз целлюлозы с целью получения глюкозы ( осахарива-ние) используют в производстве этилового спирта. [14]
Гидролиз клетчатки с целью получения глюкозы из древесины ведется при действии на древесину сверхконцентрированной соляной кислоты ( 40 — 42 / 0 НС1) на холоду. Удается получить до 96 / 0 теоретического количества d — глюкозы, при сбраживании которой получают до 34 л спирта на 100 кг древесины. Глюкоза получается в таком риде, что годится и на корм скоту. [15]
Страницы: 1 2 3
www.ngpedia.ru
Глюкоза получение — Справочник химика 21
Манноновая кислота путем целого ряда уже известных нам реакций может быть превращена в различные природные сахара восстановление ее лактона приводит к )-маннозе, а при нагревании самой кислоты с пиридином происходит а-инверсня и образуется Д-глюконо-вая кислота, лактон которой при восстановлении дает Д-глюкозу, Полученные таким образом )-глюкоза и Д-манноза могут быть через озазон и озон превращены в Д-фруктозу [c.438]Если требуется получить чистую глюкозу, то кипячение крахмала ведут дольше, чем достигается более полное превращение его I) глюкозу. Полученный после нейтрализации и фильтрования растзор сгущают, пока из него не начнут выпадать кристаллы глюкозы. [c.494]
Поместите в пробирку 1 каплю 0,5%-ного раствора глюкозы (23) и 6 капель 2 н. NaOH (2). К полученной смеси добавьте 1 каплю 0,2 н. раствора медного купороса (19). Образующийся вначале осадок гидроксида меди Си(0Н)2 немедленно растворяется и получается прозрачный раствор сахарата меди со слабой синей окраской. Растворение гидроксида меди (И) указывает на наличие гидроксильных групп в глюкозе. Полученный раствор сохраните для следующего опыта. Сравните приведенную реакцию с реакцией образования глицерата меди (см. оп. 24), а также с реакцией образования комплексной соли виннокаменной кислоты (см. оп. 61). Напишите схему реакции (в упрощенном виде или с образованием хелатного соединения). [c.80]
Для получения 24 электронов такой процесс должен повториться 6 раз, т. е. на каждую молекулу глюкозы, полученную с помощью фотосинтеза, образуется 6 молекул Ог. (В связи с тем что в целом процесс очень сложен и в нем существуют некоторые другие стадии, потребляющие энергию, на одну молекулу глюкозы расходуется не 24 кванта света, как следует из приведенного упрощенного рассмотрения, а 60 квантов.) [c.370]
Математическая модель процесса гидрогеиолиза глюкозы, полученная методом случайного баланса, и оптимизация процесса [c.131]
Другой способ получения глицерина заключается в сбраживании глюкозы (полученной осахариванием крахмала, стр. 116) в присутствии, например, бисульфита натрия ЫаНЗОз по схеме [c.126]
При спиртовом брожении глюкозы получен газ, который прореагировал с раствором гидроксида натрия объемом 60,2 мл и плотностью 1,33 г/мл, образовав среднюю соль. Массовая доля гидроксида натрия в этом растворе равна 30%, Какая масса раствора с массовой долей этанола 60% получена при этом Ответ 23 г. [c.202]
Сырая глюкоза, полученная из древесины, может служить кормом для скота. [c.338]
При брожении глюкозы получен этанол массой [c.235]
В результате спиртового брожения глюкозы получен этанол, который окислили до кислоты. При действии избытка гидрокарбоната калия на всю полученную кислоту выделился газ объемом 8,96 л. (н. у.). Определите массу глюкозы, подвергшуюся брожению. [c.632]
Задача 0-54. В результате спиртового брожения глюкозы получен этанол, который окислили до кислоты. При действии избытка гидрокарбоната калия на всю полученную кислоту выделился газ объемом 8,96 л (н. у.). Определите массу глюкозы, подвергшуюся брожению, если выход спирта в этом процессе 80%. [c.135]
Не совсем чистый препарат перекристаллизовывают из петролейного эфира (т. кип. 30—60°), содержащего 0,5% абсолютного эфира, в экстракторе непрерывного действия. На 6—7 г вещества берут 100 мл растворителя. Для получения чистого препарата обычно бывает достаточно одной перекристаллизации. Удельное вращение [а]в чистой тетраметил- /-глюкозы, полученной по описанному методу, равно примерно — -81,3° (примечание 4). [c.409]
Вследствие все большего вытеснения мыла синтетическими моющими средствами, производство глицерина уменьшается, и взамен его может быть обосновано применение других многоатомных спиртов, в частности сорбита. Глюкоза, полученная методом гидролиза древесины концентрированной соляной кислотой, имеет в этом отношении большие преимущества благодаря высокой чистоте продукции, низкой стоимости производства и удачной сочетаемости процессов производства глюкозы и ее дальнейшей переработки. Производство глюкозы из древесины представляет собой также меру предосторожности на случай недостатка продуктов питания, в особенности в Европе. Организация переработки древесины методом гидролиза будет также способствовать промышленному развитию районов, богатых лесом. Предпосылкой всех этих возможностей Шенеман считает рентабельность гидролизного производства. [c.55]
Деструкция высокомолекулярных соединений отличается от аналогичного процесса у низкомолекулярных веществ тем, что она, как правило, не приводит к образованию новых типов соединений. Например, глюкоза, полученная при гидролитической деструкции целлюлозы, является, так же как исходный полимер, углеводом. [c.623]
Крахмал является важнейшим углеводом пищевых продуктов (хлеба, круп, картофеля). Большие его количества перерабатываются в патоку и глюкозу. Получение глюкозы и патоки из крахмала основано на гидролитическом его расщеплении под действием минеральных кислот. Удобнее всего использовать здесь серную кислоту, так как ее легко удалить в виде гипса после обработки мелом. [c.118]
Кроме природной, или О-глюкозы, получен синтетически ее оптический антипод — Ь-глюкоза (например, циангидринным синтезом из арабинозы), а также оптически недеятельная -глюкоза. [c.658]
Следует рассказать об их функциях. Если крахмал в растении служит запасом углеводов для зародыша, то механическую прочность органам растения придает клетчатка. Нужно продемонстрировать гидролиз клетчатки или крахмала, чтобы подтвердить, что их мономер — глюкоза. Полученная глюкоза даст реакцию с реактивом Фелинга. [c.143]
Обычная чистая глюкоза, полученная перекристаллизацией из водных или спиртоводных растворов выше 30°С, представляет собой безводную глюкозу, находящуюся в а-форме (с. 340). [c.350]
Изомеризация глюкозы, получение глюконата, трансформация стероидов [c.134]
Сахар, полученный после кислотного и ферментативного гидролиза, располагался на хроматограммах всегда вблизи глюкозы и галактозы. При окислении сахара азотной кислотой была выделена калиевая соль сахарной кислоты, которая могла получиться только после окисления глюкозы. Получение озазона сахара с Тип 198—199° тоже говорит в пользу глюкозы. [c.51]
Для получения оксида меди (I) в стакан наливают 33 мл 9,5 %-ного раствора сульфата меди (II) и добавляют 2 мл 60 %-ного раствора глюкозы. Полученную смесь нагревают на газовой горелке до 35° и, перемешивая, быстро приливают 15 мл 20 %-ного раствора гидроксида натрия. Раствору дают отстояться до окончания образования осадка оксида меди. Первоначально выпавший осадок желтого цвета (мелкодисперсный) превращается в осадок к
www.chem21.info

