Моноферменты ,изоферменты, мультиферменты проферменты, олигоферменты
Изоферменты
Изоферменты – это изофункциональные белки. Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по:
— аминокислотному составу;
— электрофоретической подвижности;
— молекулярной массе;
— кинетике ферментативных реакций;
— способу регуляции;
— стабильности и др.
Изоферменты – это молекулярные формы фермента, различия в аминокислотном составе обусловлены генетическими факторами.
Примеры изоферментов: глюкокиназа и гексокиназа.
+АДФ
Гексокиназа может фосфорилировать любой шестичленный цикл, гексокиназа – только превращение глюкозы. После приёма пищи, богатой глюкозой, глюкокиназа начинает работать. Гексокиназа – стационарный фермент. Он катализирует реакцию расщепления глюкозы при низких её концентрациях, поступающих в организм. Отличаются по локализации (глюкокиназа – в печени, гексокиназа – в мышцах и печени), физиологическому значению, константе Михаэльса.
Если фермент – олигомерный белок, то изоформы могут получаться в результате различной комбинации протомеров. Например, лактатдегидрогеназа состоит из 4-х субъединиц. Н – субъединицы сердечного типа, М – мышечного. Может быть 5 комбинаций этих субъединиц, а, следовательно, и 5 изоферментов: НННН (ЛДГ1 – в сердечной мышце), НННМ (ЛДГ2), ННММ (ЛДГ3), НМММ (ЛДГ4), ММММ (ЛДГ5 – в печени и мышцах). [рис. эти 4 буквы в кружочки.
Надо отличать изоферменты от множественных форм ферментов. Множественные формы ферментов – это ферменты, которые модифицированы после своего синтеза, например фосфорилаза A и B.
Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов
Проферменты, или проэнзимы, зимогены, энзимогены — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям (обычно расщеплению специфическими эндо- или экзопептидазами или гидролизу), в результате чего образуется каталитически активный продукт — фермент. Относятся к группе протеиназ(сериновые, тиоловые, кислые). Синтез зимогенов осуществляется на рибосомах эндоплазматического ретикулума особыми секреторными клетками в виде зимогенных гранул, которые после завершения процесса мигрируют к поверхности клеток и затем секретируются в окружающую среду. Достигнув места действия они превращаются в активные формы ферментов. К ним относятся пепсиноген, активной формой которого является пепсин (основной протеолитический фермент желудочного сока), трипсиноген — трипсин, химотрипсиноген — химотрипсин, прокарбоксилепептидазы — карбоксипептидазы (ферменты поджелудочной железы) и др. К зимогенам относятся ферменты свёртывания крови (факторы свёртывания крови), компоненты и факторы системы комплемента.
Химическая природа ферментов. Однокомпонентные (мономерные) и двухкомпонентные (олиголимерные) ферменты. По химической природе бывают мономерные (однокомпонентные) ферменты, состоящие только из белковой части и олигомерные (двухкомпонентные), содержащие наряду с белковой частью (апофермент) и небелковую часть (кофактор). В роли кофактора могут выступать: коферменты, непрочно связанные с белковой частью, и простетические группы прочно связанные с белком. Кофактор может быть представлен коферментными формами водорастворимых витаминов (В1, В2, В3, В5, В6, В12, Н) и многими двухвалентными металлами (Mg2 , Mn2 , Ca2 ). Отличительная особенность двухкомпонентных ферментов – ни кофактор отдельно, ни апофермент сами по себе не обладают каталитической активностью, а только в комплексе, образуя холофермент.
20 Свойства ферментов
Общие черты ферментов и небиологических катализаторов:
1) и те, и другие катализируют только энергетически возможные реакции;
2) увеличивают скорость реакции;
3) не меняют направления реакции;
4) в ходе реакции не расходуются;
5) для обратимых процессов катализируют как прямую, так и обратную реакции, не смещая равновесия, а лишь ускоряя время его наступления.
Особые свойства ферментов:
1) высокая каталитическая активность. Металлы увеличивают скорость реакции в тысячи раз, а ферменты в миллионы раз. Например, уреаза ускоряет скорость реакции в 1014 раз. Каталаза ускоряет распад H2O2 в 1 млдр. раз! 2H2O2 ®2H2O +O2. Без катализатора выделения кислорода не видно. Металлический катализатор увеличивает скорость реакции в 1000 раз, а при добавлении каталазы – бурное вспенивание.
2) специфичность действия – наиболее характерная черта. Строение активного центра фермента, катализирующего реакции, различна. Структура активного центра фермента комплементарна структуре его субстрата, поэтому фермент из множества веществ присоединяет только свой субстрат – субстратная специфичность фермента.
Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения. Например, на АК ГИС действуют 2 фермента: гистидаза (отщепляет NH 3) и гистидиндекарбоксилаза (отщепляет CO2).
Выделяют несколько видов специфичности:
а) абсолютная специфичность. Фермент действует только на один единственный субстрат. Пр.: уреаза разрушает мочевину: NH2-CO-NH2® (над стрелкой уреаза, под – вода) 2NH3+ CO2. Аргиназа катализирует распад аргинина.
б) групповая специфичность. Фермент действует на определённую связь в разных субстратах. Пр.: пептидазы разрывают пептидные связи [-NH-CH(R)-CO—NH-CH(R)-CO-]. Пепсин действует только на связи, образованные карбоксильной группой ароматических АК (ФЕН, ТИР, ТРИ). Эстеразы разрывают сложно-эфирную связь [-CO-NH-] в различных липидах. Гликозидазы действуют на гликозидную связь. Действие ферментов, обладающих групповой специфичностью, позволяет организму содержать небольшое количество ферментов.
в) стереоспецифичность. Фермент действует на определённый стереоизомер (D- и L-, цис- и транс-). Пр.: бутен-2-диовая кислота имеет 2 стереоизомера: транс-изомер или фумаровая к-та, и цис-изомер или малеиновая кислота.
Фумараза действует на фумаровую к-ту с превращением последней в яблочную.
В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты.
3) Влияние температуры (правило Вант-Гоффа). При увеличении температуры на 10 градусов скорость реакции увеличивается в 1,5-2 раза. Но для фермента это правило действует только до 40 градусов, т.к. дальше наступает тепловая денатурация фермента. Большинство ферментов в организме человека имеет оптимальную температуру 25-40 градусов [рис. графика: по оси х – температура, по у – процент активности. Рисуем горочку, оптимум – на 37-40°С].
Повышение активности фермента при увеличении температуры объясняется увеличением кинетической энергии реагирующих молекул, что приводит к увеличению числа столкновений между молекулами. При дальнейшем повышении температуры энергия становится чрезмерной, и внутри молекулы разрываются слабые связи – водородные, гидрофильные взаимодействия; происходит нарушение вторичной, третичной, четвертичной структуры фермента.
Ряд ферментов термостабильны, например, гликопротеины.
4) Влияние рН. Для поддержания третичной или четвертичной структуры фермента часто может быть необходимо наличие заряда на группе, удаленной от области связывания субстрата. Если же заряд этой группы меняется, то может происходить частичное развертывание белковой цепи, или компактизация, или диссоциация (олигомерные белки). Поэтому при отклонении рН от оптимального значения, фермент может потерять свою нативную структуру, в результате чего не происходит полноценного связывания активного центра с субстратом. Также при изменении рН может происходить изменение заряда на субстрате.
[рис. график. По х – рН, по у – процент активности. Рисуем горочку.]
Пепсин – 1.5-2, амилаза слюны — 6.8-7.2, трипсин — 7.5-8.6. Для большинства ферментов оптимум рН лежит в среде, близкой к нейтральной.
5) Скорость ферментативной реакции прямо пропорциональна кол-ву фермента (для небиологических катализаторов такой зависимости нет). Недостаток фермента в живом организме, например при неполноценном питании, генетических нарушениях, приводит к уменьшению скорости превращения веществ и наоборот.
6) Ферменты являются регулируемыми катализаторами. Так под действием различных веществ (активаторов и ингибиторов) меняется скорость ферментативной реакции.
infopedia.su
Мультиферментные комплексы
В их состав входят разные ферменты, катализирующие последовательные этапы превращения какого-либо субстрата. Особенность подобных комплексов – прочность ассоциации ферментов. Образование мультиферментных комплексов имеет определенный биологический смысл и ряд преимуществ.
Организация функционально связанных ферментов в комплексы концентрирует каталитическую активность, позволяет достичь высоких концентраций интермедиатов и перехода субстратов с одного активного центра на другой с минимизацией диффузионных эффектов. Кроме того, присутствие ферментов в комплексе делает возможным координацию аллостерического контроля нескольких активностей. Пируватдегидрогеназный комплекс являяется растворимым мультиэнзимным комплексом, который изучен в деталях.
Пируватдегидрогеназный комплекс
Этот мультиферментный комплекс, имеющий молекулярную массу 4500 кДа, состоит из трех типов ферментов. Первый из них (E1) ускоряет реакцию декарбоксилирования пировиноградной кислоты. В состав комплекса входит 12 димерных молекул этого фермента. Второй и третий ферменты, катализирующие окислительно-восстановительные процессы при окислении пировиноградной кислоты, сосредоточены внутри мультиэнзимного комплекса. Один из них (Е3) представлен шестью димерными молекулами, другой (Е2) ‒ 24 протомерами (рис. 4.1.4).
Рис.4.1.4. Трехмерная струкатура пируватдегидрогеназного комплекса
В результате слаженного во времени и пространстве действия всех трех видов входящих в его состав ферментов мультиэнзимный комплекс с огромной скоростью осуществляет превращение пировиноградной кислоты (4.1.5).
Сравнительно недавно выявлена еще одна своеобразная черта в строении ферментов: некоторые из них являются полифункциональными, т.е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Эта единая цепь при формировании третичной структуры образует несколько функционально и стерически обособленных глобулярных участков ‒ доменов, каждый из которых характеризуется своей каталитической активностью. Такие ферменты называют мультиферментными конъюгатами.
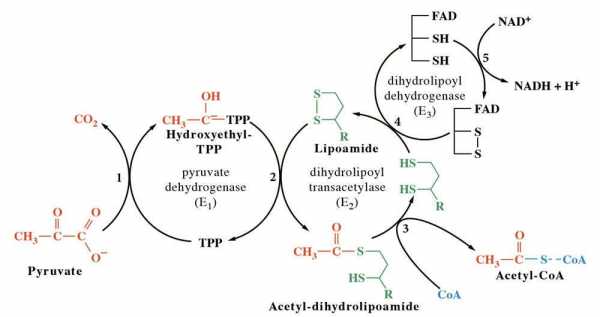
Рис. 4.1.5. Процесс декарбоксилирования пирувата пируватдегидрогеназным комплексом
Мультиферментные конъюгаты
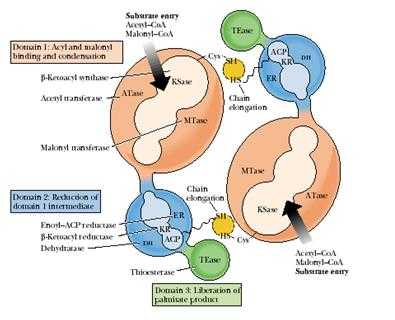
Примерами полифункциональных конъюгатов являются комплекс синтазы жирных кислот (рис. 4.1.5) и КАД – комплекс, объединяющий первые три энзиматические активности. участвующие в метаболизме пиримидинов.

Рис.4.1.5. Комплекс синтазы жирных кислот млекопитающих
Каждая субъединица этого конъюгата включает три различных домена и восемь субдоменов.
Домен I состоит из трех субдоменов: субдомен 1 − АПБ-S-ацетилтрансфераза, 60 кДа; субдомен 2 − АПБ-S-малонилтрансфераза, 23 кДа; субдомен 3 − β-кетоацил-АПБ-синтаза (конденсирующий фермент, 45 кДа). Домен I катализирует присоединение субстратов ацетил-СоА и малонил-СоА ацетилтрансферазой и малонилтрансферазой соответственно и последующую конденсацию обоих партнеров β-кетоацил-синтазой.
Домен II также состоит из трех субдоменов: субдомен 4 − β-кетоацил-АПБ-редуктаза, 21 кДа; субдомен 5 − β-гидроксиацил-АПБ-дегидратаза, 50 кДа; субдомен 6 − еноил-АПБ-редуктаза, 14 кДа. К субдомену 4 присоединен ацилпереносящий белок (АПБ), 15 кДа. Домен II восстанавливает растущую цепь ЖК с помощью вышеназванных трех ферментов.
Домен III содержит субдомен 7 − ацил-АПБ-гидролаза, тиоэстераза, 33 кДа. Домен III после семь циклов удлинения цепи катализирует высвобождение готового продукта − пальмитата с помощью гидролитического фермента тиоэстеразы.
В настоящее время показано, что многие ферменты организованы в мультиферментные ансамбли. По мере роста наших знаний в деталях, число их увеличивается. Сплайсинг мРНК осуществляется в сплайсосомах, транскрипция осуществляется в транскрипционных комплексах. В синтез белка вовлечено множество ферментов, мРНК и рибосомы, образующие трансляционный комплекс. Деградация белков осуществляется протеосомами.
Кроме того, существуют доказательства мультиэнзимных систем в других путях (обозначенных метаболонами, от слова метаболизм ‒ обмен веществ), таких как гликолиз, цикл лимонной кислоты, синтез нуклеотидов, синтез мочевины, ЦТК, окисление жирных кислот и аминокислотный метаболизм.
studfiles.net
Билет 13.
Виды регуляции активности ферментов:
Аллостерическая модификация.
Активация зимогенов.
Регуляция путем химической модификации.
Аллостерическая модификация.
Этот вид активации характерен для ключевых обменных процессов:
Ключевой фермент начинает (открывает) процесс.
Ферменты, от активности которых зависит скорость процесса, называются регуляторными или аллостерическими.
Особенности аллостерических ферментов.
Регуляторные ферменты – это олиго или мультиферменты.
Регуляторные ферменты имеют аллостерический центр или центры, которые формируются за счет 2 или нескольких протомеров.
Для регуляторных ферментов характерен сигмоидный характер зависимости скорости реакции от концентрации субстрата.
S-образная форма кривой объясняется по-видимому тем, что регуляторный фермент состоит не из одной полипептидной цепи, а из нескольких. Каждый протомер обладает свойством связывать субстрат (есть субстратные и каталитические центры на каждом протомере) с образованием F-S-комплекса. Активные центры конкурируют между собой за субстрат до тех пор пока не произойдет полного насыщения всех активных центров, после этого скорость реакции быстро достгает максимума.
I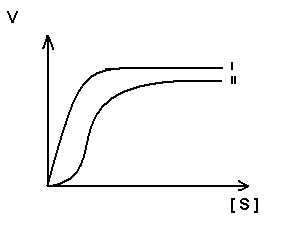 .-
простой фермент
.-
простой фермент
II – регуляторный фермент.
Вещества, связывающиеся с активны центром и изменяющие структуру белковой молекулы фермента, а следовательно и пространственную ориентацию функциональных групп аминокислот, составляющих субстратный и каталитический центры называют модификаторами.
Модификаторы бывают двух видов:
Положительные модификаторы (+) – после присоединения активность ферментов повышается.
Отрицательные модификаторы(-) после взаимодействия с ферментом снижают его активность.
Модификаторы обычно низкомолекулярные вещества. Это субстраты конечные продукты реакции.
Различают три вида регуляторных ферментов:
Гомотропные – для этого класса ферментов субстрат является положительным модулятором или регуляция по принципу прямой положительной связи.
Гетеротропные – активируются другими модификаторами, ингибируются конечным продуктом или регуляция по принципу обратной отрицательной связи.
Гомогетеротропные – для этих ферментов характерно смешанное регулирование и субстратом и другими соединениями.
Билет 14.
Виды регуляции активности ферментов:
Аллостерическая модификация.
Активация зимогенов.
Регуляция путем химической модификации.
Аллостерическая модификация.
Этот вид активации характерен для ключевых обменных процессов:
Ключевой фермент начинает (открывает) процесс.
Ферменты, от активности которых зависит скорость процесса, называются регуляторными или аллостерическими.
Особенности аллостерических ферментов.
Регуляторные ферменты – это олиго или мультиферменты.
Регуляторные ферменты имеют аллостерический центр или центры, которые формируются за счет 2 или нескольких протомеров.
Для регуляторных ферментов характерен сигмоидный характер зависимости скорости реакции от концентрации субстрата.
S-образная форма кривой объясняется по-видимому тем, что регуляторный фермент состоит не из одной полипептидной цепи, а из нескольких. Каждый протомер обладает свойством связывать субстрат (есть субстратные и каталитические центры на каждом протомере) с образованием F-S-комплекса. Активные центры конкурируют между собой за субстрат до тех пор пока не произойдет полного насыщения всех активных центров, после этого скорость реакции быстро достгает максимума.
I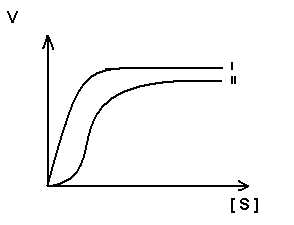 .-
простой фермент
.-
простой фермент
II – регуляторный фермент.
Вещества, связывающиеся с активны центром и изменяющие структуру белковой молекулы фермента, а следовательно и пространственную ориентацию функциональных групп аминокислот, составляющих субстратный и каталитический центры называют модификаторами.
Модификаторы бывают двух видов:
Положительные модификаторы (+) – после присоединения активность ферментов повышается.
Отрицательные модификаторы(-) после взаимодействия с ферментом снижают его активность.
Модификаторы обычно низкомолекулярные вещества. Это субстраты конечные продукты реакции.
Различают три вида регуляторных ферментов:
Гомотропные – для этого класса ферментов субстрат является положительным модулятором или регуляция по принципу прямой положительной связи.
Гетеротропные – активируются другими модификаторами, ингибируются конечным продуктом или регуляция по принципу обратной отрицательной связи.
Гомогетеротропные – для этих ферментов характерно смешанное регулирование и субстратом и другими соединениями.
Активация зимогенов.
Многие пищеварительные ферменты синтезируются в неактивной форме – в виде зимогенов (пепсиноген, трипсиноген и др.).
Эти неактивные зимогены активируются после попадания в ЖКТ, благодаря этому не происходит переваривания клеток, где происходит синтез ферментов. Зимогены не активны, так как содержат дополнительные участки или группы, которые препятствуют доступу субстрата к активному центру. Удаление этой блокирующей группы протеолитическими ферментами приводит к необратимой активации зимогена.
Трипсиноген 
Эндопептидаза расщепляет пептидную связь между лиз в положении 6 и лей в положении 7, в результате отщепляется пептид и образуется активный трипсин.
Схема активации зимогена:
По такой схеме происходит активация целого ряда зимогенов:
Пищеварительные ферменты
Ферменты свертывания крови
Белковые гормоны
Кининовая система, компонент
Фибриллярный белок проколлоген
 коллоген.
коллоген.
Основная черта активации зимогенов заключается в каскадном (последовательном) включении зимогенов с образованием активных ферментов например 12-перстной кишки.
Регуляция путем химической модификации.
По существу это изменение химической структуры активного центра. В некоторых случаях фермент может существовать в клетке в неактивной форме или слабоактивном состоянии, но присоединение фосфатной группы при участии фосфорилирующего фермента, называемого киназой, к аминокислоте вблизи от активного центра, активирует фермент. Такая система может быть возвращена в исходное состояние под действием фермента, отщепляющего фосфатную группу.
Киназа Ф
F (актив)
F(неакт) Ф
Фосфотаза – Ф
Такой механизм очень важен, т.к. активность киназы и фосфатазы могут изменяться под действием гормонов.
Билет15
Уровни организации ферментов в клетке.
Большинство ферментов в клетке имеют сложное строение, т.е. это мультиферменты.
По сложности молекулярная организация мультиферменые системы, осуществляющие последовательные реакции можно разделить на 3 уровня.
I уровень организации
В простейших мультиферментных системах отдельные ферменты растворены в цитозоле и работают независимо друг от друга; предполагается, что во время своего действия они физически друг с другом не связаны. Небольшие молекулы субстрата, характеризующиеся высокой скоростью диффузии, очень быстро находят дорогу от одного фермента к другому:
II уровень организации
Отдельные ферменты, относящиеся к этим системам, могут ассоциировать друг с другом в форме ферментных комплексов.
Например: синтетаза жирных кислот, представляющая систему из семи разных ферментов, молекулы которых объединены в тесно связанный комплекс, который с трудом распадается на отдельные ферменты, причем после диссоциации все они оказываются неактивными (биологически выгодно – сокращается скорость образования конечного продукта).
III уровень организации
Это наиболее высокоорганизованные ферментные системы, связанные с крупными надмолекулярными структурами (мембраны, рибосомы).
Цепь дыхательных ферментов, прикрепленных к мембране митохондрий и представляющих собой по существу часть мембраны. Мембраны могут изменять специфичность ферментов, изменяя пространственную конформацию белковой молекулы фермента (четмертичная структура). Например, АТФ-аза, связанная с мембраной синтезирует АТФ, а свободная разрушает.
Билет 16
Классификация ферментов.
Выделяют шесть классов ферментов:
Гидролазы – ферменты, расщепляющие субстрат при участии молекул воды.
Лиазы – ферменты, расщепляющие молекулы субстрата без участия воды, при этом часто образуются низкомолекулярные продукты – СО2, NH3, Н2О.
Изомеразы – ферменты, вызывающие в молекуле изомерные превращения.
Феразы (трансферазы) – ферменты, переносящие группы от одной молекулы на другую или из одного положения в другое в пределах одной молекулы.
Оксидоредуктазы — ферменты, катализирующие перенос протонов и электронов (т.е.окислительно-восстановительные реакции).
Лигазы(синтетазы) – ферменты, катализирующие синтез крупных молекул из более мелких.
Номенклатура ферментов.
Рабочее название фермента складывается из названия субстрата, типа катализируемой реакции и окончания –аза.
Систематическое название складывается из названия субстратов, названия типа катализируемого химического превращения и окончания –аза.
Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы – уточняет действие фермента, так как указывает на природу химической группы субстрата, атакуемой ферментом. Подкласс делится на подподклассы. Подподклассы конкретизируют действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
I. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Оксидоредуктазы называют также дегидрогеназами или редуктазами. Оксидоредуктазы переносят протоны и электроны. Оксидоредуктазы делят на подклассы:
Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
Коферментами оксидоредуктаз являются:
НАД – никотинамидадениндинуклеотид – содержит витамин В5 – никотинамид.
НАДФ – никотинамидадениндинуклеотид фосфат, содержит витамин В5.
ФАД – флавинадениндинуклеотид, содержит витамин В2 – рибофлавин.
ФМН – флавинмононуклеотид, содержит витамин В2 – рибофлавин.
Оксидоредуктазы катализируют реакции дегидрирования, т.е. отщепление водорода.
Оксидоредуктазы окисляют следующие функциональные группы:
-ОН, -С=О, -NH2
|
Н
Коферменты дегидрогеназ присоединяют протоны и электроны.
НАД-зависимые дегидрогенизы окисляют следующие функциональные группы: спиртовый гидроксил (ОН), альдегидную группу (СОН), аминогруппу (NH2).
НАД-зависимые дегидрогеназы катализируют следующие типы реакций:
Дегидрирование гидроксильных групп
СН3 СООН
| лактатдегидрогеназа |
HC-O С=О
| |
COOH НАД+ НАДН +Н+ СН3
Лактат пируват
Молочная кислота
Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 –
фосфата)
H
|
С=О, СООН
| + НАД+ +
Н3РО4 | +
НАДН + Н+
| +
НАДН + Н+
НC-OH НC-OН
| |
CH2OPO3H2 CH2OPO3H2
Глицеральдегид-3-фосфат 1,3-бифосфоглицериновая кислота
Дегидрирование аминогрупп
СООН СООН
| |
СН2 +НАД СН2
|| + НАДН + Н+
СН2 глутаматдегидрогеназа СН2
| |
СНNH2 С=О
| |
COOH СООН
Глутаминовая кислота
ФАД – зависимые дегидрогеназы окисляют (дегидрируют) следующие функциональные группы: отщепление водорода от групп –СН2— СН2— с образованием двойной связи.
Пример:
СООН СООН
| ФАД ФАДН2 |
СН2 СН
|||
СН2 сукцинатдегидрогеназа СН
| |
СООН СООН
Сукцинат фумарат
2. Анаэробные дегидрогеназы переносят протоны и электроны не на кислород, а на какой-то другой субстрат. Эти ферменты называют также оксигеназами.
II. Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому.
Подклассы трансфераз:
Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту. Катализируют реакцию трансаминирования.
Метилтрансферазы катализируют перенос метильных групп (СН3-).
Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. В подкласс фосфотрансфераз входят киназы, которые используют АТФ в качестве донора фосфатного остатка.
III. Лиазы – ферменты, катализирующие разрыв С-О, С-С, С-N и других связей, а также обратимые реакции отщепления различных групп, без участия воды.
Карбоксилазы – присоединение карбоксильной группы (СО2).
Дегидратазы – отнятие молекулы воды от субстрата.
Альдолазы – расщепляют связь С-С.
Гидратазы – ферменты воды по двойной связи.
IV. Изомеразы – ферменты, катализирующие превращение в пределах одной молекулы.
Катализируют реакции изомеризации. Подклассы: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы.
V. Гидралазы – ферменты, катализирующие разрыв связей в присутствии воды.
VI. Лигазы (синтетазы) – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи АТФ.
studfiles.net
1)Мультиферментные комплексы и изоферменты. Кдз определения активности изоферментов. Энзимодиагностика. Ферментативные лекарственные препараты.
Билет 1.
Мультиферментный комплекс — это комплекс, в котором принимают участие несколько ферментов, при этом продукт предшествующей реакции является субстратом следующей реакции.
Пример:
— дыхательная цепь;
— гликолиз;
— пируватдегидрогеназы;
— синтетаза жирных кислот.
Изоферменты— множественные молекулярные формы данной особи, катализирующие одну и туже реакцию, но отличающиеся друг от друга по физическим и химическим свойствам и разделяющиеся с помощью физико-химических методов.
Примером фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом гексокиназа IV, экспрессируется почти исключительно впечении обладает особыми физиологическими свойствами. Ещё одним примером фермента, имеющего изоферменты, являетсяамилаза— панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Третий пример фермента,креатинфосфокиназа— изотип этого фермента, экспрессируемый всердце, отличается от креатинфосфокиназы скелетных мышц
Энзимодиагностика— определение активности фермента.
Изоферменты ЛДГ органоспецифичны
ЛДГ5 —характерен для ткани, в которой анаэробные процессы.
ЛДГ1— для ткани, в которой аэробные процессы.
В инфаркте миокарда кровь из сердца выходит с ЛДГ1, при заболеваниях печени — ЛДГ4 , ЛДГ5, при патологиях лёгких ЛДГ3.
АСТ — имеет двойную локализацию (митохондрии и цитоплазма)
АЛТ — локализуется только в цитоплазме.
Активность АЛТ увеличивается при заболеваниях печени. Активность АСТ увеличивается при инфаркте миокарда.
Коэфициент Де Ритиса <1 при патологиях печени – АСТ/АЛТ = 1,75
Активность щелочной фосфатазыувеличивается при рахите, механической желтухе и патологии костной ткани.
Активность кислой фосфатазыувеличивается при раке простаты.
Активность амилазыувеличивается при патологии слюнных желез и остром панкреатите.
Также при остом панкреатите Увеличена активность:амилаза крови и мочи, липаза, фосфолипаза, трипсин, химотрипсин.
А при гепатите Увеличена активность:АЛТ, АСТ, ЛДГ4,5, сорбитолдегидрогеназа.
Коэффициент де Ритиса <1
Лечение ферментами
Заместительная терапия
Пепсин — при недостаточной активности пепсина в желудке, при нарушении переваривания белков, синтеза и секреции пепсина
Патогенетическая терапия
Трипсин, химотрипсин— при лечении гнойных ран (в хирургии и стоматологии), способен расщеплять пептидные связи в белках
ДНКаза — используется в лечении вирусных кератитов, гнойных бронхитов
Фибринолизин, стрептокиназа— способны растворять нити фибрина (ликвидация тромбов)
Липаза, гиалуронидаза-используются для лечения спаечной болезни, рубцов
Лизилоксидаза, аспарагиназа— лечение опухолей
2) Окисление жирных кислот. Внутриклеточная локализация и биоэнергетика процесса. Особенности обмена жк с нечетным количеством углеродных атомов и ненасыщенных жк.
Окисление жирных кислот (β-окисление)
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2и воды. Этот путь называетсяβ-окисление.
Включает 4 этапа — первая стадия дегидрирования, стадия гидратации, вторая стадия дегидрирования, тиолазная реакция.
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие изкрови или появляющиеся прилиполизе собственных внутриклеточных ТАГ.
Расчет энергетического баланса β-окисления линолиевой кислоты.
так как число атомов углерода равно 18, то количество молекул ацетил-S-КоАравно 9. Значит при его окислении в ЦТК образуется 9×12=108 молекул АТФ.
исходя из формулы (n/2 — 1) число циклов β-окисления равно 8. При расчете получаем 8×5=40 молекул АТФ.
в кислоте имеются 2 двойные связи. Следовательно, в двух циклах β-окисления не образуется 2 молекулы ФАДН2, что равноценно потере 4 молекул АТФ.
на активацию жирной кислоты тратятся 2 макроэргические связи.
таким образом, энергетический выход 108 + 40 — 4 — 2 =142 молекулы АТФ.
Окисление жирных кислот с нечетным числом углеродных атомов
Жирные кислоты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой образуется пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и образованию сукцинил-SКоА. В этих реакциях участвуютбиотинивитамин В12.
Последние реакции окисления жирных кислот с нечетным числом атомов углерода
Окисление ненасыщенных жирных кислот
При окислении ненасыщенных жирных кислот возникает потребность клетки в дополнительных ферментах изомеразах. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ—в β—положение и переводят природные двойные связи изцис— втранс-положение.
Таким образом, уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД.
studfiles.net
Система мультиферментные — Справочник химика 21
Мультиферментные системы — системы ферментов, катализирующие в интактной клетке последовательные цепи реакций, в которых продукт, полученный при участии первого фермента, оказывается субстратом для следующего и т. д. По сложности молекулярной организации мультиферментные системы можно разделить на три группы. [c.116]Большой интерес с точки зрения обмена веществ представляют митохондрии (см. кн. I, стр. 9). Митохондрии содержат ферменты цикла лимонной кислоты, системы р-окисления жирных кислот, дыхательной цепи и окислительного фосфорилирования, пируватдегидрогеназный комплекс — мультиферментную систему, катализирующую окисление пировиноградной кислоты до ацетил-КоА, и другие ферменты [9]. Локализация ферментных систем в митохондриях показана ниже [c.398]
Мультиферментные системы могут включать в себя до 20 различных ферментов, функционирующих в определенной последовательности. [c.82]
В простейших мультиферментных системах каждый фермент растворен а цитоплазме и работает независимо от других. Очевидно, во время своего действия ферменты физически друг с другом не связаны.. [c.116]
В 60-х годах XX столетия на стыке химии, физики и биологии сформировался мощный фундамент, создавший условия для развития новой науки — супрамолекулярной химии. Супрамолекулярную химию можно определить как химию молекулярных ансамблей и межмолекулярных связей. Одними из наиболее широко изучаемых объектов супрамолекулярной химии являются природные и синтетические Н2Р, МР и их разнообразные производные. Так, модельные синтетические порфирины позволяют ученым справиться с глобальной задачей биохимии — выяснением физико-химической природы процессов, благодаря которым осуществляется самосборка молекулярных ансамблей в биологических системах (мультиферментные ансамбли, органеллы клеток и др.). С другой стороны, благодаря имеющимся в настоящее время теоретическим разработкам стало возможным проводить целенаправленный синтез порфиринов с заданными практическими свойствами. [c.202]
Гетерогенность разных видов и клонов бактерий по магнитной восприимчивости определяется количественным соотношением в них диа- и парамагнитных соединений (Павлович, 1984, 1985 Павлович, Галлиулин, 1986 Галлиулин, 1986). Развивающиеся микроорганизмы не находятся в строгом равновесии с окружающей средой и являются неравновесными открытыми системами, т. е. в течение определенного времени в химическом составе клеток каких-либо изменений не происходит, хотя клеточные вещества постоянно и очень интенсивно обновляются. Кажущееся постоянство химического состава объясняется тем, что процессы обмена веществом и энергией между питательной средой и микробными клетками уравновешены. Отличаясь устойчивостью, метаболизм микробов в то же время характеризуется и значительной изменчивостью. Скорость катаболизма и биосинтеза структурных элементов в каждый момент определяется потребностями клеток, которые обычно обеспечиваются минимальными количествами вещества, что обусловлено наличием тонких механизмов регуляции обмена веществ и энергии. Самые простые из них, влияющие на скорость ферментативной реакции у бактерий, вызывают изменения концентрации водородных ионов, субстрата, появление ингибиторов или, наоборот, активаторов и т. д. Более сложным уровнем регуляции может быть ингибирование мультиферментных реакций конечным продуктом определенной метаболической последовательности регуляторных ферментов, катализирующих начальные звенья цепи биохимической реакции. Клеточный метаболизм, наконец, детерминируется генотипом, поэтому скорость синтеза ферментов и течение реакций у микроорганизмов высокоспецифичны. [c.81]
Метаболические пути представляют собой последовательности реакций, катализируемых мультиферментными системами [c.378]
Ферменты-это простейшие единицы метаболической активности каждый из них катализирует какую-нибудь одну химическую реакцию. Метаболизм, однако, лучше рассматривать исходя из представления о мультиферментных системах, каждая из которых катализирует последовательные стадии данного метаболического пути. Такие мультиферментные системы могут включать от 2 до [c.378]
Каждая из главных стадий катаболизма ил анаболизма данной биомолекулы катализируется мультиферментной системой. Последовательности химических превращений на каждом из центральных метаболических путей в принципе у всех живых форм едины. Так, например, расщепление D-глюкозы протекает почти у всех живых организмов одинаково, т. е. через те же реакции и с образованием одних и тех же промежуточных продуктов. [c.383]
Мультиферментная система. Последовательность связанных между собой ферментов, участвующих в данном метаболическом пути. [c.1014]
Эта изящная простая система имеет одно очевидное преимущество. Так как константы равновесия для реакций переаминирования близки к 1, скорости этих реакций будут зависеть от скоростей удаления образующихся продуктов. Одним из продуктов обычно бывает глутамат, дальнейший обмен которого жестко
www.chem21.info
Интернет-курс Ёршикова С.М. / 4 / 4
Локализация ферментов в клетке
В клеточном содержимом ферменты распределены не хаотически, а строго упорядоченно. При помощи внутриклеточных мембран клетка разделена на отсеки или компартменты (рисунок 4.1). В каждом из них осуществляются строго определенные биохимические процессы и сосредоточены соответствующие ферменты или полиферментные комплексы. Вот несколько характерных примеров.
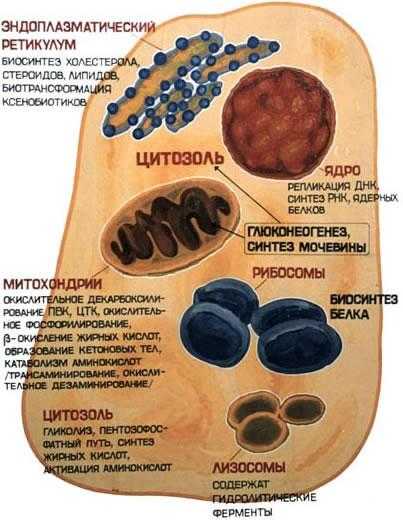
Рисунок 4.1. Внутриклеточное распределение ферментов различных метаболических путей.
В лизосомах сосредоточены преимущественно разнообразные гидролитические ферменты. Здесь протекают процессы расщепления сложных органических соединений на их структурные компоненты.
В митохондриях находятся сложные системы окислительно-восстановительных ферментов.
Ферменты активирования аминокислот распределены в гиалоплазме, но они же есть и в ядре. В гиалоплазме присутствуют многочисленные метаболоны гликолиза, структурно объединенные с таковыми пентозофосфатного цикла, что обеспечивает взаимосвязь дихотомического и апотомического путей распада углеводов.
В то же время ферменты, ускоряющие перенос аминокислотных остатков на растущий конец полипептидной цепи и катализирующие некоторые другие реакции в процессе биосинтеза белка, сосредоточены в рибосомальном аппарате клетки.
В клеточном ядре локализованы в основном нуклеотидилтрансферазы, ускоряющие реакцию переноса нуклеотидных остатков при новообразовании нуклеиновых кислот.
Распределение ферментов по субклеточным органеллам изучают после предварительного фракционирования клеточных гомогенатов путем высокоскоростного центрифугирования, определяя содержание ферментов в каждой фракции.
Локализацию данного фермента в ткани или клетке часто удается установить in situ гистохимическими методами («гистоэнзимология»). Для этого тонкие (от 2 до 10 мкм) срезы замороженной ткани обрабатывают раствором субстрата, к которому специфичен данный фермент. В тех местах, где находится фермент, образуется продукт катализируемой этим ферментом реакции. Если продукт окрашен и нерастворим, он остается на месте образования и позволяет локализовать фермент. Гистоэнзимология дает наглядную и в известной мере физиологичную картину распределения ферментов.
Ферментные системы ферментов, сосредоточенные во внутриклеточных структурах, тонко координированы друг с другом. Взаимосвязь катализируемых ими реакций обеспечивает жизнедеятельность клеток, органов, тканей и организма в целом.
При исследовании активности различных ферментов в тканях здорового организма можно получить картину их распространения. Оказывается, что некоторые ферменты широко распространены во многих тканях, но в разных концентрациях, а другие очень активны в экстрактах, полученных из одной или нескольких тканей, и практически отсутствуют в остальных тканях организма.
Рисунок 4.2. Относительная активность некоторых ферментов в тканях человека, выраженная в процентах от активности в ткани с максимальной концентрацией данного фермента (Мосс, Баттерворт, 1978).
Изоферменты (изозимы)
Изоферментами или изозимами называют множественные формы ферментов, которые существуют у одного и того же вида, в одной и той же ткани, и даже в одной и той же клетке. Все эти формы фермента катализируют одну и ту же реакцию, но различаются по своим кинетическим свойствам, а также по первичной структуре. Изоферменты играют регуляторную роль в обмене веществ и позволяют метаболизму в разных тканях лучше приспосабливаться к действию внутренних и внешних факторов.
Примером фермента, у которого были обнаружены такие формы, может служить лактатдегидрогеназа (L-лактат:НАД+-оксидоредуктаза, КФ 1.1.1.27), катализирующая обратимую окислительно-восстановительную реакцию:
Лактатдегидрогеназа (ЛДГ) присутствует в тканях животных в виде пяти разных изоферментов, которые различаются на уровне четвертичной структуры. Молекула ЛДГ состоит из четырех протомеров двух типов, Н (от англ. heart — сердце) и М (от англ. muscle — мышца), которые различаются по аминокислотному составу и последовательности аминокислот. Каталитической активностью обладает только тетрамерная молекула.
Протомеры могут быть скомпонованы следующими способами:
Изофермент | HHHH | HHHM | HHMM | HMMM | MMMM |
Обозначение | ЛДГ1 | ЛДГ2 | ЛДГ3 | ЛДГ4 | ЛДГ5 |
Изоферменты сывороточной лактатдегидрогеназы могут быть обнаружены с помощью электрофореза при рН 8,6. При данном значении рН изозимы несут разный заряд и распределяются на электрофореграмме в пяти разных местах. Наибольшим отрицательным зарядом обладает изозим ЛДГ1.
Распределение изоферментов ЛДГ (изоферментный спектр) в тканях также отличается. Так, изоформа ЛДГ, содержащая четыре М-субъединицы, преобладает в печени и скелетной мышце, а изоформа, состоящая из четырех Н-субъединиц, преобладает в миокарде (рисунок 4.3).
Рисунок 4.3. Относительное содержание изоферментов ЛДГ (в процентах от суммарной активности) в некоторых тканях человека (Мосс, Баттерворт, 1978).
Мультиферменты
Мультиферменты (мультэнзимы) — надмолекулярные комплексы, в состав которых входят ферменты, катализирующие последовательные стадии превращения субстрата.
Например, для в реакциях превращения метаболита A в метаболит D :
комплекс ферментов Е1, Е2, Е3 является мультиферментом. Объединение нескольких ферментов в один комплекс имеет важное преимущество: резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться от фермента к ферменту. Поэтому суммарная скорость таких метаболических путей довольно высока.
Примером мультэнзима может служить пируватдегидрогеназный комплекс, находящийся в митохондриях и катализирует последовательные реакции окислительного декарбоксилирования пирувата:
Пируватдегидрогеназный комплекс состоит из трёх ферментов: пируватдекарбоксилазы, трансацилазы и дигидролипоилдегидрогеназы.
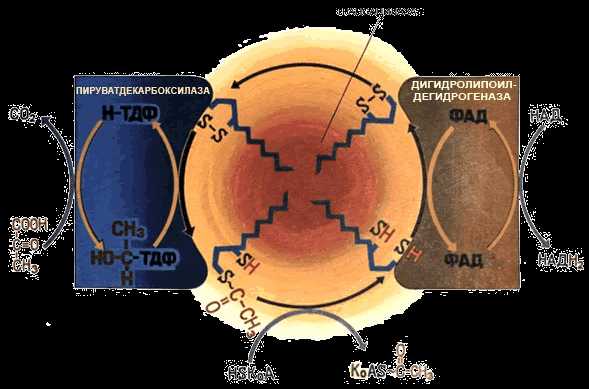
В промежуточных реакциях участвует пять коферментов:
тиаминдифосфат;
липоевая кислота;
коэнзим А;
ФАД;
НАД.
Регуляторным ферментом комплекса является пируватдекарбоксилаза, активность которой (и всего комплекса в целом) снижается при высокой концентрации АТФ в клетке.
studfiles.net
| Обратная связь ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса — ваш вокал Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими Целительная привычка Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Тренинг уверенности в себе Вкуснейший «Салат из свеклы с чесноком» Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Как слышать голос Бога Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека — Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д. Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу. Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар. | Примерами полифункциональных конъюгатов являются комплекс синтазы жирных кислот (рис. 4.1.5) и КАД – комплекс, объединяющий первые три энзиматические активности. участвующие в метаболизме пиримидинов.
Рис.4.1.5. Комплекс синтазы жирных кислот млекопитающих
Каждая субъединица этого конъюгата включает три различных домена и восемь субдоменов. Домен I состоит из трех субдоменов: субдомен 1 − АПБ-S-ацетилтрансфераза, 60 кДа; субдомен 2 − АПБ-S-малонилтрансфераза, 23 кДа; субдомен 3 − β-кетоацил-АПБ-синтаза (конденсирующий фермент, 45 кДа). Домен I катализирует присоединение субстратов ацетил-СоА и малонил-СоА ацетилтрансферазой и малонилтрансферазой соответственно и последующую конденсацию обоих партнеров β-кетоацил-синтазой. Домен II также состоит из трех субдоменов: субдомен 4 − β-кетоацил-АПБ-редуктаза, 21 кДа; субдомен 5 − β-гидроксиацил-АПБ-дегидратаза, 50 кДа; субдомен 6 − еноил-АПБ-редуктаза, 14 кДа. К субдомену 4 присоединен ацилпереносящий белок (АПБ), 15 кДа. Домен II восстанавливает растущую цепь ЖК с помощью вышеназванных трех ферментов. Домен III содержит субдомен 7 − ацил-АПБ-гидролаза, тиоэстераза, 33 кДа. Домен III после семь циклов удлинения цепи катализирует высвобождение готового продукта − пальмитата с помощью гидролитического фермента тиоэстеразы. В настоящее время показано, что многие ферменты организованы в мультиферментные ансамбли. По мере роста наших знаний в деталях, число их увеличивается. Сплайсинг мРНК осуществляется в сплайсосомах, транскрипция осуществляется в транскрипционных комплексах. В синтез белка вовлечено множество ферментов, мРНК и рибосомы, образующие трансляционный комплекс. Деградация белков осуществляется протеосомами. Кроме того, существуют доказательства мультиэнзимных систем в других путях (обозначенных метаболонами, от слова метаболизм ‒ обмен веществ), таких как гликолиз, цикл лимонной кислоты, синтез нуклеотидов, синтез мочевины, ЦТК, окисление жирных кислот и аминокислотный метаболизм. Метаболоны Одним из элементов пространственной организации ферментов является метаболон – надмолекулярный комплекс, объединяющий ферменты определенного метаболического пути. Предположение о существовании такого комплекса – гликолитического метаболона было высказано еще в 1956 г. Грином с соавт., изучавшими активность гликолитических ферментов мембранных фракций эритроцитов быка. Метаболоны формируются на подложках, в роли которых могут выступать биологические мембраны, структурные белки мышц и некоторые клеточные структуры. Подложка содержит белок, который выполняет якорные функции. Фиксация на подложке обеспечивает однозначность сборки комплекса, а также создает центр управления, чувствительный к новым регуляторным факторам, в первую очередь к вторичным мессенджерам. Рассмотрим образование комплекса гликолитических ферментов в эритроцитах. По мнению Б.И. Курганова с соав. роль якорной площадки, обеспечивающей фиксацию метаболона на мембране эритроцитов, играет белок полосы 3 – интегральный мембраносвязанный гликопротеин с молекулярной массой 93 кДа, основной функцией которого является транспорт анионов через мембрану эритроцитов. Существует в димерной форме, но при образовании метаболона образует замкнутую структуру, а именно тримера димеров, т.е. гексамер (рис. 4.1.6).
Рис. 4.1.6. Гликолитический метаболон (комплекс ферментов гликолиза в эритроцитах)
В сборке метаболона на белке полосы 3 ключевую роль играет фермент фосфофруктокиназа (ФФК), самого большого по размерам гликолитического фермента. Стехиометрия связывания фермента такова: одна тетрамерная молекула ФФК связывается димером БП3. Таким образом, гексамер БП3 должен связывать 3 молекулы ФФК. Далее к ФФК присоединяется альдодаза и глицеральдегид-3-фосфатдегидрогеназа (Г3ФД). Молекула эритроцитарной ФФК является тетрамером, но в отличие от мышечного фермента, построенного из идентичных субъединиц с молекулярной массой 85 кДа, фермент из эритроцитов содержит одну субъединицу мышечного типа (М) и три субъединицы (Е) с молекулярной массой 80 кДа и с аминокислотным составом, отличающимся от такового для субъединицы мышечного типа (тетрамер МЕ3). Принцип построения метаболона таков: ферменты, связанные общими метаболитами или коферментами, находятся в метаболоне рядом друг с другом. Такое расположение ферментов метаболического пути, во-первых, может обеспечить эффективное продвижение метаболических интермедиатов по конвейеру активных центров в микрокомпартменте, образующемся при сборке метаболона. Во-вторых, благодаря сближению дегидрогеназ, NADH, образующийся в ходе реакции, катализируемой Г3ФД, может прямо реокисляться до NAD+ с участием глицерол-3-фосфатдегидрогеназы и лактатдегидрогеназы (ЛДГ) без выхода кофермента из компартмента. Аналогично, благодаря сближению фосфотрансфераз, часть АТР, продуцируемого фосфоглицераткиназой и пируваткиназой, может использоваться ФФК. Принцип построения метаболона таков: ферменты, связанные общими метаболитами или коферментами, находятся в метаболоне рядом друг с другом. Такое расположение ферментов метаболического пути, во-первых, может обеспечить эффективное продвижение метаболических интермедиатов по конвейеру активных центров в микрокомпартменте, образующемся при сборке метаболона. Во-вторых, благодаря сближению дегидрогеназ, NADH, образующийся в ходе реакции, катализируемой Г3ФД, может прямо реокисляться до NAD+ с участием глицерол-3-фосфатдегидрогеназы и лактатдегидрогеназы (ЛДГ) без выхода кофермента из компартмента. Аналогично, благодаря сближению фосфотрансфераз, часть АТР, продуцируемого фосфоглицераткиназой и пируваткиназой, может использоваться ФФК. Гликолитический метаболон содержит тройной набор ферментов. Молекулярная масса его составляет 4х106 Да. В метаболон, изображенный на рис.4.1.6. не включен фермент гексокиназа, но она контактирует с метаболической системой. Это физиологически выгодно, поскольку в этом случае возможно прямое использование АТР, продуцируемое гликолитическим комплексом. Сборка комплекса гликолитических ферментов приводит к образованию микрокомпартмента, в котором гликолитический процесс может протекать без выхода гликолитических интермедиатов в объем. Микрокомпартмент состоит из трех отсеков, каждый из которых содержит активные центры всех гликолитических ферментов и обеспечивает, таким образом, полную химическую трансформацию поступающего в компармент глюкозо-6-фосфата. Метаболон – это мобильная структура, он находится в равновесии со свободными ферментами. Согласно данным Дженкинса с соавт. в интактных эритроцитах человека около 50% ФФК и 40% альдолазы связаны с мембраной. Количество полноценных комплексов, формирование которых начинается с посадки ФФК на якорную площадку мембраны эритроцитов, зависит прежде всего от соотношения между концентрацией ФФК и других белков, способных конкурировать с ФФК за связывание на белке полосы 3. К числу таких белков относится не только альдолаза и Г3ФД, но и гемоглобин. Дезоксиформа гемоглобина обладает более высоким сродством к БП3, чем оксигемоглобин, и поэтому можно ожидать, что при снижении количества кислорода в эритроцитах количество адсорбированных гликолитических ферментов будет уменьшаться. ЛЕКЦИЯ 4.2 |
megapredmet.ru

 коллоген.
коллоген.