Лимонная кислота: свойства и все характеристики
Характеристики и физические свойства лимонной кислоты
Рис. 1. Строение молекулы лимонной кислоты.
Таблица 1. Физические свойства лимонной кислоты.
|
Молекулярная формула |
(HOOCCH2)2C(OH)COOH |
|
Молярная масса |
192 |
|
Плотность (20oС), г/см3 |
1,665 |
|
Температура плавления, oС |
153 |
|
Растворимость в воде (20oС), г/100 мл |
133 |
Получение лимонной кислоты
Лимонная кислота содержится в различных растениях. Она была впервые выделена К. В. Шееле из лимонного сока, где её содержание достигает 10%. В промышленности лимонную кислоту получают путем лимоннокислого брожения отходов сахарного производства с помощью плесневого грибка Aspergillius niger.
Химические свойства лимонной кислоты
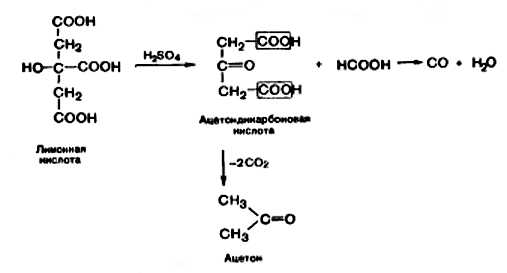
Под действие серной кислоты лимонная кислота как α-гидроксикислота разлагается с образованием ацетондикарбоновой и муравьиной кислот. Ацетондикарбоновая кислота легко подвергается декарбоксилированию с образованием ацетона. Муравьиная кислота в этих условиях разлагается на монооксид углерода и воду.
Применение лимонной кислоты
Лимонная кислота нашла широкое применение в пищевой промышленности (производство плавленых сыров, напитков и т.д.), при производстве косметики, цемента, а также в нефтехиии.
Соли лимонной кислоты называются цитратами. Цитрат натрия применяется для консервации донорской крови. Противосвертывающее действие основано на том, что цитрат натрия связывает участвующие в процессе свертывания ионы кальция в нерастворимый цитрат кальция.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Растворимость лимонной кислоты — Справочник химика 21
С. Лимонная кислота легко растворима в воде. [c.301]Лимонная кислота — бесцветные кристаллы, легко растворимые в воде. [c.164]
Растворите в одной пробирке несколько кристалликов лимонной кислоты (48), в другой — виннокаменной кислоты (66). Нейтрализуйте (по лакмусу) кислоты 10%-ным NH OH (3), затем добавьте немного раствора хлорида кальция (37). В пробирке с виннокаменной кислотой вьшадает осадок тартрата кальция, вторую пробирку с раствором нейтрализованной лимонной кислоты кипятят 2—3 мин при кипячении выпадает осадок. Различная растворимость кальциевых солей позволяет различить виннокаменную и лимонную кислоты. Уравнения проведенных реакций запишите в тетрадь.
Состав растворителя, вес. % Растворимость лимонной кпслоты, вес. % Состав растворителя, БОС. % Растворимость лимонной кислоты, вес. % [c.1140]
Из солей лимонной кислоты интересен лимоннокислый кальций, лучше растворимый в холодной, чем в горячей воде. [c.302]
В пробирку вносят несколько кристаллов лимонной кислоты и растворяют в дистиллированной воде. Раствор нейтрализуют 10%-ным раствором аммиака и к полученному нейтральному раствору добавляют 0,5 мл 5 %-ного раствора хлорида кальция. При кипячении раствора выпадает осадок, растворимый в холодной воде. [c.63]
Лимонная кислота может существовать в форме одноводного кристаллогидрата (мол. вес 192) и представляет собой бесцветные кристаллы, хорошо растворимые в воде, спирте и эфире Тпл 70° С, плотность 1,54. [c.103]
Опыт 2. Действие кипело к. Для формирования у учащихся умений правильно нагревать растворы рекомендуется при изучении растворимости газов в воде показывать следующий опыт. В небольшой стакан (рис. 3) налить 5 %-ный раствор питьевой соды и бросить туда немного лимонной кислоты до прекращения вскипания жидкости от очередной порции. Полученную газированную воду налить в узкую кювету и опустить в нее привязанную на проволоке капиллярную трубку с запаянным концом (можно использовать кусок изоляции от тонкого провода). Трубка вводится так, чтобы она была целиком видна. Откры- [c.157]
Обработка композициями на основе комплексонов также обеспечивает перевод оксидов железа в устойчивые, хорошо растворимые в воде комплексы. Смесь комплексона (этилендиаминтетрауксусной кислоты — ЭДТК или ее динатриевой соли — трилона Б) с лимонной кислотой (5 г/кг) и восстановителем (0,5 г/кг) обладает в 1,5—2 раза более высокой емкостью по железу (по сравнению с суммой железоемкостей отдельных компонентов). При указанных концентрациях реагентов скорость коррозии металла в промывочном растворе составляет 20—30 г/(м2-ч).
ФОСФОРНЫЕ УДОБРЕНИЯ — минеральные удобрения, содержащие фосфор — один из основных питательных элементов для растений. К Ф. у. относятся суперфосфат, двойной суперфосфат, преципитат, аммофос, диаммофос, орто-и метафосфаты калия, томасшлак, фосфоритная и костная мука и т. д. Сырьем для производства Ф. к. служат апатиты, фосфориты, кости, серная и фосфорная кислоты. Содержание фосфора в удобрениях вычисляют в процентах Р2О5. Агрохимическая характеристика Ф. у. основана на их растворимости. По степени растворимости Ф. у. делятся на водорастворимые, цитратно-растворимые (растворимые в реактиве Петермана — аммиачном растворе цитрата аммония), лимонно-растворимые (растворимые в 2%-ном растворе лимонной кислоты). Наиболее распространены водорастворимые Ф. к., которые можно вносить во все почвы, под все культуры. [c.266]
Растворимость 20 г продукта в 100 г воды при температуре не ниже 20 °С Полная Кислотность титруемая в пересчете на лимонную кислоту, г/100 г СВ 1,5—3 [c.157]
Осажденные бораты магния содержат около 9% (мае.) бора (растворимого в 2%-ной лимонной кислоте, но нерастворимого в воде) н приблизительно 32% (мае.) оксида магния. [c.311]
В результате формируется сетчатая пространственная структура, способствующая образованию растворимого в воде комплекса с иодом. В случае отсутствия лимонной кислоты комплекс с иодом растворим в воде. [c.42]
Применяя эту реакцию при анализе объектов, содержащих железо, его нужно предварительно окислить до Fe Дело в том, что Ре -ионы, образующиеся обычно при растворении исследуе-N ого образца в кислотах, с диметилглиоксимом дают растворимое Е воде комплексное соединение красного цвета. При этом растворимость осадка диметилглиоксимата никеля увеличивается, поскольку часть диметилглиоксима связывается железом. Так как осаждение ведут, прибавляя в раствор, содержащий никель и ди- етилглиоксим, аммиак, то должны отсутствовать также и Fe +-ионы, образующие в этих условиях осадок Ре(ОН)з. Поэтому Fe + предварительно маскируют прибавлением достаточного количества винной или лимонной кислоты при этом образуются прочные комплексы железа (ИI).
Превращение фосфатов в растворимое (в 2%-ноп лимонной кислоте) состояние связано с образованием аморфного стекловидного расплава. [c.262]
Лимонная кислота может существовать как в форм(>. пирата, содержащего молекулу воды, так и в безводном виде. Безводн 1я кислот тлавится при 153°, гидрат — уже около 100°. В воде растворима очень хорощо. [c.412]
Большие количества третичного спирта можно получать (и были уже получены) из крекинг-газа. Однако- при изьюкании возможностей использования сравнительно больших количеств этого продукта возникают значительные затруднения. Насколько известно, третичный бутиловый спирт, как таковой, не нашел широкого применения в химической промышленности, хотя его -можно 1 спользовать для очищения некоторых веществ (например оксикислот) перекристаллизацией из горячих растворов. Для этой цели требуется растворитель, в котором растворимость, будучи низкой при обьжновенных температурах, быстро бы возрастала с повышением температуры. Сравнение влияния температуры на растворимость лимонной кислоты в воде, этиловом спирте и третичном бутиловом спирте показывает, что последний является наилучшим растворителем для перекристаллизации этой Кислоты [c.432]
По химической природе является трехосновной четырехатомнрй кислотой и имеет разветвленную цепь углеродных атомов. Кристаллизуется с 1 молекулой HjO в виде гидрата плавится при 70—75° С, безводная — при 153° С. Хорошо растворима в воде. Как показывает ее название, лимонная кислота была выделена из лимонов, в которых она содержится в большом количестве (в незрелых — до 6—7%). Она встречается также и во многих других растениях в соке винограда, свеклы, малины, вишни, клюквы и др. [c.213]
Основные металлургические шлаки являются побочными продуктами при получении стали по томасовскому или основному мартеновскому способу. Они соответственно называются томас-шлаком и основным мартеновским шлаком. Эти удобрения содержат фосфат, растворимый в 2%-но
www.chem21.info
| Температура | гр/100,00 гр воды | гр/100,00 гр этанола | гр/100,00 гр метанола | гр/100,00 гр диэтилового эфира | гр/100,00 гр ДМСО | гр/100,00 гр этилацетата | гр/100,00 гр амилацетата | гр/100,00 гр муравьиной кислоты 95% | гр/100,00 гр пропанола | гр/100,00 гр диоксана | гр/100,00 гр амилового спирта | гр/100,00 гр трихлорэтилена | гр/100,00 гр хлороформа | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (безводный) | (моногидрат) | (безводный) | (моногидрат) | (моногидрат) | (безводный) | (моногидрат) | (безводный) | (моногидрат) | (моногидрат) | (безводный) | (моногидрат) | (безводный) | (моногидрат) | (безводный) | (моногидрат) | |
| 0°C 273,15 K | 32,66 | |||||||||||||||
| 10°C 283,15 K | 35,02 | 117,4 | ||||||||||||||
| 15°C 288,15 K | ~47,1 | ~131 | 0,012 | |||||||||||||
| 20°C 293,15 K | 59,2 | 145,1 | 200 | 40 | 12,25 | 62,6 | ||||||||||
| 25°C 298,15 K | ~163 | 62 | 99,2 | 1,05 | 2,25 | 5,6 | 6,36 | 35,9 | 18,25 | 0,007 | ||||||
| 30°C 303,15 K | 180,1 | |||||||||||||||
| 40°C 313,15 K | 218,5 | |||||||||||||||
| 50°C 323,15 K | 243,6 | |||||||||||||||
| 60°C 333,15 K | 277,4 | |||||||||||||||
| 70°C 343,15 K | 320,2 | |||||||||||||||
| 80°C 353,15 K | 371,7 | |||||||||||||||
| 90°C 363,15 K | 437,6 | |||||||||||||||
| 100°C 373,15 K | 525,0 | |||||||||||||||
ru.crystalls.info
Лимонная кислота — это… Что такое Лимонная кислота?
Лимо́нная кислота́ (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C 6H8O7) — кристаллическое вещество белого цвета, температура плавления 153 °C, хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая трёхосновная кислота. Соли и эфиры лимонной кислоты называются цитратами.
Открытие
Впервые лимонная кислота была выделена в 1784 году из сока недозрелых лимонов шведским аптекарем Карлом Шееле.
Биохимическая роль
Лимонная кислота, являясь главным промежуточным продуктом метаболического цикла трикарбоновых кислот, играет важную роль в системе биохимических реакций клеточного дыхания множества организмов.
Нахождение в природе
Поскольку цикл трикарбоновых кислот используют при дыхании все аэробные организмы, то лимонная кислота в определённой концентрации содержится в большинстве прокариотов и почти во всех эукариотах (преимущественно в митохондриях). В наибольшей концентрации она содержится в ряде растений: в ягодах, плодах цитрусовых, хвое, стеблях махорки, особенно много её в китайском лимоннике и недозрелых лимонах.
Свойства
Кристаллы лимонной кислоты, подсвеченные поляризованным светом, в двухсоткратном увеличенииСлабая трёхосновная кислота в растворе подвергается электролитической диссоциации. Константы диссоциации (в воде при 18 °C):
- К1 = 8,4·10−4
- K2 = 1,7·10−5
- K3 = 4·10−7
Проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175 °C разлагается на углекислый газ и воду. В водном растворе образует хелатные комплексы с ионами кальция, магния, меди, железа и др.
Промышленное получение
Лимонную кислоту раньше получали из сока лимона и биомассы махорки. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ (меласса) промышленными штаммами плесневого гриба Aspergillus niger.
Применение
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), для производства напитков, сухих шипучих напитков.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса).
В косметике используется как регулятор кислотности, буфер, хелатирующий агент, для шипучих композиций (ванны).
В нефтяной промышленности при бурении нефтяных и газовых скважин используется для нейтрализации цемента в растворе (например, после срезки с цементного моста). Лимонная кислота удаляет ионы кальция из бурового раствора.
При приёме внутрь в небольших дозах (например, при употреблении цитрусовых) активирует цикл Кребса, что способствует ускорению метаболизма. При похмелье рассматривается токсикологами как мера химической дезинтоксикации.[источник не указан 283 дня]
Влияние на здоровье
Лимонная кислота содержится в организме человека.
Сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При единовременном употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании сухой лимонной кислоты — раздражение дыхательных путей.[1]
LD50 для крыс перорально: 3000 мг/кг.
В конце 1970-х годов в Западной Европе получила распространение мистификация, известная как «вильжюифский список», в котором лимонная кислота была названа сильным канцерогеном.[2]
Примечания
Ссылки
dic.academic.ru
Лимонная кислота Википедия
| Лимонная кислота | |
|---|---|
| Общие | |
| Систематическое наименование | 2-гидроксипропан-1,2,3-трикарбоновая кислота |
| Традиционные названия | Лимонная кислота |
| Хим. формула | (HOOCCH2)2C(OH)COOH |
| Физические свойства | |
| Молярная масса | 192,1 г/моль |
| Плотность | 1,665 г/см³ |
| Термические свойства | |
| Т. плав. | 153 °C |
| 175 °C | |
| Химические свойства | |
| pKa | 3,14[1] |
| Растворимость в воде | 133 г/100 мл |
| Классификация | |
| Рег. номер CAS | 77-92-9 |
| PubChem | 311 |
| Рег. номер EINECS | 201-069-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E330 |
| RTECS | GE7350000 |
| ChEBI | 30769 |
| Номер ООН | 1789 |
| ChemSpider | 305 |
| Безопасность | |
| H-фразы | h419 |
| P-фразы | P264, P280, P305+P351+P338, P337+P313 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Лимо́нная кислота́ (2-гидроксипропан-1,2,3-трикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) HOOC-CH2-C(OH)COOH-CH2-COOH или (НООССН2)2С(ОН)СООН — трёхосновная карбоновая кислота. Кристаллическое вещество белого цвета, температура плавления 153 °C. Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая кислота. Соли и эфиры лимонной кислоты называются цитратами.
Открытие
Открытие лимонной кислоты приписывают арабскому алхимику Джабиру ибн Хайяну. Выделить её впервые удалось шведскому аптекарю Карлом Шееле. В 1784 году он осадил её в виде цитрата кальция из лимонного сока. В 1838 году Юстус фон Либих установил, что в молекуле лимонной кислоты присутствует одна гидроксильная группа и три карбоксильные группы. Собственно лимонная кислота была получена из цитрата кальция в 1860 году в Англии[2][3].
Физические свойства
Кристаллы лимонной кислоты под микроскопом между скрещённых поляроидов. Увеличение 200х.Лимонная кислота представляет собой кристаллическое вещество без цвета и запаха, имеющее сильный кислый вкус. Ниже 36,6 °С она кристаллизуется из водного раствора в виде моногидрата, который имеет относительную плотность 1,542 и плавится при 100 °С. Его кристаллы имеют орторомбическую сингонию. Безводная лимонная кислота имеет относительную плотность 1,665 и плавится при 153 °С. Её кристаллы имеют моноклинную сингонию. Перевести моногидрат в безводную форму можно в вакууме в присутствии серной кислоты. Безводная форма поглощает влагу из воздуха[4].
Химические свойства
При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту, а при сухой перегонке отщепляет воду и декарбоксилируется, одновременном образуя ацетон, и даёт ангидриды итаконовой и цитраконовой кислот. Окисление перманганатом калия при 35 °С приводит к ацетондикарбоновой кислоте, а при 85 °С — к щавелевой кислоте. При плавлении с гидроксидом калия лимонная кислота образует щавелевую кислоту и уксусную кислоту[5].
Лимонная кислота является слабой трёхосновной кислотой, образует три ряда солей, в растворе подвергается многоступенчатой электролитической диссоциации. Константы диссоциации (в воде при 18 °C) равны:
- К1 = 8,2⋅10−4;
- K2 = 1,8⋅10−5;
- K3 = 4,0⋅10−6[4].
В водном растворе лимонная кислота образует хелатные комплексы с ионами кальция, магния, меди, железа и другими. Иногда в комплексообразовании участвует не одна молекула лимонной кислоты[5].
Лимонная кислота образует сложные эфиры со спиртами в присутствии обычных кислотных катализаторов (серная кислота, пара-толуолсульфокислота, ионообменные смолы) либо без катализатора (с высококипящими спиртами). Триметилцитрат, триэтилцитрат и трибутилцитрат используются в качестве пластификаторов. С двухатомными и многоатомными спиртами лимонная кислота образует полиэфиры[6].
Гидроксильная группа лимонной кислоты при обработке хлорангидридами и ангидридами кислот может участвовать в образовании сложных эфиров, а также взаимодействует с эпоксидами[6].
Получение
В промышленности
С середины 1800-х гг. лимонную кислоту получали исключительно из сока несозревших лимонов, смешивая его с негашёной известью и осаждая таким образом цитрат кальция. Обработка последнего серной кислотой приводила к образованию осадка сульфата кальция, а из надосадочной жидкости выкристаллизовывали лимонную кислоту. Выход такого процесса составлял 2–3 мас. % от массы фрукта[6]. В литературе упоминается, что лимонную кислоту в виде соли развозили из Сицилии и Южной Италии к местам назначения (преимущественно в Англию, Францию и США), а саму кислоту выделяли уже на месте[7].
В 1893 году был обнаружен первый ферментативный метод получения лимонной кислоты: немецкий химик и миколог Карл Вемер использовал для этого плесневые грибы пеницилл. Однако внедрить метод в промышленность не удалось из-за проблем с очисткой продукта. Успех пришёл лишь в 1919 году, когда подобный процесс был организован в Бельгии. Перевес в пользу ферментативных подходов произошёл после Первой мировой войны, когда возникли проблемы с поставкой лимонной кислоты из Италии, а мировые потребности всё более нарастали. В 1923 году фирма Пфайзер коммерциализировала открытый ранее Джеймсом Карри и Чарлзом Том процесс превращения углеводов в лимонную кислоту под действием плесневых грибов рода Aspergillus niger в присутствии небольшого количества неорганических солей[7].
По состоянию на начало ХХІ в. весь объём промышленной лимонной кислоты производится биосинтезом. В качестве сырья используют гидролизат кукурузы (в Северной и Южной Америке и Европе), гидролизат маниока, батата и кукурузы (в Азии), кристаллическую сахарозу (в Южной Америке) и мелассу (в Азии и Европе). В некоторых случаях лимонную кислоту получают из сельскохозяйственных отходов[6].
Этот процесс используется с 1930-х гг. Теоретически из 100 кг сахарозы можно получить 123 кг моногидрата лимонной кислоты либо 112 кг безводной лимонной кислоты. В действительности выход понижается за счёт того, что грибы потребляют часть сахарозы для роста и дыхания. Реальный выход составляет от 60 до 85 % от теоретического. Ферментативный процесс можно проводить в трёх форматах:
- твердофазная ферментация;
- поверхностная ферментация;
- глубинная ферментация[8].
При твердофазной ферментации сырьё помещается в желоба и смачивается водой. При необходимости в воду добавляют питательные вещества, и затем туда помещают микробную культуру. После окончания процесса лимонную кислоту вымывают водой, выделяют из раствора и очищают. Поверхностную ферментацию проводят на специальных лотках, куда помещают субстрат и определённые неорганические питательные вещества. pH регулируют в области 3–7 в зависимости от субстрата, затем проводят стерилизацию и устанавливают необходимую температуру. Затем на лотки помещают культуру, которая размножается и покрывает всю поверхность, после чего начинается синтез лимонной кислоты. По окончании процесса из жидкости выделяют лимонную кислоту. Глубинная ферментация проводится в больших ёмкостях в два этапа. Сначала 10 % субстрата ферментируют в течение 1 дня в качестве затравки, после чего смесь добавляют в основную массу и ферментируют в течение 3–7 дней. Процесс проводится при постоянной подаче воздуха компрессором[8].
После ферментации жидкость фильтруют через мембрану и отделяют лимонную кислоту от белков и остаточных углеводов негашёной известью, экстракцией или хроматографией. Согласно первому, наиболее распространённому способу, лимонная кислота осаждается в виде кальциевой соли, которую затем обрабатывают серной кислотой, получая нерастворимый гипс и раствор очищенной лимонной кислоты. Второй способ основан на использовании специфичного растворителя, в котором лимонная кислота растворяется лучше, чем примеси. Хроматографическая очистка основана на использовании анионитов: лимонная кислота сорбируется на носителе, а затем смывается разбавленой серной кислотой[9].
После выделения проводят очистку. Для этого грязную лимонную кислоту обрабатывают активированным углём (для удаления окрашенных примесей), пропускают через ионообменные смолы (для удаления солей), фильтруют от нерастворимых примесей и кристаллизуют[8].
В 2012 году мировой объём производства лимонной кислоты составил приблизительно 1,6 млн тонн, из них примерно 0,8-0,9 млн т произведено в Китае. 70 % от общего количества потребляет пищевая промышленность[8].
Лабораторный синтез
Классический лабораторный синтез лимонной кислоты начинается с ацетона, который бромируют по метильным группам, затем вводят в реакцию с циановодородом и гидролизуют[6].
Полный синтез
Впервые лимонную кислоту химическим синтезом получили Гримо (Grimaux) и Адам (Adam) в 1880 году. Исходным соединением в этом синтезе послужил глицерин. Первичные гидроксильные группы сначала замещали на атомы хлора, а затем на нитрильные группы, которые при гидролизе давали концевые карбоксильные группы. Вторичную же гидроксильную группу окисляли до кетогруппы, к которой затем присоединяли циановодород; полученный циангидрин также при гидролизе давал карбоксильную группу[10].
Другой подход был предложен в 1890 году. Он был основан на превращении ацетоуксусного эфира, который хлорировали, как предполагалось, по концевому α-положению, затем вводили в то же положение нитрильную группу, которую в итоге гидролизовали до карбоксильной группы. На последней стадии создавали заместители при атоме С-2, получая циангидрин и гидролизуя его в кислой среде. Этот полный синтез был поставлен под вопрос: некоторые химики, например Шарль Прево, высказали предположение, что хлорируется не концевое α-положение ацетоуксусного эфира, а среднее, из-за чего образуется не сама лимонная кислота, а её изомер. Проблема, как полагается, заключалась в том, что в конце XIX в. ещё не существовало спектроскопических методов, которые позволили бы заметить эту разницу[11].
В 1891 году лимонную кислоту получили присоединением синильной кислоты к моноэтиловому эфиру ацетондикарбоновой кислоты с последующим гидролизом. Правда, само исходное вещество было изначально получено из лимонной кислоты[12].
В 1897 году был предложен подход к синтезу лимонной кислоты, основанный на недавно открытой реакции Реформатского (1895). Согласно этому методу, в реакцию вводились этилбромацетат и диэтилоксалоацетат в присутствии цинка[13].
Из более поздних подходов можно отметить предложенное в 1973 году превращение щавелевоуксусной кислоты, которая при самоконденсации с декарбоксилированием давала цитроилмуравьиную кислоту. Последнюю затем в присутствии пероксида водорода или трет-бутилгидропероксида превращали в лимонную кислоту[14][15].
В 1980 году лимонную кислоту получили по реакции конденсации 3-метилбутен-3-ола-1 и формальдегида с последующим окислением полученного продукта оксидом азота(IV)[16][15].
Нахождение в природе
Лимонная кислота содержится в различных фруктах, в большом количестве — в цитрусовых (примерно 5 % в плодах и 9 % в соке). На 100 г лайма приходится 7 г лимонной кислоты; лимона — 5,6 г; малины — 2,5 г; чёрной смородины — 1,2 г; помидора — 1,0 г; ананаса и клубники — 0,6 г; клюквы — 0,2 г; яблока — 14 мг[3].
Лимонная кислота участвует в цикле трикарбоновых кислот — ключевом этапе дыхания клетки, поэтому в определённой концентрации она содержится почти во всех животных и растениях[3].
Применение
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция, дицитрат трикалия висмута), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), для производства плавленых сыров, напитков, сухих шипучих напитков.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса).
В косметике используется как регулятор кислотности, буфер, хелатирующий агент, для шипучих композиций (ванны).
При приёме внутрь в небольших дозах (например, при употреблении цитрусовых) активирует цикл Кребса, что способствует ускорению метаболизма.
В нефтяной промышленности при бурении нефтяных и газовых скважин используется для нейтрализации высокого уровня pH бурового раствора (после щелочных ванн).
В строительстве лимонную кислоту применяют в качестве добавки к цементу и гипсу вяжущему для замедления схватывания[17][18].
Лимонная кислота может использоваться для травления печатных плат[19] (совместно с перекисью водорода).
Широко используется в бытовой химии в качестве очистительного средства.
Влияние на здоровье
В конце 1970-х годов в Западной Европе получила распространение мистификация, известная как «вильжюифский список», в котором лимонная кислота была названа сильным канцерогеном[20]. В действительности в пищевой сфере лимонная кислота считается безопасной добавкой. Согласно европейскому законодательству, лимонную кислоту можно использовать в GMP без ограничений. Американская FDA определяет лимонную кислоту как GRAS (англ. generally recognized as safe, в целом признаётся безопасной)[21].
Сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При единовременном употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей[22].
LD50 для крыс перорально: 3 г/кг.
Примечания
- ↑ CRC Handbook of Chemistry and Physics (1st student edition) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Apelblat, 2014, p. 1.
- ↑ 1 2 3 Ullmann, 2014, p. 1.
- ↑ 1 2 Ullmann, 2014, p. 2.
- ↑ 1 2 Ullmann, 2014, p. 3.
- ↑ 1 2 3 4 5 Ullmann, 2014, p. 4.
- ↑ 1 2 Apelblat, 2014, p. 2.
- ↑ 1 2 3 4 Ullmann, 2014, p. 4–6.
- ↑ Ullmann, 2014, p. 6–7.
- ↑ Apelblat, 2014, p. 213.
- ↑ Apelblat, 2014, p. 214–215.
- ↑ Apelblat, 2014, p. 216.
- ↑ Apelblat, 2014, p. 215.
- ↑ Wiley R. H., Kim K. S. Bimolecular decarboxylative self-condensation of oxaloacetic acid to citrolyformic acid and its conversion by oxidative decarboxylation to citric acid : [англ.] // J. Org. Chem.. — 1973. — Vol. 38, no. 20. — P. 3582–3585. — DOI:10.1021/jo00960a030.
- ↑ 1 2 Apelblat, 2014, p. 216–217.
- ↑ Wilkes J. B., Wall R. G. Reaction of dinitrogen tetraoxide with hydrophilic olefins: synthesis of citric and 2-hydroxy-2-methylbutanedioic acids : [англ.] // J. Org. Chem.. — 1980. — Vol. 45, no. 2. — P. 247–250. — DOI:10.1021/jo01290a008.
- ↑ Singh, N.B.; A.K. Singh, S. Prabha Singh (1986). “Effect of citric acid on the hydration of portland cement”. Cement and Concrete Research. 16 (6): 911—920. DOI:10.1016/0008-8846(86)90015-3. ISSN 0008-8846.
- ↑ Козлова В. К., Карпова Ю. В., Вольф А. В. Оценка эффективности добавок, замедляющих схватывание цементного теста // Ползуновский вестник. — 2006. — Вып. №2-2. — С. 230-233.
- ↑ РадиоКот :: Безопасный общедоступный состав для травления меди в домашних условиях
- ↑ https://www.jstor.org/pss/2749354
- ↑ Ullmann, 2014, p. 8.
- ↑ Merck Safety Data Sheet — Citric acid (pdf)
Литература
Ссылки
wikiredia.ru
Лимонная кислота
Лимонная кислота
Бушуева О.А. 11МБОУ «Холмовская средняя школа»
Сергеева В.Н. 11МБОУ «Холмовская средняя школа»
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
I. Введение
1. Актуальность работы заключается в том, чтобы выяснить: какими свойствами обладает лимонная кислота, ее области применения. Изучить получение лимонной кислоты, как естественным путем, так и в промышленности.
2. Объект исследования: лимонная кислота.
3. Гипотеза: недостаточные знания по отдельным темам могут привести к негативному мнению о данном веществе.
4. Цель исследования: целью моего исследования является: изучение физических свойств лимонной кислоты, способов ее получения и областей применения, особых свойств этого всем знакомого вещества, биологической роли лимонной кислоты.
5. Задачи исследования:
Анализ литературных данных и данных сети интернета.
Проведение лабораторного опыта по ознакомлению с физическими свойствами лимонной кислоты.
Проведение ряда учебно-исследовательских экспериментов.
Анализ полученных экспериментальных данных.
6. Методы исследования:
Библиографический анализ литературы и материалов сети интернета.
Описание.
Наблюдения.
Сравнительный анализ.
Проведение лабораторного опыта.
Проведение учебно-исследовательского эксперимента.
Анализ полученных результатов эксперимента.
Компьютерное моделирование.
Фотографирование.
7. Теоретическая значимость исследования заключается в том, что результаты исследования могут быть использованы в нашей школе на уроках химии и биологии и во внеурочной деятельности для более глубокого изучения темы “Лимонная кислота”, для применения знаний на практике.
8. Практическая значимость исследовательской работы состоит в том, что она может быть использована для повышения образовательного уровня школьников при изучении предметов химии и биологии, подготовки к экзаменам.Для использования лимонной кислоты в быту помогут приобретенные знания в области лимонной кислоты.
II. Основное содержание
1. Исторические сведения
1.1. Происхождение названия вещества. Первые сведения о лимонной кислоте и ее свойствах.
Впервые лимонная кислота была получена из сока недозрелых лимонов шведским аптекарем Шееле (приложение 1) в 1784 г.; он и дал ей название.
Состав химических веществ и их формулы во времена Шеелеопределять не могли и поэтому называли новые вещества по тем исходным материалам, из которых их получали, а также по вкусу, по запаху, либо по именам химиков, впервые получивших эти вещества.
До 30-х годов ХХ века лимонная кислота вырабатывалась из цитрусовых, в основном в Италии. Позднее эту кислоту стали получать промышленным способом, как путем синтеза, так и из натуральных продуктов. Так в 1933 году в Чехословакии, а в 1935 году в Советском Союзе было создано производство лимонной кислоты методом биохимического синтеза с помощью плесневых грибов Aspergillus niger из сахара.
2. Теоретическое изучение темы «Лимонная кислота, ее свойства, получение, применение» (приложение 2)
2.1. Строение молекулы лимонной кислоты. Формула. Химическое название.
Формула лимонной кислоты:
Химическое название:
2-гидрокси-1,2,3-пропантрикарбоновая кислота,
3-гидрокси-3-карбоксипентандиовая
2.2. Физические свойства лимонной кислоты.
Кислая на вкус
Твердая, кристалловидная белого цвета
Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире
Температура плавления 153°C
Температура разложения = 175 °C.
Молярная масса составляет 192,1 г/моль. Плотность — 1,665 г/см³
Слабая кислота
2.3. Химические свойства лимонной кислоты
Под действие серной кислоты лимонная кислота как α-гидроксикислота разлагается с образованием ацетондикарбоновой и муравьиной кислот.
Взаимодействует с металлами
Взаимодействует с основными оксидами
Взаимодействует с основаниями
Взаимодействует с солями
Взаимодействует с аммиаком
Подвергается электролитической диссоциации
Проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту
Лимонная кислота переходит в ангидриды итаконовой и цитраконовой кислот (теряется вода и углекислый газ и образование ацетона)
В реакциях с сильными окислителями (перманганат калия, бертолетова соль) переходит в акриловую кислоту и этиленоксид.
В водном растворе образует хелатные комплексы с ионами кальция, магния, меди, железа и др.
2.4. Получение лимонной кислоты в промышленности.
Около 60 лет назад лимонную кислоту выделяли преимущественно из плодов цитрусовых растений. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ (меласса) промышленными штаммами плесневого гриба Aspergillus niger. Поскольку основным сырьем для получения лимонной кислоты является меласса, в которой содержится много железа, то на стадии пред-ферментации его осаждают при помощи желтой кровяной соли -K4[Fe(CN)6]. Известны два способа ферментации Aspergillus niger — поверхностный и глубинный. Первый из них реализуют на предприятиях малой и средней мощности в виде жидкофазной ферментации на жидкой среде (например, в ряде стран Европы и Америки) и в виде твердофазной ферментации (например, в Японии). Ныне Е330 получают новыми способами. Среди них самыми популярными являются:
с помощью плесневых грибов;
из продуктов получения сахара;
синтезирование.
2.5. Нахождение лимонной кислоты в природе.
Лимонная кислота в определённой концентрации содержится в большинстве прокариотов и почти во всех эукариотах (преимущественно в митохондриях).
В естественном виде лимонную кислоту содержат такие фрукты и ягоды, как: земляника, все цитрусовые, крыжовник, брусника, персики, лимоны в большом количестве (особенно несозревшие), ананасы, барбарис, хвойные, рябина, помидоры, клюква, абрикосы, гранаты, черная смородина, айва, вишня, китайский лимонник, малина, сливы, махорка и другие. (приложения 3, 4, 5)
2.6. Особенные свойства лимонной кислоты и ее солей.
Лимонная кислота всегда есть в человеческом организме. Ее производные — соли, выполняют важную роль при формировании костей, помогая регулировать размер кристаллов кальция. В биохимии соли данной кислоты имеют большое значение в качестве промежуточного звена в цикле трикарбоновых кислот, который имеет место при метаболизме у всех аэробных организмов. Обладает лимонная кислота и ценными лечебными свойствами. Она способствует очищению организма от вредных веществ, лишних солей, шлаков, положительно влияет на работу систем пищеварения, улучшает зрение, сжигает углеводы, проявляет ценные противоопухолевые свойства, повышает иммунитет. Лимонная кислота также способствует выведению токсинов через клетки кожи.
С другой стороны, сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей. Высокая концентрация данного вещества, применяемая наружу или внутрь, является причиной серьезных ожогов. Также лимонная кислота является разрушителем зубной эмали, вступая с ней в реакцию из-за нейтрализации кальция. Страдающим желудочно-кишечными заболеваниями не рекомендуется (а в некоторых случаях даже запрещено) употреблять продукты, имеющие в своем составе Е330. Также ограничить их употребление или исключить из своего меню следует лицам с повышенной кислотностью, так как поступление в организм лимонной кислоты вызовет ухудшения состояния здоровья, может стать причиной сильных желудочных болей.
2.7. Применение лимонной кислоты.
В кондитерской промышленности лимонная кислота используется как подкислитель и усилитель вкуса.
В алкогольные и прохладительные газированные и негазированные напитки лимонная кислота добавляется для придания им ощущения свежести.
Кроме того, она является синергистом, т. е. веществом, усиливающим действие антиоксидантов, таких, например, как аскорбиновая кислота.
В консервной промышленности лимонная кислота используется как консервант вместо уксуса, который признан канцерогеном и применение которого в большинстве стран в пищевой промышленности резко ограничен.
В масложировой промышленности лимонная кислота предохраняет продукцию от разлагающего действия находящихся в них следов тяжелых металлов, путем образования с ними комплексных соединений. Таким путем значительно снижается вероятность прогоркания жиров, маргаринов и животного масла.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса).
В косметике используется как регулятор кислотности, буфер, хелатирующий агент, для шипучих композиций (ванны).
Применение в домашнем хозяйстве :
Для продления времени стояния роз в воде, ее нужно обогатить сахаром и лимонной кислотой. Для вазы, в которую помещается пять литров воды нужно взять 1 г лимонной кислоты (1/8 чайной ложки) и стакан сахара, растворить в воде и поместить в этот раствор розы.
Раствор для очищения утюга от накипи. Такой способ очистки применим для утюгов с возможностью подачи пара. Чтобы приготовить чистящий раствор, в стакане воды следует растворить столовую ложку лимонной кислоты. Этот раствор залить вместо воды в резервуар для подачи пара, подключить утюг к сети электропитания, установить отметку подачи пара на максимум и нажимая на кнопку подачи пара, постепенно очищать утюг. По окончанию проведения этой процедуры в резервуар для воды наливают чистую воду и повторяют процедуру несколько раз, с целью очистки парообразующих путей от следов лимонной кислоты.
Раствор для очищения налет или потемнений на посуде из серебра, а также ювелирных украшениях, любые монеты, кулоны, перстни, браслеты и так далее.
Раствор для очищения накипи на дне и стенках чайника. Очистить сантехнику и даже стены ванной комнаты можно при помощи порошка, полученного из Е 330. Желательно, чтобы фракции порошка были мелкими, а достигнуть этого можно, размолов средство в кофемолке (используя средства защиты дыхательных путей) или хотя бы измельчив скалкой на столе. Использовать так само, как и все чистящие порошки — нанеся небольшое количество на губку, постепенно очищать поверхность.
Обладая легкими дезинфицирующими свойствами, Е 330 прекрасно подходит для очищения кухонных столов. Протирать стол слабым раствором этого вещества достаточно раз в неделю. Учитывая его свойство устранять неприятные запахи, им можно протирать также внутренние поверхности холодильника и кухонных шкафчиков.
3. Экспериментальная часть «Лимонная кислота и изучение ее свойств»
3.1. Лабораторный опыт «Ознакомление с физическими свойствами лимонной кислоты».
Цель выполнения лабораторного опыта: изучить физические свойства лимонной кислоты и определение ph среды.
Этапы лабораторного опыта:
Убедилась в том, что лимонная кислота имеет белый, кристаллический вид
Приготовила раствор лимонной кислоты, убедившись, что она растворима в воде. (приложение 6)
С помощью индикаторов определяю рh среду. Индикатор Лакмус изменил цвет на бледно-розовый цвет. Индикатор Метиловый оранжевый изменил цвет на красный. Индикатор Универсальный изменил цвет на оранжевый, и с его помощью определила, что среда раствора кислая, слабая. Ph = 3.0 (приложение 7)
Температура плавления 153°C
Температура разложения = 175 °C.
Молярная масса составляет 192,1 г/моль. Плотность — 1,665 г/см³
3.2. Учебно-исследовательский эксперимент “Лимонная кислота как разрыхлитель”.
Цель эксперимента: доказать, что лимонную кислоту можно использовать в качестве разрыхлителя.
Этапы эксперимента:
Приготовила раствор лимонной кислоты и соды.
С6Н8О7 + 3NaHCO3 —> Na3C6H5O7 + 3CO2 + 3h3O (приложение 8)
Наблюдала выделение углекислого газа. (приложение 9)
Раствор лимонной кислоты и пищевой соды можно использовать в качестве разрыхлителя теста в кулинарии. Разрыхлитель используется для того, чтобы тесто было нежным и приятным. Сода помогает тесту подняться.
3.3. Учебно-исследовательский эксперимент «Выявление биологической роли лимонной кислоты».
Название эксперимента и есть цель моей исследовательской работы.
Этапы эксперимента и выводы:
Приготовила раствор лимонной кислоты.
Наношу на две половинки заранее разрезанных яблок этот раствор, а две половинки оставляю непропитанными. (приложение 10)
Наблюдаю, что через некоторое время те половинки, которые не были смазаны раствором, темнеют. Потемнение происходит из-за окисления железа, содержащегося в яблоке, кислородом воздуха.(приложение 10)
Лимонная кислота замедляет процессы окисления, являясь природным антиоксидантом. Поэтому она играет большую биологическую роль в жизни человека.
3.4. Учебно-исследовательский эксперимент “Осаждение белков молока лимонной кислотой”.
Цель эксперимента: проследить процесс осаждения белков молока с помощью лимонной кислоты.
Этапы эксперимента:
В стакан с молоком насыпаю лимонной кислоты. Перемешивая, наблюдаю на трубочке творожистовидный осадок. (приложение 11)
Пропускаю через фильтр получившийся раствор.
Наблюдаю, что через некоторое время на фильтре остается масса, содержащая казеин и жиры. (приложение 12)
На долю глобулина приходится 6-15% от общего содержания белков. В молоке глобулин находится в растворенном состоянии. Глобулин молока укрепляет иммунитет, защищает организм от инфекций. На долю альбумина приходится 2-3% от общего содержания белков в молоке.
3.5. Учебно-исследовательский эксперимент “Удаление пятен ржавчины с тканей с помощью лимонной кислоты”.
Название эксперимента и есть цель моей исследовательской работы.
Этапы эксперимента:
Приготовила концентрированный раствор лимонной кислоты.
Готовым раствором смочила ткань со ржавчиной. Через небольшой промежуток времени наблюдала исчезновение пятна. (приложение 13)
Проведя этот эксперимент, я рассмотрела лимонную кислоту как пятновыводитель. Это свойство лимонной кислоты можно применить в быту.
3.6. Выводы по результатам экспериментов.
Выполняя эксперименты, я изучила некоторые свойства лимонной кислоты, о которых я и не догадывалась. Я узнала, какую биологическую роль в жизни человека играет лимонная кислота. Узнала и наглядно продемонстрировала осаждение белка молока лимонной кислотой. Лимонная кислота – интересное органическое вещество!
III. Заключение и выводы по работе
Выполнив такую обширную работу, я выяснила значение лимонной кислоты в жизни человека, изучила физические и химические свойства данной кислоты, изучила способы получения и области применения лимонной кислоты, выяснила влияние лимонной кислоты на здоровье человека – это естественный антиоксидант. Узнала, что лимонная кислота может осаждать белки молока, может использоваться как средство для очищения поверхностей, для приготовления газированных напитков, как разрыхлитель теста совместно с пищевой содой.
IV. Источники
https://ru.wikipedia.org/wiki/Лимонная_кислота
https://zhenskoe-mnenie.ru/themes/diets/izvestnye-svoistva-limonnoi-kisloty-i-novye-nauchnye-fakty-o-ee-polze-limonnaia-kislota-poleznaia-veshch-ili-vrednaia-shtuka/
http://www.calorizator.ru/addon/e3xx/e330
http://sovets.net/9024-limonnaya-kislota.html
А. Ликум – «Всё обо всем» популярная энциклопедия для детей, Том 1. Москва, 1993г.
П.А. Оржековский, В.Н. Давыдов, Н.А. Титов – «Творчество учащихся на практических занятиях по химии». АРКТИ, Москва, 1999г.
П.И. Воскресенский – «Техника лабораторных работ». Химия. Москва. 1973г.
С.А. Шапиро, М.А. Шапиро – «Аналитическая химия». Высшая школа. Москва. 1989г.
Химия. 10 класс. Углубленый уровень: учебник / О.С.Габриелян, И.Г.Остроумов, С.Ю. Пономарев, — 6-е изд., стереотип. — М.: Дрофа, 2018. — 368: ил.
Приложения
Приложение 1
Аптекарь Шееле
Приложение 2
Кристаллы лимонной кислоты под микроскопом.
Увеличение 200х.
Приложение 3
Цитрусовые
Приложение 4
Айва
Приложение 5
Махорка
Приложение 6
Приготовление раствора.
Приложение 7
Индикатор Лакмус.
Индикатор Метиловый оранжевый.
Индикатор Универсальный.
Приложение 8
Приготовление раствора пищевой соды и лимонной кислоты.
Приложение 9
Выделение углекислого газа.
Приложение 10
Раствор лимонной кислоты наношу на две половинки яблок.
Окисление яблок.
Приложение 11
Образование творожистого осадка на трубочке.
Приложение 12
Образование творожестого
осадка на фильтре.
Приложение 13
Очищение раствором лимонной кислоты от ржавчины.
Начало эксперимента.
В конце эксперимента.
Просмотров работы: 1300
school-science.ru
Лимонная кислота — Циклопедия
Кристаллы лимонной кислоты, подсвеченные поляризованным светом, в двухсоткратном увеличении Цикл Кребса/Цикл лимонной кислотыЛимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота; 3-гидрокси-3-карбоксипентандиовая) — слабая трёхосновная органическая кислота, кристаллическое вещество белого цвета с суммарной химической формулой C6H8O7, более развёрнутая формула: (НООССН2)2С(ОН)СООН[1].
Открыта в 1784 году шведским химиком Карлом Шееле в соке недозрелых лимонов.
[править] Физические свойства
Представляет собой бесцветные ромбические кристаллы. Температура плавления = 153 °C. Температура разложения = 175 °C. Молярная масса составляет 192,1 г/моль. Плотность — 1,665 г/см³. В растворе подвергается электролитической диссоциации. Хорошо растворима в воде и спирте (например, в этаноле). В большинстве органических растворителей, как например в диэтиловом эфире, — малорастворима. Из водного раствора при температуре ниже 36,5°С лимонная кислота кристаллизуется в виде моногидрата.
[править] Химические свойства
Лимонная кислота проявляет свойства многоосновных карбоновых кислот и образует одно-, двух- и трёхзамещённые соли и эфиры, называемые цитратами. Ацилируется по группе ОН. Будучи гидроксикислотой образует стабильные комплексы с многовалентными катионами.
При температуре 175°С отщепляет молекулу воды и превращается в аконитовую кислоту. При температуре выше 175°С превращается в итаконовую кислоту.
При декарбоксилировании, при сухой перегонке, теряя воду и углекислый газ и при одновременном образовании ацетона, лимонная кислота преобразуется в ангидриды итаконовой и цитраконовой кислот.
В водном растворе лимонная кислота образует хелатные комплексы с ионами кальция, магния, меди, железа и т. д.
При окислении с помощью КMnО4 или Н2О2 образует 3-кетоглутаровую кислоту.
[править] Биологическая роль
Лимонная кислота является необходимым звеном в системе биохимических реакций клеточного дыхания, являясь главным промежуточным продуктом метаболического цикла трикарбоновых кислот. Также лимонная кислота участвует в глиоксилатном цикле. Лимонная кислота в определённой концентрации содержится в организмах большинства прокариотов и почти у всех эукариотов (главным образом в митохондриях). Она содержится и в организме человека. Наряду с другими компонентами цикла трикарбоновых кислот, лимонная кислота содержится в небольших количествах в митохондриях всех клеток. Растения и некоторые бактерии способны накапливать лимонную кислоту. Другая функция лимонной кислоты — поддержание в организме кислотно-щелочного равновесия и ионного состава.
[править] Промышленное значение
Раньше лимонную кислоту получали из сока лимона и биомассы махорки. Современный основной путь промышленного производства лимонной кислоты — лимоннокислое брожение — биосинтез из сахара или сахаристых веществ («меласса») промышленными штаммами плесневого гриба Aspergillus niger. Получают её также извлечением из растительного сырья или взаимодействия кетена с ангидридом щавелевоуксусной кислоты.
Лимонная кислота и её соли (цитрат натрия, цитрат калия, цитрат кальция), широко используется в пищевой промышленности как вкусовая добавка, регулятор кислотности и консервант (пищевые добавки E330 — Е333), для производства напитков, сухих шипучих напитков.
В медицине лимонная кислота применяется в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса). Также её используют для консервирования крови.
В фармацевтической промышленности применяется как компонент многих лекарственных средств (лимоннокислый Na — антикоагулянт).
В косметике лимонная кислота используется как регулятор кислотности, буфер, хелатирующий агент, для шипучих композиций (ванны).
В нефтяной промышленности применяется при бурении нефтяных и газовых скважин для нейтрализации цемента в растворе (например, после срезки с цементного моста). Удаляет ионы кальция из бурового раствора.
Также используется в качестве компонентов буферных растворов, для предохранения жиров от порчи, для снятия ржавчины и окалины с металлических поверхностей, при электротравлении меди, в таннирующих растворах в ситцепечатании, при производстве диазобумаг.
Триэтиловый и трибутиловый эфиры ацетиллимонной кислоты используются как пластификаторы. Триаллиловый эфир применяется как мономер.
При попадании в глаза сухая лимонная кислота и её концентрированные растворы вызывают сильное раздражение, при контакте с кожей может наблюдаться слабое раздражение.
При употреблении внутрь больших количеств лимонной кислоты наблюдаются раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота.
При вдыхании сухой лимонной кислоты возникает раздражение дыхательных путей.
LD50 для крыс перорально: 3000 мг/кг.
cyclowiki.org
