Параметры ИВЛ. Вопрос- ответ.
Статья, посвященная проблеме выбора «правильного» аппарата ИВЛ для клиники или амбулатории.
1. Что такое искусственная вентиляция лёгких?Искусственная вентиляция лёгких (ИВЛ) – это форма вентиляции, призванная решать ту задачу, которую в норме выполняют дыхательные мышцы. Задача включает в себя обеспечение оксигенации и вентиляции (удалении углекислого газа) пациента. Существует два главных типа ИВЛ: вентиляция с положительным давлением и вентиляция с отрицательным давлением. Вентиляция с положительным давлением может быть инвазивной (через эндотрахеальную трубку) или неинвазивной (через лицевую маску). Возможна также вентиляция с переключением фаз по объёму и по давлению (см. вопрос 4). К многочисленным разным режимам ИВЛ относятся управляемая искусственная вентиляция (CMV в английской аббревиатуре – ред.), вспомогательная искусственная вентиляция (ВИВЛ, ACV в английской аббревиатуре), перемежающаяся принудительная (
Важно делать отличие между эндотрахеальной интубацией и ИВЛ, поскольку одно необязательно подразумевает другое. Например, больной может нуждаться в эндотрахеальной интубации для обеспечения проходимости дыхательных путей, однако при этом оставаться ещё способным самостоятельно поддерживать вентиляцию через эндотрахеальную трубку, обходясь без помощи ИВЛ.
2. Каковы показания к ИВЛ?
ИВЛ показана при многих расстройствах. В то же время, во многих случаях показания не являются строго очерченными. К главным причинам применения ИВЛ относятся неспособность к достаточной оксигенации и утрата адекватной альвеолярной вентиляции, что может быть связано либо с первичным паренхиматозным поражением лёгких (например, при пневмонии или отёке лёгких), либо с системными процессами, опосредованно поражающими функцию лёгких (как это происходит при сепсисе или нарушениях функции центральной нервной системы). Дополнительно к этому, проведение общей анестезии часто подразумевает ИВЛ, потому что многие препараты оказывают угнетающий эффект на дыхание, а миорелаксанты вызывают паралич дыхательных мышц. Главная задача ИВЛ в условиях дыхательной недостаточности – поддержание газообмена до тех пор, пока не будет устранен патологический процесс, вызвавший эту недостаточность.
3. Что такое неинвазивная вентиляция и каковы показания для неё?
Неинвазивная вентиляция может проводиться или в режиме отрицательного, или в режиме положительного давления. Вентиляция с отрицательным давлением (обычно с помощью танкового – «железные лёгкие» – или кирасного респиратора) изредка применяется у пациентов с нейромышечными расстройствами или хроническим усталостью диафрагмы вследствие хронического обструктивного заболевания лёгких (ХОЗЛ). Оболочка респиратора обхватывает туловище ниже шеи, а создаваемое под оболочкой отрицательное давление приводит к возникновению градиента давлений и газотока из верхних дыхательных путей в лёгкие. Выдох происходит пассивно. Этот режим вентиляции позволяет отказаться от интубации трахеи и избежать связанных с нею проблем. Верхние дыхательные пути должны быть свободны, однако это делает их уязвимыми для аспирации. В связи с застоем крови во внутренних органах может возникать гипотония.
4. Опишите наиболее распространённые режимы ИВЛ: CMV, ACV, IMV.
Эти три режима с обычным переключением по объёму, по сути, представляют собой три разных способа откликания респиратора. При CMV вентиляция пациента целиком контролируется с помощью предварительно установленного дыхательного объёма (ДО) и заданной частоты дыхания (ЧД). CMV применяется у пациентов, полностью утративших способность совершать попытки дыхания, что, в частности, наблюдается во время общей анестезии при центральном угнетении дыхания или вызванном миорелаксантами параличе мышц. Режим ACV (ВИВЛ) позволяет пациенту вызывать искусственный вдох (почему и содержит слово «вспомогательный»), после чего осуществляется подача заданного дыхательного объёма. Если по каким-то развивается брадипноэ или апноэ, респиратор переходит на резервный управляемый режим вентиляции. Режим IMV, первоначально предложенный в качестве средства отучения от респиратора, допускает спонтанное дыхание пациента через дыхательный контур аппарата. Респиратор проводит ИВЛ с установленными ДО и ЧД. Режим SIMV исключает аппаратные вдохи во время продолжающихся спонтанных дыханий.
5. Каковы первоначальные настройки респиратора при ОДН? Какие задачи решаются с помощью этих настроек?
Большинство пациентов с ОДН нуждаются в полной заместительной вентиляции. Главными задачами при этом становятся обеспечение насыщения артериальной крови кислородом и предотвращение связанных с искусственной вентиляцией осложнений. Осложнения могут возникать из-за увеличенного давления в дыхательных путях или длительного воздействия повышенной концентрации кислорода на вдохе (FiO2) (см. ниже).
Чаще всего начинают с режима ВИВЛ, гарантирующего поступление заданного объёма. Однако всё более популярными становятся прессоциклические режимы.
Необходимо выбрать FiO2. Обычно начинают с 1,0, медленно снижая до минимальной концентрации, переносимой пациентом. Длительное воздействие высоких значений FiO2 (> 60-70%) может проявиться токсическим действием кислорода.
Дыхательный объём подбирается с учётом массы тела и патофизиологических механизмов повреждения лёгких. В настоящее время приемлемым считается установка объёма в пределах 10–12 мл/кг массы тела. Однако при состояниях, подобных острому респираторному дистресс-синдрому (ОРДС), объём лёгких снижается. Поскольку высокие значения давлений и объёмов могут ухудшать течение основного заболевания, используют меньшие объёмы – в пределах 6–10 мл/кг.
Частота дыхания (ЧД), как правило, устанавливается в диапазоне 10 – 20 дыханий в минуту. Для пациентов, нуждающихся в большом объёме минутной вентиляции, может потребоваться частота дыхания от 20 до 30 дыханий в минуту. При частоте > 25 удаление углекислого газа (СO2) существенно не улучшается, а частота дыхания > 30 предрасполагает к возникновению газовой ловушки вследствие сокращенного времени выдоха.
Положительное давление в конце выдоха (ПДКВ; см. вопрос 6) на начальном этапе обычно устанавливается невысоким (например, 5 см Н2О) и может быть постепенно увеличено при необходимости улучшения оксигенации. Небольшие значения ПДКВ в большинстве случаев острого повреждения лёгких помогают поддерживать воздушность альвеол, склонных к коллапсу. Современные данные свидетельствуют о том, что невысокое ПДКВ позволяет избежать воздействия противоположно направленных сил, возникающих при повторном раскрытии и спадении альвеол. Эффект от действия таких силы может усугублять повреждение лёгких.
6. Объясните, что такое ПДКВ. Как подобрать оптимальный уровень ПДКВ?
ПДКВ дополнительно устанавливают при многих типах и режимах вентиляции. В этом случае давление в дыхательных путях в конце выдоха остаётся выше атмосферного. ПДКВ направлено на предотвращение коллапса альвеол, а также восстановление просвета спавшихся в состоянии острого повреждения лёгких альвеол. Функциональная остаточная ёмкость (ФОЕ) и оксигенация при этом увеличиваются. Изначально ПДКВ устанавливают приблизительно на уровне 5 см Н2О, а увеличивают до максимальных значений – 15–20 см Н2О – небольшими порциями. Высокие уровни ПДКВ могут отрицательно сказаться на сердечном выбросе (см. вопрос 8). Оптимальное ПДКВ обеспечивает наилучшую артериальную оксигенацию с наименьшим снижением сердечного выброса и приемлемым давлением в дыхательных путях. Оптимальное ПДКВ соответствует также уровню наилучшего расправления спавшихся альвеол, что можно быстро установить у кровати больного, увеличивая ПДКВ до той степени пневматизации лёгких, когда их растяжимость (см. вопрос 14) начнёт падать. Отслеживать давление в дыхательных путях после каждого повышения ПДКВ несложно. Давление в дыхательных путях должно расти только пропорционально устанавливаемому ПДКВ. Если давление в дыхательных путях начнёт расти быстрее, чем устанавливаемые значения ПДКВ, это будет указывать на перерастяжение альвеол и превышение уровня оптимального раскрытия спавшихся альвеол. Непрерывное положительное давление (НПД) является формой ПДКВ, реализуемой с помощью дыхательного контура при спонтанном дыхании пациента.
7. Что такое внутреннее или ауто-ПДКВ?
Впервые описанное Pepe и Marini в 1982 г., внутреннее ПДКВ (ПДКВвн) означает возникновение положительного давления и движения газа внутри альвеол в конце выдоха при отсутствии искусственно создаваемого наружного ПДКВ (ПДКВн). В норме объём лёгких в конце выдоха (ФОЕ) зависит от результата противоборства эластической тяги лёгких и упругости грудной стенки. Уравновешивание этих сил в обычных условиях приводит к отсутствию градиента давлений или воздушного потока в конце выдоха. ПДКВвн возникает вследствие двух главных причин. Если ЧД излишне высока или время выдоха слишком укорочено, при ИВЛ здоровым лёгким остаётся недостаточно времени для того, чтобы закончить выдох до начала следующего дыхательного цикла. Это приводит к накапливанию воздуха в лёгких и появлению положительного давления в конце выдоха. Поэтому пациенты, вентилируемые большим минутным объёмом (например, при сепсисе, травме) или с высоким I:E соотношением, имеют угрозу развития ПДКВвн. Эндотрахеальная трубка небольшого диаметра также может затруднять выдох, способствуя ПДКВвн. Другой главный механизм развития ПДКВвн связан с поражением самих лёгких. Больные с повышенным сопротивлением дыхательных путей и растяжимостью лёгких (например, при астме, ХОЗЛ) имеют высокий риск ПДКВвн. Вследствие обструкции дыхательных путей и связанным с этим затруднением выдоха, такие пациенты склонны испытывать ПДКВвн и при спонтанном дыхании, и при ИВЛ. ПДКВвн обладает теми же побочными эффектами, что и ПДКВн, однако требует в отношении себя большей настороженности. Если респиратор, как это обычно бывает, имеет открытый в атмосферу выход, то единственный способ обнаружения и измерения ПДКВвн заключается в закрытии выходного отверстия выдоха на время мониторинга давления в дыхательных путях. Такая процедура должна стать привычной, особенно в отношении пациентов высокого риска. Лечебный подход опирается на этиологию. Изменение параметров респиратора (наподобие снижения ЧД или увеличения скорости надува со снижением I:E) может создать условия для полного выдоха. Кроме того, может помочь терапия основного патологического процесса (например, с помощью бронходилататоров). У пациентов с ограничением потока выдоха при обструктивном поражении дыхательных путей положительный эффект был достигнут применением ПДКВн, обеспечившим уменьшение газовой ловушки. Теоретически ПДКВн может действовать как распорка для дыхательных путей, позволяющая осуществить полный выдох. Однако, поскольку ПДКВн добавляется к ПДКВвн, могут возникать тяжёлые расстройства гемодинамики и газообмена.
8. Каковы побочные действия ПДКВн и ПДКВвн?
1. Баротравма – из-за перерастяжения альвеол.
2. Снижение сердечного выброса, которое может быть обусловлено с несколькими механизмами. ПДКВ повышает внутригрудное давление, вызывая рост трансмурального давления в правом предсердии и падение венозного возврата. Кроме того, ПДКВ ведёт к подъёму давления в лёгочной артерии, что затрудняет выброс крови из правого желудочка. Следствием дилатации правого желудочка может стать пролабирование межжелудочковой перегородки в полость левого желудочка, препятствующее наполнению последнего и способствующее снижению сердечного выброса. Всё это проявит себя гипотонией, особенно тяжёлой у больных с гиповолемией.
В обычной практике срочная эндотрахеальная интубация проводится у пациентов с ХОЗЛ и дыхательной недостаточностью. Такие больные пребывают в тяжёлом состоянии, как правило, несколько дней, в течение которых они плохо питаются и не восполняют потери жидкости. После интубации лёгкие пациентов энергично раздуваются для улучшения оксигенации и вентиляции. Ауто-ПДКВ быстро нарастает, и в условиях гиповолемии возникает тяжёлая гипотония. Лечение (если превентивные меры не увенчались успехом) включает интенсивные инфузии, обеспечение условий для более продолжительного выдоха и устранение бронхоспазма.
3. Во время ПДКВ возможна также ошибочная оценка показателей сердечного наполнения (в частности, центрального венозного давления или давления окклюзии лёгочной артерии). Давление, передающееся с альвеол на лёгочные сосуды, может приводить к ложному увеличению этих показателей. Чем более податливы лёгкие, тем большее давление передаётся. Поправку можно сделать с помощью эмпирического правила: из измеренной величины давления заклинивания лёгочных капилляров (ДЗЛК) надо вычесть половину величины ПДКВ, превышающей 5 см Н2О.
4. Перерастяжение альвеол избыточным ПДКВ сокращает кровоток в этих альвеолах, увеличивая мёртвое пространство (МП/ДО).
5. ПДКВ может увеличивать работу дыхания (при триггерных режимах ИВЛ или при спонтанном дыхании через контур респиратора), поскольку больному придётся создавать большее отрицательное давление для включения респиратора.
6. К другим побочным эффектам относятся увеличение внутричерепного давления (ВЧД) и задержка жидкости.
9. Опишите типы вентиляции с ограничением по давлению.
Возможность проведения ограниченной по давлению вентиляции – в триггерном (вентиляция с поддерживающим давлением) или принудительном режиме (вентиляция с управляемым давлением) – появилась на большинстве респираторов для взрослых лишь в последние годы. Для вентиляции новорождённых применение режимов с ограничением по давлению является рутинной практикой. При вентиляции с поддерживающим давлением (PSV) пациент начинает вдох, чем вызывает подачу газа респиратором до заданного – призванного увеличить ДО – давления. Искусственный вдох заканчивается после того, как поток на вдохе упадёт ниже предустановленного уровня, обычно – ниже 25% от максимального значения. Обратите внимание, что давление поддерживается до тех пор, пока поток не станет минимальным. Такие характеристики потока хорошо соответствуют требованиям внешнего дыхания пациента, в результате чего режим переносится с бóльшим комфортом. Данный режим спонтанной вентиляции может быть использован у больных, находящихся в терминальном состоянии, для снижения работы дыхания, затрачиваемой на преодоление сопротивления дыхательного контура и увеличение ДО. Поддержка давлением может применяться совместно с режимом IMV или самостоятельно, с ПДКВ или НПД и без них. Кроме того, было доказано, что PSV ускоряет восстановление спонтанного дыхания после ИВЛ.
При вентиляции с управляемым давлением (PCV) фаза вдоха прекращается после достижения заданного максимального давления. Дыхательный объём зависит от сопротивления дыхательных путей и податливости лёгких. PCV может применяться самостоятельно или в комбинации с другими режимами, например, иИВЛ (IRV) (см. вопрос 10). Характерный для PCV поток (высокий начальный с последующим падением), вероятно, обладает свойствами, улучшающими податливость лёгких и распределение газа. Было высказано мнение, что PCV можно использовать в качестве безопасного и удобного для пациента начального режима вентиляции больных с острой гипоксической дыхательной недостаточностью. В настоящее время на рынок стали поступать респираторы, обеспечивающие минимально гарантированный объём при режиме с управляемым давлением.
10. Имеет ли значение при вентиляции пациента обратное соотношение вдоха и выдоха?
Тип вентиляции, обозначаемый акронимом иИВЛ (IRV), применяется с определённым успехом у больных СОЛП. Сам режим воспринимается неоднозначно, поскольку предполагает удлинение времени вдоха свыше обычного максимума – 50% времени дыхательного цикла при прессоциклической или волюметрической вентиляции. По мере увеличения времени вдоха, соотношение I:E становится инвертированным (например, 1:1, 1.5:1, 2:1, 3:1). Большинство врачей интенсивной терапии не рекомендуют превышать соотношение 2:1 из-за возможного ухудшения гемодинамики и риска баротравмы. Хотя и было показано улучшение оксигенации при удлинении времени вдоха, на эту тему не выполнено ни одного проспективного рандомизированного исследования. Улучшение оксигенации может объясняться несколькими факторами: увеличением среднего Рaw (без увеличения пикового Рaw), раскрытием – в результате замедления инспираторного потока и развития ПДКВвн – дополнительных альвеол, имеющих бóльшую временную константу вдоха. Более медленный поток на вдохе может снижать вероятность развития баро- и волотравмы. Тем не менее, у больных с обструкцией дыхательных путей (например, с ХОЗЛ или астмой), из-за усиления ПДКВвн, данный режим может иметь отрицательное воздействие. Учитывая то, что при иИВЛ больные часто испытывают дискомфорт, может потребоваться их глубокая седация или миорелаксация. В конечном счёте, несмотря на отсутствие неопровержимо доказанных преимуществ метода, следует признать, что иИВЛ может иметь самостоятельное значение в терапии запущенных форм СОЛП.
11. Оказывает ли ИВЛ влияние на различные системы организма, кроме сердечно-сосудистой системы?
Да. Повышенное внутригрудное давление может вызывать или способствовать подъёму ВЧД. В результате длительной назотрахеальной интубации возможно развитие синуситов. Постоянная угроза для больных, находящихся на искусственной вентиляции, заключена в возможности развития госпитальной пневмонии. Достаточно распространёнными являются желудочно-кишечные кровотечения из стрессовых язв, что требует профилактической терапии. Увеличенное образование вазопрессина и сниженный уровень натрийуретического гормона могут привести к задержке воды и соли. Неподвижно лежащие больные, находящиеся в критическом состоянии, подвержены постоянному риску тромбоэмболических осложнений, поэтому здесь вполне уместны профилактические меры. Многие больные нуждаются в седации, а в некоторых случаях – в миорелаксации (см. вопрос 17).
12. Что такое управляемая гиповентиляция с допустимой гиперкапнией?
Управляемая гиповентиляция – это метод, нашедший применение у пациентов, нуждающихся в такой ИВЛ, которая могла бы предотвратить перерастяжение альвеол и возможное повреждение альвеолярно-капиллярной мембраны. Современные данные свидетельствуют, что высокие значения объёмов и давлений могут вызывать или предрасполагать к повреждению лёгких вследствие перерастяжения альвеол. Управляемая гиповентиляция (или допустимая гиперкапния) реализуют стратегию безопасной, ограниченной по давлению вентиляции лёгких, придающей приоритетное значение давлению раздутия лёгких, а не уровню рСО2. Проведённые в связи с этим исследования больных с СОЛП и астматическим статусом показали уменьшение частоты баротравмы, числа дней, потребовавших интенсивной терапии, и летальности. Для поддержания пикового Рaw ниже 35–40 см вод.ст., а статического Рaw – ниже 30 см вод.ст., ДО устанавливают приблизительно в пределах 6–10 мл/кг. Малый ДО оправдан при СОЛП – когда лёгкие поражены негомогенно и вентилироваться способен лишь небольшой их объём. Gattioni и др. описали три зоны в поражённых лёгких: зону ателектазированных патологическим процессом альвеол, зону коллабированных, но ещё способных раскрыться альвеол и небольшую зону (25–30% от объёма здоровых лёгких) способных вентилироваться альвеол. Традиционно задаваемый ДО, существенно превышающий доступный для вентиляции объём лёгких, может вызвать перерастяжение здоровых альвеол и этим усугубить острое повреждение лёгких. Термин «лёгкие ребёнка» был предложен именно в связи с тем, что лишь малая часть объёма лёгких, способна вентилироваться. Вполне допустим постепенный подъём рСО2 до уровня 80–100 мм рт.ст.. Снижение рН ниже 7.20–7.25 может быть устранено введением буферных растворов. Другой вариант – подождать, пока нормально функционирующие почки компенсируют гиперкапнию задержкой бикарбоната. Допустимая гиперкапния обычно хорошо переносится. К возможным неблагоприятным следствиям относится расширение мозговых сосудов, повышающее ВЧД. Действительно, внутричерепная гипертензия является единственным абсолютным противопоказанием для допустимой гиперкапнии. Кроме того, при допустимой гиперкапнии могут встречаться повышенный симпатический тонус, лёгочная вазоконстрикция и сердечные аритмии, хотя все они редко приобретают опасное значение. У пациентов с исходным нарушением функции желудочков может иметь серьёзное значение угнетение сократимости сердца.
13. Какими ещё методами контролируют рСО2?
Существует несколько альтернативных методов контроля рСО2. Пониженное образование СО2 может быть достигнуто глубокой седацией, миорелаксацией, охлаждением (естественно, избегая гипотермии) и снижением количества потребляемых углеводов. Простым методом увеличения клиренса СО2 является трахеальная инсуффляция газа (ТИГ). При этом через эндотрахеальную трубку вводят небольшой (как для проведения отсасывания) катетер, проводя его до уровня бифуркации трахеи. Через этот катетер подают смесь кислорода и азота со скоростью 4–6 л/мин. Это приводит к вымыванию газа мёртвого пространства при неизменных минутной вентиляции и давлении в дыхательных путях. Среднее снижение рСО2 составляет 15%. Данный метод хорошо подходит той категории больных с травмой головы, в отношении которой может быть с пользой применена управляемая гиповентиляция. В редких случаях используют экстракорпоральный метод удаления СО2.
14. Что такое податливость лёгких? Как её определить?
Податливость – это мера растяжимости. Она выражается через зависимость изменения объёма от заданного изменения давления и для лёгких вычисляется по формуле: ДО/(Рaw – ПДКВ). Статическая растяжимость равна 70–100 мл/см вод.ст. При СОЛП она меньше 40–50 мл/см вод.ст. Податливость является интегральным показателем, не отражающим регионарных различий при СОЛП – состоянии, при котором поражённые участки чередуются с относительно здоровыми. Характер изменения податливости лёгких служит полезным ориентиром в определении динамики ОДН у конкретного больного.
15. Является ли вентиляция в положении на животе методом выбора у больных со стойкой гипоксией?
Исследования показали, что в положении на животе у большинства пациентов с СОЛП существенно улучшается оксигенация. Возможно, это связано с улучшением вентиляционно-перфузионных отношений в лёгких. Тем не менее, из-за усложнения сестринского ухода вентиляция в положении на животе не стала привычной практикой.
16. Какого подхода требуют больные, «борющиеся с респиратором»?
Возбуждение, расстройство дыхания или «борьба с респиратором» должны быть серьёзно приняты во внимание, поскольку ряд причин является жизнеугрожаемыми. Для того, чтобы избежать необратимого ухудшения состояния больного, необходимо быстро определиться с диагнозом. Для этого сначала отдельно анализируют возможные причины, связанные с респиратором (аппарат, контур и эндотрахеальная трубка), и причины, относящиеся к состоянию больного. Причины, связанные с состоянием больного, включают гипоксемию, обструкцию дыхательных путей мокротой или слизью, пневмоторакс, бронхоспазм, инфекционные процессы, подобные пневмонии или сепсису, лёгочную эмболию, ишемию миокарда, желудочно-кишечное кровотечение, нарастающую ПДКВвн и беспокойство. К причинам, связанным с респиратором, относят утечку или разгерметизацию контура, неадекватный объём вентиляции или недостаточную FiO2, проблемы с эндотрахеальной трубкой, включая экстубацию, обструкцию трубки, разрыв или деформацию манжетки, неправильную настройку чувствительности триггера или объёмной скорости вдоха. До тех пор, пока с ситуацией не удалось полностью разобраться, необходимо проводить ручную вентиляцию больного 100% кислородом. Без промедления следует провести аускультацию лёгких и проверить показатели жизненно важных функций (включая данные пульсоксиметрии и СО2 в конце выдоха). Если позволяет время, следует выполнить анализ газов артериальной крови и рентгенографию грудной клетки. Для контроля проходимости эндотрахеальной трубки и удаления мокроты и слизистых пробок допустимо быстрое проведение катетера для отсасывания через трубку. При подозрении на пневмоторакс с гемодинамическими расстройствами, следует безотлагательно, не дожидаясь рентгенографии грудной клетки, выполнить декомпрессию. В случае адекватной оксигенации и вентиляции пациента, а также стабильной гемодинамики, возможен более тщательный анализ ситуации, а при необходимости – седация больного.
17. Следует ли использовать миорелаксацию для улучшения условий ИВЛ?
Миорелаксация широко используется для облегчения ИВЛ. Это способствует умеренному улучшению оксигенации, снижает пиковое Рaw и обеспечивает лучшую сопряжённость больного и респиратора. А в таких специфических ситуациях, как внутричерепная гипертензия или вентиляция в необычных режимах (например, иИВЛ или экстракорпоральный метод), миорелаксация может приносить ещё большую пользу. Недостатками миорелаксации являются потеря возможности неврологического обследования, утрата кашля, возможность непреднамеренной миорелаксации больного в сознании, многочисленные проблемы, связанные с взаимодействием препаратов и электролитов, и возможность продлённого блока. Кроме того, нет научных доказательств, что миорелаксация улучшает исходы критических состояний пациентов. Использование миорелаксантов следует хорошо продумать. Пока не выполнена адекватная седация больного, миорелаксацию следует исключить. Если же миорелаксация представляется абсолютно показанной, её следует проводить только после окончательного взвешивания всех за и против. Чтобы избежать продлённого блока, применение миорелаксации, по возможности, следует ограничивать 24–48 часами.
18. Действительно ли есть польза от раздельной вентиляции лёгких?
Раздельная вентиляция лёгких (РИВЛ) представляет собой независимую друг от друга вентиляцию каждого лёгкого обычно с помощью двухпросветной трубки и двух респираторов. Изначально возникшая с целью улучшения условий проведения торакальных операций, РИВЛ была распространена на некоторые случаи в практике интенсивной терапии. Здесь кандидатами для раздельной вентиляции лёгких могут стать пациенты с односторонним поражением лёгких. Показано, что данный вид вентиляции улучшает оксигенацию у пациентов с односторонними пневмониями, отёками и ушибами лёгких. Защита здорового лёгкого от попадания содержимого поражённого лёгкого, достигаемая изоляцией каждого из них, может стать спасительной для жизни пациентов с массивным кровотечением или абсцессом лёгких. Кроме того, РИВЛ может оказаться полезной у больных с бронхоплевральным свищом. Применительно к каждому лёгкому могут быть установлены индивидуальные параметры вертиляции, включая значения ДО, скорости потока, ПДКВ и НПД. Нет никакой необходимости в синхронизации работы двух респираторов, поскольку, как показывает практика, стабильность гемодинамики лучше достигается при асинхронной их работе.
Полезная статья? Поделитесь с друзьями из соцсетей!
Возврат к списку
www.medcom.ru
Рациональные параметры искусственной вентиляции легких
Рациональная методика ИВЛ может сделать ее высокоэффективной и в то же время практически безопасной, если она основана на обеспечении адекватного газообмена при максимальном ограничении вредных эффектов, а также при сохранении субъективного ощущения «дыхательного комфорта» у больного, если он во время ИВЛ остается в сознании.
Понятие «рациональная методика» подразумевает прежде всего рациональный выбор для данного больного следующих параметров ИВЛ: минутной вентиляции, дыхательного объема, частоты вентиляции, давления на вдохе и на выдохе (а также особенностей его изменения в течение дыхательного цикла), отношения продолжительности вдоха и выдоха, скорости вдувания газов (а также особенностей ее изменения в течение дыхательного цикла).
Указанные параметры тесно связаны и обусловливают друг друга. Тем не менее при выборе конкретных величин параметров ИВЛ одному из них придается значение основного, определяющего величину всех остальных. Таким основным параметром является минутный объем вентиляции.
Минутный объем вентиляции. ИВЛ только тогда выполнит свое назначение, когда обеспечит достаточный минутный объем альвеолярной вентиляции, какими бы при этом ни оказались другие параметры.
При ИВЛ достаточную вентиляции можно определить как обмен вентиляционных объемов между внешней средой и легкими, необходимый для поддержания нормального напряжения углекислого газа в артериальной крови. Величина достаточной вентиляции зависит от величины общего мертвого пространства (к которой следует прибавить также и величину «мертвого пространства аппарата»), а также от количества углекислого газа, выделяемого в организме больного.
Как указывалось выше, величиной, характеризующей легочную вентиляцию, является не минутный объем дыхания, а минутный объем альвеолярной вентиляции, который равен разности дыхательного объема и общего объема мертвого пространства, умноженной на частоту дыхания. При этом выбираемыми для ИВЛ параметрами являются дыхательный объем и частота дыхания.
Дыхательный объем. Он должен быть достаточным для «промывки» мертвого пространства и удаления углекислого газа из альвеолярного воздуха. Если дыхательный объем будет меньше или равен объему мертвого пространства, то теоретически альвеолярная вентиляция должна быть равна нулю. Однако практически при дыхательном объеме, который меньше объема мертвого пространства, незначительное количество вдыхаемого газа все же достигает альвеол [Briscoe et al., 1951]. Это происходит главным образом в результате конического (слойного) движения вдыхаемого газа по воздухоносным путям и диффузии газа в газовой среде.
Для здорового человека размеры физиологического мертвого пространства и количество выделяемого углекислого газа могут быть высчитаны с достаточной точностью, что позволило Radford и соавт. (1954, 1955) предложить способ определения необходимого объема вентиляции.
С учетом объема мертвого пространства и необходимой минутной вентиляции Radford и соавт. составили номограмму для определения оптимального дыхательного объема, обусловленного полом и массой тела пациента, частотой дыхания и температурой тела (рис. 3).
Номограмма Рэдфорда составлена для определения оптимального дыхательного объема в обычных условиях основного обмена. Условия при наркозе или проведении реанимационных мероприятий значительно отличаются от условий основного обмена. Поэтому в найденную по номограмме величину оптимального дыхательного объема вводят поправки с учетом ряда факторов:
1) при повышенной температуре тела необходимый дыхательный объем увеличивают на 5% на каждые 0,5°С сверх 37°С;
2) при «обычной активности» увеличивают дыхательный объем на 10% по сравнению с таковым в условиях основного обмена;
3) в местностях выше уровня моря дыхательный объем увеличивают на 5% на каждые 600 м;
4) при применении медикаментов, обладающих катаболическим действием (например, атропин, этиловый эфир), увеличивают дыхательный объем в среднем на 20%;
5) при ИВЛ через трахеальную трубку (или трахеостомическую канюлю) дыхательный объем уменьшают на 30 — 50 мл, так как трахеальная интубация (или трахеостомия) уменьшает мертвое пространство;
6) объем присоединительных частей аппарата (маска, тройник, коннектор и т.д.) прибавляют к дыхательному объему, найденному по номограмме Рэдфорда;
7) повышенное давление в аппарате во время фазы вдоха приводит к некоторому растяжению обычных гофрированных шлангов на всем пути газовой смеси от аппарата до тройника. На заполнение возросшего объема шлангов уходит некоторая часть подаваемого дыхательного объема; ее величина зависит от растяжимости шлангов и давления во время дыхательного цикла. С учетом этого фактора корригируют подаваемый аппаратом дыхательный объем. Значимость этого фактора особенно возрастает при высокочастотной ИВЛ с относительно малым дыхательным объемом и высокой величиной ПДКВ.
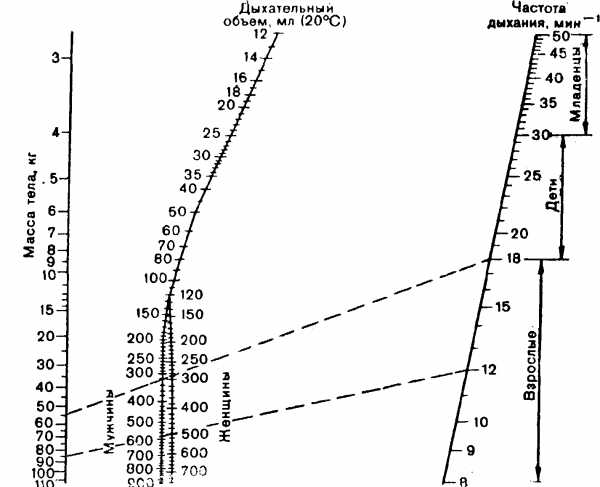
3, Номограмма для определения оптимального дыхательного объема [по Radford et al., 1954].
Практически при определении оптимального дыхательного объема для ИВЛ нужно учитывать сумму перечисленных факторов. Кроме того, при ИВЛ могут, быть регионарные нарушения вентиляционно-перфузионных отношений с увеличением доли альвеолярного мертвого пространства, что само по себе требует увеличения, нередко значительного, объема вентиляции. Поэтому при ИВЛ величину дыхательного объема, найденную по номограмме Рэдфорда, увеличивают в среднем на 30%. Т.М. Дарбинян (1976) предложил следующую формулу для расчета минутного объема вентиляции:
MOB (л/мин) = масса_тела/10 кг + 1.
В.С. Ширяев и А.Л. Тверской (1979) подтвердили приемлемость этой формулы.
Не следует забывать о возможной утечке вдыхаемого газа на пути от аппарата до легких пациента. Утечка бывает непредвиденной (из-за плохой герметизации системы) или преднамеренной (открытие предохранительного клапана). Всякая утечка газа должна быть вовремя обнаружена, устранена или учтена при подаче необходимого дыхательного объема.
Для контроля адекватности вентиляции наряду с измерением напряжения углекислого газа в крови необходимо измерять минутную вентиляцию и дыхательный объем. Достоверные данные позволяет получить только непосредственное измерение дыхательного объема с помощью специальных приборов (вентилометр, спиромонитор). Для большей точности измерений приборы или их датчики устанавливают в линии выдоха.
Одновременно с измерением дыхательного объема необходимо измерять максимальное давление вдоха с помощью мановакуумметра, который есть у аппаратов ИВЛ практически всех типов. Измерение давления на вдохе позволяет (при известном дыхательном объеме) весьма приблизительно вычислить растяжимость легких и грудной клетки (как отношение величины дыхательного объема к величине давления вдоха). Уменьшение растяжимости имеет важное прогностическое значение прежде всего как ранний признак легочных осложнений с нарушением вентиляционно-перфузиоииых отношений. Кроме того, если применяется аппарат ИВЛ с переключением по давлению, то нераспознанное уменьшение растяжимости легких и грудной клетки неизбежно приведет к уменьшению дыхательного объема со всеми нежелательными последствиями.
Частота дыхания. Не менее важно рационально выбрать частоту дыхания. Многие авторы считают оптимальной частоту 14 — 18 в минуту при ИВЛ у взрослых [Максимов Б.П., 1979; Herzog, 1970; Bergman, 1972]. Вполне допустимы колебания частоты от 10 — 12 [Афинский Н.П., 1972; Pontoppidan, 1965] до 20 — 22 в минуту [Кассиль В.Л., Рябова Н.М., 1977].
Слишком редкое дыхание нерационально, так как при нем значительно возрастает необходимый дыхательный объем, что может привести к чрезмерно высокому и опасному «пику давления», к перерастяжению стенок альвеол и баротравме легких. Кроме того, слишком редкое дыхание с большими экспираторными паузами может вызвать так называемую циклическую гипоксемию [Bergman, 1961].
При более частом дыхании можно подобрать такой дыхательный объем, чтобы альвеолярная вентиляция оставалась нормальной. Так, Gray и соавт. (1959) для максимального уменьшения «пика давления» в альвеолах и среднего внутригрудного давления первыми предложили применять частое дыхание (до 50 — 60 в минуту) при снижении дыхательного объема до 250 мл.
Недостаточная и избыточная вентиляция. Что же является показателем достаточности вентиляции: нормальное содержание О2 или СО2 в крови, оттекающей от легкого?
Насыщение крови кислородом зависит не только от величины вентиляции, но и от распределения вентиляции и кровотока, существования артериовенозных шунтов, диффузионной способности альвеоло-капиллярных мембран, а при вдыхании газовой смеси — еще и от содержания в ней кислорода. В то же время удаление углекислого газа зависит практически только от альвеолярной вентиляции. Легко представить случай, когда вследствие значительного нарушения диффузии кровь легочных капилляров не будет достаточно насыщена кислородом (если во вдыхаемой смеси газов парциальное давление кислорода не будет повышенным), какой бы величины ни достигла вентиляция, в то время как содержание углекислого газа в крови легочных капилляров будет нормальным. При значительном уменьшении дыхательного объема, по высоком содержании кислорода во вдыхаемой газовой смеси гииоксемии может и не быть, но обязательно наступят задержка углекислого газа и гиперкапния.
Таким образом, достаточность минутного объема вентиляции определяется нормальным содержанием углекислого газа в крови, оттекающей от легкого. В свою очередь содержание углекислого газа в артериальной крови может быть определено по его содержанию в альвеолярном воздухе, которое в норме составляет приблизительно 5,6% (РАсо2 соответственно равно 40 мм рт. ст). Следовательно, можно заключить, что при нормально функционирующих легких достаточным будет тот объем вентиляции, при котором содержание СО2 в альвеолярном воздухе составит приблизительно 5,6%.
Гиповентиляция во время ИВЛ, когда больному подают смесь газов с повышенным содержанием кислорода, редко приводит к гипоксемии, но всегда вызывает задержку и накопление углекислого газа в альвеолярном воздухе и в крови, т.е. гипоркапнию.
Однако ИВЛ нередко сопровождается не гипо-, а гипервентиляцией, результатом которой становится гипокапния. Умеренная альвеолярная гипервентиляция (при напряжении CO2 в артериальной крови, равном 30 — 35 мм рт. ст.) почти никогда не является опасной. «Неинструментальная» диагностика гипер-, а особенно гипокапнии во время ИВЛ трудна и требует опыта и наблюдательности. Наиболее надежные результаты дает измерение напряжения углекислого газа в артериальной крови. Можно также измерить содержание углекислого газа в альвеолярном воздухе. Следует помнить, что концентрации (напряжение) альвеолярного и артериального CO2 могут считаться равными только у больных с нормальной функцией легких. При выраженных расстройствах отношения вентиляция/перфузия альвеолоартериальный градиент СО2 неопределенно увеличен и непостоянен, да и сам анализируемый в этих случаях газ представляет собой не альвеолярный, а так называемый конечно-выдыхаемый газ (end-expiration gas английских авторов).
На практике важно знать, как быстро меняется концентрация CO2 в альвеолярном воздухе при тех или иных изменениях вентиляции. Допустим, что врач обнаружил у пациента признаки, гиперкапнии. Сколько времени нужно проводить гипервентиляцию, чтобы удалить избыток СО2 из альвеол? Dripps, Severinghaus (1955), ссылаясь на опыты Fenn, Rahn, Utis, утверждают, что требуется не менее 4 мин интенсивной гинервентиляции, чтобы получить стойое снижение альвеолярной концентрации СО2 на 50% от исходного уровня. Таким образом, если в результате гиповентиляции РАсо2 поднялось с 40 до 80 мм рт. ст., то потребуется не менее 4 мин гипервентиляции, чтобы нормализовать содержание СО2 в альвеолах. Разумеется, что при большем накоплении углекислого газа нужна еще более длительная гипервентиляция. Все указанное верно и тогда, когда у пациента имеется не гипер-, а гипокапния в результате гипервентиляции и когда необходимо поднять содержание СО2 до нормальных цифр. Конечно, и в этом случае нужна довольно длительная нормальная или пониженная (допустима только при высоком содержании кислорода во вдыхаемой смеси газов) вентиляция, чтобы вернуть содержание СО2 в альвеолах к нормальным цифрам.
Отметим, что для изменения концентрации альвеолярного кислорода нужно гораздо меньше времени: достаточно, например, нескольких глубоких вдохов газовой смеси с высоким содержанием кислорода, чтобы вывести больного из состояния дыхательной гипоксии. Разница связана с тем, что емкость крови и тканей для углекислоты гораздо выше, чем для кислорода.
Снижение максимального и среднего давлений в легких. Мы отмечали уже, что больному при всех условиях должен быть обеспечен достаточный минутный объем вентиляции. Однако совершенно не безразлично, ценой какого давления в легких будет достигнут этот объем вентиляции. Как показали ставшие классическими исследования, вредные эффекты ИВЛ связаны прежде всего с повышением среднего виутрилегочного давления. Поэтому долго считали рациональной такую методику ИВЛ, при которой дыхательные потребности пациента удовлетворяются при наиболее низком среднем давлении в легких.
Считалось общепринятым, что «пик давления» в легких на высоте вдоха не должен превышать 20 см вод.ст., и лишь во время коротких периодов раздувания легких допустимо давление, превышающее 30 см вод.ст. Желательно, чтобы среднее внутрилегочное давление не превышало 4 — 5 см вод.ст. Со времен исследований Frey, Stoffregen (1959) оптимальным считался такой режим ИВЛ, при котором среднее внутрилегочное давление стремится к нулю, как при спонтанном дыхании.
Дыхательные потребности больного во время ИВЛ при минимальном среднем давлении в легких можно обеспечить при соблюдении следующих условий.
1. Положительное давление в легких должно поддерживаться только во время введения в легкие требуемого дыхательного объема. Иными словами, выдох должен начинаться немедленно после введения газа в легкие, без задержки после вдоха. Задержка газа в легких после окончания вдувания (пауза вдоха), как при использовании некоторых моделей аппаратов ИВЛ, приводит к появлению «плато» на кривой давления и к увеличению среднего внутрилегочного давления.
Паузой вдоха следует называть ту часть вдоха, во время которой вдувание газа в легкие пациента уже прекратилось, а выдох еще не начался. С технической точки зрения пауза вдоха характеризуется тем, что линии вдоха и выдоха аппарата перекрыты и от пациента отсоединены, поэтому скорость вдувания равна нулю, а давление «во рту» и дыхательный объем не увеличиваются (рис. 4). Ряд авторов, начиная с Engstrorn (1963), считают, что наличие «плато» способствует равномерности внутрилегочного распределения вентиляции [Максимов Б.П., 1979; Damman, McAslan, 1977; Zietz, 1981]. Вместе с тем специальные клинические исследования с применением азотографического метода определения равномерности вентиляции [Юревич В.М., 1966], равно как и экспериментальные исследования на модели легких [Черкасова А.А., 1970], не выявили отличий в равномерности распределения вентиляции при проведении ИВЛ с «плато» на вдохе и без него. Nordstrom (1972) в весьма обстоятельных экспериментальных исследованиях обнаружил, что Pao2 и Расо2 не имеют различий при ИВЛ с «плато» на вдохе и без него. Зато при наличии «плато» на вдохе было отмечено уменьшение минутного и ударного объема сердца, снижение артериального давления, а также снижение проходимости сосудов легкого (что эквивалентно уменьшению легочного кровотока). Клинические исследования Б.П. Максимова (1979) также показали, что введение паузы вдоха, составляющей по времени 20% от длительности всего дыхательного цикла, приводит к повышению среднего внутрилегочного давления на 43% и сопровождается снижением венозного возврата крови и производительности работы сердца.
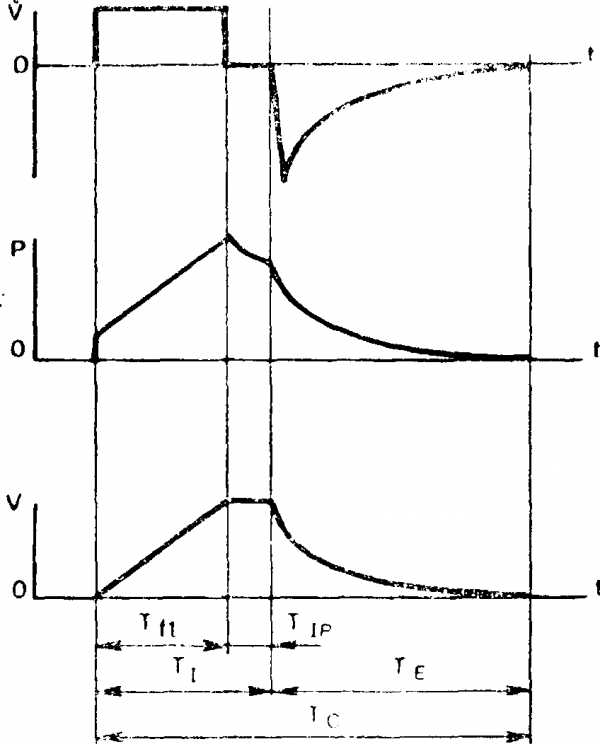
Тff, — продолжительность вдуоания;
TI — продолжительность вдоха:
ТE — продолжительность выдоха:
TC — продолжительность дыхательного цикла;
ТIP — продолжительность паузы вдоха.
Представляет несомненный интерес рассмотреть процессы, происходящие в легких при наличии или отсутствии паузы вдоха с использованием математической двухкамерной модели легких. Характеристиками модели служат общие значения растяжимости (Со) и сопротивления (Ro), a также регионарные значения этих параметров: для левой камеры Ci и Ri, для правой камеры Са и R2.
Методика нашего исследования заключалась в расчете и сопоставлении объемов газа (V1, V2), поданных в каждую камеру, и возникающих там давлений P1, Р2 (для модели в целом — V0 и Р0). При этом рассмотрены два режима ИВЛ: с паузой на вдохе и без паузы, обеспечивающих одну и ту же вентиляцию. Кроме того, исследования основывались на том, что давления на входе в каждую камеру равны между собой, а объемная скорость вдувания в модель равна сумме объемных скоростей вдувания газа в каждую из камер:
V0 = V1 + V2.
Чтобы приблизить результаты расчетов к реальной клинической ситуации, они были выполнены для следующих пяти комбинаций характеристик камер модели:
модель 1 — в целом имеет типовое значение растяжимости и несколько увеличенное (для получения контрастных результатов) значение сопротивления. Характеристики каждой камеры одинаковы, что соответствует отсутствию легочной патологии;
модель 2 — при прежних значениях характеристик модели в целом моделируется рестриктивно-обструктивная патология в левой камере: снижается ее растяжимость и одновременно увеличивается сопротивление. Изменения характеристик подобраны так, чтобы постоянные времени камер (тау=RC) сохранили прежнее и равное предыдущей ситуации значение;
модель 3 — сохраняя неизменными значения характеристик модели в целом, моделируется маловероятная ситуация, при которой снижение растяжимости в левой камере сопровождается уменьшением ее сопротивления; в правой камере характеристики изменяются в обратном направлении. Существенная особенность этого случая — резкое различие (в 16 раз) постоянной времени камер;
модель 4 — рестриктивная патология: растяжимость левой камеры по сравнению с правой снижается, но сопротивления камер остаются равными между собой и соответствующими первой ситуации. Общие характеристики модели остаются теми же, что и в других ситуациях;
модель 5 — обструктивная патология в правой камере:
при нормальных и одинаковых значениях растяжимости сопротивление правой камеры значительно увеличивается. Общие характеристики модели остаются неизменными.
Количественные значения параметров камер, принятые в расчетах, приведены в табл. 2.
Таблица 2
studfiles.net
Параметры ИВЛ. | Реаниматологическая школа профессора С.В. Царенко
При разработке подходов к подбору параметров ИВЛ нам пришлось преодолеть ряд предубеждений, традиционно «кочующих» из одной книги в другую и для многих реаниматологов ставших практически аксиомами. Эти предубеждения можно сформулировать следующим образом:
•ИВЛ вредна для мозга, так как повышает ВЧД и опасна для центральной гемодинамики, так как снижает сердечный выброс.
•Если врач вынужден проводить ИВЛ у пострадавшего с тяжелой ЧМТ, ни в коем случае нельзя применять PEEP, так как это еще больше повысит внутригрудное давление и усилит отрицательные эффекты ИВЛ на мозг и центральную гемодинамику.
•Повышенные концентрации кислорода во вдыхаемой больным смеси опасны из-за вызываемого ими спазма сосудов мозга и прямого повреждающего эффекта на легкие. Кроме того, при проведении оксигенотерапии имеются возможность угнетения дыхания из-за снятия гипоксической стимуляции дыхательного центра.
Специально проведенные нами исследования показали, что бытующие представления об отрицательном влиянии аппаратного дыхания на внутричерепное давление не имеют под собой почвы. ВЧД при проведении ИВЛ может повышаться не из-за простого факта перевода больного со спонтанной вентиляции на поддержку респиратором, а из-за возникновения борьбы больного с респиратором. Влияние перевода больного с самостоятельного дыхания на искусственную вентиляцию легких на показатели церебральной гемодинамики и оксигенации мозга был исследован нами у 43 пострадавших с тяжелой ЧМТ.
Респираторная поддержка начиналась ввиду угнетения уровня сознания до сопора и комы. Признаки дыхательной недостаточности отсутствовали. При проведении ИВЛ у большинства пациентов отмечена нормализация церебральной артериовенозной разницы по кислороду, что свидетельствало об улучшении его доставки к мозгу и купировании церебральной гипоксии. При переводе больных со спонтанного дыхания на искусственную вентиляцию легких существенных изменений ВЧД и ЦПД не было.
Совершенно другая ситуация складывалась при несинхронности дыхательных попыток больного и работы респиратора. Подчеркнем, что нужно различать два понятия. Первое понятие – это несинхронность дыхания больного и работы респиратора, присущее ряду современных режимов вентиляции (в частности BiPAP), когда независимо друг от друга существуют спонтанное дыхание и механические вдохи. При правильном подборе параметров режима данная несинхронность не сопровождается повышением внутригрудного давления и каким-либо отрицательным влиянием на ВЧД и центральную гемодинамику. Второе понятие – борьба больного с респиратором, которая сопровождается дыханием пациента через закрытый контур аппарата ИВЛ и вызывает повышение внутригрудного давления более 40-50 см вод. ст. «Борьба с респиратором» очень опасна для мозга. В наших исследованиях получена следующая динамика показателей нейромониторинга — снижение церебральной артериовенозной разницы по кислороду до 10-15% и повышение ВЧД до 50 мм рт.ст. и выше. Это свидетельствовало о развитии гиперемии мозга, вызывавшей нарастание внутричерепной гипертензии.
На основании проведенных исследований и клинического опыта для предупреждения борьбы с респиратором мы рекомендуем применять специальный алгоритм подбора параметров вспомогательной вентиляции.
Алгоритм подбора параметров ИВЛ.
Устанавливают так называемые базовые параметры вентиляции, обеспечивающие поступление кислородно-воздушной смеси в режиме нормовентиляции: VT = 8-10 мл/кг, FPEAK = 35-45 л/мин, f = 10-12 в 1 мин, PEEP = 5 см вод. ст., нисходящая форма потока. Величина МОД должна составлять 8-9 л/мин. Обычно используют Assist Control или SIMV + Pressure Support, в зависимости от вида респиратора. Подбирают такую чувствительность триггера, которая будет достаточно высокой, чтобы не вызывать десинхронизации больного и респиратора. В то же время она должна быть достаточно низкой, чтобы не вызывать аутоциклирования аппарата ИВЛ. Обычная величина чувствительности по давлению (-3)–(-4) см вод. ст., по потоку (-2)–(-3) л/мин. В результате больному обеспечивается поступление гарантированного минутного объема дыхания. При возникновении дополнительных дыхательных попыток респиратор увеличивает поступление кислородно-воздушной смеси. Такой подход удобен и безопасен, однако требует постоянного контроля над величиной МОД, paCO2, насыщения кислородом гемоглобина в венозной крови мозга, так как имеется опасность развития пролонгированной гипервентиляции.
Что касается возможных расстройств гемодинамики при проведении ИВЛ, то к этому выводу приходят обычно на основании следующей цепочки умозаключений: «ИВЛ проводится методом вдувания воздуха в легкие, поэтому при ней повышается внутригрудное давление, что вызывает нарушения венозного возврата к сердцу. В результате повышается ВЧД и падает сердечный выброс». Однако вопрос не столь однозначен. В зависимости от величины давления в дыхательных путях, состояния миокарда и степени волемии при проведении ИВЛ сердечный выброс может как повышаться, так и снижаться.
Следующей проблемой при проведении ИВЛ у пострадавших с ЧМТ является безопасность применения повышенного давления в конце выдоха (РЕЕР). Хотя G. МcGuire et al. (1997) продемонстрировали отсутствие существенных изменений ВЧД и ЦПД при повышении РЕЕР до 5, 10 и 15 см вод.ст. у пациентов с разным уровнем внутричерепной гипертензии, мы провели собственное исследование. По нашим данным, в первые 5 сут тяжелой ЧМТ при величинах PEEP к концу выдоха 5 и 8 см вод.ст. отмечались незначительные изменения ВЧД, что позволяло сделать вывод о допустимости применения этих значений РЕЕР с точки зрения внутричерепной гемодинамики. В то же время уровень РЕЕР 10 см вод.ст. и выше у ряда больных существенно влиял на ВЧД, повышая его на 5 мм рт. ст. и более. Следовательно, такое повышение давления в конце выдоха можно использовать только при незначительной исходной внутричерепной гипертензии.
В реальной клинической практике проблема влияния PЕEP на ВЧД не встает столь остро. Дело в том, что вызываемое применением РЕЕР повышение внутригрудного давления по-разному влияет на давление в венозной системе в зависимости от степени повреждения легких. В случае здоровых легких с нормальной податливостью повышение РЕЕР распределяется примерно поровну между грудной клеткой и легкими. На венозное давление влияет только давление в легких. Приведем примерный расчет: при здоровых легких повышение РЕЕР на 10 см вод. ст. будет сопровождаться повышением ЦВД и ВЧД на 5 см вод. ст. (что составляет примерно 4 мм рт. ст.). В случае увеличения жесткости легких повышение РЕЕР в основном приводит к растяжению грудной клетки и практически вообще не сказывается на внутрилегочном давлении. Продолжим расчеты: при пораженных легких повышение РЕЕР на 10 см вод. ст. будет сопровождаться повышением ЦВД и ВЧД лишь на 3 см вод. ст. (что составляет примерно 2 мм рт. ст.). Таким образом, в тех клинических ситуациях, в которых необходимо значительное повышение PEEP (остром повреждении легких и ОРДС), даже большие его величины существенно не влияют на ЦВД и ВЧД.
Еще одна проблема – возможные отрицательные эффекты повышенных концентраций кислорода. В нашей клинике у 34 пациентов специально исследовано влияние оксигенации 100%-ным кислородом продолжительностью от 5 до 60 мин на тонус сосудов головного мозга. Ни в одном из клинических случаев не отмечено снижения ВЧД. Этот факт свидетельствовал о том, что внутричерепной объем крови не изменялся. Следовательно, не было сужения сосудов и развития церебрального вазоспазма. Вывод подтверждало исследование линейной скорости кровотока в крупных артериях мозга методом транскраниальной допплерографии. Ни у одного из обследованных больных при подаче кислорода линейная скорость кровотока в средней мозговой, передней мозговой и основной артериях достоверно не менялась. Существенных изменений АД и ЦПД при оксигенации 100%-ным кислородом нами также не отмечено. Таким образом, из-за особой чувствительности пострадавшего мозга к гипоксии нужно полностью отказаться от проведения ИВЛ с использованием чисто воздушных смесей. Необходимо применение кислородно-воздушных смесей с содержанием кислорода 0,35-0,5 (чаще всего 0,4) в течение всего периода проведения искусственной и вспомогательной вентиляции легких. Мы не исключаем возможности применения и более высоких концентраций кислорода (0,7-0,8, вплоть до 1,0) для целей экстренной нормализации оксигенации головного мозга. Этим достигается нормализация повышенной артериовенозной разницы по кислороду. Применение повышенного содержания кислорода в дыхательной смеси нужно стремиться ограничить короткими сроками, учитывая известные повреждающие эффекты гипероксигенации на легочную паренхиму и возникновение абсорбционных ателектазов.
Немного физиологии
Как всякое лекарство, кислород может быть и полезен, и вреден. Извечная проблема реаниматолога: «Что опаснее для больного – гипоксия или гипероксия?». О негативных эффектах гипоксии написаны целые руководства, поэтому отметим ее главный отрицательный эффект. Для того чтобы нормально функционировать, клетки нуждаются в энергии. Причем не в любом виде, а только в удобной форме, в виде молекул–макроэргов. В процессе синтеза макроэргов образуются лишние атомы водорода (протоны), эффективно удалить которые можно только по так называемой дыхательной цепочке путем связывания с атомами кислорода. Для работы этой цепочки нужно большое количество кислородных атомов.
Однако использование высоких концентраций кислорода тоже может запускать ряд патологических механизмов. Во-первых, это образование агрессивных свободных радикалов и активация процесса перекисного окисления липидов, сопровождающегося разрушением липидного слоя клеточных стенок. Особенно этот процесс опасен в альвеолах, так как они подвергаются действию наибольших концентраций кислорода. При длительной экспозиции 100%-ный кислород может вызывать поражение легких по типу ОРДС. Не исключено участие механизма перекисного окисления липидов в поражении других органов, например мозга.
Во-вторых, если в легкие поступает атмосферный воздух, то он на 21% состоит из кислорода, нескольких процентов водяных паров и более чем на 70% из азота. Азот – химически инертный газ, в кровь не всасывается и остается в альвеолах. Однако химически инертный – это не означает бесполезный. Оставаясь в альвеолах, азот поддерживает их воздушность, являясь своеобразным экспандером. Если воздух заменить чистым кислородом, то последний может полностью всосаться (абсорбироваться) из альвеолы в кровь. Альвеола спадется, и образуется абсорбционный ателектаз.
В-третьих, стимуляция дыхательного центра вызывается двумя путями: при накоплении углекислоты и недостатке кислорода. У пациентов с резко выраженной дыхательной недостаточностью, особенно у так называемых «дыхательных хроников», дыхательный центр постепенно становится нечувствителен к избытку углекислоты и основное значение в его стимуляции приобретает недостаток кислорода. Если этот недостаток купировать введением кислорода, то из-за отсутствия стимуляции может произойти остановка дыхания.
Наличие негативных эффектов повышенных концентраций кислорода диктует настоятельную необходимость сокращения времени их использования. Однако если больному угрожает гипоксия, то ее отрицательное влияние гораздо опаснее и проявится быстрее, чем негативный эффект гипероксии. В связи с этим для профилактики эпизодов гипоксии необходимо всегда применять преоксигенацию больного 100% кислородом перед любой транспортировкой, интубацией трахеи, сменой интубационной трубки, трахеостомией, санацией трахеобронхиального дерева. Что касается угнетения дыхания при повышении концентрации кислорода, то указанный механизм действительно может иметь место при ингаляции кислорода у больных с обострением хронической дыхательной недостаточности. Однако в этой ситуации необходимо не увеличение концентрации кислорода во вдыхаемом воздухе при самостоятельном дыхании больного, а перевод больного на искусственную вентиляцию, что снимает актуальность проблемы угнетения дыхательного центра гипероксическими смесями.
Кроме гиповентиляции, приводящей к гипоксии и гиперкапнии, опасной является и гипервентиляция. В наших исследованиях, как и в других работах (J. Muizelaar et al., 1991), установлено, что необходимо избегать намеренной гипервентиляции. Возникающая при этом гипокапния вызывает сужение сосудов мозга, увеличение церебральной артериовенозной разницы по кислороду, уменьшение мозгового кровотока. В то же время, если по какой-либо причине, например, из-за гипоксии или гипертермии, у больного развивается спонтанная гипервентиляция, то не все средства хороши для ее устранения.
Необходима коррекция причины, вызвавшей повышение объема минутной вентиляции. Нужно снизить температуру тела, используя ненаркотические анальгетики и (или) физические методы охлаждения, устранить гипоксию, вызванную обструкцией дыхательных путей, недостаточной оксигенацией дыхательной смеси, гиповолемией, анемией. При необходимости возможно применение седативных препаратов в расчете на снижение потребления организмом кислорода и уменьшение необходимой минутной вентиляции легких. Однако нельзя просто применить миорелаксанты и навязать больному желаемый объем вентиляции при помощи аппарата ИВЛ, так как существует серьезная опасность резкой внутричерепной гипертензии из-за быстрой нормализации уровня углекислоты в крови и гиперемии церебральных сосудов. Мы уже приводили результаты наших исследований, которые показали, что нежелательно не только повышение уровня углекислоты выше нормы 38-42 мм рт.ст., но даже быстрая нормализация значений раСО2 после периода длительной гипокапнии.
При выборе параметров вентиляции очень важно оставаться в рамках концепции «open lung rest» (A. Doctor, J. Arnold, 1999). Современные представления о ведущем значении баро- и волюмотравмы в развитии повреждения легких при ИВЛ диктуют необходимость тщательного контроля пикового давления в дыхательных путях, которое не должно превышать 30-35 см вод.ст. При отсутствии поражения легких дыхательный объем, подаваемый респиратором, составляет 8-10 мл/кг массы больного. При выраженном поражении легких дыхательный объем не должен превышать 6-7 мл/кг. Для профилактики коллабирования легких используют РЕЕР 5-6 см вод. ст., а также периодические раздувания легких полуторным дыхательным объемом (sigh) или повышение РЕЕР до 10-15 см. вод. ст. на протяжении 3-5 вдохов (1 раз на 100 дыхательных движений).
www.reancenter.ru
2. Основные параметры ИВЛ. Классификация аппаратов ИВЛ и принцип их работы
Похожие главы из других работ:
Аппараты электронного парамагнитного резонанса
1.2 Основные параметры спектров ЭПР
Основными параметрами спектра ЭПР являются интенсивность, форма и ширина резонансной линии, g-фактор, константы тонкой и сверхтонкой (СТС) структуры. На практике обычно регистрируется 1-я, реже 2-я производные кривой поглощения…
Изготовление зубных протезов из акриловой пластмассы
Глава 3. Влияние акриловых базисных пластмасс различных производителей на параметры слизистой оболочки рта
По данным Всемирной организаци здравоохранения (Информационный бюллетень №318, май 2012 г.), полная потеря естественных зубов — широко распространенная патология, особенно среди пожилых людей…
Магниторезонансная томография
4. Основные блоки МРТ
магнитный резонанс томография спиновое Из электронных узлов, обеспечивающих действие системы, наибольший интерес представляют блоки радиочастотной группы. Структурная схема…
Мази в аптечной практике
2.1 Основные требования
К мазям предъявляется ряд требований, таких как: 1. Мази должны иметь мягкую консистенцию для удобства нанесения их на кожу и слизистые оболочки и образования на поверхности ровной сплошной пленки. 2…
Методы литотрипсии и аппараты для ее реализации
2.2 Параметры литотрипторов
Рабочая дистанция Под рабочей дистанцией понимается расстояние от источника излучателя ударно-волновых импульсов (F1) до терапевтического фокуса (F2), т. е. характеристика…
Мониторинг нервной системы у туристов
3. Параметры нервной системы
О силе нервных процессов можно судить по таким критериям, как смелость, настойчивость, активность, целеустремленность, воля к победе, упорство в овладении спортивными навыками. Важным признаком является отношение к неудачам…
Общие принципы работы медицинского ультразвукового диагностического оборудования
2. Метрологические прослеживаемые акустические параметры, характеризующие ультразвуковое излучение медицинского ультразвукового оборудования
ГОСТ IEC 61157-2013 «Государственная система обеспечения единства измерений. Изделия медицинские электрические. Приборы ультразвуковые диагностические…
Основные положения биофармацевтического анализа
1.4 Влияние различных факторов, на фармакокинетические параметры
Основные группы факторов, влияющих на фармакокинетику лекарственных средств: Биохимические особенности организма (ферментопатии, различия в скорости метаболизма). Физиологические особенности — пол, возраст, масса тела, циркадные ритмы…
Основы сердечно-лёгочной реанимации
1.1 Гемодинамические параметры
В подавляющем большинстве случаев сдавливание закрытой грудной клетки приводит к тяжелому состоянию вследствие низкого кровотока. В эксперименте на животных сердечный выброс при этом колеблется в пределах от 17 до 27 % значений…
Острая сердечно-сосудистая недостаточность
1. ПАРАМЕТРЫ ЦЕНТРАЛЬНОЙ ГЕМОДИНАМИКИ
Основными факторами, характеризующими состояние кровообращения и его эффективность, являются МОС, общее периферическое сопротивление сосудов и ОЦК. Эти факторы взаимообусловлены и взаимосвязаны и являются определяющими…
Очерки медицины
3.4 Варианты и параметры факторов гемодинамики
Табл.3…
Очерки медицины
Варианты и параметры факторов гемодинамики
№ вар. Варианты гемодинамики СИ, л/мин/м2 ОПСС, дин•с•см-5 МПК, Вт/м2 САД > 100 мм. рт. ст. 1 Гипокинетическая гипертензия с вазоконстрикцией и гиподинамией сердца < 2,4 > 3404 < 0…
Правила выписки рецептов врача в Республике Беларусь и за рубежом
1.1 Основные понятия
Лекарственное средство — вещество или комбинация нескольких веществ природного, синтетического или биотехнологического происхождения…
Профилактика внутрибольничных инфекций
1.1 Основные возбудители ВБИ
Основными возбудителями ВБИ являются : — грамположительная кокковая флора: род Стафилококки (золотистый стафилококк, эпидермальный стафилококк), род Стрептококки (пиогенный стрептококк, стрептококк пневмонии…
Токсикологическое действие метанола
4. Параметры токсикометрии
Предельно допустимая концентрация метанола: в воздухе рабочей зоны ПДКрз =5мг/м3, среднесуточная концентрация ПДКсс=0.5 мг/м3, максимально разовая концентрация ПДКмр=1мг/м3; в сточных водах…
med.bobrodobro.ru
МЕТОДИЧКА Методы и режимы современной искусственной вентиляции лёгких. П.А. Брыгин
Заключение
Мы детально рассмотрели практически все современные методы и режимы искусственной вентиляции легких. Выбор того или иного режима— творческая задача, которую должен решать врач в каждой конкретной клинической ситуации.
Однако основной принцип современной респираторной терапии всегда должен быть соблюден: Вентилятор должен быть адаптирован к нуждам пациента, а
не наоборот! Нужно постоянно стремиться использовать режимы с наименьшей необходимой пациенту «степенью респираторной поддержки» — Pressurre control, Pressure support, SIMV, пусть даже это потребует от врача более вниматель ного наблюдения за пациентом. При переводе пациента на самостоятельное дыхание целесообразно делать это масимально постепенно уменьшать частоту принудитеьных вдохов в режиме SIMV до нуля, затем использовать самостоятельное дыхание с поддержкой давлением(Pressure support), постепенно уменьшая уровень давления поддержки.
Полноценный мониторинг состояния больногоЧСС, АД, пульсоксиметрия (SpO2), оксиметрия смешанной венозной крови(SvO2), газовый состав кровитакже может принести ценные данные для выбора того или иного режима вентиляции.
В заключение отметим, что успех респираторной терапии в большой степени зависит от правильного сестринского наблюдения и ухода за пациентом и респиратором. Так, адекватное увлажнение дыхательной смеси позволит избежать многих осложнений, связанных с нарушением проходимости трахеобронхиалыюго дерева, своевременное удаление из контура конденсированной воды позволяет обеспечить нормальную работу триггерных систем респиратора ,исоответственно, обеспечить заданный ритм дыхания.
Глава 1. ИВЛ в современной интенсивной терапии
Искусственная вентиляция легких — одно из важнейших лечебных мероприятий в современной интенсивной терапии. Показания к проведению ИВЛ в наше время значительно расширились в связи с появлением современной аппаратуры, позволяющей, с одной стороны, проводить ИВЛ с наименьшей травматичностью для респираторной системы пациента (контроль давления в дыхательных путях, адекватное увлажнение.и подогрев дыхательной смеси), с другой — имеющей режимы плавного уменьшения респираторной поддержки, облегчающие перевод больного на самостоятельное дыхание.
Можно выделить несколько типов клинических ситуаций, требующих проведения ИВЛ:
Поражение непосредственно респираторной системы пациента вентиляционная дыхательная недостаточность — тяжелые пневмо нии, травмы груди с повреждением реберного каркаса, респираторный дистресс-синдромвзрослых.
Особенности этих ситуаций в том, что пациенты чаще всего в сознании. Дыхательный центр больного способен регулировать параметры дыхания. Следовательно, требуются преимущественно вспомогательные методы ИВЛ(Pressure support), направленные на уменьшение работы дыхания.
Показаниями для начала ИВЛ служит обычно нарастание одышки, уменьшение дыхательного объема, снижение РаО2 Минутный объем дыхания (ориентир — РаСО2) может быть как снижен (гиповентиляция) – в стадии декомпенсации, так и повышен (гиповентиляция) — в стадии субкомпенсании. Предпочтительнее начинать ИВЛ в стадии субкомпенсацпии.
2.Нарушения нервной регуляции дыхания, центральные (ЧМТ и ОНМК с по-
ражением ствола мозга, отравление опиатами) и периферичес кие (применение миорелаксантов). В этих ситуациях требуется полное замещение регуляторной функции дыхательного центра, применение при нудительных методов ИВЛ с адекватным мониторингом газов’артерналыюй крови.
Клиническими показаниями к началу ИВЛ служит урежение частоты дыхания (вплоть до апноэ), гиповентиляция.
3.ИВЛ в связи с внутричерепной гипертензией (ЧМТ, ОНМК,гипоксия).
Функция внешнего дыхания больного может быть, не нарушена! Минутным
объем дыхания, частота дыхания, дыхательный объем, Р’аСО2, в норме, однако пациенту необходимо проиеденпе ИВЛ в режиме умеренной гипо-вентнляциис целью снижения РаС02 до25-30мм Hg
Клиническими показаниями к началу ИВЛ будут признаки внутричерной гипертензнииугнетение сознания до уровня сопора и комы, судорожным синдром, отрицательная неврологическая динамика, а также ранний (до 1 сут.) послеоперационный и посттравматический период. В раннем периоде лечения применяются принудительные режимы вентиляции, и дальнейшем — выбор режима ИВЛ основывается на данных мони торинга внутричерепного давления.
4. ИВЛ в связи с крайне тяжелым общим состоявшем — больного травматический,иифекционно-токсическийшок, синдром полиорганной недостаточности, сепсис. Собственно респираторная система пациента может быть не поражена, регуляция дыхания в норме, однако пациенту требуется проведение ИВЛ с целью увеличения доставки кислорода с од новременным снижением его
studfiles.net
параметры ивл у детей
параметры ивл у детей
У детей без легочной патологии примерные НАЧАЛЬНЫЕ параметры ИВЛ: Pin (PIP) 15-20ммрт ст или мбар.
По моему опыту,чем старше ребенок, тем меньшеепиковое давление требуется (как правило).Если есть возможность измерять дыхательный обем на вдохе и выдохе, пользуйтесьею. При прочих неизменных параметрах изменение (пассивное при ИВЛ с контролемпо давлению) этих объемов свидетельствует об отклонении легочных характеристик, например, неадекватной санации ребенка или развитии интерстициального отека или прогрессировании пневмонии и т.д.
Или (вентиляция с контролем по объему)
Vt (ДО) 8-10-12мл/кг.Мыприменяем 10.
Fr (f), ЧД.зависит от возраста, я выставляю нижнюю возрастную норму (25 для доношенногоноворожденного, 20-22для годовалого, и так далее…
FiO2 — при отсутствии патологии- 25-30%.
Ti для доношенногоноворожденного 0,5, для годовалого 0,75- 0,80, для пятилетнего 1 с, длябольших можно тоже 1-1,5с.
I:E я рассматриваю пассивнооноопределяется Ti и f. Оно меня волнует приналичии ARDS(ALI), когда требуется ИВЛ с инвертированным соотношениемвдоха к выдоху. Ономожет составлять 1:1,5, 1:2 иди даже 1:4 (например,если время вдоха 0,5 с, а частота дыхания 30, то I:E составляет 1:3.
Flow (L/min) в среднем рассчитывается как 6 минутных объемов, однакопри увеличения среднегодавления в ДП применяем и бОльшие значения.
PEEP (ПДКВ) — рекомендуется 2-3-5мбарили мм рт ст.
Если аппарат современный и оборудован триггером потока или давления (для детекции собственных вдохов ребенка), предпочтение я отдаю именно потоковому триггеру и в зависимости от ситуации выставляю чувствительностьчем меньше и «больнее» ребенок, темчувствительнее должен буть триггер. Для н/рожденного- 0,5-1,0л/мин, для детей постарше или для «тренировки» можно выставить и1-2-3Л/мин (чем выше цифра, темменее чувствителен триггер и тем бОльшееусилие надо создать ребенку, чтобы аппарат «словил» его вдох. Триггер по давлению можно использовать, если трубка стоит достаточно герметичная, т.е.нет сброса. параметры примерно те же(1-3мм рт ст).
Через 15 минутпослеустановки параметров — газы крови, артериальной или капиллярной. Венозныегазы — суррогат для распираторных параметров.
рСО2 в капилляре должно быть 35-45ммрт ст.
рО2 — более 80 (или 60, если уребенка прохладные конечности) мм рт ст).
Если имеется гиперкапния, то перед тем, как трогатьвентилятор, проверьте уровень стояния трубки(лучше рентгенологически, рутинно после каждой интубации)и качество санации трахеи от мокроты. Это основная причина гиперкапнии/гипоксемии, наряду сбольшим сбросомпри маленьком размере трубки.
Если устранены все причины, увеличте один из параметровпиковое давление, или ПДКВ вместе с пиковым давлением,
инспираторный поток,частота дыхания или удлините время вдоха прибольшом сбросе.
Если имеет место гипоксемия и десатурация, после устранения других причин, в томчисле и десинхронизации ребенка с аппаратом и экстубации, увеличьте один из параметров: Пиковое давление, ПДКВ, процент кислорода, длительность вдоха,частота дыхания.
studfiles.net
Режимы и параметри искусственной вентиляции легких
- Родительская категория: Нейрореанимация
- Категория: Респираторная поддержка
Режимы ИВЛ
Основной технической задачей респираторной поддержки является обеспечение нужного объема минутной вентиляции легких. Минутный объем дыхания (МОД) является произведением частоты дыхания (ЧД) на дыхательный объем (ДО) — объем воздуха, поступающий в дыхательные пути больного за один дыхательный цикл: МОД (л/мин) = ЧД (в 1 мин) х ДО (л) .
Например, если ЧД пациента составляет 15 циклов в минуту, а ДО —600 мл, то МОД будет равен 9 л.
ИВЛ осуществляют кислородно-воздушной смесью. Фракция 02 во вдыхаемой смеси (FiO,) может составлять от 21 (воздух) до 100 % (чистый 02). У больных с внутричерепными кровоизлияниями наиболее часто используют вентиляцию смесью с содержанием О, 30—50 %.
Существует принципиальная разница между способами обеспечения дыхательного объема при различных режимах ИВЛ — «по объему» и «по давлению».
♦ В режиме «по объему» врач задает аппарату необходимый ДО, который должен быть введен пациенту. В режиме «по давлению» устанавливают не ДО, а уровень давления в дыхательных путях, который должен быть достигнут при вдохе.
Основные фазы дыхательного цикла режима «по объему» представлены на рис. 3.4.
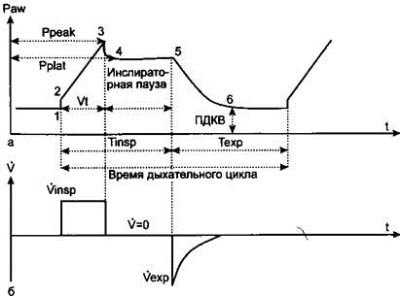
Рис. 3.4. Дыхательный цикл при ИВЛ в режиме «по объему», а — динамика давления в дыхательных путях (Paw): Ppeak — пиковое давление, Pplat — давление плато, Vt — дыхательный объем, Tinsp — время вдоха, Техр — время выдоха, t — время, ПДКВ — положительное давление в конце выдоха; б — динамика серости потока воздуха (V) в дыхательных путях на вдохе (Vinsp) и выдохе (Vexp).
В начале вдоха (1) аппарат ИВЛ подает в дыхательный контур поток воздуха. Поток преодолевает сопротивление дыхательных путей (интервал 1—2), связанное с коллабиро — ванием части альвеол во время фазы выдоха. После того как в дыхательные пути больного введен заданный ДО, поток резко прекращается (3). Окончанию инспираторного потока соответствует пиковое давление в дыхательных путях (Ppeak). Однако даже после прекращения активного поступления газовой смеси воздух продолжает распределяться по воздухоносным путям, что обусловливает незначительное снижение давления в них (4). Так как клапан выдоха аппарата ИВЛ остается закрытым, наступает инспираторная пауза. Давление в дыхательных путях во время этой паузы называют давлением плато (Pplat). Клапан выдоха открывается после окончания заданной врачом инспираторной паузы (5). Наступает пассивный выдох, который завершается по достижении уровня положительного давления в конце выдоха (ПДКВ), также заданного врачом (6).
Таким образом, основными параметрами, которые врач задает аппарату ИВЛ в режиме «по объему», являются ДО, ЧД, соотношение вдоха к выдоху (обычно 1:3) и ПДКВ (при интактных легких — 5 см вод. ст.). В некоторых респираторах можно устанавливать дополнительные параметры (например, скорость нарастания и форму потока, распределение скорости нарастания потока по всему вдоху и др.).
- < Протезирование дыхательных путей и респираторная поддержка больных с внутричерепными кровоизлияниями Назад
- Вперёд Основные режимы ИВЛ по объему >
physiomed.com.ua
