Ферменты химическая природа — Справочник химика 21
ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ [c.118]Данные о важнейших коферментах и простетических группах ферментов, включая их наименования и структуру, химическую природу витамина, входящего в их состав, и характер выполняемой биохимической функции в метаболизме, детально рассмотрены в главах 7 и 9—13. [c.122]
Все ферменты по своей химической природ являются белками. Например, рибонуклеаза [c.654]
По своей химической природе рецепторы почти всех биологически активных веществ оказались гликопротеинами, причем узнающий домен (участок) рецептора направлен в сторону межклеточного пространства, в то время как участок, ответственный за сопряжение рецептора с эффекторной системой (с ферментом, в частности), находится внутри (в толще) плазматической мембраны. Общим свойством всех рецепторов является их высокая специфичность по отношению к одному определенному гормону (с константой сродства от 0,1 до 10 нМ). Известно также, что сопряжение рецептора с эффекторными системами осуществляется через так называемый С-белок, функция которого заключается в обеспечении многократного проведения гормонального сигнала на уровне плазматической мемб-
Одним из характерных проявлений жизни является удивительная способность живых организмов кинетически регулировать химические реакции, подавляя стремление к достижению термодинамического равновесия. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, pH среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента. [c.134]
Химическая природа активной группы пируватдекарбоксилазы в настоящее время полностью выяснена. Она представляет собой соединение молекулы витамина В, и двух остатков фосфорной кислоты. Пируватдекарбоксилаза является примером фермента, активная группа которого содержит витамин. Как показали исследования, витамины являются неотъемлемой составной частью целого ряда важнейших ферментов (каталаза, пероксидаза и др.). [c.169]
В последние годы благодаря использованию ферментов функции ионселективных электродов удалось существенно расширить и сделать их применимыми для быстрого клинического анализа на глюкозу, мочевину, аминокислоты и другие метаболиты. Такие электроды называются ферментными электродами или электрохимическими сенсорами. Создание электродов с указанными свойствами оказывается возможным благодаря тому, что ряд ферментов обладает высокой специфичностью, т. е. способностью катализировать превращения одного единственного вещества из многих сотен и даже тысяч веществ близкой химической природы. Если, например, фермент катализирует реакцию, в ходе которой изменяется pH среды, то рН-чувствительный электрод, покрытый пленкой геля или полимера, содержащей этот фермент, позволит провести количественное определение только того вещества, которое превращается под действием данного фермента. Из мочевины в присутствии фермента уреазы образуются ионы МН+. Если ионселективный электрод, чувствительный к ионам ЫН , покрыть пленкой, содержащей уреазу, то при помощи его можно количественно определять мочевину. Ферментные электроды — один из примеров возрастающего практического использования ферментов в науке и технике.
Эти работы явились решающей предпосылкой для исследований строения активного центра. При этом внимание обращается на число активных центров в молекуле фермента, химическую природу групп, связывающих субстрат и активирующих его. [c.177]
Представляется целесообразным в качестве основы для классификации ферментов избрать или химическую характеристику реакций, катализируемых ферментами (химическая природа атакуемых связей или групп, подвергающихся переносу , или химическую природу субстрата, подвергающегося превращению. Так, можно один и тот же фермент называть или глюкозидазой, имея в виду расщепление глюкозидных связей, или карбогидразой, имея в виду, что субстрат по химической природе принадлежит к углеводам. В номенклатуре ферментов нередко удается совместить эти оба принципа, однако обычно путем усложнения наименования фермента. В настоящее время известно свыше 800 различных ферментов. [c.135]
Следовательно, структурные особенности поверхностного слоя белковых глобул позволяют сосредоточить в активном центре большое число различных по химической природе функциональных групп, способных не только сорбировать субстрат на ферменте,-но взаимодействовать с ним также и химически. [c.20]
Так, структурные особенности поверхностного слоя белковых глобул позволяют сосредоточить в активном центре большое число различных по химической природе функциональных групп, способных не только сорбировать молекулу субстрата, но также и взаимодействовать с ней химически (см. гл. I). Среда активного центра обладает высокоразвитой микрогетерогенностью, где гидрофобные участки с исключительно низкой диэлектрической проницаемостью и полярностью (по сравнению с водой) чередуются с сильно гидратированными полярными областями с высоким электростатическим потенциалом и т. д. Поверхностный слой характеризуется также и повышенной микровязкостью. Все эти эффекты способствуют в конечном итоге многоцентровому взаимодействию фермента (его активного центра) с молекулой субстрата.
Функции солода и культур плесневых грибов не ограничиваются осахариванием крахмала, в них входят накопление в сусле достаточного количества органического азота для питания дрожжей и частичное растворение клеточных стенок эндосперма сырья. В осуществлении этих процессов, а также в выращивании солода и плесневых грибов участвуют многочисленные ферменты, поэтому необходимо знание их химической природы, строения и механизма действия. [c.114]
Для фармации не менее важное значение имеет ферментативный катализ. Понимание механизма действия любого фермента возможно только на основе установления его химической природы и знания общей теории катализа. [c.10]
Сочетание этого кофа
www.chem21.info
ферменты
Вопросы к итоговому компьютерному контролю: «Ферменты»
1 Что изучает наука энзимология?
+ ферменты
2 Какую функцию выполняют ферменты в организме?
+ каталитическую
3 Биологическая роль ферментов в организме:
+ контролируемый катализ всех метаболических процессов
4 Какими свойствами обладают ферменты?
+ амфотерными
5 Выберите свойства ферментов:
+ способны к гидролизу и денатурации
6 При растворении в воде ферменты:
+ образуют коллоидный раствор
7 Как ферменты влияют на химические реакции в организме?
+ ускоряют термодинамически возможные
8Как ферменты влияют на состояние равновесия химических реакций в организме?
+ не изменяют, ускоряют его достижение
9 Расходуются ли ферменты в биохимической реакции?
+ не расходуются
10Зависит ли активность ферментов в организме от действия активаторов и ингибиторов?
+ зависит
11 Какая субстратная специфичность характерна для большинства ферментов?
+ абсолютная
12Спомощью какой реакции можно определить количество фермента в
образце?
+ специфической реакции на субстраты или продукты
13 В международной системе единиц СИ активность ферменто в измеряется:
+ каталами
14 Ферменты состоят из:
+ аминокислот
15 Из чего состоят простые белки-ферменты?
+ только из аминокислот
16 Из чего состоят сложные белки-ферменты?
+ из аминокислот и коферментов
17 Ферменты по своей химической природе являются:
+ белками
18 Какие уровни организации имеют молекулы ферментов?
+ третичный или четвертичный
19 Какое структурное образование обязательно входит в состав любого фермента?
+ активный центр
20 Чем образован активный центр в простых ферментах?
+ радикалами аминокислот
21 Как называется группа, которая входит в состав активного центра фермента и принимает
непосредованное участие в катализе?
+ кофермент
22 Как называется белковая часть сложного фермента?
+ апофермент
23 Как
+ холофермент
24 Какая простетическая группа не входит в состав активного центра фермента?
+ кофактор
25 Как называется небелковая часть сложного фермента?
+ кофермент
26 КакаясубстратнаяспецифичностьхарактернадлябольшинстваферментовЖКТ?
+ групповая (относительная)
27 Что неизменится при воздействии температуры t > 80С на простой белок-фермент?
+ Первичная структура
28 Основной функцией коферментов в составе сложных ферментов является:
+ Непосредственное участие в катализе
29 Какой центр обеспечивает регуляцию каталитической активности регуляторного
фермента?
+ аллостерический
30 Выберите автора, который предложил теорию строгого геометрического соответствия Фермента и субстрата:
+ Фишер
31 Выберите автора, который предложил теорию индуцированного соответствия фермента и субстрата:
+ Кошланд
32 Выберите современную теорию, которая которая объясняет механизм действия
ферментов:
+ теория промежуточных соединений
33 Выберите авторов, которые предложили уравнение, описывающее кривую субстратного Насыщения V = (Vmax*[S])/(Km+[S]) (2 ответа):
+ Михаэлис
+ Ментен
34 Выберите график зависимости скорости ферментативной реакции от величины рН
(концентрация субстрата и фермента const)
+ imgскоростьph2.gif
35 Выберите график зависимости скорости ферментативной реакции от температуры
(концентрация субстрата и фермента const)
+ imgскоростьT1.gif
36 Выберите график зависимости скорости реакции от концентрации фермента
(концентрация субстрата const)
+ imgнасыщенияVE1.gif
37Выберите график зависимости скорости реакции от концентрации субстрата для
Не аллостерического фермента
+ imgнасыщенияVS1.gif
38 Выберите определение константы Михаэлиса-Ментена (Km) (S — субстрат, E — фермент):
+ [S], при которой V ферментативной реакции составляет ½ от V max
39Где в клетке находятся ферменты переаминирования аминокислот(аминотрансферазы)?
(2 ответа)
+ в цитоплазме
+ в матриксе митохондрий
40 Где в клетке находятся ферменты орнитинового цикла(цикламочевины)? (2 ответа)
+ в матриксе митохондрий
41 Где в клетке находятся ферменты цепи окислительного фосфорилирования (синтез АТФ в присутствии О2)?
+ на внутренней мембране митохондрий
42 Где в клетке находятся сновные ферменты цикла Кребса?
+ в матриксе митохондрий
43 Где в клетке находятся ферменты микросомального окисления?
+ в ЭПР
44 Где в клетке находится фермент аденилатциклаза?
+ в клеточной мембране
45 Где в клетке находятся ферменты инозитолтрифосфатной системы фосфолипазаСи
протеинкиназа С?
+ в клеточной мембране
46 Где в клетке находится фермент Na/K-АТФаза?
+ в клеточной мембране
47 Где в клетке находятся ферменты ß-окисления жирных кислот?
+ в матриксе митохондрий
48 Где в клетке находятся ферменты липолиза (гидролизатриглицеридов)?
+ в цитоплазме
49 Где в клеткена ходятся ферменты синтеза кетоновых тел?
+ в матриксе митохондрий
50 Где в клетке находятся ферменты синтеза холестерина? (2 ответа)
+ в ЭПР
+ в цитоплазме
51 Где в клетке локализован пальмитоилсинтетазный комплекс (синтеза жирных кислот)?
+ в цитоплазме
52 Где в клетке находятся ферменты липогенеза (синтеза триглицеридов)?
+ в цитоплазме
53 Где в клетке находятся ферменты гликолиза?
+ в цитоплазме
54 Где вклетке находятся ферменты пентозофосфатного шунта?
+ в цитоплазме
55 Где вклетке находятся ферменты синтеза и распада гликогена?
+ в цитоплазме
56 Где вклетке находятся ферменты глюконеогенеза? (2 ответа)
+ в матриксе митохондрий
+ в цитоплазме
57 Что означает понятие «маркерные ферменты» — это ферменты, маркирующие:
+ Органеллы
58 Наиболее высокая каталитическая активность АСТ наблюдаетсяв:
+ миокарде
59 Высокая каталитическая активность АСТ наблюдается в:
+ печени
60 Высокая каталитическая активность АСТ наблюдается в:
+ нервной ткани
61 Высокая каталитическая активность АСТ наблюдается в:
+ скелетной мускулатуре
62 Высокая каталитическая активность АЛТ наблюдается в:
+ миокарде
63 Наиболее высокая каталитическая активность АЛТ наблюдается в:
+ печени
64 Высокая каталитическая активность АЛТ наблюдается в:
+ поджелудочной железе
65 Высокая каталитическая активность АЛТ наблюдается в:
+ скелетной мускулатуре
66 Высокая каталитическая активность АЛТ наблюдаетсяв:
+ почках
67 Где синтезируется ферментa-амилаза?
+ слюных желез
68 Где синтезируется ферментa-амилаза?
+ поджелудочной железы
69 Источником трипсина в крови является:
+ поджелудочная железа
70 Где наблюдается наиболее высокая каталитическая активностьγ-
гаммаглутамилтранспептидазы(ГГТ)?
+ почек
71 Где наблюдается наиболее высокая каталитическая активностьγ-
Гаммаглутамил транспептидазы(ГГТ)?
+ печени
72 Где наблюдается высокая каталитическая активностьγ-гаммаглутамилтранспептидазы
(ГГТ)?
+ поджелудочной железы
73
Где наблюдается высокая каталитическая активностьγ-гаммаглутамилтранспептидазы
(ГГТ)?
+ щеточной каймы клеток тонкой кишки
74 Где наблюдается высокая каталитическая активность щелочной фосфатазы?
+ тонкой кишке
75 Где наблюдается высокая каталитическая активность щелочной фосфатазы?
+ почках
76 Где наблюдается высокая каталитическая активность щелочной фосфатазы?
+ костной ткани
77 Где наблюдается высокая каталитическая активность щелочной фосфатазы?
+ печени
78 Где наблюдается высокая каталитическая активность щелочной фосфатазы?
+ плаценте
79 Для какого органа характерен органоспецифический фермент кислая фосфатаза?
+ простата
80
Множественные формы одного фермента, катализирующие одну и туже реакцию
называются:
+ изоферменты
81 Какое количество субъединиц содержит изофермент?
+ четное
82 Какие уровни организации имеют белки, являющиеся изоферментами?
+ с первичного по четвертичный
83 Что объединяет изоферменты водносемейство?
+ катализируемая реакция
84 Какому из наборов субъединиц соответствует изофермент ЛДГ 5?
+ ММММ
85 Какому из наборов субъединиц соответствует изофермент ЛДГ1?
+ НННН
86 Какому из наборов субъединиц соответствует изофермент ЛДГ2?
+ НННМ
87 Какому из наборов субъединиц соответствует изофермент ЛДГ3?
+ ННММ
88 Какому из наборов субъединиц соответствует изоферментЛДГ 4?
+ НМММ
89 Высокая концентрация изоферментов ЛДГ1 и ЛДГ2 наблюдается в:
+ эритроцитах
90 Высокая концентрация изоферменто в ЛДГ 1и ЛДГ 2 наблюдается в:
+ миокарде
91 Высокая концентрация изоферментов ЛДГ1 и ЛДГ2 наблюдается в:
+ корковом веществе почек
92 Высокая концентрация изофермента ЛДГ 3 наблюдается в:
+ легких
93 Высокая концентрация изоферментов ЛДГ4 и ЛДГ5 наблюдается в:
+ печени
94 Высокая концентрация изоферментов ЛДГ4 и ЛДГ5 наблюдается в:
+ поперечно-полосатой скелетной мускулатуре
95 Высокая концентрация креатинфосфокиназы ММ наблюдается в:
+ поперечно-полосатой скелетной мускулатуре
96 Высокая концентрация креатинфосфокиназы МВ наблюдается в:
+ миокарде
97 Высокая концентрация креатинфосфокиназы ВВ наблюдается в:
+ нервной ткани
98 Систематическая классификация ферментов(КФ) основана на:
+ типе катализируемой химической реакции
99 Сколько классов выделяют у ферментов по систематической классификации?
+ 6
100 С чего начинается название ферментов посистематической номенклатуре?
+ название субстратов
101 Чем заканчивается название ферментов по систематической номенклатуре?
+ названием класса
102 Что обозначает первая цифра в класификаторе ферментов(КФ)?
+ номер класса фермента
103 Что обозначает вторая цифра в класификаторе ферментов(КФ)?
+ номер подкласса фермента
104 Что обозначает третья цифра в класификаторе ферментов(КФ)?
+ номер поподкласса фермента
105 Что обозначает четвертая цифра в класификаторе ферментов(КФ)?
+ номер фермента в алфавитном порядке
106 Каким номером в шифре фермента (КФ) обозначается тип катализируемой реакции?
+ первым
107 Как по систематической номенклатуре называется 1 класс ферментов?
+ оксидоредуктазы
108 Как по систематической номенклатуре называется 2 класс ферментов?
+ трансферазы
109 Как по систематической номенклатуре называется 3 класс ферментов?
+ гидролазы
110 Как по систематической номенклатуре называется 4 класс ферментов?
+ лиазы
111 Как по систематической номенклатуре называется 5 класс ферментов?
+ изомеразы
112 Как по систематической номенклатуре называется 6 класс ферментов?
+ лигазы
113 Выберите название класса ферментов, которые осуществляют окислительно-
Восстановительные реакции?
+ оксидоредуктазы
114 Выберите название класса ферментов, которыепринимают участие в переносе атомных
групп, молекулярных остатков от одного соединения к другому?
+ трансферазы
115 Выберите название класса ферментов, которые разрывают в субстрате связи с участием воды?
+ гидролазы
116 Выберитеназваниеклассаферментов, которыеразрываютвсубстратесвязибезучастия
воды?
+ лиазы
117 Выберите название класса ферментов, которые осуществляют внутри молекулярные перестройки субстратов:
+ изомеразы
118 Выберите название класса ферментов, которые соединяют два субстрата в один продукт с использованием энергии макроэргических соединений?
+ лигазы
119 Выберите реакцию, которую катализирует фермент класса лиаз:
+ imgлиаза1.gif
120 Какой класс ферментов катализирует эту реакцию?
+ оксидоредуктазы
121 Какой класс ферментов катализирует эту реакцию?
+ лигазы
122 Какой класс ферментов катализирует эту реакцию?
— + трансферазы
123 Какой класс ферментов катализирует эту реакцию?
+ гидролазы
124 Какой класс ферментов катализирует эту реакцию?
+ лиазы
125 Какой класс ферментов катализирует эту реакцию?
+ изомеразы
126 Какой класс ферментов катализирует эту реакцию?
+ лигазы
127 Выберите реакцию, которую катализирует фермент класса оксидоредуктаз:
+ imgоксидоредуктаза.gif
128 Выберите реакцию, которую катализирует фермент класса трансфераз:
+ imgтрансфераза.gif
129 Выберите реакцию, которую катализирует фермент класса гидролаз:
+ imgгидролаза.gif
130 Выберите реакцию, которую катализирует фермент класса лиаз:
+ imgлиаза.gif
131 Выберите реакцию, которую катализирует фермент класса изомераз:
+ imgизомераза.gif
132 Выберите реакцию, которую катализирует фермент класса лигаз:
+ imgлигаза.gif
133 Какие факторы могут избирательно регулировать активность ферментов? (2 ответа)
+ субстраты
+ продукты
134 Как температура влияет на каталитическую активность ферментов?
+ у каждого фермента своя оптимальная температура
135 Как рН влияет на каталитическую активность ферментов?
+ у каждого фермента своя оптимальная рН
136 Какие факторы регулируют каталитическую активность ферментов в организме?
+ рН, температура, специфические активаторы и ингибиторы
137
Какие факторы неспецифически изменяют каталитическую активность ферментов? (2
ответа)
+ температура
+ рН
138
Какие факторы специфически изменяют каталитическую активность ферментов? (2
ответа)
+ активаторы-метаболиты
+ ингибиторы-метаболиты
139 Какие факторы регулируют количество ферментов в клетке? (2 ответа)
+ индукторы
+ репрессоры
140 Какое действие оказывают ингибиторы на ферменты?
+ Снижают их каталитическую активность
141 Какое действие оказывают активаторы на ферменты?
+ Увеличивают их каталитическую активность
142 Какое действие оказывают индукторы на ферменты?
+ Активируют их синтез
143 Какое действие оказывают репрессоры на ферменты?
+ Подавляют их синтез
144 Как меняется Кофермента при воздействии на него неконкурентным ингибитором?
+ Не изменяется
145 Как меняется Кофермента при воздействии на него конкурентным ингибитором?
+ Возрастает
146 Как изменяется скорость ферментативной реакции при повышении концентрации
Субстрата в присутствии конкурентного ингибитора?
+ Увеличивается
147Какизменяется скорость ферментативной реакции при повышении концентрации
Субстрата в присутствии неконкурентного ингибитора?
+ Не изменяется
148 Как при конкурентном ингибировании меняется Vmax иKm?
+ Vmax — не меняется, Km — возрастает
149 Как при неконкурентном ингибировании меняется Vmax иKm?
+ Vmax — снижается, Km — не меняется
150 На каком графике верноуказано влияние неконкурентного ингибитора(обозначен
пунктиром) на кривую субстратного насыщения?
+ imgингибитор1.gif
151 На каком графике верно указано влияние конкурентного ингибитора(обозначен
пунктиром) на кривую субстратного насыщения?
+ imgингибитор2.gif
152 Какую роль выполняют в клетке каскадные системы?
+ передача сигнала внутрь клетки
153 Какую роль выполняют в клетке каскадные системы?
+ многократное усиление сигнала
154 Выберите компоненты каскадных систем клеток:
+ рецепторы
155 Выберитекомпонентыкаскадныхсистемклеток:
+ регуляторные белки
156 Выберите компоненты каскадных систем клеток:
+ ферменты
157 Выберите компоненты каскадных систем клеток:
+ вторичные посредники
158 Выберите механизм увеличения каталитической активности регуляторного фермента с помощью субстрата:
+ аллостерический
159 Выберите механизм снижения каталитической активности регуляторного фермента с помощью продукта:
+ аллостерический
160Выберите механизм регуляции каталитической активности ферментов с помощьюG
белков:
+ белок-белковых взаимодействий
161Выберите механизмы регуляции каталитическая активность ферментапротеинкиназы А?
(2 ответа)
+ белок-белковых взаимодействий
+ аллостерическая модификация
162 Выберите механизм, по которому протеинкиназы (ПК) регулируют каталитическую
Активность ферментов:
+ фосфорилирования
163 Выберите механизм, по которому фосфопротеинфосфатазы (ФПФ) регулируют
Каталитическую активность ферментов:
+ дефосфорилирования
164 Выберите механизм увеличения каталитической активности ферментов ЖКТ:
+ частичный протеолиз
165 Какой механизм действия у рецепторов обладающих тирозин киназной активностью?
+ фосфорилируют регуляторные белки
166 Какой механизм действия у рецепторов с фосфатазной активностью?
+ дефосфорилируют регуляторные белки
167 Какой механизм действия у рецепторов с гуанилатциклазной активностью?
+ ГТФ → цГМФ
168 Какую реакцию катализирует аденилатциклаза(АЦ)?
+ AТФ → цAМФ
169 Какую реакцию катализирует протеинкиназаА(ПКА)?
+ фосфорилирует белки
170 Какую реакцию катализирует протеинкиназаС(ПКС)?
+ фосфорилирует белки
171 Какую реакцию катализирует протеинкиназаG (ПКG)?
+ фосфорилирует белки
172 Какую реацию катализирует фосфолипазаС(ФЛС)?
+ ФИДФ → ИТФ + ДАГ
173 Какую реацию катализирует фосфодиэстераза(ФДЭ)?
+ цАМФ → АМФ
174 Какую функцию выполняют G-белки в каскадных системах?
+ меняют активность аденилатциклазы (АЦ)
175 Какую функцию выполняют G-белки в каскадных системах?
+ меняют активность фосфолипазы С (ФЛС)
176 Какую функцию выполняют рецепторы, связанные с G-белками?
+ увеличивают сродство G-белков к ГТФ
177 Какую функцию выполняют ядерные рецепторы?
+ меняют доступность промотора для РНК-полимеразы
178 Как функционируют мебранные рецепторы, связанные с ионными каналами?
+ регулируют проницаемость мембран для электролитов
179 Выберите фермент, который в каскадных система хактивируется ионами кальция?
+ протеинкиназа С
180 Выберите фермент, который в каскадных системах активируется цАМФ?
+ протеинкиназа А
181 Выберите фермент, который в каскадных системах активируется цГМФ?
+ протеинкиназа G
studfiles.net
что это такое, зачем нужны, принцип действия
- Общие свойства ферментов
- Классификация
- Пищеварительные ферменты
- Роль заместительной терапии препаратом «Микразим»
Жизнь любого организма возможна благодаря протекающим в нем процессам обмена веществ. Этими реакциями управляют природные катализаторы, или ферменты. Другое название этих веществ – энзимы. Термин «ферменты» происходит от латинского fermentum, что означает «закваска». Понятие появилось исторически при изучении процессов брожения.

Рис. 1 — Брожение с использованием дрожжей – типичный пример ферментативной реакции
Человечество давно пользуется полезными свойствами этих ферментов. Например, уже много веков из молока с помощью сычужного фермента делают сыр.
Ферменты отличаются от катализаторов тем, что действуют в живом организме, тогда как катализаторы – в неживой природе. Отрасль биохимии, которая изучает эти важнейшие для жизни вещества, называется энзимологией.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
- специфичность: способность фермента действовать только на специфический субстрат, например, липазы – на жиры;
- каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
- способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
|
Классы |
Особенности |
|
Оксиредуктазы |
Катализируют окисление своих субстратов, перенося электроны или атомы водорода |
|
Трансферазы |
Участвуют в переносе химических групп из одного вещества в другое |
|
Гидролазы |
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды |
|
Лиазы |
Катализируют расщепление молекулярных связей без процесса гидролиза |
|
Изомеразы |
Активируют перестановку атомов в молекуле |
|
Лигазы (синтетазы) |
Образуют связи с атомами углерода, используя энергию АТФ. |
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
- печень – аланинаминотрансефраза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, сорбитдегидрогеназа;
- почки – щелочная фосфатаза;
- предстательная железа – кислая фосфатаза;
- сердечная мышца – лактатдегидрогеназа
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
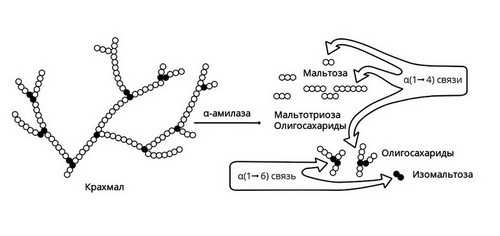
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
Белки или протеины — существенная часть человеческого рациона. Для их расщепления необходимы ферменты – протеазы. Они различаются по месту синтеза, субстратам и другим характеристикам. Некоторые из них активны в желудке, например, пепсин. Другие вырабатываются поджелудочной железой и активны в просвете кишечника. В самой железе выделяется неактивный предшественник фермента – химотрипсиноген, который начинает действовать только после смешивания с кислым пищевым содержимым, превращаясь в химотрипсин. Такой механизм помогает избежать самоповреждения протеазами клеток поджелудочной железы.
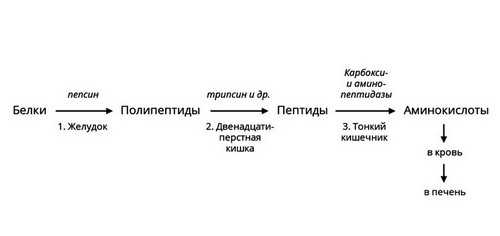
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
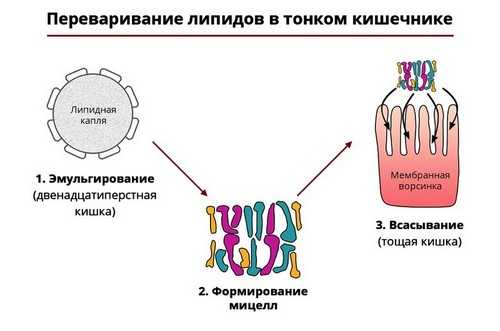
Рис. 4 — Ферментативный гидролиз жиров
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике. Это особенно важно для детей, страдающих муковисцидозом.
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом.
micrazim.kz
Ферменты — Мегаэнциклопедия Кирилла и Мефодия — статья
Ферме́нты (от лат. «fermentum» — брожение, закваска), энзимы — специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов. По химической природе — белки, обладающие оптимальной активностью при определенном рН, наличии необходимых коферментов и кофакторов и отсутствии ингибиторов. Ферменты называют также биокатализаторами по аналогии с катализаторами в химии. Каждый вид ферментов катализирует превращение определенных веществ (субстратов), иногда лишь единственного вещества в единственном направлении. Поэтому многочисленные биохимические реакции в клетках осуществляет огромное число различных ферментов. Подразделяются на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы. Многие ферменты выделены из живых клеток и получены в кристаллическом виде (впервые в 1926 году). Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов — все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма — дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. — обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значительной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-либо его дефект могут привести к серьезным отрицательным последствиям для организма.Ферменты — самые активные среди всех известных катализаторов. Большинство реакций в клетке протекает в миллионы и миллиарды раз быстрее, чем если бы они протекали в отсутствие ферментов. Так, одна молекула фермента каталазы способна за секунду превратить в воду и кислород до 10 тыс. молекул токсичной для клеток перекиси водорода, образующейся при окислении различных соединений. Каталитические свойства ферментов обусловлены их способностью существенно уменьшать энергию активации вступающих в реакцию соединений, то есть в присутствии ферментов требуется меньше энергии для «запуска» данной реакции.Процессы, протекающие при участии ферментов, известны человеку с глубокой древности, ведь в основе приготовления хлеба, сыра, вина и уксуса лежат ферментативные процессы. Но только в 1833 году впервые из прорастающих зерен ячменя было выделено активное вещество, осуществляющее превращение крахмала в сахар и получившее название диастазы (ныне этот фермент называется амилазой). В конце 19 века было доказано, что сок, получаемый при растирании дрожжевых клеток, содержит сложную смесь ферментов, обеспечивающих процесс спиртового брожения. С этого времени началось интенсивное изучение ферментов — их строения и механизма действия. Так как роль биокатализатора была выявлена при изучении брожения, то именно с этим процессом были связаны два установившихся еще с 19 веке названия — «энзим» (в переводе с греч. «из дрожжей») и «фермент». Правда, последний синоним применяется только в русскоязычной литературе, хотя научное направление, занятое изучением ферментов и процессов с их участием, традиционно называется энзимологией. В первой половине 20 века было установлено, что по химической природе ферменты являются белками, а во второй половине века для многих сотен ферментов уже была определена последовательность аминокислотных остатков, установлена пространственная структура. В 1969 году впервые был осуществлен химический синтез фермента рибонуклеазы. Огромные успехи были достигнуты в понимании механизма действия ферментов.В клетке часть ферментов находится в цитоплазме, но в основном ферменты связаны с определенными клеточными структурами, где и проявляют свое действие. В ядре, например, находятся ферменты, ответственные за репликацию — синтез ДНК (ДНК-полимеразы), за ее транскрипцию — образование РНК (РНК-полимеразы). В митохондриях присутствуют ферменты, ответственные за накопление энергии, в лизосомах — большинство гидролитических ферментов, участвующих в распаде нуклеиновых кислот и белков.Все реакции с участием ферментов протекают в основном в нейтральной, слабощелочной или слабокислой среде. Однако максимальная активность каждого отдельного фермента проявляется при строго определенных значениях pH. Для действия большинства ферментов теплокровных животных наиболее благоприятной температурой является 37-40 oС. У растений при температуре ниже 0 oС действие ферментов полностью не прекращается, хотя жизнедеятельность растений при этом резко снижается. Ферментативные процессы, как правило, не могут протекать при температуре выше 70 oС, так как ферменты, как и всякие белки подвержены тепловой денатурации (разрушению структуры).
Молекулярная масса ферментов, как и всех остальных белков, лежит в пределах 10 тыс. — 1 млн. (но может быть и больше). Они могут состоять из одной или нескольких полипептидных цепей и могут быть представлены сложными белками. В состав последних наряду с белковым компонентом (апоферментом) входят низкомолекулярные соединения — коферменты (кофакторы, коэнзимы), в том числе ионы металлов, нуклеотиды, витамины и их производные. Некоторые ферменты образуются в форме неактивных предшественников (проферментов) и становятся активными после тех или иных изменений в структуре молекулы, например, после отщепления от нее небольшого фрагмента. К их числу относятся пищеварительные ферменты трипсин и химотрипсин, которые синтезируются клетками поджелудочной железы в форме неактивных предшественников (трипсиногена и химотрипсиногена) и обретают активность в тонком кишечнике в составе поджелудочного сока. Многие ферменты образуют так называемые ферментные комплексы. Такие комплексы, например, встроены в мембраны клеток или клеточных органелл и участвуют в транспорте веществ.Подвергающееся превращению вещество (субстрат) связывается с определенным участком фермента, его активным центром, который формируется боковыми цепями аминокислот, находящимися часто в значительно удаленных друг от друга участках полипептидной цепи. Например, активный центр молекулы химотрипсина образуют остатки гистидина, находящегося в полипептидной цепи в положении 57, серина в положении 195 и аспарагиновой кислоты в положении 102 (всего в молекуле химотрипсина 245 аминокислот). Таким образом, сложная укладка полипептидной цепи в молекуле белка — ферменте обеспечивает возможность нескольким боковым цепям аминокислот оказаться в строго определенном месте и на определенном расстоянии друг от друга. Коферменты также входят в состав активного центра (белковая часть и небелковый компонент в отдельности ферментативной активностью не обладают и приобретают свойства фермента, лишь соединившись вместе).Большинство ферментов отличается высокой специфичностью (избирательностью) действия, когда превращение каждого реагирующего вещества (субстрата) в продукт реакции осуществляется специальным ферментом. При этом действие фермента может быть строго ограничено одним субстратом. Например, фермент уреаза, участвующий в распаде мочевины до аммиака и углекислого газа, не реагирует на сходную по строению метилмочевину. Многие ферменты действуют на несколько родственных по структуре соединений или на один тип химической связи (например, расщепляющие фосфодиэфирную связь фермент фосфатазы).Фермент осуществляет свое действие через образование фермент-субстративного комплекса, который затем распадается с образованием продуктов ферментативной реакции и освобождением фермента. A результате образования фермент-субстратного комплекса субстрат изменяет свою конфигурацию; при этом преобразуемая фермент-химическая связь ослабляется и реакция протекает с меньшей начальной затратой энергии и, следовательно, с намного большей скоростью. Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Многие ферментативные реакции в зависимости от концентрации в среде субстрата и продукта реакции могут протекать как в прямом, так и в обратном направлении (избыток субстрата сдвигает реакцию в сторону образования продукта, в то время как при чрезмерном накоплении последнего будет происходить синтез субстрата). Это означает, что ферментативные реакции могут быть обратимыми. Например, карбоангидраза крови превращает поступающий из тканей углекислый газ в угольную кислоту (H2CO3), а в легких, напротив, катализирует превращение угольной кислоты в воду и углекислый газ, который удаляется при выдохе. Однако следует помнить, что ферменты, как и другие катализаторы, не могут сдвигать термодинамическое равновесие химической реакции, а лишь значительно ускоряют достижение этого равновесия.При наименовании фермента cа основу берут название субстрата и добавляют суффикс «аза». Так появились, в частности, протеиназы — ферменты, расщепляющие белки (протеины), липазы (расщепляют липиды, или жиры) и т. д. Некоторые ферменты получили специальные (тривиальные) названия, например, пищеварительные ферменты — пепсин, химотрипсин и трипсин.В клетках организма протекает несколько тысяч различных реакций обмена веществ и, следовательно, имеется столько же ферментов. Aля того, чтобы привести такое многообразие в систему, было принято международное соглашение о классификации ферментов. A соответствии с этой системой все ферменты a зависимости от типа катализируемых ими реакций были поделены на шесть основных классов, каждый из которых включает ряд подклассов. Кроме того, каждый фермент получил четырехзначный кодовый номер (шифр) и название, указывающее на реакцию, которую yтот фермент катализирует. Ферменты, катализирующие одну и ту же реакцию у организмов разных видов, могут существенно различаться между собой по своей белковой структуре, но в номенклатуре имеют общее название и один кодовый номер.
Отсутствие или снижение активности какого-либо фермента (нередко и избыточная активность) у человека приводит к развитию заболеваний (энзимопатий) или гибели организма. Так, передаваемое по наследству заболевание детей — галактоземия (приводит к умственной отсталости) — развивается вследствие нарушения синтеза фермента, ответственного за превращение галактозы в легко усваиваемую глюкозу. Причиной другого наследственного заболевания — фенилкетонурии, сопровождающегося расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение аминокислоты фенилаланина в тирозин. Определение активности многих ферментов a крови, моче, спинно-мозговой, семенной и других жидкостях организма используется для диагностики ряда заболеваний. С помощью такого анализа сыворотки крови возможно обнаружение на ранней стадии инфаркта миокарда, вирусного гепатита, панкреатита, нефрита и других заболеваний.Так как ферменты сохраняют свои свойства и вне организма, их успешно используют в различных отраслях промышленности. Например, протеолитический фермент папайи (из сока папайи) — в пивоварении, для мягчения мяса; пепсин — при производстве «готовых» каш и как лекарственный препарат; трипсин — при производстве продуктов для детского питания; реннин (сычужный фермент из желудка теленка) — в сыроварении. Каталаза широко применяется в пищевой и резиновой промышленности, а расщепляющие полисахариды целлюлазы и пектидазы — для осветления фруктовых соков. Ферменты необходимы при установлении структуры белков, нуклеиновых кислот и полисахаридов, в генетической инженерии и т. д. С помощью ферментов получают лекарственные препараты и сложные химические соединения.Обнаружена способность некоторых форм рибонуклеиновых кислот (рибозимов) катализировать отдельные реакции, то есть выступать в качестве ферментов. Возможно, в ходе эволюции органического мира рибозимы служили биокатализаторами до того, как ферментативная функция перешла к белкам, более приспособленным к выполнению этой задачи.
- Фершт Э. Структура и механизм действия ферментов. М., 1980.
- Страйер Л. Биохимия. М., 1984-1985. Т. 1. С. 104-131. O. 2. С. 23-94.
- Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека. Т. 1. М., 1993.
- Ферменты и нуклеиновые кислоты. — СПб.: Изд-во С.-Петерб. ун-та, 1997.
- Молекулярная динамика ферментов. — М.: Изд-во Моск. ун-та, 2000.
- Кислухина О. В. Ферменты в производстве пищи и кормов. — М.: ДеЛи принт, 2002.
- Федоренко Б. Н. Ферменты и мембраны: научные основы взаимодействия. — М.: МГУПП, 2002.
- Ферменты микроорганизмов. — Казань: Унипресс, 1998.
megabook.ru
Что такое ферменты и каковы их функции? Действие ферментов и их
Ферменты: общая характеристика, функции, виды и механизмы действия

Различные химические процессы – основа жизнедеятельности любого организма. Главная роль в них отведена ферментам. Ферменты или энзимы являются природными биокатализаторами. В организме человека они принимают активное участие в процессе переваривания пищи, функционировании центральной нервной системы и стимуляции роста новых клеток. По своей природе ферменты относятся к белкам, предназначенным для ускорения различных биохимических реакций в организме. Расщепление белков, жиров, углеводов и минералов – процессы, в которых энзимы выступают одними из основных действующих компонентов.
Существует довольно много разновидностей ферментов, каждая из которых предназначена для воздействия на то или иное вещество. Белковые молекулы уникальны и не способны заменять друг друга. Для их активности необходим определенный температурный диапазон. Для ферментов человека идеальной является нормальная температура тела. Кислород и солнечный свет разрушает ферменты.
Общая характеристика ферментов
Являясь органическими веществами белкового происхождения, ферменты действуют по принципу неорганических катализаторов, ускоряя реакции в клетках, в которых они синтезируются. Синоним к названию таких белковых молекул – энзимы. Почти все реакции в клетках происходят с участием специфических ферментов. В их составе выделяют две части. Первая представляет собой непосредственно белковую часть, представленную белком третичной структуры и именуемую апоферментом, вторая – активный центр энзима, получивший название кофермент. Последний может представлять собой органические/неорганические вещества, и именно он выступает основным «ускорителем» биохимических реакций в клетке. Обе части образуют единую белковую молекулу, названную холоферментом.
Каждый фермент предназначен для воздействия на конкретное вещество, именуемое субстратом. Результат произошедшей реакции называется продуктом. Названия самих ферментов довольно часто образуется на основе названия субстрата с добавлением окончания «-аза». К примеру, энзим, предназначенный для расщепления янтарной кислоты (сукцината), носит название сукцинатдегидрогеназа. Кроме того, название белковой молекулы определяется и типом реакции, выполнение которой она обеспечивает. Так, дегидрогеназы отвечают за процесс регенерации и окисления, а гидролазы – за расщепление химической связи.
Действие ферментов различных видов направлено на определенные субстраты. То есть участие белковых молекул в тех или иных биохимических реакциях индивидуально. Каждый фермент связан со своим субстратом и может работать только с ним. За неразрывность этой связи отвечает апофермент.
Ферменты могут пребывать в свободном состоянии в цитоплазме клетки или же взаимодействовать с более сложными структурами. Также существуют определенные их виды, действующие вне клетки. К ним относятся, например, ферменты, расщепляющие белки и крахмал. Кроме того, энзимы могут вырабатываться различными микроорганизмами.
Современная энзимология

Для изучения ферментов и процессов, происходящих с их участием, предназначена отдельная область биохимической науки – энзимология. Впервые информация об особых белковых молекулах, действующих по принципу катализаторов, появилась в результате изучения пищеварительных процессов и реакций брожения, происходящих в организме человека. Существенный вклад в развитие современной энзимологии приписывается Л. Пастеру, который считал, что все биохимические реакции в организме происходят при участии исключительно живых клеток. О неживых «участниках» таких реакций впервые было заявлено Э. Бухнером в начале ХХ ст. В то время исследователю удалось определить, что катализатором в процессе сбраживания сахарозы с последующим выделением этилового спирта и диоксида углерода выступает бесклеточный дрожжевой экстракт. Данное открытие стало решительным толчком для подробного изучения так называемых катализаторов различных биохимических процессов в организме.
Уже в 1926 году был выделен первый фермент – уреаза. Автором открытия стал Дж. Самнер, сотрудник Корнеллского университета. После этого в течение одного десятилетия учеными был выделен ряд других энзимов, а белковая природа всех органических катализаторов – доказана окончательно. На сегодняшний день миру известно свыше 700 различных ферментов. Но при этом современная энзимология продолжает активное изучение, выделение и изучение свойств отдельных видов белковых молекул.
Ферменты: белковая природа
Так же как и белки, ферменты принято делить на простые и сложные. Первые представляют собой соединения, состоящие из аминокислот, например, трипсина, пепсина или лизоцима. Сложные энзимы, как упоминалось выше, состоят из белковой части с аминокислотами (апофермента) и небелковой составляющей, получившей названием кофактора. Только сложные ферменты могут участвовать в биореакциях. Кроме того, подобно белкам ферменты бывают моно- и полимерами, то есть состоят из одной или нескольких субъединиц.
Общими свойствами ферментов как белковых структур являются:
- эффективность действия, подразумевающая значительное ускорение химических реакций в организме;
- избирательность к субстрату и типу выполняемой реакции;
- чувствительность к показателям температуры, кислотно-щелочного баланса и другим неспецифическим физико-химическим факторам среды, в которой действуют ферменты;
- чувствительность к действию химических реагентов и др.
Функции ферментов

Основная роль ферментов в организме человека – преобразование одних веществ в другие, то есть субстратов в продукты. Они выступают катализаторами свыше чем в 4 тысячах биохимических жизненно важных реакций. Функции ферментов заключаются в направлении и регуляции метаболических процессов. Как неорганические катализаторы, энзимы могут в разы ускорять прямую и обратную биореакцию. Стоит отметить, что при их действии химическое равновесие не нарушается. Происходящие реакции обеспечивают распад и окисление питательных веществ, попадающих в клетки. Каждая белковая молекула может выполнять огромное множество действий в минуту. При этом белок ферментов, вступая в реакцию с различными веществами, остается неизменным. Энергия, вырабатываемая в процессе окисления питательных веществ, используется клеткой так же, как и продукты расщепления веществ, необходимые для синтеза органических соединений.
Сегодня широкое применение нашли не только ферменты-препараты медицинского назначения. Энзимы также используются в пищевой и текстильной промышленности, в современной фармакологии.
Классификация ферментов
На собрании V Международного биохимического союза, прошедшем в Москве в 1961 году, была принята современная классификация ферментов. Данная классификация подразумевает их деление на классы, в зависимости от типа реакции, в которой энзим выступает катализатором. Кроме того, каждый класс ферментов делится на подклассы. Для их обозначения используется код из четырех чисел, разделенных точками:
- первое число обозначает механизм реакции, в которой фермент выступает катализатором;
- второе число указывает на подкласс, к которому принадлежит данный энзим;
- третье число – подкласс описываемого фермента;
- и четвертое – порядковый номер энзима в подклассе, к которому он принадлежит.
Всего в современной классификации ферментов выделяют шесть их классов, а именно:
- Оксидоредуктазы – энзимы, выступающие катализаторами в различных окислительно-восстановительных реакциях, происходящих в клетках. В данный класс входит 22 подкласса.
- Трансферазы – класс ферментов с 9 подклассами. В него входят энзимы, обеспечивающие реакции транспорта между разными субстратами, ферменты, принимающие участие в реакциях взаимопревращения веществ, а также обезвреживания различных органических соединений.
- Гидролазы – энзимы, разрывающие внутримолекулярные связи субстрата посредством присоединения к нему молекул воды. В данном классе насчитывается 13 подклассов.
- Лиазы – класс, в составе которого находятся только сложные ферменты. В нем насчитывается семь подклассов. Энзимы, относящиеся к данному классу, выступают катализаторами в реакциях разрыва С-О, С-С, С-N и прочих типов органических связей. Также ферменты класса лиазы участвуют в обратимых биохимических реакциях отщепления негидролитическим путем.
- Изомеразы – энзимы, выступающие катализаторами в химических процессах изомерных превращений, происходящих в одной молекуле. Как и к предыдущему классу к ним относятся только сложные ферменты.
- Лигазы, иначе именуемые синтетазами – класс, включающий шесть подклассов и представляющий энзимы, катализирующие процесс соединения двух молекул под воздействием АТФ.
Состав ферментов

Состав ферментов объединяет в себе отдельные области, отвечающие за выполнение конкретных функций. Так, в составе ферментов, как правило, выделяют активный и аллостерический центры. Последний, к слову, есть далеко не у всех белковых молекул. Активный центр представляет собой сочетание остатков аминокислот, отвечает за контакт с субстратом и выполнение катализа. Активный центр в свою очередь делится на две части: якорную и каталитическую. Энзимы, состоящие их нескольких мономеров, могут содержать более одного активного центра.
Аллостерический центр отвечает за активность ферментов. Свое название такая часть ферментов получила из-за того что его пространственная конфигурация не имеет ничего общего с молекулой субстрата. Изменение скорости реакции, происходящей с участием фермента, обуславливается связыванием различных молекул именно с аллостерическим центром. Энзимы, содержащие в своем составе аллостерические центры, являются полимерными белками.
Механизм действия ферментов
Действие ферментов можно разделить на несколько этапов, в частности:
- первый этап подразумевает присоединение субстрата к энзиму, вследствие чего формируется фермент-субстратный комплекс;
- второй этап заключается в преобразовании полученного комплекса в один или сразу несколько переходных комплексов;
- третий этап – образование комплекса фермент-продукт;
- и, наконец, четвертый этап подразумевает разделение конечного продукта реакции и фермента, остающегося в неизменном виде.
Кроме того, действие ферментов может происходить с участием различных механизмов катализа. Так, выделяют кислотно-основной и ковалентный катализ. В первом случае в реакции участвуют энзимы, содержащие в своем активном центре специфические остатки аминокислот. Такие группы ферментов являются отличными катализаторами многочисленных реакций в организме. Ковалентный катализ подразумевает действие ферментов, которые при контакте с субстратами формируют нестабильные комплексы. Результатом таких реакций является образование продуктов посредством внутримолекулярных перестроек.
Также выделяют три основных типа ферментативных реакций:
- «Пинг-понг» – реакция, при которой энзим соединяется с одним субстратом, заимствуя у него определенные вещества, а потом взаимодействует с другим субстратом, отдавая ему полученные химические группы.
- Последовательные реакции подразумевают поочередное присоединение к ферменту сначала одного, а потом и другого субстрата, в результате чего формируется так называемый «тройной комплекс», в котором и происходит катализ.
- Случайные взаимодействия – реакции, при которых субстраты взаимодействуют с ферментом неупорядоченно, а после катализа в таком же порядке и отщепляются.
Регуляция активности ферментов

Активность ферментов является непостоянной и во многом зависит от различных факторов среды, в которой им приходится действовать. Так основным показателями для активности ферментов являются факторы внутреннего и внешнего воздействия на клетку. Активность ферментов изменяют в каталах, показывающих количество энзима, превращающего за секунду 1 моль субстрата, с которым он взаимодействует. Международная единица измерения – Е, демонстрирующая количество энзима, способного за 1 минуту преобразовать 1 мкмоль субстрата.
Ингибирование ферментов: процесс
Одним из основных направлений в современной медицине и энзимологии в частности является разработка методов управления скоростью метаболических реакций, происходящих с участием энзимов. Ингибированием принято называть уменьшение активности ферментов посредством использования различных соединений. Соответственно, вещество, обеспечивающее специфичное снижение активности белковых молекул, получило название ингибитора. Существует различные виды ингибирования. Так, в зависимости от прочности связывания энзима с ингибитором процесс их взаимодействия может быть обратимым и, соответственно, необратимым. А в зависимости от того, как воздействует ингибитор на активный центр энзима, процесс ингибирования может быть конкурентным и неконкурентным.
Активирование ферментов в организме
В отличие от ингибирования, активация ферментов подразумевает увеличение их действия в происходящих реакциях. Вещества, позволяющие получить необходимый результат, называются активаторами. Такие вещества могут иметь органическую и неорганическую природу. Например, органическими активаторами могут выступать желчные кислоты, глутатион, энтерокиназа, витамин С, разные тканевые ферменты и др. В качестве неорганических активаторов могут использоваться пепсиноген и ионы различных металлов, чаще всего двухвалентных.
Роль ферментов и практическое использование

Различные ферменты, реакции, происходящие с их участием, а также их результат нашли свое широкое применения в многообразных сферах. На протяжении многих лет действие ферментов активно используется в пищевой, кожевенной, текстильной, фармацевтической и многих других промышленных отраслях. Например, с помощью природных энзимов исследователи пытаются повысить эффективность спиртового брожения при изготовлении алкогольных напитков, улучшить качество продуктов питания, разработать новые методы похудения и др. Но стоит отметить, что использование ферментов в различных отраслях промышленности по сравнению с применением химических катализаторов значительно проигрывает. Ведь основная сложность воплощения такой задачи на практике является термическая неустойчивость энзимов и их повышенная чувствительность к воздействию различных факторов. Также невозможно многократное использование ферментов в производстве из-за сложности их отделения от готовых продуктов выполненных реакций.
Кроме того, свое активное применение действие ферментов обрело в медицине, сельскохозяйственной и химической отрасли. Рассмотрим подробнее, как и где может использоваться действие ферментов:
-
Пищевая промышленность. Всем известно, что хорошее тесто при выпекании должно подняться и разбухнуть. Но далеко не все понимают, как именно это происходит. В муке, из которой и готовится тесто, имеется множество различных ферментов. Так, амилаза в составе муки участвует в процессе разложения крахмала, при котором активно выделяется углекислый газ, способствующий так называемому «разбуханию» теста. Клейкость теста и удерживание в нем СО2 обеспечивается за счет действия фермента под названием протеаза, который также содержится в муке. Получается, что такие, казалось бы. простые вещи, как приготовление теста для выпечки, подразумевают под собой сложнейшие химические процессы. Также особую востребованность некоторые ферменты, реакции, происходящие с их участием, обрели в области производства алкоголя. Различные энзимы используются в составе дрожжей, обеспечивающих качество процесса брожения спирта. Кроме того, некоторые ферменты (например, папаин или пепсин) помогают растворять осадок в спиртосодержащих напитках. Также активно применяются ферменты в производстве кисломолочных продуктов и сыра в том числе.
-
В кожевенной отрасли ферменты используются для эффективного расщепления белков, что наиболее актуально при выведении стойких пятен от различных продуктов питания, крови и др.
-
В производстве стиральных порошков может использоваться целлюлаза. Но при использовании таких порошков для получения заявленного результата необходимо соблюдать допустимый температурный режим стирки.
Кроме того, в производстве кормовых добавок ферменты используются с целью увеличения их питательной ценности, гидролиза белков и некрахмальных полисахаридов. В текстильной промышленности ферменты позволяют изменять свойства поверхности текстильных изделий, а в целлюлозно-бумажной промышленности – удалять чернила и тонеры в процессе вторичной переработки бумаги.
Огромная роль ферментов в жизни современного человека неоспорима. Уже сегодня их свойства активно используются различными сферами, но также непрерывно ведутся поиски новых вариантов применения уникальных свойств и функций ферментов.
Ферменты человека и наследственные заболевания
Многие заболевания развиваются на фоне энзимопатий – нарушений функций ферментов. Выделяют первичные и вторичные энзимопатии. Первичные нарушения являются наследственными, вторичные – приобретенными. Наследственные энзимопатии относят, как правило, к метаболическим заболеваниям. Наследование генетических дефектов или снижения активности ферментов происходит преимущественно по аутосомно-рецессивному типу. К примеру, такое заболевание как фенилкетонурия является следствием дефекта такого фермента как фенилаланин-4-монооксигеназа. Данный фермент в норме отвечает за преобразование фенилаланина в тирозин. В результате нарушений функций фермента происходит накопление аномальных метаболитов фенилаланина, являющихся токсичными для организма.
Также к энзимопатиям относят подагру, развитие которой вызвано нарушением обмена пуриновых оснований и как следствие стабильным увеличением уровня мочевой кислоты в крови. Галактоземия – еще одно заболевание, вызванное наследственным нарушением функциональности ферментов. Развивается данная патология из-за нарушения углеводного обмена, при котором организм не может преобразовывать галактозу в глюкозу. Следствием такого нарушения является накопление галактозы и ее метаболических продуктов в клетках, что приводит к поражениям печени, ЦНС и других жизненно важных систем организма. Основными проявлениями галактоземии выступают диарея, рвота, появляющиеся сразу после рождения ребенка, механическая желтуха, катаракта, задержка физического и интеллектуального развития.
Разные гликогенозы и липидозы также относятся к наследственным энзимопатиям, иначе именуемым энзимопатологиями. Развитие таких нарушений обусловлено низкой ферментной активностью в организме человека или полным ее отсутствием. Наследственные метаболические дефекты, как правило, сопровождаются развитием заболеваний с различной степенью тяжести. При этом некоторые энзимопатии могут протекать бессимптомно и определяются лишь при проведении соответствующих диагностических процедур. Но в основном первые симптомы наследственных метаболических нарушений проявляются уже в раннем детстве. Реже это происходит у старших детей и тем более у взрослых.
При диагностике наследственных энзимопатий немаловажную роль играет генеалогический метод исследования. При этом реакции ферментов специалисты проверяют лабораторным путем. Наследственные ферментопатии могут приводить к нарушениям выработки гормонов, характеризующихся особым значением для полноценной жизнедеятельности организма. Например, корой надпочечников вырабатываются глюкокортикоиды, отвечающие за регуляцию обмена углеводов, минералокортикоиды, участвующие в водно-солевом обмене, а также андрогенные гормоны, оказывающие непосредственное влияние на развитие вторичных половых признаков у подростков. Таким образом, нарушение выработки перечисленных гормонов может привести к развитию многочисленных патологий со стороны различных систем органов.
Пищеварительные ферменты

Процесс переработки пищи в организме человека происходит с участием различных пищеварительных ферментов. В процессе переваривания пищи все вещества расщепляются до небольших молекул, ведь исключительно низкомолекулярные соединения способны проникать сквозь стенку кишечника и всасываться в кровоток. Особая роль в данном процессе отводится ферментам, расщепляющим белки до аминокислот, жиров до глицерина и жирных кислот, а крахмала до сахаров. Расщепление белков обеспечивается действием фермента пепсина, содержащегося в основном органе пищеварительной системы – желудке. Часть пищеварительных ферментов вырабатывается в кишечник поджелудочной железой. В частности к ним относится:
- трипсин и химотрипсин, основным предназначением которых выступает гидролиз белков;
- амилаза – ферменты, расщепляющие жиры;
- липаза – пищеварительные ферменты, расщепляющие крахмал.
Такие пищеварительные энзимы, как трипсин, пепсин, химотрипсин вырабатываются в форме проферментов, и только после их попадания в желудок и кишечник они становятся активными. Подобная особенность защищает ткани желудка и поджелудочной железы от агрессивного их воздействия. Кроме того, внутренняя оболочка этих органов дополнительно покрыта слоем слизи, что обеспечивает еще большую их безопасность.
Часть пищеварительных ферментов вырабатывается также в тонком кишечнике. За переработку целлюлозы, поступающей в организм вместе с растительной пищей, отвечает фермент с созвучным названием целлюлаза. Другими словами, практически в каждом отделе желудочно-кишечного тракта вырабатываются пищеварительные ферменты, начиная со слюнных желез и заканчивая толстой кишкой. Каждый вид энзимов выполняет свои функции, в совокупности обеспечивая качественное переваривание пищи и полноценное всасывание всех полезных веществ в организме.
Ферменты поджелудочной железы
Поджелудочная железа является органом смешанной секреции, то есть выполняет и эндо- и экзогенные функции. Поджелудочная железа, как упоминалось выше, вырабатывает ряд ферментов, которые активируются под воздействием желчи, поступающей вместе с энзимами в органы пищеварения. Ферменты поджелудочной железы отвечают за расщепление жиров, белков и углеводов на простые молекулы, способные проникать сквозь клеточную мембрану в кровоток. Таким образом, благодаря ферментам поджелудочной железы происходит полное усвоение полезных веществ, поступающих в организм вместе с пищей. Рассмотрим подробнее действие энзимов, синтезируемых клетками данного органа ЖКТ:
- амилаза вместе с такими энзимами тонкого кишечника, как мальтаза, инвертаза и лактаза обеспечивают процесс расщепления сложных углеводов;
- протеазы, иначе именуемые протеолитическими ферментами в организме человека, представлены трипсином, карбоксипептидазой и эластазой и отвечают за расщепление белков;
- нуклеазы – ферменты поджелудочной железы, представленные дезоксирибонуклеазой и рибонуклеазой, воздействующими на аминокислоты РНК, ДНК;
- липаза – фермент поджелудочной железы, отвечающий за преобразование жиров в жирные кислоты.
Также поджелудочной железой синтезируется фосфолипаза, эстераза и щелочная фасфтаза.
Наиболее опасными в активном виде являются протеолитические ферменты, вырабатываемые органом. Если процесс их выработки и выделения в другие органы пищеварительной системы нарушается, энзимы активируются непосредственно в поджелудочной железе, что приводит к развитию острого панкреатита и сопутствующих тому осложнений. Ингибиторами протеолитических энзимов, позволяющими затормозить их действие, являются панкреатический полипептид и глюкагон, соматостатин, пептид YY, энкефалин и панкреастатин. Перечисленные ингибиторы способны затормозить выработку панкреатических энзимов путем воздействия на активные элементы пищеварительной системы.
Ферменты тонкой кишки
В тонкой кишке происходят основные процессы переваривания поступающей в организм пищи. В данном отделе ЖКТ также синтезируются ферменты, процесс активации которых происходит совместно с энзимами поджелудочной железы и желчного пузыря. Тонкая кишка – отдел пищеварительного тракта, в котором происходят завершающие этапы гидролиза питательных веществ, поступающих в организм вместе с продуктами питания. В нем синтезируются различные ферменты, расщепляющие олиго- и полимеры на мономеры, которые без проблем могут всасываться слизистой тонкой кишки и поступать в лимфо- и кровоток.
Под воздействием энзимов тонкой кишки происходит процесс расщепления белков, прошедших предварительное преобразование в желудке, на аминокислоты, сложных углеводов на моносахариды, жиров – на жирные кислоты и глицерин. В составе кишечного сока насчитывается свыше 20 видов ферментов, участвующих в процессе переваривания пищи. С участием панкреатических и кишечных ферментов обеспечивается полная отработка химуса (частично переваренной пищи). Все процессы в тонком кишечнике происходят в течение 4 часов после поступления химуса в данный отдел пищеварительного тракта.
Важную роль в переваривании пищи в тонкой кишке играет желчь, поступающая в двенадцатиперстную кишку в процессе пищеварения. В составе самой желчи ферменты отсутствуют, но при этом данная биологическая жидкость усиливает действие энзимов. Наиболее значимой желчь оказывается для расщепления жиров, превращая их в эмульсию. Такой эмульгированный жир намного быстрее расщепляется под воздействием ферментов. Жирные кислоты, взаимодействуя с желчными кислотами, преобразуются в легкорастворимые соединения. Кроме того, выделение желчи стимулирует перистальтику кишечника и выработку пищеварительного сока поджелудочной железой.
Кишечный сок синтезируется железами, расположенными в слизистой тонкой кишки. В составе такой жидкости и присутствуют пищеварительные ферменты, а также энтерокиназа, предназначенная для активации действия трипсина. Кроме того, в кишечном соке имеется фермент под названием эрепсин, необходимый для завершающего этапа расщепления белков, энзимы, действующие на различные виды углеводов (например, амилаза и лактаза), а также липаза, предназначенная для преобразования жиров.
Желудочные ферменты
Процесс переваривания пищи поэтапно происходит в каждом отделе желудочно-кишечного тракта. Так, начинается он еще в ротовой полости, где пища измельчается зубами и смешивается со слюной. Именно в слюне содержатся ферменты, расщепляющие сахар и крахмал. После ротовой полости измельченная пища поступает по пищеводу в желудок, где и начинается следующий этап ее переваривания. Основным желудочным ферментом является пепсин, предназначенный для преобразования белков в пептиды. Также в желудке присутствует желатиназа – фермент, процесс расщепления коллагена и желатина для которого выступает основной задачей. Плюс ко всему пища в полости данного органа подвергается действию амилазы и липазы, соответственно, расщепляющие крахмал и жиры.
От качества пищеварительного процесса зависит возможность получения организмом всех необходимых питательных элементов. Расщепление сложных молекул на множество простых обеспечивает их дальнейшее всасывание в крово- и лимфоток на последующих этапах пищеварения в других отделах ЖКТ. Недостаточная выработка желудочных ферментов может стать причиной развития различных заболеваний.
Ферменты печени

Огромным значением для протекания различных биохимических процессов в организме обладают ферменты печени. Функции белковых молекул, вырабатываемых данным органом, настолько многочисленны и многообразны, что все ферменты печени принято делить на три основные группы:
- Секреторные энзимы, предназначенные для регуляции процесса свертывания крови. К ним относятся холинэстераза и протромбиназа.
- Индикаторные ферменты печени, включающие аспартатаминотрансферазу, обозначаемую аббревиатурой АСТ, аланинаминотрасферазу с соответственным обозначением АЛТ и лактатдегидрогеназу – ЛДГ. Перечисленные энзимы сигнализируют о поражениях тканей органа, при которых разрушаются гепатоциты, «выходят» из клеток печени и поступают в кровоток;
- Экскреторные энзимы вырабатываются печенью и покидают пределы органа с потом желчи. К таким энзимам относится щелочная фосфатаза. При нарушениях оттока желчи из органа уровень щелочной фосфатазы растет.
Нарушение работы тех или иных ферментов печени в будущем может привести к развитию различных заболеваний или сигнализировать об их наличии в настоящее время.
Одним из самых информативных анализов при болезнях печени является биохимия крови, позволяющая определить уровень индикаторных ферментов АСТ, АТЛ. Так, нормальными показателями аспартатаминотрансферазы для женщины является 20-40 Ед/л, а для представителей сильного пола – 15-31 Ед/л. Повышение активности данного фермента может указывать на повреждение гепатоцитов механической или некротической природы. Содержание аланинаминотрасферазы в норме не должно превышать у женщин отметки в 12-32 Ед/л, а для мужчин нормальным считается показатель активности АЛТ в пределах 10-40 Ед/л. Увеличение активности АЛТ, достигаемое десятикратных показателей, может свидетельствовать о развитии инфекционных заболеваний органа, причем еще задолго до появления их первых симптомов.
Дополнительные исследования активности ферментов печени используются, как правило, для дифференциальной диагностики. Для этого может проводиться анализ на ЛДГ, ГГТ и ГлДГ:
medaboutme.ru
4. Ферменты
101
4.1.Общее понятие о ферментах
Вещества белковой природы, биологическая функция которых состоит в катализе, т.е. ускорении течения химических реакций в организме, называются ферментами (от лат. ферментум – закваска) или энзимами (от греч. «эн» – внутри, «зим» – закваска).
Как говорит само происхождение названия этих веществ, начальные сведения об их существовании были получены при изучении процессов брожения. Первое вполне научное описание действия фермента было дано в 1914 г. петербургским ученым К.С. Кирхгоффом. Л. Пастер, связывая процесс брожения с действием ферментов, считал, что эти ферменты не отделимы от дрожжевых клеток и от всего того, что поддерживает клетку в живом состоянии. Лишь благодаря работам русских ученых М.М. Манассеиной, А.Н. Лебедева, а также Э. Бухнера, было доказано, что эти важнейшие ферменты, катализирующие основные метаболические процессы, могут функционировать вне клетки. Тем самым был положен конец виталистической теории брожения.
Наиболее крупные достижения в учении о ферментах принесXX век. В 1926 году Самнером был получен первый кристаллический фермент – уреаза и доказана его белковая природа. Самнер высказал мнение, что все ферменты являются белками. Белковая природа ферментов была окончательно выяснена после того, как Нортроп с сотрудниками выделили в кристаллическом виде пепсин, трипсин и химотрипсин.
К настоящему времени идентифицировано более двух тысяч различных ферментов, из которых около 200 ферментов получено в кристаллическом виде и изучены их свойства. В этом большая заслуга таких исследователей как А.Н. Бах, В.И. Палладин, Варбург, Вилланд, Самнер, Диксон, Уэбб, Кошланд и др.
Успехи, достигнутые в изучении строения и функции ферментов позволяют считать, что ферменты являются тем рабочим аппаратом, при помощи которого реализуется генетическая информация, зашифрованная в последовательности нуклеотидов ДНК.
Ферменты катализируют тысячи химических реакций, из которых слагается в организме обмен веществ и энергии.
При этом биокатализаторы (ферменты) отличаются исключительной эффективностью. При оптимальных условиях большинство ферментативных реакций протекает во много миллионов раз быстрее, чем те же реакции в отсутствии ферментов.
102 4. Ферменты
Число оборотов (т.е. число молекул субстрата, превращаемых за одну минуту, на одну молекулу фермента) для большинства ферментов равно приблизительно 1000, а в некоторых случаях может превышать 1 млн. Из всех известных ферментов максимальным числом оборотов обладает карбоангидраза, для которой оно составляет 36 млн.
Многие химические реакции, которые обычно протекают только при высоких температурах или только в сильно кислой или щелочной среде, в присутствии соответствующих ферментов могут идти быстро и количественно при комнатной температуре и при значениях рН, близких к нейтральному. К примеру, гидролитический распад белка до аминокислот в присутствии неорганических катализаторов (крепких кислот или щелочей) осуществляется при температуре 100°С и выше за несколько десятков часов. Этот же процесс при каталитическом участии специфических ферментов требует всего несколько десятков минут и идет при температуре 30-40°С.
Ферменты обеспечивают способность живых организмов осуществлять необходимые для их жизнедеятельности превращения веществ как поступающих из внешней среды, так и образующихся внутри организма. Питание организма, усвоение им веществ внешней среды происходит при участии ферментов, находящихся в пищеварительных соках, т.е. функционирующих внеклеточно. Дальнейшее использование питательных веществ клетками, освобождение химической энергии высокомолекулярных соединений в процессе биологического окисления и образование структурных элементов клеток и тканей в процессе их развития и дифференцировки совершается при обязательном участии внутриклеточных ферментов. Складываясь в единый ансамбль биохимических процессов, эти ферментативные реакции преобразования веществ составляют материальную и энергетическую основу жизнедеятельности организма. Поэтому ферменты заслуженно считают истинными двигателями всех жизненных процессов. Блокирование деятельности ферментов микробными токсинами и иными ядами ведет к гибели организма.
Благодаря контакту ферментов с лекарственными веществами в больном организме достигается такое изменение ферментативных процессов, которое способствует излечению от болезней. Стимулирование развития животных и растений, осуществляемое разнообразными препаратами, в большинстве случаев основано на действии их на те или иные ферменты.
В тончайших различиях строения ряда ферментов кроется причина видовых особенностей организмов, а в нарушении биосинтеза некоторых ферментов – исходное звено в возникновении наследственных и других заболеваний.
На свойстве ферментов сохранять свои специфические функции вне организма основано их практическое применение в медицине, химической, пищевой, легкой и фармацевтической промышленности.
В последние годы все большее применение в различных областях -промышленности, в фармации, медицине получили искусственно иммобилизованные ферменты. Путем иммобилизации, т.е. связывания, фиксирования ряда ферментов на различных носителях (полиамиде, стекле, силастике, целлюлозе, полистироле, полиуретане, целлофане и др.) создаются нерастворимые катализаторы, которые не только сохраняют специфичность и активность типичных биокатализаторов, но и превышают их стойкостью и длительностью действия.
Иммобилизованные ферменты получили применение в непрерывных реакторах в химической промышленности и биотехнологических процессах. С их помощью созданы новые аналитические методы(афинная хроматография), повысилась эффективность медицинского применения ферментов. В частности, ферменты, включенные в микрокапсулы, липосомы и другие«контейнеры», используются для удаления из крови мочевины, возмещения врожденной ферментной недостаточности, терапии различных опухолей, растворении тромбов, используются в аппаратах «искусственная почка и печень» и для наработки коферментов и кофакторов, аминокислот, гормонов, антител, вакцин в мультимерных реакторах. Ферменты, включенные в волокна или трубки, используются в медицине в экстракорпоральных шунтах при терапии некоторых аспарагин-зависимыхопухолей и для удаления вредных метаболитов из крови, а также при диагностических определениях. Разрабатывается использование
полых волокон с иммобилизованными ферментами в качестве капиллярных подложек в культурах клеток при решении проблем биотехнологического характера, для наработок гормонов, вирусов, вакцин и антител с целью их терапевтического или диагностического использования. Большие перспективы открываются для медицинского использования липосом(микропузырьков из фосфолипидов) с включенными в них ферментами. Их использование дает в ряде случаев уникальную возможность целенаправленного транспорта активного начала внутрь клетки. Использование иммобилизованных ферментов в составе липосом возможно для лечения многих наследственных, онкологических и сердечно-сосудистыхзаболеваний. Широки перспективы для клинического использования ферментов, связанных с водорастворимыми полимерами.
Уже достигнуты определенные успехи в использовании в клинике на пациентах иммобилизованных протеаз в качестве фибринолитических и противовоспалительных препаратов. Созданы на биодеградирующих носителях(гепарине, антителах и др.) препараты стрептокиназы, фибринолизина, трипсина, урокиназы. Особое значение приобрело применение препарата иммобилизованной стрептокиназы (стрептодеказы) для лечения инфаркта миокарда и тромбозов.
4.2. Выделение ферментов и определение их активности
Ферменты обычно присутствуют в тканях в малых количествах. Для изучения их строения и свойств требуется их извлечение из тканей особыми -методами и очистка от сопутствующих веществ. Очень удобным источником извлечения некоторых ферментов являются пищеварительные соки животных и человека, поскольку их можно рассматривать как достаточно концентрированные водные растворы ферментов. Из тканей и органов животных и растительных организмов ферменты извлекают путем разрушения этих тканей(измельчением, растиранием с кварцевым или стеклянным песком, гомогенизацией и др.) на холоду с последующей экстракцией той или иной жидкостью: солевыми растворами или буферными смесями,спирто-солевымисмесями, глицерином, бутиловым спиртом. Чаще всего ферменты получают путем адсорбции (связывания на поверхности) с последующей элюцией(снятием с поверхности) с адсорбента. Этот метод был введен в химию ферментов А.Я. Данилевским и дал мощный толчок развитию ферментологии. Наряду с ним широко применяется метод ионообменной хроматографии, метод молекулярных сит и электрофорез. Словом, ферменты выделяют также, как и другие белки. Причем, при изучении ферментовокислительно-восстановительныхпроцессов, биосинтеза белка и т.д. весьма важное значение приобрели методы дифференциального центрифугирования субклеточных структур– митохондрий, рибосом, ядер, гиалоплазмы, где эти ферменты сосредоточены. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, при которых была бы исключена денатурация белка, так как она всегда связана с потерей ферментативной активности.
О степени чистоты ферментативного препарата судят по его биологической активности. Если активность при дальнейшей обработке не возрастает, препараты можно считать гомогенными.
Наличие фермента обычно распознается по проявлениям катализируемой им химической реакции; количество присутствующего фермента можно определить путем измерения скорости этой реакции. Таким образом, о количестве фермента судят по его активности.
Активность ферментов определяется большим числом факторов, которые можно схематически подразделить на три группы:
1.Количество самого ферментного белка в клетке, т.е. уровень его биосинтеза.
2.Наличие факторов, изменяющих скорость ферментативной реакции, т.е. наличие субстратов, кофакторов, активаторов, ингибиторов, влияющих на конформацию апофермента, денатурирующих влияний, метаболическое взаимопревращение ферментов, величина температуры, гидратации, рН, осмолярности, наличие электролитов и т.д.
3. Локализация ферментов и зависящие от проницаемости мембран доступность субстратов ферментативному воздействию и скорость удаления продуктов ферментативной реакции.
Учитывая эту разностороннюю зависимость активности ферментов, определение активности ферментов проводят в буферных растворах, имеющих значение рН, близкое к оптимальному для данного фермента, при температуре в пределах 25-40°С(обычно при 37°С). В состав опытных смесей добавляют необходимые коферменты (в концентрациях, превышающих концентрацию насыщения), активаторы и стабилизаторы (последние препятствуют денатурации ферментативного белка). Используются концентрации субстрата, превышающие концентрацию насыщения. Основными современными методами определения активности ферментов являются спектрофотометрические, флюориметрические, полярографические, колориметрические, монометрические и др. В основном, эти методы определяют убыль субстрата или появление продуктов его ферментативного расщепления и дают оценку относительных количеств фермента. Однако с помощью спектрофотометрии и флюориметрии можно получать информацию об абсолютном количестве фермента(по степе-
ни поглощения растворами фермента лучей света с определенной длинной волны – в первом случае и по степени флюоресценции простетических групп фермента – во втором случае).
До недавнего времени в работах по определению активности ферментов не было единообразия ни в выборе условий измерения активности ферментов, ни в способе выражения единиц активности ферментов.
Комиссия по ферментам Международного биохимического союза в1961 году рекомендовала общие правила и величины, в которых выражается количество ферментов. Согласно этим рекомендациям за единицу(Е) фермента принимается такое его количество, которое катализирует превращение одного микромоля субстрата в минуту при25°С в оптимальных условиях. Удельная активность ферментного препарата выражается числом единиц ферментативной активности в расчете на 1 мг белка, а концентрация фермента в растворе– числом этих единиц на 1 мл раствора.
В дальнейшем комиссия по биохимической номенклатуре рекомендовала выражать скорость реакций в молях в секунду, придерживаясь единиц международной системы мер. Согласно рекомендациям международного биохимического союза (1972) и номенклатуре ферментов (1978) предложено вместо безымянной ферментной единицы ввести для выражения каталитической активности ферментов новую единицу под названием катал. Катал (символ – кат) есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю субстрата в секунду, в заданной системе измерения активности.
studfiles.net
— строение ферментов — Биохимия
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем), лактатдегидрогеназа (содержит Zn2+), амилаза (содержит Ca2+).
Кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+).
Деление на коферменты и простетические группы не всегда однозначно:
• если связь кофактора с белком прочная, то в этом случае говорят о наличии простетической группы,
• но если в качестве кофактора выступает производное витамина — то его называют коферментом, независимо от прочности связи.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами, т.е. состоять из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы.
Изоферменты креатинкиназы |
Изоферменты лактатдегидрогеназы |
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2).
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами «туннель». В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
Строение мульферментного комплекса
Например,
Абзимы
Абзимами называются антитела, имеющие каталитическую функцию (англ. abzymes, antibodies as enzymes) и катализирующие конкретные реакции. Такая способность возникает в результате формирования промежуточного продукта при связывании антитела с антигеном (имитация переходного комплекса E-X ферментативной реакции).
biokhimija.ru
