D-аминокислоты: не только в Зазеркалье
По до сих пор неизвестным причинам в состав белков живых организмов входят преимущественно L-энантиомеры (оптические изомеры) аминокислот, — за довольно редкими и разрозненными исключениями вроде пептидных веществ, образующихся в грибах и бактериях путём нерибосомного синтеза. (Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
Верно ли, что Оспод и Погг, не ограничиваясь обычным загрязнением беззащитной, пустынной планеты, решили, по пьяному делу, учинить на ней, самым бесстыдным и возмутительным образом, биологическую эволюцию, какой еще свет не видывал? <…> Верно ли, что эти безобразники, лишенные всякого чувства приличия и нравственных тормозов, вылили на скалы безжизненной Земли шесть бочек заплесневелого желатинового клея и два ведра испорченной альбуминовой пасты, подсыпали туда забродившей рыбозы, пентозы и левуллозы и, словно им мало было всех этих гадостей, добавили три больших бидона с раствором прокисших аминокислот, а получившееся месиво взболтали угольной лопатой, скособоченной влево, и кочергой, скрученной в ту же сторону, в результате чего белки всех будущих земных существ стали ЛЕВОвращающими?!
С. Лем,
«Звездные дневники Ийона Тихого. Путешествие восьмое» (1966 г.)
Вступив из своей комнаты в загадочный мир зазеркалья, маленькая героиня Льюиса Кэррола — английская девочка Алиса — узнала, что эти два мира, на первый взгляд выглядящие столь похожими, на самом деле существенно отличаются. Алиса интуитивно чувствует, что даже молоко в мире-отражении совсем не такое, как тот вкусный и полезный напиток, которым она привыкла наслаждаться у себя в Англии: «Впрочем, не знаю, можно ли пить зазеркальное молоко? Не повредит ли оно тебе, Китти…» [1]. И правда: то ли Кэррол (то есть, конечно, Чарльз Лютвидж Доджсон) уже знал о стереохимических свойствах органических соединений, то ли предвосхитил это знание, — но так или иначе, подавляющее большинство биологических молекул может существовать в виде двух зеркальных отражений друг друга, не совмещаемых простым наложением. Девятнадцать из 20 природных аминокислот (кроме глицина) являются хиральными, — то есть, расположение заместителей вокруг центрального атома углерода (Cα) может дать две зеркально-симметричные молекулы, похожие друг на друга как перчатки с левой и правой руки. Пары таких молекул называются стереоизомерами (или оптическими изомерами, или энантиомерами), и по одной из классификаций обозначаются L- и D-аминокислотами (см. рисунок в заглавии).
Если вернуться к Алисе, то её сомнения насчет молока были отнюдь не беспочвенными: ведь пара «зеркальных» молекул, хотя во многих отношениях и идентична (например, молекулярная масса, углы и длины связей у них равны), может иметь разительно отличающиеся биологические характеристики. В частности, Алисе вряд ли удалось бы переварить молоко, белк и которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
Клеточная стенка является, по сути, «крепостной стеной» бактериальной клетки, защищая её от разнообразных неблагоприятных факторов окружающей среды. Состоит она главным образом из пептидогликана — эластичного полимера, в котором сахара и аминокислоты «сшиваются» между собой подобно сетке и охватывают бактериальную мембрану целиком. Одна из ролей D-аминокислот здесь — образовывать поперечные пептидные сшивки между длинными углеводными тяжами пептидогликанов; эти сшивки обогащены D-аланином и D-глутаминовой кислотой, роль которых предположительно заключается в противостоянии расщеплению клеточной стенки враждебными ферментами-гидролазами, «настроенными» только на L-аминокислоты.
Для успешного роста и процветания микроорганизмов пептидогликан должен обладать незаурядной пластичностью: ведь бактерии, оказавшись в богатой питательными веществами среде, немедленно начинают делиться, и клеточная стенка должна делиться вместе с ними, чтобы не оставить потомство без защиты. В период сомнений и тягостных раздумий стресса же пептидогликан должен, наоборот, становиться жёстче, чтобы максимально усилить защиту бактерии. Однако факторы, управляющие этими сложными превращениями при переходе от «довольства» к голоданию, практически не были известны.
Одним из объектов, с которым работала команда Лэма, является бактерия Vibrio cholerae, или холерный вибрион, являющийся возбудителем острой кишечной инфекции. Исследователи отметили, что состояние клеточной стенки бактерии меняется в зависимости от содержания в питательной среде определённых аминокислот. К удивлению учёных, D- (а не L-!) энантиомеры метионина и лейцина вызывали замедление синтеза пептидогликана и смену «режима» образования поперечных сшивок в клеточной стенке. Роль этих аминокислот в перестройке клеточной стенки была дополнительно подтверждена открытием у холерного вибриона нового фермента, синтезирующего эти D-аминокислоты. Что интересно, в аналогичный процесс у грамположительной бактерии Bacillus subtilis (сенной палочки) оказались также вовлечены две D-аминокислоты, но другие: D-тирозин и D-фенилаланин.
Как именно под действием D-аминокислот происходит перестройка клеточной стенки, пока в точности не ясно. По-видимому, увеличение их содержания как-то влияет на частоту и/или длину сшивок пептидогликана и, следовательно, на прочность и гибкость. Нельзя исключить также возможность, что D-аминокислоты регулируют активность периплазматических ферментов, синтезирующих и перестраивающих клеточную стенку.
Постепенно накапливаются и другие примеры функциональной важности D-аминокислот. У некоторых видов бацилл образование вегетативных клеток из спор регулируется именно относительным содержанием в среде L- и D-аминокислот, которые, соответственно, индуцируют или замедляют проращивание посредством взаимодействия со специальными рецепторами на поверхности спор [6]. На поверхности капсулы B. anthracis — возбудителя сибирской язвы — находятся полимеры с высоким содержанием D-глутаминовой кислоты, что, по-видимому, защищает бактерию от действия протеаз [7]. D-аминокислоты во множестве содержатся в природных антибиотиках, иммуносупрессорных лекарствах и противоопухолевых веществах [8].
Хотя еще совсем недавно D-аминокислоты считались исключительно «артефактом» бактерий и грибов, появляются данные и о роли этих веществ у эукариот. Эндогенный D-серин выполняет в мозгу млекопитающих функцию нейротрансмиттера [9]. D-аспарагиновая кислота найдена в нейроэндокринных тканях млекопитающих, где она модулирует гормональную секрецию [10].
Возвращаясь напоследок снова к Алисе — точнее, к её создателю Чарлзу Доджсону, — можно высказать предположение, что он (Доджсон) всё-таки знал о вопросах, возникающих в стереохимии, поскольку Луи Пастер (знаменитый химик и микробиолог) был его современником. Пастер к тому моменту уже опубликовал несколько работ по хиральным свойствам винной кислоты, найденной на дне бутылки во многих восхитительных яствах по эту сторону зеркального стекла, — например, в винах и некоторых фруктах и растениях.
Открытия новых функций D-аминокислот, несомненно, продолжатся, и несправедливой дискриминации этих неплохих, в сущности, соединений недолго ещё осталось жить на Земле 🙂
По материалам рубрики «Перспектива» Science [11].
- Кэррол Л. Сквозь зеркало и что там увидела Алиса, или Алиса в Зазеркалье. М.: «Наука», 1991;
- Victor S Lamzin, Zbigniew Dauter, Keith S Wilson. (1995). How nature deals with stereoisomers. Current Opinion in Structural Biology. 5, 830-836;
- Stephen F. Mason. (1984). Origins of biomolecular handedness. Nature. 311, 19-23;
- V Prelog. (1976). Chirality in chemistry. Science. 193, 17-24;
- H. Lam, D.-C. Oh, F. Cava, C. N. Takacs, J. Clardy, et. al.. (2009). D-Amino Acids Govern Stationary Phase Cell Wall Remodeling in Bacteria. Science. 325, 1552-1555;
- M. T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;
- J. W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol. 87, 250-250;
- J. Grunewald, M. A. Marahiel. (2006). Chemoenzymatic and Template-Directed Synthesis of Bioactive Macrocyclic Peptides. Microbiology and Molecular Biology Reviews. 70, 121-146;
- Aude Panatier, Dionysia T. Theodosis, Jean-Pierre Mothet, Bastien Touquet, Loredano Pollegioni, et. al.. (2006). Glia-Derived d-Serine Controls NMDA Receptor Activity and Synaptic Memory. Cell. 125, 775-784;
- A. S. Huang. (2006). D-Aspartate Regulates Melanocortin Formation and Function: Behavioral Alterations in D-Aspartate Oxidase-Deficient Mice. Journal of Neuroscience. 26, 2814-2819;
- S. R. Blanke. (2009). Expanding Functionality Within the Looking-Glass Universe. Science. 325, 1505-1506.
biomolecula.ru
аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
D-аминокислота
Cтраница 1
Некоторые D-аминокислоты при включении их в рацион взамен соответствующих L-изомеров могут поддерживать рост животных и размножение микроорганизмов. В большинстве случаев эти D-изомеры, очевидно, превращаются в L-аминокислоты путем окислительного дезаминирования с образованием а-кето-кислот и последующего реаминирования в результате переами-нирования. Следует подчеркнуть, что такой механизм инверсии D-аминокислот в организме нельзя считать полностью доказанным; однако эти представления находятся в согласии с данными, свидетельствующими о возможности обеспечения роста животных и микроорганизмов при помощи а-кетоаналогов некоторых аминокислот, а также с существованием и широким распространением оксидазы D-аминокислот и различных транс-аминаз. Наблюдения над ростом молодых крыс показали, что вместо D-аминокислот, которые заменяют соответствующие L-аминокислоты, можно вводить в организм и соответствующие а-кетопроизводные. Вместе с тем в некоторых случаях а-кето-кислоты ( например, а-кетоаналоги лейцина и изолейцина) обеспечивают рост молодых животных, тогда как соответствующие им D-аминокислоты не используются растущим организмом; эти данные позволяют предполагать, что скорость окислительного дезаминирования D-аминокислот не всегда достаточно высока, чтобы обеспечить рост животных. [1]
L-и D-аминокислоты различаются, кроме того, по вкусу: первые-горькие, вторые-сладкие. [2]
Определяли следующие D-аминокислоты: D-фенилаланин, — аланин, — валин, — метионин, — лейцин и изолейцин, которые могут вступать в реакции типа ( XI. [3]
Оксидаза D-аминокислот в организме млекопитающих находится только в тканях печени и почек, причем активность ее в почках значительно выше, чем в печени. Фермент окисляет множество различных D-аминокислот и не проявляет поддающейся обнаружению активности по отношению к L-аминокисло-там. В связи с этим следует напомнить, что его используют для обнаружения ничтожных количеств D-аминокислот в присутствии высоких концентраций соответствующих L-изомеров ( стр. [4]
Оксидазы D-аминокислот найдены у ряда плесеней и бактерий; субстратами этих ферментов могут служить встречающиеся в некоторых микроорганизмах D-аминокислоты. [5]
Остатки D-аминокислот обнаружены в немногих простых пептидах, содержащихся в живых организмах. [7]
Оксидаза D-аминокислот с простетической группой ФАД [369] окисляет в соответствующие иминокислоты DL-лейцин, D — и DL-метионин, D — и DL-аланин, DL-a — аминомасляную кислоту. Оксидаза L-аминокислот, содержащая ФАД, дезаминирует L-аргинин в a — кето-б — гуанидовалериановую кислоту, L-орнитин в a — кето-б-аминовалериановую кислоту, L-лизин в г-кето-е-аминокапроновую кислоту. [8]
Остатки D-аминокислот входят в состав многих природных пепти дов, прежде всего антибиотиков В частности, в грамицидин S входит D-фенилаланин, в грамицидин А — D-валин, D-лейцин, D трипто фан, в актиномнцин D D изолейцин, в полимнксин D-серин D-Пролин встречается в эргоалкалоидах. [9]
Остатки D-аминокислот обнаружены в немногих простых пептидах, содержащихся в живых организмах. [11]
Распространение D-аминокислот пока еще представляется несколько ограниченным. [12]
Почечная оксидаза D-аминокислот не действует на аминокислоты, в молекуле которых замещен а-водородный атом или замещены оба водородных атома аминогруппы. В табл. 18 приведены выборочно данные литературы по ферментативному окислению различных аминокислот. [14]
Активность оксидазы D-аминокислот т vivo подтверждается рядом фактов. Например, установлено, что некоторые D-аминокислоты при введении их с пищей вместо соответствующих L-аминокислот обеспечивают рост животных ( стр. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
что это такое, полезные свойства и как их правильно принимать
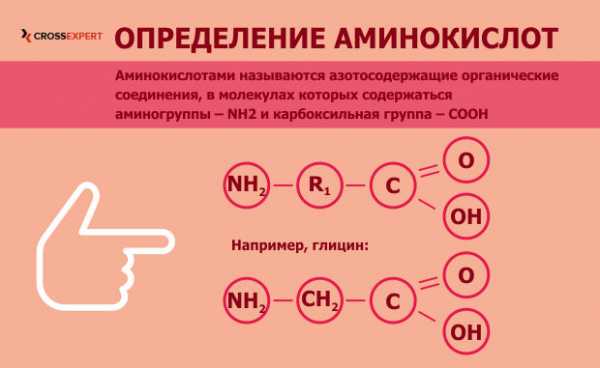
Аминокислоты — сложные органические вещества, состоящие из углеводородного скелета и двух дополнительных групп: аминной и карбоксильной. Последние два радикала обусловливают уникальные свойства аминокислот — они могут проявлять свойства как кислот, так и щелочей: первые — за счет карбоксильной группы, вторые — за счет аминогруппы. Теперь, когда, что такое аминокислоты с точки зрения биохимии, — мы разобрались, давайте рассмотрим их влияние на организм человека и применение в спорте.
Для спорта аминокислоты важны своим участием в протеиновом обмене. Именно из отдельных аминокислот строятся протеины для роста мышечной массы нашего тела — мышечная, скелетная, печеночная, соединительная ткани. Помимо этого, некоторые аминокислоты непосредственно участвуют в обмене веществ, например, аргинин участвует в, так называемом, орнитиновом цикле мочевины — уникальном механизме обезвреживания аммиака, образующегося в печени в процессе переваривания белков.
- Из тирозина в коре надпочечников синтезируются катехоламины — адреналин и норадреналин — гормоны, функция которых — поддержание тонуса сердечно сосудистой системы, мгновенная реакция на стрессовую ситуацию и, в итоге, сохранение жизни индивидуума.
- Триптофан является предшественником гормона сна — мелатонина, вырабатывающегося в шишковидном теле — эпифизе, в головном мозге. При недостатке этой аминокислоты в рационе, процесс засыпания сильно усложняется, приводя к бессоннице и ряду заболеваний, ею обусловленных. Перечислять можно долго, однако остановимся на аминокислоте, значение которой особенно велико для спортсменов и людей, умеренно занимающихся спортом.
Для чего нужен глютамин?
Глютамин — аминокислота, которая лимитирует синтез протеина, из которого состоит наша иммунная ткань — лимфатические узлы и отдельные образования лимфоидной ткани. Значение этой системы переоценить трудно, ведь без должного сопротивления инфекциям ни о каком тренировочном процессе говорить не приходится. Тем более, что каждая тренировка — не важно, профессиональная или любительская — является дозированным стрессом.
Стресс — необходимое явление для того, чтобы сдвинуть с места нашу «точку равновесия», то есть вызвать определенные биохимические и физиологические изменения в организме человека. Однако, любой стресс — это цепь реакций, мобилизующих тело. В промежуток, характеризующий регресс каскада реакций симпатоадреналовой системы (а именно они и олицетворяют собой стресс) происходит снижение синтеза лимфоидной ткани. Из-за этого процесс распада в ней превышает скорость синтеза, а, значит, иммунитет ослабевает. Так вот, дополнительный прием глютамина помогает свести к минимуму этот не совсем желательный, но неизбежный эффект физической нагрузки

Незаменимые и заменимые аминокислоты
Для того чтобы понять, для чего нужны незаменимые аминокислоты в спорте, необходимо иметь общие представления о белковом обмене. Потребленные человеком белки на уровне желудочно-кишечного тракта обрабатываются ферментами — веществами, расщепляющими ту пищу, которую мы употребили.
В частности, белки распадаются сперва до пептидов — отдельных цепочек аминокислот, не имеющих четвертичной пространственной структуры. И уже пептиды распадутся на отдельные аминокислоты. Те, в свою очередь, могут быть усвоены организмом человека. Это значит, что аминокислоты всасываются в кровь, и только с этого этапа могут быть использованы в качестве продуктов для синтеза белка тела.

Забегая вперед скажем, что прием отдельных аминокислот в спорте, помогает сократить данный этап — отдельные аминокислоты будут сразу же всасываться в кровь и процессы синтеза, и, соответственно, биологический эффект аминокислот наступит быстрее. Всего существует двадцать аминокислот, образующих полный спектр последних. Для того, чтобы процесс синтеза белка в теле человека стал возможным в принципе, в рационе человека должен присутствовать полный спектр аминокислот.
Незаменимые
Вот с этого момента и появляется понятие незаменимости. К незаменимым аминокислотам относятся строго те, которые наше тело не способно синтезировать самостоятельно из каких- то других аминокислот. То есть, появиться им ,кроме как из продуктов питания, неоткуда. Таких аминокислот восемь плюс 2 частично-заменимые. Рассмотрим в таблице, в каких продуктах содержится аминокислота и ее роль в организме человека:
| Название | В каких продуктах содержится? | Роль в организме |
| Лейцин | Орехи, овес, рыба, яйца, курица, чечевица. | Снижает содержание сахара в крови. |
| Изолейцин | Нут, чечевица, кешью, мясо, соя, рыба, яйца, печень, миндаль, мясо. | Восстанавливает мышечную ткань. |
| Лизин | Амарант, пшеница, рыба, мясо, большинство молочных продуктов. | Принимает участие в усвоении кальция. |
| Валин | Арахис, грибы, мясо, бобовые, молочные продукты, многие зерновые. | Принимает участие в обменных процессах азота. |
| Фенилаланин | Говядина, орехи, творог, молоко, рыба, яйца, разные бобовые. | Улучшение памяти. |
| Треонин | Яйца, орехи, бобы, молочные продукты. | Синтезирует коллаген. |
| Метионин | Фасоль, соя, яйца, мясо, рыба, бобовые, чечевица. | Принимает участие в защите от радиации. |
| Триптофан | Кунжут, овес, бобовые, арахис, кедровые орехи, большинство молочных продуктов, курица, индейка, мясо, рыба, сушенные финики. | Улучшает и делает сон глубже. |
| Гистидин (частично-заменимая) | Чечевица, соевые бобы, арахис, тунец, лосось, говяжье и куриное филе, свиная вырезка. | Принимает участие в противовоспалительных реакциях. |
| Аргинин (частично-заменимая) | Йогурт, кунжут, семена тыквы, швейцарский сыр, говядина, свинина, арахис. | Способствует росту и восстановлению тканей организма. |
В достаточном количестве они содержаться в животных источниках белка — рыбе, мясе, птице. При отсутствии таковых в рационе, весьма целесообразен прием недостающих аминокислот в качестве добавок спортивного питания. Особенно это актуально для спортсменов-вегетарианцев. Крайне большое внимание последним нужно обратить на такие добавки, как ВСАА — смесь лейцина, валина и изолейцина.
Именно по этим аминокислотам возможна «просадка» в рационе, не содержащем животных источников белка. Для спортсмена, не важно профессионала или любителя, это абсолютно не допустимо, так как в долгосрочной перспективе приведет к катаболизму со стороны внутренних органов и к заболеваниям последних. В первую очередь, печени.
Заменимые
Заменимые аминокислоты и их роль, рассмотрим в таблице ниже:
| Название | Роль в организме |
| Аланин | Принимает участие в глюконеогенезе печени. |
| Пролин | Отвечает за составление прочной структуры коллагена. |
| Левокарнитин | Поддерживает кофермент А. |
| Тирозин | Отвечает за ферментативную активность. |
| Серин | Отвечает за построение природных белков. |
| Глютамин | Синтезирует протеины мышц. |
| Глицин | Снижает напряжение т уменьшает агрессивность. |
| Цистеин | Положительно влияет на текстуру и состояние кожи. |
| Таурин | Оказывает метаболическое действие. |
| Орнитин | Принимает участие в биосинтезе мочевины. |
Что происходит с аминокислотами и протеинами в вашем теле?
Аминокислоты, попавшие в кровоток, распределяются, в первую очередь, по тканям тела, где в них есть наибольшая потребность. Именно поэтому, если у вас есть «просадка» по определенным аминокислотам, прием дополнительного количества белка, богатого ими, либо прием дополнительных аминокислот, будет вам полезен.
Синтез белка происходит на клеточном уровне. В каждой клетка есть ядро — самая важная часть клетки. Именно в ней происходит считывание генетической информации и ее воспроизводство. По сути дела, вся информация закодирована в последовательности аминокислот.
Как выбрать аминокислоты простому любителю, умеренно занимающемуся спортом 3-4 раза в неделю? Никак. Они ему просто не нужны. На современном этапе развития человечества, более важным для такого любителя будет, в первую очередь:
- Начать питаться регулярно, в одно и то же время.
- Сбалансировать свой рацион по белкам жирам и углеводам.
- Убрать фастфуд и некачественную пищу из своего рациона.
- Начать употреблять достаточное количество воды — 30 мл на килограмм массы тела.
- Отказаться от рафинированного сахара.
Эти, казалось бы, банальные манипуляции с рационом принесут гораздо больше, чем добавление в рацион каких бы то ни было добавок. Более того, эти самые добавки, без соблюдения этих условий, будут абсолютно бесполезны. Как вы можете быть уверены в том, какие аминокислоты вам нужны, если вы питаетесь непонятно чем? Откуда вы знаете, из чего сделаны котлеты в столовой? Или сосиски? Или что за мясо в котлете в бургера? Про начинку для пиццы вообще промолчим. Поэтому прежде, чем делать вывод о потребности в аминокислотах, нужно начать питаться тем, что приготовил сам, из простых и чистых продуктов. Ну, и выполнить описанные выше шаги. То же самое касается дополнительного приема белка, если в вашем рационе присутствует белок, в количестве 1,5- 2 грамма на килограмм массы тела, никакой дополнительный белок вам не нужен. Лучше потратить деньги на покупку качественных продуктов питания.
Важно понимать, что протеин и аминокислоты — это не фармакологические препараты!
Это всего лишь добавки спортивного питания. И ключевое слово здесь — добавки. Добавлять их следует по потребности. А для того, чтобы понять, есть ли потребность, нужно контролировать свое питание. В случае, если вы уже прошли описанные выше шаги, и поняли, что добавить в рацион что-либо нужно, все, что вы должны сделать, — это пойти в магазин спортивного питания и выбрать соответствующий продукт, сообразно вашим финансовым возможностям. Единственное, чего не следует делать, так это покупать аминокислоты с натуральным вкусом — пить их довольно трудно, в силу чрезвычайной горечи.
Вред, побочные эффекты, противопоказания
Если у вас есть заболевания, которые характеризуются непереносимостью одной из аминокислот спектра, вы об этом знаете с рождения, так же как и ваши родители. Этой аминокислоты нужно избегать и дальше. Если же этого нет, говорить о вреде и противопоказаниях для БАДов глупо.
Аминокислоты — составляющая часть белка, белок — привычная часть рациона человека. Все то, что продается в магазинах спортивного питания, не является фармакологическими препаратами! И говорить о каком-то вреде и противопоказаниях — дело старушек на лавочке у подъезда. По той же причине мы не будем рассматривать такое понятие, как побочные эффекты аминокислот — оно попросту не состоятельно.
Трезво подходите к своему рациону, занятиям, жизни! Будьте здоровы!
Оцените материалcross.expert
1.5. Α-Аминокислоты
Аминокислоты представляют собой основные «строительные» единицы всех белков.
Большинство аминокислот, участвующих в биохимических превращениях, являются карбоновыми кислотами, содержащими карбоксильную и аминную группы, которые находятся у одного и того же углеродного атома. В организме человека найдено 70 аминокислот. Двадцать из них входят в состав белков. Это так называемые протеиногенные аминокислоты.
Общая формула α-аминокислот представлена на Рис. 1.2:
Рис. 1.2. Общая формула аминокислот
Аминокислоты отличаются друг от друга структурой боковых групп, которые в приведенной выше формуле, обозначены через R. Эти группы имеют различную химическую структуру.
1.5.1. Изомерия аминокислот
1.5.1.1. Изомерия положения аминогруппы
Для аминокислот, прежде всего, характерна изомерия положения аминогруппы.
В биологии и химии до сих пор широко распространены названия аминокислот, в которых взаимное расположение аминогруппы по отношению к карбоксильной группе обозначается греческими буквами.
Так, если аминогруппа и карбоксил находятся у одного и того же атома углерода, то такая аминокислота называется α-аминокислотой.
В β-аминокислотах функциональные группа разделены двумя атомами углерода, в γ- — тремя и т.д.
Белки образованы только из α-аминокислот, но в организме встречаются и другие аминокислоты. Например γ-аминомасляная кислота (ГАМК):
CH2(NH2)-CH2-CH2-COOH
Рис. 1.3. γ-аминомасляная кислота
ГАМК играет важную роль в механизме передачи нервного импульса.
1.5.1.2. Оптическая изомерия аминокислот
α-Аминокислоты характеризуются наличием оптической активности, т. е. они могут вращать плоскость поляризованного света вправо или влево. Это свойство природных аминокислот обусловлено наличием ассиметрического атома углерода или иначе: хирального центра (хиральность от греч. Cheir – рука), т. е. атома углерода с четырьмя различными заместителями.
Все α-аминокислоты, имеющие ассиметричесийй атом углерода, образуют оптические (зеркальные, т. е. которые нельзя совместить) изомеры.
Оптические изомеры принято обозначать латинскими буквами. L— (от лат. Louvus – левый) и D— (от лат dexter – правый).
L-аминокислота d-аминокислота
Рис. 1.4. L и D оптические изомеры α-аминокислот
Считают, что кислота относится к L-ряду, если в написании фишеровской проекции аминогруппа расположена слева (рис. 1.4).
Все природные аминокислоты, входящие в состав белков, относятся именно к L-ряду.
Вся белковая жизнь на земле – «левая». Есть и «исключения», но они только подтверждают правило. Оказывается, D-аминокислоты крайне редко, но все же встречаются в природе.
Например, они присутствуют в оболочке бактерии, которая является возбудителем сибирской язвы. Именно поэтому оболочка бактерии не разрушается ферментами, разрывающими белковые цепи L-аминокислот.
Из 20 α—аминокислот, входящих в состав белков:
1) 17 обладают одним ассиметричным атомом углерода;
2) одна не содержит ассиметричного атома углерода: глицин;
3) две имеют два ассиметричных атома углерода: изолейцин и треонин.
studfiles.net
Аминокислота — d-ряд — Большая Энциклопедия Нефти и Газа, статья, страница 1
Аминокислота — d-ряд
Cтраница 1
Аминокислоты D-ряда называют иногда неприродным так как они не используются для построения белков челове ского организма. D-a — аминокислоты встречаются во мно природных пептидах, продуцируемых микроорганизмами, нап мер в антибиотиках ( грамицидин, актиномицин, полимикси а также в составе биополимеров клеточной стенки бактер например остаток D-глутаминовой кислоты — в оболочке бак рий сибирской язвы. [1]
В большинстве случаев аминокислоты D-ряда сладкие на вкус, L-ряда — горькие или безвкусные. [2]
Замена аминокислоты L-ряда на аминокислоту D-ряда или замена даже одной L-аминокислоты на другую может привести к полному исчезновению биологической активности пептида. [3]
Интересно, что в тканях значительно скорее дезаминируются не L-аминокисло-ты, входящие в состав белков, а ненатуральные аминокислоты D-ряда. Ткани почек, например, оказались более богаты таким ферментом, действующим на D-аминокисло-ты. Таким образом, в тканях большее распространение имеет океидаза D-аминокислот. Эта дегидрогеназа оказалась по своему строению флавиновым ферментом, кофермент-ной группой которого является рибофлавинадениновый динуклеотид. [4]
Интересно, что человек может уже по вкусу отличить оптические антиподы аминокислот: аминокислоты L-ряда горькие или безвкусные, аминокислоты D-ряда обычно сладкие. [5]
Отнесение делается по аналогии с глицериновым альдегидом, НОСН2СН ( ОН) СНО, проекционная формула левовращающего изомера которого содержит гидроксил слева от вертикальной линии. Аминокислоты D-ряда содержатся в некоторых антибиотиках. [6]
Физиологическое значение и обмен L — и D-аминокислот совершенно р з-личны. Можно считать, что аминокислоты D-ряда, как правило, или совершенно не усваиваются животными и растениями, или усваиваются гораздо хуже, поскольку ферментные системы животных и растений специфически приспособлены к L-аминокислотам. [7]
Интересно отметить различие в физиологическом действии аминокислот L — и D-рядов. Большинство аминокислот L-ряда имеет сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные. [8]
Пенициллин ингибирует фермент только у микроорганизмов. Ферментная система животного организма, не способная использовать аминокислоты D-ряда, не затрагивается. [10]
Интересно отметить различие в физиологическом действии аминокислот L — и D-рядов. Большинство аминокислот L-ряда имеет сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные. [11]
В В-цепи окисленного инсулина эти протеазы гидролизовали пептидные связи по карбоксильным группам тех же аминокислот, проявляя специфичность, близкую к специфичности панкреатического химотрипсина. Пептиды, в которых х-аминокислотой были глицин, валин, пролин и пептиды, содержащие аминокислоты D-ряда, а также амиды КБО-лейцина и бензоилтирозина, исследуемыми протеазами практически не гидролизовались. [12]
Окислительное дезаминирование а-амино-кислот в а-кетокислоты и моноаминов в альдегиды. Окислительное дезаминирование а-аминокислот катализируют флавопротеиды-оксидазы L-аминокислот, катализирующие окисление природных аминокислот L-ряда, и оксидазы D-аминокислот, действующие на неприродные аминокислоты D-ряда. [13]
Полученную оптически активную кислоту обрабатывали тионилхлоридом. Основываясь на представлении о том, что в процессе образования активной а-бромпропионовой кислоты из L-аланина имеет место вальденовское обращение, Фишер считал, что для синтеза пептидов, состоящих из L-аминокислот, необходимо галоид кислоты синтезировать из аминокислот D-ряда. [14]
Растения по-разному относятся к D — и L-формам аминокислот, и если L-формы хорошо усваиваются растениями и легко включаются в различные процессы обмена веществ, то D-формы растениями не ассимилируются, а иногда даже ингибируют процессы обмена. Это объясняется тем, что ферментативные системы организмов специфически приспособлены к L-аминокис-лотам. Большинство аминокислот D-ряда имеет сладкий вкус, а природные L-формы — горькие или безвкусные. Для разделения аминокислот на оптические антиподы пользуются химическими, микробиологическими и ферментативными методами. [15]
Страницы: 1 2
www.ngpedia.ru
аминокислота — Большая Энциклопедия Нефти и Газа, статья, страница 2
D-аминокислота
Cтраница 2
Энергия сорбции D-аминокислот несколько превышает энергию сорбции их L-антиподов. Это позволяет полностью разделить энан-тиомеры большинства аминокислот на соответствующих хиральных адсорбентах. [16]
Хотя присутствие D-аминокислот в белках не доказано, наличие их в свободном состоянии и в виде пептидов в клетках различных микроорганизмов не вызывает сомнений. Как видно из данных, представленных в табл. 4, выражение природная конфигурация утратило свой смысл. [17]
О роли D-аминокислот в биологических объектах судить довольно трудно; наличие их в природе позволяет подвести по крайней мере телеологическое основание под существование D-аминокислотной оксидазы ( стр. Существуют и другие ферментные системы, осуществляющие обмен D-изомеров. Очевидно, что D-аминокислоты могут образоваться при действии аминокислотных рацемаз бактерий ( стр. Остатки D-аминокислот, входящие в состав некоторых антибиотиков, придают молекулам последних повышенную устойчивость, делая их менее доступными воздействию пептидаз. В связи с этим интересно отметить, что глутаминовая кислота, входящая в состав клеточных белков В. L-конфигурацию, тогда как глутаминовая кислота, выделенная из клеточных капсул, является D-изомером. Предположение о том, что биологическая активность некоторых антибиотиков обусловлена наличием в их молекуле остатков D-аминокислот, лишено фактического основания. [18]
В тканях высших животных D-аминокислоты не найдены; если они и присутствуют в этих тканях, то их концентрации, очевидно, невелики. Тем не менее животные способны усваивать D-изомеры некоторых аминокислот, и иногда в такой степени, что последние могут обеспечивать рост животных взамен соответствующих L-изомеров. Усвоение D-аминокислот зависит в основном от скорости их превращения в L-изомеры. Такая инверсия может осуществляться по крайней мере двумя путями: 1) окислительное превращение D-изомера в аналогичную а-кето-кислоту и последующее специфическое для L-конфигурации разминирование ( переаминирование, стр. По-видимому, наличие оксидазы D-аминокислот является необходимым, но не всегда достаточным условием использования D-аминокислот в организме животных. Как показывает табл. 15, D-фенилаланин и D-метионин усваиваются мышью, крысой и человеком. [19]
Как правило, D-аминокислоты не усваиваются животными организмами. Синтетически полученные аминокислоты являются, естественно, рацематами. Для разделения их на оптические антиподы пользуются химическими, микробиологическими и, главным образом, ферментативными методами. [20]
Как правило, D-аминокислоты не усваиваются животными организмами. Синтетически полученные аминокислоты являются, естественно, рацематами. Для разделения аминокислот на оптические антиподы пользуются химическими, микробиологическими и, главным образом, энзиматическими методами. [21]
Как правило, D-аминокислоты не усваиваются животными организмами. Синтетически полученные аминокислоты являются, естественно, рацематами. Для разделения их на оптические антиподы пользуются химическими, микробиологическими и главным образом ферментативными методами. [22]
Бактерии обычно используют D-аминокислоты более эффективно, чем высшие животные. Это и не удивительно, так как D-аминокислоты входят в состав клеток бактерий ( стр. Кроме того, бактерии значительно легче, чем высшие организмы, приспосабливаются к особым условиям питания. Некоторые бактерии могут использовать D-изомеры аминокислот непосредственно, другие обладают ферментными системами, катализирующими инверсию D-аминокислот путем рацемизации, окисления и реаминирования и, возможно, другими путями. Автор сообщает о 26 видах бактерий, использующих по крайней мере одну из 13 D-аминокислот. Наиболее часто используются D-изомеры валина, аланина, серина, глутаминовой кислоты. [23]
Играет ли оксидаза D-аминокислот физиологическую роль и какова ее функция, пока не известно. [24]
Исследование реакций переаминирования D-аминокислот еще недавно было затруднительным ввиду отсутствия достаточно чистых препаратов — D-изомеров аминокислот. В настоящее время трудно оценить результаты, так как в работах не приведены доказательства оптической чистоты использованных изомеров аминокислот. [25]
В природных объектах D-аминокислоты были найдены значительно позднее. К настоящему времени в материалах биологического происхождения обнаружен ряд D-аминокислот ( стр. Установлено, что некоторые из них могут подвергаться ферментативным превращениям; ведутся работы по выяснению происхождения D-аминокислот и путей их обмена. [26]
Глицин окисляется оксидазой D-аминокислот, содержащейся в печени и почках млекопитающих. [27]
Как отмечено выше, D-аминокислоты не встречаются в белках. Тем не менее они широко распространены в живой природе. [28]
Фермент, катализирующий окисление D-аминокислот, был отделен от ферментной системы, осуществляющей окисление L-амино-кислот. В ряде более поздних исследований присутствие в почках и печени оксидазы D-аминокислот было подтверждено. Окислительное дезаминирование L-аминокислот, о котором сообщал Кребс, объясняется, вероятно, сочетанным действием транс-аминаз и дегидрогеназы глутаминовой кислоты ( стр. Получен, однако, ряд препаратов оксидаз L-аминокислот, и в существовании подобных ферментов едва ли можно сомневаться. [29]
По мнению одних авторов, D-аминокислоты оказываются там просто потому, что бактерия старается избавиться от них, но высказывается и такая точка зрения, что они встраиваются в стенки бактерий для защиты ее от воздействия ферментов ( не ли-зоцимов, атакующих ( З — глюкозидную связь), которые оказывают наиболее эффективное воздействие на обычные L-аминокислоты. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Аминокислоты — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Кто впервые выделил[1] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ф. Бопп |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Кессель, С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Гопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены Незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 +
wiki-org.ru
