Применение щавелевой кислоты
Список ссылок всех БК
▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰
- Альтернативный Адрес № 1
- Альтернативный Адрес № 2
- Альтернативный Адрес № 3
- Альтернативный Адрес № 4
▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰
Привет, всем! Многие знают, что щавелевая кислота вызывает образование камней в почках. Но, что это за вещество и где содержится, и как применяется знают не многие. Поэтому, с познавательной точки зрения, эта статья на женском сайте об этом.
Немецкий химик Фридрих Велер в 1824 году впервые синтезировал щавелевую кислоту. Щавелевая кислота (научное название — этандиовая кислота), относится к группе органических кислот. В природе щавелевую кислоту можно встретить в свободном состоянии и в виде оксалатов кальция и калия.
Немного о химических и физических свойствах щавелевой кислоты.
Щавелевая кислота — кристаллическое, гигроскопичное, бесцветное вещество, без запаха. Она частично растворима в спирте (этаноле), воде. Образует дигидрат щавелевой кислоты.

Щавелевая кислота
Получение щавелевой кислоты:
- Окислением ацетилена азотной кислоты или этилена в присутствии PdCl2 или Pd(No3)2.
- Окислением спиртов, углеводов или гликолей смесью азотной и серной кислот в присутствии V2O5.
- Из гидроксида натрия и окиси углерода получают промежуточный формиат натрия. При его нагревании образуется оксалат натрия, который в подкисленном состоянии выделяет щавелевую кислоту.
Научу работать на финансовой бирже!
Я ВебМастерМаксим даю консультации по работе на Форекс! Выведу вас на большой доход! Научу самую тупую блондинку!!
Ознакомиться
Щавелевая кислота в организме человека.
Мы знаем, что физическое состояние человека во многом зависит от правильной работы мышц и нервов. Работа системы кровообращения, пищеварительного тракта, органов выделения основана на перистальтических движениях, которые волнообразны по своей природе и состоят из последовательных расслаблений и сокращений мышц и нервов.Эффективность этих процессов зависит от их физического состояния.
Щавелевая кислота является хорошим стимулятором работы мышц и нервов.
Следует помнить, что жизненные процессы в нашем организме будут активны и живы, если ткани и клетки органов молоды и здоровы. Если какие-либо части наших органов начинают дряхлеть, то и эффективность их работы начинает ухудшаться. Такое состояние связывают с отсутствием или недостатком живых атомов в пище, которые доставляются тканям и клеткам.
Что же такое — живая пища? Это пища, которая содержит живые органические энзимы и атомы, содержащиеся в сырых продуктах.
Рассмотрим этот вопрос на примере щавелевой кислоты. Щавелевая кислота в продуктах (в сырых соках и овощах) является органической, она изобилует энзимами, т. е. является не только полезной, но и жизненно необходимой для нормальной работы нашего организма.
А вот в термически обработанной пище она становится неорганической и у нее появляются вредные свойства, которые порой становятся просто разрушительными.
Щавелевая кислота легко взаимодействует с кальцием. Если оба вещества органические, то щавелевая кислота способствует усвоению кальция, а это стимулирует перистальтические функции организма.
Но если в процессе обработки пищи щавелевая кислота становится неорганической, то образуются соединения, в которых происходит разрушение кальция и образование солей щавелевой кислоты — оксалатов. Это, в свою очередь, вызывает разрушение костной ткани, образование камней, способствует возникновению таких заболеваний как артриты, артрозы, импотенция и др.
Поэтому следует помнить, что избыток щавелевой кислоты и образуемые ею соединения могут нанести вред организму.
Конечно, если пищеварительная система здорова, то оксалаты не нанесут особенного вреда, а вот если вы страдаете мочекаменной болезнью, подагрой, мочекислым диатезом, то следует уменьшить употребление продуктов, содержащих щавелевую кислоту.
| Продукты с высоким уровнем содержания щавелевой кислоты (Более 10 мг на ½ чашки) | |
| Щавель Шпинат Ревень Свекла Лук-порей Кабачок Сельдерей Шоколад/какао и напитки с его содержанием Овощи зеленого цвета Ботва свеклы Мангольд Петрушка Цикорий, салат эскариоль Баклажан (умеренно) Бочковое пиво Гречневая крупа Салат | Крыжовник Клубника Растворимый кофе (больше 8 унций в сутки) Чай (крепкий) Орехи, ореховое масло Шиповник Лимон, лайм, апельсин Инжир Помидоры Соевые продукты (тофу) Фасоль Пророщенная пшеница Пшеничные отруби Черемша Изделия из сдобного теста Перец красный сладкий |
Повышенное содержание щавелевой кислоты в продуктах может вызвать ряд других симптомов: расстройство желудка, слабость, затрудненное дыхание, тошноту, рези в животе.
Для людей, не страдающих вышеперечисленными болезнями, данные продукты( за исключений некоторых) не принесут вреда, а только пользу.
Применение щавелевой кислоты.
- В химической промышленности — при синтезе красителей, используется при производстве чернил, пластмасс.
- В химической металлургии — в виде специального состава при очистке металлов, котлов от накипи, ржавчины, оксидов.
- В кожевенной и текстильной промышленности — для дубления кожи, при окраске шелка и шерсти. В фотографии применяют как восстановитель.
- Используется как дезинфицирующее и отбеливающее средство в составе синтетических моющих средств.
- При очистке воды. С помощью щавелевой кислоты проводится снижение жесткости воды и ее химический способ очистки.
- В косметической промышленности — как добавка в отбеливающие крема.
- В сельском хозяйстве — как инсектицид. Очень любят щавелевую кислоту пчеловоды. С ее помощью любители пчел научились избавляться от варроатоза. Потребовалось много времени для разработки безвредного для семьи пчел и пчеловода способа подачи препарата в гнездо. Суть идеи очень проста. Мы знаем, что нагревая щавелевую кислоту до 180 градусов мы переводим ее в парообразное состояние. В парообразном состоянии ее пары представляют собой муравьиную кислоту, которая и воздействует на виновника заболевания. Но следует помнить, что муравьиная кислота очень летуча и обладает раздражающим действием на слизистые оболочки, которые не защищены. Поэтому нужно соблюдать технику безопасности — при обработке пользоваться противогазом.
- В настоящее время щавелевая кислота широко применяется в пищевой промышленности для производства пищевых добавок.
- Очень распространено применение щавелевой кислоты в быту. Если на вашем любимом шерстяном или хлопчатобумажном платье появились пятна ржавчины, целесообразно применить раствор щавелекислого калия, который можно получить путем растворения в одном литре воды 120 грамм щавелевой кислоты 60 грамм поташа. Поташ и кислоту нужно отдельно растворить в 0,5 литре воды, а затем осторожно смешать. Перед употреблением раствора его следует подогреть до 60-70 градусов, а после применения обработанное место хорошенько промыть водой. Раковины и унитазы, которые не покрыты эмалью отлично обрабатываются специальными моющими средствами, содержащими щавелевую кислоту. Эти моюще-чистящие средства помогут вам содержать квартиру или дом в чистоте.
Симптомы отравления щавелевой кислотой.
После внутреннего приема большого количества щавелевой кислоты возникает боль в ротовой полости, по ходу пищевода и в желудке. Появляются рвота, нитевидный пульс, нарушение координации движения. Позднее — признаки уремии и почечной недостаточности.
Первая помощь при отравлении кислотой.
Если щавелевая кислота принималась внутрь, ее необходимо нейтрализовать. Для этого больному нужно назначить соли кальция для внутреннего применения (мел, хлорид кальция, глюконат кальция, лактат кальция и др.). При ухудшении состояния направить больного в стационар.
Требования безопасности при транспортировке и хранении щавелевой кислоты.
Щавелевая кислота относится к группе веществ второго класса опасности, т. е. ее отрицательное воздействие на организм человека очевидно.
Соли щавелевой кислоты, а также сама щавелевая кислота обладают очень сильным раздражающим воздействием на верхние дыхательные пути, кожу, слизистую оболочку глаз.
Поэтому не забывайте при работе с кислотой применять средства индивидуальной защиты.
Упаковка щавелевой кислоты производится в специальные барабаны с пленочными мешками-вкладышами или в контейнеры для разового использования.
Транспортировка ее возможна любым видом транспорта. Хранение проводится в хорошо проветриваемом помещении.
загрузка…
Загрузка…Понравилась статья? Оставь свой отзыв, задай вопрос и про кнопки соц сетей не забудь!!!
Все разделы блога:
femininesite.ru
применение в быту | HELLO, BLOGGER самые интересные блоги Рунета
Всем привет!
Как вам моя история о врачах в предыдущей статье? Что думаете на этот счет?
А вообще меня жизнь почему-то часто сталкивает с вот таким недопониманием. Помню, когда переехала из Курчатова в Усть-Каменогорск, то пошла в Центр обслуживания населения (ЦОН) прописываться, там оператор начала заполнять на меня анкету и дошла до образования. На вопрос, кто я по диплому, я ответила «химик-аналитик».
У бедной девочки-оператора (на вид – лет 18, не больше) стали квадратные глаза и она чуть не шепотом переспросила: «А это значит учитель химии, да?». Мне после всех мытарств с квартирой и пропиской было уже все равно, поэтому я кивнула: «Да, пишите, учитель химии».
Плохо иметь малоизвестную профессию 🙂
И после этого небольшого отступления я возвращаюсь к интереснейшим химическим веществам, о которых недавно начала рассказывать – кислотам. Я уже рассказала о лимонной и ацетилсалициловой.
Сегодня речь пойдет том, что такое щавелевая кислота: применение в быту, свойства, меры предосторожности при работе с ней. Или вы думаете, что вам это не нужно, потому что вы с ней нигде не сталкиваетесь? Зря. Давайте посмотрим.
Что такое щавелевая кислота?
Это органическая кислота, которая в природе встречается в некоторых растениях. Больше всего ее в щавеле, шпинате и ревене. Именно она придает им кислый вкус. Как ни странно, много ее в шоколаде, свекле и крепком черном чае.

Соли щавелевой кислоты называются оксалатами. Думаю, это слово вы часто слышали, особенно те, у кого проблемы с отложением солей в суставах или с камнями в почках – это именно нерастворимые оксалаты кальция. Именно поэтому при лечении врачи рекомендуют снизить употребление продуктов, в которых много щавелевой кислоты.
Природные соединения щавелевой кислоты – это, чаще всего, оксалаты калия.
Интересно, но щавелевая кислота сыграла значительную роль в развитии органической химии как науки. Дело в том, что в начале 19-го века ученые четко разделяли все вещества на так называемые минеральные и органические. Причем, первые могли существовать только в живых организмах, а вторые – соответственно, в неживых предметах.
И вот в 1824 году немецкий химик Фридрих Вёлер разрушил эти представления тем, что получил органическое вещество (щавелевую кислоту) из неорганических веществ. Ну а после этого подобные открытия пошли одно за другим. В итоге, ученые пришли к тому, что пропасти между неорганическими и органическими веществами не существует, для всех них действуют одни и те же законы.
Вот такое интересное вещество – эта щавелевая кислота или «щавелька», как называют ее химики в лабораториях, часто используя ее для приготовления смесей для мытья химической посуды.
Применение
Что и говорить, оно огромно:
- для производства пищевых добавок,
- в косметологии — как отбеливающий компонент в кремах.
- для уменьшения жесткости воды и для ее очистки от примесей,
- как инсектицид, особенно она востребована у пчеловодов,
- для дубления кож, а также при окраске натуральных шелковых и шерстяных тканей,
- промышленный синтез красителей и пластмасс также не обходится без ее участия.
Ну а в быту основное ее применение — входит в состав моющих средств как отбеливающее и дезинфицирующее вещество.
Самое распространенное применение – очистка от ржавчины. Причем, это свойство щавелевой кислоты легко расправляться с ржавчиной действительно и для сантехники, и для металлических деталей, и даже для пятен ржавчины на одежде.
Когда-то один мой коллега повесил свой белый свитер сушиться на батарею и не обратил внимание, что на ней есть потеки ржавчины. В итоге на свитере остались ржавые пятна. Я тогда работала в лаборатории, мы дали ему немного щавелевой кислоты, с помощью которой он и спас свою одежду.
Сейчас чистую щавелевую кислоту найти и купить проблематично, по крайней мере, у нас, в Казахстане, но ее легко можно найти в составе самых разных порошков для чистки труб, моющих средств, а также «Антинакипина». Кстати, пока писала, мне подсказали, что ее можно найти в магазинах для пчеловодов и в ветеринарных магазинах.
Ну а как пользоваться? Легко. Чайную ложку растворяем с литре теплой воды – вот и готов раствор против ржавчины.
Только не забывайте про меры предосторожности! Это вещество относится ко второму классу опасности – раздражает верхние дыхательные пути, обладает ярко выраженным раздражающим действием для кожи и слизистых оболочек. Причем, это касается не только самой кислоты, но и ее солей. Кроме того, пыль ее пожароопасна.
Органическая и неорганическая щавелевая кислота
А теперь – то, что вызвало мое огромное недоумение, а потом – возмущение. Когда искала материал к это статье, то перерыла много справочной и специальной литературы как в бумажном, так и электроном виде, и также попыталась искать информацию в интернете. Я говорю «попыталась», потому что практически в каждой второй статье мне попадался такой ужас… Я даже не знаю, какими словами это описать. Судите сами, вот скриншот части статьи на одном из таких сайтов:
А как вам такое:
Как может органическая щавелевая кислота вдруг превратиться в неорганическую?! Ну что за бред-то! Вещество – всегда одно, если с ним происходят какие-то химические превращения, то оно превращается в другое вещество, которое будет называться по-другому, иметь другое строение и другие свойства.
Но такого, чтобы вещество вдруг претерпело какие-то химические превращения и осталось самим собой – не бывает такого! А органический кальций – это синоним белой сажи! Не бывает органического кальция.
Особенно порадовало «разрушение кальция», которое происходит при обработке пищи. А она, случайно, не в атомном реакторе обрабатывается? Ведь только ядерные реакции способны разрушить какой-либо химический элемент.
Короче, если вы видите подобный сайт – бегите от него со всех ног. Их авторы безграмотны и глупы. Безграмотны – потому что не знают элементарного школьного курса химии, а глупы – потому что переписывают друг у друга подобную чушь, даже не задумываясь над тем, что они пишут. И никакой викиум им уже не поможет.
Это как в статье про воду с «живой активной средой», про которую я уже писала.
Соответственно, очень большой вопрос – можно ли доверять советам с таких сайтов. Если хотите – попробуйте, рискните своим здоровьем. А я не буду.
Кстати, вот интересное видео, которое поразило меня не меньше этих сайтов:
Всем удачи и хорошей рабочей недели!
Наталья Брянцева
helloblogger.ru
Щавелевая кислота: применение в быту
Всем привет!
Как вам моя история о врачах в предыдущей статье? Что думаете на этот счет?
А вообще меня жизнь почему-то часто сталкивает с вот таким недопониманием. Помню, когда переехала из Курчатова в Усть-Каменогорск, то пошла в Центр обслуживания населения (ЦОН) прописываться, там оператор начала заполнять на меня анкету и дошла до образования. На вопрос, кто я по диплому, я ответила «химик-аналитик».
У бедной девочки-оператора (на вид – лет 18, не больше) стали квадратные глаза и она чуть не шепотом переспросила: «А это значит учитель химии, да?». Мне после всех мытарств с квартирой и пропиской было уже все равно, поэтому я кивнула: «Да, пишите, учитель химии».
Плохо иметь малоизвестную профессию Вот здесь я рассказывала эту историю подробно, а с ней — еще парочку примеров из жизни.
И после этого небольшого отступления я возвращаюсь к интереснейшим химическим веществам, о которых недавно начала рассказывать – кислотам. Я уже рассказала о лимонной и ацетилсалициловой.
Сегодня речь пойдет том, что такое щавелевая кислота: применение в быту, свойства, меры предосторожности при работе с ней. Или вы думаете, что вам это не нужно, потому что вы с ней нигде не сталкиваетесь? Зря. Давайте посмотрим.
Что такое щавелевая кислота?
Это органическая кислота, которая в природе встречается в некоторых растениях. Больше всего ее в щавеле, шпинате и ревене. Именно она придает им кислый вкус. Как ни странно, много ее в шоколаде, свекле и крепком черном чае.

Соли щавелевой кислоты называются оксалатами. Думаю, это слово вы часто слышали, особенно те, у кого проблемы с отложением солей в суставах или с камнями в почках – это именно нерастворимые оксалаты кальция. Именно поэтому при лечении врачи рекомендуют снизить употребление продуктов, в которых много щавелевой кислоты.
Рекомендуемое суточное потребление щавелевой кислоты – не более 50 мг.
Природные соединения щавелевой кислоты – это, чаще всего, оксалаты калия.
Интересно, но щавелевая кислота сыграла значительную роль в развитии органической химии как науки. Дело в том, что в начале 19-го века ученые четко разделяли все вещества на так называемые минеральные и органические. Причем, первые могли существовать только в живых организмах, а вторые – соответственно, в неживых предметах.
И вот в 1824 году немецкий химик Фридрих Вёлер разрушил эти представления тем, что получил органическое вещество (щавелевую кислоту) из неорганических веществ. Ну а после этого подобные открытия пошли одно за другим. В итоге, ученые пришли к тому, что пропасти между неорганическими и органическими веществами не существует, для всех них действуют одни и те же законы.
Вот такое интересное вещество – эта щавелевая кислота или «щавелька», как называют ее химики в лабораториях, часто используя ее для приготовления смесей для мытья химической посуды.
Применение
Что и говорить, оно огромно:
- для производства пищевых добавок,
- в косметологии — как отбеливающий компонент в кремах.
- для уменьшения жесткости воды и для ее очистки от примесей,
- как инсектицид, особенно она востребована у пчеловодов,
- для дубления кож, а также при окраске натуральных шелковых и шерстяных тканей,
- промышленный синтез красителей и пластмасс также не обходится без ее участия.
Ну а в быту основное ее применение — входит в состав моющих средств как отбеливающее и дезинфицирующее вещество.
Самое распространенное применение – очистка от ржавчины. Причем, это свойство щавелевой кислоты легко расправляться с ржавчиной действительно и для сантехники, и для металлических деталей, и даже для пятен ржавчины на одежде.
Когда-то один мой коллега повесил свой белый свитер сушиться на батарею и не обратил внимание, что на ней есть потеки ржавчины. В итоге на свитере остались ржавые пятна. Я тогда работала в лаборатории, мы дали ему немного щавелевой кислоты, с помощью которой он и спас свою одежду.
Сейчас чистую щавелевую кислоту найти и купить проблематично, по крайней мере, у нас, в Казахстане, но ее легко можно найти в составе самых разных порошков для чистки труб, моющих средств, а также «Антинакипина». Кстати, пока писала, мне подсказали, что ее можно найти в магазинах для пчеловодов и в ветеринарных магазинах.
Ну а как пользоваться? Легко. Чайную ложку растворяем с литре теплой воды – вот и готов раствор против ржавчины.
Только не забывайте про меры предосторожности! Это вещество относится ко второму классу опасности – раздражает верхние дыхательные пути, обладает ярко выраженным раздражающим действием для кожи и слизистых оболочек. Причем, это касается не только самой кислоты, но и ее солей. Кроме того, пыль ее пожароопасна.
Органическая и неорганическая щавелевая кислота
А теперь – то, что вызвало мое огромное недоумение, а потом – возмущение. Когда искала материал к это статье, то перерыла много справочной и специальной литературы как в бумажном, так и электроном виде, и также попыталась искать информацию в интернете. Я говорю «попыталась», потому что практически в каждой второй статье мне попадался такой ужас… Я даже не знаю, какими словами это описать. Судите сами, вот скриншот части статьи на одном из таких сайтов:
А как вам такое:
Как может органическая щавелевая кислота вдруг превратиться в неорганическую?! Ну что за бред-то! Вещество – всегда одно, если с ним происходят какие-то химические превращения, то оно превращается в другое вещество, которое будет называться по-другому, иметь другое строение и другие свойства.
Но такого, чтобы вещество вдруг претерпело какие-то химические превращения и осталось самим собой – не бывает такого! А органический кальций – это синоним белой сажи! Не бывает органического кальция.
Особенно порадовало «разрушение кальция», которое происходит при обработке пищи. А она, случайно, не в атомном реакторе обрабатывается? Ведь только ядерные реакции способны разрушить какой-либо химический элемент.
Короче, если вы видите подобный сайт – бегите от него со всех ног. Их авторы безграмотны и глупы. Безграмотны – потому что не знают элементарного школьного курса химии, а глупы – потому что переписывают друг у друга подобную чушь, даже не задумываясь над тем, что они пишут. И никакой викиум им уже не поможет. Кстати, кому интересно, вот подробная статья о нем.
Это как в статье про воду с «живой активной средой», про которую я уже писала.
Соответственно, очень большой вопрос – можно ли доверять советам с таких сайтов. Если хотите – попробуйте, рискните своим здоровьем. А я не буду.
Всем удачи и хорошей рабочей недели!
Наталья Брянцева
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+, В контакте, Одноклассники , Facebook, Twitter
kidschemistry.ru
что нам о ней известно? :: SYL.ru
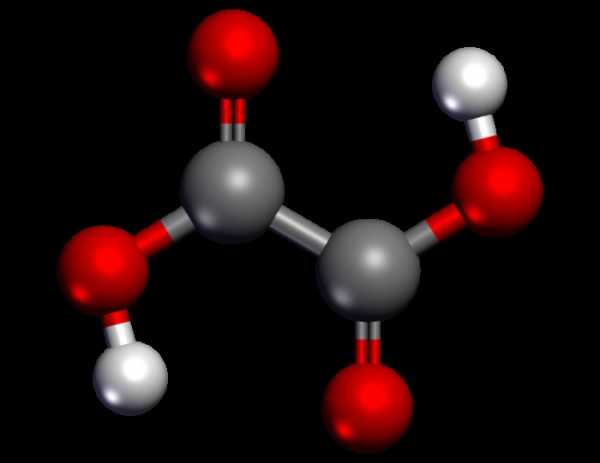
Щавелевая кислота представляет собой простейшую двухосновную карболовую кислоту. Она довольно часто встречается в природе, особенно велико ее содержание в растениях как в виде кристаллов солей, так и в свободном виде. В литературе нередко употребляют и другие синонимы этого вещества: этандиовая кислота и дигидрат. Впервые она была получена из диацина в 1824 году благодаря усилиям немецкого химика Фридриха Вёлера. Международное обозначение — OXALIC ACID dihydrate.
Что представляет собой щавелевая кислота?
Формула данного вещества имеет такой вид — H2C2O4. Ему присущи все химические свойства, которыми обладают карбонатные кислоты. К примеру, его можно растворить в спирте, эфире и воде. А вот в хлоформе и бензоле щавелевая кислота нерастворима. Данное вещество довольно активно. Поскольку кислота щавелевая относится к сильным органическим кислотам, в концентрированном виде и больших количествах она может стать причиной раздражения слизистых оболочек желудка, пищевода, дыхательных путей, кишечника и кожных покровов. Поэтому при работах с данным веществом требуется применять средства персональной защиты. Щавелевая кислота, синтезированная для технических целей, является довольно горючей и в осевшем состоянии при халатном обращении может спровоцировать пожар. По уровню воздействия на человеческий организм рассматриваемое вещество попадает в группу соединений 3-го класса опасности.

Кислота щавелевая: где она применяется?
В первую очередь отметим, что данный продукт бывает как органическим, так и неорганическим. Как раз первый тип в виде солей калия и распространен в природе в суккулентах, щавеле, шпинате, ревене и других растениях. Также эта кислота может образовываться на сахарных растворах определенного ряда заплесневелых грибов. В таком виде она не только приносит пользу, но и является необходимым элементом для нормальной работы всех физиологических функций человеческого организма. Щавелевая кислота быстро вступает в связь с кальцием, и если он также является органическим, такое соединение является одновременно и конструктивным, и полезным. Благодаря этому мы лучше усваиваем кальций, а перистальтика желудочно-кишечного тракта получает дополнительную стимуляцию.

А вот неорганическое состояние данного вещества, получаемое в результате обработки и варки продуктов, наоборот, приводит к связыванию кальция, что приводит к его недостатку в костной ткани. Кроме того, в таком виде щавелевая кислота нередко откладывается в почках в виде кристаллов. Второе применение данного вещества – это область косметики. Здесь щавелевую кислоту используют в качестве активной добавки в различных отбеливающих кремах. Также ее применяют в аналитической химии, органическом синтезе, в микроскопии в роли отбеливателя срезов, в химической металлургии, например, для очистки металлов от накипи и ржавчины и т. д. Осталось добавить, что получают данный продукт посредством окисления этиленгликоля смесью серной и азотной кислоты с использованием катализатора, в роли которого обычно служит пятиокись ванадия.
www.syl.ru
Что такое ЩАВЕЛЕВАЯ КИСЛОТА — Большая Медицинская Энциклопедия
ЩАВЕЛЕВАЯ КИСЛОТА, этан-дикислота, (С00Н)2-2Н2О. Щ. к. весьма распространена в природе. Она встречается как в свободном виде (в нек-рых грибах), так гл. обр. в виде солей. Калиевая соль Щ. к., кислая и средняя, находится в щавеле, ревене, белладонне и ряде других растений. Кальциевая соль Щ. к. чрезвычайно часто встречается в корнях, листьях и коре в виде кристаллов разнообразной формы: а) друз—сростков кристаллов, имеющих звездчатую форму, б) рафид—пучко-образно расположенных игол и в) в виде одиночных кристаллов. В животном организме Щ. к. встречается в качестве нормального продукта обмена веществ и происходит во-первых непосредственно из щавелево- и лимоннокислых солей пищи и во-вторых в результате неполного сгорания углеводов и др. составных частей пищи. Щ. к. находится в моче при оксалу-рш (см.), в мочевых осадках (см. Моча), в почечных и пузырных камнях, в слизи желчного пузыря и т. д. При пат. состояниях (диабет, желтуха) количество Щ. к., выделяемое с мочой, может доходить до 1,5 г в сутки. Получается Щ. к. в технике сплавлением опилок хвойной древесины со щелочами, причем образующиеся при этом щавелевокислые соли (ок-салаты) разлагаются кислотами. Щ. к. может быть также получена при действии Aspergillus niger или уксусных бактерий на углеводы. Щ. к. кристаллизуется в виде бесцветных моноклинических призм уд. веса 1,64, растворимых в 10 ч. воды и 2,5 ч. спирта с сильно кислой реакцией. При нагревании около 100° щавелевая кислота теряет воду, превращаясь в белый порошок, при более высокой температуре разлагается, давая, в зависимости от условий, углекислоту, воду, окись углерода и муравьиную кислоту: (COOH)j -> СО, + НСООН со+нго Водоотнимающие средства (ZnCl2, Р205, H2S04 и т. д.) действуют на Щ. к. аналогичным образом. Окислители переводят Щ. к. в угольную к-ту. Распознавание Щ. к. производится с помощью кальциевых солей, дающих осадок ща-велево-кальциевой соли, нерастворимой в воде и уксусной кислоте, легко растворимой в соляной и азотной к-тах. Щ. к. не находит врачебного применения, но представляет немалый токсикологический интерес. При приеме внутрь Щ. к. и ее растворимых солей наблюдаются явления отравления, весьма часто (до 50%) имеющие летальный исход (см. Отравление).— Патологоанатомические данные: слизистая желудка опухает и гиперемируется, пищевод также большей частью поражается. В 12-перст-ной кишке—струпья и экхимозы. Кровь жидкая, яркоалого цвета (в свежих трупах). В почках—инфаркты щавелево-кальциевой соли, канальцы забиты белыми кристаллами. При су-дебнохим. исследовании констатируют характерную форму кристаллов щавелево-кальциевой соли, а также извлекают измельченный и высушенный материал подкисленным НС1 кипящим спиртом, фильтрат выпаривают на водяной бане досуха, остаток растворяют в воде и проделывают описанные реакции. с. Шубин. Смотрите также:- ЩЕЛОЧИ, растворимые в воде основания (см.), вещества, дающие в водном растворе ион гидроксила. Ион гидроксила и обусловливает. способность Щ.: 1) реагировать с к-тами с выделением тепла и образованием солей (реакция …
- ЩЕРБАК Александр Ефимович (1863—1934), выдающийся невропатолог и физиотерапевт. Мед. образование получил в Военно-мед. академии, к-рую окончил в 1887 г. Еще студентом 4 курса написал научную работу, за к-рую получил золотую медаль …
- ЩЕТИННОЕ ПРОИЗВОДСТВО. Материалом для производства щеток и кистей служат гл. обр. щетина и конский волос, реже волос козий, барсучий и других животных. Щеточные фабрики получают волос и щетину в сыром, частью …
- ЩИТОВИДНАЯ ЖЕЛЕЗА (gl. thyreoidea, син. corpus thyreoideum), одна из важнейших желез внутренней секреции позвоночных животных. В эмбриональном развитии Щ. ж. возникает из эпителия нижней стенки жаберной части кишечника; у личинок круглоротых рыб …
- ЭБУЛЛИОСКОПЫ. Этим названием объединяются две группы приборов, имеющих различное назначение: 1) приборы, служащие для определения молекулярного веса растворимых тел путем определения повышения t° кипения растворителя вследствие введения в последний означенных …
bigmeden.ru
Щавелевая кислота
Предельная карбоновая двухосновная кислота с брутто-формулой C2h3O4 называется, по систематической номенклатуре, этандиовой кислотой. Это вещество также известно под другим, более распространенным названием — щавелевая кислота. Впервые она была получена немецким химиком Ф. Велером из дициана (динитрил щавелевой кислоты) в 1824 году. Бесцветные кристаллы кислоты растворяются в воде с образованием бесцветных растворов. Масса молярная составляет 90,04 г/моль. По внешнему виду напоминает моноклинные бесцветные кристаллы. При температуре 20 оС в 100 г воды растворяется 8 г щавелевой кислоты. Хорошо растворяется в ацетоне, этиловом спирте и серном эфире. Плотность 1,36 г/см³. Плавится при температуре 189,5 оС, возгоняется при 125 оС, разлагается при 100—130 оС.
Всеми химическими свойствами, характерными для карбоновых кислот, обладает щавелевая кислота. Формула ее: НООС—СООН. Несмотря на то, что относится к карбоновым кислотам, считается сильной органической кислотой (в 3000 раз сильнее, чем уксусная кислота): C2O4h3 → C2O4H- + H+ (рК = 1,27) и далее: C2O4H- → C2O42 — + H+ (рК = 4,27). Эфиры и соли этой кислоты называют оксалатами. Оксалат-ион C2O42− является восстановителем. При взаимодействии щавелевой кислоты с раствором перманганата калия (KMnO4) последний восстанавливается и раствор обесцвечивается. Для нее характерна обратимая и медленно протекающая реакция взаимодействия со спиртами (этерификация), в результате которой образуются сложные эфиры: HOOC—COOH + 2HOR ↔ 2h3O + ROOC—COOR.
В промышленности щавелевая кислота получается окислением химических соединений. Например, в присутствии ванадиевого катализатора (V2O5) смесью азотной (HNO3) и серной (h3SO4) кислот окисляют спирты, углеводы и гликоли. Также применяется способ окисления этилена и ацетилена азотной кислотой (HNO3) в присутствии палладиевых солей Pd(NO3)2 или PdCl2. Щавелевую кислоту получают из пропилена, который окисляют жидким диоксидом азота (NO2). Имеет хорошую перспективу способ получения кислоты взаимодействием гидроокиси натрия (NaOH) с угарным газом (CO) через промежуточную стадию образования формиата натрия: NaOH + CO → HCOONa. Затем образуется оксалат натрия и выделяется водород: HCOONa + NaOH → NaOOC—COONa + h3↑. Из оксалата натрия в кислой среде получается кислота щавелевая: NaOOC—COONa + 2H+ → НООС—СООН + 2Na+.
Основные области применения щавелевой кислоты — это очистка или отбеливание. Щавелевая кислота способна эффективно удалять ржавчину, поэтому многие чистящие средства содержат это химическое соединение. Около четверти производимой щавелевой кислоты используется как протрава для крашения в кожевенных и текстильных производствах. Применяется также в качестве реактива (ГОСТ 22180-76) в аналитической химии. Этандиоевая кислота дигидрат (НООС—СООН •h3O) по ТУ 2431-002-77057039-2006 с массовой долей основного вещества ≥ 99,3 % используется в производственных процессах органического синтеза, для очистки от ржавчины и накипи металлов, для отбеливания срезов в микроскопии. Пчеловоды применяют раствор щавелевой кислоты с массовой долей 3,2 % в сахарном сиропе для борьбы с паразитическим клещом. При завершении мраморных структур ею обрабатывают поверхности для уплотнения и придания им блеска.
Щавелевая кислота и оксалаты присутствует во многих растениях, в том числе в черном чае, встречаются в организме животных. Основной вред для человека связан с почечной недостаточностью, которая возникает из-за взаимодействия щавелевой кислоты с кальцием, в результате происходит осаждение твердого оксалата кальция (СаС2O4) — основной компонент камней в почках. Кислота провоцирует боли в суставах из-за осаждения в них подобных соединений. Щавелевая кислота может образовываться в организме в результате метаболизма этиленгликоля, поступающего из окружающей среды (например, антиобледенительное средство для обработки взлетно-посадочных полос и самолетов в аэропортах, а также из других антропогенных источников). Потенциальные проблемы с оксалатами в организме человека можно разделить на две. Первая — важный макроэлемент кальций связывается щавелевой кислотой и образуется его дефицит в клетках тканей и органов. Вторая — образование камней в почках. Самое большое количество щавелевой кислоты содержится в шпинате, листьях и стеблях ревеня, щавеле, свекле, петрушке, зеленом луке.
fb.ru
ЩАВЕЛЕВАЯ КИСЛОТА — Большая Медицинская Энциклопедия
ЩАВЕЛЕВАЯ КИСЛОТА (синоним этандиновая кислота) — дикарбоновая кислота, НО ОС—С О ОН, низший представитель гомологического ряда. У человека и животных щавелевая кислота образуется,как конечный продукт окислительного дезаминирования (см.) аминокислоты глицина (см.). Генетически обусловленное нарушение обмена глицина и его метаболита — глиоксиловой кислоты (см.), ведущее к накоплению в организме аномальных количеств щавелевая кислота, является причиной наследственной болезни оксалоза (см.), проявляющегося оксалурией (см.), симптомами интерстициального нефрита (см.), мочекаменной болезни (см. Почечнокаменная болезнь), нефрокалъциноза (см..) с последующим развитием почечной недостаточности и уремии (см.). Щавелевая и ее соли используются как антикоагулянты и химические реактивы в гематологической практике и клинико-диагностических лабораториях. Они применяются также в качестве отбеливающего средства в текстильной и бумажной промышленности, для очистки металлов от ржавчины и др. Некоторые соединения щавелевой кислоты ядовиты, например дициан [(CN)2, динитрил щавелевой кислоты] действует подобно синильной кислоте (см.), но в несколько раз слабее.
Молекулярный вес (масса) щавелевой кислоты 90, из воды она кристаллизуется в виде бесцветных кристаллов, г°пл 189,5°, температура возгонки 125°. Щавелевая кислота гигроскопична, растворима в воде, спирте, эфире. Она является сильной кислотой (см. Кислоты и основания) и активным восстановителем. Соли и эфиры щавелевой кислоты называются ок-салатами. Оксалаты щелочноземельных и тяжелых металлов практически нерастворимы, на этом их свойстве основан метод количественного определения щавелевой кислоты. Перманганат калия в кислом растворе легко окисляет щавелевую кислоту до диоксида углерода С02 и воды, что используется в титриметрическом анализе (см.).
Щавелевую кислоту получают быстрым нагреванием муравьинокислого натрия до температуры свыше 350°, а также омылением дициана и другими способами. Эта кислота образуется при сбраживании углеводов некоторыми низшими грибками (Aspergillus niger и др.) и бактериями.
Оксалаты содержатся во многих растениях, особенно высока их концентрация в щавеле, кислице, некоторых водорослях, папоротниках, лишайниках.
Образовавшаяся в организме человека или животного щавелевая кислота не подвергается дальнейшим превращениям и вместе со щавелевой кислотой пищи (экзогенной щавелевой кислотой) выделяется с мочой (см.) в виде оксалата кальция. Щавелевая кислота, содержащаяся в пище, частично всасывается в кишечнике, частично разрушается его микрофлорой (частично ею же синтезируется). Суточное выделение щавелевой кислоты с мочой здорового взрослого человека составляет 10— 20 мг, в моче ребенка первого года жизни содержание щавелевой кислоты (за исключением первого месяца жизни) несколько выше, чем у взрослых. Концентрация щавелевой кислоты в цельной крови взрослого человека в среднем составляет 2—4 мг/100 мл, в сыворотке крови — 0,2 мг/100 мл.
Одной из наиболее часто встречающихся форм мочевых камней (см.) являются щавелевокислые (оксалатные) камни, состоящие из гидро-оксалата кальция СаС204-Н20 и дигидрооксалата кальция СаС204-2Н20. При высокой концентрации щавелевой кислоты в моче оксалаты могут выпадать в осадок в виде свободных кристаллов — мочевого песка. Оксалаты кальция в небольшом количестве выделяются с желчью.
Библиогр.: Березов Т. Т. и Коровкин Б. Ф. Биологическая химия, с. 511, М., 1982; Каррер П. Курс органической химии, пер. с нем., JI., 1960.
Н. Ф. Толкачевская.
xn--90aw5c.xn--c1avg
