Словом «сода» называют несколько сложных химических веществ. Пищевая, питьевая, гидрокарбонат натрия, химическая формула NaHCO3, кислая натриевая соль угольной кислоты. Кальцинированная, бельевая, карбонат натрия, химическая формула Na2CO3, натриевая соль угольной кислоты.
Каустическая, гидроксид натрия, химическая формула NaOH. Есть еще некоторые технические виды соды – кристаллогидраты, содержащие карбонат натрия, и различные марки каустика. Вышеперечисленные соединения имеют различные свойства и химические формулы. Но все они хорошо растворяются в воде, а их растворы имеют более или менее выраженную щелочную реакцию. Рассмотрим их подробнее.
Формула пищевой соды
Гидрокарбонат натрия – химическое название белого кристаллического порошка белого цвета со средним размером кристаллов 0,05 — 0,20 мм. Синонимы, часто встречающиеся в научно-популярной литературе и в быту, — пищевая сода, чайная, питьевая, натрий двууглекислый, бикарбонат натрия.
Двууглекислый натрий (бикарбонат) – широко востребованное вещество в разных сферах жизни. Он применяется в химической промышленности и медицине, в легкой, пищевой отраслях, в металлургии. В пищевой промышленности сода включена в состав добавки E500.
Формула питьевой соды в химии NaHCO3 говорит о том, что это кислая натриевая соль угольной кислоты. Ее химические свойства как у соли сильного основания и слабой кислоты.

Гидрокарбонат натрия активно вступает в реакцию с кислотами. В результате образуется соль соответствующей кислоты, угольная кислота, которая в свою очередь распадается на углекислый газ и воду. Сильное образование пузырьков — это углекислый газ, высвобождающийся в процессе реакции.
Вот как происходит реакция с соляной кислотой:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑.
Реакция соды пищевой с уксусной кислотой:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
В результате взаимодействия соды NaHCO3 с уксусной кислотой Ch4COOH образуются: Ch4COONa – ацетат натрия, вода h3O и углекислый газ CO2.
Многими, наверное, замечено, что если залить пищевую соду кипятком, она так же начинает гаситься, что выражается в обильном образовании пузырьков. Это происходит реакция термического разложения.
Гидракарбонат натрия термически малоустойчив. При нагревании порошок соды пищевой разлагается с образованием карбоната натрия (соды кальцинированной) и выделением диоксида углерода, а также воды в газовую фазу.
2NaHCO3↔ Na2CO3 + CO2 + h3O
Аналогично разлагаются и водные растворы бикарбоната натрия.
Растворяется ли пищевая сода в воде?
Есть 2 важные момента в растворении натрия гидрокарбоната в воде. Если мы растворяем соду притемпературе до 50 °С, происходит реакция гидролиза соли. Это обратимое взаимодействие соли с водой. Приводит к образованию слабого электролита.
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет сильнощелочную реакцию. Отсюда вывод: растворимость гидрокарбоната натрия в воде невелика, но при повышении температуры и она повышается.

При взаимодействии с водой двууглекислый натрий распадается на гидроксид натрия NaOH , который придает щелочность воде, угольную кислоту h3CO3, которая, в свою очередь, сразу же распадается на воду и углекислый газ h3O + CO2.
Химическая формула растворения соды в воде:
NaHCO3 + h3O ↔ h3CO3 (h3O + CO2) + NaOH
Водный раствор соды пищевой на растительные и животные ткани практически не действует.
Кальцинированная сода и ее кристаллогидраты
Карбонат натрия, или соду кальцинированную, натриевая соль угольной кислоты, не следует путать с содой пищевой. Химическая формула соды кальцинированной Na2CO3. Еще ее называют содой бельевой, потому что применяют в изготовлении моющих и чистящих средств бытовой химии. Добывается из природных кристаллогидратов путем термического разложения. Кальцинированная сода, безводный карбонат натрия, представляет собой бесцветный порошок.

Различные кристаллогидраты кальцинированной соды имеют свои названия:
- Натрит, натрон – декагидрат карбоната натрия. Химическая формула: Na2CO3 • 10h3O
- Термонатрит – моногидрат карбоната натрия. Химическая формула: Na2CO3 • h3O
Эти кристаллогидраты еще называют кристаллической содой, технической содой.
Каустическая сода, гидроксид натрия, химическая формула: NaOH. Ее еще называют едким натром, каустиком, едкой щелочью. Сильное основание, молекулы полностью диссоциируют в воде. Даже на воздухе то вещество начинает активно впитывать воду и «расплывается».
Опасная едкая щелочь может оставлять на коже сильные ожоги. Поэтому при работе с каустической содой необходимо соблюдать технику безопасности.

Применяется в быту, в химической, целлюлозно-бумажной промышленности, для производства мыла и био-дизельного топлива.
В России производится несколько видов технической соды – натра едкого:
- РД — раствор диафрагменный, бесцветная или окрашенная жидкость с массовой долей NaOH 44,0 % — 46,0 %;
- РХ — раствор химический с массовой долей NaOH 45,5 %, допускается небольшой осадок;
- РР — раствор ртутный, прозрачная жидкость с массовой долей NaOH 42,0 %;
- ТД — твердый диафрагменный, плавленая масса белого цвета с массовой долей NaOH 94,0 %;
- ТР — твёрдый ртутный, чешуированная масса белого цвета, с массовой долей NaOH 98,5 %.
Как видите, сода соде рознь. Принимать внутрь можно только пищевую, остальные виды — технические. Особенно осторожно необходимо обращаться с каустической содой. Это едкое агрессивное вещество оставляет долго незаживающие ожоги на коже. Поэтому, работать с растворами каустика нужно в защитной одежде, маске и резиновых перчатках.
Карбонат натрия — Википедия
| Карбонат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Карбонат натрия |
| Традиционные названия | кальцинированная сода, углекислый натрий |
| Хим. формула | Na2CO3 |
| Физические свойства | |
| Молярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см³ |
| Термические свойства | |
| Т. плав. | 852 °C |
| Т. кип. | 1600 °C |
| Химические свойства | |
| pKa | 10,33 |
| Растворимость в воде при 20 °C | 21,8 г/100 мл |
| Классификация | |
| Рег. номер CAS | 497-19-8 |
| PubChem | 10340 |
| Рег. номер EINECS | 207-838-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500 |
| RTECS | VZ4050000 |
| ChEBI | 29377 |
| ChemSpider | 9916 |
| Безопасность | |
| ЛД50 | 4 г/кг (крысы, орально) |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
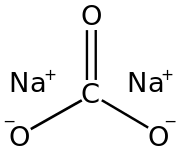
Карбона́т на́трия Na2CO3 (другие названия — кальцинированная сода) — химическое соединение, натриевая соль угольной кислоты.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый (устар.), бикарбонат натрия
Название «сода» происходит от растения солянка содоносная[en] (лат. Salsola soda),[источник не указан 252 дня]
из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать, то есть нагревать до высокой температуры. В конце 1860-х годов два бельгийца, братья Эрнест и Альфред Сольве, осуществили аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия.Оксиды и гидроксиды
| Вид | Для Na | Для С |
|---|---|---|
| Гидроксид | NaOH | H2CO3 |
| Оксид | Na2O | CO2 |
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- N a 2 S O 4 + 2 C → N a 2 S + 2 C O 2 {\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- N a 2 S + C a C O 3 → N a 2 C O 3 + C a S {\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 N a C l + H 2 S O 4 → N a 2 S O 4 + 2 H C l {\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- N H 3 + C O 2 + H 2 O + N a C l → N a H C O 3 + N H 4 C l {\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2 N a H C O 3 → o t N a 2 C O 3 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2 N H 4 C l + C a ( O H ) 2 → C a C l 2 + 2 N H 3 + 2 H 2 O {\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2426 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[1].
Свойства
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100-120 °C моногидрат теряет воду. Плавится при 852 °C, при дальнейшем нагревании разлагается (выше 1000 °C).
Безводный карбонат натрия представляет собой бесцветный порошок.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 852 °C (по другим источникам, 853 °C) | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- C O 3 2 − + H 2 O ⇄ H C O 3 − + O H − {\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5·10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- N a 2 C O 3 + H 2 S O 4 → N a 2 S O 4 + H 2 O + C O 2 ↑ {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[2].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью
Также используется для приготовления фотографических проявителей как ускоряющее средство[3].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1л масла.
Примечания
Литература
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
Пищевая сода, или, как её называют иначе, столовая, питьевая, чайная, знакома, пожалуй, всем: её используют для придания тесту пышности и рыхлости, для очищения посуды и кафеля, для уничтожения вредителей в саду и огороде, для устранения огрубевшей кожи со стоп и отбеливания зубов – перечислять можно долго, однако при всём этом мало кто задумывается о химических свойствах порошка или о том, какая формула у соды. И совершенно зря, поскольку знание природы вещества и сведений относительно его физических и химических качеств зачастую позволяет расширить кругозор относительно возможностей и сфер его использования.
К тому же, далеко не всем известно, что сода имеет несколько разновидностей, которые отличаются друг от друга не только по своим характеристикам, но и по степени безопасности для здоровья человека. Вот как раз об этом мы и поговорим.
Определение и формула соды
В понятие «сода» химики включают все натриевые соли угольной кислоты, и таковых, в зависимости от химического соединения, всего 3.
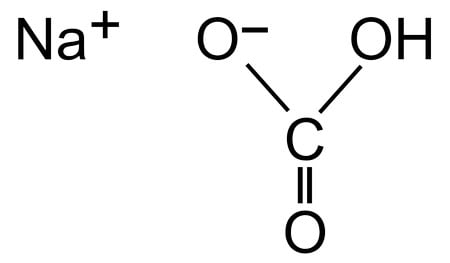
- Пищевая (чайная, питьевая, столовая) – наиболее распространённый вариант, с химической точки зрения именуемый как бикарбонат натрия, гидрокарбонат натрия, натрий двууглекислый или пищевая добавка Е500. Вещество представляет собой мелкокристаллический порошок, который характеризуется белым цветом, слабовыраженным запахом и наличием солёно-горького вкуса. В науке пищевая сода обозначается записью NaHCO₃
- Кальцинированная сода (техническая, стиральная) – вещество, получившее своё второе название по причине его использования в качестве средства для стирки белья и одежды. Карбонат натрия (так именуют его химики) внешне очень подобен пищевой соде, однако путать два этих вещества не стоит: кальцинированная сода является щёлочью сильного действия, которая при неправильном и неосторожном обращении может вызывать раздражения и ожоги слизистых и кожных покровов. Химическая формула карбоната натрия выглядит следующим образом: Na₂СО₃
- Каустическая сода (каустик) – известна как едкая щёлочь, едкий натр, имеет и другое название – гидрокссид натрия. Вещество обладает сильно выраженными щелочными характеристиками, имеет вид твёрдых гранул белого цвета, у которых отсутствует какой-либо запах. Несмотря на то, что едкий натр зарекомендовал себя как эффективное чистящее средство, использовать его следует осторожно: высокая концентрация гидроксида натрия разъедает соединения органического происхождения и вызывает ожоги кожи. В области химии каустическая сода обозначается формулой NaOH
Таким образом, принципиальная разница между тремя названными разновидностями заключается в степени щелочной реакции, которую они способны создавать, и, соответственно, в сферах деятельности человека, где они могут использоваться.
Пищевая сода
Пожалуй, в каждом доме есть картонная коробочка, дизайн которой не меняется вот уже много лет. В ней содержится белый мелкокристаллический порошок, практически не обладающий запахом, но отличающийся немного горьковатым вкусом, – речь идёт о пищевой соде, которая используется людьми в различных целях и становится настоящим помощником по удалению загрязнений, уничтожению вредителей, лечению различных заболеваний.
Первая сода, полученная искусственным путём, появилась лишь в XVIII веке, благодаря опытам французского учёного Анри Дюамеля де Монсо, который с этой целью использовал метод кристаллизации. Промышленным способом содовый порошок стали производить сначала в России: этому послужило открытие химика Э. Лаксмана, выяснившего, что при спекании древесного угля и смеси сульфата натрия можно получить натрий двууглекислый. Однако широкого распространения данная методика всё же не получила, и со временем, начиная с 1791 года, содовый порошок стали производить посредством сплавления древесного угля, смеси сульфата натрия и мела. Такая технология была открыта французским учёным Н. Лебманом. С 1838-1840-х г был предложен аммиачный метод, который отличался не только экономичностью, но и возможностью получать соду более высокого качества. С тех пор и до настоящего времени натрий двууглекислый получают именно этим способом.
Гидрокарбонат натрия характеризуется рядом определённых химических свойств: при нагревании до 60 С он начинает плавится, в результате чего распадается на карбонат натрия, углекислый газ и воду. Именно таким образом из натрия двууглекислого получают другую разновидность – кальцинированную соду. Вещество не растворяется в ацетоне и спирте, однако довольно хорошо растворяется в тёплой или горячей воде. При взаимодействии с ней образуется раствор, обладающий слабощелочной средой, в связи с чем соду, которая по своей сути является натриевой солью угольной кислоты, нередко называют щёлочью. рН воды, в которой растворяется бикарбонат натрия, равен 8-9, что и указывает на не агрессивность получаемого содержимого. Нередко такое вещество используют в качестве лечебного средства, при помощи которого понижают повышенную кислотность и борются с изжогой, грибковыми заболеваниями, неприятным запахом изо рта.
Химическая реакция также происходит в результате соединения натрия двууглекислого с кислотами и, в частности, с уксусом. При взаимодействии этих двух компонентов пищевая сода начинает выделять углекислый газ и воду, вследствие чего можно наблюдать специфическое «шипение». Именно такую реакцию мы получаем на кухне при замешивании теста: высвобождение углекислого газа в результате взаимодействия натрия двууглекислого и уксуса способствует «росту» пирога и приданию ему рыхлости и воздушности.
Интересное видео: Химическая реакция уксуса с содой красиво
Однако применяется содовый порошок не только в сфере кулинарии: зачастую он «спасает» тогда, когда под рукой не оказывается чистящих средств, но есть загрязнения, которые нужно срочно устранить. При помощи соды можно избавиться от многих пятен на поверхности стола или холодильника, вымыть посуду и кафель. За счёт безопасности для здоровья, пищевую соду можно применять в качестве очищающего средства для мытья именно детской посуды, ведь ни одна промышленная жидкость не может похвастаться таким важным критерием. Называть качества гидрокарбоната натрия, которые могут быть полезными для человека, можно довольно долго, но об этом мы поговорим несколько позже.
Кальцинированная, или бельевая, техническая сода
Ещё одна разновидность соды – карбонат натрия, или кристаллическая, бельевая, стиральная сода. Своё второе название она получила в соответствии с той сферой, в которой применяется: вещество отлично устраняет различные загрязнения, в виду чего его иногда используют вместо стирального порошка.
Формула кальцинированной соды выражается записью Na2CO3. Вещество выпускают в двух формах: в виде крупных кристаллов (тип А) и в виде порошка (тип В). В зависимости от критерия принадлежности к одной из марок, карбонат натрия применяется в различных областях.
Кальцинированная сода характеризуется белым цветом и отсутствием запаха, она хорошо растворяется в воде и довольно легко впитывает запахи и влагу, превращаясь при этом в твёрдое вещество. Карбонат натрия является сильной щёлочью (рН 11), поэтому обращаться с ним нужно крайне осторожно.
В промышленности кальцинированную соду получают несколькими методами:
- из нефелинового сырья;
- из соды, добываемой в природе;
- аммиачно-хлоридным способом;
- посредством карбонизации каустической соды.
Интересное видео: Технологии производства соды
Естественным путём соду добывают из золы морских водорослей, некоторых озёр, а также в подземных солях в виде минералов термонатрита, натрона, трона, нахколита. Странами, богатыми данным веществом, являются США, Россия, Канада, Мексика, ЮАР, Кения. Из пластиковых металлов соду получают посредством прокаливания, а из озёр – при помощи кристаллизации.
Самый распространённый метод получения соды – аммиачно-хлоридный. Данная технология изготовления позволяет производить вещество высокого качества, но при минимуме затрат. В условиях низких температур раствор хлористого натрия подвергается насыщению двуокисью углеводорода и аммиаком. Вследствие этого процесса выпадает осадок натрия двууглекислого, который проходит фильтрацию и дальнейшее кальцинирование. Именно так и получается кальцинированная сода.
Каустическая сода
Наиболее сильной щёлочью из всех разновидностей соды выступает едкий натр, или, иначе говоря, каустик, каустическая сода. В области химии данное вещество носит название гидроксид натрия и имеет формулу NaOH. При высоких концентрациях каустическая сода способна разъедать соединения органического происхождения, вызывать ожоги и сильные раздражения, она обладает и рядом других опасных свойств, в связи с чем её транспортируют исключительно в водонепроницаемых мешках.
Внешне гидроксид натрия представляет собой твёрдое вещество белого цвета, у которого отсутствует какой-либо запах. Каустик прекрасно растворяется в спиртовых растворах и воде, но не взаимодействует с эфирами и ацетоном. Кроме того, едкий натр вступает в реакцию с оловом, цинком, свинцом, алюминием, а с аммиаком – воспламеняется. Каустическая сода не горит, однако кипит и плавится при температуре, составляющей не менее 390 С. Вещество обладает способностью к нейтрализации загрязнений и жиров, в связи с чем оправдано его применение в качестве очищающего средства.
В промышленности гидроксид натрия производят, начиная с середины XVIII века. Вплоть до ХХ столетия при изготовлении едкого натра применялась аммиачная и известковая технология получения. Впоследствии был открыт электрохимический метод, который является приоритетным до сегодняшнего дня. Ведущие позиции по производству каустической соды сейчас занимают такие страны, как США, Китай, а также многие европейские государства.
Общие химические свойства соды
Все три разновидности соды относятся к классу натриевых солей угольной кислоты. Они обладают щелочными характеристиками при взаимодействии с водой, но уровень рН при этом отличается, в связи с чем только пищевая сода может применяться в домашней кулинарии и народной медицине, поскольку именно гидрокарбонат натрия имеет самый низкий водородный показатель. За счёт того, что любой вид соды можно по праву назвать щёлочью, использовать каждое из веществ допускается с целью устранения жира и загрязнений: гидрокарбонат натрия, а также кристаллическая и каустическая сода прекрасно справляются с данной задачей.
Сходство химических свойств заключается не только в принадлежности к солям, имеющим щелочные качества, но и в способности достаточно хорошо растворяться в воде. Кроме того, и пищевая, и кальцинированная сода не взаимодействуют со спиртовыми растворами, то есть не могут растворяться в них, чем одновременно отличаются от едкого натра.
От степени агрессивности веществ зависит место их применения: если гидрокарбонат натрия активно используется в быту, кулинарии и при лечении различных заболеваний, то сфера, в которой просто необходимо участие карбоната и гидроксида натрия, – это промышленность.
Контактировать с кальцинированной содой и особенно каустиком следует очень осторожно: оба вещества, за счёт высокого уровня рН, являются сильными раздражителями, которые могут спровоцировать ожоги слизистой и кожных покровов и даже вызвать интоксикацию организма.
Применение
Самым распространённым вариантом в домашнем обиходе является гидрокарбонат натрия. Чаще всего его используют в кондитерском деле, поскольку при взаимодействии пищевой соды и уксуса происходит выделение углекислого газа, придающего выпечке пышную и рыхлую структуру. К слову сказать, именно натрий двууглекислый выступает основным компонентом привычного всем разрыхлителя, который в кулинарии зачастую применяется вместо самой пищевой соды. Однако только этим важность компонента на кухне не ограничивается. Некоторые хозяйки идут на уловку и добавляют данное вещество в омлет, за счёт чего он получается не только вкусным, но и воздушным. Другие применяют содовый порошок для размягчения слишком жёсткого мяса или ускорения процесса приготовления гороха, фасоли. При помощи пищевой соды допускается промывание фруктов и овощей: это позволяет уничтожить нитраты, а заодно – продлить срок их хранения. Если добавить небольшое количество соды в кастрюлю, можно предотвратить прилипание круп к её дну или свёртывание молока в процессе его кипячения.
Видео — 20 НЕОБЫЧНЫХ ПРИМЕНЕНИЙ СОДЫ | ЛАЙФХАКИ С СОДОЙ
Ещё одно, несомненно, важное достоинство гидрокарбоната натрия – наличие у данного вещества целого спектра лечебных свойств: противогрибкового, антисептического, антибактериального, дезинфицирующего, смягчающего. Чаще всего пищевую соду используют для нейтрализации повышенной кислотности в организме и последующего восстановления водного баланса.
Натрий двууглекислый становится настоящим помощником при:
- боли в горле во время простудных заболеваний;
- изжоге;
- ожогах, раздражениях, вызванных укусами насекомых;
- молочнице, грибковых поражениях стоп;
- отбеливании зубной эмали;
- инфекционных заболеваниях полости рта;
- интоксикации, в том числе и алкогольной;
- обезвоживании организма;
- остеохондрозе, болях в суставах, подагре;
- аритмии и повышенном АД;
- морской болезни;
- фурункулах, натоптышах, мозолях;
- гипергидрозе;
- похудении;
- онкологических заболеваниях (согласно одной из теорий).
В быту актуальным становится абсолютно любой вид соды, однако контактировать с карбонатом или гидроксидом натрия следует очень осторожно, в связи с чем перед началом работы рекомендуется надевать резиновые перчатки. Средства достаточно эффективно справляются с различными загрязнениями, однако для удаления давнишних пятен рекомендуется использовать кальцинированную соду, которая также подойдёт для освежения деталей стиральной машины и уничтожения с них накипи.
При помощи пищевой соды можно до блеска вычистить раковину, столешницу, сантехнику, ковры, посуду, при этом необходимо помнить, что изделия из алюминия отмывать с применением даже неагрессивного гидрокарбоната натрия нельзя, так как они покрыты специальной оксидной плёнкой, предохраняющей металл от окисления и проникновения в пищу вредных компонентов. Однако пищевая сода станет находкой для очищения других деликатных поверхностей: линолеума, мрамора, кафеля. Её использование актуально в том случае, если нужно избавиться от неприятного запаха, например, в холодильнике. А вот для отбеливания белья и устранения пятен с одежды чаще всего применяют кальцинированную соду, поскольку именно карбонат натрия с подобной задачей справляется гораздо лучше.
В промышленности широкой популярностью пользуется каустическая сода. Она принимает участие в следующих отраслях:
- целлюлозно-бумажная: производство искусственных волокон, картона и бумаги;
- строительство: укрепление фундаментов, изготовление газобетона;
- текстиль: отбеливание тканей и регенерация резины;
- химическая промышленность: очищение нефтепродуктов, производство масляной продукции;
- военная отрасль: применение в противогазе с целью устранения углекислого газа из воздуха, нейтрализация опасных газов.
Также каустическая сода используется практически на каждом предприятии, поскольку выполняет роль средства, очищающего промышленное оборудование и инвентарь от жира и загрязнений. Вместе с тем, едкий натр нередко выступает компонентом, входящим в состав стиральных порошков, мыла, косметической продукции.
Техника безопасности
Гидрокарбонат натрия при взаимодействии с водой в небольших концентрациях является нетоксичным для здоровья человека веществом. Однако это совершенно не говорит о том, что содовый порошок безопасен. По степени пожаро — и взрывоопасности он относится к 3-му классу. Отдельно следует рассматривать ограничения присутствия натрия двууглекислого в воздухе: 5 мг на куб.метр. Хранить вещество необходимо в недоступном для детей и животных месте.
Работая с карбонатом натрия, в целях предотвращения ожогов кожных покровов, необходимо надевать резиновые перчатки, что же касается каустической соды, то для контактирования с ней одних перчаток, как правило, недостаточно: кроме них, применяется маска, халат, а также специальные очки.
Соду можно по праву назвать универсальным средством, которое имеет довольно широкую популярность, за счёт своего применения в различных сферах деятельности. Однако одновременно с этим не стоит умалять её способность оказывать негативное воздействие на организм человека, в связи с чем рекомендуется помнить о мерах предосторожности, а также чётко соблюдать правильные пропорции при выполнении лечебных и бытовых растворов.
Физико-химические показатели ГОСТ 5100-85
| Наименование показателя | Норма для марки и сорта | |||||
| Марка А | Марка Б | |||||
| Высший сорт | Первый сорт | Второй сорт | Высший сорт | Первый сорт | Второй сорт | |
| Внешний вид | Гранулы белого цвета | Порошок белого цвета | ||||
| Массовая доля углекислого натрия (Na2CO3), %, не менее | 99,4 | 99,0 | 98,5 | 99,4 | 99,0 | 99,0 |
| Массовая доля углекислого натрия (Na2CO3) в пересчете на непрокаленный продукт, %, не менее | 98,7 | 98,2 | 97,0 | 98,9 | 98,2 | 97,5 |
| Массовая доля потери при прокаливании при 270-300°С, %, не более | 0,7 | 0,8 | 1,5 | 0,5 | 0,8 | 1,5 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,5 | 0,8 | 0,4 | 0,5 | 0,8 |
| Массовая доля железа в пересчете на Fe2O3, %, не более | 0,003 | 0,005 | 0,008 | 0,003 | 0,003 | 0,008 |
| Массовая доля веществ, нерастворимых в воде %, не более | 0,04 | 0,04 | 0,08 | 0,03 | 0,04 | 0,08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,05 | — | 0,04 | 0,05 | — |
| Насыпная плотность, г/см³, не менее | 1,1 | 0,9 | 0,9 | — | — | — |
| Гранулометрический состав: — остаток на сите с сеткой № 2К по ГОСТ 6613-86, %, не более — прохождение через сито с сеткой № 1,25К по ГОСТ 6613-86, %, — остаток на сите с сеткой № 1К по ГОСТ 6613-86, %, не более — прохождение через сито с сеткой № 01К по ГОСТ 6613-86, %, не более |
— 100 3 7 |
5 — — 15 |
5 — — 25 |
— — — — |
— — — — |
— — — — |
| Магнитные включения размером более 0,25 мм | Отсутствуют | — | — | — | — | — |
Физико-химические показатели импортного продукта
| Наименование показателя | Норма по ГОСТ 5100-85, м.А, высший сорт | Спецификация импортного продукта |
| Внешний вид | Гранулы белого цвета | |
| Массовая доля углекислого натрия (Na2CO3), %, не менее | 99,4 | 99,7 |
| Массовая доля углекислого натрия (Na2CO3) в пересчете на непрокаленный продукт, %, не менее | 98,7 | Не регламентируется |
| Массовая доля потери при прокаливании при 270-300°С, %, не более | 0,7 | Не регламентируется |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0,2 | 0,066 |
| Массовая доля железа в пересчете на Fe2O3, %, не более | 0,003 | 0,0007 |
| Массовая доля веществ, нерастворимых в воде %, не более | 0,04 | 0,015 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0,04 | 0,058 |
| Насыпная плотность, г/см³, не менее | 1,1 | 1,1 |
| Гранулометрический состав: — прохождение через сито с сеткой № 1,25К по ГОСТ 6613-86, % — остаток на сите с сеткой № 1К по ГОСТ 6613-86, %, не более — прохождение через сито с сеткой № 01К по ГОСТ 6613-86, %, не более |
100 3 7 |
Соответствует |
| Магнитные включения размером более 0,25 мм | Отсутствуют | Не регламентируется |
Требования безопасности
| Класс опасности по степени воздействия на организм человека | 3 |
| Виды опасности | |
| Взрыво- и пожароопасность | Пожаро- и взрывобезопасен. |
| Опасность для человека | Вдыхание пыли может вызвать раздражение дыхательных путей, конъюнктивит. При длительной работе с растворами возможны экземы; концентрированный раствор при попадании в глаза может вызвать ожог, невроз, а в последующем – помутнение роговицы. |
| Средства индивидуальной защиты | Респиратор типа ШБ-1 «Лепесток», ватно-марлевая повязка, защитные очки, защитный костюм. |
Гарантийный срок хранения соды кальцинированной марки А – 3 мес., марки Б – 6 мес., упакованной в мягкие специализированные контейнеры – 5 лет с даты изготовления.
Сода кальцинированная марок А и Б используется в производстве стекла всех видов, в том числе: хрусталя, оптического и медицинского стекла, стеклоблоков, пеностекла, силиката натрия растворимого, керамических плиток, компонента фритт для глазурей; в черной и цветной металлургии: для производства свинца, цинка, вольфрама, стронция, хрома, для десульфуризации и дефосфации чугуна, в очистке отходящих газов, для нейтрализации сред.
Сода кальцинированная марки А используется для производства электровакуумного стекла.
Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта; целлюлозно-бумажной, анилино-красочной и лакокрасочной и нефтяной промышленностях.
Сода кальцинированная
Синонимы: карбонат натрия, безводный углекислый натрий, натрий углекислый
Product name: disodium carbonate monohydrate technical grade
Химическая формула: Na2CO3
CAS#: 5968-11-6
Код ОКП: 213110
ГОСТ: ГОСТ 5100-85
Внешний вид: Порошок или гранулы белого цвета.
Описание: Сода кальцинированная – гигроскопичный продукт, на воздухе поглощает влагу и углекислоту с образованием кислой соли NaHCO3.
Водные растворы соды кальцинированной имеют сильно щелочную реакцию. Выпускают соду кальцинированную марки А (гранулированная) и марки Б (порошкообразная).
Применение: Сода кальцинированная марок А и Б используется в производстве стекла всех видов, в том числе: хрусталя, оптического и медицинского стекла, стеклоблоков, пеностекла, силиката натрия растворимого, керамических плиток, компонента фритт для глазурей; черной и цветной металлургии: для производства свинца, цинка, вольфрама, стронция, хрома, для десульфуризации и дефосфации чугуна, в очистке отходящих газов, для нейтрализации сред.
Для производства электровакуумного стекла используется сода кальцинированная марки А высшего сорта со строго нормированным гранулометрическим составом.
Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта; целлюлозно-бумажной, анилино-красочной и лакокрасочной и нефтяной промышленностях.
Получение: Название «сода» происходит от растения Salsola Soda, из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
- Промышленный аммиачный способ (способ Сольве).
- Способ Хоу
Технические характеристики:
| Наименование показателя | Норма | ||
| Высший | Первый | Второй | |
| Внешний вид | Гранулы белого цвета без запаха | ||
| Массовая доля углекислого натрия, %, не менее | 99.4 | 99.0 | 98.5 |
| Массовая доля углекислого натрия в пересчете на непрокаленный продукт, %, не менее | 98.7 | 98.2 | 97.0 |
| Массовая доля потери при прокаливании при температуре 270-300 °С, %, не более | 0.7 | 0.8 | 1.5 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0.2 | 0.5 | 0.8 |
| Массовая доля железа в пересчете на Fe2O3, %, не более | 0.003 | 0.005 | 0.008 |
| Массовая доля не растворимых в воде веществ, %, не более | 0.04 | 0.04 | 0.08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0.04 | 0.05 | — |
| Насыпная плотность, г/см3, не менее | 1.1 | 0.9 | 0.9 |
| Гранулометрический состав: | |||
| остаток на сите с сеткой № 2К по ГОСТ 6613-86, %, не более | — | 5 | 5 |
| прохождение через сито с сеткой № 1, 25К по ГОСТ 6613-86, %, не более | 100 | — | — |
| остаток на сите с сеткой № 1К по ГОСТ 6613-86, %, не более | 3 | — | — |
| прохождение через сито с сеткой № 01К, 25К по ГОСТ 6613-86, %, не более | 7 | 15 | 25 |
Технические характеристики кальцинированной соды марки Б
| Наименование показателя | Норма | ||
| Высший | Первый | Второй | |
| Внешний вид | Гранулы белого цвета без запаха | ||
| Массовая доля углекислого натрия, %, не менее | 99.4 | 99.0 | 99 |
| Массовая доля углекислого натрия в пересчете на непрокаленный продукт, %, не менее | 98.9 | 98.2 | 97.5 |
| Массовая доля потери при прокаливании при температуре 270-300 °С, %, не более | 0.7 | 0.8 | 1.5 |
| Массовая доля хлоридов в пересчете на NaCl, %, не более | 0.2 | 0.5 | 0.8 |
| Массовая доля железа в пересчете на Fe2O3, %, не более | 0.003 | 0.005 | 0.008 |
| Массовая доля не растворимых в воде веществ, %, не более | 0.04 | 0.04 | 0.08 |
| Массовая доля сульфатов в пересчете на Na2SO4, %, не более | 0.04 | 0.05 | — |
| Насыпная плотность, г/см3, не менее | 1.1 | 0.9 | 0.9 |
| Гранулометрический состав: | |||
| остаток на сите с сеткой № 2К по ГОСТ 6613-86, %, не более | — | 5 | 5 |
| прохождение через сито с сеткой № 1, 25К по ГОСТ 6613-86, %, не более | 100 | — | — |
| остаток на сите с сеткой № 1К по ГОСТ 6613-86, %, не более | 3 | — | — |
| прохождение через сито с сеткой № 01К, 25К по ГОСТ 6613-86, %, не более | 7 | 15 | 25 |
Условия хранения: На открытых площадках под навесом и на закрытых площадках, исключая попадание влаги. При хранении на открытом воздухе слеживается. Продукт взрыво- и пожаробезопасен. Нетоксичен.
Гарантийный срок хранения: Гарантийный срок хранения технической кальцинированной соды марки А — 3 мес, марки Б — 6 мес.
Класс опасности: 3 класс.
Упаковка: Сода кальцинированная упаковывается в мешки по 43 кг.
Транспортировка. Всеми видами транспорта в соответствии с правилами перевозок в соответствии с правилами перевозок грузов, действующими на транспорте данного вида.
ПРИМЕНЕНИЕ
• Производство продуктов питания и напитков
• Основной ингредиент в разрыхлителях
• Готовый к употреблению торт и пастообразный компонент
• Ингредиент в замороженных дрожжевых продуктах
• средство для мытья фруктов
• Запах абсорбента
• Чистящее средство
Пищевая сода — это ингредиент корма для животных, предназначенный для производителей кормов и частных фермеров. Доступный в форме порошка и гранул (компактная сода).
ПРИМЕНЕНИЕ
• Регулятор кислотности; стабилизирует рН от 6,0 до 6,8
• Ингредиент в кормовых смесях и премиксах
• Улучшает эффективность кормления животных
Его кислотное нейтрализующее действие, потенциальное связывание с другими химическими веществами и чистящие свойства помогают фармацевтической соде найти широкое применение.
ПРИМЕНЕНИЕ
• Производство различных шипучих таблеток
• Ингредиент в лекарствах и пищевых добавках
• Производство зубной пасты
• Компонент избранных оздоровительных продуктов
Гидрокарбонат натрия, бикарбонат натрия доступен в нескольких фракциях зерна, от мелкозернистых до ультра крупнозернистых.
ПРИМЕНЕНИЕ
• Добавка в стиральные порошки
• Компонент в зарядах огнетушителя
• Производство бумаги
• Добыча нефти
• Кожевенная промышленность
• Средство для чистки фасадов зданий
Упаковка пищевой соды гидрокарбоната натрия: мешки по 25 кг, 50 кг, 650 кг, 1000 кг, 1300 кг., пачки по 500 гр для розничной продажи.
Формула соды в химии
Определение и формула соды
Содой называют несколько химических соединений:
Сода, кальцинированная сода, бельевая сода – карбонат натрия.
Химическая формула: Na2CO3, натриевая соль угольной кислоты.
Такую соду называли кальцинированной, потому что ее получали из кристаллогидратов путем прокаливания (кальцинации).
Натрит, натрон – декагидрат карбоната натрия. Формула:Na2CO3 • 10H2O
Термонатрит – моногидрат карбоната натрия. Формула: Na2CO3 • H2O
Общие химические свойства соды
Растворы всех вышеперечисленных вещества имеют щелочную реакцию среды, гидроксид натрия за счет диссоциации:
а карбонат и гидрокарбонат натрия – за счет гидролиза по аниону (угольная кислота – слабая кислота):
Реакции с кислотами:
Термическое разложение. При температуре 60–200°C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду:
При температуре выше 100–120°C отщепляется кристаллизационная вода от кристаллогидратов:
При температуре выше 1000°C разлагается карбонат натрия:
Пищевая сода широко применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Примеры решения задач
В этой статье представлена некоторая информация о различных аспектах пищевой соды, которая является популярным домашним ингредиентом, используемым для различных целей.
Пищевая содаимеет множество применений и в основном используется в кулинарных целях. Он химически известен как бикарбонат натрия, или, точнее, по названию IUPAC, он известен как гидрокарбонат натрия. Он представлен химической формулой NaHCO 3 .Итак, что такое пищевая сода? Ну, по сути, пищевая сода — это белая кристаллическая соль натрия, и она обычно появляется в виде порошка.
Химическая формула
Хотите написать для нас? Ну, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
Пищевая сода или разрыхлительимеет различные химические названия, такие как бикарбонат натрия (Na 2 CO 3 ), бикарбонат соды, гидрокарбонат натрия (NaHCO 3 ) и т. Д.Его также называют бикарб натрия или просто бикарб. Его основная химическая формула — NaHCO 3 , и он изготовлен промышленным способом Solvay .
В этом процессе используются такие химические вещества, как карбонат кальция (CaCO 3 ), хлорид натрия (NaCl), аммиак (NH 3 ), диоксид углерода (CO 2 ) и вода (H 2 O) , Они реагируют на разных этапах, чтобы выдать основной продукт. Реакция протекает в два этапа:
Стадия 1 : реакция водного раствора гидроксида натрия (NaOH) и диоксида углерода (CO 2 ) —
CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O
Стадия 2 : добавление большего количества диоксида углерода в вышеуказанную реакцию —
Na 2 CO 3 + CO 2 + H 2 O → 2NaHCO 3
Химическая реакция пищевой соды в воде
NaHCO 3 состоит из двух ионов, ионов натрия (катионов) Na + и бикарбонат-ионов (анионов) HCO 3 — .Ниже поясняется способ растворения бикарбоната натрия в воде путем разложения на два иона.
NaHCO 3 → Na + (aq) + HCO 3 — (aq)
Термическое разложение пищевой соды
Химическая формула для любого соединения дает нам общее представление о различных химических реакциях и свойствах этого соединения. Ясно, что если мы разлагаем соединение с помощью тепловой энергии, мы можем получить соединения, с помощью которых оно было приготовлено.Ниже представлена реакция этого процесса при 70 ° С.
Хотите написать для нас? Ну, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим …
Давайте работать вместе!
2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Как правило, можно вспомнить, что большинство гидроксидов в целом следуют приведенным выше реакциям разложения. При дальнейшем нагревании примерно при 100 ° С гидроксиды распадаются на соответствующие оксиды.
Na 2 CO 3 → Na 2 O (оксид натрия) + CO 2
Использует
Пищевая соданаходит широкое применение в промышленных и бытовых товарах. Бикарбонат натрия используется в качестве лекарства от расстройства желудка и кислых газов, смешивая в соответствующих количествах различные лекарства. В случаях почечной и мочевой кислоты бикарбонат натрия используется для лечения проблем, связанных с мочой. Раствор бикарбоната натрия считается внутривенным в случаях ацидоза.Бикарбонат натрия в надлежащих количествах добавляется вместе с соответствующей концентрацией раствора пероксида водорода и служит альтернативой зубным пастам.
Наиболее распространенное использование пищевой соды в наших домах для очистки и отбеливания. Бикарбонат натрия широко используется для выпечки. Он также используется в качестве химических разрыхлителей, которые помогают тесту расти после выпечки. Однако добавление слишком большого количества этого порошка в жидкое тесто приводит к горькому вкусу, и, следовательно, необходимо соблюдать осторожность в отношении соответствующего количества разрыхлителя, который необходимо использовать.
Приготовление легкой пасты из пищевой соды и воды, а затем нанесение их на область кожи, пораженную прыщами, помогает избавиться от прыщей в течение 2–3 дней. Все, что вам нужно сделать, это нанести пасту непрерывно и дать ей высохнуть в течение 10 — 20 минут. Различные химические и физические свойства пищевой соды можно выяснить, поняв ее формулу, в которой содержатся элементы и металлы с различными свойствами.
,Технический сорт Глюконат натрия Химическая формула
Описание продукта
Глюконат натрия представляет собой соединение с формулой C 6 H 11 NaO 7 , которое представляет собой натриевую соль глюконовой кислоты.
Это белый бесцветный порошок или кристалл, который очень хорошо растворяется в воде.
Глюконат натрия широко используется для крашения текстиля, печати и обработки поверхности металла.
Он также используется в качестве хелатирующего агента, средства для очистки стальной поверхности, чистящего средства для стеклянных бутылок,
и в качестве хелатирующего агента для цементной, гальванической и глиноземной промышленности.
| Фото | Артикул | Спецификация |
| Внешний вид: | Белый бесцветный порошок или кристалл | |
| Чистота: % | ||
| Хлорид: | ≤0.05% | |
| Соль мышьяка: | ≤3PPM | |
| Соль свинца (Pb): | ≤0,001% | |
| Хэви-метал: | ≤0,002% | ≤ 0,05% |
| Редузат: | ≤0,5% |
Упаковка и отгрузка
1. Глюконат натрия упаковывают в тканые тканые мешки с массой нетто 25 кг / мешок.
2.Объем загрузки составляет около 22 метрических тонн на 20FCL.
Информация о компании
Xinxiang Huaxing Chemical Co., Ltd была основана в 1983 году и была преобразована в комплексное и модернизированное химическое предприятие, которое объединяет научные исследования, промышленность и торговлю и имеет годовое производство 35000. тонны фосфорной кислоты и фосфата, органические мелкие химические технологические установки с фиксированными чистыми активами в 20 миллионов юаней, годовая стоимость производства 150 миллионов юаней и налоги более одного миллиона юаней.
Наша компания специализируется на производстве и эксплуатации химических продуктов из фосфора и органических чистых химикатов.
Наша компания владеет передовыми технологиями производства, сильными техническими силами, первоклассным производственным оборудованием и модернизированной системой контроля приборов и устройств обнаружения.
Кроме того, он оснащен расширенным режимом управления бизнесом и полными системами управления качеством и обеспечения качества. Была пройдена сертификация системы управления качеством ISO9001: 2000, а также квалификационная проверка автоматической регистрации права на экспортную торговлю были получены.
Наша продукция была продана во многие страны и регионы, такие как Америка, Япония, Западная Европа, Ближний Восток, Тайвань и Гонконг и т. Д.
Мы искренне надеемся, что друзья разных кругов дома и за рубежом могут работать с нами, чтобы искать взаимное развитие и создавать будущее!
FAQ
1. Вы производитель или торговая компания?
Мы являемся профессиональным производителем в Китае с более чем 30-летним опытом.
2. Какую продукцию вы производите?
Производятся фосфаты, такие как STPP, SHMP, STMP, SPP, TSP, DSP и PTPP и т.д.
3.Какой платеж вы принимаете?
В настоящее время T / T и L / C будут приемлемы для нас.
4.Принимаете ли вы OEM?
Да, мы принимаем OEM и приглашаем Вас к сотрудничеству с нами.
Любой интерес, пожалуйста, не стесняйтесь связаться со мной.
,химическая формула каустической соды Пищевой / Промышленный сорт
1. Наши преимущества
♦ профессиональный производитель каустической соды в Китае
♦ быстрая доставка : после оплаты
♦ Пакет со стандартным экспортом по требованию клиента
♦ Быстрый ответ по вашему предложению
♦ Контроль качества : Обеспечение качества продукции
2.Знаки едкого натра
♦ Название: Хлопья / жемчуг каустической соды / твердые 99% мин.
♦ Псевдоним: Гидроксид натрия, едкая щелочь
♦ Молекулярная формула: NaOH ♦000. :
♦ Чистота: 96%, 98%, 99%
♦ Упаковка: 25 кг мешки / 1000 кг джамбо мешки
3. Спецификация каустической соды
ЧИСТОТА | Na2CO3 | NaCl | Fe2O3 |
96% мин. | 1.4% макс. | 2,8% макс. | 0,01% макс. |
98% мин. | 1,1% макс. | 0,6% макс. | 0,01% макс. |
99% мин. | 0,5% макс. | 0,05 макс. | 0,005 макс. |
4. Применение каустической соды
♦ В , текстиль и бумага;
♦ В умягчении и очистке воды, переработке нефтепродуктов, в санитарии и средствах гигиены;
♦ В пищевой и фармацевтической промышленности и т. Д.
5. Упаковка едкого натра
Жемчужина из каустической соды: мешок 25 кг на миллион, 25MT / 20FCL
9902
9000 9000 9000
9000 9000 9000 9000 9000 9000 9000 9000 9000 9000
6. Сервис, который мы можем предоставить
♦ Служба смешанных контейнеров
♦ Служба контроля качества
♦ Служба упаковки
Информация о компании
7.Информация о компании
Zhengzhou Clean Chemical Co., LTD. Является ли коллекция производственных, научных исследований и
предприятий химической промышленности, занимающихся торговлей химическими веществами.
Получите предложение в течение 30 минут, увеличьте ваши преимущества благодаря нашей конкурентоспособной цене.
контакт
Химическая формула | Britannica
Химическая формула , любой из нескольких видов выражений состава или структуры химических соединений. Обычно встречающиеся формы — это эмпирические, молекулярные, структурные и проекционные формулы.
Британика Викторина
входов и выходов из химии
Какой электрический заряд имеет протон?
Эмпирическая формула состоит из символов, представляющих элементы в соединении, таких как Na для натрия и Cl для хлора, и индексов, указывающих относительное число атомов каждого составляющего элемента.(Однако нижний индекс не используется, если только число не превышает одного.) Таким образом, бензол представлен эмпирической формулой СН, которая указывает, что типичный образец соединения содержит один атом углерода (С) на один атом водород (Н). Вода представлена эмпирической формулой H 2 O, обозначающей, что вещество содержит два атома водорода (H 2 ) на каждый атом кислорода (O).
Общая формула — это тип эмпирической формулы, которая представляет состав любого члена целого класса соединений.Каждый член класса парафиновых углеводородов состоит, например, из водорода и углерода, причем число атомов водорода всегда составляет два или более чем вдвое больше атомов углерода. Учитывая, что n означает «любое число», общая формула этого класса, следовательно, C n H 2 n + 2 .
Эмпирические формулы обычно используются для представления веществ с неопределенными молекулярными структурами или веществ, не состоящих из нормальных молекулярных образований — e.г., хлористый натрий (поваренная соль), который состоит из ионов. Для выражения химического состава отдельных молекул вещества — молекулы, являющейся мельчайшей частицей, в которой вещество сохраняет свои химические свойства, — используется молекулярная формула. Например, в молекулярных формулах C 2 H 4 и C 3 H 6 соответственно для этилена и пропилена указано число и вид каждого атома, присутствующего в молекуле каждого вещества.Напротив, и этилен, и пропилен имеют одну и ту же эмпирическую формулу CH 2 , поскольку они состоят из атомов углерода и водорода в соотношении от 1 до 2. В некоторых случаях, таких как вода, эмпирические и молекулярные формулы вещество может быть идентичным.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняСтруктурные формулы определяют местоположение химических связей между атомами молекулы. Структурная формула состоит из символов для атомов, соединенных короткими линиями, которые представляют химические связи — одну, две или три линии, обозначающие одинарные, двойные или тройные связи, соответственно.Например, структурная формула этана имеет вид
, что означает, что соединение состоит из двух атомов углерода, каждый из которых связан с другим, и с тремя атомами водорода одинарными связями. Структурные формулы особенно полезны для того, чтобы показать, как различаются соединения с одинаковым видом и числом атомов.
Формула проекции — это двумерное представление того, что на самом деле является трехмерной молекулой. Такая формула напоминает структурный тип в том смысле, что она состоит из символов, представляющих атомы составляющих элементов, соединенных друг с другом штрихами или кривыми, обозначающими химические связи.Таким образом, молекула метана, характеризующаяся тетраэдрическим расположением четырех химических связей вокруг атома углерода, удобно представлена формулой проекции
Формулы проекции широко используются при изучении стереоизомеров — соединений, которые имеют одинаковый состав, но отличаются пространственным расположением атомов, составляющих их молекулы. Определенные условные обозначения для составления формул проекции были приняты для того, чтобы стереоизомеры можно было отличать друг от друга посредством соответствующих различий в их формулах.
