Свойства гидроксида натрия и применение вещества в промышленности и быту
Гидроксид натрия является неорганическим токсичным соединением, которое широко применяется при изготовлении различных продуктов ежедневного пользования, в промышленных и бытовых целях.
Основные свойства гидроксида натрия
Наименование неорганического соединения произошло из физических и химических свойств едкого натра, который оказывает сильно разъедающее действие при соприкосновении с различными поверхностями, включая кожу, бумагу, ткани и другие органические вещества. В технических сферах вещество также именуют каустической содой, применение которой распространяется на область быта, промышленность.
Физические свойства гидроксида натрия
По физическим свойствам едкий натр – твердый реагент белого цвета, который плавится при температуре выше 322 градусов. Характеризуется сильной гигроскопичностью. При взаимодействии с воздухом «расплывается» из-за активного поглощения паров воды. При взаимодействии с водой – растворяется, выделяя тепло из-за образования гидратов. Полученный раствор получается мылким.
При взаимодействии с водой – растворяется, выделяя тепло из-за образования гидратов. Полученный раствор получается мылким.
Химические свойства гидроксида натрия
При взаимодействии с воздухом образует гидраты различного состава, которые при нагревании начинают разлагаться. Вещество хорошо распадается при сочетании с растворами и проявляет свойства щелочей.
Легко вступает в реакции с некоторыми веществами, включая:
- Кислоты.
- Кислотные и амфотерные оксиды и гидроксиды.
- Галогены.
Под воздействием высокой температуры может вступать в реакцию с металлами, а при смешивании с солями – образовывать гидроксиды. В ходе реакции с монооксидом углерода образуется формиат натрия.
Меры безопасности (класс опасности)
Каустик входит в группу пожаробезопасных и не взрывоопасных веществ, но в то же время едким и коррозионно-активным реактивом. Из-за чего веществу был присвоен 2 класс опасности.
Хранение и перевозка
При транспортировке реагента используют II и III группы упаковок. Если же необходима совместная упаковка, используют марки MP15 (II группа упаковки), MP19 (III группа упаковки). Для перевозки используют транспорты 2 или 3 категории.
Для хранения используют герметичную тару, которую помещают в сухое складское помещение. Рядом с веществом нельзя хранить кислоты, включая органические, легкие металлы и их сплавы.
Применение гидроксида натрия
На производственные и бытовые цели распространяется использование:
- натра едкого чешуированного;
- натра едкого гранулированного;
- диафрагменного твердого;
- ртутного, химического или диафрагменного раствора.

Применение едкого натра распространяется на множество областей:
- Получение бумаги.
- Каустик участвует в получении бумаги и картона, искусственного волокна и древесно-волоконных плит. Также применение распространяется на делигнификацию целлюлозы.
- Изготовление бытовой химии.
- В данной области применения каустическая сода необходима, чтобы провести омыление жиров, которые используются в мыльной продукции, шампунях и других моющих растворах.
- Отрасль химического производства.
- В химии каустик используется с целью нейтрализации действия кислоты или оксидов. Используется в качестве катализатора при проведении химических опытов, анализе для титрования, получении чистых металлов или травлении алюминия. В переработке нефти необходим для получения масел.
- Получение биодизельного топлива.
-
В этой области каустик выступает в роли щелочного катализатора, который добавляется к смеси органических масел и спирта.

- Для прочистки инженерных коммуникаций.
- При устранении трубных застоев едкий натр выступает растворителем. Агент расщепляет скопление мусора и обеспечивает его дальнейшее движение по коммуникации.
- В военной сфере.
- В данной области едкий натр используется, чтобы дегазировать и нейтрализовать действие отравляющих веществ. Реагент применяется при сборке изолирующих приборов для дыхания, где едкий натр выступает в роли очистителя воздуха от примесей углекислого газа.
- В текстильном производстве.
- В текстильном деле каустик используется для мерсеризации хлопкового и шерстяного сырья. При непродолжительном воздействии едким веществом, растительное волокно становится более прочным, блестящим и шелковистым.
- В поварском деле.
-
Использование каустика в приготовлении блюд позволяет быстро очистить овощи и фрукты от кожуры. Также применяется для получения некоторых видов сладостей, напитков и шоколада.

- В косметологических процедурах.
- При помощи каустика удается избавиться от папиллом, бородавок и огрубевших частиц кожи.
- В проявлении фотоснимков.
При проявке фотографий едкий натр ускоряет процесс, что позволяет в разы сократить время на обработку фотоматериалов.
Чтобы купить гидроксид натрия, свяжитесь с нами по телефону или заполните форму на сайте.
Гидроксид натрия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
С чем реагирует гидроксид натрия?
Гидроксид натрия (NaOH) представляет собой сильно основное органическое соединение, которое также очень гигроскопично. Также известная как каустическая сода или щелочь, она вступает в реакцию с рядом соединений, приводя к очень разным результатам.
В этом посте:
Растворение в водеГидроксид натрия ионизируется при растворении в воде. Хотя это не обязательно может быть химической реакцией, это важная характеристика того, как это основное соединение ведет себя в водном растворе.
В воде гидроксид натрия способен полностью диссоциировать, распадаясь на ионы натрия (Na+) и гидроксид-ионы (OH-). При таком растворении раствор приобретает очень сильную щелочную среду, представленную высоким pH.
Водный раствор также будет очень скользким на ощупь, но важно избегать контакта с кожей, так как гидроксид натрия наиболее агрессивен при растворении в воде.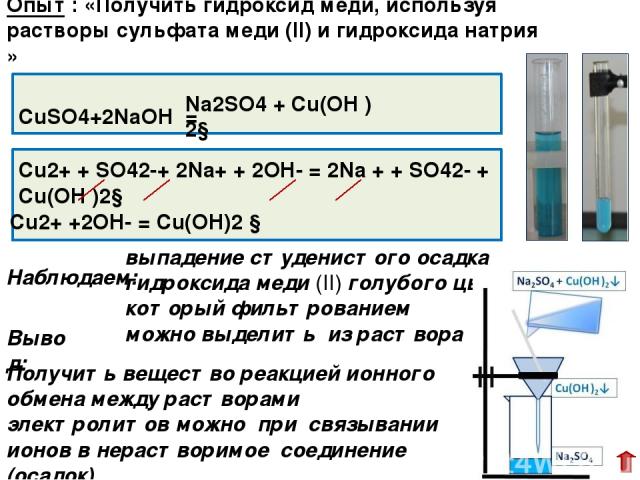 Это происходит из-за избытка ионов ОН-, которые делают раствор чрезвычайно щелочным и едким.
Это происходит из-за избытка ионов ОН-, которые делают раствор чрезвычайно щелочным и едким.
Гидроксид натрия подвергается реакции нейтрализации при соединении с кислотой. Это делает его хорошо подходящим в качестве регулятора pH во многих отраслях промышленности, например, при очистке воды, благодаря его способности нейтрализовать или контролировать кислотность.
NaOH реагирует с кислотой с образованием воды и ионного соединения. Например, когда гидроксид натрия реагирует с соляной кислотой (HCl), ион гидроксида из NaOH реагирует с ионом водорода в HCl с образованием воды (H 2 О).
Затем оставшаяся часть кислоты соединяется с оставшимися ионами натрия с образованием ионного соединения хлорида натрия (NaCl). Реакцию нейтрализации, которая здесь происходит, можно затем проверить с помощью фенолфталеина, обычного индикатора, используемого при кислотно-щелочном титровании. Реакция между гидроксидом натрия и соляной кислотой может быть представлена следующим уравнением:
NaOH + HCl → NaCl + H 2 O
Аналогичным образом серная кислота (H 2 SO 4 ) нейтрализуют гидроксидом натрия.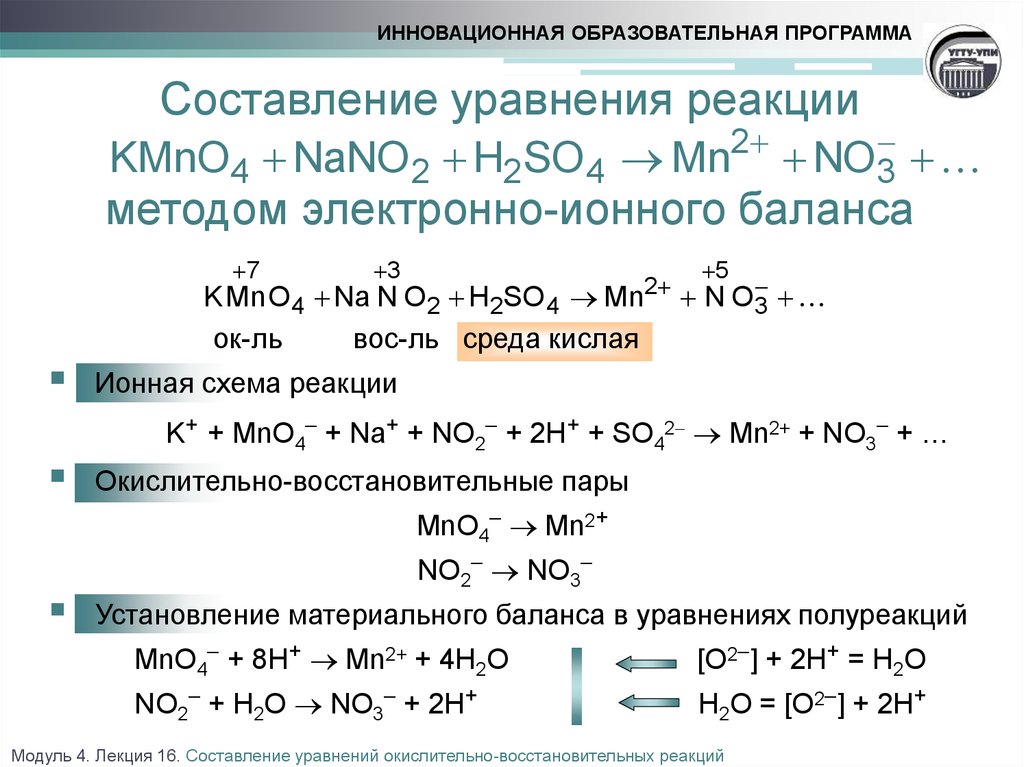 Как и прежде, эта реакция нейтрализации дает воду и ионное соединение, на этот раз сульфат натрия (Na 2 SO 4 ).
Как и прежде, эта реакция нейтрализации дает воду и ионное соединение, на этот раз сульфат натрия (Na 2 SO 4 ).
Когда гидроксид натрия реагирует с некоторыми растворенными металлами, он образует твердое вещество. Эта реакция обычно используется для удаления растворенных металлов из раствора, особенно если они токсичны.
Когда реакция включает превращение растворимых ионов в нерастворимое твердое вещество, она известна как реакция осаждения. Гидроксид натрия можно использовать для облегчения этой реакции во многих переходных металлах, таких как сульфат меди (CuSO 4 ).
Переходные металлы хорошо растворяются в воде и при растворении образуют окрашенные растворы. Сульфат меди, например, окрашивает раствор в характерный голубой цвет. Цинк же дает белый цвет.
Если гидроксид натрия ввести в водный раствор, содержащий растворимый переходный металл, переходный металл вытесняется из его соединения. Этот процесс называется реакцией замещения, и происходит он потому, что натрий — гораздо более активный металл.
Этот процесс называется реакцией замещения, и происходит он потому, что натрий — гораздо более активный металл.
После вытеснения переходного металла образуется нерастворимый гидроксид переходного металла. В случае сульфата меди гидроксид натрия вытесняет медь, и образуется гидроксид меди (Cu(OH) 2 ). Вместо растворения это соединение выпадает в осадок и появляется в жидкости в виде светло-голубого твердого вещества. В этот момент раствор становится бесцветным, а на дне остается твердый гидроксид меди.
Эту реакцию можно использовать для определения того, какой ион переходного металла присутствует в растворе по цвету конечного осадка. Светло-голубое твердое вещество указывает на присутствие Cu 2+ ионов. Зеленое твердое вещество указывает на присутствие ионов Fe 2+ , тогда как красное/коричневое твердое вещество указывает на наличие ионов Fe 3+ . Со всеми этими соединениями можно использовать гидроксид натрия, чтобы вызвать осаждение.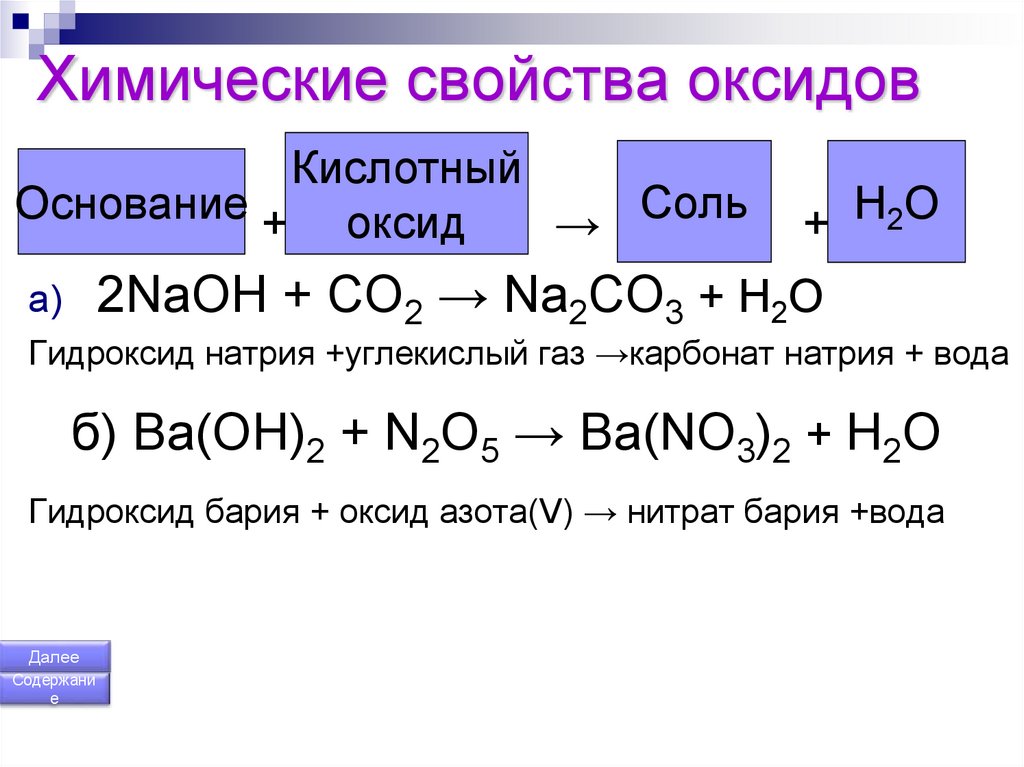
Гидроксид натрия реагирует с порошком алюминия (Al) с образованием алюмината натрия и водорода (H). Это был распространенный метод, используемый для наполнения дирижаблей и воздушных шаров из-за быстрого выделения газообразного водорода, который он производит. Он также был предложен в качестве источника топлива для автомобилей с водородным двигателем.
Реакцию можно провести в лаборатории путем смешивания порошка алюминия с концентрированным раствором NaOH в колбе. Затем образовавшийся газ можно уловить, плотно поместив баллон над колбой. Общее уравнение этой реакции:
2Al (т) +6 NaOH (водн.) → 2Na 3 AlO 3 (водн.) + 3H 2 (г)
важно соблюдать необходимые меры предосторожности. Реакция между алюминием и гидроксидом натрия чрезвычайно быстрая, экзотермическая и едкая. Газообразный водород также взрывоопасен, поэтому следует соблюдать крайнюю осторожность.
Побочный продукт этой реакции, алюминат натрия, сам по себе является важным соединением и обычно используется в качестве источника гидроксида алюминия. Он также используется в водоподготовке, строительной технике и бумажной промышленности.
С чем еще реагирует гидроксид натрия?Реакции с участием гидроксида натрия на этом не заканчиваются. Некоторые другие примеры того, с чем реагирует гидроксид натрия, включают, но не ограничиваются:
- Необратимая реакция омыления с жирами, которая используется в производстве мыла, шампуней и других косметических продуктов
- Взаимодействие с многоатомными спиртами с образованием алкоголятов, белых кристаллических веществ, хорошо растворимых в воде
- Реакция диспропорционирования с неметаллами, такими как сера или хлор, при которой одно вещество окисляется и восстанавливается
ReAgent поставляет гидроксид натрия в мешках по 1 кг и 25 кг, а также в различных концентрациях. На все наши продукты распространяется 100% гарантия качества, поэтому вы можете с уверенностью покупать NaOH. Закажите онлайн сегодня или свяжитесь с нашей дружной командой для получения дополнительной информации.
На все наши продукты распространяется 100% гарантия качества, поэтому вы можете с уверенностью покупать NaOH. Закажите онлайн сегодня или свяжитесь с нашей дружной командой для получения дополнительной информации.
Отказ от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Эффект концентрации NaOH с помощью h3O
••• Изображение тестового набора Cinneman с сайта Fotolia.com
Обновлено 24 апреля 2017 г. класс соединений, называемых основаниями. Также известный как щелочь, он находит широкое применение в химических лабораториях, химической промышленности и строительстве, среди прочего. При увеличении концентрации гидроксида натрия в воде могут возникать следующие четыре эффекта.
Гидроксид-ионы
Когда NaOH растворяется в воде, он диссоциирует на два иона: положительно заряженный ион натрия и отрицательно заряженный гидроксид-ион (ОН-). Увеличение количества гидроксид-ионов в растворе увеличивает концентрацию гидроксид-ионов в воде.
pH
Вода может подвергаться реакции, называемой аутопротолизом, при которой одна молекула воды отдает протон (ион водорода) другой молекуле, что приводит к образованию иона гидроксида (OH-) и иона гидроксония (h4O+). Эта реакция также может быть обращена вспять, поскольку ионы гидроксида принимают атом водорода от ионов гидроксония с образованием молекулы воды. В чистой воде эта двусторонняя реакция находится в равновесии, поэтому концентрации гидроксида и ионов гидроксония в воде равны. Отрицательный логарифм концентрации ионов водорода называется pH; чистая вода имеет рН 7. Ионы гидроксида из растворенного гидроксида натрия нарушают этот баланс; поскольку дополнительные гидроксиды принимают протоны от ионов гидроксония, они снижают концентрацию ионов водорода, тем самым увеличивая рН. Добавление большего количества гидроксида натрия повысит pH воды или сделает ее более щелочной.
В чистой воде эта двусторонняя реакция находится в равновесии, поэтому концентрации гидроксида и ионов гидроксония в воде равны. Отрицательный логарифм концентрации ионов водорода называется pH; чистая вода имеет рН 7. Ионы гидроксида из растворенного гидроксида натрия нарушают этот баланс; поскольку дополнительные гидроксиды принимают протоны от ионов гидроксония, они снижают концентрацию ионов водорода, тем самым увеличивая рН. Добавление большего количества гидроксида натрия повысит pH воды или сделает ее более щелочной.
Нейтрализация
Основание, такое как гидроксид натрия, может реагировать с кислотой, чтобы нейтрализовать ее. В этом типе реакции ион гидроксида примет протон от кислоты с образованием молекулы воды (h3O). Добавление гидроксида натрия к раствору кислоты может нейтрализовать часть кислоты в воде.
Буферизация
Буфер представляет собой раствор, рН которого мало изменяется при добавлении кислоты или основания.



