Научно-исследовательская работа Влияние различных условий на жизнедеятельность дрожжей
Научно-исследовательская работа
«Биология»
«ИССЛЕДОВАНИЕ ВЛИЯНИЯ РАЗЛИЧНЫХ УСЛОВИЙ НА ЖИЗНЕДЕЯТЕЛЬНОСТЬ ХЛЕБОПЕКАРНЫХ ДРОЖЖЕЙ»
Выполнила Дмитриева Назира Владимировна
Содержание
Введение………………………………………………………………………..3
1. История дрожжей………………………………………………………….4
2. Экспериментальная часть…………………………………………………6
2.1 Объект исследования………………………………………………….6
2.2 Ход работы…………………………………………………………….6
2.3 Выводы…………………………………………………………………14
Заключение……………………………………………………………………. 15
15
Список использованной литературы и электронных ресурсов……………16
Введение
Дрожжи имеют большое практическое значение. Некоторые виды дрожжей с давних пор используются человеком при приготовлении хлеба, пива, вина, кваса и др. Полезные физиологические свойства дрожжей позволяют использовать их в биотехнологии и производстве лекарств. В настоящее время их применяют в производстве ксилита (заменитель сахара), ферментов, пищевых добавок, для очистки от нефтяных загрязнений.
Также дрожжи широко используются в науке в качестве модельных организмов для генетических исследований и в молекулярной биологии. Пекарские дрожжи были одними из первых организмов, у которых была полностью определена последовательность геномной ДНК.
Целью моей работы было изучение влияния различных факторов на хлебопекарные
дрожжи и качество получаемого с их помощью хлеба.
1. История дрожжей
Русское слово «дрожжи» имеет общий корень со словами «дрожь», «дрожать», которые применялись при описании вспенивания жидкости, в результате брожения, осуществляемого дрожжами. Английское слово означает «пена, кипеть, выделять газ».
Дрожжи
— одни из наиболее древних «домашних организмов». Тысячи лет люди использовали
их для ферментации и выпечки. Археологи нашли среди руин древнеегипетских городов жернова и пекарни, а также
изображение пекарей и пивоваров. Предполагается, что пиво египтяне начали варить
за 6000 лет до н. э., а к 1200 году до
н.э. овладели технологией выпечки дрожжевого хлеба вместе с выпечкой
пресного. Для начала сбраживания нового теста люди использовали остатки
старого. В результате в различных хозяйствах столетиями происходила селекция дрожжей, и
сформировались новые расы, не встречающиеся в природе.
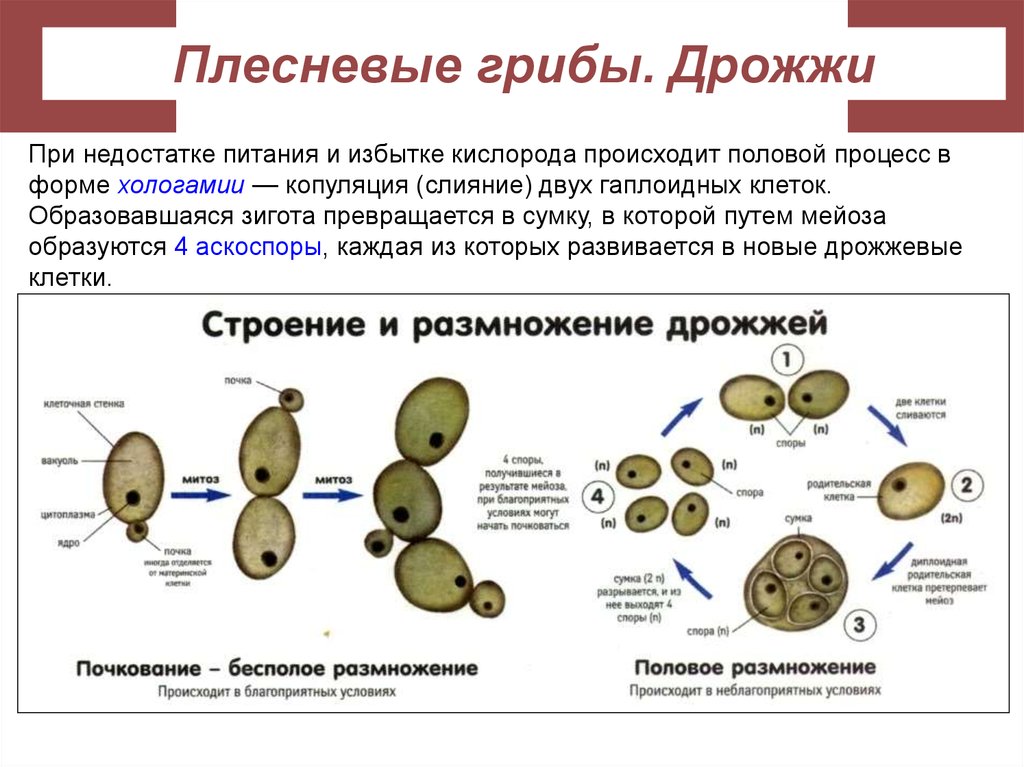
В 1680 году голландский ученый Антони Ван Левенгук впервые увидел дрожжи в оптический микроскоп. В 1857 году французский микробиолог Луи Пастер в работе доказал, что спиртовое брожение — не просто химическая реакция, как считалось ранее, а биологический процесс, производимый дрожжами.
Луи Пастер — учёный, установивший роль дрожжей в спиртовом брожении.
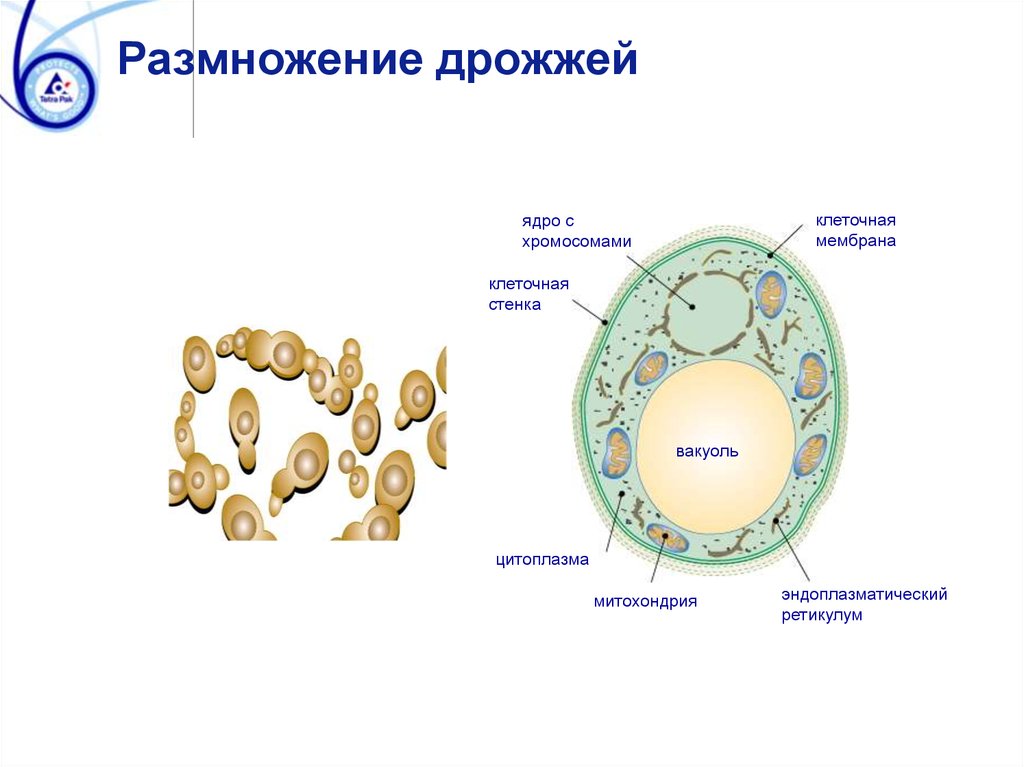
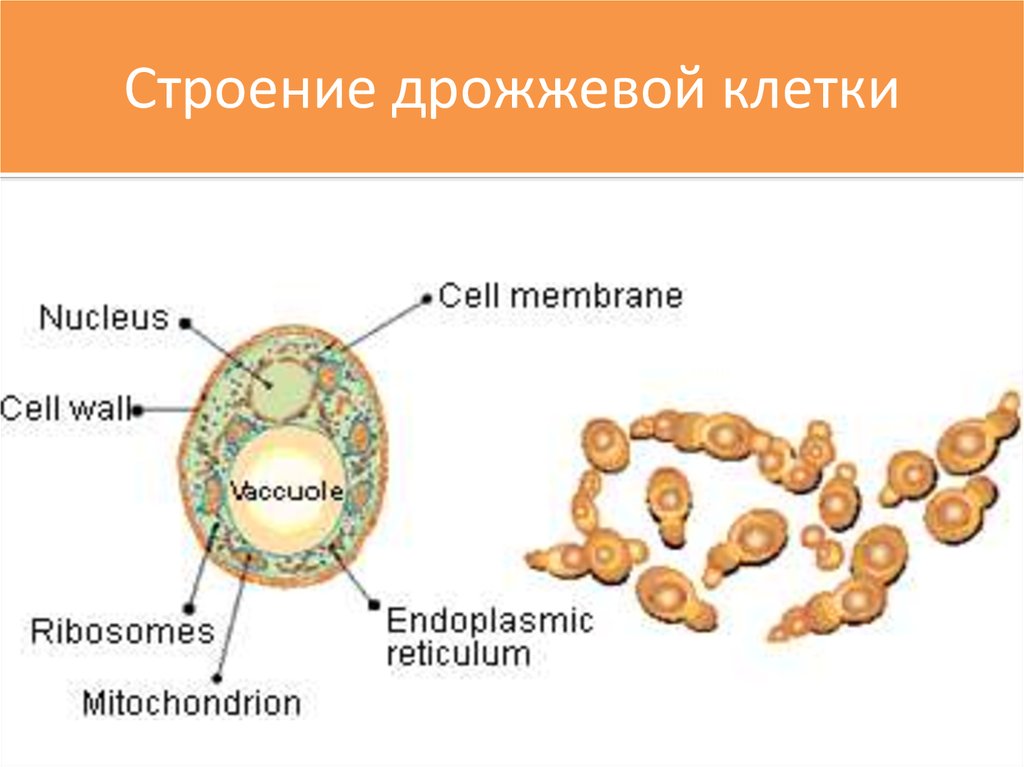
Дрожжи — это одноклеточные микроорганизмы, относящиеся к классу грибов сахаромицетов. Дрожжевые клетки имеют шаровидную или овальную форму и содержат 75 % влаги. Сухое вещество клетки состоит в основном из белков (44—67%), минеральных веществ (6—8%), углеводов (до 30%). Дрожжи содержат также разнообразные витамины и ферменты
Ферменты, присутствующие в дрожжах, способствуют протеканию всех
жизненных функций их, в том числе процессов дыхания, размножения, построения
органов клетки.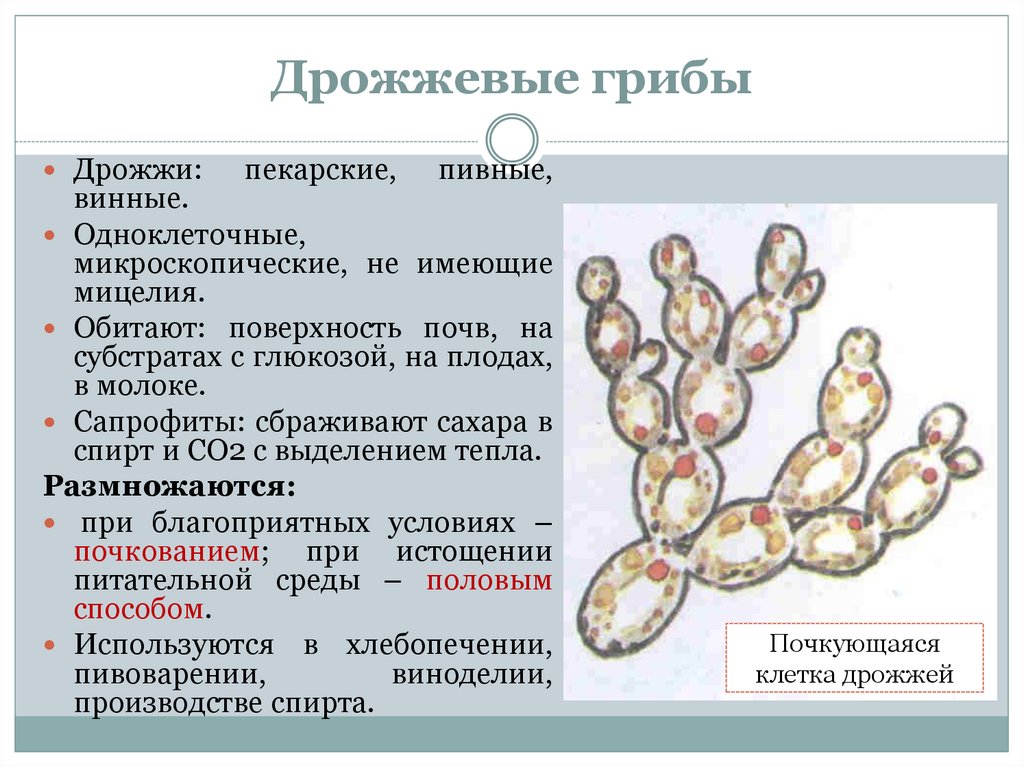
В тесте и других полуфабрикатах хлебопекарного производства кислорода очень мало, поэтому дрожжи вызывают процесс спиртового брожения, при этом дрожжевые клетки получают энергию, необходимую для своей жизнедеятельности. Образовавшийся в результате брожения углекислый газ разрыхляет тесто и обеспечивает необходимую пористость изделий.
Для нормальной жизнедеятельности дрожжей необходимы:
— жидкая среда, содержащая питательные вещества,
— соответствующая реакция среды
— температурные условия.
Жидкая среда для развития дрожжей должна содержать сахар, азотистые соединения, минеральные соединения, витамины. Хлебопекарные дрожжи усваивают глюкозу, сахарозу.
Большое значение для жизнедеятельности дрожжей имеют
температурные условия. Для размножения дрожжей наиболее благоприятна
температура 25 — 28 °С. Спиртовое брожение идет наиболее активно при
температуре 30—35 °С. При температуре 45—50 °С и выше дрожжевые клетки
погибают. Низкая температура тормозит жизнедеятельность дрожжей, дрожжи впадают
в состояние анабиоза (скрытая жизнедеятельность), в котором могут сохраняться
долго без порчи.
2. Экспериментальная часть
В данной работе продемонстрировано влияние температурных условий и сахара на жизнедеятельность дрожжей.
2.1 Объект исследования
Объектом исследования в работе были быстродействующие сухие дрожжи «Приправыч»:
2.2 Ход работы
В четыре ёмкости насыпали по 1 чайной ложке дрожжей и 1 чайной ложке сахара.
|
|
|
|
Далее:
Эксперимент №1:
Целью первого
эксперимента было изучить влияние на жизнедеятельность дрожжей различных
температур. Для этого:
Для этого:
1) В первую емкость добавили 50 мл теплой воды (температурой 40 ºС)
2) Во вторую – 50 мл воды горячей воды (температурой 80 ºС)
3) В третью – 50 мл холодной воды (температурой 10 ºС)
Эксперимент №2
Целью второго эксперимента было изучить влияние на жизнедеятельность дрожжей большого количества сахара. Для этого:
В четвёртую емкость добавили 50 мл теплой воды (температурой 40 ºС) и дополнительно 5 чайных ложек сахара.
Первую, вторую и четвертую емкости оставили при комнатной температуре + 25 °С, а третью поставили в холодильник, при температуре +2°С.
Через 30 минут наблюдаем следующее:
|
|
|
|
В первой емкости идет
активное вспенивание жидкости.
Во втором и третьем образцах вспенивания не наблюдается.
В четвертой емкости также можно увидеть вспенивание, но не такое активное, как в первой.
Далее добавляем в каждую емкость три столовых ложки муки и замешиваем тесто:
|
|
|
|
Образцы № 1, 2 и 4
накрываем блюдцами и ставим в тёплое место при температуре 40 °С.
Образец № 3 ставим в холодильник, при температуре 2°С. Через 1 час наблюдаем следующее:
|
|
|
|
Тесто в ёмкости №1
увеличилось в объеме 3 раза, остальные образцы почти не изменились. Таким
образом, можно сделать следующие выводы:
Таким
образом, можно сделать следующие выводы:
Эксперимент №1 – Температура 40°С (образец №1) является оптимальной для протекания жизненных процессов дрожжей. Температура 80°С (образец №2) и 2°С (образец №3) привели к снижению активности дрожжей и отсутствию процесса брожения.
Эксперимент №2 – Несмотря на то, что сахар является основным питанием дрожжей, слишком большое его количество приводит к снижению их жизнедеятельности (образец №4).
Далее делаем из теста шарики, кладем на противень, ставим в теплое место (температура 40°С).
Через 20 минут видим, что шарик из теста № 1 опять увеличился в объеме ( в 2 раза), немного увеличился в объеме шарик №3. Образцы №2 и 4 не изменились.
|
|
|
|
Отсюда можно сделать следующие выводы:
Эксперимент №1 – Температура 40°С является оптимальной для протекания жизненных процессов
дрожжей, поэтому в образце №1 продолжает протекать процесс брожения, который,
за счет выделения углекислого газа, и вызвал увеличение объёма. Повысилась до
оптимальной величины температура в образце №3, поэтому там тоже началось
брожение и выделение углекислого газа. Температура 80 °С оказалась губительной для дрожжей, т.е. они погибли, поэтому в
образце №2 никаких процессов жизнедеятельности не наблюдается.
Повысилась до
оптимальной величины температура в образце №3, поэтому там тоже началось
брожение и выделение углекислого газа. Температура 80 °С оказалась губительной для дрожжей, т.е. они погибли, поэтому в
образце №2 никаких процессов жизнедеятельности не наблюдается.
Эксперимент №2 – Большое количество сахара продолжает мешать нормальному протеканию процесса брожения, поэтому выделения углекислого газа почти не происходит, тесто не увеличивается в объёме.
Затем помещаем образцы в духовку, нагретую до 200 ºС.
|
|
|
|
|
|
Через 20 минут получаем готовые булочки:
|
|
|
|
|
|
2. 3 Выводы
3 Выводы
В результате работы мы сделали выводы:
Эксперимент №1:
1) В первом образце дрожжам создали наиболее благоприятные условия, поэтому они хорошо бродили, выделилось достаточно углекислого газа, и получился очень хороший хлеб.
2) Во втором образце в дрожжи добавили очень горячую воду, и они погибли, поэтому не было брожения, не выделялся углекислый газ, и хлеб получился очень плотным – без пор и маленького объёма.
3) Дрожжи в третьем образце сначала поместили в холод, поэтому процесса брожения почти не было, дрожжи «спали». Затем, перед выпечкой и при выпечке дрожжи начали активно сбраживать питательные вещества, что привело к резкому увеличению объема получившегося хлеба. Но этот хлеб имеет подрыв сбоку и не очень приятный дрожжевой запах.
Эксперимент №2:
4)
В четвертом образце
исследовалось влияние на дрожжи сахара. Не смотря на то, что сахар – основное
питание дрожжей, слишком большое его количество приводит к тому, что дрожжи
теряют свою активность и даже погибают. Поэтому хлеб получился недостаточного
объема, а его мякиш был очень липким.
Поэтому хлеб получился недостаточного
объема, а его мякиш был очень липким.
Заключение
Приготовление дрожжевого хлеба — одна из древнейших технологий. В этом процессе используется преимущественно дрожжи рода сахаромицетов. Они проводят спиртовое брожение с образованием множества вторичных продуктов, обуславливающих вкусовые и ароматические качества хлеба, а также используются при изготовлении кваса, пива, вина, и др., Кроме того, при брожении в тесте формируются пузыри углекислого газа, заставляющие его «подниматься» и после выпечки придающие хлебу губчатую структуру и мягкость.
Поэтому, изучив влияние на дрожжи различных факторов, можно управлять процессами жизнедеятельности дрожжей и производить качественные и полезные продукты — например, хлеб и булочки.
Список использованной литературы и электронных ресурсов
1. Бабьева И. П., Чернов И. Ю. Биология дрожжей. М.: Товарищество научных изданий КМК, 2004
2. Ивин М. Хлеб
сегодня, хлеб завтра. М.: Издательство Детская литература, 1980
Ивин М. Хлеб
сегодня, хлеб завтра. М.: Издательство Детская литература, 1980
3. Мусатов А. Как хлеб на стол пришел. М.: Издательство Малыш, 1979
4. ru.wikipedia.org/wiki/Saccharomycetes
5. ru.wikipedia.org/wiki/Хлеб
6. www.hlebopechka.net/h51.php
7. www.yeast.ru/koi/aboutpr.htm
8. www.foodcafe.ru/…/hlebopekarnyie-pressovannyie-drozhzhi.html
7. Факторы влияющие на размножение дрожжей
Для
роста микроорганизма необходимо
взаимодействие ряда факторов (питательные
вещества, факторы роста) и физико-химических
условий (температура, рН, аэрация). Всякий
фактор или условие, отсутствие или
изменение которых влечет приостановку
или прекращение роста, называют
«лимитирующим фактором». Если в
соответствующую питательную среду
внести несколько клеток микроорганизмов
(обсеменение), они будут размножаться
до полного использования лимитирующего
фактора (например, сахара) или до того
момента, когда лимитирующий фактор
достигнет критического значения
(например, концентрации выделяемого
спирта).
Факторы роста — это органические вещества, которые играют роль основных метаболитов; они необходимы для жизнедеятельности микроорганизмов. Факторы роста должны быть доставлены тем организмам, которые, сами не синтезируя их, не могут развиваться в их отсутствие. Одной из характеристик их является способность действовать в очень слабых концентрациях.
В зависимости от потребности в факторах роста микроорганизмы делят на две категории: прототрофы, способные синтезировать все свои составные части из различных органических источников, и ауксотрофы, неспособные синтезировать некоторые составные части; они должны находить их в питательной среде в готовом виде. Различные виды дрожжей принадлежат к обеим категориям.
У дрожжей эти факторы относятся к классу витаминов: биотин, пиридоксин, тиамин, пантотеновая кислота, мезоинозит, никотинамид, парааминобензойная кислота.
Температура
30-33°С оптимальна для размножения дрожжей,
но только в том случае, если ее поддерживать
постоянно. Экспериментально показано,
что повышение температуры до
сверхоптимальной (37,5-40°С) стимулирует
ускоренное размножение дрожжей, если
до этого они жили при более низкой
температуре (14-30°С). При длительном
воздействии повышенной температуры
дрожжи теряют терморезистентность,
Экспериментально показано,
что повышение температуры до
сверхоптимальной (37,5-40°С) стимулирует
ускоренное размножение дрожжей, если
до этого они жили при более низкой
температуре (14-30°С). При длительном
воздействии повышенной температуры
дрожжи теряют терморезистентность,
Активная кислотность* сусел и вин оказывает заметное влияние на развитие микрофлоры вина. В пределах обычных для сусел и вин величин рН (2,7-4,0) дрожжи особых затруднений при брожении не испытывают. Что касается бактерий, особенно молочнокислых, то они плохо переносят высокую активную кислотность (рН 2,7-3,1). Поэтому чем ниже величина рН, тем лучше вино защищено от этих бактерий. Подкисление сусел и вин путем добавки кислот (винной, лимонной), гипсование, применение ионитов в Н+ -форме являются эффективными приемами борьбы с некоторыми болезнями вин.
Кислород
воздуха, растворенный в сусле или вине
в количестве нескольких миллиграммов
на литр, оказывает существенное влияние
на жизнедеятельность микроорганизмов,
в первую очередь дрожжей, которые
нуждаются в кислороде в стадии размножения. Иногда при недоброде сусла энергичной
аэрацией можно вызвать возобновление
брожения. Вина, содержащие сахар и не
проявляющие никаких признаков брожения,
могут все же забродить после их усиленной
аэрации.
Иногда при недоброде сусла энергичной
аэрацией можно вызвать возобновление
брожения. Вина, содержащие сахар и не
проявляющие никаких признаков брожения,
могут все же забродить после их усиленной
аэрации.
Основные продукты брожения — спирт, углекислый газ и дрожжи.
Интенсивность аэрирования сусла. С повышением интенсивности аэрирования сусла в дрожжегенераторах содержание спирта снижается, что связано с увеличением расхода сахара на образование биомассы дрожжей и других продуктов. Поэтому расход воздуха необходимо определять с учетом требуемого количества дрожжей в бражке.
Концентрация сахара. При повышении концентрации сахара в мелассном сусле от 9 до 14 % в зрелой бражке увеличивается содержание, г/л: альдегидов — 0,15–0,4, эфиров — 0,06–0,13 высших спиртов — 0,42–0,63, а содержание кислот снижается от 0,42 до 0,04. При понижении концентрации СВ в сусле метаболитов образуется меньше.
Кислотность
сбраживаемого сусла. При изменении кислотности среды от 0,3°
(рН = 5,7) до 1,6° (рН = 4,2) содержание (г/л)
этанола в зрелой бражке уменьшалось с
59,1 до 56,03, эфиров — с 0,15 до 0,08, концентрация
альдегидов увеличивалась с 0,19 до 0,4 г/л,
органических кислот — с 0,06 до 0,34 г/л,
высших спиртов — с 0,47 до 0,84 г/л.
При изменении кислотности среды от 0,3°
(рН = 5,7) до 1,6° (рН = 4,2) содержание (г/л)
этанола в зрелой бражке уменьшалось с
59,1 до 56,03, эфиров — с 0,15 до 0,08, концентрация
альдегидов увеличивалась с 0,19 до 0,4 г/л,
органических кислот — с 0,06 до 0,34 г/л,
высших спиртов — с 0,47 до 0,84 г/л.
Температура брожения. Альдегиды образуются главным образом в начальный период брожения, затем их содержание уменьшается, и в зрелой бражке альдегидов тем меньше, чем выше температура брожения. Например, при температуре 24 °С альдегидов было 0,27 г/л, при температуре 36 °С — 0,18 г/л.
Содержание продуктов брожения (г/л) в зрелой бражке в зависимости от температуры сбраживания (T) описывается следующими уравнениями:
Раса дрожжей. Мелассное сусло сбраживают различными расами дрожжей, чаще — одновременно двумя.. Основное количество побочных метаболитов накапливается главным образом при дрожжегенерировании
Репродуктивный потенциал дрожжевых клеток зависит от общего действия взаимосвязанных изменений в метаболизме центрального углерода, клеточной биосинтетической способности и протеостазе
1. Штеффен К.К., Кеннеди Б.К., Каберляйн М. Измерение продолжительности репликативной жизни почкующихся дрожжей. Дж. Вис. Эксп. 2009; 28 doi: 10.3791/1209. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Штеффен К.К., Кеннеди Б.К., Каберляйн М. Измерение продолжительности репликативной жизни почкующихся дрожжей. Дж. Вис. Эксп. 2009; 28 doi: 10.3791/1209. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Kaeberlein M., Kennedy B.K. Крупномасштабная идентификация у дрожжей консервативных генов старения. мех. Старение Дев. 2005; 126:17–21. doi: 10.1016/j.mad.2004.090,013. [PubMed] [CrossRef] [Google Scholar]
3. Kaeberlein M., Kirkland K.T., Fields S., Kennedy B.K. Гены, определяющие продолжительность репликативной жизни дрожжей на долгоживущем генетическом фоне. мех. Старение Дев. 2005; 126: 491–504. doi: 10.1016/j.mad.2004.10.007. [PubMed] [CrossRef] [Google Scholar]
4. Smith E.D., Kennedy B.K., Kaeberlein M. Полногеномная идентификация законсервированных генов долголетия у дрожжей и червей. мех. Старение Дев. 2007; 128:106–111. doi: 10.1016/j.mad.2006.11.017. [PubMed] [CrossRef] [Академия Google]
5. Delaney J.R., Murakami C., Chou A., Carr D. , Schleit J., Sutphin G.L., An E.H., Castanza A.S., Fletcher M., Goswami S., et al. Диетическое ограничение и функция митохондрий связывают репликативное и хронологическое старение у Saccharomyces cerevisiae . Эксп. Геронтол. 2013;48:1006–1013. doi: 10.1016/j.exger.2012.12.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Schleit J., Sutphin G.L., An E.H., Castanza A.S., Fletcher M., Goswami S., et al. Диетическое ограничение и функция митохондрий связывают репликативное и хронологическое старение у Saccharomyces cerevisiae . Эксп. Геронтол. 2013;48:1006–1013. doi: 10.1016/j.exger.2012.12.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
6. Tsuchiya M., Dang N., Kerr E.O., Hu D., Steffen K.K., Oakes J.A., Kennedy B.K., Kaeberlein M. Sirtuin-независимые эффекты никотинамида на увеличение продолжительности жизни за счет ограничения калорий в дрожжах. Стареющая клетка. 2006; 5: 505–514. дои: 10.1111/j.1474-9726.2006.00240.х. [PubMed] [CrossRef] [Google Scholar]
7. Maslanka R., Zadrag-Tecza R. Меньше значит больше или больше значит меньше: значение метаболизма глюкозы в регуляции репродуктивного потенциала и общей продолжительности жизни Saccharomyces cerevisiae дрожжи. Дж. Селл. Физиол. 2019; 234:17622–17638. doi: 10.1002/jcp.28386. [PubMed] [CrossRef] [Google Scholar]
8. Билински Т., Задронг-Тенча Р., Бартош Г. Гипотеза гипертрофии как альтернативное объяснение феномена репликативного старения дрожжей. FEMS Yeast Res. 2012;12:97–101. doi: 10.1111/j.1567-1364.2011.00759.x. [PubMed] [CrossRef] [Google Scholar]
Билински Т., Задронг-Тенча Р., Бартош Г. Гипотеза гипертрофии как альтернативное объяснение феномена репликативного старения дрожжей. FEMS Yeast Res. 2012;12:97–101. doi: 10.1111/j.1567-1364.2011.00759.x. [PubMed] [CrossRef] [Google Scholar]
9. Neurohr G.E., Terry R.L., Lengefeld J., Bonney M., Brittingham G.P., Moretto F., Miettinen T.P., Vaites L.P., Soares L.M., Paulo J.A., et al. Чрезмерный рост клеток вызывает разбавление цитоплазмы и способствует старению. Клетка. 2019;176:1083–1097. doi: 10.1016/j.cell.2019.01.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Ян Дж., Дунгравала Х., Хуа Х., Манукян А., Абрахам Л., Лейн В., Мид Х., Райт Дж. , Шнайдер Б.Л. Размер клеток и скорость роста являются основными детерминантами репликативной продолжительности жизни. Клеточный цикл. 2011;10:144–155. doi: 10.4161/cc.10.1.14455. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Задраг-Теча Р., Кволек-Мирек М., Бартош Г., Билински Т.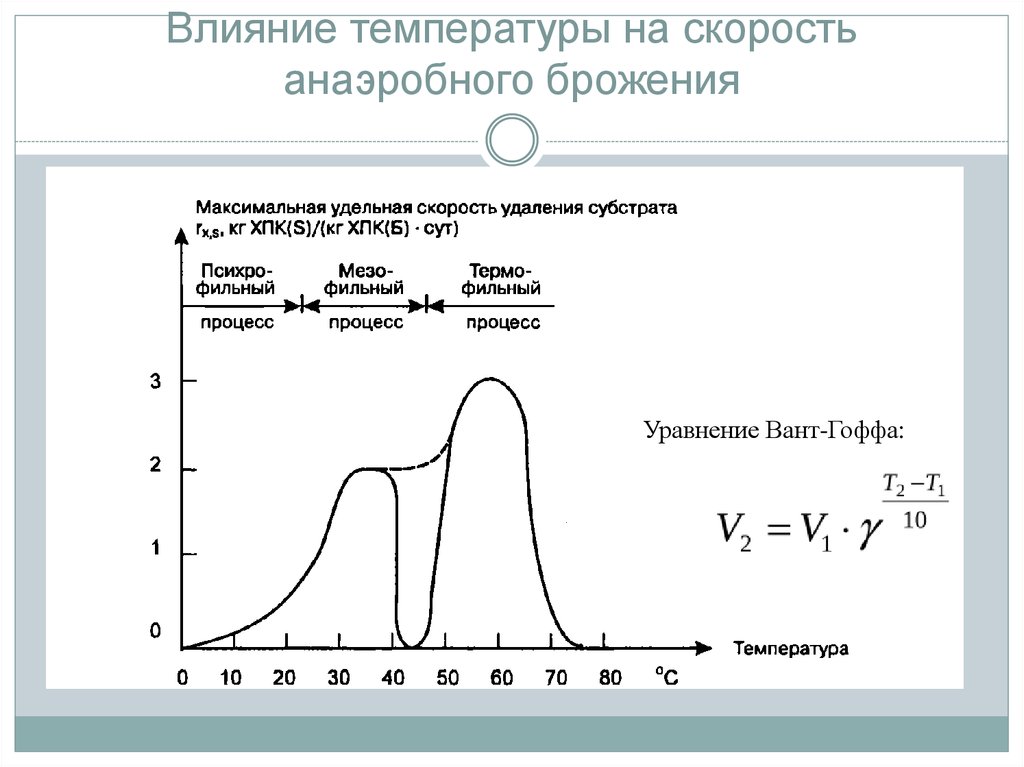 Объем клеток как фактор, ограничивающий репликативную продолжительность жизни дрожжей Saccharomyces cerevisiae . Биогеронтология. 2009; 10: 481–488. doi: 10.1007/s10522-008-9192-0. [PubMed] [CrossRef] [Google Scholar]
Объем клеток как фактор, ограничивающий репликативную продолжительность жизни дрожжей Saccharomyces cerevisiae . Биогеронтология. 2009; 10: 481–488. doi: 10.1007/s10522-008-9192-0. [PubMed] [CrossRef] [Google Scholar]
12. Maslanka R., Kwolek-Mirek M., Zadrag-Tecza R. Последствия ограничения и избытка калорий для физиологических параметров клеток дрожжей Saccharomyces cerevisiae . FEMS Yeast Res. 2017;17 doi: 10.1093/фемсир/fox087. [PubMed] [CrossRef] [Google Scholar]
13. Порро Д., Брамбилла Л., Альбергина Л. Метаболизм глюкозы и размер клеток в непрерывных культурах Saccharomyces cerevisiae . ФЭМС микробиол. лат. 2003; 229:165–171. doi: 10.1016/S0378-1097(03)00815-2. [PubMed] [CrossRef] [Google Scholar]
14. Фонтана Л., Партридж Л. Укрепление здоровья и долголетия с помощью диеты: от модельных организмов к людям. Клетка. 2015; 161:106–118. doi: 10.1016/j.cell.2015.02.020. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Фонтана Л., Партридж Л., Лонго В.Д. Увеличение продолжительности здоровой жизни — от дрожжей до людей. Наука. 2010; 328:321–326. doi: 10.1126/science.1172539. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Фонтана Л., Партридж Л., Лонго В.Д. Увеличение продолжительности здоровой жизни — от дрожжей до людей. Наука. 2010; 328:321–326. doi: 10.1126/science.1172539. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Lin SJ, Defossez P.A., Guarente L. Требование NAD и SIR2 для увеличения продолжительности жизни за счет ограничения калорий в Saccharomyces cerevisiae . Наука. 2000; 289:2126–2128. doi: 10.1126/science.289.5487.2126. [PubMed] [CrossRef] [Google Scholar]
17. Fabrizio P., Pozza F., Pletcher S.D., Gendron C.M., Longo V.D. Регуляция долголетия и стрессоустойчивости с помощью Sch9в дрожжах. Наука. 2001; 292: 288–290. doi: 10.1126/science.1059497. [PubMed] [CrossRef] [Google Scholar]
18. Лонго В.Д. Пути Ras и Sch9 регулируют стрессоустойчивость и долголетие. Эксп. Геронтол. 2003; 38: 807–811. doi: 10.1016/S0531-5565(03)00113-X. [PubMed] [CrossRef] [Google Scholar]
19. Kaeberlein M., Powers R.W., Steffen K.K., Westman E.A., Hu D.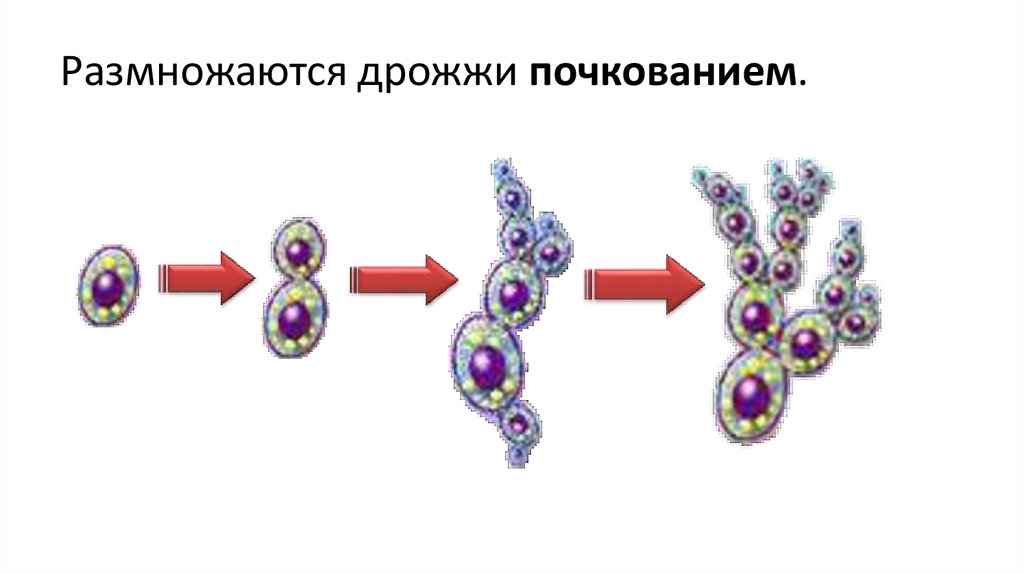 , Dang N., Kerr E.O., Kirkland K.T., Fields S., Kennedy B.K. Регуляция продолжительности репликативной жизни дрожжей с помощью TOR и Sch9в ответ на питательные вещества. Наука. 2005; 310:1193–1196. doi: 10.1126/science.1115535. [PubMed] [CrossRef] [Google Scholar]
, Dang N., Kerr E.O., Kirkland K.T., Fields S., Kennedy B.K. Регуляция продолжительности репликативной жизни дрожжей с помощью TOR и Sch9в ответ на питательные вещества. Наука. 2005; 310:1193–1196. doi: 10.1126/science.1115535. [PubMed] [CrossRef] [Google Scholar]
20. Лу С.П., Лин С.Дж. Регуляция сиртуинов дрожжей посредством метаболизма NAD(+) и ограничения калорийности. Биохим. Биофиз. Акта. 2010; 1804: 1567–1575. doi: 10.1016/j.bbapap.2009.09.030. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Андерсон Р.М., Биттерман К.Дж., Вуд Дж.Г., Медведик О., Синклер Д.А. Никотинамид и PNC1 регулируют увеличение продолжительности жизни за счет ограничения калорий в 9 случаях.0011 Saccharomyces cerevisiae . Природа. 2003; 423:181–185. doi: 10.1038/nature01578. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
22. Mei SC, Brenner C. Количественная оценка количества копий белка в дрожжах: метаболом NAD +. ПЛОС ОДИН. 2014;9:e106496. doi: 10.1371/journal. pone.0106496. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
pone.0106496. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Kaeberlein M., Kirkland K.T., Fields S., Kennedy B.K. Sir2-независимое увеличение продолжительности жизни за счет ограничения калорий у дрожжей. PLoS биол. 2004;2:E296. doi: 10.1371/journal.pbio.0020296. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Kaeberlein M., Powers RW 3rd, Sir2 и ограничение калорий в дрожжах: скептическая точка зрения. Старение Res. 2007; 6: 128–140. doi: 10.1016/j.arr.2007.04.001. [PubMed] [CrossRef] [Google Scholar]
25. Kaeberlein M., Hu D., Kerr E.O., Tsuchiya M., Westman E.A., Dang N., Fields S., Kennedy B.K. Увеличение продолжительности жизни из-за ограничения калорий у дрожжей с респираторной недостаточностью. Генетика PLoS. 2005;1:e69. doi: 10.1371/journal.pgen.0010069. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Ву Д.К., Пойтон Р.О. Отсутствие митохондриального генома в клетках дрожжей rho0 увеличивает продолжительность жизни независимо от ретроградной регуляции. Эксп. Геронтол. 2009; 44: 390–397. doi: 10.1016/j.exger.2009.03.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эксп. Геронтол. 2009; 44: 390–397. doi: 10.1016/j.exger.2009.03.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Flores C.L., Rodriguez C., Petit T., Gancedo C. Метаболизм углеводов и энергии у нетрадиционных дрожжей. ФЭМС микробиол. 2000 г.; 24:507–529.. doi: 10.1016/S0168-6445(00)00037-1. [PubMed] [CrossRef] [Google Scholar]
28. Ганседо Дж. М. Ранние этапы передачи сигналов глюкозы у дрожжей. ФЭМС микробиол. 2008; 32: 673–704. doi: 10.1111/j.1574-6976.2008.00117.x. [PubMed] [CrossRef] [Google Scholar]
29. Rolland F., Winderickx J., Thevelein J.M. Механизмы восприятия глюкозы и сигнальные механизмы у дрожжей. FEMS Yeast Res. 2002; 2: 183–201. doi: 10.1016/S1567-1356(02)00046-6. [PubMed] [CrossRef] [Google Scholar]
30. Де Декен Р. Х. Эффект Крэбтри: регуляторная система дрожжей. J. Gen. Microbiol. 1966;44:149–156. doi: 10.1099/00221287-44-2-149. [PubMed] [CrossRef] [Google Scholar]
31. Хэгман А., Салл Т., Пискур Дж. Анализ краткосрочного эффекта Крэбтри у дрожжей и его происхождение. FEBS J. 2014; 281:4805–4814. doi: 10.1111/февраль 13019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
FEBS J. 2014; 281:4805–4814. doi: 10.1111/февраль 13019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Nilsson A., Nielsen J. Метаболические компромиссы в дрожжах вызваны синтазой F1F0-ATP. науч. Отчет 2016; 6: 22264. doi: 10.1038/srep22264. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Вандер Хейден М.Г., Кэнтли Л.С., Томпсон С.Б. Понимание эффекта Варбурга: метаболические потребности пролиферации клеток. Наука. 2009; 324:1029–1033. doi: 10.1126/science.1160809. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Shimizu K., Matsuoka Y. Регуляция гликолитического потока и переливного метаболизма в зависимости от источника выработки энергии для потребности в энергии. Биотехнолог. Доп. 2019; 37: 284–305. doi: 10.1016/j.biotechadv.2018.12.007. [PubMed] [CrossRef] [Академия Google]
35. Морено Ф., Ауатци Д., Риера А., Паломино К.А., Эрреро П. Определение уровня глюкозы через Hxk2-зависимый сигнальный путь. Биохим. соц. Транс. 2005; 33: 265–268. doi: 10.1042/BST0330265. [PubMed] [CrossRef] [Google Scholar]
соц. Транс. 2005; 33: 265–268. doi: 10.1042/BST0330265. [PubMed] [CrossRef] [Google Scholar]
36. Вега М., Риера А., Фернандес-Сид А., Эрреро П., Морено Ф. Гексокиназа 2 — внутриклеточный сенсор глюкозы дрожжевых клеток, который поддерживает структуру и Активность белкового репрессорного комплекса Mig1. Дж. Биол. хим. 2016; 291:7267–7285. doi: 10.1074/jbc.M115.711408. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Родригес А., Де Ла Сера Т., Эрреро П., Морено Ф. Белок гексокиназа 2 регулирует экспрессию генов GLK1, HXK1 и HXK2 Saccharomyces cerevisiae . Биохим. Дж. 2001; 355: 625–631. doi: 10.1042/bj3550625. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Дидерих Дж. А., Раамсдонк Л. М., Крукеберг А. Л., Берден Дж. А., Ван Дам К. Физиологические свойства Saccharomyces cerevisiae , из которых гексокиназа II была удалена. заявл. Окружающая среда. микробиол. 2001; 67: 1587–159.3. doi: 10.1128/AEM.67.4.1587-1593. 2001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
39. Zadrag-Tecza R., Kwolek-Mirek M., Alabrudzińska M., Skoneczna A. Размер клеток влияет на репродуктивный потенциал и общую продолжительность жизни. Оксид. Мед. Клетка. Лонгев. 2018;2018:1898421. дои: 10.1155/2018/1898421. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Масланка Р., Кволек-Мирек М., Задраг-Текза Р. Автофлуоресценция дрожжей Saccharomyces cerevisiae клеток, вызванных продуктами метаболизма глюкозы, и его методологические последствия. Дж. Микробиол. Методы. 2018;146:55–60. doi: 10.1016/j.mimet.2018.01.017. [PubMed] [CrossRef] [Google Scholar]
41. Lee D., Son H.G., Jung Y., Lee S.V. Роль пищевых углеводов в старении организма. Клетка. Мол. Жизнь наук. 2017; 74: 1793–1803. doi: 10.1007/s00018-016-2432-6. [PubMed] [CrossRef] [Google Scholar]
42. Баррос М.Х., Бэнди Б., Тахара Э.Б., Ковальтовски А.Дж. Более высокая дыхательная активность снижает высвобождение митохондриального реактивного кислорода и увеличивает продолжительность жизни в Saccharomyces cerevisiae . Дж. Биол. хим. 2004; 279:49883–49888. doi: 10.1074/jbc.M408918200. [PubMed] [CrossRef] [Google Scholar]
Дж. Биол. хим. 2004; 279:49883–49888. doi: 10.1074/jbc.M408918200. [PubMed] [CrossRef] [Google Scholar]
43. Lin S.J., Kaeberlein M., Andalis A.A., Sturtz L.A., Defossez P.A., Culotta VC, Fink G.R., Guarente L. Ограничение калорий продлевает Saccharomyces cerevisiae за счет увеличения продолжительности дыхания . Природа. 2002; 418:344–348. doi: 10.1038/nature00829. [PubMed] [CrossRef] [Google Scholar]
Ограничение калорий истерически стимулирует старение Saccharomyces cerevisiae для более эффективного окислительного метаболизма. ПЛОС ОДИН. 2013;8:e56388. doi: 10.1371/journal.pone.0056388. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
45. Kümmel A., Ewald J.C., Fendt S.M., Jol S.J., Picotti P., Aebersold R., Sauer U., Zamboni N., Heinemann M. , Дифференциальная репрессия глюкозы в обычных штаммах дрожжей в ответ на делецию HXK2. FEMS Yeast Res. 2010;10:322–332. doi: 10.1111/j.1567-1364.2010.00609.x. [PubMed] [CrossRef] [Академия Google]
46. Оттерстедт К., Ларссон С., Билл Р.М., Стольберг А., Болес Э., Хохманн С., Густафссон Л. Переключение режима метаболизма у дрожжей Saccharomyces cerevisiae . EMBO Rep. 2004; 5: 532–537. doi: 10.1038/sj.embor.7400132. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Оттерстедт К., Ларссон С., Билл Р.М., Стольберг А., Болес Э., Хохманн С., Густафссон Л. Переключение режима метаболизма у дрожжей Saccharomyces cerevisiae . EMBO Rep. 2004; 5: 532–537. doi: 10.1038/sj.embor.7400132. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Busti S., Coccetti P., Alberghina L., Vanoni M. Опосредованная передачей сигналов глюкозы координация клеточного роста и клеточного цикла в Saccharomyces cerevisiae . Датчики. 2010;10:6195–6240. doi: 10.3390/s100606195. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
48. Roosen J., Oesterhelt C., Pardons K., Swinnen E., Winderickx J. Интеграция сигнальных путей питательных веществ в дрожжах Saccharomyces cerevisiae . В: Winderickx J., Taylor PM, редакторы. Темы современной генетики. Том 7. Спрингер; Берлин/Гейдельберг, Германия: 2004. стр. 277–318. Индуцированные питательными веществами ответы в эукариотических клетках. [Google Scholar]
49. Ньюкомб Л.Л., Дидерих Дж.А., Слэттери М.Г., Хайдеман В. Регуляция глюкозы генами клеточного цикла Saccharomyces cerevisiae. Эукариот. Клетка. 2003; 2: 143–149.. doi: 10.1128/EC.2.1.143-149.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ньюкомб Л.Л., Дидерих Дж.А., Слэттери М.Г., Хайдеман В. Регуляция глюкозы генами клеточного цикла Saccharomyces cerevisiae. Эукариот. Клетка. 2003; 2: 143–149.. doi: 10.1128/EC.2.1.143-149.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Смешанная и разнообразная регуляция метаболизма и экспрессии генов гликолитических и ферментативных путей в ответ на делецию HXK2 в Saccharomyces cerevisiae . FEMS Yeast Res. 2008; 8: 155–164. doi: 10.1111/j.1567-1364.2007.00282.x. [PubMed] [CrossRef] [Академия Google]
51. Хейланд Дж., Фу Дж., Бланк Л.М. Корреляция между потоком цикла ТСА и скоростью поглощения глюкозы во время респироферментативного роста Saccharomyces cerevisiae . Микробиология. 2009; 155:3827–3837. doi: 10.1099/микрофон 0.030213-0. [PubMed] [CrossRef] [Google Scholar]
52. Chen Y., Nielsen J. Энергетический метаболизм контролирует фенотипы за счет эффективности и распределения белков. проц. Натл. акад. науч. США. 2019;116:17592–17597.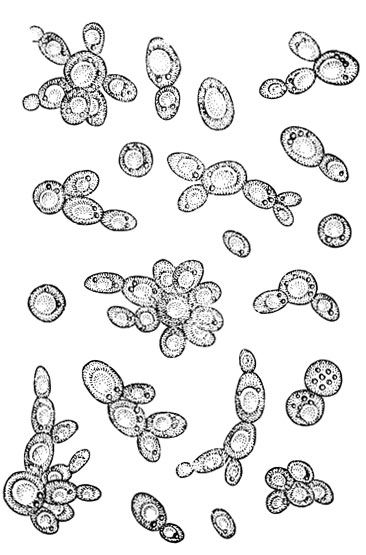 doi: 10.1073/pnas.1906569116. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1073/pnas.1906569116. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Де Альтериис Э., Картени Ф., Параскандола П., Серпа Дж., Маццолени С. Пересмотр эффекта Крэбтри/Варбурга в динамической перспективе: преимущество в приспособленности против гибели клеток, вызванной сахаром. Клеточный цикл. 2018; 17: 688–701. doi: 10.1080/15384101.2018.1442622. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Rose M., Albig W., Entian K.D. Репрессия глюкозы у Saccharomyces cerevisiae напрямую связана с фосфорилированием гексозы гексокиназами PI и PII. Евро. Дж. Биохим. 1991;199:511–518. doi: 10.1111/j.1432-1033.1991.tb16149.x. [PubMed] [CrossRef] [Google Scholar]
55. Росас Лемус М., Руссари Э., Хаммад Н., Мужоль А., Рансак С., Исса Р., Мазат Дж. П., Урибе-Карвахаль С., Ригуле М. ., Девин А. Роль гексозофосфатов, полученных в результате гликолиза, в индукции эффекта Крэбтри. Дж. Биол. хим. 2018;293:12843–12854. doi: 10.1074/jbc.RA118.003672.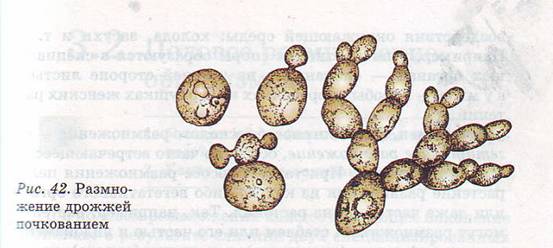 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Марторана Ф., Гальо Д., Бьянко М.Р., Апреа Ф., Виртуоз А., Бонаноми М., Альбергина Л., Папа М., Коланджело А.М. Дифференцировка по фактору роста нервов (NGF) включает механизмы перекрестных помех между энергетическим гомеостазом и ремоделированием митохондрий. Клеточная смерть Дис. 2018;9:391. doi: 10.1038/s41419-018-0429-9. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
57. Kunkel J., Luo X., Capaldi AP. Интегрированная передача сигналов TORC1 и PKA контролирует временную активацию экспрессии генов, индуцированную глюкозой, в дрожжах. Нац. коммун. 2019;10:3558. doi: 10.1038/s41467-019-11540-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
58. Chen Y.C., Jiang P.H., Chen H.M., Chen C.H., Wang Y.T., Chen YJ, Yu CJ, Teng S.C. Потребление глюкозы препятствует PKA-регулируемому HSP90 сопровождающая деятельность. Элиф. 2018;7:e39925. doi: 10.7554/eLife.39925. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Yuan Y., Lin J.Y., Cui H.J., Zhao W., Zheng H.L., Jiang Z.W., Xiong X.D., Xu S., Liu X.G. Дефицит PCK1 сокращает репликативную продолжительность жизни Saccharomyces cerevisiae за счет усиления регуляции PFK1. Биомед. Рез. Междунар. 2020;2020:3858465. doi: 10.1155/2020/3858465. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Yuan Y., Lin J.Y., Cui H.J., Zhao W., Zheng H.L., Jiang Z.W., Xiong X.D., Xu S., Liu X.G. Дефицит PCK1 сокращает репликативную продолжительность жизни Saccharomyces cerevisiae за счет усиления регуляции PFK1. Биомед. Рез. Междунар. 2020;2020:3858465. doi: 10.1155/2020/3858465. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Анджелло Дж. К., Пендерграсс В. Р., Норвуд Т. Х., Протеро Дж. Пролиферативный потенциал фибробластов человека: обратная зависимость от размера клетки. J. Cell Physiol. 1987;132:125–130. doi: 10.1002/jcp.1041320117. [PubMed] [CrossRef] [Google Scholar]
61. Анци С., Столович-Райн М., Клохендлер А., Фридлих О., Хельман А., Паз-Зонненфельд А., Авни-Маген Н., Кауфман Э. ., Гинзберг М.Б., Снайдер Д. и соавт. Постнатальный экзокринный рост поджелудочной железы за счет клеточной гипертрофии коррелирует с более короткой продолжительностью жизни у млекопитающих. Дев. Клетка. 2018;45:726–737. doi: 10.1016/j.devcel.2018.05.024. [PubMed] [CrossRef] [Google Scholar]
62. Morocutti A., Earle K.A., Sethi M., Piras G., Pal K., Richards D., Rodemann P., Viberti G. Преждевременное старение фибробластов кожи от больные инсулинозависимым диабетом с заболеваниями почек. почки инт. 1996;50:250–256. doi: 10.1038/ki.1996.309. [PubMed] [CrossRef] [Google Scholar]
Morocutti A., Earle K.A., Sethi M., Piras G., Pal K., Richards D., Rodemann P., Viberti G. Преждевременное старение фибробластов кожи от больные инсулинозависимым диабетом с заболеваниями почек. почки инт. 1996;50:250–256. doi: 10.1038/ki.1996.309. [PubMed] [CrossRef] [Google Scholar]
63. Janssens G.E., Meinema A.C., Gonzalez J., Wolters J.C., Schmidt A., Guryev V., Bischoff R., Wit E.C., Veenhoff L.M., Heinemann M. Биогенез белка механизм является движущей силой репликативного старения дрожжей. Элиф. 2015;4:e08527. doi: 10.7554/eLife.08527. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Кафри М., Мецл-Раз Э., Йона Г., Баркай Н. Стоимость производства белка. Cell Rep. 2016; 14:22–31. doi: 10.1016/j.celrep.2015.12.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Штеффен К.К., Маккей В.Л., Керр Э.О., Цучия М., Ху Д., Фокс Л.А., Данг Н., Джонстон Э.Д., Оукс Дж.А., Чао Б.Н. и др. Увеличение продолжительности жизни дрожжей за счет истощения 60-секундных рибосомных субъединиц опосредуется Gcn4.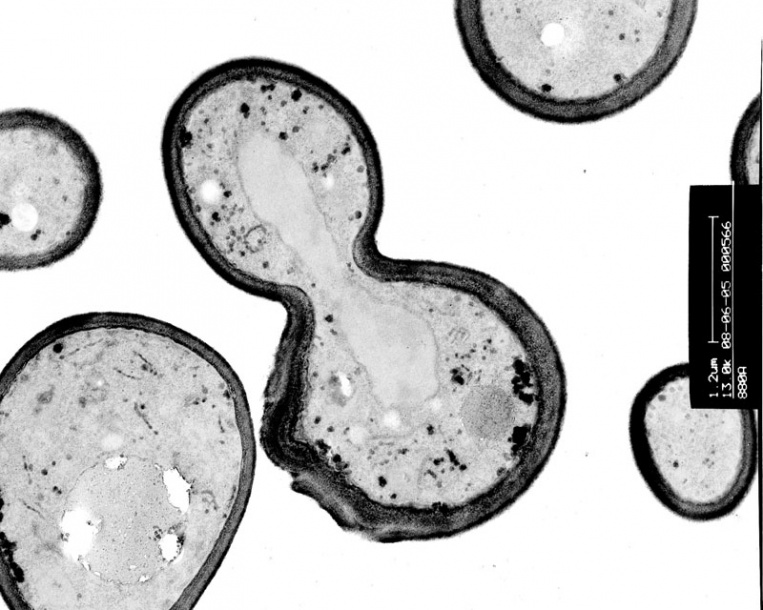 Клетка. 2008; 133: 292–302. doi: 10.1016/j.cell.2008.02.037. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Клетка. 2008; 133: 292–302. doi: 10.1016/j.cell.2008.02.037. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Перич М., Ловрич А., Шарич А., Муса М., Бу Диб П., Рудан М., Николич А., Собочанец С. ., Микецин А.М., Деннерляйн С. и соавт. Опосредованное TORC1 определение активности шаперона изменяет метаболизм глюкозы и увеличивает продолжительность жизни. Стареющая клетка. 2017;16:994–1005. doi: 10.1111/acel.12623. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Hu Z., Xia B., Postnikoff S.D., Shen Z.J., Tomoiaga A.S., Harkness TA., Seol JH, Li W., Chen K., Тайлер Дж.К. Ssd1 и Gcn2 подавляют глобальную эффективность трансляции в репликативно стареющих дрожжах, в то время как их активация увеличивает продолжительность жизни. Элиф. 2018;7:e35551. doi: 10.7554/eLife.35551. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Sampaio-Marques B., Ludovico P. Связь клеточного протеостаза с продолжительностью жизни дрожжей. FEMS Yeast Res. 2018;18 дои: 10.1093/femsyr/foy043. [PubMed] [CrossRef] [Google Scholar]
2018;18 дои: 10.1093/femsyr/foy043. [PubMed] [CrossRef] [Google Scholar]
69. Robey R.B., Hay N. Митохондриальные гексокиназы, новые медиаторы антиапоптотических эффектов факторов роста и Akt. Онкоген. 2006; 25:4683–4696. doi: 10.1038/sj.onc.1209595. [PubMed] [CrossRef] [Google Scholar]
70. Amigoni L., Martegani E., Colombo S. Отсутствие HXK2 индуцирует локализацию активного Ras в митохондриях и запускает апоптоз в дрожжах Saccharomyces cerevisiae . Оксид. Мед. Клетка. Лонгев. 2013 г.: 10.1155/2013/678473. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Kruegel U., Robison B., Dange T., Kahlert G., Delaney J.R., Kotireddy S., Tsuchiya M., Tsuchiyama S., Murakami C.J., Schleit J., et al. Повышенная способность протеасом увеличивает продолжительность репликативной жизни у Saccharomyces cerevisiae . Генетика PLoS. 2011;7:e1002253. doi: 10.1371/journal.pgen.1002253. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Yao Y., Tsuchiyama S., Yang C., Bulteau A.L., He C., Robison B., Tsuchiya M., Miller D., Брионес В., Тар К. и др. Протеасомы, Sir2 и Hxk2 образуют взаимосвязанную сеть старения, которая воздействует на репрессор транскрипции Mig1, регулируемый AMPK/Snf1. Генетика PLoS. 2015;11:e1004968. doi: 10.1371/journal.pgen.1004968. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Yao Y., Tsuchiyama S., Yang C., Bulteau A.L., He C., Robison B., Tsuchiya M., Miller D., Брионес В., Тар К. и др. Протеасомы, Sir2 и Hxk2 образуют взаимосвязанную сеть старения, которая воздействует на репрессор транскрипции Mig1, регулируемый AMPK/Snf1. Генетика PLoS. 2015;11:e1004968. doi: 10.1371/journal.pgen.1004968. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Ваврин Дж., Кшепилко А., Мышка А., Билински Т. Дефицит супероксиддисмутазы сокращает продолжительность жизни дрожжевых клеток. Акта Биохим. пол. 1999; 46: 249–253. doi: 10.18388/abp.1999_4158. [PubMed] [CrossRef] [Google Scholar]
74. Zadrag R., Bartosz G., Bilinski T. Являются ли дрожжи подходящей моделью старения многоклеточных организмов? Взгляд на общую продолжительность жизни Saccharomyces cerevisiae . Курс. Наука о старении. 2008; 1: 159–165. doi: 10.2174/1874609810801030159. [PubMed] [CrossRef] [Google Scholar]
75. Виддел Ф. Теория и измерение роста бактерий. Далам. Грундпрактикум микробиол. 2007; 4:1–11. [Google Scholar]
Грундпрактикум микробиол. 2007; 4:1–11. [Google Scholar]
76. Кволек-Мирек М., Задраг-Теча Р. Сравнение методов, используемых для оценки жизнеспособности и жизнеспособности дрожжевых клеток. FEMS Yeast Res. 2014; 14:1068–1079. doi: 10.1111/1567-1364.12202. [PubMed] [CrossRef] [Google Scholar]
77. Tian W.N., Braunstein L.D., Pang J., Stuhlmeier K.M., Xi QC, Tian X., Stanton R.C. Значение активности глюкозо-6-фосфатдегидрогеназы для роста клеток. Дж. Биол. хим. 1998;273:10609–10617. doi: 10.1074/jbc.273.17.10609. [PubMed] [CrossRef] [Google Scholar]
Исследование лучших условий роста Saccharomyces cerevisiae
Электронный врач. 2017 янв; 9(1): 3592–3597.
Опубликовано онлайн 2017 январь 25. DOI: 10.19082/3592
1 и 2
Информация о авторе статьи Примечания к заявлениям об авторском правом и лицензии.0012 известен как один из полезных дрожжей, используемых в хлебопекарной и других отраслях промышленности. Его можно легко культивировать по экономичной цене. Сегодня рассматривается вопрос о внедрении безопасных и эффективных перевозчиков. Из-за его в целом круглой формы и объема, заключенного в его мембране и клеточной стенке, он используется для инкапсулирования активных материалов для их защиты от деградации или для введения системы доставки лекарств с замедленным высвобождением. Обеспечение наилучших условий для достижения наилучших морфологических свойств Saccharomyces cerevisiae в качестве носителя.
Его можно легко культивировать по экономичной цене. Сегодня рассматривается вопрос о внедрении безопасных и эффективных перевозчиков. Из-за его в целом круглой формы и объема, заключенного в его мембране и клеточной стенке, он используется для инкапсулирования активных материалов для их защиты от деградации или для введения системы доставки лекарств с замедленным высвобождением. Обеспечение наилучших условий для достижения наилучших морфологических свойств Saccharomyces cerevisiae в качестве носителя.
Методы
В этом исследовании наиболее подходящие условия роста дрожжевых клеток, которые обеспечивают наилучший размер для использования в качестве носителей лекарств, были найдены в биореакторе в синтетической культуральной среде. Были получены кривые репродукции и роста дрожжевых клеток на основе данных подсчета колоний в чашке и поглощения образца в УФ/видимом диапазоне при 600 нм. Модели роста клеток дрожжей и скорость роста определяли с помощью математического программного обеспечения Matlab.
Результаты
Результаты показали, что pH=4 и растворенный кислород (DO) 5% были лучшими условиями для роста и размножения дрожжевых клеток. Это условие также обеспечивало наибольший размер (2 × 3 мкм) дрожжевых клеток.
Заключение
Благодаря низкозатратному производству дрожжевых клеток и их структурным характеристикам их можно использовать в качестве сильнодействующих носителей лекарств.
Финансирование
Эта работа была поддержана грантом проректора исследований Мешхедского университета медицинских наук.
Ключевые слова: Носитель, Рост, Математика, Saccharomyces cerevisiae дрожжевые клетки
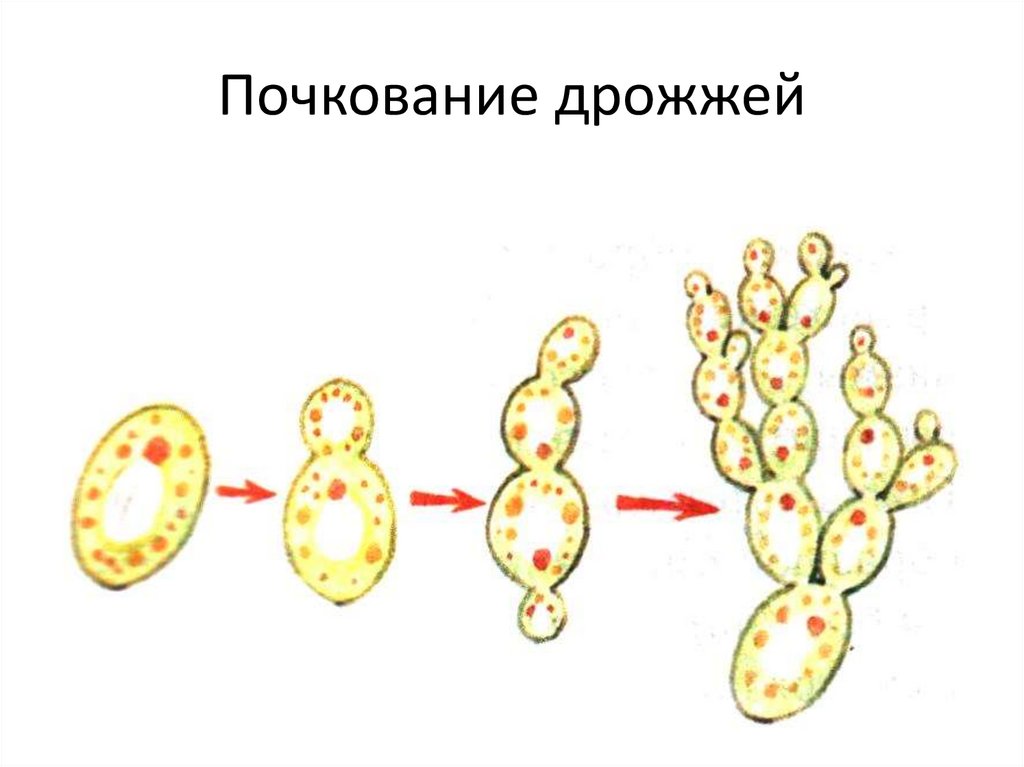
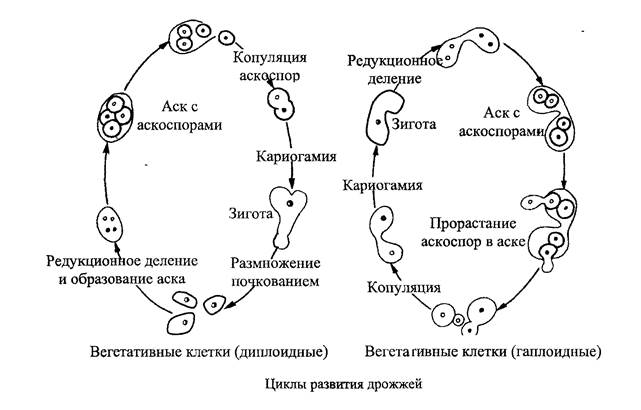
Название Saccharomyces cerevisiae состоит из двух частей: «cerevisiae» означает «пиво». S. cerevisiae известен как один из полезных дрожжей, используемых в хлебопекарной и других отраслях промышленности. Он используется в качестве модельного эукариотического организма в биологических исследованиях, поскольку его легко культивировать. Этот организм осуществляет наиболее распространенный тип брожения. Он имеет форму от круглой до яйцевидной и размножается почкованием (1, 2). Клетки дрожжей могут расти в гаплоидной и диплоидной формах. Гаплоидные клетки указывают на простой жизненный цикл митоза, который в стрессовых условиях погибает. Диплоидные клетки, как и гаплоидные, демонстрируют жизненный цикл митоза, но в условиях сильного стресса вступают в жизненный цикл мейоза и производят четыре гаплоидные споры. Их время удвоения составляет примерно 90 мин (3–6). S. cerevisiae может расти в аэробных и анаэробных условиях. Его способность использовать разные сахара зависит от того, как он растет. Если он растет аэробно, галактоза и фруктоза являются лучшими сахарами для брожения. Всем штаммам для роста требуются источники азота и фосфора. Для получения азота расходуют аммиак и мочевину. В качестве источника фосфора они используют дигидрофосфат. Им также нужна сера и различные металлы, такие как магний, для оптимального роста.
Этот организм осуществляет наиболее распространенный тип брожения. Он имеет форму от круглой до яйцевидной и размножается почкованием (1, 2). Клетки дрожжей могут расти в гаплоидной и диплоидной формах. Гаплоидные клетки указывают на простой жизненный цикл митоза, который в стрессовых условиях погибает. Диплоидные клетки, как и гаплоидные, демонстрируют жизненный цикл митоза, но в условиях сильного стресса вступают в жизненный цикл мейоза и производят четыре гаплоидные споры. Их время удвоения составляет примерно 90 мин (3–6). S. cerevisiae может расти в аэробных и анаэробных условиях. Его способность использовать разные сахара зависит от того, как он растет. Если он растет аэробно, галактоза и фруктоза являются лучшими сахарами для брожения. Всем штаммам для роста требуются источники азота и фосфора. Для получения азота расходуют аммиак и мочевину. В качестве источника фосфора они используют дигидрофосфат. Им также нужна сера и различные металлы, такие как магний, для оптимального роста. Из-за гендерной дифференциации дрожжевые клетки имеют два типа спаривания: а и α. Две гаплоидные дрожжевые клетки разных типов могут спариваться друг с другом. В этой ситуации спаривание приводит к генетической рекомбинации. Почти все дрожжи имеют почки. По мере роста клеток почки тоже растут, пока не станут зрелыми. Затем они расходятся и оставляют своих родителей (7). 9Клетка дрожжей 0011 S. cerevisiae может использоваться в качестве эффективного носителя благодаря своим пищевым характеристикам и низкой стоимости. S. cerevisiae состоит из внешней толстой клеточной стенки, состоящей из бета-глюкановой сети и небольшого количества хитина, связанного со слоем маннопротеина. Эти свойства клеточной стенки заставляют дрожжевую клетку быть носителем типа замедленного высвобождения. Механическая прочность структур дрожжей позволяет им нагружать различные активные вещества (8–10). Было проведено несколько экспериментов в различных условиях, чтобы улучшить количество и размеры дрожжевых клеток для использования в качестве носителей.
Из-за гендерной дифференциации дрожжевые клетки имеют два типа спаривания: а и α. Две гаплоидные дрожжевые клетки разных типов могут спариваться друг с другом. В этой ситуации спаривание приводит к генетической рекомбинации. Почти все дрожжи имеют почки. По мере роста клеток почки тоже растут, пока не станут зрелыми. Затем они расходятся и оставляют своих родителей (7). 9Клетка дрожжей 0011 S. cerevisiae может использоваться в качестве эффективного носителя благодаря своим пищевым характеристикам и низкой стоимости. S. cerevisiae состоит из внешней толстой клеточной стенки, состоящей из бета-глюкановой сети и небольшого количества хитина, связанного со слоем маннопротеина. Эти свойства клеточной стенки заставляют дрожжевую клетку быть носителем типа замедленного высвобождения. Механическая прочность структур дрожжей позволяет им нагружать различные активные вещества (8–10). Было проведено несколько экспериментов в различных условиях, чтобы улучшить количество и размеры дрожжевых клеток для использования в качестве носителей. Многие кривые роста применялись для моделирования биологического роста. Уравнение логистического роста является наиболее известной и эффективной моделью. Различные расширенные уравнения роста исходят из этой модели в соответствии с ее ограничениями и ограничениями. Уравнение роста Ричарда — одна из расширенных моделей, которая показала наибольшую корреляцию с нашими данными (11–15).
Многие кривые роста применялись для моделирования биологического роста. Уравнение логистического роста является наиболее известной и эффективной моделью. Различные расширенные уравнения роста исходят из этой модели в соответствии с ее ограничениями и ограничениями. Уравнение роста Ричарда — одна из расширенных моделей, которая показала наибольшую корреляцию с нашими данными (11–15).
2.1. Культура дрожжевых клеток
S. cerevisiae была предоставлена промышленной исследовательской организацией, Тегеран, PTCC 5269. Для культивирования дрожжевых клеток использовали биореактор (Winpact, серия FS-01-A (сосуд с двойной рубашкой)). Был применен биореактор, чтобы создать наилучшие условия окружающей среды для роста дрожжей. Он состоял из трех частей: контроллера, газосмесителя и газоанализатора. Сосуд биореактора (3 литра) заполняли 2 литрами синтетической питательной среды (10 г KH 2 PO 4 , 4 г (NH 4 ) 2 SO 4 , 0,8 г MgSO 4 , 2 г дрожжевого экстракта, 10 г глюкозы) (Merck). В сосуд добавляли 3 мл Взвесь дрожжевых клеток (10 8 КОЕ/мл) в физиологической сыворотке. Температуру устанавливали на уровне 30°С и перемешивали культуральную среду со скоростью 200 об/мин. Биореактор содержит сосуд с двойной рубашкой. Вода, циркулирующая вокруг сосуда между двумя рубашками, помогает культуральной среде поддерживать свою температуру. Температура воды, циркулирующей вокруг рубашки, должна быть на 10–15 °С ниже температуры синтетической питательной среды. Ранее рост S. cerevisiae был оптимизирован (16). В настоящем исследовании изучалось влияние двух параметров синтетической среды (pH и процентного содержания растворенного кислорода (DO)) в девяти ситуациях на скорость роста S. cerevisiae . рН культуральной среды доводили до 4, 5 и 6 с помощью 1М HCl, а процентное содержание DO доводили до 5, 10 и 15% с помощью газовой мешалки.
В сосуд добавляли 3 мл Взвесь дрожжевых клеток (10 8 КОЕ/мл) в физиологической сыворотке. Температуру устанавливали на уровне 30°С и перемешивали культуральную среду со скоростью 200 об/мин. Биореактор содержит сосуд с двойной рубашкой. Вода, циркулирующая вокруг сосуда между двумя рубашками, помогает культуральной среде поддерживать свою температуру. Температура воды, циркулирующей вокруг рубашки, должна быть на 10–15 °С ниже температуры синтетической питательной среды. Ранее рост S. cerevisiae был оптимизирован (16). В настоящем исследовании изучалось влияние двух параметров синтетической среды (pH и процентного содержания растворенного кислорода (DO)) в девяти ситуациях на скорость роста S. cerevisiae . рН культуральной среды доводили до 4, 5 и 6 с помощью 1М HCl, а процентное содержание DO доводили до 5, 10 и 15% с помощью газовой мешалки.
2.2. Определение кривых роста дрожжевых клеток
Рост дрожжевых клеток в каждом состоянии определяли путем подсчета колоний на четвертом разведенном планшете с помощью счетчика колоний (аколит (симбиоз)). Один миллилитр питательной среды был разбавлен примерно на 10 -1 раз с физиологической сывороткой четыре раза, и разведения вносили в четыре отдельных планшета с TSA. Кроме того, было получено поглощение образцов культуральной среды в УФ/видимом диапазоне (CECIL 9000) при 600 нм за период от 0 до 13 часов, чтобы построить общую кривую роста микроорганизмов, состоящую из лаг-, логарифмической, стационарной и убывающей фаз. Модели роста дрожжевых клеток и скорость роста оценивали с помощью математического программного обеспечения Matlab.
Один миллилитр питательной среды был разбавлен примерно на 10 -1 раз с физиологической сывороткой четыре раза, и разведения вносили в четыре отдельных планшета с TSA. Кроме того, было получено поглощение образцов культуральной среды в УФ/видимом диапазоне (CECIL 9000) при 600 нм за период от 0 до 13 часов, чтобы построить общую кривую роста микроорганизмов, состоящую из лаг-, логарифмической, стационарной и убывающей фаз. Модели роста дрожжевых клеток и скорость роста оценивали с помощью математического программного обеспечения Matlab.
2.3. Определение размера дрожжевых клеток
Размер дрожжевых клеток в логарифмической фазе измеряли каждый час в течение 10 часов с помощью световой микроскопии и определяли средний размер. Если дрожжевая клетка используется в качестве носителя для загрузки активных материалов, ее размер должен быть достаточно подходящим.
2.4. Изображения SEM
Сканирующая электронная микроскопия (Oxford Company, S-360) была использована для изучения морфологической формы дрожжевых клеток при pH=4 и DO 5%. Клетки заливали в парафин, делали срезы, депарафинировали и напыляли золотом.
Клетки заливали в парафин, делали срезы, депарафинировали и напыляли золотом.
3.1. Определение роста дрожжевых клеток
Кривые роста дрожжевых клеток изучали в девяти ситуациях (3 различных значения pH × 3 различных процента DO) (–). Математическое программное обеспечение Matlab было использовано для составления уравнения для описания характера роста дрожжевых клеток на основе подсчета колоний (КОЕ/мл × 10 9 ).0207 8 ) (ось Y) в зависимости от времени (ч) (ось X) при pH=4 и DO 5%, что было лучшим условием. Кривая роста дрожжевых клеток (pH=4 и DO5%), основанная на подсчете колоний, была приведена в соответствие с уравнением Ричарда для оценки максимальной скорости роста (). Оси Y и X показали максимальную скорость роста и время (ч) соответственно.
Открыть в отдельном окне
Кривые роста Saccharomyces cerevisiae на основе подсчета колоний
Открыть в отдельном окне
Кривые роста Saccharomyces cerevisiae на основе поглощения УФ/видимого света
Открыть в отдельном окне
Кривая скорости роста Saccharomyces cerevisiae при pH=4 и DO5%
3.
 2. Определение размера дрожжевых клеток
2. Определение размера дрожжевых клетокСветовую микроскопию применяли для измерения среднего размера дрожжевых клеток в условиях pH=4 и DO 5%, ():
Открыть в отдельном окне
Изображение Saccharomyces cerevisiae, полученное с помощью световой микроскопии при pH=4 и DO5%
3.3. СЭМ-изображения
СЭМ-изображение дрожжевых клеток в условиях pH=4 и DO 5% показано на рис.
Открыть в отдельном окне
СЭМ-изображение Saccharomyces cerevisiae при pH=4 и DO 5%
В настоящее время рассматривается вопрос о внедрении безопасных и эффективных носителей. Носители очень желательны, когда они натуральные и их производство стоит недорого. Эффективный носитель должен иметь надлежащую грузоподъемность. Конструктивно он также должен иметь возможность хорошо контролировать высвобождение активных ингредиентов. 9Клетки дрожжей 0011 Saccharomyces cerevisiae в качестве носителей обладают всеми упомянутыми выше преимуществами. С этим транспортным средством нет необходимости покупать дорогие ингредиенты синтетического носителя (10). Предоставив подходящую культуральную среду, можно получить миллионы дрожжей для использования в качестве носителей. Культуральная среда должна создавать наилучшие условия для роста дрожжей, чтобы наилучшим образом загрузить активные вещества. Чтобы обеспечить подходящую нагрузочную способность и однородность клеточной стенки, был оптимизирован рост дрожжевых клеток. pH и процент DO – это два параметра, которые были оптимизированы, чтобы обеспечить наилучшую ситуацию для чрезмерного роста дрожжей. Было изучено несколько математических уравнений и программного обеспечения, чтобы объяснить процесс роста дрожжей. Среди этих уравнений и программного обеспечения для наших данных подходили уравнение роста Ричарда и математическое программное обеспечение Matlab. Изучен рост клеток дрожжей в различных условиях (–). Было доказано, что pH=4 и DO 5% обеспечивают наилучшие условия для размножения и роста дрожжевых клеток.
С этим транспортным средством нет необходимости покупать дорогие ингредиенты синтетического носителя (10). Предоставив подходящую культуральную среду, можно получить миллионы дрожжей для использования в качестве носителей. Культуральная среда должна создавать наилучшие условия для роста дрожжей, чтобы наилучшим образом загрузить активные вещества. Чтобы обеспечить подходящую нагрузочную способность и однородность клеточной стенки, был оптимизирован рост дрожжевых клеток. pH и процент DO – это два параметра, которые были оптимизированы, чтобы обеспечить наилучшую ситуацию для чрезмерного роста дрожжей. Было изучено несколько математических уравнений и программного обеспечения, чтобы объяснить процесс роста дрожжей. Среди этих уравнений и программного обеспечения для наших данных подходили уравнение роста Ричарда и математическое программное обеспечение Matlab. Изучен рост клеток дрожжей в различных условиях (–). Было доказано, что pH=4 и DO 5% обеспечивают наилучшие условия для размножения и роста дрожжевых клеток. Это условие улучшило не только размножение и рост дрожжевых клеток, но и их размер в качестве носителей. В этой ситуации кривая роста показала короткую лаг-фазу (два часа). Логарифмическая фаза имела самый крутой наклон и продолжалась семь часов. В конце логарифмической фазы количество дрожжевых клеток достигало 1,2 × 109.что было максимальным количеством воспроизводства. Поглощение УФ/видимого света при 600 нм также подтвердило результаты, и оно было максимальным, около 1, в конце логарифмической фазы. Были исследованы сравнения различных параметров, влияющих на рост дрожжевых клеток. Результаты показали, что дрожжевые клетки могут лучше воспроизводиться при более низком pH и процентном DO. При трех разных процентных соотношениях DO при снижении кислотности цикл роста уменьшался. Лучший рост в условиях повышенной кислотности может быть связан с метаболитом этанола дрожжевых клеток. Кислота нейтрализовала этанол, вырабатываемый клетками дрожжей, и позволила им продолжить свой рост. Более высокий процент DO, так же как и более высокий pH, предотвращает рост дрожжевых клеток из-за окисления этанола, что является мощным профилактическим фактором роста (17–19).
Это условие улучшило не только размножение и рост дрожжевых клеток, но и их размер в качестве носителей. В этой ситуации кривая роста показала короткую лаг-фазу (два часа). Логарифмическая фаза имела самый крутой наклон и продолжалась семь часов. В конце логарифмической фазы количество дрожжевых клеток достигало 1,2 × 109.что было максимальным количеством воспроизводства. Поглощение УФ/видимого света при 600 нм также подтвердило результаты, и оно было максимальным, около 1, в конце логарифмической фазы. Были исследованы сравнения различных параметров, влияющих на рост дрожжевых клеток. Результаты показали, что дрожжевые клетки могут лучше воспроизводиться при более низком pH и процентном DO. При трех разных процентных соотношениях DO при снижении кислотности цикл роста уменьшался. Лучший рост в условиях повышенной кислотности может быть связан с метаболитом этанола дрожжевых клеток. Кислота нейтрализовала этанол, вырабатываемый клетками дрожжей, и позволила им продолжить свой рост. Более высокий процент DO, так же как и более высокий pH, предотвращает рост дрожжевых клеток из-за окисления этанола, что является мощным профилактическим фактором роста (17–19).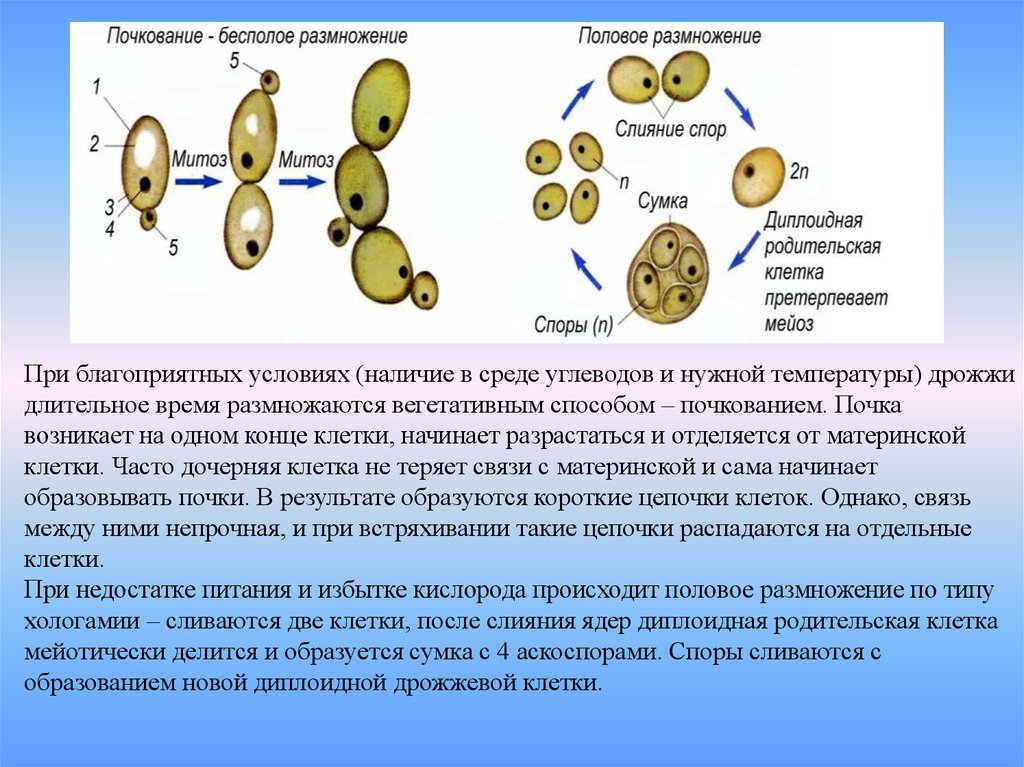 ). Как показано на кривых, рост DO улучшился на 10%, но когда результаты были подогнаны с помощью программного обеспечения Matlab и уравнения Ричарда, это вводящее в заблуждение улучшение было отклонено. Программное обеспечение Matlab оценило наилучшее уравнение для описания модели роста в каждой ситуации. На первом этапе цикла роста клеток дрожжей абсорбция изменялась больше, чем число клеток дрожжей. В этой ситуации сначала количество дрожжевых клеток было постоянным, и продолжали расти только дрожжи и возникшие из них почки. Таким образом, абсорбция увеличивалась без увеличения количества дрожжевых клеток. Среди различных ветвей обобщенных логистических уравнений уравнение Ричарда () лучше всего соответствовало результатам с максимальным коэффициентом корреляции для расчета максимальной скорости роста в каждой ситуации. Клетки дрожжей достигли наибольшей скорости роста (3,309) в условиях pH=4 и DO 5%. В этом состоянии было получено самое продолжительное время фазы роста (7,8 часа). Размер дрожжевых клеток в этих условиях (pH = 4 и DO 5%) был оценен с помощью программного обеспечения для световой микроскопии примерно в 2 × 3 мкм ().
). Как показано на кривых, рост DO улучшился на 10%, но когда результаты были подогнаны с помощью программного обеспечения Matlab и уравнения Ричарда, это вводящее в заблуждение улучшение было отклонено. Программное обеспечение Matlab оценило наилучшее уравнение для описания модели роста в каждой ситуации. На первом этапе цикла роста клеток дрожжей абсорбция изменялась больше, чем число клеток дрожжей. В этой ситуации сначала количество дрожжевых клеток было постоянным, и продолжали расти только дрожжи и возникшие из них почки. Таким образом, абсорбция увеличивалась без увеличения количества дрожжевых клеток. Среди различных ветвей обобщенных логистических уравнений уравнение Ричарда () лучше всего соответствовало результатам с максимальным коэффициентом корреляции для расчета максимальной скорости роста в каждой ситуации. Клетки дрожжей достигли наибольшей скорости роста (3,309) в условиях pH=4 и DO 5%. В этом состоянии было получено самое продолжительное время фазы роста (7,8 часа). Размер дрожжевых клеток в этих условиях (pH = 4 и DO 5%) был оценен с помощью программного обеспечения для световой микроскопии примерно в 2 × 3 мкм (). Опять же, в этом состоянии из всех других мы обнаружили самый большой размер дрожжевой клетки для использования в качестве носителя при загрузке активных материалов. Снимки СЭМ также подтвердили структурную однородность дрожжевых клеток как носителей и объем, который окружен клеточной стенкой ().
Опять же, в этом состоянии из всех других мы обнаружили самый большой размер дрожжевой клетки для использования в качестве носителя при загрузке активных материалов. Снимки СЭМ также подтвердили структурную однородность дрожжевых клеток как носителей и объем, который окружен клеточной стенкой ().
Согласно результатам, условия (pH=4 и DO 5%) являются лучшими условиями роста для Saccharomyces cerevisiae , чтобы иметь наилучшие морфологические свойства. Важность этих результатов заключается в том, что эти дрожжи можно рассматривать как эффективный и доступный носитель. Предполагается, что в будущих исследованиях различные активные ингредиенты будут инкапсулированы в дрожжи в качестве носителей и изучены их эффективность и стабильность.
Эта работа была поддержана грантом Школы фармации, Школы персидской и комплементарной медицины и вице-канцлера по исследованиям в Мешхедском университете медицинских наук.
Проверка iThenticate: 28 августа 2016 г., редактирование на английском языке: 10 октября 2016 г. , контроль качества: 28 ноября 2016 г.
, контроль качества: 28 ноября 2016 г.
Вклад авторов:
Оба автора внесли одинаковый вклад в этот проект и в статью. Оба автора прочитали и одобрили окончательный вариант рукописи.
1. Фельдман Х. Дрожжи: молекулярная и клеточная биология. Уайли-Блэквелл; 2010. [Google Академия]
2. Walker LJ, Aldhous MC, Drummond HE, Smith BR, Nimmo ER, Arnott ID, et al. Антитела к Saccharomyces cerevisiae (ASCA) при болезни Крона связаны с тяжестью заболевания, но не с мутациями NOD2/CARD15. Клин Эксп Иммунол. 2004;135(3):490–6. doi: 10.1111/j.1365-2249.2003.02392.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Фридман Н. Хроники лаборатории Фридмана. Выращивание дрожжей (роботизированное) Nir Friedman Lab. 2011 [Google Scholar]
4. Херсковиц И. Жизненный цикл почкующихся дрожжей Saccharomyces cerevisiae. Микробиол Ред. 1988;52(4):536–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Kaeberlein M, Powers RW, Steffen KK, Westman EA, Hu D, Dang N, et al.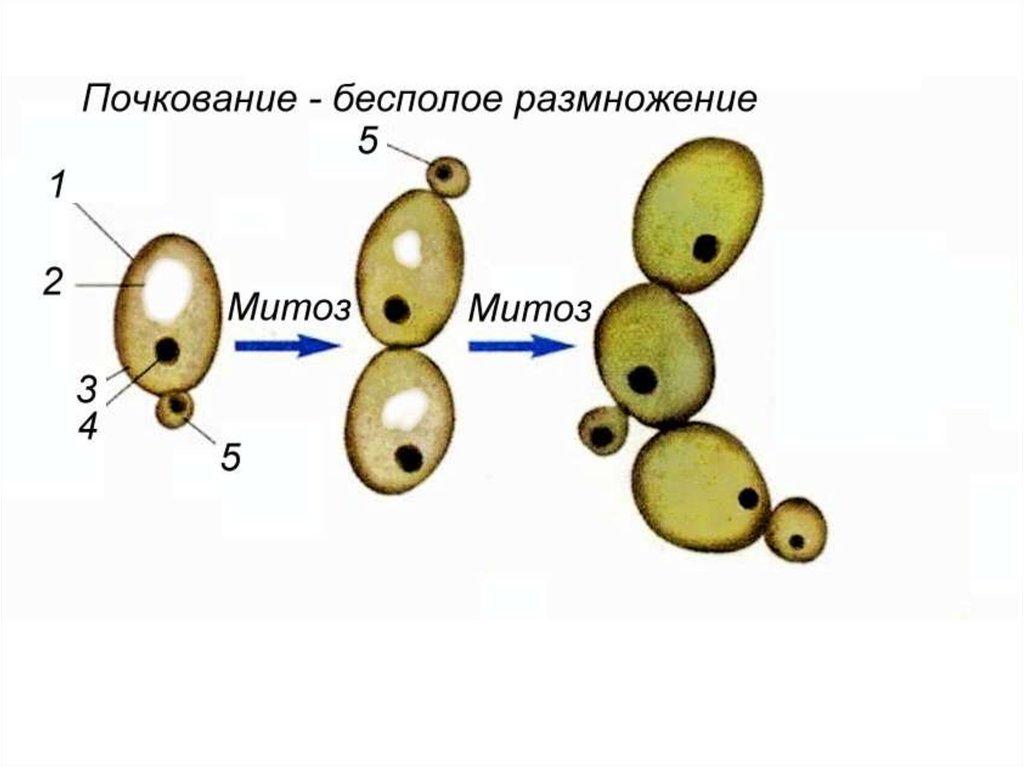 Регуляция продолжительности репликативной жизни дрожжей с помощью TOR и Sch9 в ответ на питательные вещества. Наука. 2005;310(5751):1193–6. doi: 10.1126/science.1115535. [PubMed] [CrossRef] [Google Scholar]
Регуляция продолжительности репликативной жизни дрожжей с помощью TOR и Sch9 в ответ на питательные вещества. Наука. 2005;310(5751):1193–6. doi: 10.1126/science.1115535. [PubMed] [CrossRef] [Google Scholar]
6. Kaeberlein M. Уроки долголетия почкующихся дрожжей. Природа. 2010;464(7288):513–9. doi: 10.1038/nature08981. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Kraft P, Pharoah P, Chanock SJ, Albanes D, Kolonel LN, Hayes RB, et al. Генетическая изменчивость гена HSD17B1 и риск развития рака предстательной железы. Генетика PLoS. 2005;1(5):68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. De Nobel JG, Klis FM, Munnik T, Priem J, Van Den Ende H. Анализ относительной пористости клеточных стенок Saccharomyces cerevisiae, Kluveromyces lactis и Schizosaccharomyces помбе. Дрожжи. 1990;6(6):483–90. doi: 10.1002/yea.320060605. [PubMed] [CrossRef] [Академия Google]
9. Садеги Ф., Тораб М., Хаттаб М., Хомаюни А., Афрасиаби Гарекани Х. Улучшение физико-механических свойств частично аморфного ацетаминофена, полученного из водно-спиртового раствора с использованием метода распылительной сушки.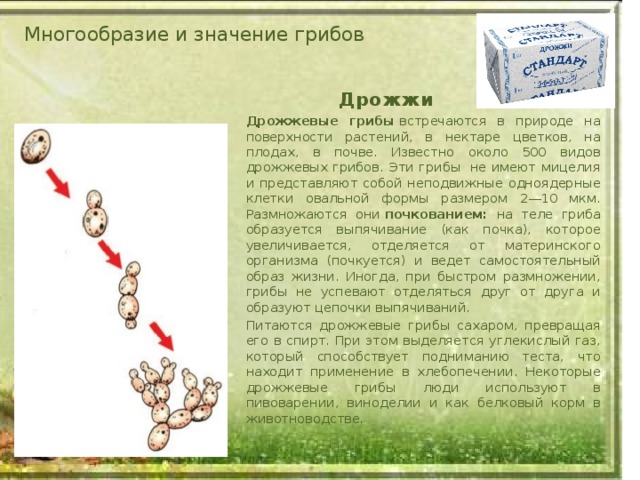 Иран J Basic Med Sci. 2013;16(10):1100–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Иран J Basic Med Sci. 2013;16(10):1100–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Shi G, Rao L, Yu H, Xiang H, Pen G, Long S, et al. Микрокапсулирование хлорогеновой кислоты в качестве водорастворимого антиоксиданта на основе клеток дрожжей. Дж Фуд Инж. 2007;80(4):1060–7. doi: 10.1016/j.jfoodeng.2006.06.038. [Перекрестная ссылка] [Академия Google]
11. Буис Р. Об обобщении логистического закона роста. Acta Biotheoretica. 1991;39(3):185–95. doi: 10.1007/BF00114174. [CrossRef] [Google Scholar]
12. Марчетти С., Накиченович Н. Динамика энергетических систем и модель логистического замещения. Int Inst для Appl Sys; Лаксенбург, Австрия: 1980. [Google Scholar]
13. Nelder JA. Подгонка обобщения логистической кривой. Биометрия. 1961; 17: 89–110. дои: 10.2307/2527498. [Перекрестная ссылка] [Академия Google]
14. Цуларис А., Уоллес Дж. Анализ моделей логистического роста. Математические бионауки. 2002;179(1):21–55. [PubMed] [Google Scholar]
15. Тернер М.Э., мл., Блуменштейн Б.А., Себо Дж.Л. Обобщение логистического закона роста. Биометрия. 1969; 25 (3): 577–80. дои: 10.2307/2528910. [PubMed] [CrossRef] [Google Scholar]
Тернер М.Э., мл., Блуменштейн Б.А., Себо Дж.Л. Обобщение логистического закона роста. Биометрия. 1969; 25 (3): 577–80. дои: 10.2307/2528910. [PubMed] [CrossRef] [Google Scholar]
16. Ричардс О.В. Рост дрожжей Saccharomyces cerevisiae. Энн Бот. 1928;42(1):271–83. [Google Scholar]
17. Серрано Р., Мартин Х., Касамайор А., Ариньо Дж. Сигнализация щелочного стресса pH у дрожжей Saccharomyces cerevisiae через сенсор клеточной поверхности Wsc1 и путь Slt2 MAPK. Дж. Биол. Хим. 2006;281(52):39785–95. doi: 10.1074/jbc.M604497200. [PubMed] [CrossRef] [Google Scholar]
18. Салари Р., Фазли Баззаз Б.С., Раджаби О., Хашьярманеш З. Новые аспекты Saccharomyces cerevisiae как нового носителя берберина. ДАРУ. 2013;21:73. doi: 10.1186/2008-2231-21-73. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Салари Р., Раджаби О., Хашьярманеш З., Фатхи Наджафи М., Фазли Баззаз Б.С. Характеристика инкапсулированного берберина в клетках дрожжей Saccharomyces cerevisiae.