Эффективность метформина у больных с метаболическим синдромоми неалкогольной жировой болезнью печени | Бутрова
1. Богомолов П.О., Шульпекова Ю.О. Неалкогольная жировая болезнь печени: стеатоз и неалкогольный стеатогепатит. // Клинические перспективы в гастроэнтерологии, гепатологии. — 2004. — №3. — С.20-26.
2. Болезни печени и желчевыводящих путей: Руководство для врачей под ред. В.Т. Ивашкина. / 2-е изд. -М.: «М-Вести» 2005; с- 536.
3. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. — М., 2002.
4. Adams L.A., Angulo P. Treatment of non-alcoholic fatty liver disease. Postgraduate medical Journal. 2006; 82; 315-322.
5. Ahmed M. H., Byrne C.D. Non-alcoholic steatohepatitis. // In The Metabolic syn- drome. Ed. by Byrn C.D. and Wild S.H., 2005; 279-303.
6. Alba L. M., Lindor, K. Review article: non-alcoholic fatty liver disease. Aliment. Pharmacol. Ther. 2003; 17 (8): 977- 986.
7. Baily CI, Turner RC. Metformin. N Engl. J. Med. 1996; 334: 574-79.
Metformin. N Engl. J. Med. 1996; 334: 574-79.
8. Carr DB, Utzschneider KM, Hull RL et al. Intra- abdominal fat is a major determi- nant of the National Cholesterol Education Program Adult Treatment Panel III cri- teria for the metabolic syndrome. Diabetes 2004; 53: 2087-94
9. Cortez-Pinto H., Camilo M.E., Baptista A., De Oliveira A.G., De Moura M.C. Non- alcoholic fatty liver: another feature of the metabolic syndrome? Clin Nutr., 1999; 18(6): 353-358.
10. Fassio E, Alvarez E, Dominguez N, et al. Natural history of nonalcoholic steato- hepatitis: a longitudinal study of liver biopsies. Hepatology 2004; 40: 820-6.
11. Houmard JA, Tanner CJ, Slentz CA, et al. Effect of the volume and intensity of exercise training on insulin sensitivity. J Appl Physiol 2004; 96:101-6.
12. Lam TK, Carpentier A, Lewis GF, van de Werve G, Fantus IG, Giacca A Mechanisms of the fatty acid-induced increase in hepatic glucose production. Am J Physiol Endocrinol Metab 2003; 284: 863-73.
13. Lin, H. Z., Yang, S. Q., Chuckaree, C, Kuhajda, F., Ronnet, G., Diehl, A. M. Metformin reverses fatty liver disease in obese, leptin-deficient mice. Nat. Med., 2000; 6 (9): 998-1003.
14. Marchesini, G., Brizi, M., Morselli-Labate, A. M., Bianchi, G., Bugianesi, E., McCullough, A. J., Forlani, G., Melchionda, N. Association of nonalcoholic fatty liver disease with insulin resistance. Am. J. Med., 1999 ;107 (5): 450-455.
15. Marchesini, G., Brizi, M., Bianchi, G., Tomassetti, S., Zoli, M., Melchionda, N. Metformin in non-alcoholic steatohepatitis. Lancet, 2001; 358 (9285): 893-894.
16. Medina J., Ferdandez-Salazar L.I., Garcia-Buey L., Moreno-Otero R. Approach to the pathogenesis and treatment of nonalcoholic steatohepatitis. Diabetes Care. 2004; 27: 2057-2066.
17. Moghetti P, Castello R, Negry C, et al. Metformin effects on clinical features, endocrine and metabolic profiles, and insulin sensitivity in polycystic ovary syn- drome: a randomized, double- blind, placebo-controlled 6- month trial, fol-lowed by open, long- term clinical evalution. J. Clin. Endocrinol. Metab. 2000; 85:139-46.
J. Clin. Endocrinol. Metab. 2000; 85:139-46.
18. Nair S, Diehl AM, Wiseman M, et al. Metformin in the triement of non- alcoholic steatohepatitis: a pilot open label trial. Aliment Pharmacol Ther 2004; 20: 23-8.
19. Palmer M, Schaffner F. Effect of weight reduction on hepatic abnormalities in overweight patients. Gastroenterology 1990; 99: 1408-13.
20. Scheen, A. J., Luyckx, F. H. Nonalcoholic steatohepatitis and insulin resistance: interface between gastroenterologists and endocrinologists., Acta Clin. Belg., 2003;58 (2): 81-91.
21. Sheth, S. G., Gordon, F. D., Chopra, S. Nonalcoholic steatohepatitis., Ann. Intern. Med., 1997; 126(2): 137-145.
22. Tiikkainen M, Hakkinen AM, Korsheninnikova E et al. Effects of rosiglitazone and metformin on liver fat content, hepatic insulin resistance, insulin clearance, and gene expression in adipose tissue in patients with type 2 diabetes. Diabetes 2004; 53: 2169-76.
23. Uygun A, Kadayifci A, Yesilova Z et al. Serum leptin levels in patients with nonal- coholic steatohepatitis. Am J Gastroenterol 2000; 95: 3584-3589.
Am J Gastroenterol 2000; 95: 3584-3589.
24. Uygun A., Kadayifci A., Isik А. Т., Ozgurtas, Т., Deveci S., Tuzun A., Yesilova Z., Gulsen M., Dagalp K. Metformin in the treatment of patients with non-alcoholic steatohepatitis., Aliment. Pharmacol. Ther., 2004;19 (5): 537-544.
Влияние Метформина на формирование устойчивого вирусологического ответа
О.О. Хафисова, Т.С. Поликарпова, Н.В. Мазурчик, П.П. Огурцов
Кафедра госпитальной терапии
Медицинский факультет
Российский университет дружбы народов
Хронические вирусные поражения печени являются одной из главных причин роста смертности населения в РФ и за рубежом от цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК). В настоящее время, в качестве весьма значимого прогностического фактора снижения эффективности противовирусной терапии (ПВТ) при хроническом гепатите «С» (ХГС), особый интерес представляет инсулинорезистентность (ИР).
Опубликовано в журнале «Вестник РУДН», Серия Медицина 2011, № 2
О.О. Хафисова, Т.С. Поликарпова, Н.В. Мазурчик, П.П. Огурцов
Медицинский факультет
Российский университет дружбы народов
ул. Трофимова, 26, стр. 2, городская больница, Москва, Россия, 115432
Опубликовано в журнале «Вестник РУДН», Серия Медицина 2011, № 2
Хронические вирусные поражения печени являются одной из главных причин роста смертности населения в РФ и за рубежом от цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК). В настоящее время, в качестве весьма значимого прогностического фактора снижения эффективности противовирусной терапии (ПВТ) при хроническом гепатите «С» (ХГС), особый интерес представляет инсулинорезистентность (ИР).
Проанализировано 114 взрослых (старше 18 лет) пациентов с ХГС, впервые проходивших ПВТ ПегИФН 2b и рибавирином в Центре изучения печени медицинского факультета РУДН (РФ, Москва) в 2008—2010 гг.
Хронические вирусные поражения печени (в значительной степени хронический гепатит «С» (ХГС)) являются одной из главных причин роста смертности населения в РФ и в зарубежных странах от цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) [1, 2].
В настоящее время, в качестве весьма значимого прогностического фактора снижения эффективности противовирусной терапии (ПВТ) при ХГС, особый интерес представляет инсулинорезистентность (ИР) [3, 4, 5], определяемая индексом [6].
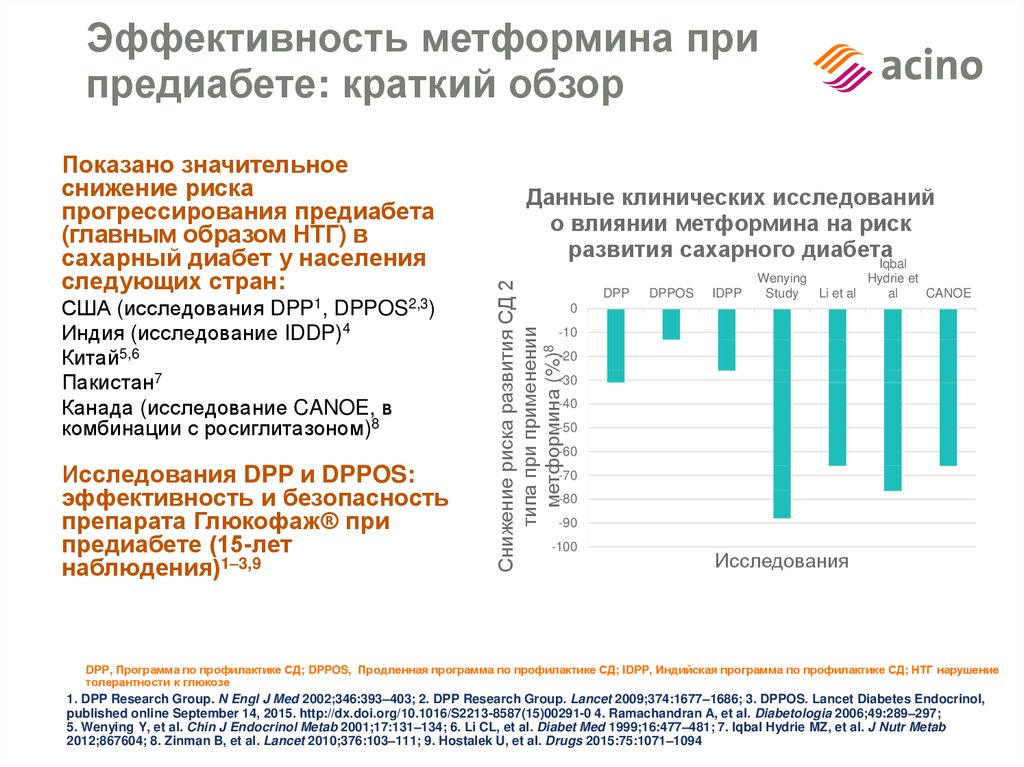
Закономерно предположить, что лечение ИР перед началом и/или во время терапии пегилированными интерферонами может повысить частоту устойчивого вирусологического ответа (УВО). Похудение (на фоне диеты, направленной на потерю 10% массы тела) перед началом лечения пегилированными интерферонами и рибавирином у 32 больных с 1-ым генотипом ХГС и метаболическим синдромом значительно уменьшило ИР и улучшило эффективность ПВТ [7].
M. Romero-Gomez и соавторы провели проспективное, многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование в 19 испанских больницах [9]. В исследование вошли 123 пациента с генотипом 1 вируса гепатита С (HCV-1) и инсулинорезистентностью (HOMA-IR более 2). Увеличение частоты УВО достоверно различалось у женщин, получающих метформин. Авторы заключили, что применение схемы ПегИнтерферон + рибавирин + метформин должно быть стандартом лечения у женщин с ХГС и инсулинорезистентностью, так как это значительно увеличит частоту достижения УВО. Также авторы сообщили о немаловажном факте хорошей переносимости пациентами этой трехкомпонентной терапии.
Таким образом, в настоящее время активно изучается применение метформина как новой составляющей терапии у пациентов с ХГС: когда начинать лечение метформином, как долго его проводить и в какой период — противовирусной терапии или совместно с ней.
Целью данного исследования явилось изучение частоты ИР у больных ХГС, с различной массой тела и в оценке влияния метформина (в дозе 20 мг/кг/сут. в течение всего курса комбинированной противовирусной терапии Пег-ИФН 2b и рибавирином ) на УВО у пациентов с хроническим гепатитом С при исходной инсулинорезистентности.
Материалы и методы. Нами проанализированы 114 взрослых пациентов старше 18 лет с ХГС, впервые проходивших ПВТ ПегИФН2b и рибавирином в Центре изучения печени медицинского факультета РУДН (РФ, Москва) в 2008—2010 гг. Из них исходно инсулинорезистентность (HOMA-индекс более 2) имели 59 пациентов.
Из исследования исключались больные со следующими дополнительными этиологическими факторами поражения печени: этаноловый и лекарственный фактор, коинфекция HBV, болезнь Вильсона—Коновалова, аутоиммунный гепатит, наследственный гемохроматоз. Исключались так же больные с ВИЧ-инфекцией, гипотиреозом и сахарным диабетом I и II типов, при этом концентрацию глюкозы крови натощак более 6,7 ммоль/л расценивали как сахарный диабет [14].
Пациенты, имевшие инсулинорезистентность, были поделены на 2 группы. В первую группу вошли 22 пациента с инсулинорезистентностью, но без нарушений углеводного обмена. Им назначался метформин в дозе 20 мг/кг/сут. с их информированного согласия, принимая во внимание безопасность применения метформина у лиц, проходящих ПВТ ХГС с нормальным углеводным обменом [9]. Метформин назначался либо одновременно с ПВТ, либо за 3—6 месяцев до начала ПВТ и далее в течение всего курса терапии. Пациенты второй (контрольной) группы метформин не получали (n = 37). Всем пациентам с ИР рекомендовалось оздоровление образа жизни, в том числе увеличение физической активности и снижение массы тела, низкокалорийная диета.
Обследование пациентов включило в себя определение роста, веса, расчет индекса массы тела (ИМТ) в кг/м2, проведение общего и биохимического анализа крови. Концентрацию HCV-РНК определяли с помощью количественной полимеразной цепной реакции (с использованием Cobas Amplicor HCV Monitor, версия 2.0 фирмы Roche, США, порог чувствительности — 43-6,9х10*7 МЕ [15] до начала лечения и далее — через 4 и 12 недель. Если при этом вирусная РНК не обнаруживалась, для подтверждения ее исчезновения из крови использовали качественный тест (с использованием Amplicor фирмы Roche, порог чувствительности — 50 МЕ) [16]. Всем пациентам, вошедшим в исследование, проводилось исследование уровня инсулина и глюкозы в сыворотке крови натощак и оценка инсулинорезистентности с применением HOMA-индекса, который рассчитывался по формуле:
ИР диагностировалась при индексе HOMA > 2 [6]. Всем больным проводилась терапия ПегИФН 2b в дозе 1,5 мкг/кг массы тела/неделю и рибавирином в дозе 15 мг/кг массы тела/сутки.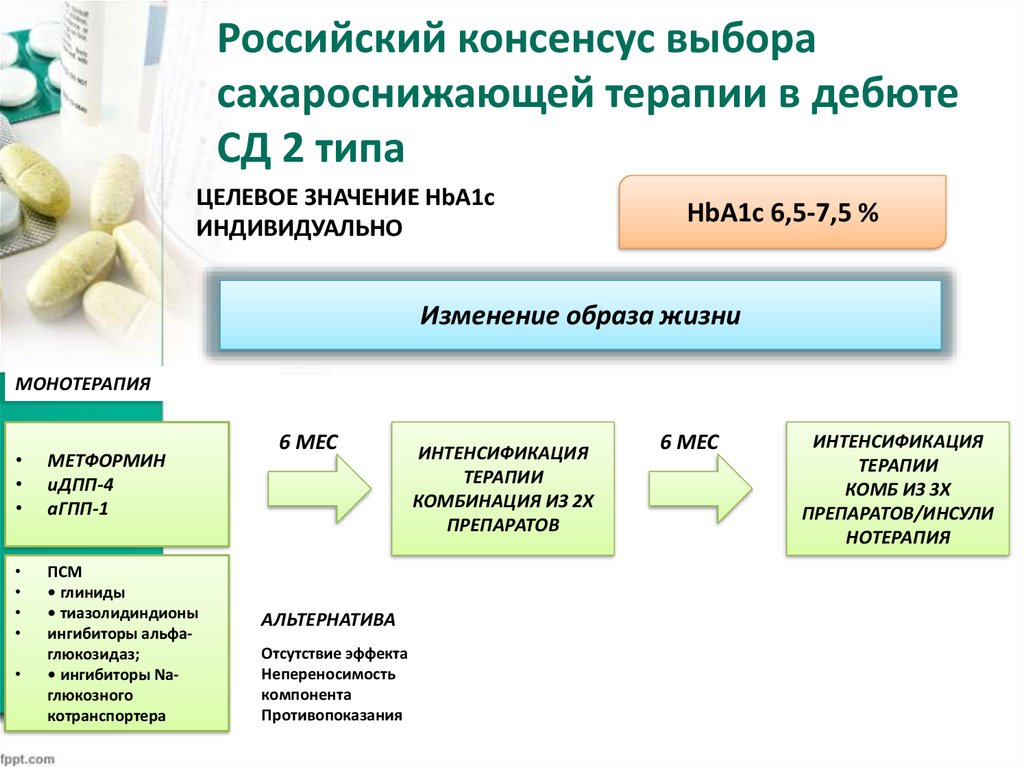
Статистический анализ проводился с помощью программы Statistica версии 6,0 для Windows.
Результаты. Из 114 больных с ХГС инсулинорезистентность имелась у 59 (51,7%) человек, из них 34 пациента с ХГС HCV-1 и 25 пациентов с ХГС HCV-2/3.
Среди пациентов с ХГС, с HOMA-IR 2, артериальная гипертензия (АД 140/90 мм рт. ст.) встречалась у 20% (n = 12), повышенная масса тела (ИМТ > > 25 кг/м2) — у 52% (n = 30), гепатомегалия — у 56% (n = 33), гипергликемия натощак — у 41% (n = 24), гиперхолестеринемия — у 29% (n = 17), высокая вирусная нагрузка — у 42% (n = 25), HOMA-IR от 2—4 у 64% (n = 38), HOMA-IR 4 у 36% (n = 21). Среди пациентов с ХГС, с HOMA-IR < 2, артериальная гипертензия (АД 140/90 мм рт. ст.) встречалась у 14% (n = 8), повышенная масса тела (ИМТ > 25 кг/м2) — у 49% (n = 26), гепатомегалия — у 51% (n = 28), гипергликемия натощак — у 37% (n = 20), гиперхолестеринемия — у 27% (n = 15), высокая вирусная нагрузка — у 38% (n = 21).
Основные клинико-лабораторные показатели представлены в табл. 1 и на рис. 1.
Таблица 1
Сравнительная характеристика больных ХГС с исходной ИР, получающих и не получающих метформин в дозе 20 мг/кг/сут.
Рис. 1. Клинико-лабораторная характеристика пациентов
с ХГС в зависимости от уровня HOMA-IR
В группе пациентов, получавших метформин (группа 1) в течение ПВТ, доля достигших УВО составила 95% (21 из 22), тогда как в группе пациентов, не получавших метформин (группа 2), число достигших УВО составило лишь 43% (16 из 37), p = 0,0001.
Частота достижения УВО отдельно анализировалась в данных группах также в зависимости от генотипа HCV. Так, пациенты с 1-ым генотипом HCV, получающие метформин, достигли УВО в 89% случаев (8 из 9), а пациенты с 1-ым генотипом HCV, не получающие метформин, лишь в 60% (15 из 25), p = 0,0001. Пациенты с 2/3 генотипом HCV, получающие метформин, достигли УВО в 100% (13 из 13), в то время как пациенты, не получающие метформин, — в 84% (10 из 12), p = 0,0001 (рис.
Рис. 2. Доля пациентов, достигших УВО в группах сравнения (получавшие и не получавшие метформин), в зависимости от генотипа HCV
Среди пациентов с HCV-1, получающих метформин и достигших УВО, у 88% (7 из 8) пациентов определялась низкая вирусная нагрузка (более 600 000 МЕ), а среди пациентов с HCV-1, не получающих метформин, достигших УВО, — у 80% (12 из 15) определялась низкая вирусная нагрузка (более 600 000 МЕ), p = 0,88.
Пациенты обеих групп были разделены на подгруппы в зависимости от массы тела. Итак, среди пациентов, получающих метформин (n = 22), было 13 человек с ИМТ > 25кг/м2 и 9 человек с нормальной массой тела (ИМТ 25 кг/м2), а среди пациентов, не получающих метформин (n = 37), было 24 человека с повышенной массой тела и 13 человек с нормальной массой тела. Пациенты в первой группе (получавшие метформин) с повышенной массой тела достигли УВО в 77% (10 из 13), тогда как пациенты второй группы (без метформина) с повышенной массой тела достигли УВО лишь в 34% (8 из 24), p = 0,0001. Пациенты с нормальной массой тела, получавшие метформин, достигли УВО в 100% (9 из 9), тогда как пациенты с нормальной массой тела, не получавшие метформин, — в 46% (6 из 13), p = 0,0001 (рис. 3).
Пациенты с нормальной массой тела, получавшие метформин, достигли УВО в 100% (9 из 9), тогда как пациенты с нормальной массой тела, не получавшие метформин, — в 46% (6 из 13), p = 0,0001 (рис. 3).
Стоит отметить, что статистически масса тела при применении метформина в обеих подгруппах снижалась в одинаковой пропорции. В группе пациентов, получающих метформин, средний уровень массы тела до начала терапии составил 81,8 3,7 кг, а после завершения терапии 76,5 3,5, p = 0,15. В группе пациентов, не получающих метформин, средний уровень массы тела до начала терапии составил 84,5 2,7 кг, а после ПВТ — 82,5 2,3 кг, p = 0,18.
Пациенты были так же разделены на группы в зависимости от значения HOMA-индекса. Пациенты с HOMA-индексом от 2 до 4 (n = 38), получающие метформин (n = 15) и не получающие метформин (n = 23), и пациенты с HOMA-IR 4 (n = 21), получающие метформин (n = 7) и не получающие метформин (n = 14). Так, при HOMA-индексе от 2 до 4 частота УВО среди пациентов, получающих метформин, составила 100% (15 из 15), тогда как у пациентов с HOMA-IR 4 — 85% (6 из 7), p = 0,0001, при HOMA-индексе от 2 до 4, среди пациентов, не получающих метформин, УВО достигли 48% (11 из 23), тогда как у пациентов с HOMA-IR 4, не получающих метформин, УВО достигли лишь 29% (4 из 14), p = 0,044 (рис. 4).
4).
Рис. 3. Доля пациентов, достигших УВО в группах сравнения (получавшие и не получавшие метформин), в зависимости от ИМТ
Рис. 4. Доля пациентов, достигших УВО в группах сравнения (получавших и не получавших метформин), в зависимости от значения НОMA-индекса
С целью оценки профиля безопасности применения метформина проводился анализ уровня глюкозы у пациентов, получающих метформин, до и после терапии. Значимого снижения уровня глюкозы, требующего отмены препарата или снижения дозы, выявлено не было: средний уровень глюкозы до начала приема метформина 5,57 0,17, после завершения терапии — 5,17 0,19, p = 0,07. Таким образом, метформин значимо не снижает уровень глюкозы и может безопасно применяться в комбинации с ПВТ.
Обсуждение результатов и выводы. Из полученных данных следует, что инсулинорезистентность — частый спутник ХГС, присутствует у половины пациентов.
ИР является специфической особенностью ХГС, независимо от наличия такого признака метаболического синдрома, как ожирение, что может свидетельствовать о связи HCV-инфекции и развитии толерантности к глюкозе [10, 11, 12]. Среди наших пациентов с ХГС и нормальным ИМТ доля лиц с ИР составила 37,3% (22 человека из 59). Наши результаты позволяют подтвердить, что HCV является метаболическим вирусом и может индуцировать развитие ИР при нормальной и даже сниженной массе тела, что ХГС — системное заболевание, затрагивающее углеводный метаболизм, а ИР — синдром ХГС, независимо от метаболических факторов [12, 13].
Среди наших пациентов с ХГС и нормальным ИМТ доля лиц с ИР составила 37,3% (22 человека из 59). Наши результаты позволяют подтвердить, что HCV является метаболическим вирусом и может индуцировать развитие ИР при нормальной и даже сниженной массе тела, что ХГС — системное заболевание, затрагивающее углеводный метаболизм, а ИР — синдром ХГС, независимо от метаболических факторов [12, 13].
Согласно нашим данным, при 1-м генотипе HCV противовирусная терапия ПегИФН 2b в сочетании с рибавирином более эффективна в комбинации с метформином в дозировке 20 мг/кг/сут., по сравнению с таковой у пациентов, не получавших метформин, в качестве третьего компонента стандартной ПВТ — УВО в 89 vs 60% случаев, что согласуется с данными M. Romero-Gomez и соавт. Впервые показано, что при 2-м — 3-м генотипах HCV противовирусная терапия в сочетании ПегИФН 2b с рибавирином в 100% случаях оказалась эффективной у пациентов, получавших метформин в дозировке 20 мг/кг/сут. по сравнению с пациентами, не получавшими метформин — УВО в 84% случаев.
Данное исследование впервые показало, что метформин эффективен в качестве третьего компонента у пациентов с ИР на ПВТ, особенно с низкой или нормальной массой тела. Пациенты, получающие метформин, с повышенной массой тела достигли УВО в 77% (10 из 13), тогда как пациенты без метформина, с повышенной массой тела, достигли УВО лишь в 34% (8 из 24), p = 0,001. Эффект метформина, очевидно, не связан со снижением массы тела. Лечение метформином значимо не приводит к снижению массы тела: в группе пациентов, получающих метформин, средний уровень массы тела до начала терапии составил 81,8 +- 3,7 кг, а после завершения терапии — 76,5 +- 3,5, p = 0,15; в группе пациентов, не получающих метформин, средний уровень массы тела до начала терапии составил 84,5 +- 2,7 кг, а после ПВТ — 82,5 +- 2,3 кг, p = 0,18.
До настоящего времени считалось, что пациенты с умеренной ИР (HOMA-индекс от 2 до 4) нуждаются лишь в немедикаментозной коррекции (дозированные физические нагрузки, соблюдение диеты), что, в совокупности с интерферонотерапией, снижает ИР без ее корректоров, в отличие от пациентов с преддиабетом (HOMA-индекс более 4), нуждающихся в назначении препаратов, уменьшающих ИР [7]. Однако наше исследование доказывает, что помимо оздоровления образа жизни, соблюдения диеты, необходима медикаментозная коррекция ИР пациентам с умеренной ИР, так как частота УВО среди пациентов (HOMA-IR 2—4), получающих метформин, составила 100% (15 из 15), тогда как у пациентов, не получающих метформин, лишь 48% (11 из 23), p = 0,001. Среди пациентов с HOMA-IR 4 частота достижения УВО составила 85% (6 из 7) у пациентов, получающих метформин, и 29% (4 из 14) у пациентов, не получающих метформин, p = 0,0001. Таким образом, эффективность ПВТ повышается у пациентов с исходной ИР (HOMA-IR 2) любой степени выраженности, при использовании в течение всего курса ПВТ метформина в дозе 20 мг/кг/сутки.
Однако наше исследование доказывает, что помимо оздоровления образа жизни, соблюдения диеты, необходима медикаментозная коррекция ИР пациентам с умеренной ИР, так как частота УВО среди пациентов (HOMA-IR 2—4), получающих метформин, составила 100% (15 из 15), тогда как у пациентов, не получающих метформин, лишь 48% (11 из 23), p = 0,001. Среди пациентов с HOMA-IR 4 частота достижения УВО составила 85% (6 из 7) у пациентов, получающих метформин, и 29% (4 из 14) у пациентов, не получающих метформин, p = 0,0001. Таким образом, эффективность ПВТ повышается у пациентов с исходной ИР (HOMA-IR 2) любой степени выраженности, при использовании в течение всего курса ПВТ метформина в дозе 20 мг/кг/сутки.
Отмечена хорошая переносимость и безопасность метформина, несмотря на длительный прием. Среди побочных эффектов у 14% (3 из 22) пациентов отмечена однократная диарея, купирующаяся самостоятельно, не требующая медикаментозной коррекции или отмены препарата, у 5% (1 из 22) пациентов отмечалось ощущение «металлического» привкуса во рту, не возникающего при приеме препарата во время еды. Метформин безопасен в комбинации с ПВТ, не снижает уровень глюкозы у пациентов с ХГС и ИР. Средний уровень глюкозы до начала приема метформина 5,57 +- 0,17, после завершения терапии — 5,17 +- 0,19, p = 0,07.
Метформин безопасен в комбинации с ПВТ, не снижает уровень глюкозы у пациентов с ХГС и ИР. Средний уровень глюкозы до начала приема метформина 5,57 +- 0,17, после завершения терапии — 5,17 +- 0,19, p = 0,07.
Таким образом, ИР является специфической особенностью ХГС, независимо от наличия или отсутствия ожирения. ИР выявлена у 37% пациентов с нормальной массой тела. Помимо оздоровления образа жизни, соблюдения диеты, необходима медикаментозная коррекция ИР у пациентов на ПВТ.
Коррекция ИР метформином оправдана начиная от значения HOMA-IR 2, при любом генотипе HCV значительно улучшает результаты ПВТ Пег-ИФН 2b и рибавирином, особенно у пациентов с низкой или нормальной массой тела.
Метформин, в качестве третьего компонента ПВТ Пег-ИФН 2b и рибавирином, безопасен и эффективен.
ЛИТЕРАТУРА
[1] Яковлев А.А., Виноградова Е.Н., Рахманова А.Г., Демиденко Т.П., Алексеева М.Н., Кошкарова Н.В. Хронический вирусные гепатиты в цирротической стадии // Эпидемиология и инфекционные болезни. — 2002. — N 4. — С. 27—30.
— 2002. — N 4. — С. 27—30.
[2] Alberti A., Chemello L., Benvengnu L. Natural history of hepatitis C // J. Hepatol. —2004. — Vol. 39 (4). — P. 1147—1171.
[3] Romero-Gómez M., Del Mar Viloria M., Andrade R.J., Salmerón J., Diago M., Fernández-Ro¬dríguez C.M., Corpas R., Cruz M., Grande L., Vázquez L. et al. Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patients // Gast¬roenterology. — 2005. — 128. — P. 636—641.
[4] Calvin H. Chan, Ross D. Hansen, Brett E. Jones. AASLD abstracts, Hepatology, october 2009.
[5] Thompson A., Diago M., Foster G., Ferenci P., Lurie Y., Stanciu C., Jablkowski M., Häus¬singer D., Urbanek P., Pianko S., Chuang W.-L., Subramanian G., McHutchison J. // Journal of Hepatology. — Vol. 52. — Suppl. 1, april 2010.
[6] Mattews D.R., Hosker J.P., Rudensky A.S. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentration in man // Diabetologia. — 1985. — 28. — P. 412—19.
— 1985. — 28. — P. 412—19.
[7] Tarantino G., Conca P., Ariello M., Mastrolia М. // Gut. — 2006. — 55 (4). — P. 585.
[8] Moucari R., Asselah T., Cazals-Hatem D. et al. Insulin resistance in chronic hepatitis C: association with genotypes 1 and 4, serum HCV RNA level, and liver fibrosis // Gastroenterology. — 2008. — Vol. 134. — P. 416—423.
[9] Romero-Gomez M., Diago М., Andrade R.J. // Hepatology. — 2009. — Dec, 50 (6). — P. 1702—8.
[10] Mehta S.H., Brancati F.L., Sulkowski M.S., Strathdee S.A., Thomas D.L. // Ann. Intern. Med. — 2000. — 133(8). — P. 592—9.
[11] Wang C.S., Wang S.T., Yao W.J., Chang T.T., Chou P. // Am. J. Epidemiol. — 2007. — july 15, 166 (2). — 196—203, 2003.
[12] Ernandez C., Genesca J., Esteban J.I., Hardi R., Garsia L., Knobler H., Schihmanter R., Zifro¬ni A. Increased risk of type 2 diabetes in noncirrhotic patients with chronic hepatitis C virus infection // Mayo Clin. Proc. — 2000. — 75. — P. 355—9.
— 75. — P. 355—9.
[13] Hui J.M., Sud A., Farell G.C., Bandara P., Byth K. Insulin resistance is associated with chronic hepatitis C and fibrosis progression // Gastroenterology. — 2003. — 125. — P. 1695—1704.
[14] World Health Organization: Report of a WHO Consultation: Definition, Diagnosis and Classification of Diabetes Mellitus and ins Complications. Geneva, World Health Organization, 1999.
[15] Pawlotsky J.M. Use and interpretation of virological tests for hepatitis C // Hepatology. — 2002. — 36 (suppl 1). — P. 565—573.
[16] Pawlotsky J.M. Molecular diagnosis of viral hepatitis // Gastroenterology. — 2003. — 122. — P. 1554—1568.
- Вперёд >
Уточнение роли и риска метформина в дисфункции печени
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Эльзевир Наука
Полнотекстовые ссылки
Обзор
./95-1.jpg) 2010 май-июнь;50(3):407-10.
2010 май-июнь;50(3):407-10.
doi: 10.1331/JAPhA.2010.08090.
Кэролайн С Брэкетт 1
принадлежность
- 1 Фармацевтический колледж Университета штата Огайо, 500 West 12th Ave., Колумбус, Огайо 43210, США. скобка[email protected]
- PMID: 20452916
- DOI: 10.1331/ЯФА.2010.08090
Обзор
Кэролайн С Брэкетт. Ассоциация J Am Pharm (2003 г.). 2010 май-июнь.
. 2010 май-июнь;50(3):407-10.
2010 май-июнь;50(3):407-10.
doi: 10.1331/JAPhA.2010.08090.
Автор
Кэролайн С Брэкетт 1
принадлежность
- 1 Фармацевтический колледж Университета штата Огайо, 500 West 12th Ave., Колумбус, Огайо 43210, США. скобка[email protected]
- PMID: 20452916
- DOI: 10.1331/ЯФА.2010.08090
Абстрактный
Цели: Выяснить, почему некоторые клиницисты не решаются использовать метформин у пациентов с заболеваниями печени, и обоснован ли рутинный мониторинг трансаминаз до и во время терапии метформином.
Источники данных: Был проведен поиск литературы в Medline (с 1966 г. по июнь 2008 г.) с использованием терминов метформин, лактоацидоз, заболевание печени, хроническое заболевание печени, гепатотоксичность, гипоксия, риски и предрасполагающие факторы.
Синтез данных: Информация производителя о назначении препарата, а также некоторая текущая медицинская и непрофессиональная литература предостерегают от использования метформина у пациентов с заболеваниями печени. Эта рекомендация по-разному интерпретируется разными врачами, при этом некоторые полагают, что предостережение подразумевает, что метформин может вызывать или усугублять поражение печени. Другие считают, что заболевания печени предрасполагают пациентов к развитию лактоацидоза. Таким образом, требуется более четкое понимание того, как и когда проводить скрининг дисфункции печени у пациентов до и во время терапии метформином.
Вывод: Метформин, по-видимому, не вызывает и не усугубляет поражение печени и, действительно, часто приносит пользу пациентам с неалкогольной жировой болезнью печени. Неалкогольная жировая дистрофия печени часто проявляется повышением активности трансаминаз, но ее не следует рассматривать как противопоказание к применению метформина. Литературные данные о том, что заболевание печени связано с метаболическим ацидозом, связанным с метформином, в основном представлены сообщениями о случаях. Большинство таких пациентов имели цирроз печени, а также активно употребляли алкоголь. У пациентов с циррозом печени, особенно с энцефалопатией, может быть артериальная гипоксемия, что повышает риск развития лактоацидоза. По этой причине выявление пациентов с циррозом печени до начала лечения метформином представляется целесообразным. Однако, поскольку цирроз может развиваться на фоне нормальных трансаминаз печени, а также поскольку метформин не считается гепатотоксичным по своей природе, отмена метформина у пациентов с аномальными трансаминазами или рутинный мониторинг трансаминаз до или во время лечения метформином не поддерживаются.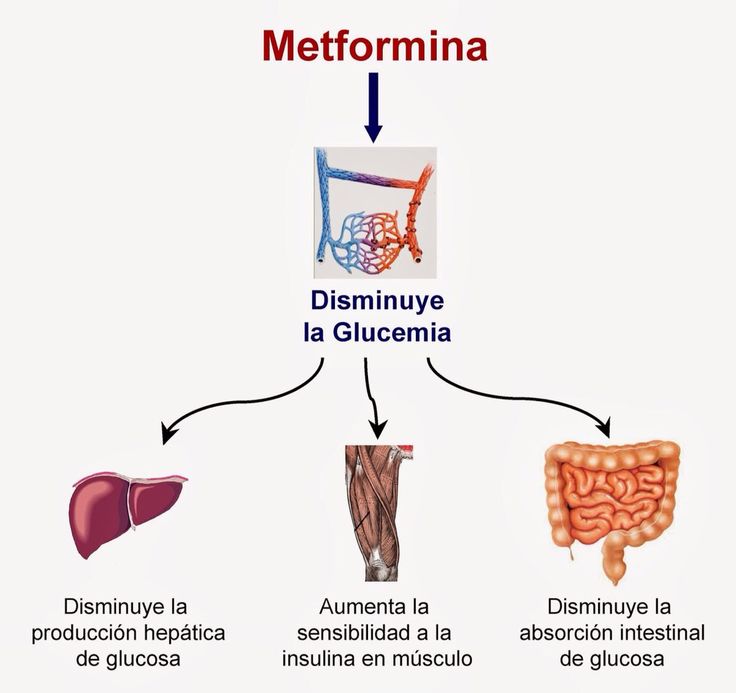
Похожие статьи
Гепатотоксичность, связанная с терапией метформином при лечении сахарного диабета 2 типа с неалкогольной жировой болезнью печени.
Конус С.Дж., Бахирич А.М., Мурата Г.Х. Конус CJ и др. Энн Фармакотер. 2010 Октябрь; 44 (10): 1655-9. doi: 10.1345/aph.1P099. Epub 2010 31 августа. Энн Фармакотер. 2010. PMID: 20647417
Метформин у больных хронической болезнью почек: сильные и слабые стороны.
Роша А., Алмейда М., Сантос Дж., Карвалью А. Роча А. и соавт. J Нефрол. 2013 янв-февраль;26(1):55-60. doi: 10.5301/jn.5000166. J Нефрол. 2013. PMID: 22641582 Обзор.
Уведомления о нежелательных явлениях, связанных с метформином при лактоацидозе, в Австралии.

Хуанг В., Кастелино Р.Л., Петерсон Г.М. Хуан В. и др. J Осложнения диабета. 2015 ноябрь-декабрь; 29(8):1261-5. doi: 10.1016/j.jdiacomp.2015.06.001. Epub 2015 9 июня. J Осложнения диабета. 2015. PMID: 26104729
Лактоацидоз, индуцированный метформином, у больного на хроническом гемодиализе с сахарным диабетом 2 типа.
Алтун Э., Кая Б., Пайдаш С., Сарыакчалы Б., Караяйлалы И. Алтун Э. и др. Гемодиал Инт. 2014 апр;18(2):529-31. doi: 10.1111/hdi.12109. Epub 2013 3 декабря. Гемодиал Инт. 2014. PMID: 24299454
Метформин-ассоциированный лактоацидоз у пациента с заболеванием печени.
Эдвардс К.М., Бартон М.А., Снук Дж., Дэвид М., Мак В.Х., Чоудхури Т.А. Эдвардс С.М. и соавт. QJM.
 2003 г., апрель; 96 (4): 315-6. doi: 10.1093/qjmed/hcg049.
QJM. 2003.
PMID: 12651978
Аннотация недоступна.
2003 г., апрель; 96 (4): 315-6. doi: 10.1093/qjmed/hcg049.
QJM. 2003.
PMID: 12651978
Аннотация недоступна.
Посмотреть все похожие статьи
Цитируется
Связь применения метформина с метаболическим ацидозом у больных диабетом с хроническим циррозом печени, связанным с гепатитом В, и почечной недостаточностью.
Yip TC, Chan RNC, Wong VW, Tse YK, Liang LY, Hui VW, Zhang X, Li GL, Chan HL, Wong GL. Йип Т.С. и др. Health Sci Rep. 2021 Aug 11;4(3):e352. doi: 10.1002/hsr2.352. электронная коллекция 2021 сент. Представитель медицинских наук, 2021 г. PMID: 34401527 Бесплатная статья ЧВК.
Совместное лечение агонистом PPARα и метформином улучшает течение НАСГ у мышей, вызванных диетой с дефицитом холина и определенными аминокислотами с содержанием жира 45%.

Окишио С., Ямагути К., Исиба Х., Точики Н., Яно К., Такахаши А., Катаока С., Окуда К., Секо Ю., Лю Ю., Фуджи Х., Такахаши Д., Ито Ю., Камон Дж., Умэмура А., Моригути М., Ясуи К., Окануэ Т., Ито Ю. Окисио С. и др. Научный представитель 2020 11 ноября; 10 (1): 19578. дои: 10.1038/s41598-020-75805-з. Научный представитель 2020. PMID: 33177546 Бесплатная статья ЧВК.
Клинические проявления, диагностика и лечение сахарного диабета у пациентов с хроническими заболеваниями печени.
Чанг В., Промрат К., Вандс Дж. Чанг В. и др. Мир J Гепатол. 2020 27 сентября; 12 (9): 533-557. дои: 10.4254/wjh.v12.i9.533. Мир J Гепатол. 2020. PMID: 33033564 Бесплатная статья ЧВК. Обзор.
Токсичность, связанная с комбинированным лечением метформином/ритонавиром при рецидивирующей/рефрактерной множественной миеломе.

Натвани Н., Палмер Дж., Синолд Т.В., Салехиан Б., Розенцвейг М., Санчес Дж.Ф., Хаммонд С.Н., Адекола К., Томарчио В., Чоудхури А., Каранес С., Хтут М., Сахеби Ф., Сиддики Т., Кришнан А., Форман С.Дж., Розен СТ. Натвани Н. и др. Клин Лимфома Миелома Лейк. 2020 окт; 20(10):e667-e672. doi: 10.1016/j.clml.2020.05.017. Epub 2020 29 мая. Клин Лимфома Миелома Лейк. 2020. PMID: 32631779 Бесплатная статья ЧВК. Аннотация недоступна.
Метформин: ответ на рак в цветке? Текущие знания и будущие перспективы метформина как противоракового агента при раке молочной железы.
Самуэль С.М., Варгезе Э., Кубата П., Триггл Ч.Р., Бюссельберг Д. Сэмюэл С.М. и др. Биомолекулы. 2019 9 декабря; 9 (12): 846. дои: 10.3390/биом9120846. Биомолекулы. 2019. PMID: 31835318 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Полнотекстовые ссылки
Эльзевир Наука
Укажите
Формат: ААД АПА МДА НЛМ
Отправить по телефону
Метформин — LiverTox — Книжная полка NCBI
Последнее обновление: 21 января 2020 г. или в комбинации с производными сульфонилмочевины, тиазолидиндионами, препаратами на основе инкретинов, ингибиторами натрий-глюкозного котранспортера-2 или другими гипогликемическими средствами. Метформин не был связан с повышением сывороточных ферментов во время терапии и является чрезвычайно редкой причиной идиосинкразического клинически очевидного острого повреждения печени.
или в комбинации с производными сульфонилмочевины, тиазолидиндионами, препаратами на основе инкретинов, ингибиторами натрий-глюкозного котранспортера-2 или другими гипогликемическими средствами. Метформин не был связан с повышением сывороточных ферментов во время терапии и является чрезвычайно редкой причиной идиосинкразического клинически очевидного острого повреждения печени.
Исходная информация
Метформин (в течение мин.) представляет собой бигуанин и действует как агент, повышающий чувствительность к инсулину, вероятно, за счет активации аденозинмонофосфатзависимой (АМФ) киназы в печени и мышечной ткани. Метформин часто ассоциируется с потерей веса, что делает его предпочтительным препаратом первой линии для лечения пациентов с избыточным весом и диабетом 2 типа. Первоначальные опасения по поводу возможности того, что метформин (как родственный бигуанин фенформин) может вызывать лактоацидоз, в значительной степени развеялись, хотя по этой причине препарат противопоказан пациентам с почечной дисфункцией и должен использоваться с осторожностью у пациентов со значительным заболеванием печени. Метформин был одобрен для использования в США в 1995 и в настоящее время является одним из наиболее часто используемых препаратов для лечения диабета: ежегодно в Соединенных Штатах выписывается более 30 миллионов рецептов. Метформин доступен во многих непатентованных формах в таблетках по 500, 850 или 1000 мг, рекомендуемая схема лечения заключается в том, чтобы начинать с 500 или 850 мг один раз в день и увеличивать дозу в зависимости от переносимости до 1000–2550 мг в день, принимаемых в два приема. Коммерческие составы включают Glucophage, Glumetza, Fortamet и Riomet. Метформин также доступен в формах с пролонгированным высвобождением и в комбинации с препаратами сульфонилмочевины, такими как глипизид (Metaglip) или глибурид (Glucovance), ингибиторами DDP-4, такими как алоглиптин (Kazano), линаглиптин (Jentadueto), саксаглиптин (Kombiglyze) и ситаглиптин (Janumet). , а также тиазолидиндионы, такие как пиоглитазон (Актоплюс) и розиглитазон (Авандамет). Метформин, как правило, хорошо переносится, но побочные эффекты могут включать диарею, желудочно-кишечные расстройства, боль в животе, тошноту, металлический привкус, слабость, головную боль, головокружение и сыпь.
Метформин был одобрен для использования в США в 1995 и в настоящее время является одним из наиболее часто используемых препаратов для лечения диабета: ежегодно в Соединенных Штатах выписывается более 30 миллионов рецептов. Метформин доступен во многих непатентованных формах в таблетках по 500, 850 или 1000 мг, рекомендуемая схема лечения заключается в том, чтобы начинать с 500 или 850 мг один раз в день и увеличивать дозу в зависимости от переносимости до 1000–2550 мг в день, принимаемых в два приема. Коммерческие составы включают Glucophage, Glumetza, Fortamet и Riomet. Метформин также доступен в формах с пролонгированным высвобождением и в комбинации с препаратами сульфонилмочевины, такими как глипизид (Metaglip) или глибурид (Glucovance), ингибиторами DDP-4, такими как алоглиптин (Kazano), линаглиптин (Jentadueto), саксаглиптин (Kombiglyze) и ситаглиптин (Janumet). , а также тиазолидиндионы, такие как пиоглитазон (Актоплюс) и розиглитазон (Авандамет). Метформин, как правило, хорошо переносится, но побочные эффекты могут включать диарею, желудочно-кишечные расстройства, боль в животе, тошноту, металлический привкус, слабость, головную боль, головокружение и сыпь. Редкие, но потенциально тяжелые нежелательные явления включают лактоацидоз, гипогликемию, обезвоживание и реакции гиперчувствительности.
Редкие, но потенциально тяжелые нежелательные явления включают лактоацидоз, гипогликемию, обезвоживание и реакции гиперчувствительности.
Гепатотоксичность
Сообщалось о незначительном повышении активности ферментов во время терапии метформином менее чем у 1% пациентов. Действительно, метформин может снизить повышенный уровень аминотрансфераз у пациентов с жировой болезнью печени. Клинически очевидное поражение печени при применении метформина встречается очень редко, в литературе описано менее дюжины случаев, несмотря на широкое применение этого препарата в течение нескольких десятилетий. Повреждение печени обычно появляется через 1–8 недель, как правило, с симптомами слабости и утомляемости, за которыми следует желтуха. Описаны различные комбинации гепатоцеллюлярного и холестатического повреждения, и многие из них были смешанными. Аллергические проявления нетипичны, но описаны сыпь, лихорадка и эозинофилия. Образование аутоантител также не характерно. Поскольку этот препарат обычно назначают в комбинации с другими гипогликемическими препаратами, многие из которых также вызывают поражение печени, может быть трудно установить, вызвано ли повреждение метформином или другим препаратом. Время повреждения, возможно, наиболее характерно, повреждение возникает вскоре после начала приема агента, а не во время длительной терапии. Восстановление обычно происходит быстро после прекращения приема метформина.
Время повреждения, возможно, наиболее характерно, повреждение возникает вскоре после начала приема агента, а не во время длительной терапии. Восстановление обычно происходит быстро после прекращения приема метформина.
Оценка вероятности: B (редкая, но хорошо задокументированная причина клинически очевидного повреждения печени).
Механизм повреждения
Механизм повреждения печени из-за метформина неизвестен. Метформин действительно может быть полезен при некоторых формах заболеваний печени, таких как неалкогольный стеатогепатит, и его не следует избегать у пациентов с умеренными, ранее существовавшими нарушениями ферментов сыворотки. Острое поражение печени, вызванное метформином, может иметь метаболическую основу и возникать после нескольких недель или месяцев терапии. Повторный вызов может привести к рецидиву, но также требует от недель до месяцев терапии, прежде чем травма снова появится.
Исходы и лечение
Повреждение печени, вызванное метформином, обычно быстро проходит после прекращения приема препарата. Хроническое поражение не описано. Не сообщалось об убедительных случаях фульминантной печеночной недостаточности при приеме метформина. В случаях, когда при появлении поражения печени применялись несколько гипогликемических средств, уместно повторное введение агента, который с наименьшей вероятностью связан с повреждением. Нет перекрестной реактивности при гепатотоксичности с другими противодиабетическими препаратами. 9(1) желтуха через пять недель. У нее не было в анамнезе заболеваний печени или факторов риска вирусного гепатита, и она не употребляла алкоголь. У нее была ишемическая болезнь сердца, и она постоянно принимала лекарства, включая аспирин, изосорбида мононитрат, дилтиазем и акарбозу. При поступлении через 6 недель после начала приема метформина у нее был общий билирубин 4,8 мг/дл (таблица). Анализы на гепатиты А, В и С были отрицательными. У нее были антинуклеарные антитела (1:320). УЗИ органов брюшной полости и КТ в норме. Биопсия печени показала острое воспаление. Метформин и акарбозу отменили и начали принимать гликлазид.
Хроническое поражение не описано. Не сообщалось об убедительных случаях фульминантной печеночной недостаточности при приеме метформина. В случаях, когда при появлении поражения печени применялись несколько гипогликемических средств, уместно повторное введение агента, который с наименьшей вероятностью связан с повреждением. Нет перекрестной реактивности при гепатотоксичности с другими противодиабетическими препаратами. 9(1) желтуха через пять недель. У нее не было в анамнезе заболеваний печени или факторов риска вирусного гепатита, и она не употребляла алкоголь. У нее была ишемическая болезнь сердца, и она постоянно принимала лекарства, включая аспирин, изосорбида мононитрат, дилтиазем и акарбозу. При поступлении через 6 недель после начала приема метформина у нее был общий билирубин 4,8 мг/дл (таблица). Анализы на гепатиты А, В и С были отрицательными. У нее были антинуклеарные антитела (1:320). УЗИ органов брюшной полости и КТ в норме. Биопсия печени показала острое воспаление. Метформин и акарбозу отменили и начали принимать гликлазид. Желтуха медленно разрешилась в течение следующих трех месяцев, но впоследствии метформин был возобновлен, и желтуха снова появилась через 3 месяца. Метформин снова был отменен, и ее повреждение печени медленно улучшилось.
Желтуха медленно разрешилась в течение следующих трех месяцев, но впоследствии метформин был возобновлен, и желтуха снова появилась через 3 месяца. Метформин снова был отменен, и ее повреждение печени медленно улучшилось.
Ключевые моменты
| Препарат: | Метформин (500 мг два раза в день) | |||||||
|---|---|---|---|---|---|---|---|---|
| Паттерна: | Hepatocelllular (R = 26) | (r = 26) | (R = 26) | . | ||||
| Латентный период: | Tc_1_1_4_1″ rowspan=»1″ colspan=»1″> 5 недель | |||||||
| Выздоровление: | Полное в течение 2 месяцев | |||||||
| Другие препараты:0299 |
Лабораторные показатели
- *
Значения АЛТ и билирубина были рассчитаны по рисунку и преобразованы из умножения на верхний предел нормы в абсолютные значения на основе предоставленных нормальных значений.
Случай 2. Острое гепатитоподобное поражение, вызванное метформином.(2)
73-летняя японка с плохо контролируемым диабетом, несмотря на терапию производными сульфонилмочевины и пиоглитазоном, начала прием метформина (500 мг два раза в день). через 3 недели развилась утомляемость, слабость и желтуха. Было известно, что до начала приема метформина у нее были нормальные печеночные пробы. При поступлении лабораторные анализы показали общий билирубин 6,5 мг/дл и гепатоцеллюлярную картину повышения ферментов сыворотки (таблица). Все пероральные противодиабетические средства были прекращены, и она была переведена на инсулин. Тесты на гепатит В и С были отрицательными, как и аутоантитела. УЗИ, КТ и ЭРХПГ без особенностей. Ферменты в ее сыворотке быстро улучшились после прекращения приема метформина и нормализовались через 7 недель.
Все пероральные противодиабетические средства были прекращены, и она была переведена на инсулин. Тесты на гепатит В и С были отрицательными, как и аутоантитела. УЗИ, КТ и ЭРХПГ без особенностей. Ферменты в ее сыворотке быстро улучшились после прекращения приема метформина и нормализовались через 7 недель.
Ключевые моменты
| Препарат: | Метформин (500 мг два раза в день) | ||||||
|---|---|---|---|---|---|---|---|
| Паттерна: | Hepatocellularularularularularularularularularularularularularularularularularular (R = 210296 | (R = 210296 | (R = 210296 | Te_1_1_2_1″ rowspan=»1″ colspan=»1″>. | |||
| Латентный период: | 3 недели | ||||||
| Восстановление: | Полное в течение 2 месяцев0299 |
Laboratory Values
| Time After Starting | Time After Stopping | ALT (U/L) | Alk P (U/L) | Bilirubin (mg/ dL) | Other |
|---|---|---|---|---|---|
| Pre | Tf_1_1_1_2″ rowspan=»1″ colspan=»1″> | 16 | 337 | 0.7 | |
| 3 weeks | 0 | 772 | 635 | 6.5 | Admission |
| 4 weeks | 1 weeks | Tf_1_1_1_3″ rowspan=»1″ colspan=»1″> 353 | 480 | 3.2 | |
| 6 weeks | 3 weeks | 101 | 2.6 | Symptoms resolved | |
| 8 weeks | 5 weeks | 65 | Tf_1_1_1_4″ rowspan=»1″ colspan=»1″> | 1.7 | |
| 10 weeks | 7 weeks | 13 | 0.6 | ||
| Normal Values | <36 | <359 | Tf_1_1_1_5″ rowspan=»1″ colspan=»1″> <1.2 | ||
CHEMICAL FORMULA AND STRUCTURE
| DRUG | CAS REGISTRY НОМЕР | МОЛЕКУЛЯРНАЯ ФОРМУЛА | СТРУКТУРА |
|---|---|---|---|
| Метформин | 657-24-9 | C4-h21-N5 | 469


 2003 г., апрель; 96 (4): 315-6. doi: 10.1093/qjmed/hcg049.
QJM. 2003.
PMID: 12651978
Аннотация недоступна.
2003 г., апрель; 96 (4): 315-6. doi: 10.1093/qjmed/hcg049.
QJM. 2003.
PMID: 12651978
Аннотация недоступна.

 2005;3:270–3. [PubMed: 16503324]
2005;3:270–3. [PubMed: 16503324] прекращено, летальных случаев не описано).
прекращено, летальных случаев не описано).  1996; 334: 574–9. [PubMed: 8569826]
1996; 334: 574–9. [PubMed: 8569826] История болезни. Псевдогепатотоксичность метформина. Уход за диабетом. 1998; 21: 677–8. [PubMed: 9571371]
История болезни. Псевдогепатотоксичность метформина. Уход за диабетом. 1998; 21: 677–8. [PubMed: 9571371]
 Е., Крайдер М., Фрид М.И. Оценка функции печени у пациентов с диабетом 2 типа в ходе клинических исследований: доказательства того, что розиглитазон не вызывает нарушения функции печени. Уход за диабетом. 2002; 25:815–21. [В паблике: 11978674]
Е., Крайдер М., Фрид М.И. Оценка функции печени у пациентов с диабетом 2 типа в ходе клинических исследований: доказательства того, что розиглитазон не вызывает нарушения функции печени. Уход за диабетом. 2002; 25:815–21. [В паблике: 11978674]
 2005;3:270–3. [В паблике: 16503324]
2005;3:270–3. [В паблике: 16503324] , Арранс де ла Мата Г., Бойшеда де Микель Д. [Конституциональный синдром, связанный с гепатотоксичностью, вызванной метформином]. Гастроэнтерол Гепатол 2008; 31: 643-5. Испанский. PMID: 19174081.
, Арранс де ла Мата Г., Бойшеда де Микель Д. [Конституциональный синдром, связанный с гепатотоксичностью, вызванной метформином]. Гастроэнтерол Гепатол 2008; 31: 643-5. Испанский. PMID: 19174081.

 ДЖАМА. 2011;305:1659–68. [Статья бесплатно PMC: PMC3110082] [PubMed: 21521847]
ДЖАМА. 2011;305:1659–68. [Статья бесплатно PMC: PMC3110082] [PubMed: 21521847]


 Сеть США по лекарственным повреждениям печени. Особенности и исходы 899 пациентов с лекарственным поражением печени: проспективное исследование DILIN. Гастроэнтерология. 2015;148:1340–52.e7. [Статья без PMC: PMC4446235] [PubMed: 25754159]
Сеть США по лекарственным повреждениям печени. Особенности и исходы 899 пациентов с лекарственным поражением печени: проспективное исследование DILIN. Гастроэнтерология. 2015;148:1340–52.e7. [Статья без PMC: PMC4446235] [PubMed: 25754159]