Сера. Химия серы и ее соединений
1. Положение серы в периодической системе химических элементов
2. Электронное строение атома серы
3. Физические свойства и нахождение в природе
4. Соединения серы
5. Способы получения
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с галогенами
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с окислителями
6.2.2. Взаимодействие с щелочами
Сероводород
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
3.4. Взаимодействие с солями тяжелых металлов
Сульфиды
Химические свойства сульфидов
Оксиды серы
1. Оксид серы (IV)
2. Оксид серы (VI)
Серная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация серной кислоты
3.2. Основные свойства серной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с солями
3.6. Качественная реакция на сульфат-ионы
3.7. Окислительные свойства серной кислоты
Сернистая кислота
Соли серной кислоты – сульфаты
Сера
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии:

Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:

Электронная конфигурация серы во втором возбужденном состоянии:

Таким образом, максимальная валентность
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета.


Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны». Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96оС, а при обычной температуре превращающееся в ромбическую серу.



Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.

В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO3 Серная кислота H2SO4 Сульфаты MeSO4 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты MeSO3 Гидросульфиты MeHSO3 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S Сульфиды металлов MeS |
Способы получения серы
1. В промышленных масштабах серу получают открытым способом на меторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
2H2S + O2 → 2S + 2H2O
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
2H2S + SO2 → 3S + 2H2O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1.
S + O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S + 2Al → Al2S3
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
S + H2 → H2S
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
Например, азотная кислота окисляет серу до серной кислоты:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2H2SO4 → 3SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S + NaOH → Na2SO3 + Na2S + H2O
При взаимодействии с перегретым паром сера диспропорционирует:
S + H2O (пар) → 2H2S + SO2
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы серводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.

Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводродо до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, н ив минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют |
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) |
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя | Разлагаются водой
| |
| ZnS + 2HCl → ZnCl2 + H2S | Al2S3 + 6H2O → 2Al(OH)3 + 3H2S | ||
Способы получения сульфидов
1. Сульфиды получают при взаимодействии серы с металлами. При этом сера проявляет свойства окислителя.
Например, сера взаимодействует с магнием и кальцием:
S + Mg → MgS
S + Ca → CaS
Сера взаимодействует с натрием:
S + 2Na → Na2S
2. Растворимые сульфиды можно получить при взаимодействии сероводорода и щелочей.
Например, гидроксида калия с сероводородом:
H2S + 2KOH → K2S + 2H2O
3. Нерастворимые сульфиды получают взаимодействием растворимых сульфидов с солями (любые сульфиды) или взаимодействием сероводорода с солями (только черные сульфиды).
Например, при взаимодействии нитрата меди и сероводорода:
Pb(NO3)2 + Н2S → 2НNO3 + PbS
Еще пример: взаимодействие сульфата цинка с сульфидом натрия:
ZnSO4 + Na2S → Na2SO4 + ZnS
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
K2S + H2O ⇄ KHS + KOH
S2– + H2O ⇄ HS– + OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS + 2HCl → CaCl2 + H2S
А сульфид никеля, например, не растворяется:
NiS + HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого веещства, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
или горячей концентрированной серной кислоте:
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
4. Сульфиды проявляют восстановительные свойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS + 4H2O2 → PbSO4 + 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS + Cl2 → CuCl2 + S
5. Сульфиды горят (обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS + 3O2 → 2CuO + 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
2ZnS + 3O2 → 2SO2 + ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
7. Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S + 2AlCl3 + H2O → 2Al(OH)3 + 3H2S + 6NaCl
Оксиды серы
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения окисда серы (IV):
1. Сжигание серы на воздухе:
S + O2 → SO2
2. Горение сульфидов и сероводорода:
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
4. Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 + 2NaOH(изб) → Na2SO3 + H2O
SO2(изб) + NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 + Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 + H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 + O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 + 2HNO3 → H2SO4 + 2NO2
Озон также окисляет оксид серы (IV):
SO2 + O3 → SO3 + O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 + PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 + 2Н2S → 3S + 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
SO2 + С → S + СO2
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
2SO2 + O2 ↔ 2SO3
Сернистый газ окисляют и другие окислители, например, озон или оксид азота (IV):
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства оксида серы (VI).
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
2. Серный ангидрид является типичным кислотным оксидом, взаимодействует с щелочами и основными оксидами.
Например, оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
Еще пример: оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Cера — химические свойства, получение, соединения. VIа группа » HimEge.ru
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
HgS — киноварь,
Sb2S3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S8
t°пл. = 113°C; r = 2,07 г/см3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 → 2S + 2H2O
- Реакция Вакенродера:
2H2S + SO2 → 3S + 2H2O
Окислительные свойства серы
(S0 + 2ē → S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2Al + 3S –→ Al2S3
Zn + S –→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6)
3) c кислородом:
S + O2 –t° → S+4O2
2S + 3O2 –t°;pt → 2S+6O3
4) c галогенами (кроме йода):
S + Cl2 → S+2Cl2
S + 3F2 → SF6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
Реакции диспропорционирования:
6) 3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия
Сера, подготовка к ЕГЭ по химии
Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.

Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
H2S + O2 = S + H2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакции с кислотами
- Реакции с щелочами
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.
S + O2 = (t) SO2
S + F2 = SF6
S + Cl2 = (t) SCl2
S + C = (t) CS2

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
K + S = (t) K2S
Al + S = Al2S3
Fe + S = (t) FeS
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO4 + NO2 + H2O
Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O

Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- Восстановительные свойства
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
2KOH + H2S = K2S + 2H2O
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
Сероводород — сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + S (недостаток кислорода)
H2S + O2 = H2O + SO2 (избыток кислорода)
H2S + HClO3 = H2SO4 + HCl

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- Восстановительные свойства
- Как окислитель
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
2NaOH + SO2 = Na2SO3 + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4
SO2 + O2 = (t, кат. — Pt) SO3
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S + H2O
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
- Диссоциация
- Кислотные свойства
- Окислительные свойства
- Восстановительные свойства
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3—
HSO3— = H+ + SO32-
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота — основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr

Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
SO2 + O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
Химические свойства
- Кислотные свойства
- Окислительные свойства
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O

SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
SO3 + P = SO2 + P2O5
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
зачем нам сера или что такое МСМ (MSM)? — Когда мы едины
Сегодня я напишу о таком важнейшем микроэлементе как сера (S, сульфур).
Прочтите и, возможно, вы по-иному посмотрите на это простое непростое вещество.
Отрывок из записок алхимика (перевод Н.Морозова):
«Семь металлов создал свет
По числу семи планет:
Дал нам космос на добро
Медь, железо, серебро,
Злато, олово, свинец…
Сын мой! Сера их отец!»
Мы даже не задумываемся, насколько сера необходима нам, и сколько внутренних биохимических процессов нарушается при ее дефиците.
Сера — это жёлтое вещество, существующее в нескольких формах, как кристаллических, так и жидких. Это одно из основных веществ, содержащихся в нашем организме. Сера стоит по весу на 8-м месте среди элементов, составляющих наше тело. Химический состав человеческого тела по весу (на 75 кг): вода — 45 кг, углерод — 16 кг, кислород (неводный) — 2,9 кг, водород (неводный) — 2,9 кг, азот — 1,8 кг, кальций — 1, 1 кг, фосфор — 600 г, сера — 140-175 г, калий — 140 г, сода — 100 г и другие микроэлементы в гораздо меньших количествах.
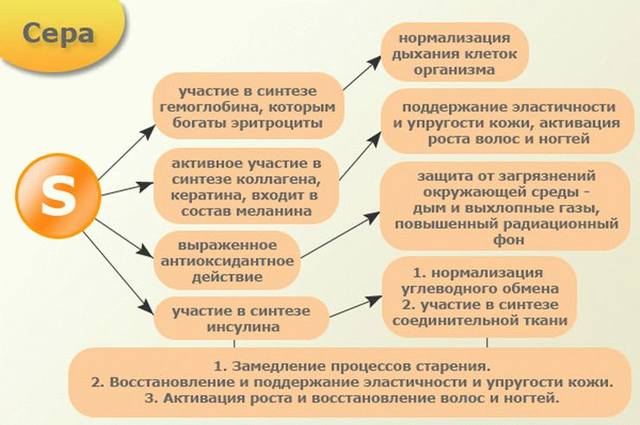
Сера играет большую роль в организме – она ответственна за ионный обмен в клетке; она обеспечивает функционирование системы, от которой зависит проницаемость клеточных мембран. При достаточном количестве серы нашему организму легче выводить токсины. Сера также является компонентом инсулина – важного гормона, который регулирует усвоение глюкозы клетками для выработки энергии. Кроме этого сера является составной частью протеинов большинства тканей организма, кровеносных сосудов, волос, ногтей, кожи и соединительных тканей, главный из которых фибриллярный гликопротеиноидный белок коллаген, который обеспечивает прочность соединительной ткани, кожи, связок, сухожилий, хрящей, костей. На долю коллагена приходится около 30% всех белков организма. Именно поэтому достаточное поступление такого элемента как сера в организм является отличной профилактикой многих заболеваний, а при заболеваниях способствует выздоровлению. Сера должна обязательно присутствовать в рационе.
Для восполнения серы я принимаю препарат МСМ. Это не реклама. Это добрый совет. Ведь многие о нем даже и не знают. МСМ означает метилсульфонилметан (диметилсульфон). Это неметаллическая смесь серы, часто встречающаяся в природе. МСМ также жизненно необходим, как вода или соль. Он абсолютно нетоксичен — безопасен, как вода!
МСМ — это белое кристаллическое вещество без запаха, напоминающее сахар. Оно слегка горчит на вкус. Серный компонент МСМ составляет 34% от общей массы вещества, поэтому МСМ — один из самых богатых источников серы в природе. МСМ легко растворяется в воде или соке. Но кто не может переносить горьковатый вкус, может принимать МСМ в капсулах.
Сера содержится в клетках всех животных и растений. ВСЕХ! Но для того, чтобы она усвоилась, она должна быть в биологически доступной форме. Простейшие организмы (планктон, водоросли и др.) получают неорганическую серу и перерабатывают её в органические соединения серы, называемые диметилсульфониевыми солями. В морской и океанической воде эти соли трансформируются в очень неустойчивое соединение диметилсульфид (ДМС). Оно испаряется с поверхности океана и поднимается в верхние слои атмосферы. Там под воздействием озона и ультрафиолета ДМС окисляется в диметилсульфоксид (ДМСО), который в свою очередь преобразуется в метилсульфонилметан (МСМ). Два этих соединения растворяются в атмосфере, собираются в облака, а затем выпадают на землю в виде дождя или снега. Вот почему так полезна талая вода! И наличие МСМ в воде при замерзании и придает ей снежно-белый цвет. Замерзшая дистиллированная или водопроводная вода прозрачна. Сейчас мы пьём очищенную воду, которая больше не содержит минералов, необходимых для здоровья. Если вы заморозите воду, содержащую МСМ, она белеет. При таянии она снова приобретает прозрачность.
МСМ отлично растворяются в воде. Растения получают серу из дождевой воды, в которой они находятся в большом количестве. МСМ является источником серы для синтеза очень важных органических веществ — аминокислот метионин и цистеин, которые затем входят в структуру растений. В процессе жизнедеятельности растений МСМ и другие соединения серы вновь трансформируются и вновь попадают в воду, а в итоге в мировой океан. Затем процесс повторяется снова. Метионин и цистеин в растениях представляют собой природный источник органической серы. Две эти аминокислоты наряду с другими служат для образования протеинов. В свою очередь животный белок становится также источником серы. То есть протеины образуются и из растений: ведь сколько животных-вегетарианцев.))))
МСМ и родственные ему соединения ДМСО и ДМС являются источником 85% серы, содержащейся в живых организмах.
Сера ответственна за характерный запах чеснока, лука, горчицы, хрена и т.д. Многие другие особые запахи обязаны своим появлением соединениям серы. Запах горелых волос или шерсти (органики) говорит о высоком содержании в них серы. Вьются наши волосы также благодаря серным связям аминокислоты цистина.

Сера содержится в каждой клетке человеческого организма. В каждой! Самая высокая концентрация серы в суставах, волосах, коже и ногтях. Излишки серы выделяются, присоединив к себе «всякий хлам». Сера также содержится в крови и других органах. Организм использует серу для постоянного обновления клеток. Наряду с МСМ к этому процессу организм также подключает витамины и аминокислоты.
Содержание серы в организме человека уменьшается с возрастом и при нарушении обмена веществ, а также в результате ограничительных диет. Если организм перестанет получать пищу, содержащую МСМ, то он начнёт создавать плохо функционирующие и слабые клетки.
Тиамин, пантотеновая кислота, биотин и липоевая кислота содержат элементарную серу и являются необходимыми элементами метаболических процессов. Они также поддерживают здоровье нервной системы. Сера играет важную роль в клеточном дыхании — процессе, при котором кислород и другие вещества используются для построения клеток и выработки энергии. Сера влияет на выработку в печени желчи.
Три самые важные функции серы в организме:
Детоксикация. Сера ответственна за ионный обмен в клетке, который обеспечивает, так называемый, калиево-натриевый насос мембран клеток. Именно сера обеспечивает нормальное функционирование этой системы, от которой зависит проницаемость клеточных мембран. Это нужно для того, чтобы необходимые питательные вещества доставлялись в клетку, а токсины и продукты жизнедеятельности выводились из неё. При недостатке серы токсины накапливаются в организме.
Выработка энергии и углеводный обмен. Сера является компонентом инсулина, очень важного гормона, регулирующего усвоение глюкозы клетками для выработки энергии. Сера также нужна тиамину и биотину для поддержания нормального углеводного обмена.
Регенерация тканей. Сера — это составляющая протеинов большинства тканей организма: кровеносных сосудов, волос и ногтей, кожи и других органов. Сера образует гибкие дисульфидные связи внутри протеинов, которые обеспечивают гибкость и подвижность тканей. Все клетки организма находятся в состоянии постоянной регенерации, для которой необходимо присутствие достаточного количества серы в нашем рационе, что обеспечит противостояние разрушению тканей свободными радикалами и способствоваует омоложению.
Симптомами дефицита серы могут быть:
— медленное заживление ран
— ломкие ногти и волосы
— артриты, артрозы, остеопороз
— проблемы ЖКТ
— воспалениями на коже (включая юношеские акне)
— иммунная недостаточность
— артрозо-артритом
— депрессиия и ухудшение памяти
В настоящее время учёные по всему миру исследуют взаимосвязь между дефицитом МСМ и заболеванием суставов, болезнью Альцгеймера, аллергиями и астмой, дерматологическими проблемами, состоянием зубов и даже онкологическими заболеваниями.
Раньше, когда наш рацион не включал в себя такого количества полуфабрикатов, обычная каждодневная еда представляла собой важный источник МСМ. МСМ в достаточном количестве встречался в природе, и все формы жизни могли его потреблять. Сейчас уровень серы в почве сильно варьируется, поэтому в некоторых областях наблюдается огромный дефицит серы. А соответственно и растения уже не содержат серу в достаточном количестве. Богата ей крапива, но ведь ее много и не съешь. Да и побочка существенна: крапива существенно увеличивает свертываемость крови.

Взрослому человеку ежедневно необходим примерно 1 — 1, 2 г серы. Ежедневно. Конечно, полезно употреблять больше свежих фруктов и овощей. Будем надеяться, что сера еще содержится в бананах, ананасах, арбузах, крыжовнике, горохе, темно-зеленых листовых овощах. Недостаток серы снижает интенсивность фотосинтеза, листях растения светлеют и желтеют, поэтому , чем зеленее и темнее листовые овощи, тем лучше. Наибольшее содержание серы в остром перце, капусте, брюссельской капусте, капусте курчаволистной (браунколь), в брокколи, хрене, луке и чесноке. Для сохранности серы овощи лучше готовить на пару. Кроме того, много серы в орехах (грецкие, миндаль, кешью, кокосы) и семенах (подсолнечника, кунжута), овсянке и гречке, мясе, рыбе (морской окунь, сардины, ставрида, треска, горбуша, камбала, щука)¸ молочных продуктах (качественных), куриных яйцах. А порция перепелиных яиц, например, может обеспечить почти аналогичным количеством макроэлемента, что и порция мяса. Поэтому хотя бы детишкам давайте перепелиные яйца.

Загрязнение воздуха и воды, слишком сильно удобряемая и загрязнённая почва, искусственное орошение, вырубка лесов вызывают минеральный дефицит почвы. Современные продукты питания не могут стать полноценными источниками серы и МСМ, так как теряют их во время переработки.
Животным серу добавляют в рацион.

А нам порой приходится добавлять самим. ))))
Какова же польза от приема МСМ?
Только не надо путать МСМ с серосодержащими лекарствами, сульфитами и сульфатами. Они-то как раз токсичны.
МСМ способен разрушать слабые (водные) соединения кальция в синовиальной жидкости и «очищать» суставы. Он уменьшает рубцовую ткань путем предотвращения образования поперечных связей, участвующих в формировании рубцовой ткани. Все вместе это способствует заживлению тканей и ускорению выздоровления. МСМ необходим для людей, страдающих дегенеративными заболеваниями, например, ревматоидный артрит, а также при проблемах с позвоночными дисками, сильных ушибах, бурситах и т.д. МСМ уменьшает образование молочной кислоты и способен сокращать частоту возникновения или совсем избавлять от мышечных спазмов. Это особенно важно для пожилых людей, страдающих судорогами икроножных мышц.
МСМ укрепляет естественные защитные барьеры организма. Оральное употребление МСМ уменьшает аллергический ответ организма на пыльцу и продукты питания. Сера играет важнейшую роль в ослаблении аллергии и многих форм легочной дисфункции путем детоксикации и уничтожения свободных радикалов. МСМ подавляет скрытые пищевые аллергические реакции.
Есть ещё один очень важный процесс, который происходит с помощью МСМ — это усиление выработки жидкости (слизи), которая покрывает стенки дыхательных путей. Это очень важный фактор защиты легких от микробов и других вредоносных факторов окружающей среды. Противовоспалительные свойства МСМ особенно ярко проявляются при инфекционно-аллергической форме бронхиальной астме. МСМ обладает сильным противовоспалительными и обезболивающими свойствами. МСМ блокирует боль в определенных нервных волокнах.
Сера увеличивает проницаемость мембран клеток путем регуляции системы перемещения калия и натрия («калий-натриевый насос»). Этот насос позволяет жидкости и питательным веществам проходить свободно через стенки клетки, что обеспечивает удаление токсинов из клеток.
В процессе нескольких независимых исследований изучались антираковые сврйства овощей и растений, содержащих серу. Было выяснено, что их употребление вызывает снижение активности канцерогенов в организме. Крестоцветные овощи (капуста, брюссельская капуста, цветная капуста, люцерна и брокколи) предотвращают формирование раковых клеток. Исследования, проведенные в американском Университете штата Огайо показали, что МСМ обладает антикарциногенным действием и значительно снижает риск развития рака молочной железы и кишечника.
МСМ улучшает пищеварение, эффективен против паразитов.
МСМ может восстановить нормальный уровень сахара в крови, поскольку мембраны клетки становятся проницаемыми.
Волосы на 98 % состоят из протеина (в основном, кератина). Дефицит серы или аминокислот, таких как цистин, может вызвать изменение цвета волос, изменение строения или потерю волос. Необходимо устранить дефицит серы, чтобы строение волоса вернулось к своему нормальному состоянию. Сера также называется «минералом красоты», потому что делает волосы блестящими и гладкими, а также улучшает цвет лица. Сера необходима для выработки коллагена и кератина, протеиновых веществ, необходимых для здоровья и улучшения состояния кожи, ногтей и волос.
МСМ также играет важную роль в заживлении ожогов и следов хирургического вмешательства.
Она используется в синтезе коллагена. У подростков, использующих МСМ, значительно уменьшаются проявления угревой сыпи. Сера помогает в лечении также таких проблем, как псориаз, экзема, дерматит, перхоть, опрелости и различные грибковые инфекции. Зуд и шелушение кожи также можно устранить принимая МСМ.
Благодаря своей способности защищать от вредоносных последствий радиации и загрязнения окружающей среды, сера замедляет процесс старения и увеличивает продолжительность жизни.
P.S. Рекламировать препараты не буду, но интересующимся отвечу: я непатриотично периодически принимаю штатовский MSM. Почему-то получается дешевле, чем купить в России. А в России едим дикорастущие травы и их еще сушу травки и листочки на чаи. 🙂 Можно также высушить листья крапивы, смолоть в порошок и посыпать им любую еду. Про крапиву еще напишу отдельно.
Физические и химические свойства серы
Электронная конфигурация 1s22s22p63s23p4. Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67С, плавления – 112,85С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
S + F2 = SF6;
2S + Cl2 = S2Cl2;
S + Cl2 = SCl2;
5S + 2P = P2S5;
S + H2 = H2S;
2S + C = CS2;
S + O2 = SO2;
2S + Br2 = S2Br2.
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
2Na + S = Na2S;
Ca + S = CaS
2Al + 3S = Al2S3;
Fe + S = FeS.
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
3S + 6KOH = K2SO3 +2K2S + 3H2O;
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
S + 2H2SO4 = 3SO2↑ + 2H2O.
При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Na2S + S = Na2S2.
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S8. Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.
Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Примеры решения задач
Сера (S, Sulphur) — влияние на организм, польза и вред, описание
История серы
Сера и её соединения сопровождают историю человечества с незапамятных времён. Как правило, использовались не самые приятные запахи – горения серы, сероводорода и сернистого газа, наделяя вещество, которое могло испускать такие зловонья, поистине волшебными или даже божественными свойствами. Недаром одним из традиционных применений серы было изготовление священных курений и использование их во многих обрядах некоторых религий (calorizator). Параллельно серу вводили в состав горючих смесей, применяемых во время военных действий. Антуан Лавуазье, считающийся основателем современной науки химии, первым выяснил элементарную природу серы, которую стали получать из пиритов.
Общая характеристика серы
Сера является элементом XVI группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 16 и атомную массу 32,066. Принятое обозначение S (от латинского sulfur).
Физические и химические свойства
Сера является неметаллическим веществом, образующим соли и кислоты. Считается макроэлементом. При взаимодействии с воздухом происходит возгорание серы с образованием газа без цвета, но с резким запахом – сернистого ангидрида.
Продукты питания богатые серой
Богаты серой мясные и рыбные продукты – индейка, говядина, свинина, мясо кролика, курица, говяжья и индюшачья печень, морская рыба (камбала, сардина, окунь, зубатка), перепелиные и куриные яйца, сыр, крупы и бобовые, овощи (белокочанная и брюссельская капуста, лук, чеснок, салат, репа).
Суточная потребность в сере
Норма потребления серы в сутки составляет 0,5-1 г, обычного питания вполне хватает, чтобы получить суточную норму. Спортсменам перед соревнованиями, если нужно набрать массу, серы потребуется до 3 г в сутки, для этого можно увеличить количество белковой пищи или ввести в рацион минеральную воду с содержанием серы.
Полезные свойства серы и его влияние на организм
Сера – незаменимый макроэлемент, без неё невозможны многие важнейшие процессы в организме человека. Сера играет важную роль в процессе свёртываемости крови, защищает протоплазму от вредных бактерий, является важным элементом в синтезе коллагена, поэтому благотворно влияет на состояние кожи, волос и ногтей, замедляет процессы старения организма, оказывает противоаллергическое действие.
Взаимодействие с другими
Сера усваивается быстрее при нормальном количестве в организме железа и фтора, молибден, селен и свинец задерживают усвояемость серы.
Признаки нехватки серы
Признаками дефицита серы в организме считаются:
- Снижение иммунитета и жизненного тонуса;
- Хроническая усталость;
- Запоры;
- Хрупкость ногтей и тусклость волос;
- Воспаления на коже;
- Болезненность суставов.
Признаки избытка серы
Переизбыток серы в организме крайне редок, встречается лишь в регионах, где отмечается пониженное содержание серы.
Применение серы в жизни
Сера – основа для производства серной кислоты, сферы её применения – бумажная и резиновая промышленность, сельское хозяйство, производство пороха и спичек, медицина.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Сера — урок. Химия, 8–9 класс.
Химический элемент
Сера — химический элемент № \(16\). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2h3O, глауберова соль — Na2SO4⋅10h3O).

Самородная сера

Свинцовый блеск
Сера относится к макроэлементам живых организмов. Она содержится в белках. Особенно много серы в белках волос, рогов, шерсти. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.

Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).

При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность (\(2,07\) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
S0+O20=tS+4O2−2.
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg0+S0=Hg+2S−2.
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
2Al0+3S0=tAl+32S−23.
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
h30+S0=th3+1S−2.
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
серы | Определение, свойства, использование и факты
Сера (S) , также обозначается как сера , неметаллический химический элемент, принадлежащий к кислородной группе (группа 16 [VIa] периодической таблицы), один из наиболее реактивных элементов. Чистая сера представляет собой хрупкое твердое вещество бледно-желтого цвета без вкуса и запаха, плохо проводящее электричество и нерастворимое в воде. Реагирует со всеми металлами, кроме золота и платины, с образованием сульфидов; он также образует соединения с несколькими неметаллическими элементами.Ежегодно производятся миллионы тонн серы, в основном для производства серной кислоты, которая широко используется в промышленности.
Британская викторина
118 символов и названий периодической таблицы викторины
сбн
- сера: подводная кипящая сера Кипящие котлы расплавленной серы на склоне вулкана Никко у Марианских островов. Основное финансирование этой экспедиции было предоставлено Программой исследования океана NOAA и программой NOAA Vents; видеоклипы отредактированы Биллом Чедвиком, Государственный университет Орегона / NOAA Просмотреть все видеоролики к этой статье
- сера: кипящая сера под водой Одна рука дистанционно управляемого транспортного средства Джейсона пробивает тонкую корку на залежи расплавленной серы недалеко от Марианы острова. Основное финансирование этой экспедиции было предоставлено Программой исследования океана NOAA и программой NOAA Vents; видеоклипы отредактированы Биллом Чедвиком, Университет штата Орегон / NOAA См. все видео к этой статье
По космическому изобилию сера занимает девятое место среди элементов, составляя только один атом из каждых 20 000–30 000.Сера встречается в несвязанном состоянии, а также в сочетании с другими элементами в горных породах и минералах, которые широко распространены, хотя она классифицируется среди второстепенных компонентов земной коры, в которых ее доля оценивается между 0,03 и 0,06%. На основании открытия, что некоторые метеориты содержат около 12 процентов серы, было высказано предположение, что более глубокие слои Земли содержат гораздо большую долю. Морская вода содержит около 0,09% серы в форме сульфата.В подземных отложениях очень чистой серы, которые присутствуют в куполообразных геологических структурах, считается, что сера образовалась в результате действия бактерий на минеральный ангидрит, в котором сера соединяется с кислородом и кальцием. Отложения серы в вулканических регионах, вероятно, образовались из газообразного сероводорода, образующегося под поверхностью Земли и преобразованного в серу в результате реакции с кислородом воздуха.
| атомный номер | 16 |
|---|---|
| атомный вес | 32.064 |
| точка плавления | |
| ромбическая | 112,8 ° C (235 ° F) |
| моноклинная | 119 ° C (246 ° F) |
| точка кипения | 444,6 ° C ( 832 ° F) |
| плотность (при 20 ° C [68 ° F]) | |
| ромбический | 2,07 г / см 3 |
| моноклинный | 1,96 г / см 3 |
| степени окисления | −2, +4, +6 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 3 с 2 3 п 4 |
История
История серы — это часть древности.Само название, вероятно, пришло на латынь из языка осканов, древнего народа, населявшего регион, включая Везувий, где широко распространены месторождения серы. Доисторические люди использовали серу в качестве пигмента для наскальной живописи; Один из первых зарегистрированных примеров искусства лечения — использование серы в качестве тонизирующего средства.
Сжигание серы играло роль в египетских религиозных церемониях еще 4000 лет назад. Упоминания «огонь и сера» в Библии относятся к сере, предполагая, что «адские огни» подпитываются серой.Начало практического и промышленного использования серы приписывают египтянам, которые использовали диоксид серы для отбеливания хлопка еще в 1600 году до нашей эры. Греческая мифология включает химию серы: Гомер рассказывает об использовании Одиссеем двуокиси серы для окуривания камеры, в которой он убил женихов своей жены. Использование серы во взрывчатых веществах и при демонстрации огня датируется в Китае примерно 500 г. до н.э., а средства для производства пламени, используемые в войне (греческий огонь), были приготовлены из серы в средние века. Плиний Старший в 50 г. н.э. сообщил о нескольких отдельных случаях использования серы и, по иронии судьбы, сам был убит, по всей вероятности, парами серы во время великого извержения Везувия (79 г.Сера рассматривалась алхимиками как принцип горючести. Лавуазье признал его элементом в 1777 году, хотя некоторые считали его соединением водорода и кислорода; его элементарная природа была установлена французскими химиками Жозефом Гей-Люссаком и Луи Тенаром.
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской. Подпишитесь сегодняЕстественное появление и распространение
Многие руды важных металлов представляют собой соединения серы, сульфидов или сульфатов.Некоторыми важными примерами являются галенит (сульфид свинца, PbS), обманка (сульфид цинка, ZnS), пирит (дисульфид железа, FeS 2 ), халькопирит (сульфид железа и меди, CuFeS 2 ), гипс (дигидрат сульфата кальция, CaSO 4 ∙ 2H 2 O) и барит (сульфат бария, BaSO 4 ). Сульфидные руды ценятся в основном за содержание металлов, хотя в процессе, разработанном в 18 веке для производства серной кислоты, использовался диоксид серы, полученный путем сжигания пирита. Уголь, нефть и природный газ содержат соединения серы.
В сере аллотропия возникает из двух источников: (1) различные способы связывания атомов в единую молекулу и (2) упаковка многоатомных молекул серы в различные кристаллические и аморфные формы. Сообщается о 30 аллотропных формах серы, но некоторые из них, вероятно, представляют собой смеси. Только восемь из 30 кажутся уникальными; пять содержат кольца из атомов серы, а остальные содержат цепи.
В ромбоэдрическом аллотропе, обозначаемом ρ-сера, молекулы состоят из колец из шести атомов серы.Эту форму получают обработкой тиосульфата натрия холодной концентрированной соляной кислотой, экстракцией остатка толуолом и выпариванием раствора с получением гексагональных кристаллов. ρ-сера нестабильна, в конечном итоге превращаясь в ромбическую серу (α-серу).
Второй общий аллотропный класс серы — это класс восьмичленных кольцевых молекул, три кристаллические формы которых хорошо охарактеризованы. Один из них — это ромбическая (часто неправильно называемая ромбической) форма, α-сера.Он стабилен при температурах ниже 96 ° C. Другой из кристаллических аллотропов кольца S 8 является моноклинной или β-формой, в которой две оси кристалла перпендикулярны, а третья образует наклонный угол с первыми двумя. Есть еще некоторые неясности относительно его структуры; эта модификация устойчива от 96 ° С до точки плавления 118,9 ° С. Второй моноклинный аллотроп циклооктасеры — это γ-форма, нестабильная при всех температурах, быстро превращающаяся в α-серу.
Сообщается об орторомбической модификации, кольцевых молекулах S 12 и еще одном нестабильном кольцевом аллотропе S 10 . Последний превращается в полимерную серу и S 8 . При температурах выше 96 ° C α-аллотроп превращается в β-аллотроп. Если дать этому переходу достаточно времени, чтобы полностью произойти, дальнейший нагрев вызывает плавление при 118,9 ° C; но если α-форма нагревается так быстро, что превращение в β-форму не успевает произойти, α-форма плавится на 112.8 ° С.
Сера представляет собой прозрачную подвижную жидкость желтого цвета, чуть выше точки плавления. При дальнейшем нагревании вязкость жидкости постепенно снижается до минимума примерно при 157 ° C, но затем быстро увеличивается, достигая максимального значения примерно при 187 ° C; между этой температурой и точкой кипения 444,6 ° C вязкость уменьшается. Цвет также меняется, становясь от желтого до темно-красного и, наконец, до черного примерно при 250 ° C. Считается, что изменения цвета и вязкости являются результатом изменений молекулярной структуры.Уменьшение вязкости при повышении температуры типично для жидкостей, но увеличение вязкости серы выше 157 ° C, вероятно, вызвано разрывом восьмичленных колец атомов серы с образованием реакционноспособных звеньев S 8 , которые соединяются вместе в длинные цепочки, содержащие многие тысячи атомов. В этом случае жидкость приобретает высокую вязкость, характерную для таких структур. При достаточно высокой температуре все циклические молекулы разрываются, и длина цепочек достигает максимума.Выше этой температуры цепи распадаются на мелкие фрагменты. При испарении циклические молекулы (S 8 и S 6 ) образуются снова; при примерно 900 ° C преобладающей формой является S 2 ; наконец, одноатомная сера образуется при температурах выше 1800 ° C.
,Химия серы (Z = 16) — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Физические свойства серы
- Соединения
- Оксиды
- Сероводород h3S
- Прочие серосодержащие соединения
- Производство — процесс Frasch
- Приложения
- Выбросы и окружающая среда
- Внешние ссылки
- Проблемы
- Решения
- Участники
Навыки для развития
- Опишите химический состав кислородной группы.
- Приведите тренд различных свойств.
- Запомните названия элементов группы 16.
- Объясните процесс Фрэша.
- Описать свойства и применение \ (\ mathrm {H_2SO_4} \).
- Объясните свойства и применение \ (\ mathrm {H_2S} \).
Сера — это химический элемент, который в периодической таблице обозначен химическим символом «S» и атомным номером 16. Поскольку сера составляет 0,0384% земной коры, сера является семнадцатым по распространенности элементом после стронция.Сера также принимает множество форм, включая элементарную серу, сероорганические соединения в нефти и угле, H 2 S (г) в природном газе и минеральные сульфиды и сульфаты. Этот элемент извлекается с помощью процесса Фраша (обсуждается ниже), метода, в котором перегретая вода и сжатый воздух используются для вытягивания жидкой серы на поверхность. Оффшорные участки, Техас и Луизиана являются основными участками, которые производят большое количество элементарной серы. Однако элементарная сера также может быть получена путем восстановления H 2 S, обычно обнаруживаемого в нефти и природном газе.Однако по большей части сера используется для производства SO 2 (г) и H 2 SO 4 .
Известная с древних времен (упоминается в еврейских писаниях как сера) сера была классифицирована как элемент в 1777 году Лавуазье. Чистая сера без вкуса и запаха, имеет светло-желтый цвет. Образцы серы, часто встречающиеся в лаборатории, имеют заметный запах. Сера — десятый элемент в известной вселенной по распространенности.
| Атомный номер | 16 |
| Атомный символ | S |
| Атомный вес | 32.07 грамм на моль |
| Структура | орторомбический |
| Фаза при комнатной температуре | цельный |
| Классификация | неметалл |
Физические свойства серы
Сера имеет атомный вес 32,066 грамма на моль и является частью группы 16, семейства кислорода. Это неметалл и имеет удельную теплоемкость 0,706 Дж · г -1 o C -1 .Сродство к электрону составляет 200 кДж / моль -1 , а электроотрицательность равна 2,58 (безразмерная). Сера обычно находится в виде светло-желтого, непрозрачного и хрупкого твердого вещества в больших количествах мелких кристаллов ромбической формы. Сера не только в два раза плотнее воды, но и не растворяется в воде. С другой стороны, сера хорошо растворяется в сероуглероде и слабо растворяется во многих обычных растворителях. Сера также может иметь различный цвет и чернеть при кипячении из-за углеродистых примесей.Даже всего 0,05% углеродистого вещества значительно темнеет сера.
Рисунок \ (\ PageIndex {1} \): Кусок серы, горит синим пламенем, которое трудно увидеть при дневном свете, но его можно увидеть на этой фотографии, если присмотреться. Изображение Йоханнеса Хеммерляйна использовано с разрешения.Большая часть серы извлекается непосредственно в виде элемента из подземных отложений путем нагнетания перегретой воды и откачки расплавленной серы (сера плавится при 112 o C). По сравнению с другими элементами, сера имеет больше всего аллотропов.В то время как кольцо S 8 является наиболее распространенным аллотропом, существует 6 других структур, содержащих до 20 атомов серы на кольцо.
- При соответствующих условиях пар серы может содержать \ (S \), \ (S_2 \), \ (S_4 \), \ (S_6 \) и \ (S_8 \).
- При комнатной температуре ромбическая сера (S α ) представляет собой стабильное твердое вещество, состоящее из циклических молекул \ (S_8 \).
- При 95,5 ° C ромбическая сера превращается в моноклинную серу (S β ) .Кристаллическая структура моноклинной серы отличается от таковой ромбической серы. Моноклинная сера также состоит из молекул \ (S_8 \).
- Моноклинная сера превращается в жидкую серу (S λ ) при 119 ° C. Жидкая сера — это жидкость соломенного цвета, состоящая из молекул \ (S_8 \) и других циклических молекул, содержащих от шести до двадцати атомов.
- При 160 o C это становится темной вязкой жидкостью, называемой Жидкая сера (S μ ) .Молекулы по-прежнему
Сера — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: сера
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе вонючие отложения, скунсы и запах ада.Все они начинаются с буквы S, как и элемент этой недели. Вот Стив Майлон.
Стив Майлон
«Как пахло?» Это был единственный вопрос, который мне нужно было задать своему коллеге-геологу об отложениях, которые она пыталась понять. Запах осадка многое говорит о химическом составе, лежащем в основе. Густые черные бескислородные отложения могут сопровождаться гнилостным запахом, характерным только для восстановленной серы.
Может быть, поэтому сера имеет такую плохую репутацию.Мой сын полгода не ел яйца, когда почувствовал запах своего первого тухлого яйца. В Библии кажется, что всякий раз, когда что-то плохое случается или вот-вот должно произойти, горящая сера изображена на картинке:
Например,
В Бытие мы слышим, «Господь пролил дождем горящую серу на Содом и Гоморру»
А в Откровении мы читаем, что грешники найдут свое место в огненном озере из горящей серы ».
Странно то, что в обоих случаях мы не должны ожидать появления чего-либо пахнущего.Когда сера горит на воздухе, она обычно образует диоксид серы или триоксид серы, последний из которых не имеет запаха [исправлено из аудиофайла подкаста, в котором говорится, что диоксид серы не имеет запаха]. Эти соединения могут далее окисляться и выпадать в виде серной или сернистой кислоты. Это механизм кислотных дождей, которые опустошили леса на северо-востоке Соединенных Штатов, поскольку богатые серой угли сжигаются для выработки электроэнергии в штатах Среднего Запада и переносятся на восток преобладающими ветрами, когда серная кислота выпадает, вызывая всевозможные экологические проблемы.
Кроме того, горящий уголь и туман создают смог во многих промышленных городах, вызывая респираторные заболевания у местных жителей. Здесь также виноваты диоксид серы и серная кислота. Но опять же, с этой формой серы не связано никакого запаха.
Так что, если говорят, что ад или дьявол «пахнет серой», может быть, это не так уж плохо.
Но уменьшите серу, отдав ей пару электронов, и ее запах будет безошибочным. Требование восстановления серы до сульфида явно потеряно при переводе.
Ад, пахнущий сероводородом или любым другим сероорганическим соединением, совсем не будет хорошим местом. Органические сульфидные соединения, известные как тиолы или меркаптаны, настолько плохо пахнут, что их обычно добавляют в природный газ без запаха в очень малых количествах, чтобы служить «сигнализатором запаха» в случае утечки в трубопроводе природного газа. Скунсы используют неприятный запах бутил-селеномеркаптана как средство защиты от врагов. И лично для меня наихудшая химия происходит тогда, когда восстановленная сера придает неприятный (вонючий) привкус бутылкам с вином или пивом.-приведены, чтобы испортить приятную ночь в городе или послеобеденное время в местном пабе.
Итак, откуда берется «запах ада» в бескислородных отложениях. Интересно, что некоторые бактерии эволюционировали, чтобы использовать окисленную серу, сульфат, в качестве акцептора электронов во время дыхания. Подобно тому, как люди превращают элементарный кислород в воду, эти бактерии восстанавливают сульфат до сероводорода — они явно не обращают внимания на запах.
Запах — не единственный интересный химический состав, который сопровождает восстановленную серу.Глубокий черный цвет, связанный с бескислородными отложениями, является результатом низкой растворимости большинства сульфидов металлов. Восстановление сульфата до сульфида обычно сопровождает осаждение пирита (сульфида железа), киновари (сульфида ртути), галенита (сульфида свинца) и многих других минералов. Эти сульфиды металлов стали важным промышленным источником многих из этих важных металлов.
Промышленность — это то место, где вы почти наверняка найдете серу или, что более важно, серную кислоту, которая используется в различных процессах, от производства удобрений до переработки нефти.На самом деле серная кислота считается самым производимым химическим веществом в промышленно развитом мире. Представьте себе, что элемент с такой адской репутацией стал одним из самых важных.
А некоторые даже предполагают, что сера может спасти планету. Биогенное соединение диметилсульфид (ДМС) образуется в результате расщепления диметилсуфоноприопоната, осмотического регулирующего соединения, вырабатываемого планктоном в океане. Летучесть и низкая растворимость DMS приводит к ежегодному выбросу в атмосферу около 20 тг (10 ^ 12) серы.DMS окисляется до SO2 и, наконец, до частиц серной кислоты, которые могут действовать как ядра конденсации облаков, образуя облака, которые имеют общий охлаждающий эффект для планеты.
Представьте себе более высокие температуры, сопровождаемые большей биологической активностью, что приводит к большему выбросу DMS в атмосферу. Образовавшееся облако может охладить нагреющуюся планету. Это похоже на то, как планктон раскрывает зонтик, частично состоящий из серы. Из символа проклятия в спасителя … что за поворот !!.
Крис Смит
Стив Майлон нюхает вонючую историю о Sulphur. К счастью, элемент на следующей неделе намного менее пахучий.
Джон Эмсли
История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем азот, полученный при разложении аммиака. Разница была небольшой, но реальной. Рамзи написал Рэли, предлагая поискать более тяжелый газ в азоте, полученном из воздуха, в то время как Рэли должен искать более легкий газ из аммиака.Рамзи удалил весь азот из своего образца, многократно пропуская его через нагретый магний. Ему оставили один процент, который не вступил в реакцию, и он обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент.
Крис Смит
И этот новый элемент был аргоном, прозванным ленивым элементом, потому что первоначально ученые думали, что он ни с чем не будет реагировать. Теперь мы знаем, что это неправда, и Джон Эмсли будет здесь, чтобы раскрыть секреты аргона в программе «Химия в ее элементе» на следующей неделе. Надеюсь, вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
,серы
Химический элемент сера относится к халькогенам и неметаллам. Это известно с давних времен. Его первооткрыватель и дата открытия неизвестны.
Зона данных
| Классификация: | Сера — это халькоген и неметалл |
| Цвет: | желтый |
| Атомный вес: | 32,06 |
| Состояние: | цельный |
| Точка плавления: | 115.2 o С, 388,4 К |
| Температура кипения: | 444,7 o С, 717,9 К |
| Электронов: | 16 |
| Протонов: | 16 |
| Нейтронов в наиболее распространенном изотопе: | 16 |
| Электронных оболочек: | 2,8,6 |
| Электронная конфигурация: | 1 с 2 2 с 2 2p 6 3s 2 3p 4 |
| Плотность при 20 o C: | 2.07 г / см 3 |
реакций, соединений, радиусов, проводимости
| Атомный объем: | 15,5 см 3 / моль |
| Состав: | S 8 кольца |
| Твердость: | 2 мес |
| Удельная теплоемкость | 0,71 Дж г -1 К -1 |
| Теплота плавления | 1.7175 кДж моль -1 |
| Теплота распыления | 279 кДж моль -1 |
| Теплота испарения | 9,8 кДж моль -1 из S 2 |
| 1 st энергия ионизации | 999,6 кДж моль -1 |
| 2 nd энергия ионизации | 2251 кДж моль -1 |
| 3 rd энергия ионизации | 3360.6 кДж моль -1 |
| Сродство к электрону | 200,4144 кДж моль -1 |
| Минимальная степень окисления | -2 |
| мин. общее окисление нет. | -2 |
| Максимальное число окисления | 6 |
| Макс. общее окисление нет. | 6 |
| Электроотрицательность (шкала Полинга) | 2.58 |
| Объем поляризуемости | 2,9 Å 3 |
| Реакция с воздухом | энергичный, в / в ⇒ SO 2 |
| Реакция с 15 M HNO 3 | сильное, ⇒ H 2 SO 4 , NO x |
| Реакция с 6 M HCl | нет |
| Реакция с 6 М NaOH | нет |
| Оксид (ов) | СО 2 , СО 3 |
| Гидрид (-ы) | H 2 S (сероводород) |
| Хлорид (ы) | S 2 Класс 2 , SCl 2 |
| Атомный радиус | 100 часов |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ионов) | – |
| Ионный радиус (3+ иона) | – |
| Ионный радиус (1-ионный) | – |
| Ионный радиус (2-ионный) | 170 вечера |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 0.205 Вт · м -1 K -1 |
| Электропроводность | 5,0 x 10 -14 S см -1 |
| Температура замерзания / плавления: | 115,2 o С, 388,4 К |
Отложения серы вокруг вулканического источника
Наибольшую пользу для здоровья от лука и чеснока составляют соединения серы.
Серные равнины, простирающиеся вокруг извержения вулканической луны Юпитера Ио.Фотография: НАСА
.Древняя очистка серы: серную руду нагревают в емкостях, крышки которых плотно прилегают, чтобы ограничить выброс SO 2 . (Современный предел кратковременного воздействия для SO 2 составляет 5 частей на миллион. (12) ) Жидкая сера собирается под баками. Георгий Агрикола, 1556.
Открытие серы
Доктор Дуг Стюарт
Сера известна с древних времен. В Библии это называется серой. Его можно найти в элементарном состоянии вокруг жерл вулканов.
Название, возможно, произошло от арабского «суфра», означающего желтый, или санскритского «шульбари», означающего враг (ари) меди (шульба). (1)
Возможность на санскрите привлекательна, потому что она несет послание о знаниях людей химии с давних пор: сера действительно легко реагирует со многими металлами, включая медь. (Санскрит — один из старейших индоевропейских языков — ему более 3000 лет. Несмотря на это, это человеческий язык, наиболее совместимый с искусственным интеллектом. (2) )
Когда сера горит, образуется двуокись серы, ядовитый газ. Одно время этот газ использовался в Нью-Йорке для дезинфекции зданий, зараженных инфекционными заболеваниями. (3)
Использование сжигаемой серы для фумигации началось несколько тысяч лет назад. В «Одиссее» Гомера, которому около 2800 лет, Одиссей говорит: «Принеси серу, старая кормилица, очищающая все загрязнения, и принеси мне огонь, чтобы я очистил дом серой…» (4)
В 808 году китайский текст дает нам, возможно, первый рецепт пороха, содержащего селитру, серу и углерод. (5)
Сера также считается компонентом «греческого огня» — оружия, похожего на огнемет, использовавшийся Византийской империей. (6), (7)
Сера стала признанным химическим элементом в 1789 году, когда Антуан Лавуазье включил ее в свой знаменитый список элементов. (8)
В 1823 году немецкий химик Эйльхард Митчерлих открыл аллотропию серы: он показал, что форма кристаллов серы, полученная при охлаждении расплавленной серы, отличается от формы, полученной при кристаллизации элемента из раствора. (9)
Сера, полученная из расплавленной серы, называется моноклинной серой, а сера, полученная при кристаллизации раствора, называется ромбической серой. Обе формы состоят из колец S 8 . Разница между формами заключается в том, как кольца расположены внутри кристалла.
В то время концепция аллотропии — различных структурных форм одного и того же элемента — не стала формальной частью химии. Только в 1841 году Берцелиус ввел этот термин для объяснения моноклинной и ромбической форм серы. (10)
К 1800-м годам сера в форме серной кислоты стала лучшим способом судить о богатстве страны. Страны даже начали войну из-за серы.
Вот что сказал об этом великий немецкий химик Юстус Либих примерно в 1843 году:
«Не будет преувеличением сказать, что мы можем справедливо судить о коммерческом процветании страны по количеству потребляемой серной кислоты.
(Цена серы влияет на цену…) отбеленных и набивных хлопчатобумажных материалов, мыла, стекла и т. Д., И помня о том, что Великобритания поставляет их в Америку, Испанию, Португалию и Восток, обменивая их на хлопок-сырец, шелк, вино , изюм, индиго и т. д., мы можем понять, почему английское правительство должно было решиться на войну с Неаполем (в 1839 г.), чтобы отменить монополию на серу, которую последняя держава недавно пыталась установить.” (11)
Интересные факты о сере
- Сера составляет почти 3% массы Земли. Если вы думаете, что это немного, в следующий раз, когда вы посмотрите на небо и увидите Луну, подумайте вот о чем: Земля содержит достаточно серы, чтобы образовать не одну новую луну, а две!
- Когда Шекспировский «Отелло» просит о наказании, он упоминает одну возможность: «… зажари меня в сере!»
- Сера горит очень приятным синим пламенем — его старое название — сера, что означает «камень для обжига» или «камень, который горит».’
- Чистая сера не имеет запаха, но многие ее соединения воняют! Например, соединения серы, называемые меркаптанами, придают скунсу ужасный запах. Тухлые яйца (и большинство вонючих бомб) получают свой характерный аромат благодаря сероводороду, H 2 S.
- Некоторые пещерные бактерии переваривают сероводород и производят соплей (представьте слизистые сталактиты) в пещерах. Из этих соплей капает серная кислота с нулевым pH — этого достаточно, чтобы прожечь на вашей одежде дыры, если вы встанете под ними.Снотитовые бактерии процветают в областях, где есть отложения серы, серосодержащих минералов или углеводородов. Серная кислота, которую они выделяют, вырезает под землей новые пещерные системы, растворяя породы.
- Пропорция намного выше
