Виниловая кислота
Энциклопедический словарь Ф. Брокгауза и И. Используются как мономеры для синтеза полимеров и сополимеров. Примеры B. Энциклопедический словарь. Последний в свободном виде не выделен, так как в момент образования он изомеризуется в ацетальдегид см.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Способ получения виниловых эфиров кислот фосфора
- Представители карбоновых кислот.
- Фолиниевая кислота (Folinic acid)
- Версатиковая кислота VERSATIC(TM) Acid 10
- виниловая кислота
Что лучше для пола в квартире: ламинат или виниловая плитка - 3 этапа ухода за виниловыми полами
- Справочник химика 21
- Малый опт виниловая кислота
- Карбоновые кислоты
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: 11. 1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химии
1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химии
Способ получения виниловых эфиров кислот фосфора
Способ обработки целлюлозосодержащих волокнистых материалов патент Мелованный волокнистый материал патент Многослойный бумагоподобный материал для печати патент Бумажная основа обоев с пластмассовым покрытием и обои с пластмассовым покрытием патент Композиция для получения распускаемого, не пропускающего пар покрытия для гибкого бумажного упаковочного материала и способ переработки гибкого бумажного упаковочного материала патент Адгезионное связующее на основе соевого белка для мелования бумаги, композиция для мелования бумаги и способ получения адгезионного связующего на основе соевого белка патент Кроющий материал патент Способ изготовления бумаги для струйной печати с глянцевым покрытием и бумага для струйной печати с глянцевым покрытием патент Способ изготовления бумаги для струйной печати с пигментным покрытием и бумага для струйной печати с пигментным покрытием патент Состав перламутровой краски для отделки обоев патент Бумага или картон с покрытием, пригодные для переработки, и способы их изготовления патент Способ улучшения реологических свойств водной суспензии пигмента, диспергатора и его применение патент Композиция меловального пигмента и бумага или картон, имеющие покрытие из нее патент Композиции покрытий для строительных материалов и подложки строительных материалов с покрытием патент
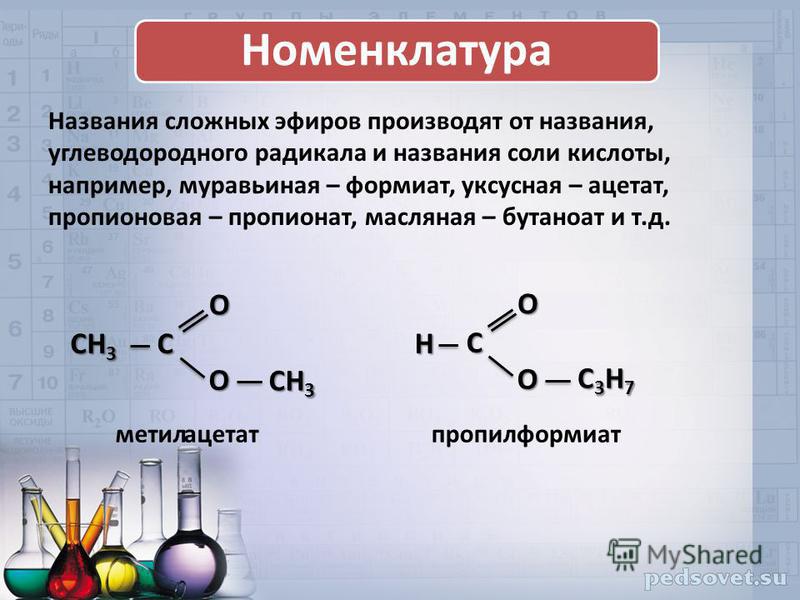
Представители карбоновых кислот.
Местонахождение: Любое. Выбрать несколько. К сожалению, не найдено. Подтвердить Отменить. Фильтр по поставщику: Торговая Гарантия.
Очень велика скорость омылении С Э винилового спирта и жирных кислот; образующийся в результате расщепления виниловый спирт изомеризуется .
Фолиниевая кислота (Folinic acid)
Применение сополимеров, полученных путем проведения на первой реакционной стадии I сополимеризации:. A по меньшей мере одной этиленненасыщенной монокарбоновой или дикарбоновой кислоты или ее производных, выбранных из группы, состоящей из:. C необязательно по меньшей мере одного другого алифатического или циклоалифатического олефина по меньшей мере с четырьмя атомами углерода, отличающегося от олефина В , и. D необязательно одного или нескольких других способных к сополимеризации мономеров, отличающихся от мономеров А , В и С , выбранных из группы, состоящей из:. Dc сложных эфиров мет акриловой кислоты со спиртами, содержащими по меньшей мере пять атомов углерода,. De N-виниловых соединений, выбранных из группы, состоящей из виниловых соединений содержащих по меньшей мере один атом азота гетероциклов, N-виниламидов или N-виниллактамов,. Применение по п. Федеральный институт промышленной собственности.
De N-виниловых соединений, выбранных из группы, состоящей из виниловых соединений содержащих по меньшей мере один атом азота гетероциклов, N-виниламидов или N-виниллактамов,. Применение по п. Федеральный институт промышленной собственности.
Версатиковая кислота VERSATIC(TM) Acid 10
Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые. При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер.
В лайтбокс Скачать бонус. Нужно больше фотографий?
виниловая кислота
Изобретение относится к получению бензолполикарбоновых кислот, используемых в промышленности для производства отвердителей эпоксидных смол, ингибиторов коррозии, а также азопигментов и как пластификаторов виниловых полимеров. Поставленная цель достигается тем, что в известном способе получения бензолгексакарбоновой кислоты, включающем окисление углеродного вещества щелочным раствором перменганата калия при нагревании, согласно изобретению в качестве углеродного вещества используют углеродное волокнистое вещество — сажу, полученную путем термокаталитического разложения гексагептановой фракции, которую подвергают непосредственно окислению в присутствии азотнокислого серебра при o C. Исходное углеродное вещество получают путем термокаталитического разложения гексан-гептановой фракции на азотокислом никеле, в качестве катализатора навеска 0,25 г , при o C, давлении 0,1 МПа, объемной скорости подачи сырья ч, продолжительностьи опыта 5 ч. Способ осуществляется следующим образом. В реактор объемом мл с водяным холодильником загружают 25 г волокнистого углеродного вещества, полученного термокаталитическим разложением гексан-гептановой фракции и предварительно обработанного азотной кислотой для удаления никеля.
Исходное углеродное вещество получают путем термокаталитического разложения гексан-гептановой фракции на азотокислом никеле, в качестве катализатора навеска 0,25 г , при o C, давлении 0,1 МПа, объемной скорости подачи сырья ч, продолжительностьи опыта 5 ч. Способ осуществляется следующим образом. В реактор объемом мл с водяным холодильником загружают 25 г волокнистого углеродного вещества, полученного термокаталитическим разложением гексан-гептановой фракции и предварительно обработанного азотной кислотой для удаления никеля.
Что лучше для пола в квартире: ламинат или виниловая плитка
Абсорбционные спектрофотометрические методы анализа ацеталей, кеталей и виниловых эфиров. Азербаев, Н. Вейсейская, Р. Сополимеризация простых виниловых эфиров гликолей с а-метилстиролом. Антраниловая кислота, виниловые эфиры, полимеризация. Ацетали, кетали и виниловые эфиры абсорбционные спектрофотометрические.
Так, в качестве депрессорной присадки применяют сополимер этилена (58— 88 %) и винилового эфира жирных кислот С1—а (12—42%), который.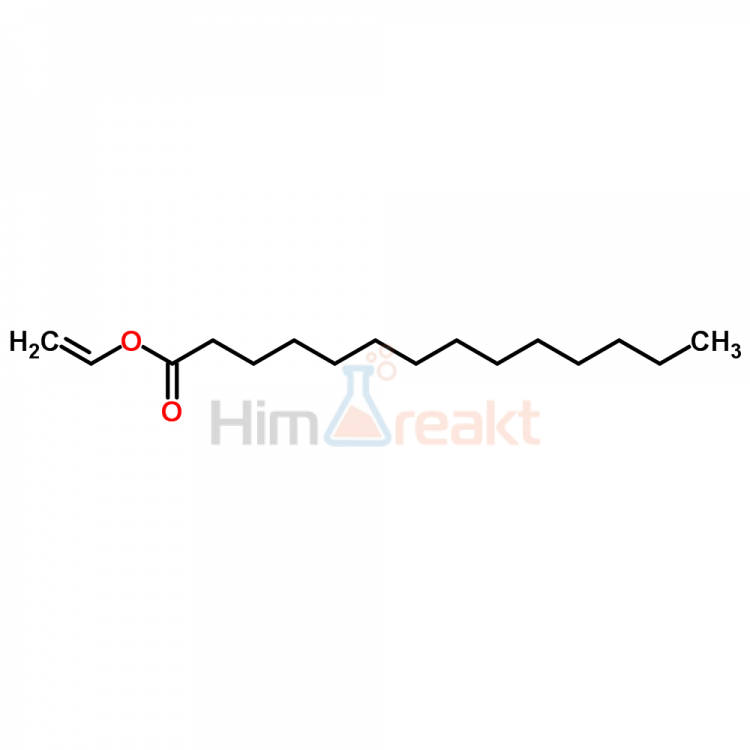
3 этапа ухода за виниловыми полами
Из всего жилого интерьера максимальной нагрузке подвергается пол. По нему двигают мебель, ходят взрослые, бегают дети. Напольное покрытие должно отвечать потребностям и особенностям возраста всех членов семьи.
Справочник химика 21
ВИДЕО ПО ТЕМЕ: Определения кислоты и основания
Виниловые полы отлично подходят для ванн и кухонь, так как они водонепроницаемы и очень легко чистятся. Винил — это недорогое напольное покрытие, оно привлекательно выглядит и имеет мягкую сердцевину, которая делает пол мягче и теплее при ходьбе по нему, в отличие от плитки или паркета. При надлежащем уходе и уборке, ваш виниловый пол может на долгие годы сохранить свой первоначальный блеск и новизну. Но все же, если вы не смогли добиться нужного результата, то советуем вам вспользоваться профессиональной уборкой квартир от нашей клининговой компании.
Виниловые эфиры длинноцепных линейных кислот в отличие от эфиров разветвленных кислот при сополимеризации с винилхлори-дом способствуют значительному понижению не только Гт, но и Гс получаемых сополимеров. Внутренняя пластификация достигается также при помощи длинноцепных алкилвиниловых эфиров, например w — октилового, к-додецилового и к-октадецилового 88, лаурило-вого , этилгексилового т, цетилового и других — виниловых эфиров.
Малый опт виниловая кислота
Яркими представителями карбоновых кислот являются:. Она содержится в выделениях муравьев. Используют в фармацевтике и в пищевой промышленности. Известна как столовой уксус. Используют в качестве консервантов и вкусовой приправы. Основную части уксусной кислоты используют в производстве искусственных волокон на основе целлюлозы.
Карбоновые кислоты
На нашем сайте собрано более бесплатных онлайн калькуляторов по математике, геометрии и физике. Не можете решить контрольную?! Мы поможем!
Виниловой эфир — кислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Виниловые эфиры длинноцепных линейных кислот в отличие от эфиров разветвленных кислот при сополимеризации с винилхлори-дом способствуют значительному понижению не только Гт, но и Гс получаемых сополимеров. Внутренняя пластификация достигается также при помощи длинноцепных алкилвиниловых эфиров, например w — октилового, к-додецилового и к-октадецилового 88, лаурило-вого 121 122, этилгексилового т, цетилового 122 124 и других 125 — 127 виниловых эфиров.
[1]
Внутренняя пластификация достигается также при помощи длинноцепных алкилвиниловых эфиров, например w — октилового, к-додецилового и к-октадецилового 88, лаурило-вого 121 122, этилгексилового т, цетилового 122 124 и других 125 — 127 виниловых эфиров.
[1]
Полимеры виниловых эфиров кислот
с 4 — 11 атомами углерода по консистенции напоминают мягкие каучуки. [2]Рассмотрение реакций образования виниловых эфиров кислот фосфора следует выделить из многочисленных реакций, ведущих к получению самых разнообразных непредельных фосфорорганических соединений. [3]
Мы рассмотрим следующие методы получения виниловых эфиров кислот фосфора: а) взаимодействием эфиров кислот трехвалентного фосфора с а-галоидкарбонильными соединениями; б) дегидрохлорированием диал-киловых эфиров а-окси — ( 3 [ 3-дихлор-иа — окси — 3, 3 ( 3-трихлорэтилфосфиновых кислот и в) взаимодействием хлорангидридов кислот фосфора с ацетальде-гидом и триэтиламином. [4]
[4]
При омылении сополимеров ВА с виниловыми эфирами кислот, имеющих более длинную углеводородную цепь, чем уксусная, в первую очередь гидролизуются винилацетатные звенья. [5]
Рид, Коддинг, Бови [543] синтезировали виниловые эфиры перфторзамещенных кислот жирного ряда ( от уксусной до капроновой и каприновой) и циклогексанкарбоновой кислоты из соответствующих перфторзамещенных кислот и ацетилена на ртутном катализаторе. Жесткость цепи поливиниловых эфиров перфторкислот и температура стеклования снижаются с увеличением числа п атомов углерода в кислотном остатке мономера. [6]
Масляная, кротоновая [50] и высшие одноосновные кислоты [51] также присоединяются к ацетилену в присутствии BF3 и его соединений и образуют виниловые эфиры кислот с хорошим выходом. [7]
Масляная, кро-тоновая [50] и высшие одноосновные кислоты [51 ] также присоединяются к ацетилену в присутствии BF3 и его соединений и образуют виниловые эфиры кислот с хорошим выходом.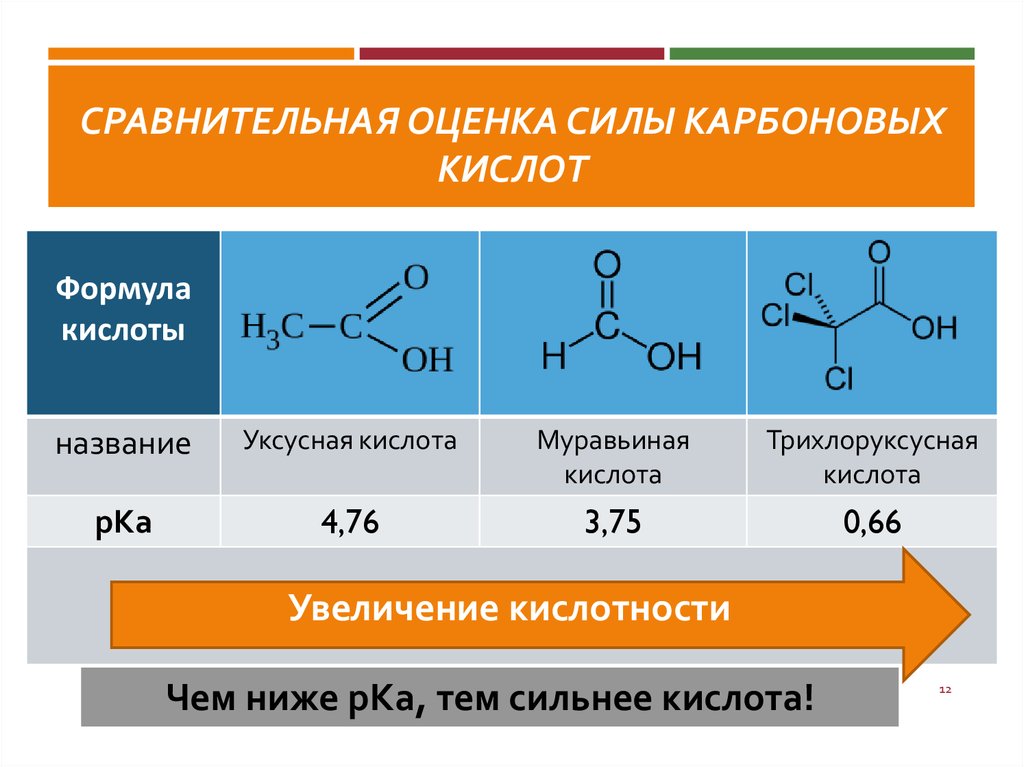 [8]
[8]
Различные степени окисления и типы отвечающих им соединений следующие: ( а) низшая степень окисления, соответствующая углеводородам: алканы, металлоорганические йоединения и алкилбораны; ( б) степень окисления, отвечающая спиртам: галогениды, алкены, амины, простые эфнры, тиолы и сульфиды. Виниловые эфиры кислот, ацетилены, аллены, диолефины, вмины, ацетали, кетали, эпокиси ( окиси), а-галогеизамещеииые простые эфиры я тиокарбонилькые соединения; ( г) степень окисления, соответствующая кислотам: галогенангидриды, ангидриды кислот, сложные эфиры, амиды, соли карбоновых кислот, тригалогенметильиые соединения, нитрилы, ортоэфиры и алкокси — или Хлорапетилекы; ( д) высшая степень окисления, соответствующая двуокиси углерода: производные угольной кислоты, тетрагалогеииды углерода и ортоугольные эфиры. [9]
Выходы в этой ] реакции невелики. Механизм образования виниловых эфиров кислот фосфора по этой реакции авторами не исследован.
Полимеризация фосфор органических соединений, содержащих винильную группу, довольно подробно изучалась в последние годы. В монографии Гефтера приведено много примеров получения сополимеров виниловых эфиров кислот фосфора с различными мономерами. Большинство описанных сополимеров имеет небольшую теплостойкость, обычно ниже 100 С, и не отличается высокими механическими показателями. [11]
Страницы: 1
α-Виниловые аминокислоты: возникновение, асимметричный синтез и биохимические механизмы
. 20 марта 2006 г.; 17 (6): 869-882.
doi: 10. 1016/j.tetasy.2006.02.026.
Epub 2006 4 апр.
1016/j.tetasy.2006.02.026.
Epub 2006 4 апр.
Дэвид Б Берковиц 1 , Брэдли Д. Шаретт 1 , Каннан Р Карукуричи 1 , Джилл М. Макфадден 1
принадлежность
- 1 Химический факультет Университета Небраски, Линкольн, NE 68588-0304.
- PMID: 29977107
- DOI: 10.1016/ж.тетасы.2006.02.026
Бесплатная статья ЧВК
Дэвид Б. Берковиц и соавт.
Тетраэдрическая асимметрия. .
Берковиц и соавт.
Тетраэдрическая асимметрия. .
Бесплатная статья ЧВК
. 20 марта 2006 г.; 17 (6): 869-882.
doi: 10.1016/j.tetasy.2006.02.026. Epub 2006 4 апр.
Авторы
Дэвид Б Берковиц 1 , Брэдли Д. Шаретт 1 , Каннан Р Карукуричи 1 , Джилл М. Макфадден 1
принадлежность
- 1 Химический факультет Университета Небраски, Линкольн, NE 68588-0304.

- PMID: 29977107
- PMCID: PMC6029878
- DOI: 10.1016/ж.тетасы.2006.02.026
Абстрактный
В этом отчете представлен обзор семейства встречающихся в природе «виниловых» аминокислот, а именно тех, которые имеют двойную связь C-C, непосредственно присоединенную к α-углероду вдоль боковой цепи. Рассмотрены стратегии стереоконтролируемого синтеза этих олефиновых аминокислот. Механистическое разнообразие, с помощью которого такие «виниловые триггеры» могут активироваться в активном центре фермента PLP (пиридоксальфосфат), затем подчеркивается при обсуждении винилглицина (VG), его замещенных родственных соединений, особенно AVG [4E-(2′-аминоэтокси)винилглицина. ] и встречающийся в природе VG-предшественник, SMM (S-метилметионин).
] и встречающийся в природе VG-предшественник, SMM (S-метилметионин).
Цифры
Рисунок 1
Ферменты PLP, которые α-депротонируют и…
Рисунок 1
Ферменты PLP, которые α-депротонируют и имеют α-виниловую структуру AA.
фигура 1ферментов PLP, которые α-депротонируют и имеют α-виниловую структуру AA.
Рисунок 2
Природные антиподы винилглицина
Рисунок 2
Природные антиподы винилглицина
фигура 2Природные антиподы винилглицина
Рисунок 3
β-замещенные винилглицины природного происхождения.
Рисунок 3
β-замещенные винилглицины природного происхождения.
Рисунок 3β-замещенных винилглицинов природного происхождения.
Рисунок 4
γ-Замещенные виниловые АК.
Рисунок 4
γ-Замещенные виниловые АК.
Рисунок 4γ-замещенных виниловых аминокислот.
Рисунок 5
β,γ-замещенные виниловые АК.
Рисунок 5
β,γ-замещенные виниловые АК.
β,γ-замещенные виниловые аминокислоты.
Рисунок 6
Аддукты кофактора-AVG, связанные в три…
Рисунок 6
Аддукты кофактора-AVG, связанные с тремя активными центрами фермента PLP (коды PDB: 1M7Y, 1C7O…
Рисунок 6Аддукты кофактора-AVG, связанные с тремя активными центрами фермента PLP (коды PDB: 1M7Y, 1C7O и 1CL2 соответственно.
Рисунок 7
Доказательство действия механизма B для…
Рисунок 7
Доказательства механизма B для L-винилглицина с синтазой ACC (PDB 1YNU) и…
Рисунок 7 Доказательства механизма B для L-винилглицина с АСС-синтазой (PDB 1YNU) и для вигабатрина с ГАМК-трансаминазой (PDB 1YHW).
Схема 1
Запись пиролиза сульфоксида Рапопорта.
Схема 1
Запись пиролиза сульфоксида Рапопорта.
Схема 1Вход для пиролиза сульфоксида Рапопорта.
Схема 2
Путь фотофрагментации Гризбека из L-метионина.
Схема 2
Путь фотофрагментации Гризбека из L-метионина.
Схема 2Путь фотофрагментации Гризбека из L-метионина.
Схема 3
Наше использование фенилселенолата, открывающего лактон…
Схема 3
Наше использование химии раскрытия лактона фенилселенолатом.
Наше использование химии раскрытия лактона фенилселенолатом.
Схема 4
Введение арилселена через Grieco…
Схема 4
Введение арилселена по протоколу Grieco.
Схема 4Введение арилселена по протоколу Grieco.
Схема 5
Окислительное декарбоксилирование L-глутамата по Ганесяну.
Схема 5
Окислительное декарбоксилирование L-глутамата по Ганесяну.
Схема 5 Окислительное декарбоксилирование L-глутамата по Ганесяну.
Схема 6
Декарбоксилативное введение селена через…
Схема 6
Декарбоксилативное введение селена через сложный эфир Бартона.
Схема 6Декарбоксилативное введение селена через сложный эфир Бартона.
Схема 7
Маршрут винилирования Felkin Anh от Galvez от…
Схема 7
Метод Galvez’s Felkin Anh-винилирования из D-глицеральдегида.
Схема 7 Метод Гальвеза Felkin Anh-винилирования из D-глицеральдегида.
Схема 8
Маршрут олефинирования Lajoie’s Peterson из…
Схема 8
Способ олефинирования Лажуа по Петерсону из L-серина.
Схема 8Способ олефинирования Lajoie’s Peterson из L-серина.
Схема 9
Перегруппировка Небера/кинетическое разрешение на основе папаина.
Схема 9
Перегруппировка Небера/кинетическое разрешение на основе папаина.
Схема 9 Перегруппировка Небера/кинетическое разрешение на основе папаина.
Схема 10
Официальное винилирование Шёллькопфом его…
Схема 10
Формальное винилирование Шёллькопфом его хирального енолята глицина.
Схема 10Формальное винилирование Шёллькопфом его хирального енолята глицина.
Схема 11
Протонирование диенолята хиральной кислоты по Дюамелю…
Схема 11
Подход Дюамеля к хиральному протонированию диенолята кислоты.
Схема 11 Подход Дюамеля к хиральному протонированию диенолята кислоты.
Схема 12
Асимметричное аллильное аминирование Trost DYKAT…
Схема 12
Метод асимметричного аллильного аминирования Trost DYKAT.
Схема 12Метод асимметричного аллильного аминирования Trost DYKAT.
Схема 13
Наш Ni(0)-опосредованный асимметричный аллил…
Схема 13
Наш Ni(0)-опосредованный путь асимметричного аллильного аминирования.
Схема 13 Наш Ni(0)-опосредованный путь асимметричного аллильного аминирования.
Схема 14
Введение эфира енола в…
Схема 14
Введение эфира енола в E — и Z -MVG
Схема 14Введение эфира енола в E — и Z -MVG
Схема 15
Ферментативное разрешение E -…
Схема 15
Ферментативное расщепление E — и Z -MVG
Схема 15Ферментативное разрешение E — и Z -MVG
Схема 16
Путь Кита к ризобитоксину
Схема 16
Путь Кита к ризобитоксину
Схема 16Путь Кита к ризобитоксину
Схема 17
Подход Кирихаты к E -APPA
Схема 17
Подход Кирихаты к E -APPA
Схема 17Подход Кирихаты к E -APPA
Схема 18
Механизм А: образование винилового имидата…
Схема 18
Механизм A: образование винилового имидата из γ-алкокси-α-виниловых АК посредством катализируемой ферментом PLP азаллильной изомеризации.
Механизм A: образование винилового имидата из γ-алкокси-α-виниловых АК с помощью азаллильной изомеризации, катализируемой ферментом PLP.
Схема 19
Механизм B: Инактивация ACC…
Схема 19
Механизм B: Инактивация АСС-синтазы L-винилглицином посредством катализируемой ферментами азааллильной изомеризации-присоединения по Михаэлю.
Схема 19Механизм B: Инактивация АСС-синтазы L-винилглицином посредством катализируемой ферментом азааллильной изомеризации-присоединения Майкла.
Схема 20
Судьба ЗРК и аналогов…
Схема 20
Судьба SAM и аналогов в активном центре АСС-синтазы.
Судьба SAM и аналогов в активном центре АСС-синтазы.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Механистические исследования с винилглицином и бета-галогенаминобутиратами в качестве субстратов для цистатионин-гамма-синтетазы из Salmonella typhimurium.
Джонстон М., Маркотт П., Донован Дж., Уолш К. Джонстон М. и др. Биохимия. 1979 1 мая; 18(9):1729-38. doi: 10.1021/bi00576a015. Биохимия. 1979. PMID: 373802
Структура АСС-синтазы, инактивируемой ингибитором L-винилглицином, основана на механизме.
Капитани Г., Чопп М., Элиот А.С., Кирш Дж.Ф., Грюттер М.Г. Капитани Г.
 и др.
ФЭБС лат. 2005 г., 25 апреля; 579(11):2458-62. doi: 10.1016/j.febslet.2005.03.048.
ФЭБС лат. 2005.
PMID: 15848188
и др.
ФЭБС лат. 2005 г., 25 апреля; 579(11):2458-62. doi: 10.1016/j.febslet.2005.03.048.
ФЭБС лат. 2005.
PMID: 15848188Мечение активного центра аспартатаминотрансфераз бета, гамма-ненасыщенной аминокислотой винилглицином.
Геринг Х., Рандо Р.Р., Кристен П. Геринг Х. и др. Биохимия. 1977 1 ноября; 16 (22): 4832-6. doi: 10.1021/bi00641a012. Биохимия. 1977. PMID: 911793
Пиридоксаль-5′-фосфатзависимые каталитические антитела.
Граматикова С., Мурату Б., Стетефельд Дж., Мехта П.К., Кристен П. Граматикова С. и соавт. Дж Иммунол Методы. 2002 1 ноября; 269 (1-2): 99-110. doi: 10.1016/s0022-1759(02)00227-2. Дж Иммунол Методы. 2002. PMID: 12379355 Обзор.
Роль шаперона пиридоксаль-5′-фосфата и ее значение при редких заболеваниях с участием B6-зависимых ферментов.

Челлини Б., Монтиоли Р., Оппичи Э., Астегно А., Вольтаторни К.Б. Челлини Б. и др. Клин Биохим. 2014 фев; 47 (3): 158-65. doi: 10.1016/j.clinbiochem.2013.11.021. Epub 2013 16 декабря. Клин Биохим. 2014. PMID: 24355692 Обзор.
Посмотреть все похожие статьи
Грантовая поддержка
- R29 CA062034/CA/NCI NIH HHS/США
α-Виниловые аминокислоты: возникновение, асимметричный синтез и биохимические механизмы
1. Eliot AC, Kirsch JF. Анну Рев Биохим. 2004; 73: 383–415. [PubMed] [Google Scholar]
2. Berkowitz DB, De la Salud-Bea R, Jahng WJ. Орг. лат. 2004; 6: 1821–1824. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Берковиц Д.Б., Чисова Э., Макфадден Дж.М. Тетраэдр. 2001; 57: 6329–6343. [Google Scholar]
4. Берковиц Д.Б., Макфадден Дж. М., Слосс М.К. J Org Chem. 2000;65:2907–2918. [Бесплатная статья PMC] [PubMed] [Google Scholar]
М., Слосс М.К. J Org Chem. 2000;65:2907–2918. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Berkowitz DB, McFadden JM, Chisowa E, Semerad CL. J Am Chem Soc. 2000;122:11031–11032. [Google Scholar]
6. Berkowitz DB, Jahng WJ, Pedersen ML. Bioorg Med Chem Lett. 1996; 6: 2151–2156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Pedersen ML, Berkowitz DB. J Org Chem. 1993;58:6966–75. [Google Scholar]
8. Дарденн Г., Казимир Дж., Марлье М., Ларсен П.О. Фитохимия. 1974; 13: 1897–900. [Google Scholar]
9. Posner BI, Flavin M. J Biol Chem. 1972; 247:6402–11. [PubMed] [Google Scholar]
10. Flavin M, Slaughter C. J Biol Chem. 1960; 235:1112–8. [PubMed] [Google Scholar]
11. Kapke G, Davis L. Biochem Biophys Res Commun. 1975; 65: 765–9. [PubMed] [Google Scholar]
12. Miles EW. Biochem Biophys Res Commun. 1975;66:94–102. [PubMed] [Google Scholar]
13. Soper TS, Manning JM, Marcotte PA, Walsh CT. Дж. Биол. Хим. 1977; 252:1571–5. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
14. Эсаки Н., Судзуки Т., Танака Х., Сода К., Рандо Р.Р. ФЭБС лат. 1977; 84: 309–12. [PubMed] [Google Scholar]
15. Джонстон М., Рейнс Р., Чанг М., Эсаки Н., Сода К., Уолш С. Биохимия. 1981; 20: 4325–33. [PubMed] [Google Scholar]
16. Уолш С., Паскаль Р.А., младший, Джонстон М., Рейнс Р., Дикшит Д., Кранц А., Хонма М. Биохимия. 1981;20:7509–19. [PubMed] [Google Scholar]
17. Рэндо Р.Р. Биохимия. 1974; 13: 3859–63. [PubMed] [Google Scholar]
18. Cornell NW, Zuurendonk PF, Kerich MJ, Straight CB. Биохим Дж. 1984; 220:707–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Asada Y, Tanizawa K, Yonaha K, Soda K. Agric Biol Chem. 1988; 52: 2873–8. [Google Scholar]
20. Маркот П., Уолш К. Биохимия. 1976; 15:3070–6. [PubMed] [Google Scholar]
21. Zabriskie TM, Klinge M, Szymanski CM, Cheng H, Vederas JC. Arch Insect Biochem Physiol. 1994;26:27–48. [PubMed] [Google Scholar]
22. Zabriskie TM, Cheng H, Vederas JC. J Am Chem Soc. 1992;114:2270–2. [Google Scholar]
J Am Chem Soc. 1992;114:2270–2. [Google Scholar]
23. Чжэн Л., Уайт Р.Х., Кэш В.Л., Дин Д.Р. Биохимия. 1994; 33:4714–20. [PubMed] [Google Scholar]
24. Capitani G, Tschopp M, Eliot AC, Kirsch JF, Grutter MG. ФЭБС лат. 2005; 579: 2458–2462. [PubMed] [Google Scholar]
25. Ko S, Eliot AC, Kirsch JF. Арх Биохим Биофиз. 2004; 421:85–90. [PubMed] [Google Scholar]
26. McCarthy DL, Capitani G, Feng L, Gruetter MG, Kirsch JF. Биохимия. 2001;40:12276–12784. [PubMed] [Академия Google]
27. Фэн Л., Кирш Дж. Ф. Биохимия. 2000; 39: 2436–44. [PubMed] [Google Scholar]
28. Сато С., Ян С.Ф. Арх Биохим Биофиз. 1989; 271: 107–12. [PubMed] [Google Scholar]
29. Culvenor CCJ, Edgar JA, Mackay MF, Gorst-Allman CP, Marasas WFO, Steyn PS, Vleggaar R, Wessels PL. Тетраэдр. 1989; 45: 2351–72. [Google Scholar]
30. Mackay MF, Van Donkelaar A, Culvenor CCJ. J Chem Soc Chem Commun. 1986: 1219–21. [Google Scholar]
31. Levenberg B. J Biol Chem. 1968;243:6009–13. [PubMed] [Google Scholar]
1968;243:6009–13. [PubMed] [Google Scholar]
32. Campos L, Marlier M, Dardenne G, Casimir J. Phytochemistry (Elsevier) 1983;22:2507–8. [Google Scholar]
33. Vervier R, Casimir J. Phytochemistry (Elsevier) 1970;9:2059–60. [Google Scholar]
34. Scannell JP, Pruess DL, Demny TC, Sello LH, Williams T, Stempel A. J Antibiot. 1972; 25: 122–7. [PubMed] [Google Scholar]
35. Sahm U, Knobloch G, Wagner F. J Antibiot. 1973; 26: 389–90. [PubMed] [Академия Google]
36. Майлз ВЗ. Необратимые ингибиторы Enzyme-Act, Proc Int Symp. 1978; 73–85 [Google Scholar]
37. Rando RR. Природа. 1974; 250: 586–587. [PubMed] [Google Scholar]
38. Rando RR, Relyea N, Cheng L. J Biol Chem. 1976; 251:3306–3312. [PubMed] [Google Scholar]
39. Dashman T. Life Sci. 1980; 27:1415–22. [PubMed] [Google Scholar]
40. Dashman T, Kamm JJ. Жизнь наук. 1979; 24: 185–92. [PubMed] [Google Scholar]
41. Gonzalez B, Pajares MA, Hermoso JA, Guillerm D, Guillerm G, Sanz-Aparicio J. J Mol Biol. 2003; 331:407–416. [PubMed] [Академия Google]
J Mol Biol. 2003; 331:407–416. [PubMed] [Академия Google]
42. Gonzalez B, Pajares MA, Hermoso JA, Alvarez L, Garrido F, Sufrin JR, Sanz-Aparicio J. J Mol Biol. 2000;300:363–375. [PubMed] [Google Scholar]
43. Pruess DL, Scannell JP, Kellett M, Axe HA, Janecek J, Williams TH, Stempel A, Berger J. J Antibiot. 1974; 27: 229–33. [PubMed] [Google Scholar]
44. Clausen T, Huber R, Messerschmidt A, Pohlenz HD, Laber B. Биохимия. 1997; 36:12633–43. [PubMed] [Google Scholar]
45. Steegborn C, Clausen T, Sondermann P, Jacob U, Worbs M, Marinkovic S, Huber R, Wahl MC. Дж. Биол. Хим. 1999;274:12675–84. [PubMed] [Google Scholar]
46. Krupka HI, Huber R, Holt SC, Clausen T. EMBO J. 2000;19:3168–3178. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Icekson I, Apelbaum A. Biochem Biophys Res Commun. 1983; 113: 586–91. [PubMed] [Google Scholar]
48. Huai Q, Xia Y, Chen Y, Callahan B, Li N, Ke H. J Biol Chem. 2001; 276:38210–38216. [PubMed] [Google Scholar]
49. Capitani G, McCarthy DL, Gut H, Grutter MG, Kirsch JF. Дж. Биол. Хим. 2002;277:49735–49742. [PubMed] [Google Scholar]
Capitani G, McCarthy DL, Gut H, Grutter MG, Kirsch JF. Дж. Биол. Хим. 2002;277:49735–49742. [PubMed] [Google Scholar]
50. Оуэнс Л.Д., Гуггенхайм С., Хилтон Дж.Л. Biochim Biophys Acta, Gen Subj. 1968; 158: 219–25. [PubMed] [Google Scholar]
51. Owens LD, Thompson JF, Pitcher RG, Williams T. J Chem Soc Chem Commun. 1972: 714. [Google Scholar]
52. Yasuta T, Okazaki S, Mitsui H, Yuhashi KI, Ezura H, Minamisawa K. Appl Environ Microbiol. 2001;67:4999–5009. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Mitchell RE, Frey EJ, Benn MH. Фитохимия. 1986;25:2711–2715. [Google Scholar]
54. Джованелли Дж., Оуэнс Л.Д., Мадд С.Х. Биохим Биофиз Акта. 1971; 227: 671–84. [PubMed] [Google Scholar]
55. Minamisawa K, Fukai K, Asami T. J Bacteriol. 1990; 172:4505–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Yasuta T, Satoh S, Minamisawa K. Appl Environ Microbiol. 1999; 65: 849–852. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Ma W, Penrose Donna M, Glick Bernard R. Can J Microbiol. 2002; 48: 947–954. [PubMed] [Академия Google]
Ma W, Penrose Donna M, Glick Bernard R. Can J Microbiol. 2002; 48: 947–954. [PubMed] [Академия Google]
58. Rapp C, Jung G, Kugler M, Loeffler W. Liebigs Ann Chem. 1988: 655–61. [Google Scholar]
59. Фреденхаген А., Ангст С., Питер Х.Х. Дж Антибиот. 1995;48:1043–5. [PubMed] [Google Scholar]
60. Park BK, Hirota A, Sakai H. Agric Biol Chem. 1976; 40: 1905–1906. [Google Scholar]
61. Steegborn C, Laber B, Messerschmidt A, Huber R, Clausen T. J Mol Biol. 2001; 311: 789–801. [PubMed] [Google Scholar]
62. Laber B, Lindell SD, Pohlenz HD. Арка микробиол. 1994;161:400–3. [PubMed] [Google Scholar]
63. Мураками Н., Фурукава Дж., Окуда С., Хатанака С. Фитохимия. 1985; 24:2291–4. [Google Scholar]
64. Мураками Н., Хатанака С. Фитохимия. 1983; 22: 2735–7. [Google Scholar]
65. Timmermans M, Randoux T, Daloze D, Braekman JC, Pasteels JM, Lesage L. Biochem Syst Ecol. 1992; 20: 343–9. [Google Scholar]
66. Plasman V, Plehiers M, Braekman JC, Daloze D, De Biseau JC, Pasteels JM.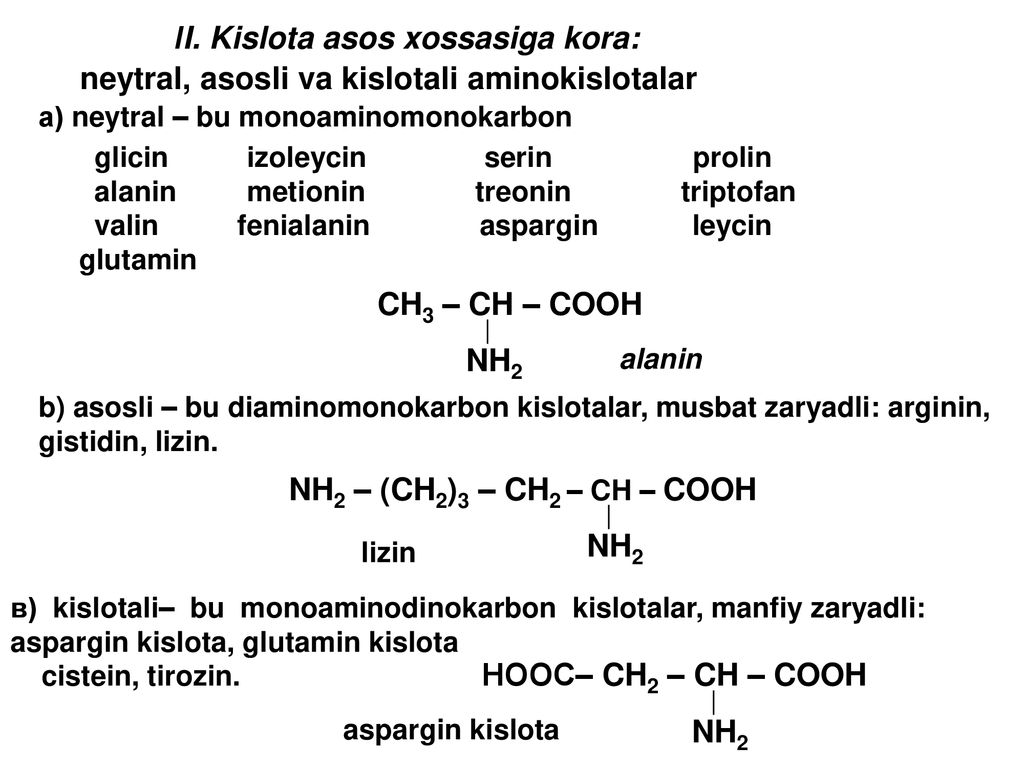 Химиоэкология. 2001; 11: 107–112. [Google Академия]
Химиоэкология. 2001; 11: 107–112. [Google Академия]
67. Аояги Ю., Такасаки С., Фуджихара С., Касуга А., Сугахара Т. Фитохимия. 1997;46:1095–1096. [Google Scholar]
68. Мацуда Х., Окино Т., Харагути Р., Мураками М., Ямагути К. Теннен Юки Кагобуцу Торонкай Коэн Йошишу. 1993; 35: 654–61. [Google Scholar]
69. Matsuda H, Okino T, Murakami M, Yamaguchi K. J Org Chem. 1996;61:8648–8650. [Google Scholar]
70. Коулман Дж. Э., Райт Дж. Л. J Nat Prod. 2001; 64: 668–70. [PubMed] [Google Scholar]
71. Дойл Р.Р., Левенберг Б. Биохимия. 1968;7:2457–62. [PubMed] [Google Scholar]
72. Chaiet L, Arison BH, Monaghan RL, Springer JP, Smith JL, Zimmerman SB. Дж Антибиот. 1984; 37: 207–10. [PubMed] [Google Scholar]
73. Раджеш С., Ами Эй, Котаке Т., Цукамото Х., Кимура Т., Хаяши Ю., Кисо Ю. Наука о пептидах. 2003; 39: 151–152. [Google Scholar]
74. Paleo MR, Aurrecoechea N, Jung KY, Rapoport H. J Org Chem. 2003; 68: 130–138. [PubMed] [Google Scholar]
75. Нолен Э.Г., Куриш А.Дж., Вонг К.А., Орландо М.Д. Тетраэдр Летт. 2003;44:2449–2453. [Google Scholar]
Нолен Э.Г., Куриш А.Дж., Вонг К.А., Орландо М.Д. Тетраэдр Летт. 2003;44:2449–2453. [Google Scholar]
76. Rajesh S, Ami Ei, Kotake T, Kimura T, Hayashi Y, Kiso Y. Bioorg Med Chem Lett. 2002; 12:3615–3617. [PubMed] [Google Scholar]
77. Collier PN, Campbell AD, Patel I, Taylor RJK. Тетраэдр. 2002; 58: 6117–6125. [Google Scholar]
78. Gao Y, Lane-Bell P, Vederas JC. J Org Chem. 1998;63:2133–2143. [Google Scholar]
79. Huwe CM, Blechert S. Synthesis. 1997: 61–67. [Google Scholar]
80. Yoo Se, Lee SH, Jeong N, Cho I. Tetrahedron Lett. 1993;34:3435–3438. [Google Scholar]
81. Zeiss HJ. Тетраэдр. 1992; 48:8263–8270. [Google Scholar]
82. Crisp GT, Glink PT. Тетраэдр. 1992; 48:3541–56. [Google Scholar]
83. Zahn I, Polborn K, Wagner B, Beck W. Chem Ber. 1991; 124:1065–1073. [Google Scholar]
84. Krol WJ, Mao SS, Steele DL, Townsend CA. J Org Chem. 1991; 56: 728–731. [Google Scholar]
85. Meffre P, Vo Quang L, Vo Quang Y, Le Goffic F. Tetrahedron Lett. 1990; 31: 2291–2294. [Google Академия]
Tetrahedron Lett. 1990; 31: 2291–2294. [Google Академия]
86. Мзенгеза С., Уитни Р.А. J Org Chem. 1988; 53: 4074–4081. [Google Scholar]
87. Витяк Дж., Гулд С.Дж., Хайн С.Дж., Кеслер Д.А. J Org Chem. 1987; 52: 2179–2183. [Google Scholar]
88. Мзенгеза С., Ян С.М., Уитни Р.А. J Am Chem Soc. 1987; 109: 276–277. [Google Scholar]
89. Fushiya S, Chiba H, Otsubo A, Nozoe S. Chemistry Lett. 1987: 2229–2232. [Google Scholar]
90. Кардани С., Прати Л., Тинти О. Синтез. 1986: 1032–1035. [Академия Google]
91. Afzali-Ardakani A, Rapoport H. J Org Chem. 1980;45:4817–20. [Google Scholar]
92. Griesbeck AG, Heckroth H. Photochem Photobiol Sci. 2003;2:1130–1133. [PubMed] [Google Scholar]
93. Griesbeck AG, Hirt J. Liebigs Ann Chem. 1995: 1957–61. [Google Scholar]
94. Берковиц Д.Б., Смит М.К. Синтез. 1996: 39–41. [Google Scholar]
95. Pellicciari R, Natalini B, Marinozzi M. Synth Commun. 1988; 18:1715–21. [Google Scholar]
96. Zhang W, Luo S, Fang F, Chen Q, Hu H, Jia X, Zhai H. J Am Chem Soc. 2005; 127:18–19. [PubMed] [Google Scholar]
Zhang W, Luo S, Fang F, Chen Q, Hu H, Jia X, Zhai H. J Am Chem Soc. 2005; 127:18–19. [PubMed] [Google Scholar]
97. Фельдман К.С., Перкинс А.Л., Мастерс К.М. J Org Chem. 2004; 69: 7928–7932. [PubMed] [Google Scholar]
98. Grieco PA, Gilman S, Nishizawa M. J Org Chem. 1976; 41: 1485–1486. [Google Scholar]
99. Ханессиан С., Саху С.П. Тетраэдр Летт. 1984; 25:1425–8. [Google Scholar]
100. Barton DHR, Crich D, Herve Y, Potier P, Thierry J. Tetrahedron. 1985; 41: 4347–57. [Google Scholar]
101. Badorrey R, Cativiela C, Diaz-de-Villegas MD, Galvez JA. Синтез. 1997:747–749. [Google Scholar]
102. Badorrey R, Cativiela C, Diaz-de-Villegas MD, Diez R, Galvez JA. Eur J Org Chem. 2003: 2268–2275. [Google Scholar]
103. Роуз Н.Г.В., Бласкович М.А., Вонг А., Лажуа Г.А. Тетраэдр. 2001; 57: 1497–1507. [Google Scholar]
104. Beaulieu PL, Duceppe JS, Johnson C. J Org Chem. 1991; 56: 4196–204. [Google Scholar]
105. Фриис П., Хелбо П. , Ларсен П.О. Acta Chem Scand, B, Org Chem Biochem. 1974; 28: 317–321. [PubMed] [Академия Google]
, Ларсен П.О. Acta Chem Scand, B, Org Chem Biochem. 1974; 28: 317–321. [PubMed] [Академия Google]
106. Hallinan KO, Crout DHG, Errington W. J Chem Soc Perkin Trans. 1994; 1:3537–43. [Google Scholar]
107. Schoellkopf U, Nozulak J, Groth U. Тетраэдр. 1984; 40:1409–17. [Google Scholar]
108. Худрлик П.Ф., Кулкарни А.К. J Am Chem Soc. 1981; 103: 6251–6253. [Google Scholar]
109. Трост Б.М., Бунт Р.С. J Am Chem Soc. 2000;122:5968–5976. [Google Scholar]
110. Трост Б.М. Pure Appl Chem. 1996; 68: 779–784. [Google Scholar]
111. Трост Б.М., Бунт Р.С. Angew Chem Int Ed Engl. 1996;35:99–102. [Google Scholar]
112. Berkowitz DB, Bose M, Choi S. Angew Chem Int Ed. 2002; 41: 1603–1607. [Бесплатная статья PMC] [PubMed] [Google Scholar]
113. Берковиц Д.Б., Шен В., Майти Г. Тетраэдр: асимметрия. 2004; 15: 2845–2851. [Google Scholar]
114. Berkowitz DB, Maiti G. Org Lett. 2004; 6: 2661–2664. [Бесплатная статья PMC] [PubMed] [Google Scholar]
115.

 и др.
ФЭБС лат. 2005 г., 25 апреля; 579(11):2458-62. doi: 10.1016/j.febslet.2005.03.048.
ФЭБС лат. 2005.
PMID: 15848188
и др.
ФЭБС лат. 2005 г., 25 апреля; 579(11):2458-62. doi: 10.1016/j.febslet.2005.03.048.
ФЭБС лат. 2005.
PMID: 15848188