Грипп сезонный. Существующие вакцины. Вакцины и схемы введения. Специалисты о прививках
Грипп сезонный. Существующие вакцины. Вакцины и схемы введения. Специалисты о прививках- Библиотека
- На связи с экспертом
- Новости
Войти
Вопрос-ответ
Вакцины и схемы введения Существующие вакцины
Эффективность иммунизации современными противогриппозными вакцинами составляет 70-90% и зависит как от конкретной вакцины, условии ее хранения и транспортировки, так и от эпидемиологической обстановки в конкретное время, от особенностей организма и прочих факторов. Уровень заболеваемости гриппом снижается в 1,4-1,7 раза, способствует уменьшению тяжести заболевания, предупреждает развитие тяжелых осложнений и смертельных исходов. В результате сокращается число госпитализаций по поводу пневмонии на 40%, а среди пожилых людей — на 45-85%. Кроме того, на 36-69% снижается частота среднего отита, на 20% — обострений хронического бронхита, на 60-70% сокращается количество обострений бронхиальной астмы.
Иммунитет после введения вакцины формируется через 14 дней и сохраняется в течение всего сезона.
Существующие
вакцины
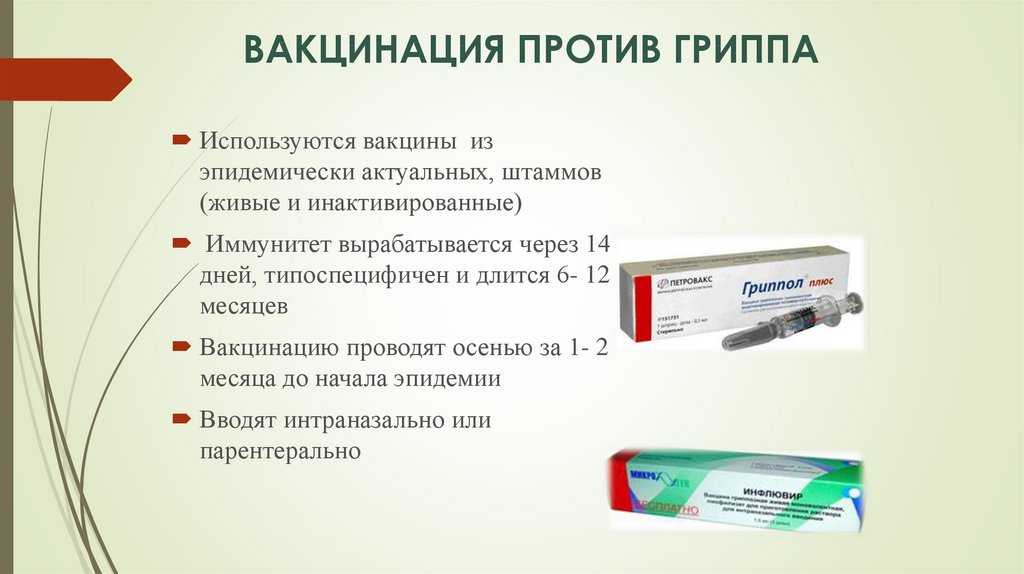
В России используются следующие вакцины:
- СОВИГРИПП — вакцина гриппозная инактивированная субъединичная (Россия)
- ВАКСИГРИПП — инактивированная сплинвакцина для профилактики гриппа (Франция)
- Гриппол — вакцина гриппозная тривалентная полимер-субъединичная жидкая (Россия)
- Инфлювак — вакцина гриппозная субъединичная инактивированная (Нидерланды)
- Бегривак — вакцина для профилактики гриппа инактивированная (Германия)
- Ультрикс — гриппозная инактивированная расщепленная (Россия)
- Флюарикс — вакцина противогриппозная инактивированная расщепленная (Бельгия)
- УльтриксКвадри — вакцина гриппозная 4-х валентная инактивированная расщепленная (Россия)
Схема
вакцинации
Когда:
- с 6 месяцев
Вакцинация против гриппа проводится ежегодно, однократно.
Противопоказания
Временные:
- острые заболевания или обострение хронической патологии
Вакцинация проводится через 2-4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых ОРВИ, острых кишечных заболеваниях вакцинацию проводят сразу после нормализации температуры.
При нетяжелых ОРВИ, острых кишечных заболеваниях вакцинацию проводят сразу после нормализации температуры.
Постоянные:
- гиперчувствительность к куриному белку или другому компоненту вакцины
- сильные аллергические реакции на предыдущее введение препарата
Полезно знать
Ответы на сложные вопросы
Возможные реакции
В месте инъекции:
болезненность
отечность
покраснение
Общие:
повышение температуры
головная боль
слабость, вялость
Возможные поствакцинальные осложнения:
редко
при повышенной чувствительности к отдельным компонентам вакцины — кожный зуд, крапивница или другая сыпь
чрезвычайно редко — тяжелые (системные) аллергические реакции (анафилактический шок)
редко — парестезии, судороги
Вакцинация против гриппа 2021-2022
Документ ВОЗ с требованием о содержании по 15 мкг каждого типа гемагглютинина все-таки существует. Он был выпущен в 2005 году и сообщает следующее:
Он был выпущен в 2005 году и сообщает следующее:
“В течение последних двадцати лет было проведено много клинических исследований цельновирионных, расщепленных и субъединичных гриппозных вакцин. Это привело к утверждению общепринятого принципа о том, что одна доза вакцины, содержащей по 15 мкг каждого типа гемагглютинина на дозу, стимулирует выработку такого уровня антител, который будет приводить к реакции торможения гемагглютинации и соответствовать тому уровню антител, который есть у большинства примированных людей (перевод редактора — Прим.).
A 5.3 Содержание гемагглютинина
Каждая доза человеческой вакцины должна содержать как минимум 15 мкг гемагглютинина каждого штамма, использованного в производстве вакцины.
В некоторых странах на основании данных клинических исследований могут устанавливаться более низкие пороги.
Экспрессия гемагглютинина может отражать неопределенность в измерениях при условии, что нижний доверительный интервал (p = 0,95) тест-системы должен быть не менее 12 мкг гемагглютинина каждого штамма на дозу” (перевод редактора — Прим. ).
).
В последней позиции ВОЗ по вакцинации от гриппа от 2012 года содержится информация, что специфическая активность гриппозных вакцин определяется концентрацией действующего вещества — гемагглютининов, антигенов вирусов гриппа :
“Доза трехвалентной инактивированной вакцины для лиц в возрасте 3 лет и старше содержит 15 мкг каждого из 3 подтипов гемагглютинина, тогда как доза вакцины для детей в возрасте 6–36 месяцев содержит каждого из соответствующих HA [типов гемагглютинина — Прим.] 7,5 мкг или 15 мкг.”
Специфическая активность ≠ реальная эффективность (effectiveness).
Реальная/идеальная эффективность гриппозных вакцин зависит от многих факторов, в том числе от правильной постановки диагноза и степени совпадения вакцинных штаммов и циркулирующих штаммов гриппа.
Ряд российских вакцин содержит меньше чем 15 мкг антигенов. По замыслу производителя, это компенсируют тем, что в данные вакцины добавляют специальный вспомогательный компонент, который усиливает иммунный ответ на вакцинацию. Он называется адъювантом.
Он называется адъювантом.
По опубликованным российскими производителями данным, эти вакцины вызывают иммунный ответ, сила которого сопоставима с иммунным ответом на вакцины с 15 мкг действующего вещества. Одинакового эффекта можно достигнуть либо высокой концентрацией антигенов, либо добавлением адъюванта.
ВОЗ в той же позиции 2012 года заявляет об адъювантах следующее:
“Для усиления иммуногенности в состав ряда трехвалентных вакцин, существующих в настоящее время, вводятся такие адъюванты, как водорастворимые адъюванты или виросомы.
[…]
Наличие в будущем других вакцин, которые могут быть более эффективными в формировании иммунного ответа, с адъювантом или живых аттенуированных вакцин, в дальнейшем принесет больше пользы и потенциально снимет необходимость в 2 дозах гриппозной вакцины для этой возрастной группы [6–23 месяца — Прим.].”
Какие требования существуют к гриппозным вакцинам в России?
- Число лиц с четырехкратным и более увеличением титра антител (сероконверсия) должно быть > 40 %.

- Увеличение среднегеометрического титра (кратности нарастания) > 2,5 раза.
- Доля лиц с защитным титром антител ≥ 1:40 должна быть > 70 %.
По крайней мере один показатель должен отвечать вышеуказанным требованиям. Эти требования являются калькой критериевевропейского Комитета по лекарственным средствам для человека от 1997 года, которые были пересмотрены и отменены в 2014 году.
Какие требования существуют к гриппозным вакцинам в Европе?
Традиционно для европейских регуляторных органов эффективность инактивированных противогриппозных вакцин оценивалась путем определения иммуногенности с помощью серологических тестов. В течение десятилетий нормативная оценка вакцин опиралась на эти критерии и корреляты защиты, хотя их пригодность для ситуаций, в которых они применялись, не была установлена. В 2014 году европейский Комитет по лекарственным средствам для человека опубликовал проект нормативного руководства по оценке противогриппозных вакцин. В руководстве предлагается более полный пакет по определению иммуногенности и реальной эффективности.
В руководстве предлагается более полный пакет по определению иммуногенности и реальной эффективности.
Эффективность сезонных инактивированных вакцин без адъювантов может быть определена с помощью прямого сравнения либо с лицензированной вакциной, либо с вакциной аналогичной конструкции, для которой существуют “какие-либо данные в пользу эффективности”. Если иммунный ответ новой вакцины не хуже, чем у контрольной, разумно предположить, что эффективность будет по крайней мере сопоставимой. Еще один способ — провести рандомизированные контролируемые испытания с клиническими показателями, чтобы определить реальную эффективность вакцины.
В протоколе Комитета по лекарственным средствам для человека указано, что по количественному составу сезонных противогриппозных вакцин есть международный консенсус относительно того, что они должны содержать по 15 мкг каждого типа гемагглютинина. В свою очередь, данное положение ссылается на предписание Европейской фармакопеи, которое звучит так: “Указанное количество гемагглютинина для каждого вакцинного штамма — 15 мкг, если только клинически не будет доказана возможность другого количества”.
Как производятся вакцины против гриппа
- Вакцины против гриппа на основе яиц
- Вакцины против гриппа на клеточной основе
- Рекомбинантные вакцины против гриппа
Внешний значок Управления по лекарственным средствам (FDA):
- яичная вакцина против гриппа, клеточная вакцина против гриппа
- и Рекомбинантная вакцина против гриппа
- .
Все имеющиеся в продаже вакцины против гриппа в США производятся частными производителями. Разные производители используют разные технологии производства, но все вакцины против гриппа соответствуют требованиям FDA по безопасности и эффективности. Различные вакцины имеют разные показания. Дополнительную информацию см. в разделе «Различные типы вакцин против гриппа».
Вакцины против гриппа на основе яиц
Наиболее распространенным способом изготовления вакцин против гриппа является использование производственного процесса на основе яиц
, который используется уже более 70 лет. Производство вакцин на основе яиц используется для производства как инактивированной (убитой) вакцины (обычно называемой «прививкой от гриппа»), так и живой аттенуированной (ослабленной) вакцины (обычно называемой «назальной вакциной против гриппа»).
Производство вакцин на основе яиц используется для производства как инактивированной (убитой) вакцины (обычно называемой «прививкой от гриппа»), так и живой аттенуированной (ослабленной) вакцины (обычно называемой «назальной вакциной против гриппа»).
Процесс производства на основе яиц начинается с того, что CDC или другой лабораторный партнер в рамках Глобальной системы эпиднадзора за гриппом и ответных мер ВОЗ предоставляет производителям частного сектора вакцинные вирусы-кандидаты (CVV), выращенные в яйцах, в соответствии с текущими нормативными требованиями FDA. Затем эти CVV вводят в оплодотворенные куриные яйца и инкубируют в течение нескольких дней, чтобы вирусы могли размножаться. Жидкость, содержащую вирус, собирают из яиц. Для инактивированных противогриппозных вакцин (т. е. прививок от гриппа) вакцинные вирусы затем инактивируются (убиваются) и очищается вирусный антиген. Производственный процесс продолжается тестированием качества, упаковкой и распространением. Для вакцины против гриппа в виде назального спрея (т. е. живой ослабленной противогриппозной вакцины – ЖГВ) исходными CVV являются живые, но ослабленные вирусы, которые проходят другой производственный процесс. FDA тестирует и утверждает все вакцины против гриппа перед выпуском и отправкой.
е. живой ослабленной противогриппозной вакцины – ЖГВ) исходными CVV являются живые, но ослабленные вирусы, которые проходят другой производственный процесс. FDA тестирует и утверждает все вакцины против гриппа перед выпуском и отправкой.
Есть несколько разных производителей, которые используют эту технологию производства для производства вакцин против гриппа для использования в Соединенных Штатах. Этот метод производства требует большого количества куриных яиц для производства вакцины и может занять больше времени, чем другие методы производства.
Вакцины против гриппа на основе клеток
Существует также процесс производства вакцин против гриппа на основе клеток, который был одобрен FDA в 2012 году. Первоначально этот процесс производства также начался с выращивания CVV из яиц в соответствии с правилами FDA. Однако 31 августа 2016 г. FDA выдало разрешение Seqirus, единственному одобренному FDA производителю клеточных вакцин против гриппа в США, на начало использования выращенных на клетках CVV. Производство на основе клеток используется для изготовления инактивированных вакцин против гриппа (например, прививок от гриппа).
Производство на основе клеток используется для изготовления инактивированных вакцин против гриппа (например, прививок от гриппа).
Процесс создания клеточных вакцин против гриппа включает несколько этапов. Во-первых, CDC или один из его лабораторных партнеров используют вирусы гриппа, выращенные в клетках, для создания CVV, которые затем предоставляются производителю вакцины. Затем производитель вакцины инокулирует CVV в культивируемые клетки млекопитающих (вместо яйцеклеток) и позволяет CVV размножаться (т. е. делать копии) в течение нескольких дней. Затем из клеток собирают вируссодержащую жидкость и очищают вирусный антиген. Производственный процесс продолжается очисткой и тестированием. Наконец, FDA тестирует и утверждает вакцины перед выпуском и отправкой.
Для производства клеточной вакцины против гриппа не требуются куриные яйца, поскольку вакцинные вирусы, используемые для изготовления вакцины, выращиваются в клетках животных. Клеточные технологии также могут ускорить запуск процесса производства противогриппозной вакцины.
В то время как вирусы, использовавшиеся в предыдущих сезонах клеточной вакцины, выращивались в клетках, до сезона 2019-2020 гг. некоторые из вирусов, предоставленных производителю, изначально были получены из яиц. В сезоне гриппа 2021-2022 гг. все четыре вируса гриппа, используемые в клеточной вакцине, имеют клеточное происхождение, поэтому вакцина полностью не содержит яиц.
Для получения дополнительной информации посетите веб-страницу CDC о клеточных вакцинах против гриппа.
Рекомбинантные вакцины против гриппа
Это изображение вируса гриппа. Поверхностные белки гемагглютинина (HA) вируса показаны синим цветом. НА вируса гриппа являются антигенами. Антигены — это особенности вируса гриппа, которые распознаются иммунной системой и вызывают защитный иммунный ответ. Большинство вакцин против гриппа предназначены для запуска иммунного ответа против НА циркулирующих вирусов гриппа.
Существует третья технология производства вакцин против гриппа, которая была одобрена для использования на рынке США в 2013 г. и предполагает использование рекомбинантной технологии. Рекомбинантные вакцины против гриппа не требуют наличия образца вакцинного вируса-кандидата (CVV) для производства. Вместо этого рекомбинантные вакцины создаются синтетическим путем. Чтобы создать рекомбинантную вакцину, ученые, занимающиеся гриппом, сначала получают ген, содержащий генетические инструкции для создания поверхностного белка, называемого гемагглютинином (HA), обнаруженного в вирусах гриппа. HA представляет собой антиген, характерный для вируса гриппа, который запускает иммунную систему человека для создания антител, специально нацеленных на вирус. Этот ген для создания антигена HA вируса гриппа затем объединяется с бакуловирусом, вирусом, инфицирующим беспозвоночных. В результате получается «рекомбинантный» бакуловирус. Роль бакуловируса заключается в том, чтобы помочь транспортировать генетические инструкции для создания антигена HA вируса гриппа в клетку-хозяин. Как только рекомбинантный вирус попадает в линию клеток-хозяев, сертифицированную Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), он инструктирует клетки быстро продуцировать антиген HA.
и предполагает использование рекомбинантной технологии. Рекомбинантные вакцины против гриппа не требуют наличия образца вакцинного вируса-кандидата (CVV) для производства. Вместо этого рекомбинантные вакцины создаются синтетическим путем. Чтобы создать рекомбинантную вакцину, ученые, занимающиеся гриппом, сначала получают ген, содержащий генетические инструкции для создания поверхностного белка, называемого гемагглютинином (HA), обнаруженного в вирусах гриппа. HA представляет собой антиген, характерный для вируса гриппа, который запускает иммунную систему человека для создания антител, специально нацеленных на вирус. Этот ген для создания антигена HA вируса гриппа затем объединяется с бакуловирусом, вирусом, инфицирующим беспозвоночных. В результате получается «рекомбинантный» бакуловирус. Роль бакуловируса заключается в том, чтобы помочь транспортировать генетические инструкции для создания антигена HA вируса гриппа в клетку-хозяин. Как только рекомбинантный вирус попадает в линию клеток-хозяев, сертифицированную Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), он инструктирует клетки быстро продуцировать антиген HA.
Этот метод производства не требует вакцинного вируса, выращенного на яйцах, и вообще не использует куриные яйца в производственном процессе. Хотя на рынке США есть и другие вакцины, в которых используются аналогичные рекомбинантные процессы производства, в настоящее время существует только одна вакцина против гриппа, произведенная с использованием рекомбинантной технологии, одобренной FDA для использования в Соединенных Штатах. Этот производственный процесс является самым быстрым, поскольку он не ограничивается отбором вакцинных вирусов, адаптированных для роста в яйцах, или разработкой вакцинных вирусов на клеточной основе.
CDC и FDA контролируют безопасность всех вакцин, лицензированных в США, включая вакцины против сезонного гриппа.
- Эволюция и революция вакцин против гриппаВнешний значок на веб-сайте Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
- Исследование вакцины против гриппа, внешний значок на веб-сайте Национального института аллергии и инфекционных заболеваний, Национальный институт здравоохранения.
- Развитие вакцины против гриппа
Выбор вирусов для вакцины против сезонного гриппа
- Резюме
- Вопросы и ответы
Резюме
Вакцины против сезонного гриппа предназначены для защиты от четырех основных групп вирусов гриппа типа A и B, которые, как показывают исследования, с наибольшей вероятностью распространится и вызовет заболевание среди людей во время предстоящего сезона гриппа.
- какие вирусы гриппа заражают людей перед предстоящим сезоном гриппа,
- степень распространения этих вирусов перед предстоящим сезоном гриппа,
- насколько хорошо вакцины предыдущего сезона могут защитить от этих вирусов гриппа, и
- способность вакцинных вирусов обеспечивать перекрестную защиту от ряда родственных вирусов гриппа того же типа или подтипа/линии.
В настоящее время существует 144 национальных центра по гриппу в более чем 114 странах, которые проводят круглогодичный эпиднадзор за вирусами гриппа в рамках Глобальной системы эпиднадзора за гриппом и ответных мер (ГСЭГО) Всемирной организации здравоохранения (ВОЗ). образцов вируса гриппа от пациентов. Для эпиднадзора за сезонным гриппом у людей лаборатории направляют репрезентативные вирусы в пять* из семи сотрудничающих центров ВОЗ по гриппу, которые расположены в следующих местах:
- Атланта, Джорджия, США (Центры по контролю и профилактике заболеваний, CDC)
- Мемфис, Теннесси, США (Детская исследовательская больница Св.
 Иуды)
Иуды) - Лондон, Великобритания (Институт Фрэнсиса Крика)
- Мельбурн, Австралия (Справочная лаборатория по инфекционным заболеваниям Виктории)
- Токио, Япония (Национальный институт инфекционных заболеваний)
- Пекин, Китай (Национальный институт контроля и профилактики вирусных заболеваний)
- Кольцово, Российская Федерация (Государственный научный центр вирусологии и биотехнологии «ВЕКТОР», Роспотребнадзор)
*Примечание. Два Сотрудничающих центра ВОЗ: в Мемфисе, Теннесси и в Кольцово, Российская Федерация, собирают только образцы вируса гриппа у животных и не участвуют в эпиднадзоре за сезонным гриппом среди людей.
Дважды в год ВОЗ организует консультации с директорами семи сотрудничающих центров ВОЗ, основных контрольных лабораторий и представителями ключевых национальных лабораторий и академий. Они рассматривают результаты эпиднадзора, лабораторных и клинических исследований, а также наличие вирусов вакцин против гриппа и дают рекомендации по составу вакцин против гриппа. Эти встречи проходят в феврале для отбора предстоящих вакцин против сезонного гриппа в Северном полушарии и в сентябре для вакцин против гриппа в Южном полушарии. Комитет ВОЗ по составу вакцин, в состав которого входят независимые технические консультанты, т. е. директора каждого из сотрудничающих центров ВОЗ и основных регулирующих лабораторий (ELR), собирается для представления глобальных данных о гриппе и рекомендации конкретных вакцинных вирусов для трехвалентных (трехкомпонентных вирусов) ) и квадривалентные (четырехкомпонентные) гриппозные вакцины. Далее каждая страна принимает собственное решение о том, какие вирусы должны быть включены в вакцины против гриппа, лицензированные в стране.
Эти встречи проходят в феврале для отбора предстоящих вакцин против сезонного гриппа в Северном полушарии и в сентябре для вакцин против гриппа в Южном полушарии. Комитет ВОЗ по составу вакцин, в состав которого входят независимые технические консультанты, т. е. директора каждого из сотрудничающих центров ВОЗ и основных регулирующих лабораторий (ELR), собирается для представления глобальных данных о гриппе и рекомендации конкретных вакцинных вирусов для трехвалентных (трехкомпонентных вирусов) ) и квадривалентные (четырехкомпонентные) гриппозные вакцины. Далее каждая страна принимает собственное решение о том, какие вирусы должны быть включены в вакцины против гриппа, лицензированные в стране.
В США Консультативный комитет по вакцинам и родственным биологическим продуктам (VRBPAC) Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) принимает окончательное решение о вакцинных вирусах для вакцин против домашнего гриппа. Информация о циркуляции вирусов гриппа и доступных вакцинных вирусов обобщается и представляется консультативному комитету FDA в феврале или марте каждого года для принятия решения США о том, какие вирусы включить в вакцину против гриппа в предстоящем сезоне.
Вопросы и ответы
Какова роль отдела CDC по гриппу в выборе вакцинного вируса?
Являясь одним из семи сотрудничающих центров ВОЗ Глобальной системы эпиднадзора за гриппом и ответных мер (ГСЭГО), Отдел по гриппу CDC ежегодно получает и тестирует тысячи вирусов гриппа со всего мира и сотрудничает с другими сотрудничающими центрами ВОЗsexternal icon и национальными центрами по гриппу в ежегодном процессе отбора сезонных вакцинных вирусов для северного и южного полушарий. CDC играет важную роль в выявлении и тестировании вирусов гриппа, которые распространяются по всему миру, благодаря своей деятельности по глобальному эпиднадзору, а затем в подготовке вирусов-кандидатов для вакцин (CVV). Отдел гриппа предоставляет эту информацию во время консультативных совещаний ВОЗ по вакцинам и участвует в обсуждениях относительно того, какие вирусы должны быть рекомендованы ВОЗ, а в США — в решениях FDA VRBPAC для включения в вакцины против гриппа.
Каковы основные факторы, влияющие на выбор вирусов для использования в производстве вакцин против гриппа каждый год?
Вирусы гриппа в вакцинах против сезонного гриппа отбираются каждый год на основе различных данных, включая следующие: разных уголков мира в разное время.

- Определение антигенных характеристик проводится отдельно для каждого из четырех компонентов вакцины против сезонного гриппа в США. И состав вакцины для каждого компонента определяется самостоятельно. В некоторые сезоны может потребоваться обновление одного или нескольких компонентов вакцины против гриппа.
 Антисыворотка хорька
Антисыворотка хорька - также используется для квалификации новых вакцинных вирусов-кандидатов (CVV) как антигенно сходных с рекомендуемым вакцинным вирусом. CVV — это вирус гриппа, подготовленный CDC или партнерами в области общественного здравоохранения для использования производителями вакцин для производства вакцины против гриппа.
 Лабораторные тесты, включая анализ ингибирования гемагглютинации (тест HI) и анализ микронейтрализации, обычно используются для серологического тестирования. Цель состоит в том, чтобы измерить, насколько хорошо антитела, полученные в результате вакцинации против гриппа, могут распознавать и нейтрализовать циркулирующие вирусы гриппа. Если антитела, полученные в результате вакцинации, эффективно нейтрализуют циркулирующие вирусы гриппа, то вполне вероятно, что состав нынешней противогриппозной вакцины соответствует требованиям и защитит людей в предстоящий сезон гриппа. Это может означать, что состав вакцины против гриппа не нуждается в обновлении. Напротив, если антитела, полученные в результате вакцинации, неэффективно нейтрализуют циркулирующие в настоящее время вирусы гриппа, то, вероятно, этот компонент необходимо будет обновить. Серологические исследования на людях полезны, потому что люди имеют разные уровни ранее существовавших антител от предшествующих инфекций и вакцинации и, следовательно, могут реагировать на вакцины иначе, чем хорьки, у которых ранее не было антител к гриппу.
Лабораторные тесты, включая анализ ингибирования гемагглютинации (тест HI) и анализ микронейтрализации, обычно используются для серологического тестирования. Цель состоит в том, чтобы измерить, насколько хорошо антитела, полученные в результате вакцинации против гриппа, могут распознавать и нейтрализовать циркулирующие вирусы гриппа. Если антитела, полученные в результате вакцинации, эффективно нейтрализуют циркулирующие вирусы гриппа, то вполне вероятно, что состав нынешней противогриппозной вакцины соответствует требованиям и защитит людей в предстоящий сезон гриппа. Это может означать, что состав вакцины против гриппа не нуждается в обновлении. Напротив, если антитела, полученные в результате вакцинации, неэффективно нейтрализуют циркулирующие в настоящее время вирусы гриппа, то, вероятно, этот компонент необходимо будет обновить. Серологические исследования на людях полезны, потому что люди имеют разные уровни ранее существовавших антител от предшествующих инфекций и вакцинации и, следовательно, могут реагировать на вакцины иначе, чем хорьки, у которых ранее не было антител к гриппу.
 Вирусные факторы и факторы хозяина, такие как возраст, сопутствующие заболевания, перенесенные заболевания гриппом в анамнезе и предшествующая вакцинация против гриппа, — все это может повлиять на преимущества, получаемые от вакцинации. Наиболее важным фактором, влияющим на преимущества, обеспечиваемые вакцинами против гриппа, является степень антигенного сходства вакцинных вирусов с циркулирующими вирусами гриппа. Поскольку все эти факторы играют роль в пользе вакцин против гриппа, именно поэтому так важно собирать все виды данных, описанных на этой странице.
Вирусные факторы и факторы хозяина, такие как возраст, сопутствующие заболевания, перенесенные заболевания гриппом в анамнезе и предшествующая вакцинация против гриппа, — все это может повлиять на преимущества, получаемые от вакцинации. Наиболее важным фактором, влияющим на преимущества, обеспечиваемые вакцинами против гриппа, является степень антигенного сходства вакцинных вирусов с циркулирующими вирусами гриппа. Поскольку все эти факторы играют роль в пользе вакцин против гриппа, именно поэтому так важно собирать все виды данных, описанных на этой странице. Наличие хороших вирусов-кандидатов для вакцины: Вакцинные вирусы-кандидаты (CVV) должны быть протестированы и доступны вовремя, чтобы производители могли производить большое количество вакцинного вируса, необходимого для производства вакцины против гриппа. CVV выбраны для защиты от вирусов, которые могут циркулировать в течение предстоящего сезона. Существует множество факторов, которые могут затруднить получение хорошего вакцинного вируса для производства вакцины, включая как научные проблемы, так и нехватку времени.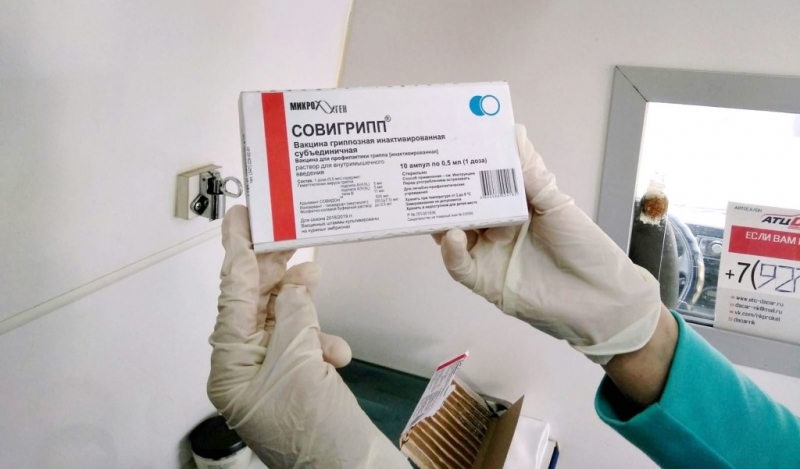 Например, CVV должны быть подготовлены и предоставлены производителям вакцин заблаговременно, чтобы они могли произвести вакцину к сезону гриппа. В некоторые годы некоторые вирусы гриппа могут не циркулировать до конца сезона гриппа, что затрудняет своевременную подготовку вакцинного вируса-кандидата для производства вакцины. Это может сделать отбор вакцинного вируса очень сложным. Исторически FDA требовало, чтобы вакцинные вирусы выделялись и выращивались в куриных яйцах, но теперь FDA разрешает выращивать вакцинные вирусы и в клетках. Некоторые вирусы гриппа, такие как вирусы гриппа A(h4N2), плохо растут в яйцах, что затрудняет получение хороших CVV для производства вакцин. В CVV, выращенных в яйцах, могут развиваться изменения, вызванные адаптацией вируса к яйцам, и такие изменения могут снижать антигенное сходство вакцинного вируса с циркулирующими вирусами. Изменения, адаптированные к яйцам, не затрагивают вакцины, в которых используются более новые технологии, такие как клеточные или рекомбинантные вакцины против гриппа.
Например, CVV должны быть подготовлены и предоставлены производителям вакцин заблаговременно, чтобы они могли произвести вакцину к сезону гриппа. В некоторые годы некоторые вирусы гриппа могут не циркулировать до конца сезона гриппа, что затрудняет своевременную подготовку вакцинного вируса-кандидата для производства вакцины. Это может сделать отбор вакцинного вируса очень сложным. Исторически FDA требовало, чтобы вакцинные вирусы выделялись и выращивались в куриных яйцах, но теперь FDA разрешает выращивать вакцинные вирусы и в клетках. Некоторые вирусы гриппа, такие как вирусы гриппа A(h4N2), плохо растут в яйцах, что затрудняет получение хороших CVV для производства вакцин. В CVV, выращенных в яйцах, могут развиваться изменения, вызванные адаптацией вируса к яйцам, и такие изменения могут снижать антигенное сходство вакцинного вируса с циркулирующими вирусами. Изменения, адаптированные к яйцам, не затрагивают вакцины, в которых используются более новые технологии, такие как клеточные или рекомбинантные вакцины против гриппа.
В некоторые годы некоторые вирусы гриппа могут не циркулировать до конца сезона гриппа, что затрудняет своевременную подготовку вакцинного вируса-кандидата для производства вакцины. Это может сделать отбор вакцинного вируса очень сложным.
Как CDC определяет, будет ли вакцинный вирус защищать от циркулирующего вируса?
Отделение CDC по гриппу каждую неделю собирает и сообщает информацию об активности гриппа в США. Лабораторные исследования циркулирующих вирусов гриппа позволяют CDC оценивать способность вакцинных вирусов нацеливаться и нейтрализовать циркулирующие вирусы гриппа каждый сезон. Генетическая характеристика может дать информацию для принятия решений о выборе вакцинного вируса на основе сходства между геномами вакцинных вирусов и циркулирующих вирусов гриппа. Антигенная характеристика может указать, эволюционировали ли циркулирующие вирусы таким образом, что текущая вакцина против гриппа не может вызывать оптимальный иммунный ответ против них. Антигенная характеристика играет важную роль в ранней оценке того, насколько хорошо может работать вакцина, путем изучения того, насколько хорошо антитела хорька могут нацеливаться и нейтрализовать циркулирующие вирусы гриппа. Поскольку хорьки, используемые для определения антигенных характеристик, никогда ранее не были вакцинированы или инфицированы гриппом, они продуцируют очень специфические и узконаправленные антитела. Однако одним из ограничений данных антигенной характеристики хорьков является то, что они не учитывают человеческий опыт и то, как предшествующие инфекции гриппа и вакцинация людей могут влиять на то, как их иммунная система реагирует на современные вакцины против гриппа. В результате CDC также использует серологические исследования человека, которые включают сбор образцов крови у людей. В рамках этих исследований антитела людей (обнаруженные в их крови) проверяются, чтобы определить, воздействуют ли они на циркулирующие вирусы гриппа и нейтрализуют их как до, так и после вакцинации. Такие исследования лучше учитывают роль предшествующих инфекций и прививок в иммунном ответе человека на вакцинацию. Наиболее непосредственным показателем защиты, получаемой от вакцинации против гриппа, являются исследования эффективности вакцин.
Поскольку хорьки, используемые для определения антигенных характеристик, никогда ранее не были вакцинированы или инфицированы гриппом, они продуцируют очень специфические и узконаправленные антитела. Однако одним из ограничений данных антигенной характеристики хорьков является то, что они не учитывают человеческий опыт и то, как предшествующие инфекции гриппа и вакцинация людей могут влиять на то, как их иммунная система реагирует на современные вакцины против гриппа. В результате CDC также использует серологические исследования человека, которые включают сбор образцов крови у людей. В рамках этих исследований антитела людей (обнаруженные в их крови) проверяются, чтобы определить, воздействуют ли они на циркулирующие вирусы гриппа и нейтрализуют их как до, так и после вакцинации. Такие исследования лучше учитывают роль предшествующих инфекций и прививок в иммунном ответе человека на вакцинацию. Наиболее непосредственным показателем защиты, получаемой от вакцинации против гриппа, являются исследования эффективности вакцин.


 Иуды)
Иуды)