Уксусная кислота – свойства, области применения, пищевая добавка Е-260
Одной из первых кислот, которая стала известна людям еще в древности, стала уксусная кислота. Обнаружено это было случайно – вследствие появления уксуса при скисании вина. В 1700 году Шталь получил концентрированную разновидность химической разновидности жидкости, а в 1814 – Берцелиус установил точный его состав.
Получение уксусной кислоты возможно разными путями, а применяется она достаточно широко во многих направлениях хозяйственной деятельности.
Что такое уксусная кислота?
Уксусная кислота является синтетическим продуктом брожения углеводов и спиртов, а также естественного скисания сухих виноградных вин. Принимая участие в процессе обмена веществ в организме человека, данная кислота является пищевой добавкой, используемой для приготовления маринадов и консервации.
Производными кислоты считаются уксус – 3-9%, и уксусная эссенция – 70-80%. Эфиры и соли уксусной кислоты называются ацетатами.
Транспортировка кислоты на разные расстояния осуществляется в железнодорожных или автомобильных цистернах, изготовленных из специализированных марок нержавеющей стали. В складских условиях она хранится в герметичных емкостях, контейнерах, бочках под навесами или в помещениях. Заливать и хранить вещество в полимерной таре можно в течение одного календарного месяца.
Качественные характеристики уксусной кислоты
Бесцветная жидкость с кислым привкусом и резковатым запахом, которой является уксусная кислота, имеет ряд определенных преимуществ. Конкретные свойства делают кислоту незаменимой во многих химических соединениях и продуктах бытового назначения.
Уксусная кислота, как одна из представителей карбоновых, имеет способность к проявлению высокой реакционной способности.
- Образование солей;
- Образование амидов;
- Образование сложных эфиров.
К уксусной кислоте предъявляется ряд определенных технических требований. Жидкость должна растворяться в воде, не иметь механических примесей и иметь установленные пропорции качественных составляющих.
Основные области применения уксусной кислоты Е-260
Разнообразие сфер, в которых применима уксусная кислота, достаточно велико. Данная кислота является непременным компонентом многих лекарственных препаратов – например, фенацетина, аспирина и других разновидностей. Ароматические амины Nh3-группы защищаются в процессе нитрования введением ацетильной группы СН3СО – это также одна из наиболее распространенных реакций, в которые вступает уксусная кислота.
 Не обходится без ее участия производство разнообразной парфюмерии и негорючих пленок.
Не обходится без ее участия производство разнообразной парфюмерии и негорючих пленок.Часто применима уксусная кислота в пищевой промышленности – в качестве пищевой добавки Е-260. Консервирование и бытовая кулинария также являются успешным полем действия и применения качественной натуральной добавки.
При крашении основные типы солей уксусной кислоты играют роли специальных протрав, обеспечивая стабильную связь текстильных волокон с красителем. Эти соли часто применяются в борьбе с самыми стойкими разновидностями растений-вредителей.
Меры предосторожности при работе с уксусной кислотой
Уксусная кислота считается легковоспламеняющейся жидкостью, которой присвоен третий класс опасности – в соответствии с классификацией веществ по степени опасного воздействия на организм. При любых работах с данным видом кислоты специалисты пользуются индивидуальными современными средствами защиты (фильтрующими противогазами).
Даже пищевая добавка Е-260 может оказаться токсичной для человеческого организма, однако зависеть степень воздействия будет от качества разбавления водой концентрированной уксусной кислоты. Растворы, концентрация кислоты в которых превышает уровень в 30%, считаются опасными для жизни. Соприкасаясь с кожей и слизистыми оболочками, уксусная кислота высокой концентрации вызовет сильнейшие химические ожоги.
Растворы, концентрация кислоты в которых превышает уровень в 30%, считаются опасными для жизни. Соприкасаясь с кожей и слизистыми оболочками, уксусная кислота высокой концентрации вызовет сильнейшие химические ожоги.
При этом способ получения кислоты не играет особой роли в ее токсикологической направленности, а смертельной может быть доза от 20 мл. Различные последствия могут стать губительными для многих человеческих органов – начиная от ротовых слизистых и дыхательных путей и заканчивая желудком и пищеводом.
При неосторожном попадании кислоты внутрь важно пить как можно больше жидкости до приезда медиков, но ни в коем случае не вызывать рвоту. Повторное прохождение веществ по организму может повторно обжечь органы. В дальнейшем необходимым будет промывание желудка при помощи зонда и госпитализация.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 1 Две формы материи: вещества и поля | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 2 Вещество (глина) и тело (глиняная фигурка) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 3 Молекула воды В основе иллюстрации лежит лицензионная фотография | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. Молекулы трех веществ: воды, углекислого газа, уксусной кислоты |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 5 Атомы двух элементов: водорода и кислорода |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. Ячейка периодической системы элементов Д. И. Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. Аналогия гравитации и химических связей | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рис. 9 Ржавчина | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Омолаживающие свойства пилингов с трихлоруксусной кислотой
28 / 01 / 2019Инновационная формула ТСА пилинга: впечатляющие результаты омоложения
Пилинг по-прежнему остаётся весьма популярной и крайне востребованной процедурой эстетической медицины.
Причины этого следующие: с одной стороны, достаточно просто и быстро технически, с другой – эффективно и не очень дорого для пациента.
Сегодня большой популярностью пользуются химические пилинги с использованием трихлоруксусной кислоты (ТСА пилинги).
Трихлоруксусная кислота: важные химические свойства
Эволюция пилингов претерпела значительные изменения: начиная с агрессивных методик, и заканчивая нетравматическими, безопасными, активно стимулирующими формулами.
Прекрасная история началась с использования фенола. Но это вещество крайне токсично для сердца и его применение возможно только в условиях медицинского учреждения. Поэтому фенол заменили более безопасным веществом – трихлоруксусной кислотой, или TCА.
Но это вещество крайне токсично для сердца и его применение возможно только в условиях медицинского учреждения. Поэтому фенол заменили более безопасным веществом – трихлоруксусной кислотой, или TCА.
Трихлоруксусная кислота, или TCА – это вещество группы карбоксикислот, являющееся галогенизированным аналогом уксусной кислоты.
Присутствие галогена в молекуле TCА влияет на подвижность протона карбоксильной группы, вызывая более лёгкое отщепление иона водорода в растворе.
Поскольку в молекуле трихлоруксусной кислоты все атомы водорода метильной группы замещены хлором, то TCA является очень сильной кислотой.
В ряду веществ: уксусная кислота, монохлоруксусная кислота, дихлоруксусная кислота, трихлоруксусная кислота, – каждое последующее вещество сильнее предыдущего, и последнее является наиболее активным.
ТСА обладает максимальной силой из всех карбоновых кислот, которые используются при проведении процедуры пилинга.
TCA пилинг: концентрация кислоты и ее действие на кожу
Что мы знаем о TCA? В чистом виде это вещество опасно и токсично.
При растворении и нанесении на кожу разведенного в необходимых концентрациях вещества TCA средство легко впитывается. Применяется на отдельных участках кожи.
Ключевое значение имеет концентрация TCA в используемом препарате:
- 60-80 % TCA оказывает на кожу прижигающее действие, поэтому иногда применяется для удаления бородавок;
- 10 -30% TCA концентрация используется для отшелушивания кожи;
- 30-35% TCA требует особого подхода к формуле рабочего раствора, чтобы пилинг в целом носил контролируемый и управляемый характер, приводя к ожидаемым результатам без осложнений.
TCA легко взаимодействует с белками, ДНК и РНК, вызывая денатурацию этих молекул. Чем глубже уровень взаимодействия TCA и тканевых структур, тем выше риск развития побочных эффектов и тем драматичнее ситуация с точки зрения защитной функции кожи.
Одновременно активизируется выброс огромного числа сигнальных молекул и цитокинов, которые вызывают изменения функционирования всего клеточного сообщества и активизируют дерму.
Инновационная формула химического пилинга с трихлоруксусной кислотой
Снижение уровня травмы, сохранение целостности эпидермиса и акцент на стимуляции клеток кожи – задача, с которой блестяще справляется комплекс TCA touch pHformula.
Состав активных компонентов позволяет инновационной формуле ТСА пилинга устранять имеющуюся гиперпигментацию и препятствует её появлению после пилинга.
Результативность и безопасность препарата TCA touch pHformula неразрывно связана с работой проводящего комплекса PH-DVC.
Сапонин контролирует равномерность распределения кислоты по поверхности и глубину проникновения, а также оказывает противовоспалительное действие.
Процесс восстановления поддерживает прекрасный метаболизатор и мощный заживляющий агент, содержащийся в препарате – перфтордекалин.
TCA touch pHformula: невероятные результаты коррекции возрастных изменений
Компоненты препарата TCA touch pHformula работают удивительно слажено, будто по-волшебству! Они позволяют реально преображать кожу и облик пациента.
Процедура значительно улучшает микрорельеф и структуру кожи, нивелирует поры, устраняет морщины и пигментные пятна. Прекрасно подходит для лечения рубцов, постакне и общего оздоровления кожи.
Какой бы безопасной не была формула с содержанием трихлоруксусной кислоты, ТСА пилинг имеет четкие показания к применению:
- Толстая плотная грубая кожа с расширенными порами;
- Продвинутая степень естественного старения;
- Фотостарение;
- Терапия постакне (рубцы, пигментные пятна, застойные пятна).
- С осторожностью для чувствительной кожи, а также при отягощенном аллергическом анамнезе.

Процедура также требует обязательного выполнения домашних назначений по уходу до и после процедуры:
— Очищение кожи средством EXFO cleanse (утром и вечером).
— Крем SOS repair cream (утром и вечером).
— Крем SPF30+ / SPF50 / CC cream (утром).
— Сыворотка Synergy или крем Vita A — через неделю после процедуры. Применять 1 раз в неделю,
вечером, вместо SOS repair cream.
С полным ассортиментом домашнего ухода можно ознакомиться на сайте
Автор: Елена Тананко, косметолог, биолог, генетик.
Детальнее о системе ТСА TOUCH узнайте на семинаре pHformula. Запись по телефону 0(800) 33 2323 (звонки по Украине бесплатные), или на сайте в разделе Обучение
| Класс | Название урока | Ссылка на учебные материалы |
| 8 | Предмет химии. Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности |
https://resh.edu.ru/subject/lesson/1521/main/ |
| 8 | Чистые вещества и смеси. Способы разделения смесей | https://resh.edu.ru/subject/lesson/1522/main/ |
| 8 | Физические и химические явления | https://resh.edu.ru/subject/lesson/1485/main/ |
| 8 | Атом. Молекула | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Химический элемент. Знаки химических элементов | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Простые и сложные вещества | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Валентность. Составление химических формул бинарных соединений | https://resh.edu.ru/subject/lesson/1520/main/ |
| 8 | Химические уравнения. Коэффициенты. Закон сохранения массы веществ Коэффициенты. Закон сохранения массы веществ |
https://resh.edu.ru/subject/lesson/1519/main/ |
| 8 | Вычисления по химическим уравнениям количества и массы вещества по количеству вещества, массе реагентов или продуктов реакции | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Обобщение и систематизация знаний по теме «Первоначальные химические понятия» | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Кислород – химический элемент и простое вещество. Озон. Состав воздуха | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Физические и химические свойства кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Получение и применение кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Озон. Аллотропия кислорода. Состав воздуха. Горение Состав воздуха. Горение |
https://resh.edu.ru/subject/lesson/2446/main/ |
| 8 | Водород – химический элемент и простое вещество. Физические и химические свойства водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Получение и применение водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Объёмные отношения газов при химических реакциях | https://resh.edu.ru/subject/lesson/2731/main/ |
| 8 | Вода в природе. Круговорот воды в природе. Физические свойства воды | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие с металлами | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие воды с оксидами металлов | https://resh. edu.ru/subject/lesson/2062/main/ edu.ru/subject/lesson/2062/main/ |
| 8 | Растворы. Растворимость веществ в воде. Массовая доля растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Расчёт массовой доли растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Оксиды. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2445/main/ |
| 8 | Амфотерные оксиды и гидроксиды | https://resh.edu.ru/subject/lesson/2684/main/ |
| 8 | Физические и химические свойства оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Получение и применение оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Основания. Классификация. Номенклатура | https://resh. edu.ru/subject/lesson/2442/main/ edu.ru/subject/lesson/2442/main/ |
| 8 | Получение и применение оснований | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Кислоты. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2055/main/ |
| 8 | Физические и химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Получение и применение кислот | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Соли. Классификация. Номенклатура. Получение и применение солей | https://resh.edu.ru/subject/lesson/2054/main/ |
| 8 | Физические и химические свойства солей | https://resh.edu.ru/subject/lesson/2441/main/ |
| 8 | Генетическая связь между классами неорганических соединений | https://resh. edu.ru/subject/lesson/2440/main/ edu.ru/subject/lesson/2440/main/ |
| 8 | Строение атома: ядро, энергетический уровень |
https://resh.edu.ru/subject/lesson/2051/main/ https://mosobr.tv/release/7883 |
| 8 | Состав ядра атома: протоны, нейтроны. Изотопы | https://resh.edu.ru/subject/lesson/2051/main/ |
| 8 | Периодический закон Д. И. Менделеева. Периодическая система химических элементов Д. И. Менделеева | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д. И. Менделеева и строения атома |
https://resh. edu.ru/subject/lesson/2049/main/ edu.ru/subject/lesson/2049/main/ |
| 8 | Электроотрицательность атомов химических элементов | https://resh.edu.ru/subject/lesson/2439/main/ |
| 8 | Ковалентная химическая связь: неполярная и полярная. Ионная связь | https://resh.edu.ru/subject/lesson/2048/main/ |
| 8 | Металлическая связь. Понятие о водородной связи и её влиянии на физические свойства веществ на примере воды | https://resh.edu.ru/subject/lesson/2438/main/ |
| 8 | Валентность и степень окисления. Правила определения степеней окисления | https://resh.edu.ru/subject/lesson/3121/main/ |
| 8 | Окислительно-восстановительные реакции | https://resh.edu.ru/subject/lesson/3122/main/ |
| 8 | Повторение и обобщение по теме «Строение атома. Строение вещества. Химическая связь» | https://resh. edu.ru/subject/lesson/3093/main/ edu.ru/subject/lesson/3093/main/ |
| 8 | Химические формулы. Индексы. Закон постоянства состава вещества | https://interneturok.ru/lesson/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/himicheskaya-formula-veschestva?seconds=0 |
| 8 | Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении |
Относительная+атомная+и+молекулярная+массы |
| 8 | Вычисление массовой доли химического элемента по формуле соединения | Вычисление+массовой+доли+химического+элемента |
| 8 | Моль – единица количества вещества. Молярная масса | Моль+-+единица+количества+вещества.+Молярная+масса |
| 8 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | Тепловой+эффект+химических+реакций.+Понятие+об +экзо-+и+эндотермических+реакциях |
| 8 | Физические и химические свойства оснований | Физические+и+химические+свойства+оснований |
| 9 | Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления |
https://resh.edu.ru/subject/lesson/2104/main/ |
| 9 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | https://resh.edu.ru/subject/lesson/2437/main/ |
| 9 | Скорость химических реакций. Первоначальные представления о катализе | https://resh.edu.ru/subject/lesson/2102/main/ |
| 9 | Обратимые и необратимые реакции. Понятие о химическом равновесии | https://resh.edu.ru/subject/lesson/2103/main/ |
| 9 | Сущность процесса электролитической диссоциации. Диссоциация кислот, оснований и солей. Слабые и сильные электролиты. Степень диссоциации | https://resh.edu.ru/subject/lesson/1518/main/ |
| 9 | Реакции ионного обмена и условия их протекания | https://resh. edu.ru/subject/lesson/1603/main/ edu.ru/subject/lesson/1603/main/ |
| 9 | Гидролиз солей | https://resh.edu.ru/subject/lesson/3123/main/ |
| 9 | Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях | https://resh.edu.ru/subject/lesson/1606/main/ |
| 9 | Обобщение и систематизация знаний по теме «Химические реакции» | https://resh.edu.ru/subject/lesson/2101/main/ |
| 9 | Общая характеристика элементов VIIA группы. Галогены в природе. Физические свойства галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Химические свойства и применение галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Хлороводород. Соляная кислота и её соли | https://resh. edu.ru/subject/lesson/2075/main/ edu.ru/subject/lesson/2075/main/ |
| 9 | Общая характеристика элементов VIA группы. Сера в природе. Физические и химические свойства серы | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Сероводород. Сульфиды | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Оксиды серы (IV). Сернистая кислота и её соли | https://resh.edu.ru/subject/lesson/2076/main/ |
| 9 | Оксиды серы (VI). Серная кислота и её соли | https://resh.edu.ru/subject/lesson/2077/main/ |
| 9 | Общая характеристика элементов VA группы. Азот в природе. Физические и химические свойства азота | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: строение молекулы, физические и химические свойства | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: химические свойства, получение, применение | https://resh. edu.ru/subject/lesson/2078/main/ edu.ru/subject/lesson/2078/main/ |
| 9 | Соли аммония | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Азотная кислота и её соли | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Фосфор. Оксид фосфора (V) | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Фосфорная кислота и её соли | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Характеристика элементов IVA группы. Углерод и кремний в природе. Физические и химические свойства углерода. Аллотропия углерода | https://resh.edu.ru/subject/lesson/2072/main/ |
| 9 | Оксиды углерода | https://resh.edu.ru/subject/lesson/2071/main/ |
| 9 | Угольная кислота и её соли | https://resh.edu.ru/subject/lesson/2070/main/ |
| 9 | Кремний и его соединения | https://resh. edu.ru/subject/lesson/2069/main/ edu.ru/subject/lesson/2069/main/ |
| 9 | Обобщение и систематизация знаний по теме «Неметаллы IV и V групп и их соединения» | https://resh.edu.ru/subject/lesson/2068/main/ |
| 9 | Положение металлов в Периодической системе химических элементов Д. И. Менделеева. Общие физические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/ https://mosobr.tv/release/7942 |
| 9 | Общие химические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/ https://mosobr.tv/release/7974 |
| 9 | Получение и применение металлов | https://resh.edu.ru/subject/lesson/1607/main/ |
| 9 | Положение щелочных и щелочноземельных металлов в Периодической таблице химических элементов Д. И. Менделеева и строение их атомов. Свойства Свойства |
https://resh.edu.ru/subject/lesson/1602/main/ |
| 9 | Соединения щелочных и щелочноземельных металлов | https://resh.edu.ru/subject/lesson/3124/main/ |
| 9 | Положение алюминия в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Физические и химические свойства алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Соединения алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Положение железа в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Нахождение в природе. Физические и химические свойства железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Соединения железа и их свойства | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Получение и применение соединений железа | https://resh. edu.ru/subject/lesson/1605/main/ edu.ru/subject/lesson/1605/main/ |
| 9 | Обобщение и систематизация знаний по теме «Металлы и их соединения» | https://resh.edu.ru/subject/lesson/2067/main/ |
| 9 | Углеводороды | https://resh.edu.ru/subject/lesson/1608/main/ |
| 9 | Спирты: метанол, этанол, глицерин | https://resh.edu.ru/subject/lesson/2066/main/ |
| 9 | Карбоновые кислоты: уксусная, стеариновая, олеиновая, аминоуксусная кислоты | https://resh.edu.ru/subject/lesson/2065/main/ |
| 9 | Биологически важные вещества: жиры, углеводы, белки | https://resh.edu.ru/subject/lesson/1609/main/ |
| 9 | Полимеры | https://resh.edu.ru/subject/lesson/2435/main/ |
| 9 | Обобщающий урок по теме «Важнейшие органические соединения» | https://resh. edu.ru/subject/lesson/2064/main/ edu.ru/subject/lesson/2064/main/ |
| 9 | Степень окисления атомов и её определение в соединениях | Степень+окисления+атомов+и+её+определение+в+соединениях |
| 9 | Положение неметаллов в Периодической системе химических элементов Д. И. Менделеева | https://www.youtube.com/watch?v=ohFd4lJ9RcE&feature=emb_logo |
| 9 | Химические свойства металлов. Взаимодействие металлов с неметаллами | https://www.youtube.com/watch?v=qgzo40bfL1o |
| 9 | Оксиды азота | https://www.youtube.com/watch?time_continue=130&v=JmbTPhygCdk&feature=emb_logo |
| 9 | Общие химические свойства металлов | https://www.youtube.com/watch?time_continue=217&v=3O_1UupZ71E&feature=emb_logo |
| 9 | Получение и применение металлов | https://www.youtube.com/watch?time_continue=347&v=ZmgAo8Q3jFI&feature=emb_logo |
| 9 | Природные источники углеводородов: природный газ, нефть, уголь | https://www. youtube.com/watch?time_continue=206&v=O9e6ORyASjI&feature=emb_logo youtube.com/watch?time_continue=206&v=O9e6ORyASjI&feature=emb_logo |
| 9 | Свойства металлов, неметаллов и их соединений. Генетическая связь между классами неорганических соединений | Свойства+металлов+неметаллов+и+их+соединений |
| 9 | Вычисления по химическим уравнениям количества, объёма, массы вещества по количеству, объёму, массе реагентов или продуктов реакции | https://www.youtube.com/watch?time_continue=8&v=nwIVA6XBq5w&feature=emb_logo |
Шеймовер, он же похмельный стыд: что это такое и как с ним бороться
- Артем Воронин
- Би-би-си
Автор фото, Getty Images
Вы открываете глаза, и ужас вдавливает вас в подушку. В соцсетях остались следы прошлой ночи, но при мысли о них вас парализует страх. Это — шеймовер, в России также известный как бояки, или похмельный стыд. Знакомо? Объясняем его биохимию и рассказываем, можно ли избавиться.
Знакомо? Объясняем его биохимию и рассказываем, можно ли избавиться.
Процесс разложения алкоголя в организме хорошо известен химикам и в общих чертах многим обывателям. Похмелью посвящаются научные работы, его пытаются победить биохакеры. С ним знакомы все, кроме 23% счастливчиков, которые утверждают, что не испытывают похмелья в принципе.
На фоне всего этого даже удивительно, что ученым пока не удалось полностью понять природу похмелья. Но в последнее время СМИ говорят о похмелье именно в связи с его эмоциональной стороной.
Этот «бодун чувств», или шеймовер (англ., комбинация слов shame и hangover — «похмелье» и «стыд») сегодня обсуждают едва ли не чаще, чем обычное физическое похмелье. Шеймовер загадочнее и служит причиной интересных душевных метаний.
Что же это такое?
Существует ли шеймовер?
Эти истории есть у многих — наутро после вечеринки вместо легкости возникает чувство стыда и беспокойства, у которого нет определенной причины.
Автор фото, Picturenow/UIG
Подпись к фото,С проблемой похмелья человечество знакомо с давних пор, однако о ее эмоциональной составляющей стали говорить лишь относительно недавно
«Даже если я не сделал ничего плохого, бывает, что я чувствую, что вечер не принес никакой пользы. Ты просто выпил, но возникает ощущение, что с тобой что-то фундаментально не так, как будто ты прогнил изнутри. И ты чувствуешь только стыд, ты чувствуешь, что в жизни тебя не ждет ничего хорошего», — рассказывает 26-летний Томас, сравнивая ощущения от похмельного стыда с клинической депрессией.
«Просыпаешься с чувством паники и вины, ощущением, что вчера совершила что-то ужасное, что всем неприятна, что была назойлива. Это скорее физическое ощущение, но мозг старается его объяснить как-то и подтасовывает факты. Вдруг вспоминаешь всех, кому ты не слишком нравишься, все неловкие моменты, все паузы в разговоре одновременно. Состояние банковского счета волнует как никогда. Жизнь кажется прожитой зря», — рассказывает о своем опыте графический дизайнер Марина.
Жизнь кажется прожитой зря», — рассказывает о своем опыте графический дизайнер Марина.
Все, кому доводилось испытывать это чувство, описывают шеймовер как комбинацию стыда и паранойи. Похожие описания можно встретить и у классиков. От похмельной паранойи страдает нордический разведчик Штирлиц (с похмелья на разведчика «давило незнакомое ему ранее, тревожное чувство надвигающейся беды; обостренно воспринимался любой шорох») и лирический герой-романтик Венедикта Ерофеева.
В то же время есть люди, которые утверждают, что не испытывают подобных ощущений в принципе, а многие отмечают, что начали испытывать шеймовер только в последние годы — в юности они таких симптомов не наблюдали.
Чтобы разобраться, почему это так, мы обратились к экспертам.
Механика похмелья
Чтобы в общих чертах понять природу шеймовера, нужно знать о действии двух веществ — ацетальдегида и серотонина, который часто называют «гормоном счастья».
Напомним кратко: весь попадающий в ваш организм алкоголь превращается сначала в ацетальдегид, а затем в уксусную кислоту. Этот процесс происходит в два этапа.
Сначала алкоголь расщепляется с помощью фермента под названием алкогольдегидрогеназа, который производят клетки печени. В результате образуется ацетальдегид. Это крайне токсичное вещество и сильный канцероген, который, помимо прочего, производят промышленно как прекурсор к уксусной кислоте.
Ацетальдегид расщепляется дальше — на уксусную кислоту, затем на воду и углекислый газ. Однако это происходит не сразу, и некоторое время токсин остается в нашей крови. Параллельно происходит еще несколько процессов, которые искажают нормальные функции организма, говорит директор Медицинского центра в Марьино, нарколог Александр Терентьев.
«Происходит сгущение крови из-за агрегации эритроцитов. Красные кровяные тельца прилипают друг к другу, образуя подобие столбиков из монет, — говорит Терентьев. — Кровь таким образом сгущается, возрастает нагрузка на сердце. Это происходит и в капиллярах головного мозга».
— Кровь таким образом сгущается, возрастает нагрузка на сердце. Это происходит и в капиллярах головного мозга».
Красные кровяные клетки, слипшись, переносят меньше кислорода и забирают из тканей меньше углекислого газа. Это значит, что ткани недополучают кислород, в них образуются излишки углекислого газа.
Все это обеспечивает нам физическое недомогание, но стыд и паранойя объясняются скорее другим.
Подпись к фото,К шеймоверу предрасположены робкие застенчивые люди, говорит нарколог
Мини-депрессия
Серотонин — один из основных нейромедиаторов в теле человека. Эти вещества обеспечивают передачу электрических импульсов между нейронами нашего мозга, а также от нейронов к мышцам или клеткам органов.
Серотонин играет роль нейромедиатора в центральной нервной системе и участвует в нашем организме почти во всем — контролирует работу кишечника, участвует в реакциях тошноты и диареи, стимулирует рецепторы, отвечающие за сон и пробуждение, сужает артерии, если нужно сформировать тромб и затянуть рану.
Для нас важно, что в мозгу серотонин регулирует тревожность и радость и отвечает за настроение. Низкий уровень гормона связывают с депрессией, а слишком высокий приводит к галлюцинациям и нервно-мышечным нарушениям.
Согласно теории невролога Барри Джейкобса, представленной в 2000 году, депрессия возникает при недостаточной регенерации нейронов, которая, в свою очередь, зависит от уровня серотонина.
Тревожные симптомы и социофобия, как следует из ряда исследований, могут быть следствием как недостатка, так и избытка серотонина.
Автор фото, Getty Images
Подпись к фото,Похмельный стыд — изолирующее чувство
Сегодня, впрочем, врачи чаще связывают депрессию именно с недостатком «гормона счастья», а большинство антидепрессантов повышают уровень серотонина у пациентов.
Так можно ли провести параллели между ощущениями людей, страдающих депрессией от недостатка серотонина, и эмоциональными страданиями шеймовера? В определенном смысле такие параллели уместны.
«Думаю, что этот феномен (шеймовер — Би-би-си) характерен далеко не для всех, а преимущественно для людей, которым изначально присущи такие черты, как робость, застенчивость, неуверенность, психоэмоциональная ранимость, заниженная самооценка, ориентировка на мнения окружающих и различные проявления социальной фобии», — говорит кандидат медицинских наук, психиатр-нарколог из медицинского центра «Клиника на Садовом» Вадим Колобов.
«Эти особенности, помимо прочего, тоже связывают со сниженным уровнем мозгового серотонина. Для таких людей алкоголь, стимулируя выброс серотонина, на начальных этапах является своего рода адаптогеном, психосоциальной защитой, и позволяет чувствовать себя комфортно в ситуациях общения», — добавляет он.
И действительно, люди, пережившие депрессию, говорят о том, что пока они находились в этом состоянии, шеймовер мучил их часто, а справившись с депрессией, они избавились и от острого похмельного стыда.
Автор фото, Getty Images
Подпись к фото,Со стороны стыд и паранойя шеймовера кажутся расплатой за веселье прошлой ночи, но это не совсем так
«Когда я была в депрессии, я пить не могла, в том числе потому, что на выходе были очень сильные психозы», — делится организатор вечеринок Юлия.
«У меня и так было слабое психическое состояние, весь мир казался страшным и безнадежным, в будущем — серость и безысходность и так далее. А тут еще расход медиаторов и выброс этого «аце-чего-то». Неудивительно, что бояки страшнее», — говорит она.
«Зато когда выровнялось состояние, а уж тем более когда стало весело, появился интерес к жизни снова, похмелье стало иначе ощущаться».
Однако чтобы ощутить шеймовер, не обязательно страдать депрессией. Чтобы утренний стыд посетил вас, достаточно всего лишь быть к нему предрасположенным, то есть иметь низкий уровень серотонина в мозгу.
«Поскольку запасы серотонина у таких людей изначально невелики, хороший абузус (пьянка) их быстро истощает, и они проваливаются временно в еще больший дефицит, со всеми психоэмоциональными последствиями и обострением присущих им особенностей характера», — резюмирует Колобов.
Но есть и хорошие новости: если вы испытываете похмельный стыд, вероятно, вы еще не деградировали.
«Когда же формируется развернутая физическая стадия зависимости с запоями и выраженным похмельным синдромом и с развивающейся алкогольной деградацией личности, этот по сути защитный психосоциальный механизм обычно исчезает», — говорит нарколог.
Полезные советы
Автор фото, Getty Images
Подпись к фото,Калорийная пища — важный элемент в преодолении последствий бурных возлияний
Шеймовер — это такой же медицинский и бытовой факт, как и обыкновенное похмелье. Как от него избавиться или предотвратить? Есть ряд советов.
1. Создайте комфортную обстановку
Устройтесь в теплом месте и в течение дня плавно восполняйте дефицит воды в организме, выпивая по два стакана жидкости с перерывом в полчаса.
Для создания комфортной обстановки у каждого свои приемы. «Мой друг детства, мучаясь похмельем — а оно у него ещё какое — вызывал несколько раз чтеца-декламатора, чтобы Тургенева ему читал», — рассказывает журналист Александр Овчаренко.
Правда, по дороге чтеца просили купить пива.
2. Не нужно опохмеляться
Опохмеляться, к слову, не рекомендуется, говорит нарколог Александр Терентьев. Новая порция алкоголя поможет психике успокоиться и ускорит образование нужных ферментов в печени, но потом будет только хуже. Кроме того, похмеляясь, вы рискуете впасть в запой.
3. Дышите глубже
Если вас одолевают нехорошие мысли, попробуйте сконцентрироваться с помощью одного из приемов для успокоения. Медленно сосчитайте до четырех на вдохе, а потом снова — на выдохе. Постарайтесь некоторое время ни о чем не думать, а просто следить за своим дыханием.
4. Поговорите с близким человеком
Стыд — изолирующее чувство. Попробуйте поделиться ощущениями с близкими, честно и подробно рассказав о том, что вы ощущаете.
5. Ешьте мясо, сыр и орехи
Чтобы избавиться от шеймовера совсем, нужно повысить уровень серотонина. Это можно сделать, выработав несколько привычек.
Это можно сделать, выработав несколько привычек.
В яйцах, молочных продуктах, нежирных сортах мяса, орехах и зерновых содержится триптофан. Эта аминокислота помогает нашему телу вырабатывать серотонин.
6. Проводите больше времени на солнце
Солнечные лучи помогают нашему телу вырабатывать серотонин.
7. Мыслите позитивно
Переживая шеймовер, в это трудно поверить, но уровень серотонина можно повысить, просто сосредоточившись на радостных мыслях.
Чаще думайте о хорошем.
Как вывести постельных клопов с помощью уксуса: народные методы
Владимир Б.
Эксперт по обработке инсектицидами
Уксус — продукт с высоким содержанием уксусной кислоты. Обычно он используется в кулинарии в качестве натурального консерванта или приправы, которая придает блюдам кисловатый вкус. Но уксус также нашел применение в быту. Его добавляют при стирке белья для сохранения яркого цвета, им чистят чайники, сантехнику, а еще — это хорошее средство от постельных клопов. Расскажем, как применять уксусную кислоту, и выясним, насколько она эффективна против паразитов.
Расскажем, как применять уксусную кислоту, и выясним, насколько она эффективна против паразитов.
Как действует уксус на паразитов
Действие уксуса на клопов зависит от концентрации в нем уксусной кислоты. Уксусная эссенция (70%), в которой содержится 70 мл кислоты на 100 мл жидкости, убивает насекомых контактным способом. Она вызывает сильные химические ожоги, после которых кровососы быстро погибают. Но средство действует только при его попадании на все тело клопа, а не только на его лапки.
Столовый уксус, в котором содержится от 3 до 15% уксусной кислоты, отпугивает паразитов резким запахом. Клопы ориентируется в темноте, используя обоняние. Они чувствуют дыхание и аромат человеческого тела. Но запах уксуса перебивает его, дезориентируя кровососов. Результат — паразиты покидают квартиру.
Можно ли избавиться от клопов с помощью уксуса
Уничтожение клопов уксусом возможно только в том случае, если вы будете отлавливать их руками и погружать в бутылку с кислотой. Другой вариант — обработка поверхностей и щелей в доме или квартире уксусной эссенцией. Но поскольку это химически агрессивный продукт, такой метод борьбы с кровососами недопустим: он испортит отделку, напольное покрытие и мебель.
Другой вариант — обработка поверхностей и щелей в доме или квартире уксусной эссенцией. Но поскольку это химически агрессивный продукт, такой метод борьбы с кровососами недопустим: он испортит отделку, напольное покрытие и мебель.
Чтобы не навредить материалам, уксус от паразитов следует применять только в разбавленном виде. Но эффективность неконцентрированного раствора существенно ниже. Он не убивает клопов, а отпугивает их. Поэтому применение уксуса — это скорее дополнительная мера в борьбе с ними. В качестве основного средства лучше использовать аэрозоли, растворы, порошки на основе диатомита и другие инсектициды.
Разбирая вопрос о том, помогает ли уксус от клопов, следует учитывать особенности размножения этих паразитов. Яйца насекомых имеют плотную оболочку, которая защищает их от действия кислоты. Поэтому личинки останутся живыми. Чтобы избавиться от них, необходимо проводить обработки уксусом регулярно до тех пор, пока в доме не останется ни одного живого клопа. В качестве профилактической меры также нужно обрабатывать помещения на протяжении 2–3 недель после обнаружения последнего насекомого. Именно через такое время личинки появляются из яиц.
Именно через такое время личинки появляются из яиц.
Внимание! Сильный запах уксуса также обладает эффективностью против тараканов и муравьев. Поэтому если использовать его регулярно, вы сможете избавиться от многих вредных насекомых в квартире.
Какой уксус лучше: слабый или концентрированный?
Для обработки помещений от кровососущих насекомых подходит только слабый раствор уксуса. В противном случае мебель и другие изделия будут испорчены. В продаже можно встретить натуральный и синтетический столовый уксус, крепость которого обычно составляет 3, 6 или 9%. Но при разбавлении водой допустимо применение и более концентрированного продукта — уксусной эссенции, крепость которой составляет от 70 до 80%.
Для борьбы с клопами в квартире обычно используют уксус крепостью 3%. Чтобы получить такую концентрацию, нужно смешать:
1 часть уксуса 6% и 1 часть воды;
2 части яблочного уксуса 4,5% и 1 часть воды;
1 часть уксуса 9% и 3 части воды;
1 часть эссенции 70% и 23 части воды;
1 часть эссенции 80% и 27 частей воды.
Меры предосторожности при работе с уксусной кислотой
Несмотря на распространенность в кулинарии, уксус — опасное для человека вещество. При употреблении внутрь оно вызывает мучительную смерть из-за сильных ожогов полости рта, горла, дыхательных путей и пищеварительного тракта. Смертельной дозой считается всего 15 мл уксусной эссенции или 200 мл столового уксуса.
Вещество вредит не только при употреблении внутрь. Опасными могут быть и его пары. Они воздействуют на слизистые оболочки глаз и органов дыхания, вызывают повышенное слезотечение, насморк и другие симптомы раздражения. Поэтому во время обработки помещений от постельных клопов следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- защитные очки.
Поскольку уксус остается и после обработки, сразу после нее оставаться в квартире нельзя. Следует покинуть ее на несколько часов, чтобы избежать негативного влияния паров уксусной кислоты на здоровье. За это время вещество может подействовать на насекомых, и они покинут ваше жилье.
Способы применения уксуса от клопов
Чтобы избавиться от постельных вредителей в доме, необходимо использовать уксус комплексно. Его запах должен пропитать все предметы, находящиеся в квартире. Тогда кровососам будет негде спрятаться от него. Конечным результатом станет либо их гибель, либо их побег из вашего жилья.
Мытье полов
Обрабатывать полы в квартире от насекомых с помощью уксусной кислоты нужно не реже 2–3 раз в неделю. Для этого необходимо приготовить раствор уксуса крепостью около 1%. Более высокая концентрация будет опасна для человека и домашних животных. Так как поверхность полов имеет большую площадь, будет много испарений. Если использовать концентрированный раствор, пары будут раздражать глаза и нос.
Мыть пол лучше руками и ветошью: с помощью швабры не получится качественно обработать труднодоступные места. Кислотный раствор должен попасть во все щели, чтобы он достал паразитов, которые могут в них прятаться. Особое внимание необходимо уделить плинтусу и пространству за ним.
Внимание! Во время обработки полов от постельных клопов используйте только уксус и воду. Не добавляйте в раствор чистящие средства, поскольку есть вероятность их вступления в химическую реакцию с уксусной кислотой, результат которой может быть непредсказуемым.
Обработка поверхностей
Насекомые передвигаются не только по полу. Они могут ползать по стенам, забираться в мелкие щели, прятаться за картинами и в других укромных местах. Поэтому обработать нужно все поверхности. Для этого лучше использовать раствор уксусной кислоты 3%. Для обработки потребуется ветошь, которую нужно смачивать в уксусе, выжимать и протирать ею мебель, полки, дверцы. Если материал позволяет, стены тоже следует смочить уксусом, чтобы от них исходил неприятный аромат. Будет хорошо, если вы сможете отодвинуть мебель и протереть ее заднюю стенку, обработать поверхность за ней.
Обработка труднодоступных мест
В каждом доме и квартире найдутся места, в которые залезть рукой и тряпкой не получится. Они служат для клопов надежным укрытием. В них насекомые могут впасть в оцепенение, в состоянии которого паразиты сохраняют жизнеспособность в течение нескольких недель. Поэтому для их уничтожения важно обработать все щели. В противном случае вы снова начнете страдать от укусов кровососов. Ведь они выйдут из оцепенения, пережив в щелях все народные способы, которые вы против них применяли.
Они служат для клопов надежным укрытием. В них насекомые могут впасть в оцепенение, в состоянии которого паразиты сохраняют жизнеспособность в течение нескольких недель. Поэтому для их уничтожения важно обработать все щели. В противном случае вы снова начнете страдать от укусов кровососов. Ведь они выйдут из оцепенения, пережив в щелях все народные способы, которые вы против них применяли.
Для обработки укромных мест, используйте бутылочку с пульверизатором. Наберите в нее 3%-раствор уксуса и разбрызгивайте его во все щели. Средство нужно распылить за мебелью, за плинтусом, за батареями отопления, за сантехникой и другими предметами, за которыми могут прятаться постельные клопы.
Вспомогательные и профилактические меры
Для эффективной борьбы с постельными клопами следует принимать дополнительные меры. Поскольку эти вредители могут прятаться в постельном или другом белье, следует все вещи выстирать при температуре 90 оС. Если такой способ обработки не подходит для ваших вещей, сдайте их в химчистку.
Паразиты также часто прячутся в складках и щелях мягкой мебели. Уничтожить их там можно с помощью водяного пара. При использовании парогенератора учитывайте, что высокая температура может навредить некоторым материалам. Если такого устройства у вас нет, возьмите обычный утюг. Во время применения переключите его в режим отпаривания.
Как усилить эффект от применения уксуса
Повысить эффективность от применения уксуса можно, прибегнув к другим народным методам борьбы с клопами. Приведем 4 распространенных способа, которые помогают в уничтожении постельных паразитов.
Рецепт №1: уксус + скипидар
Смешайте скипидар и столовый уксус в соотношении 1 к 1. Наберите полученную смесь в шприц и вылейте его в обнаруженную щель. Обработайте таким способом все щели и пространство за плинтусом.
Уксус в сочетании со скипидаром для клопов является смертельным средством. После контакта с ним насекомое погибает в течение нескольких секунд. Но смесь имеет свойство испаряться. Поэтому щели нужно обрабатывать регулярно. После высыхания остается сильный запах, который продолжает защищать квартиру от кровососов.
Поэтому щели нужно обрабатывать регулярно. После высыхания остается сильный запах, который продолжает защищать квартиру от кровососов.
Внимание! Избегайте длительного применения скипидара в детских комнатах и спальнях. Его запах может вызывать приступы астмы, головную боль и одышку.
Рецепт №2: уксус + нафталин + денатурат
Для приготовления раствора против домашних клопов вам понадобятся:
5 таблеток нафталина;
250 мл уксусной кислоты 9%;
250 мл денатурата (технического спирта).
Все ингредиенты добавьте в стеклянную емкость. Помешивайте жидкость до полного растворения нафталиновых таблеток. Полученным раствором необходимо обработать все поверхности в квартире. При прямом контакте он вызывает гибель паразитов, а сильный и стойкий запах обеспечивает эффективное отпугивание.
Рецепт №3: уксус + аммиак
Смешайте 500 мл аммиака и 500 мл уксусной кислоты 9%. Полученную смесь следует использовать для обработки поверхности пола, стен, мебели и труднодоступных мест. Она не вызывает уничтожение клопов, но средство действует как отпугиватель из-за сильного и стойкого запаха.
Она не вызывает уничтожение клопов, но средство действует как отпугиватель из-за сильного и стойкого запаха.
Рецепт №4: уксус + отвар полыни
Этот рецепт поможет отпугнуть вредителей сильным ароматом. Полынь издревле использовали как народное средство от паразитов. Из нее делали веники, которыми подметали полы. Полынные веточки клали в шкафы с бельем, под матрас. Их до сих пор применяют в огороде, раскладывая между грядок, и в птичниках для отпугивания блох.
Чтобы приготовить средство для борьбы с клопами в квартире:
Положите в кастрюльку 2 ст. л. измельченной сухой полыни.
Налейте в нее 0,5 л воды.
Поставьте кастрюльку на мелкий огонь.
Доведите ее содержимое до кипения и кипятите 10 минут.
Выключите плиту и оставьте полынь под крышкой до остывания.
Процедите раствор, добавьте в него воды до получения объема 0,5 л.
Добавьте 0,5% столового уксуса (9%).
- Положите в кастрюльку 2 ст. л. измельченной сухой полыни.
- Налейте в нее 0,5 л воды.

- Поставьте кастрюльку на мелкий огонь.
- Доведите ее содержимое до кипения и кипятите 10 минут.
- Выключите плиту и оставьте полынь под крышкой до остывания.
- Процедите раствор, добавьте в него воды до получения объема 0,5 л.
- Добавьте 0,5% столового уксуса (9%).
Приготовленным средством обработайте все поверхности и укромные места. Но избегайте его попадания на светлые материалы и ткань. Пятна после полынного отвара трудно вычищаются и отстирываются. Поэтому для обработки мягкой мебели и светлых материалов с высокой гигроскопичностью его не применяют.
Уксус — вспомогательное средство для борьбы с постельными клопами и профилактики их появления. Он отпугивает вредителей благодаря сильному запаху, усилить действие которого можно путем добавления других сильно пахнущих и химически агрессивных веществ. Но уксусный аромат опасен и для самого человека. Поэтому для уничтожения паразитов следует использовать более безопасные инсектицидные препараты.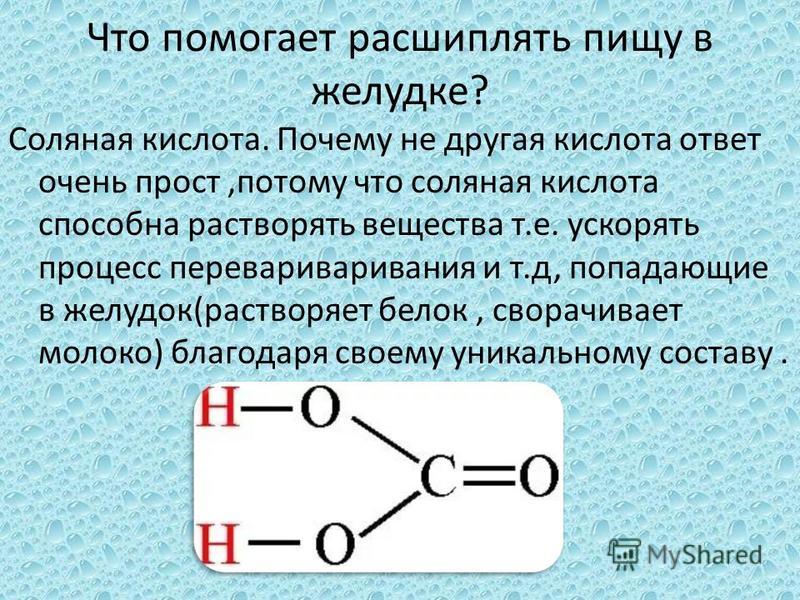 Таким является порошок из диатомита ЭКОКИЛЛЕР. Он ничем не пахнет и не вызывает ожогов при контакте. Поэтому его можно применять в любых помещениях, не опасаясь причинения вреда здоровью семьи.
Таким является порошок из диатомита ЭКОКИЛЛЕР. Он ничем не пахнет и не вызывает ожогов при контакте. Поэтому его можно применять в любых помещениях, не опасаясь причинения вреда здоровью семьи.
Когда нужна срочная помощь? | Статьи клиники «Эксимер»
Мы часто откладываем визит к врачу «на потом». Но, к сожалению, бывают экстренные ситуации, когда на счету каждая минута и времени на размышления нет. Травмы органа зрения требуют СРОЧНОЙ помощи! Необходимо немедленно (в первые часы после ранения) обратиться к специалисту. Оказать экстренную помощь нужно в самые кратчайшие сроки.
Химические ожоги глаз
Химические ожоги считаются наиболее опасными, так как некоторые вещества могут впитаться в глаз уже в течение 15 секунд. Такие ожоги вызываются щелочами (водный раствор аммиака, известь и др.) и кислотами (уксусная кислота, азотная и др.).
- Если кислота или щелочь попали в глаз, нужно немедленно начать его промывание под проточной водой (над фонтанчиком, под краном, из чайника или из чашки и т.
 п.). При этом веки должны быть максимально открыты. Общее время промывания должно составлять 30 минут.
п.). При этом веки должны быть максимально открыты. Общее время промывания должно составлять 30 минут. - Если у вас под рукой оказалась аптечка, то лучше промывать глаз специально приготовленным раствором. Для нейтрализации кислот это 2% раствор соды, для нейтрализации щелочей 2% раствор борной кислоты (или 1% раствор уксусной кислоты). Такие растворы получаются при разведении 1 ст. л. соды (порошка борной кислоты) или 100 мл (треть стакана) 9% уксуса на 1 литр теплой кипяченой воды и подаются под давлением при помощи груши или шприца без иглы. Если веки невозможно открыть широко, надеть на шприц тонкую трубку и заводить ее под веки с наружного угла глаза.
- После промывания обязательно обратитесь к врачу или в травматологический пункт!
Термические ожоги
При термических ожогах, то есть ожогах, вызванных горячей жидкостью или пламенем, тяжесть состояния зависит от их температуры.
В случае ожога нужно дать пострадавшему обезболивающее, приложить к глазам холодный влажный компресс и срочно отправить в глазной стационар или травматологический пункт в лежачем положении.
Контузии глаза
Контузии глаз могут привести к серьезным изменениям, вплоть до потери зрения. Поэтому не ставьте диагноз самостоятельно и не думайте, что если через несколько дней синяк начал рассасываться и глаз не болит, нормально двигается и видит, как обычно, то у вас все в порядке. Последствия контузии глаза (в виде повреждения сетчатки или развития такого заболевания как катаракта) могут проявить себя через несколько недель или даже лет.
В случае травмы нужно наложить повязку на оба глаза, при необходимости дать обезболивающее и срочно отправить пострадавшего в глазной стационар. От того, насколько быстро вам это удалось сделать, может напрямую зависеть то, какое зрение вам удастся сохранить.
Инородное тело в глазу
Каждому из нас попадала в глаз соринка. Обычно удаление подобного инородного тела не вызывает затруднений. Но если она не вымывается слезой и ее не удается достать при помощи ватной палочки, причем глаз продолжает болеть, появляется повышенная светочувствительность, нужно обязательно обратиться к специалисту.
Обычно удаление подобного инородного тела не вызывает затруднений. Но если она не вымывается слезой и ее не удается достать при помощи ватной палочки, причем глаз продолжает болеть, появляется повышенная светочувствительность, нужно обязательно обратиться к специалисту.
Особенно это важно, если перед тем, как вам что-то попало в глаз, вы без необходимой защиты занимались металлообработкой (деревообработкой или др. подобными работами). В таком случае мельчайшая стружка может проникнуть и внутрь глаза. Многие не считают «соринку» опасной, так как в ряде случаев ранения глазного яблока не сопровождаются кровотечением и зрительными нарушениями. А это может вам дорого стоить, причем как в прямом, так и в переносном смысле.
В случае попадания в глаз инородного тела нужно наложить повязку на оба глаза и срочно отправить пострадавшего в глазной стационар в лежачем положении. При необходимости – дать ему обезболивающее.
Внезапная потеря зрения одним из глаз
Внезапная потеря зрения одним из глаз (полная или частичная, когда в поле зрения появляется темное пятно), которая не сопровождается болью. Наступает в результате нарушения кровообращения в сетчатке глаза. Характерна для людей с общими нарушениями кровообращения.
Наступает в результате нарушения кровообращения в сетчатке глаза. Характерна для людей с общими нарушениями кровообращения.
Под язык – 1 табл. нитроглицерина, срочно вызвать скорую помощь, можно несколько раз нажать через веко на глаз (на 1-2 сек.), это способствует расширению сосудов.
«Завеса» перед глазами
Появление перед глазами «завесы», ощущение, что вы все видите как будто через слой воды, при движении глаза наблюдаются «вспышки» или «молнии». Эти симптомы характерны для отслоения сетчатки. Могут возникнуть после сильного напряжения.
Попросите кого-нибудь вызвать скорую помощь. Вам необходима транспортировка в лежачем положении. Оба глаза нужно закрыть повязкой.
Понижение зрения без видимой причины
Понижение зрения без видимой причины только вблизи при сохранении обычного зрения вдаль. Может возникнуть при применении лекарств, содержащих атропин и его аналоги, или в результате развития инфекции (ботулизм, дифтерия и т. д.)
д.)
Прекратить зрительную работу. Срочно обратиться к врачу.
При любой травме органа зрения или неприятных ощущений в глазу СРОЧНО обратитесь к специалисту. Помните, от каждой минуты зависит ваше зрение!
Уксусная кислота — полное руководство
Определение
Уксусная кислота — это монокарбоновая кислота с умеренным коррозионным действием. Это органическое соединение, также известное как этановая кислота, метанкарбоновая кислота, гидроацетат или этиловая кислота, используется в химическом производстве, в качестве пищевой добавки и при производстве нефти. Молекулярная формула уксусной кислоты: C 2 H 4 O 2 или CH 3 COOH, где –COOH определяет наличие единственной карбоксильной группы.
Уксус: раствор уксусной кислоты
Структура уксусной кислоты
Уксусная кислота имеет структуру простой карбоновой кислоты и состоит из метильной группы, присоединенной к карбоксильной группе, как показано на изображении ниже. Уксусная кислота или этановая кислота является протонным растворителем; он способен отдавать протоны в виде гидронов (положительно заряженные атомы водорода). Эта характеристика означает, что он является членом группы кислот Бренстеда, в которой протоны передаются молекулам-акцепторам, известным как основания Бренстеда.Пожертвованный водород отделяется от карбоксильной группы. Уксус — это раствор уксусной кислоты и воды, в котором примерно 0,4% молекул уксусной кислоты отдают свои атомы H + , что приводит к кислому раствору с pH примерно 2,4. По сравнению с самой сильной кислотой в мире — карборановой кислотой (H (CHB 11 Cl 11 )) — со значением pH -18, уксусная кислота является слабокислой по сравнению с этим.
Уксусная кислота или этановая кислота является протонным растворителем; он способен отдавать протоны в виде гидронов (положительно заряженные атомы водорода). Эта характеристика означает, что он является членом группы кислот Бренстеда, в которой протоны передаются молекулам-акцепторам, известным как основания Бренстеда.Пожертвованный водород отделяется от карбоксильной группы. Уксус — это раствор уксусной кислоты и воды, в котором примерно 0,4% молекул уксусной кислоты отдают свои атомы H + , что приводит к кислому раствору с pH примерно 2,4. По сравнению с самой сильной кислотой в мире — карборановой кислотой (H (CHB 11 Cl 11 )) — со значением pH -18, уксусная кислота является слабокислой по сравнению с этим.
Структура уксусной кислоты
Следует пояснить, что это не присутствие единственного атома водорода, которое изменяет pH раствора .Нейтральные растворы (ни кислотные, ни щелочные) содержат сбалансированное количество ионов гидроксония (H 3 0 + ) и гидроксильных ионов (OH — ). Две молекулы воды (H 2 0) образуются, когда связываются ионы гидроксония и гидроксила, а положительный и отрицательный заряды нейтрализуются. Когда уксусная кислота добавляется в воду, она расщепляется на отрицательно заряженный ацетат-ион (CH 3 COO — ) и H + . Следовательно, можно понять альтернативное название уксусной кислоты — гидроацетат.Небольшой процент положительно заряженных ионов водорода связывается с молекулами воды и превращает их в H 3 0 + . Это означает, что ионов гидроксония больше, и, следовательно, создается положительно заряженный (или кислый) раствор. Следовательно, pH раствора зависит от баланса гидроксония и гидроксила, а не от количества ионов водорода, хотя они и будут влиять на этот баланс. Значение pH также присваивается только раствору. В растворе всегда есть вода; даже современные суперкислоты, такие как карборан, растворяются в концентрированных водных растворах других кислот.Даже ледяная уксусная кислота имеет небольшое количество воды.
Две молекулы воды (H 2 0) образуются, когда связываются ионы гидроксония и гидроксила, а положительный и отрицательный заряды нейтрализуются. Когда уксусная кислота добавляется в воду, она расщепляется на отрицательно заряженный ацетат-ион (CH 3 COO — ) и H + . Следовательно, можно понять альтернативное название уксусной кислоты — гидроацетат.Небольшой процент положительно заряженных ионов водорода связывается с молекулами воды и превращает их в H 3 0 + . Это означает, что ионов гидроксония больше, и, следовательно, создается положительно заряженный (или кислый) раствор. Следовательно, pH раствора зависит от баланса гидроксония и гидроксила, а не от количества ионов водорода, хотя они и будут влиять на этот баланс. Значение pH также присваивается только раствору. В растворе всегда есть вода; даже современные суперкислоты, такие как карборан, растворяются в концентрированных водных растворах других кислот.Даже ледяная уксусная кислота имеет небольшое количество воды.
На следующем изображении показано диссоциация уксусной кислоты до ацетата в воде. Слева — одна молекула уксусной кислоты и одна молекула воды. Уксусная кислота передает ион водорода молекуле воды, чтобы произвести ион гидроксония. Мы говорим, что молекула воды протонирована или ей был подарен протон (гидрон).
Диссоциация уксусной кислоты
В качестве растворителя жидкая уксусная кислота растворяет полярные (гидрофильные) соединения, такие как соли и сахара, а также неполярные соединения, в том числе жиры и масла.Это означает, что он имеет множество применений в промышленном химическом производстве, но также имеет репутацию добавки для похудения , поскольку она влияет на метаболизм жиров и сахара. Дополнительная информация об использовании уксусной кислоты будет обсуждаться позже в этой статье. В кристаллической форме две молекулы уксусной кислоты соединяются водородными связями, образуя димер. При добавлении воды эти связи разрываются, и кристаллическая форма растворяется.
Димер уксусной кислоты
Формула уксусной кислоты
Формула уксусной кислоты проста и является результатом метильной группы и карбоксильной группы.Метильные группы являются одними из наиболее распространенных органических соединений на планете, но редко встречаются как единое целое. Они состоят из трех атомов водорода и одного атома углерода (CH 3 ). Поскольку углерод имеет четыре электрона, свободный электрон обычно связывается с другими молекулами посредством ковалентной связи. Простейшая молекула углерода — метан (CH 4 ), хорошо известный своим вкладом в глобальное потепление. Со свободным электроном метан реагирует с озоном (O 3 ) с образованием диоксида углерода и воды в следующей реакции: (3) CH 4 + (4) O 3 = (3) CO 2 + (6) H 2 O.На картинке изображена молекула метана, состоящая из метильной группы и дополнительного атома водорода.
Структура метана
В случае уксусной кислоты свободный электрон связывается с карбоксильной группой (CO 2 H, -COOH или -C (= O) OH), которая представляет собой один атом углерода, связанный с гидроксильной группой (-OH) и с двойной связью с атомом кислорода. На изображении ниже показана карбоксильная группа, где R представляет собой остальную часть молекулы, к которой присоединена карбоксильная группа; букву R иногда заменяют волнистой линией.В случае уксусной кислоты R представляет собой метильную группу. Некоторые предпочитают описывать карбоксильную группу как комбинацию карбонильной группы (C = 0, где = означает двойную связь) и гидроксильной группы (O-H). Карбоновые кислоты содержатся в аминокислотах и необходимы каждому живому организму.
На изображении ниже показана карбоксильная группа, где R представляет собой остальную часть молекулы, к которой присоединена карбоксильная группа; букву R иногда заменяют волнистой линией.В случае уксусной кислоты R представляет собой метильную группу. Некоторые предпочитают описывать карбоксильную группу как комбинацию карбонильной группы (C = 0, где = означает двойную связь) и гидроксильной группы (O-H). Карбоновые кислоты содержатся в аминокислотах и необходимы каждому живому организму.
Карбоксильная группа
Существует общая молекулярная формула для всех карбоновых кислот, а именно C n H 2n + 1 COOH. Это означает, что каждая карбоновая кислота имеет в два раза больше атомов водорода, чем атомов углерода, после удаления карбоксильной группы ; формула, которая идеально сочетается с уксусной кислотой — C2h5O2.Когда вы удаляете карбоксильную группу из этой формулы уксусной кислоты, у вас остается один атом углерода и два атома водорода.
Факты об уксусной кислоте
фактов об уксусной кислоте для тех, кто хочет узнать немного больше!
Молярная масса уксусной кислоты составляет 60,052 г на моль (г / моль). Молярная масса — это общая масса элемента или соединения (атомная масса), измеренная в атомных единицах массы или «а.е.м.», деленная на его количество в молях (моль). Одиночная родинка основана на числе Авогадро 6.02214076 × 10 23 , поскольку это число означает, что сравнение между молями и дальтонами, другой научной единицей атомной массы, проще.
Ледяная уксусная кислота — это раствор уксусной кислоты в очень небольшом количестве воды — менее 1%. Слово ледниковое относится к его кристаллической твердой форме при комнатной температуре. Другое название ледяной уксусной кислоты — безводная уксусная кислота. Эта форма представляет собой слабую кислоту, но является едким ядом, вызывающим образование волдырей и ожоги. Поскольку воды для диссоциации очень мало, ледяная уксусная кислота будет передавать свои протоны воде в коже или слизистых оболочках.
Чтобы найти подходящий буферный агент для кислоты, такой как уксусная кислота, необходимо знать значение pH, K a или pK a кислоты. PH, K a и pK a все связаны друг с другом. У уксусной кислоты K a составляет 1,8 x 10-5, или более простое вычисляемое значение pK составляет , равное 4,756. PH измеряет количество ионов водорода (H + ) в любом растворе, содержащем воду, и колеблется от 0 (кислотный) до 14 (щелочной). Чем ниже pH, тем выше концентрация ионов водорода.K a и pK a относятся к кислотам и относятся к константе диссоциации кислоты, которая показывает, насколько вероятно, что кислота отдаст свои протоны. Высокий показатель K a говорит нам о том, что кислота сильна и будет реагировать на любое добавленное к ней химическое вещество. У pK a наоборот — чем меньше число, тем сильнее кислота. Это потому, что pK a является отрицательным логарифмом K a .
Однако концентрированная уксусная кислота может иметь более низкий pH, чем сильная кислота.Благодаря pK a , который является постоянным значением, мы можем производить расчеты, не задумываясь о концентрациях. PK a уксусной кислоты составляет 4,756, и это говорит нам о том, насколько вероятно, что она откажется от протонов в растворе. Основания измеряются в зависимости от вероятности удаления протонов из раствора.
Температура кипения уксусной кислоты составляет от 244 до 246 ° F (от 118 до 119 ° C), а точка плавления — от 61 до 62 ° F (от 16 до 17 ° C) или чуть ниже комнатной температуры.Плотность уксусной кислоты составляет 1,049 г / см -3 в жидком состоянии и 1,27 г / см -3 в твердом состоянии.
Наиболее распространенной формой уксусной кислоты является уксус , который содержит 5-20% уксусной кислоты. Насколько велико разбавление (и, следовательно, сила кислоты), называется прочностью зерна. Вы можете легко рассчитать это, умножив концентрацию на 10. Уксус, содержащий 5% уксусной кислоты, будет иметь крепость 50.
Вы можете легко рассчитать это, умножив концентрацию на 10. Уксус, содержащий 5% уксусной кислоты, будет иметь крепость 50.
Использование уксусной кислоты
Уксусная кислота используется в большом количестве и разнообразна.Эта кислота используется в производстве товаров, в пищевой промышленности, в индустрии очистки, в медицине и в качестве добавки для здоровья. Уксусная кислота также является важным биохимическим веществом в форме ацетильной группы, где она является фундаментальной для построения аминокислот и, следовательно, невозможна без нее. Давайте рассмотрим некоторые из этих применений уксусной кислоты более подробно.
Уксусная кислота в производстве товаров
Уксусная кислота — важный химический реагент, используемый для производства ацетата, адгезивов, клеев и синтетических тканей.Уксусная кислота также используется при гальванике, когда металлическое покрытие наносится на объект, помещая его в раствор, содержащий определенную соль металла. Раствор должен быть проводящим, а кислоты, которые отдают ионы водорода, создают идеальные условия. Кроме того, гальваника может происходить только в растворе, а соли металлов растворяются только в растворах с низким (кислым) значением pH.
Уксусная кислота — это сырье, используемое для производства ацетата целлюлозы, уксусного ангидрида (пластмассы) и хлоруксусной кислоты, используемых в производстве красителей и пестицидов, а также некоторых лекарств.
Уксусная кислота в пищевой промышленности
Уксусная кислота, используемая в пищевой промышленности для регулирования уровня кислотности или щелочности пищевых продуктов. Свод федеральных правил (CFR) классифицирует уксусную кислоту как универсальную пищевую добавку, которая безопасна при использовании в соответствии с надлежащей производственной практикой. В Европе правила Е-номера распространяются на все пищевые добавки. Уксусной кислоте присвоен код E260, и она считается безопасным ингредиентом, который контролирует бактериальную колонизацию и может использоваться без ограничений.Это не новая находка. Говорят, что древние вавилоняне использовали уксус в качестве консерванта.
Уксус используется для производства заправок для салатов, приправ, в том числе горчицы, кетчупа и майонеза, а также для приготовления соусов и солений.
Уксусная кислота для очистки
Уксусная кислота использовалась в качестве чистящего средства и дезодоранта на протяжении веков, если не тысячелетий; губки с уксусом были помещены в дорогие филигранные кольца, которые носили богатые всякий раз, когда они шагали по грязным и вонючим улицам восемнадцатого века.Дезодорирующие свойства уксуса использовались на протяжении многих поколений. Моряки использовали уксус, чтобы мыть палубы кораблей, на которых они работали и жили. Принципы микробного контроля, возможно, не были поняты в то время, но характеристики этого органического раствора со свежим запахом, чистотой и предотвращением болезней были определенно хорошо известны.
Добавление щелочного продукта к кислоте вызывает реакцию пузырьков и шипения. Некоторые традиционные чистящие средства считают, что этот эффект обеспечивает более глубокую очистку и устойчивость поверхностей.Например, очистка заднего двора щелочной каустической содой (гидроксид натрия), а затем использование смеси уксуса поверх нее вызовет реакцию, которая определенно выглядит так, как будто она обладает глубоким очищающим действием; тем не менее, это очень мало увеличивает гигиенический эффект, а скорее смягчает или препятствует щелочной очищающей способности каустической соды с кислотными свойствами уксуса.
Сегодня многие преданные поклонники белого уксуса рекламируют экологические преимущества использования разбавленной уксусной кислоты для мытья ванных комнат, стирки одежды, удаления запахов и обеспечения чистоты и безопасности поверхностей для приготовления пищи.Уксусная кислота также удаляет ржавчину и известковые отложения.
Уксусная кислота в медицине
Уксусная кислота или уксус, вероятно, использовались в медицине еще до появления письменного слова. Если вы страдали от открытой раны на острове Кос в четвертом веке до нашей эры, возможно, Гиппократ прописал вам ежедневное промывание уксусом. Если у вас болит горло, он мог также попросить вас смешать мед и уксус, чтобы приготовить оксимел, древнегреческое лекарство от кашля; Если вы служили в Европе во время Первой мировой войны, у вас, возможно, был доступ только к уксусу, чтобы поддерживать чистоту и не допускать заражения.
Сегодня растворы уксусной кислоты используются в лабораторных исследованиях крови в качестве смывки предметных стекол. Они удаляют бактериальные биопленки в ранах и пищеварительной системе и часто используются при инфекциях наружного уха, поэтому избегают использования антибиотиков. Прием уксуса увеличивает уровень ацетата в толстой кишке и способствует усвоению кальция. приводит к снижению артериального давления и повышению плотности костей. Исследования изучают возможность использования ацетата в качестве противоопухолевого препарата.
Уксусная кислота в качестве пищевой добавки
Уксусная кислота — популярная добавка для здоровья, которую употребляют в виде уксуса, чаще всего яблочного уксуса. При связывании с коферментом A ацетильная группа уксусной кислоты играет центральную роль в метаболизме углеводов и жиров .
Было проведено много исследований относительно связи между потреблением уксуса и снижением уровня глюкозы в крови. В тех случаях, когда продукты с высоким гликемическим индексом потребляются после приема двух-трех столовых ложек яблочного уксуса, их гликемические значения оказываются на 35% ниже. Для диабетиков это может означать более низкие пики глюкозы в крови после приема пищи и лучший гликемический контроль, а для людей, не страдающих диабетом, — более низкий риск развития инсулинорезистентности .Замена обычного огурца соленым огурцом показала снижение общего гликемического индекса еды на 30%.
На следующем изображении показано влияние продуктов с низким и высоким гликемическим индексом (ГИ) на уровень глюкозы в крови. Продукты с высоким ГИ вызывают быстрый пик уровня глюкозы в крови, что увеличивает выработку инсулина, что позволяет клеткам метаболизировать глюкозу. Это означает, что уровень глюкозы в крови быстро падает, вызывая чувство голода. Продукты с низким ГИ вызывают более плавное повышение уровня сахара в крови и не заставляют поджелудочную железу вырабатывать такое большое количество инсулина.В результате получается плавная кривая, которая остается стабильной и не опускается, повышая уровень сытости после еды. Когда пища с высоким ГИ и пища с низким ГИ употребляется одновременно, они частично нейтрализуют друг друга, создавая эффект плато. Известно, что уксус имеет тот же эффект, что и пища с очень низким ГИ.
Значения GI
Как уже упоминалось, уксусная кислота также считается добавкой для похудания из-за ее способности повышать пиковый уровень глюкозы после еды и, таким образом, помогает повысить чувство сытости .Также предполагается, что присутствие уксусной кислоты в рационе замедляет опорожнение желудка, что также помогает контролировать некоторые формы переедания. Кроме того, уксус, кажется, препятствует образованию жира в дозах, составляющих всего пятнадцать миллилитров в день.
Викторина
Информация об опасностях и безопасности уксусной кислоты
Советы по безопасности уксусной кислотыУксусная кислота, возможно, не нарицательное название для многих, но на самом деле это относительно распространенное химическое вещество.Как жизненно важное химическое вещество в промышленной промышленности, уксусная кислота используется для различных целей во многих странах по всему миру. Вы можете даже встретить уксусную кислоту в разбавленном виде у себя дома или это может быть химическое вещество, с которым вы работаете. В любом случае важно обращаться с этой потенциально опасной и коррозионной кислотой с должной осторожностью, следуя этим советам по безопасности от наших экспертов по паспорту безопасности материалов.
Общие способы применения уксусной кислотыУксусная кислота — бесцветная жидкость с резким запахом уксуса.Это химическое вещество использовалось в алхимии еще в 3 году до нашей эры, часто в виде ледяной (безводной или безводной) уксусной кислоты. В наше время уксусная кислота используется для многих целей в нескольких отраслях промышленности, в том числе:
- Мономер винилацетата (для производства красок и клеев)
- Уксус (4-18% уксусной кислоты)
- Чернила, краски и красители
- Растворитель
- Ионтофорез для физиотерапии
Уксусная кислота также используется в производстве ряда других химикатов, которые затем используются для изготовления консервантов, фунгицидов и пестицидов, покрытий и пигментов.
Опасности, связанные с уксусной кислотойУксусная кислота может быть опасным химическим веществом, если не используется безопасным и надлежащим образом. Эта жидкость оказывает сильное разъедающее действие на кожу и глаза, поэтому с ней необходимо обращаться с особой осторожностью. Уксусная кислота также может повредить внутренние органы при проглатывании или вдыхании паров. Использование СИЗ (средств индивидуальной защиты) необходимо при обращении с этим химическим веществом в неразбавленном состоянии.
Правила безопасного обращения с уксусной кислотойПри обращении с уксусной кислотой важно помнить несколько важных советов по безопасности.Никогда не добавляйте воду к этому химическому веществу и всегда храните уксусную кислоту вдали от источников тепла, искр или пламени. При работе с уксусной кислотой в плохо вентилируемом помещении надевайте соответствующее респираторное оборудование. При использовании уксусной кислоты рекомендуется носить следующую защитную одежду:
- Перчатки
- Брызговики
- Синтетический фартук
- Респиратор паровой (при необходимости)
При работе с уксусной кислотой убедитесь, что поблизости находятся станции для промывания глаз.В случае большого разлива на рабочем месте или дома необходимо оборудовать автономный дыхательный аппарат, а также надеть полный защитный костюм для дополнительной безопасности. Если у вас нет под рукой этого оборудования, не пытайтесь удалить уксусную кислоту без него.
Надлежащая медицинская помощь при воздействии уксусной кислотыВоздействие уксусной кислоты может представлять серьезную опасность для вашего здоровья. Это химическое вещество особенно опасно при попадании на кожу или в глаза.В любом случае воздействия уксусной кислоты важно немедленно обратиться за помощью к медицинскому работнику, чтобы предотвратить вредные последствия для здоровья.
Контакт с кожей — Немедленно промойте кожу водой в течение не менее 15 минут и снимите загрязненную одежду. Покройте раздраженную кожу смягчающим средством. В случае серьезного контакта с кожей промыть дезинфицирующим мылом. Как можно скорее обратитесь за медицинской помощью.
Контакт с глазами — Немедленно снимите контактные линзы, если они есть.Немедленно промойте глаза большим количеством воды в течение не менее 15 минут. Немедленно обратитесь за медицинской помощью.
Проглатывание — При проглатывании уксусной кислоты не вызывайте рвоту. Если пострадавший без сознания, не применяйте реанимацию «рот в рот». Снимите тесную одежду. При появлении каких-либо симптомов немедленно обратитесь за медицинской помощью.
Вдыхание — При вдыхании немедленно обратиться на свежий воздух и за медицинской помощью. Если дыхание затруднено, подайте кислород.Если дыхание отсутствует, сделайте искусственное дыхание.
Безопасное хранение и утилизация уксусной кислотыУксусную кислоту следует хранить в разрешенном месте вдали от источников тепла или других источников возгорания. Держите подальше от несовместимых материалов, включая окислители, восстановители, металлы, кислоты и щелочи. Храните уксусную кислоту в прохладном, хорошо вентилируемом помещении в плотно закрытой таре.
Это химическое вещество необходимо утилизировать в соответствии с федеральными, государственными и местными законами по охране окружающей среды.Вот отличный ресурс для информации о соблюдении правил техники безопасности.
Безопасность имеет первостепенное значение при работе с потенциально опасными химическими веществами, такими как уксусная кислота. Эту агрессивную жидкость следует использовать с осторожностью как на рабочем месте, так и в бытовых товарах. Для получения дополнительной информации об использовании, безопасности или утилизации уксусной кислоты выполните поиск в нашей базе данных паспортов безопасности материалов.
Уксусная кислота: общая информация — GOV.UK
Обзор
Уксусная кислота, также известная как этановая кислота, представляет собой прозрачную бесцветную жидкость с резким запахом, напоминающим уксус.Когда она чистая (100% уксусная кислота), ее называют ледяной уксусной кислотой.
Использование уксусной кислоты
Уксусная кислота — основной компонент уксуса, который содержит от 4 до 18% уксусной кислоты. Он используется в качестве пищевого консерванта и пищевой добавки (известен как E260). В больших количествах уксусная кислота используется для изготовления таких продуктов, как чернила для печати по текстилю, красители, фотохимикаты, пестициды, фармацевтические препараты, резина и пластмассы. Он также используется в некоторых бытовых чистящих средствах для удаления известкового налета.
Как уксусная кислота попадает в окружающую среду
Уксусная кислота может попадать в окружающую среду в результате промышленных выбросов и промышленных выбросов. Сжигание пластика или резины и выхлопные газы транспортных средств также могут выделять уксусную кислоту в окружающую среду. Попадая в почву, он испаряется в воздух, где естественным образом расщепляется солнечным светом. Ожидается, что уровни уксусной кислоты в окружающей среде будут низкими.
Воздействие уксусной кислоты
В природе люди вырабатывают небольшое количество уксусной кислоты.Он играет важную роль в метаболизме жиров и углеводов в организме. Уксусная кислота естественным образом присутствует в некоторых необработанных продуктах, включая фрукты, и в некоторых продуктах питания в качестве добавки. Также возможно воздействие от использования бытовых товаров, содержащих уксусную кислоту. Не ожидается, что воздействие низких уровней уксусной кислоты в окружающей среде при нормальном питании и при правильном использовании бытовых товаров вызовет неблагоприятные последствия для здоровья.
Воздействие более высоких уровней уксусной кислоты более вероятно на рабочем месте.Однако безопасные уровни применяются для защиты сотрудников, которые могут подвергаться воздействию уксусной кислоты на работе. Такие уровни ниже тех, которые, как считается, вызывают вредные последствия.
Как воздействие уксусной кислоты может повлиять на ваше здоровье
Присутствие уксусной кислоты в окружающей среде не всегда приводит к заражению. Чтобы он вызвал какие-либо неблагоприятные последствия для здоровья, вы должны вступить с ним в контакт. Вы можете подвергнуться воздействию уксусной кислоты, вдыхая или проглатывая ее, или при контакте с кожей.После воздействия любого химического вещества неблагоприятные последствия для здоровья, с которыми вы можете столкнуться, зависят от нескольких факторов, включая количество, которому вы подверглись (доза), способ, которым вы подверглись, продолжительность воздействия, форма химического вещества и наличие вы подвергались воздействию любых других химикатов.
Низкий уровень воздействия уксусной кислоты из рациона или при правильном использовании бытовых продуктов, содержащих уксусную кислоту, не вызовет неблагоприятных последствий для здоровья.
Воздействие разбавленных растворов уксусной кислоты может вызвать раздражение.Вдыхание паров уксусной кислоты может вызвать раздражение глаз, носа и горла, а также кашель.
Воздействие более концентрированных растворов уксусной кислоты (> 25%) может вызвать коррозионные повреждения.
Вдыхание паров с высоким содержанием уксусной кислоты может вызвать раздражение глаз, носа и горла, кашель, стеснение в груди, головную боль, жар и спутанность сознания. В серьезных случаях может произойти повреждение дыхательных путей, учащенное сердцебиение и повреждение глаз. Может произойти скопление жидкости в легких, и это может занять 36 часов.
Проглатывание более высоких концентраций вызывает немедленное жжение во рту и горле, затрудненное дыхание, слюнотечение, затрудненное глотание, боли в желудке и рвоту (может быть кровь в рвоте).
Контакт с кожей сильной уксусной кислоты может вызвать боль, ожоги и язвы. Попадание в глаза вызывает боль, подергивание век, слезотечение, воспаление, чувствительность к свету и ожоги.
Уксусная кислота и рак
Уксусная кислота не считается химическим веществом, вызывающим рак.
Уязвимые
Люди с проблемами дыхания, такими как астма, могут быть более восприимчивыми к воздействию вдыхания уксусной кислоты. Это связано с тем, что более высокий уровень уксусной кислоты может вызвать раздражение дыхательных путей, приводящее к стеснению в груди, хрипу и одышке.
Беременность и нерожденный ребенок
Низкий уровень воздействия уксусной кислоты из рациона или при правильном использовании бытовых продуктов, содержащих уксусную кислоту, не может нанести вред нерожденному ребенку.
Имеется ограниченная информация о чрезмерном воздействии уксусной кислоты во время беременности. Раздражитель или едкое вещество, как правило, возникает в месте контакта, например, раздражение кожи или глаз. Всасывание кислот в организм, как правило, низкое, и поэтому они не оказывают воздействия на другие части тела. Поэтому на будущего ребенка уксусная кислота вряд ли окажет прямое воздействие. Однако, если воздействие уксусной кислоты вызывает недомогание матери, это может повлиять на здоровье будущего ребенка.
Дети
Если дети дышат, проглатывают или прикасаются к уксусной кислоте, они будут иметь те же эффекты, что и у взрослых. Ожидается, что они не будут более чувствительными к воздействию уксусной кислоты.
Бытовые чистящие средства, содержащие уксусную кислоту, следует хранить в подходящей таре в недоступном для детей месте.
Что делать, если вы подверглись воздействию уксусной кислоты
Ожидается, что воздействие уксусной кислоты, содержащейся в домашнем уксусе, не причинит вреда.
При воздействии более концентрированной уксусной кислоты:
- вы должны удалиться от источника воздействия
- Если на коже попала уксусная кислота, снимите загрязненную одежду (не через голову), промойте пораженный участок теплой водой с мылом не менее 10–15 минут и обратитесь за медицинской помощью.
- Если в глаза попала уксусная кислота, снимите контактные линзы, промойте пораженный глаз теплой водой в течение не менее 10-15 минут и обратитесь за медицинской помощью.
- , если вы вдохнули или проглотили уксусную кислоту, обратитесь за медицинской помощью
Дополнительные источники информации
уксусная кислота (ирригационная) | Michigan Medicine
Какая самая важная информация, которую я должен знать об ирриганте с уксусной кислотой?
Следуйте всем указаниям на этикетке и упаковке лекарства.Расскажите каждому из своих лечащих врачей обо всех своих заболеваниях, аллергиях и обо всех лекарствах, которые вы принимаете.
Что такое ирригант уксусной кислоты?
Уксусная кислота — это натуральное кислотное вещество, которое обычно содержится в уксусе.
Ирригант уксусной кислоты используется для очистки (орошения) внутренней части мочевого пузыря у людей, которые используют катетер в уретре (трубка для вывода мочи из мочевого пузыря) в течение длительного периода времени. Уксусная кислота помогает предотвратить инфекцию и накопление кальция в катетере и мочевом пузыре.
Ирригант с уксусной кислотой также может использоваться для целей, не указанных в данном руководстве.
Что мне следует обсудить с лечащим врачом перед использованием ирриганта уксусной кислоты?
Вы не должны использовать это лекарство, если у вас аллергия на уксусную кислоту или уксус.
Сообщите своему врачу, если у вас когда-либо были:
- поражение внутри мочевого пузыря; или
- травма мочевого пузыря.
Неизвестно, вредит ли это лекарство нерожденному ребенку. Сообщите своему врачу, если вы беременны или планируете забеременеть.
Кормить грудью при использовании этого лекарства может быть небезопасно. Спросите своего врача о любом риске.
Ирригант с уксусной кислотой не одобрен для использования кем-либо моложе 18 лет.
Как использовать ирригант уксусной кислоты?
Уксусная кислота вводится непосредственно в мочевой пузырь через катетер, введенный в мочеиспускательный канал.Скорее всего, вы получите это лекарство в клинике или больнице.
Если вы принимаете это лекарство дома, прочтите все инструкции по применению, прилагаемые к вашему лекарству, и внимательно следуйте им. Если вы не понимаете эти инструкции, спросите своего врача или фармацевта.
Не принимать внутрь. Ирригант уксусной кислоты предназначен для использования только в мочевом пузыре.
Готовьте уксусную кислоту только тогда, когда вы будете готовы промывать катетер.Чтобы сделать орошение более комфортным, вы можете согреть лекарство, но не нагревайте лекарство выше 150 градусов по Фаренгейту (66 градусов по Цельсию).
Вам могут потребоваться частые тесты pH вашей мочи, чтобы помочь вашему врачу определить, как долго вам следует лечить вас ирригентом уксусной кислоты.
Хранить при комнатной температуре вдали от влаги и тепла. Не мерзни.
Каждая бутылка ирриганта уксусной кислоты предназначена только для одного использования. Выбросьте его после одного использования, даже если внутри все еще осталось лекарство.
Что произойдет, если я пропущу дозу?
Поскольку ирригант уксусной кислоты используется при необходимости, а иногда и непрерывно, пока установлен катетер, у этого лекарства нет ежедневного графика дозирования.
Что произойдет, если я передозирую?
Передозировка маловероятна, если это лекарство используется по назначению.
Чего следует избегать при использовании ирриганта уксусной кислоты?
Следуйте инструкциям вашего врача о любых ограничениях в еде, напитках или активности.
Каковы возможные побочные эффекты ирриганта уксусной кислоты?
При появлении признаков аллергической реакции обратитесь за неотложной медицинской помощью: крапивница; затрудненное дыхание; отек лица, губ, языка или горла.
Прекратите использовать ирригант уксусной кислоты и сразу же обратитесь к врачу, если у вас есть:
- сильная боль или жжение после использования лекарства;
- кровь в катетерной трубке или пакете для сбора мочи;
- одышка; или
- необычная усталость или сонливость.
Общие побочные эффекты могут включать:
- легкое жжение или ощущение холода в уретре или мочевом пузыре.
Это не полный список побочных эффектов, могут возникать и другие. Спросите у своего доктора о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088.
Какие другие препараты повлияют на ирригант уксусной кислоты?
Уксусная кислота, используемая для ирригации мочевого пузыря, вряд ли будет подвержена влиянию других лекарств, которые вы принимаете.Но многие лекарства могут взаимодействовать друг с другом. Сообщите каждому из своих медицинских работников обо всех лекарствах, которые вы принимаете, включая лекарства, отпускаемые по рецепту и без рецепта, витамины и растительные продукты.
Где я могу получить дополнительную информацию?
Ваш фармацевт может предоставить дополнительную информацию об ирриганте с уксусной кислотой.
Помните, храните это и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте это лекарство только по назначению.
Были предприняты все усилия для обеспечения точности, актуальности и полноты информации, предоставленной Cerner Multum, Inc. («Multum»), но никаких гарантий на этот счет не дается. Содержащаяся здесь информация о препарате может меняться с течением времени. Информация Multum была собрана для использования практикующими врачами и потребителями в Соединенных Штатах, и поэтому Multum не гарантирует, что использование за пределами США является целесообразным, если специально не указано иное.Информация о лекарственных препаратах Multum не содержит рекомендаций по лекарствам, диагностике пациентов и лечению. Информация о лекарственных препаратах Multum — это информационный ресурс, предназначенный для оказания помощи лицензированным практикующим врачам в уходе за своими пациентами и / или обслуживании потребителей, рассматривающих эту услугу как дополнение к опыту, навыкам, знаниям и суждениям практикующих врачей, а не их замену. Отсутствие предупреждения для данного лекарственного средства или комбинации лекарств никоим образом не должно толковаться как указание на то, что лекарство или комбинация лекарств безопасны, эффективны или подходят для любого данного пациента.Multum не несет никакой ответственности за какие-либо аспекты здравоохранения, управляемые с помощью информации, предоставляемой Multum. Информация, содержащаяся в данном документе, не предназначена для охвата всех возможных способов использования, указаний, мер предосторожности, предупреждений, лекарственных взаимодействий, аллергических реакций или побочных эффектов. Если у вас есть вопросы о лекарствах, которые вы принимаете, проконсультируйтесь с врачом, медсестрой или фармацевтом.
Copyright 1996-2021 Cerner Multum, Inc. Версия: 1.01. Дата редакции: 13.08.2018.
использований этановой кислоты | Sciencing
Обновлено 1 декабря 2018 г.
Автор J. Dianne Dotson
Этановая кислота, также называемая уксусной кислотой, — это химическое вещество с резким едким запахом. Вы можете распознать запах, похожий на запах уксуса. Уксусная или этановая кислота, считающаяся слабой синтетической кислотой, по-прежнему является мощным химическим веществом. Этановая кислота имеет множество применений в промышленных, медицинских и домашних условиях.
TL; DR (слишком долго; не читал)
Этановая кислота, также называемая уксусной кислотой, является слабой кислотой, которую можно отличить по резкому запаху, напоминающему уксус.Этановая или уксусная кислота используется во многих аспектах, включая химические реагенты, пластмассы, пищевые продукты, фармацевтические препараты и местные медицинские препараты.
Формула и характеристики уксусной кислоты
Уксусная или этановая кислота представляет собой слабую карбоновую кислоту. Основная формула уксусной кислоты: C 2 H 4 O 2 . Формула уксусной кислоты представляет собой два атома углерода, четыре атома водорода и два атома кислорода. Другой способ выражения формулы уксусной кислоты — CH 3 COOH.Это лучше демонстрирует его карбоксильную группу (-COOH). Уксусная кислота образуется, когда этанол соединяется с кислородом воздуха, давая этановую (уксусную) кислоту и воду. Это называется окислением этанола.
Этановая кислота не имеет цвета, но имеет резкий, резкий запах, очень похожий на уксус. Имейте в виду, что это легковоспламеняющееся химическое вещество с температурой вспышки 39 градусов по Цельсию или 104 градусов по Фаренгейту. Его температура кипения составляет 118 градусов по Цельсию. Уксусная кислота относится к летучим органическим соединениям.
Уксусная кислота впитывает влагу, поэтому классифицируется как гигроскопичная. Он может сильно реагировать с основаниями или кислотами. Уксусная кислота в высоких концентрациях также вызывает коррозию металла и разрушает пластмассы и резину. Другие общие названия уксусной кислоты включают уксусную кислоту, этиловую кислоту, метанкарбоновую кислоту, ледяную уксусную кислоту и ледяную этановую кислоту.
При ферментации фруктов уксусная кислота образуется естественным путем. Некоторые бактерии также выделяют его, например, очень распространенные организмы Acetobacter.Существует несколько методов искусственного получения уксусной кислоты, например карбонилирование метанола и карбонилирование метилацетата.
Использование этановой или уксусной кислоты
Многочисленные применения уксусной кислоты существуют во многих сферах. В промышленности широко используются этановая или уксусная кислота. Обычно он используется в качестве химического реагента в лабораториях, но также и в более крупных промышленных масштабах. На химических предприятиях уксусная кислота используется для производства других химикатов.
Уксусная кислота используется в производстве пластмассовых изделий, например бутылок из других синтетических материалов.Этановая или уксусная кислота используется для изготовления красителей, пигментов, добавок к краскам и покрытиям. Используется при печати на ткани. Он входит в состав столярного клея и других герметиков. Уксусная кислота также используется в качестве очищающего и обезжиривающего растворителя. Его можно использовать для травления неорганических пленок. Уксусная кислота обычно используется в фотоматериалах, таких как пленки и химические растворы. Он также используется в нефтяной промышленности и используется для облицовки и обработки поверхностей, например, на автомобилях. Уксусная кислота также используется в производстве фармацевтических препаратов.
В пищевой промышленности уксусная кислота в более низких концентрациях используется в качестве пищевой добавки, ароматизатора и консерванта. Уксусная кислота регулирует кислотность пищи.
Пищевая уксусная кислота используется в домашнем хозяйстве, включая маринование и присутствие кислоты в уксусе. Маринование овощей и фруктов с уксусом сохраняет их, потому что уксусная кислота предотвращает рост бактерий. Разбавленная уксусная кислота преобладает в некоторых спреях для мытья окон и других бытовых чистящих средствах. Средства для стирки и мытья посуды также часто содержат уксусную кислоту.Уксусная кислота является компонентом антифризов и антиобледенителей, а также используется в таких средствах борьбы с вредителями, как гербициды и инсектициды. Он входит в состав некоторых автомобильных полиролей. Даже макияж и витамины часто делают с уксусной кислотой!
В медицине есть интересные применения уксусной кислоты, некоторые из которых использовались веками. Уксусная кислота входит в состав растворов для удаления бородавок. Его также можно найти в некоторых ушных каплях. Уксусная кислота обладает противогрибковыми и антибактериальными свойствами.
В более низких концентрациях уксусная кислота использовалась в качестве местного средства для лечения ран, особенно ожоговых ран. Уксусная кислота помогла предотвратить распространение бубонной чумы. Это было даже решающим фактором в оказании помощи раненым во время гражданской войны. Разбавленная уксусная кислота эффективно борется с некоторыми устойчивыми штаммами бактерий. Также было доказано, что он является эффективным средством против пагубных грибковых инфекций. В частности, больным мукормикозом, заболеванием, часто приводящим к летальному исходу, вызываемым грибами отряда Mucorales, может быть полезно применение низких доз уксусной кислоты.Исторически для борьбы с этим видом инфекции использовались дорогие и инвазивные методы лечения. Эта грибковая инфекция не реагирует на другие виды кислот, такие как молочная и соляная кислоты. Но при концентрации 0,3% разбавленная уксусная кислота подавляет прорастание спор грибов. Уксусная кислота, кажется, работает как из-за концентрации ионов водорода, так и из-за наличия свободного ацетата в грибковых клетках. Очень важно использовать этановую или уксусную кислоту в качестве противогрибкового средства. Это относительно недорогое и легкодоступное химическое вещество.Его можно хранить при стабильной температуре. При низких концентрациях он не так опасен, как при более высоких промышленных концентрациях. Таким образом, местная уксусная кислота может эффективно использоваться в полевых условиях или в отдаленных регионах, особенно в зонах боевых действий, для лечения раненых. При раннем лечении этой уксусной кислотой для местного применения раны могут быть не такими серьезными.
Помимо противогрибковых свойств, уксусная кислота также служит антибактериальным средством. Ожоговые раны часто инфицируются, и многие антисептические средства могут навредить заживляющей коже и даже нарушить ее восстановление.Одной из наиболее опасных бактерий, поражающих ожоговые раны, является синегнойная палочка. Эта бактерия печально известна наличием нескольких штаммов, устойчивых к антибиотикам и антисептикам. Те, кто страдает от его инфекций, рискуют оказаться в больнице надолго и дорого. В случаях с устойчивыми к антибиотикам бактериями разбавленная уксусная кислота снова оказывается эффективным и недорогим вариантом. Эффективные концентрации уксусной кислоты колеблются от 0,5 до 5 процентов. Эта концентрация работает против нескольких штаммов антибиотиков P.aeruginosa, что делает его еще одним отличным медицинским средством для лечения мягких тканей и ожоговых ран в больницах.
Риски, связанные с этановой кислотой
Несмотря на полезное использование этановой кислоты, она представляет опасность для здоровья, которую необходимо учитывать при обращении с ней. При работе с концентрированной этановой кислотой необходимо всегда носить защитную одежду и очки. Рабочие места должны хорошо проветриваться, и необходима защита органов дыхания. Температура должна быть ниже точки воспламенения 39 градусов Цельсия, чтобы предотвратить взрывоопасную смесь пара и воздуха.Электрооборудование тоже нуждается в защите. Даже при более низкой температуре 20 градусов Цельсия пары уксусной кислоты могут загрязнять воздух.
Этановая или уксусная кислота сильно разъедает, поэтому ее вдыхание может повредить нежные оболочки легких, носа и горла. Вдыхание этановой или уксусной кислоты также может привести к ухудшению симптомов, таким как одышка, головокружение и отек легких. Этановую или уксусную кислоту нельзя принимать внутрь. Это может вызвать химические ожоги и волдыри на незащищенной коже уже через несколько минут.Высококонцентрированная уксусная кислота также может повредить роговицу глаза, что может привести к потере зрения.
В высоких концентрациях этановая или уксусная кислота вредна для различных видов растений и животных. Удачный аспект уксусной кислоты заключается в том, что она растворима в воде и быстро разлагается на соединения, которые не так вредны. Однако этановая кислота является источником выбросов в бумажной, химической и текстильной промышленности. Он также может быть получен в результате добычи полезных ископаемых.
6.4: Классификация химических реакций (кислоты и основания)
Кислотно-основные реакции
Видео \ (\ PageIndex {1} \): Введение в кислоты и основания.
Кислотно-основная реакция — это реакция, в которой ион водорода H + передается от одного химического соединения к другому. Такие реакции имеют центральное значение для многочисленных природных и технологических процессов, начиная от химических превращений, происходящих в клетках, озерах и океанах, до промышленного производства удобрений, фармацевтических препаратов и других веществ, необходимых для общества.Поэтому предмет кислотно-щелочной химии заслуживает подробного обсуждения, которое, к сожалению, выходит за рамки этого курса.
В целях этого краткого введения мы рассмотрим только наиболее распространенные типы кислотно-основных реакций, протекающих в водных растворах. В этом контексте кислота — это вещество, которое растворяется в воде с образованием ионов гидроксония, H 3 O + . В качестве примера рассмотрим приведенное здесь уравнение:
\ [\ ce {HCl} (водн.) + \ Ce {h3O} (водн.) \ Rightarrow \ ce {Cl -} (водн.) + \ Ce {h4O +} (водн.) \]
Процесс, представленный этим уравнением, подтверждает, что хлористый водород является кислотой.При растворении в воде ионы H 3 O + образуются в результате химической реакции, в которой ионы H + передаются от молекул HCl к молекулам H 2 O (Рисунок \ (\ PageIndex {1} \) ).
Рисунок \ (\ PageIndex {1} \): Когда газообразный хлористый водород растворяется в воде, (а) он реагирует как кислота, передавая протоны молекулам воды с образованием (б) ионов гидроксония (и сольватированных ионов хлорида)
Природа HCl такова, что ее реакция с водой, как только что описано, по существу на 100% эффективна: практически каждая молекула HCl, которая растворяется в воде, будет подвергаться этой реакции.Кислоты, которые полностью реагируют таким образом, называются сильными кислотами, а HCl — одно из немногих обычных кислотных соединений, которые классифицируются как сильные (Таблица \ (\ PageIndex {1} \)). Гораздо большее количество соединений ведет себя как слабые кислоты и только частично реагирует с водой, оставляя большую часть растворенных молекул в их исходной форме и генерируя относительно небольшое количество ионов гидроксония. Слабые кислоты обычно встречаются в природе, являясь веществами, частично ответственными за острый вкус цитрусовых, жгучие ощущения от укусов насекомых и неприятные запахи, связанные с запахом тела.Знакомый пример слабой кислоты — уксусная кислота, главный ингредиент пищевых уксусов:
\ [\ ce {Ch4CO2H} (водн.) + \ Ce {h3O} (l) \ rightleftharpoons \ ce {Ch4CO2 -} (водн.) + \ Ce {h4O +} (водн.) \]
При растворении в воде в обычных условиях только около 1% молекул уксусной кислоты находится в ионизированной форме, \ (\ ce {Ch4CO2 -} \) (Рисунок \ (\ PageIndex {2} \)). (Использование двойной стрелки в приведенном выше уравнении обозначает аспект частичной реакции этого процесса, концепция которого полностью рассматривается в главах, посвященных химическому равновесию.)
Рисунок \ (\ PageIndex {2} \): (a) Фрукты, такие как апельсины, лимоны и грейпфрут, содержат лимонную кислоту со слабой кислотой. (б) Уксусы содержат слабокислотную уксусную кислоту. (кредит а: модификация работы Скотта Бауэра; кредит б: модификация работы Брюке-Остеуропа / Wikimedia Commons)
| Состав смеси | Название в водном растворе |
|---|---|
| HBr | бромистоводородная кислота |
| HCl | соляная кислота |
| HI | иодистоводородная кислота |
| HNO 3 | азотная кислота |
| HClO 4 | хлорная кислота |
| H 2 SO 4 | серная кислота |
Основание — это вещество, которое растворяется в воде с образованием гидроксид-ионов OH —.Наиболее распространенными основаниями являются ионные соединения, состоящие из катионов щелочных или щелочноземельных металлов (группы 1 и 2) в сочетании с гидроксид-ионом, например NaOH и Ca (OH) 2 . Когда эти соединения растворяются в воде, гидроксид-ионы выделяются непосредственно в раствор. Например, KOH и Ba (OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ , соответственно) и гидроксид-ионов, OH —. Эти основания, наряду с другими гидроксидами, которые полностью диссоциируют в воде, считаются сильными основаниями.
Рассмотрим в качестве примера растворение щелока (гидроксида натрия) в воде:
\ [\ ce {NaOH} (s) \ rightarrow \ ce {Na +} (водн.) + \ Ce {OH -} (водн.) \]
Это уравнение подтверждает, что гидроксид натрия является основанием. При растворении в воде NaOH диссоциирует с образованием ионов Na + и OH —. Это также верно для любого другого ионного соединения, содержащего ионы гидроксида. Поскольку процесс диссоциации по существу завершается, когда ионные соединения растворяются в воде в типичных условиях, NaOH и другие ионные гидроксиды все классифицируются как сильные основания.
В отличие от ионных гидроксидов, некоторые соединения образуют ионы гидроксида при растворении в результате химической реакции с молекулами воды. Во всех случаях эти соединения реагируют только частично и поэтому классифицируются как слабые основания. Эти типы соединений также широко распространены в природе и являются важным сырьем в различных технологиях. Например, глобальное производство слабого основного аммиака обычно превышает 100 метрических тонн в год, который широко используется в качестве сельскохозяйственных удобрений, сырья для химического синтеза других соединений и активного ингредиента в бытовых чистящих средствах (Рисунок \ (\ PageIndex) {3} \)).При растворении в воде аммиак частично реагирует с образованием ионов гидроксида, как показано здесь:
\ [\ ce {Nh4} (aq) + \ ce {h3O} (l) \ rightleftharpoons \ ce {Nh5 +} (aq) + \ ce {OH -} (aq) \]
Это, по определению, кислотно-основная реакция, в данном случае включающая перенос ионов H + от молекул воды к молекулам аммиака. В типичных условиях только около 1% растворенного аммиака присутствует в виде ионов \ (\ ce {Nh5 +} \).
Рисунок \ (\ PageIndex {3} \): Аммиак — слабое основание, используемое во множестве приложений.(а) Чистый аммиак обычно применяется в качестве сельскохозяйственных удобрений. (б) Разбавленные растворы аммиака являются эффективными бытовыми чистящими средствами. (кредит а: модификация работы Национальной службы охраны ресурсов; кредит b: модификация работы pat00139)
Описанные химические реакции, в которых кислоты и основания, растворенные в воде, производят ионы гидроксония и гидроксид-ионы соответственно, по определению являются кислотно-основными реакциями. В этих реакциях вода служит как растворителем , так и реагентом.Реакция нейтрализации — это особый тип кислотно-основной реакции, в которой реагентами являются кислота и основание, продуктами часто являются соль и вода, и ни один из реагентов не является самой водой:
\ [\ mathrm {кислота + основание \ rightarrow соль + вода} \]
Чтобы проиллюстрировать реакцию нейтрализации, рассмотрим, что происходит, когда обычный антацид, такой как молоко магнезии (водная суспензия твердого Mg (OH) 2 ), проглатывается для облегчения симптомов, связанных с избытком желудочной кислоты (HCl):
\ [\ ce {Mg (OH) 2} (s) + \ ce {2HCl} (водный) \ rightarrow \ ce {MgCl2} (водный раствор) + \ ce {2h3O} (l).\]
Обратите внимание, что помимо воды в этой реакции образуется соль хлорид магния.
Пример \ (\ PageIndex {1} \): Написание уравнений для кислотно-основных реакций
Напишите сбалансированные химические уравнения для кислотно-основных реакций, описанных здесь:
- слабокислый гипохлорит водорода реагирует с водой
- раствор гидроксида бария нейтрализован раствором азотной кислоты
Решение
(a) Предусмотрены два реагента: HOCl и H 2 O.Поскольку вещество считается кислотой, его реакция с водой будет включать перенос H + от HOCl к H 2 O с образованием ионов гидроксония, H 3 O + и ионов гипохлорита, OCl — .
\ [\ ce {HOCl} (aq) + \ ce {h3O} (l) \ rightleftharpoons \ ce {OCl -} (aq) + \ ce {h4O +} (aq) \ nonumber \]
В этом уравнении подходит двойная стрелка, поскольку она указывает на то, что HOCl является слабой кислотой, которая не прореагировала полностью.
(b) Предлагаются два реагента: Ba (OH) 2 и HNO 3 .Поскольку это реакция нейтрализации, двумя продуктами будут вода и соль, состоящая из катиона ионного гидроксида (Ba 2+ ) и аниона, образующегося, когда кислота переносит свой ион водорода \ (\ ce {(NO3- )} \).
\ [\ ce {Ba (OH) 2} (aq) + \ ce {2HNO3} (aq) \ rightarrow \ ce {Ba (NO3) 2} (aq) + \ ce {2h3O} (l) \ nonumber \ ]
10.1: Кислоты: свойства и примеры
Цели обучения
- Изучите свойства кислот.
Многие люди любят пить кофе.Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости. Только не забудьте пропустить воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты изменяют цвет определенных кислотно-щелочных индикаторов. Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что ряд активности — это список металлов в порядке убывания их реакционной способности. Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
\ [\ ce {Zn} \ left (s \ right) + \ ce {H_2SO_4} \ left (aq \ right) \ rightarrow \ ce {ZnSO_4} \ left (aq \ right) + \ ce {H_2} \ left (g \ right) \ label {eq1} \] - Реакция взаимодействия кислот и оснований с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот, но вы можете обнаружить, что перечисление оснований немного сложнее. Вот неполный список некоторых распространенных кислот и оснований, а также некоторые химические формулы:
Имя химика | Общее название | Использует |
|---|---|---|
соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота — HCl) | Используется при очистке (рафинировании) металлов, при обслуживании бассейнов и для уборки в домашних условиях. |
серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений. | |
азотная кислота, HNO 3 | Используется при производстве удобрений, взрывчатых веществ и при добыче золота. | |
уксусная кислота, HC 2 H 3 O 2 | уксус | Основной ингредиент в уксусе. |
угольная кислота, H 2 CO 3 | отвечает за «физ» в газированных напитках | В качестве ингредиента газированных напитков. |
лимонная кислота, C 6 H 8 O 7 | Используется в продуктах питания и диетических добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 ) CO 2 H | аспирин | Активный ингредиент аспирина. |
В следующем разделе мы начнем исследовать, что именно делает кислоту кислотой, а что заставляет основание действовать как основание. Взгляните на формулы, приведенные в первой таблице, и сделайте предположение.
соляная кислота
Соляная кислота — это сильная коррозионная минеральная кислота, которая используется во многих промышленных целях.{-} (водн.)} \]
Соляная кислота поэтому может использоваться для получения хлоридных солей. Соляная кислота — сильная кислота, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота — сильнодействующая минеральная кислота с высокой коррозионной активностью с молекулярной формулой \ (\ ce {h3SO4} \). Серная кислота является дипротоновой кислотой и имеет широкий спектр применения, в том числе в бытовых кислотных очистителях канализации, [ в качестве электролита в свинцово-кислотных аккумуляторах и в различных чистящих средствах.Это также центральное вещество в химической промышленности.
Рисунок \ (\ PageIndex {1} \): Капли концентрированной серной кислоты быстро разлагают кусок хлопкового полотенца путем обезвоживания. (CC BY-SA 3.0; Токсичный ходок).Поскольку гидратация серной кислоты является термодинамически благоприятной (и сильно экзотермической), а ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень сильным обезвоживающим свойством, удаляя воду (\ (\ ce {h3O} \)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло и пар.Серная кислота ведет себя как обычная кислота в реакции с большинством металлов с образованием газообразного водорода (уравнение 14.2.1).
Азотная кислота
Азотная кислота (\ (\ ce {HNO3} \)) — это очень коррозионная минеральная кислота, которая также широко используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем реакции диоксида азота (\ (\ ce {NO_2 (g)} \)) с водой.
\ [\ ce {3 NO2 (г) + h3O (l) → 2 HNO3 (ag) + NO (г)} \]
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации кислоты и природы металла.Разбавленная азотная кислота ведет себя как обычная кислота в реакции с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет газ \ (\ ce {h3} \)):
\ [\ ce {Mg + 2 HNO3 → Mg (NO3) 2 + h3} \]
\ [\ ce {Mn + 2 HNO3 → Mn (NO3) 2 + h3} \]
\ [\ ce {Zn + 2 HNO3 → Zn (NO3) 2 + h3} \]
Азотная кислота — это едкая кислота и мощный окислитель. Основная опасность, которую представляет он, — это химические ожоги, поскольку он выполняет кислотный гидролиз с белками (амидом) и жирами (сложным эфиром), что, следовательно, разлагает живую ткань (Рисунок \ (\ PageIndex {2} \)).Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином
Рисунок \ (\ PageIndex {2} \): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
Угольная кислота
Угольная кислота представляет собой химическое соединение с химической формулой \ (\ ce {h3CO3} \), а также иногда называют растворы углекислого газа в воде (газированная вода), потому что такие растворы содержат небольшие количества \ (\ ce {h3CO3 (водн.)} \).Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии углекислота вызывает растворение известняка с образованием бикарбоната кальция, который приводит к появлению многих свойств известняка, таких как сталактиты и сталагмиты. Угольная кислота — это полипротонная кислота, в частности, дипротонная, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда диоксид углерода растворяется в воде, он находится в химическом равновесии (обсуждается в главе 15) с образованием угольной кислоты:
\ [\ ce {CO2 + h3O <=> h3CO3} \]
Реакцию можно подтолкнуть к тому, чтобы реагенты генерировали \ (\ ce {CO2 (g)} \) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).Муравьиная кислота
Муравьиная кислота (\ (\ ce {HCO2H} \)) представляет собой простейшую карбоновую кислоту и является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравейник» происходит от латинского слова «муравей», formica, что указывает на его раннее выделение путем перегонки тел муравьев. Муравьиная кислота широко встречается в природе в виде конъюгированного с ней формиата основания.
Лимонная кислота
Лимонная кислота (\ (\ ce {C6H8O7} \)) — слабая органическая трикарбоновая кислота, которая в природе встречается в цитрусовых.Цитрат-ион является промежуточным звеном в цикле TCA (цикл Кребса), центральном метаболическом пути для животных, растений и бактерий. Поскольку это одна из наиболее сильных пищевых кислот, лимонная кислота чаще всего используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Рисунок \ (\ PageIndex {4} \): лимоны, апельсины, лаймы и другие цитрусовые содержат высокую концентрацию лимонной кислоты (CC BY-SA 2.5; Андре Карват).Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспалений.Аспирин в виде листьев ивы использовался для улучшения здоровья уже не менее 2400 лет.

 Ее разнообразные виды, от мельчайших песчинок до гигантских планет, и образуют этот огромный удивительный мир.
Ее разнообразные виды, от мельчайших песчинок до гигантских планет, и образуют этот огромный удивительный мир.

 4
4 Например, молоко — смесь воды, белков, жиров и углеводов, а воздух — смесь азота, кислорода и некоторых других газов.
Например, молоко — смесь воды, белков, жиров и углеводов, а воздух — смесь азота, кислорода и некоторых других газов. Таким образом, каждый элемент объединяет в себе от 2 до 29 похожих атомов. Химические элементы собраны в периодической системе элементов, первый вариант которой составил в 1869 году величайший русский ученый Дмитрий Иванович Менделеев (рис. 6).
Таким образом, каждый элемент объединяет в себе от 2 до 29 похожих атомов. Химические элементы собраны в периодической системе элементов, первый вариант которой составил в 1869 году величайший русский ученый Дмитрий Иванович Менделеев (рис. 6). 7
7
 Какие из веществ, на ваш взгляд, являются чистыми, а какие — смесями?
Какие из веществ, на ваш взгляд, являются чистыми, а какие — смесями? Найдите в периодической системе элементы, названные в честь:
Найдите в периодической системе элементы, названные в честь: 8
8 Или, например, ржавчина — вещество, образующееся в результате химической реакции железа с кислородом в присутствии влаги (рис. 9).
Или, например, ржавчина — вещество, образующееся в результате химической реакции железа с кислородом в присутствии влаги (рис. 9). Химические формулы бывают трех видов — истинные, эмпирические и структурные. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле. Этому количеству отвечает индекс — маленькая цифра после символа соответствующего элемента. Если индекс равен 1, т. е. в молекуле присутствует только один атом данного элемента, то такой индекс не указывают:
Химические формулы бывают трех видов — истинные, эмпирические и структурные. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле. Этому количеству отвечает индекс — маленькая цифра после символа соответствующего элемента. Если индекс равен 1, т. е. в молекуле присутствует только один атом данного элемента, то такой индекс не указывают: Для того, чтобы перейти от истинной формулы к эмпирической, нужно разделить все индексы в истинной формуле на их наибольший общий делитель. В случае воды эмпирическая формула совпадает с истинной, в случае уксусной кислоты — нет:
Для того, чтобы перейти от истинной формулы к эмпирической, нужно разделить все индексы в истинной формуле на их наибольший общий делитель. В случае воды эмпирическая формула совпадает с истинной, в случае уксусной кислоты — нет: В этом случае группу берут в круглые скобки, а количество таких групп обозначают индексом после всей скобки, например:
В этом случае группу берут в круглые скобки, а количество таких групп обозначают индексом после всей скобки, например: Если индекс относится к группе атомов, то он произносится с суффиксом -жды: Ca(OH)2 — «кальций о аш дважды».
Если индекс относится к группе атомов, то он произносится с суффиксом -жды: Ca(OH)2 — «кальций о аш дважды». Запишите истинные и эмпирические формулы следующих веществ:
Запишите истинные и эмпирические формулы следующих веществ: В. Широков
В. Широков

 п.). При этом веки должны быть максимально открыты. Общее время промывания должно составлять 30 минут.
п.). При этом веки должны быть максимально открыты. Общее время промывания должно составлять 30 минут.