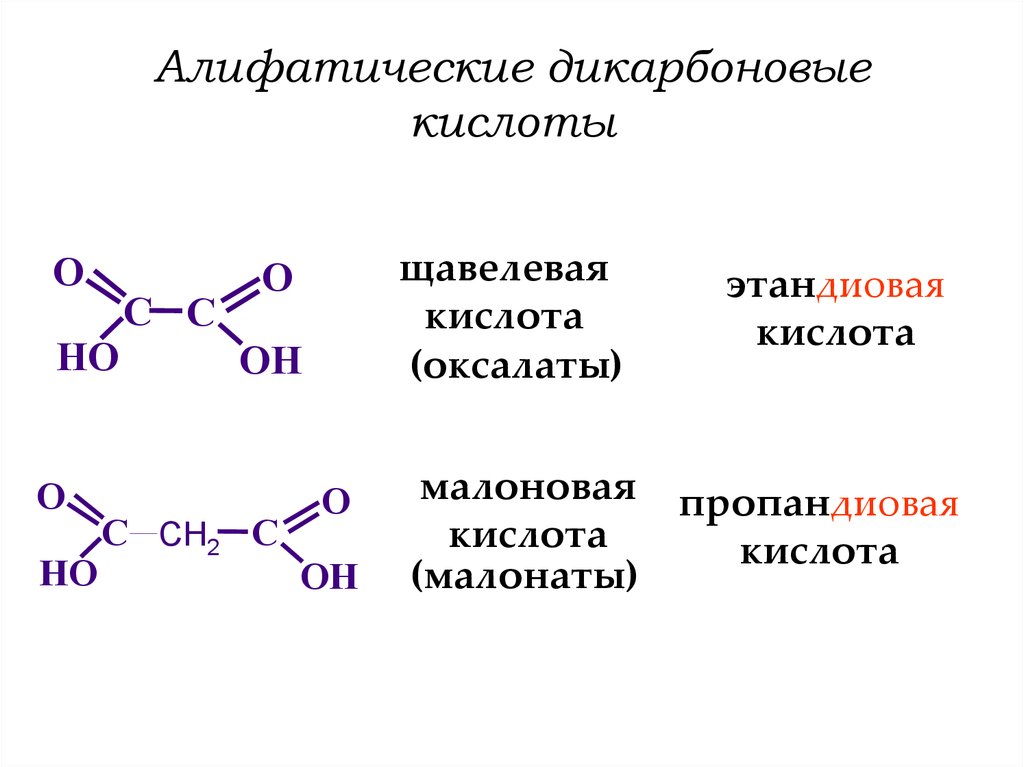
Щавелевая кислота, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Применение щавелевой кислоты
Полезная информация
Admin, 3 июля 2018 — 09:40
Данное вещество встречается в природе часто в виде амидов, солей, свободных изомеров, эфиров. Еще одно название элемента – этандиовая кислота, открыта она была в начале 19 века и до сих пор актуален вопрос о пользе и вреде элемента. Большая часть свойств обладает положительным эффектом, но иногда могут быть спровоцированы негативные процессы.
Что такое щавелевая кислота
Впервые элемент был синтезирован в 1824 году Фридрихом Велером. Щавелевая кислота – это элемент, который среди ученых еще называют этандиовая кислота, относится к категории органических (двухосновных) кислот. В природе можно встретить вещество в виде оксалатов калия, кальция или свободном состоянии. Вещество нашло широкое применение в быту, науке, пищевой промышленности, в сельском хозяйстве и содержится во многих продуктах, которые люди употребляют каждый день
В природе можно встретить вещество в виде оксалатов калия, кальция или свободном состоянии. Вещество нашло широкое применение в быту, науке, пищевой промышленности, в сельском хозяйстве и содержится во многих продуктах, которые люди употребляют каждый день
Формула щавелевой кислоты
Открытие данного вещества сильно повлияло на всю органическую химию, дала возможность проводить новые открытия. Соли щавелевой кислоты называются оксалаты. Их делят на молекулярные, кислые, средние. Большая часть из них в воде не растворяются, если же вы используете чистую кислоту, то она легко с ней смешивается. Из оксалатов с жидкость могут взаимодействовать только соли щелочных металлов и магния. Структурная формула вещества выглядит следующим образом: НООССООН.
Получение щавелевой кислоты
Добыча этого вещества, как правило, необходима для промышленных, бытовых или научных целях. Получение щавелевой кислоты проводится при помощи окисления азотной кислотой сахара при наличии катализатора реакции пятиокиси ванадия. Ниже также будет представлен список в каких продуктах содержатся оксалаты, они еще содержатся во всех растениях. Используются следующие пути получения:
Ниже также будет представлен список в каких продуктах содержатся оксалаты, они еще содержатся во всех растениях. Используются следующие пути получения:
1.Проведение в присутствии V2O5 окисления гликолей, углеводов, спиртов при помощи серной кислоты.
2.В присутствии Pd(No3)2 или PdCl2 окисление этилена или азотной кислоты.
3. Промежуточный формиат натрия получают из окиси углерода и гидроксида натрия. Если его нагреть, получается оксалат натрия, который выделяет щавелевую кислоту в подкисленном состоянии.
Свойства щавелевой кислоты
Открытие данного элемента повлияло на многие сферы, начиная применением его в быту, заканчивая пчеловодством. Соль щавелевой кислоты имеет как химические, так и физические свойства. Каждое из них может быть применено для достижения конкретных целей в текстильной промышленности, химическом производстве, сфере питания.
Выделяют следующие свойства вещества:
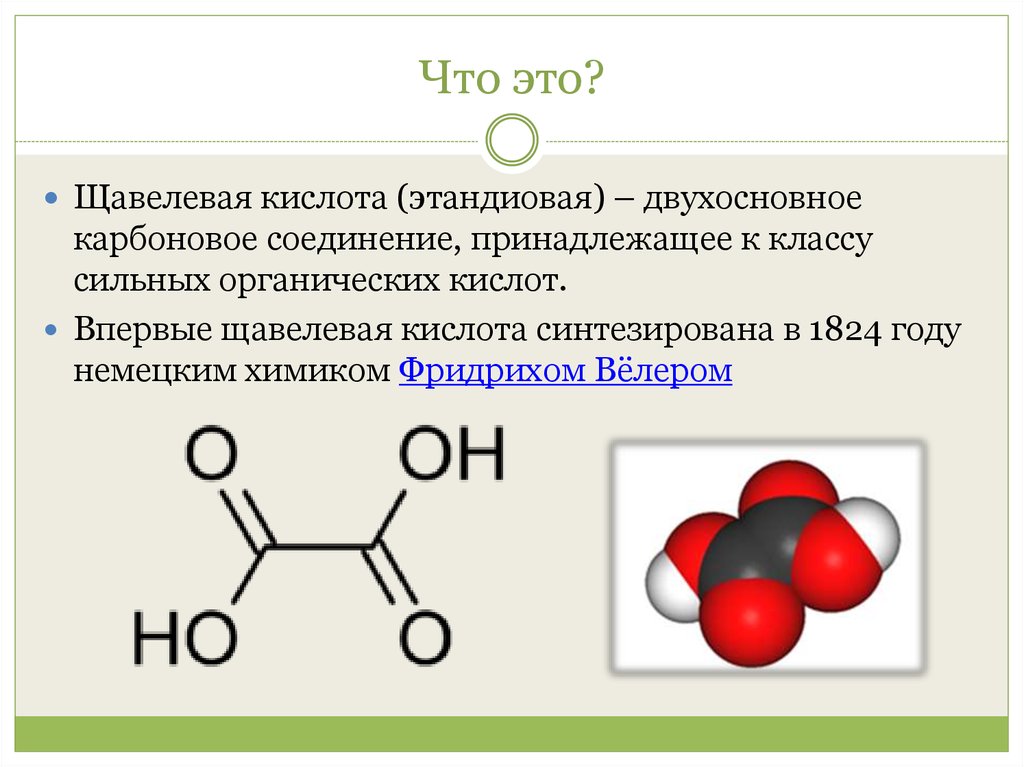
Физические. Это гигроскопичное, кристаллическое бесцветное вещество. Частично может растворяться в этаноле (спирт), воде и не имеет запаха.
Частично может растворяться в этаноле (спирт), воде и не имеет запаха.
Реклама
Химические. Существует особенность у дикарбоновых кислот – они взаимно влияют друг на друга, что облегчает процесс диссоциации. Щавелевая одна из самых сильных кислот этого вида, превосходит значительно по силе свои гомологи.
Применение щавелевой кислоты
Самые популярные области использования данного вещества – отбеливание и очистка. Применение щавелевой кислоты помогает удалить ржавчину, поэтому большинство отбеливающих/моющих средств содержат это химическое соединение. Широко применяется для смягчения, очистки воды, входит в состав чистящих средств для раковин, унитазов, имеет дезинфицирующий эффект. Около 25% от производства находит применение в качестве потравы при окраске на текстильных и кожевенных производствах. Кислота может быть использована как реактив для аналитической химии.
Дигидрат данного вещества по стандартам качества применяется для процессов органического синтеза, очистки от накипи металлов, ржавчины, отбеливания при микроскопии срезов. Раствор с массовой долей 3% используют пчеловоды, чтобы избавиться от паразитического клеща. Рассматриваемое вещество оказывает на пищеварительный тракт бактерицидное действие, участвует в метаболизме. В организм человека должно попадать за сутки 20-30 мг, предельная допустима доза – 50 мг. При превышении этого порога проявляются симптомы передозировки.
Раствор с массовой долей 3% используют пчеловоды, чтобы избавиться от паразитического клеща. Рассматриваемое вещество оказывает на пищеварительный тракт бактерицидное действие, участвует в метаболизме. В организм человека должно попадать за сутки 20-30 мг, предельная допустима доза – 50 мг. При превышении этого порога проявляются симптомы передозировки.
Используют карбоновую кислоту при:
аменорее; бесплодии; кровотечениях; мигренях; атипичном климаксе; глистных инвазиях; вялом кишечнике; хроническом туберкулезе; гайморитах, синуситах; импотенции; кишечных инфекциях; ревматических болях; хламидиозе, трихомониазе.
Не следует забывать, что чрезмерное потребление может привести к нарушению процесса абсорбции кальция. По этой причине могут формироваться оксалатные камни внутри органов мочеполовой системы. Вредоносные образования проходят по мочевым протокам, окрашиваясь из-за крови в черный цвет, травмируя слизистую оболочку. Это приводит к острым болям в спине, паху, брюшной полости, изменению цвета урины.
Передозировка веществом может вызвать: головокружение; слабость; рези в животе; расстройство желудка; жжение горла, ротовой полости, носовых пазух; тошноту.
В каких продуктах содержится
Существует два варианта получения элемента – синтетический и при деструкции древесины. Существуют и продукты, содержащие щавелевую кислоту, которые многие из людей употребляют ежедневное в свою меню. Процент элемента относительно низкий, поэтому передозировка крайне маловероятна и опасности он не представляет. Содержание отличается, ниже будет приведен список, какие продукты содержат кислоту свыше, чем 10 мг на 0,5 чашки.
ревень; кабачок; шпинат; карамбола; ботва свеклы; крепкий чай; крыжовник; шпинат; бочковое пиво; фасоль; салат; апельсин, лайм, лимон; растворимый кофе; щавель; инжир; цикорий; лук-порей; клубника; помидоры; сдобное тесто; красная смородина; пшеничные отруби; овощи зеленого цвета; петрушка.
Источник: https://sovets.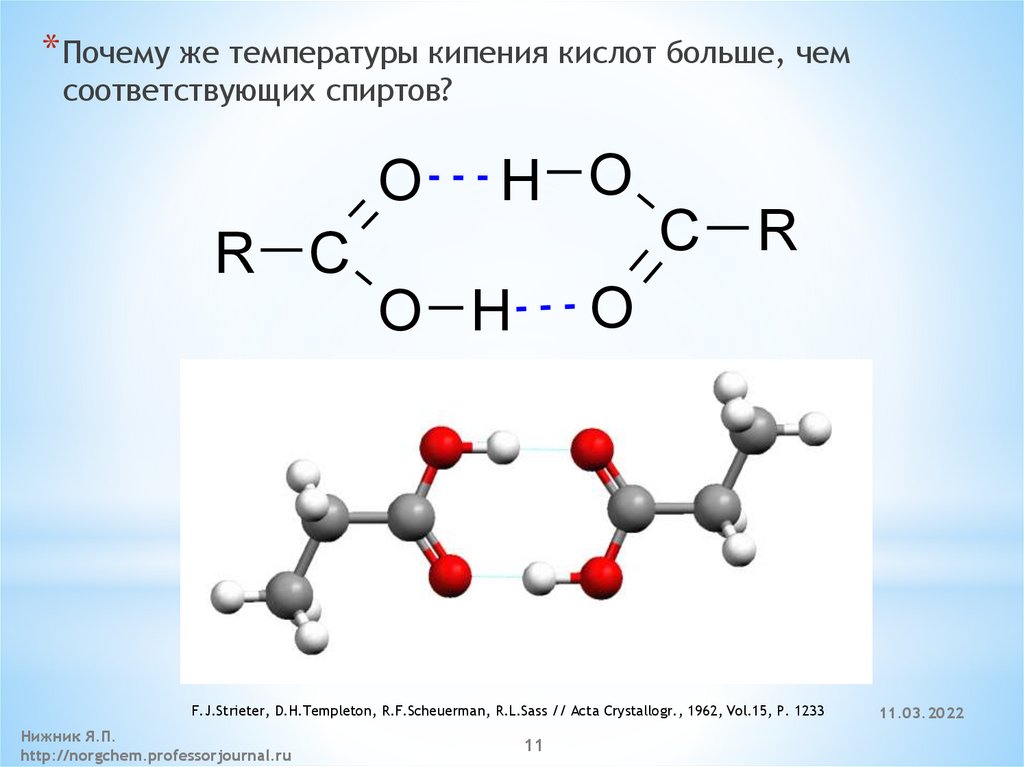 net/12273-cshavelevaya-kislota.html
net/12273-cshavelevaya-kislota.html
Самое интересное в наших социальных сетях
ВКонтакте: Мензелинск news — Мензеля-информ
Одноклассники: ok.ru/menzelinsk
Telegram-канал: Мензелинск news — Мензеля-информ
Следите за самым важным и интересным в Telegram-каналеТатмедиа
К сожалению, реакцию можно поставить не более одного раза 🙁
Мы работаем над улучшением нашего сервиса
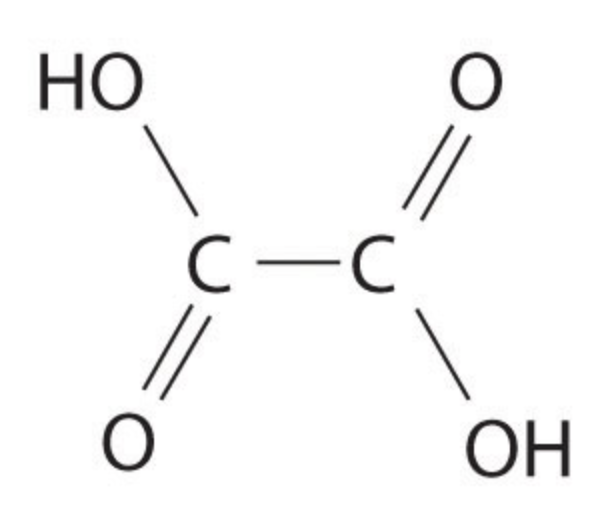
Щавелевая кислота представляет собой химическое соединение с формулой H 2 C 2 O 4 . Эта дикарбоновая кислота лучше описывается формулой HO 2 CCO 2 H. Это относительно сильная органическая кислота, примерно в 10 000 раз сильнее уксусной кислоты. Дианион, известный как оксалат, также является восстановителем, а также лигандом в координационной химии. Многие ионы металлов образуют нерастворимые осадки с оксалатом, ярким примером которого является оксалат кальция, который является основным компонентом наиболее распространенного вида камней в почках. Дополнительные рекомендуемые знания
ПодготовкаХотя щавелевую кислоту можно легко купить, ее можно получить в лаборатории путем окисления сахарозы азотной кислотой в присутствии небольшого количества пятиокиси ванадия в качестве катализатора. [1] В больших масштабах оксалат натрия производится путем поглощения монооксида углерода под давлением в горячем гидроксиде натрия. [2] Обычно щавелевую кислоту получают в виде дигидрата. Это твердое вещество можно дегидратировать нагреванием или азеотропной перегонкой. [3] Безводная щавелевая кислота существует в виде двух полиморфов; в одном водородная связь приводит к цепочечной структуре, тогда как образец водородной связи в другой форме определяет листовую структуру. РеакцииЩавелевая кислота является относительно сильной «слабой кислотой» с pKa 1 = 1,27 и pKa 2 = 4,28. Щавелевая кислота проявляет многие реакции, характерные для других карбоновых кислот. Он образует сложные эфиры, такие как диметилоксалат (т.пл. 52,5–53,5 °C). [5] . Он образует хлорангидрид, называемый оксалилхлоридом. Оксалат, сопряженное основание щавелевой кислоты, является превосходным лигандом для ионов металлов. Обычно он связывается как бидентатный лиганд, образуя 5-членную МО 2 C 2 кольцо. Иллюстративный комплекс представляет собой ферриоксалат калия, K 3 [Fe(C 2 O 4 ) 3 ]. Препарат Оксалиплатин обладает улучшенной растворимостью в воде по сравнению с более ранними препаратами на основе платины, что позволяет избежать ограничивающего дозу побочного эффекта нефротоксичности. Возникновение в природе Щавелевая кислота и оксалаты в изобилии присутствуют во многих растениях, в первую очередь в жирной курице (ягнятине), кислой траве и щавеле (включая Кислица ). Пищевые продукты, которые съедобны, но содержат значительные концентрации щавелевой кислоты, включают в порядке убывания карамболу, черный перец, петрушку, мак, стебли ревеня, амарант, шпинат, мангольд, свеклу. , какао, шоколад, большинство орехов, большинство ягод и бобы. Привкус песка во рту, возникающий при употреблении молока с десертом из ревеня, вызван осаждением оксалата кальция. Таким образом, даже разбавленные количества щавелевой кислоты могут легко «расщепить» казеин, содержащийся в различных молочных продуктах. Листья чайного растения ( Camellia sinensis ) содержат одну из самых высоких измеренных концентраций щавелевой кислоты по сравнению с другими растениями. Однако настой обычно содержит от низкого до умеренного количества щавелевой кислоты на порцию из-за небольшой массы листьев, используемых для заваривания. Физиологические эффекты Сродство ионов двухвалентных металлов иногда выражается в их склонности к образованию нерастворимых осадков. Щавелевая кислота также может быть получена в результате метаболизма этиленгликоля («антифриза»), глиоксиловой кислоты или аскорбиновой кислоты (витамин С). При определенных условиях концентрации и pH щавелевая кислота может осаждаться в почках в виде кристаллов оксалата кальция, образуя примерно 80% камней в почках. [9] Некоторые виды Aspergillus продуцируют щавелевую кислоту, которая вступает в реакцию с кальцием крови или тканей с образованием осадка оксалата кальция. [10] Имеются некоторые предварительные данные о том, что прием пробиотиков может влиять на скорость экскреции щавелевой кислоты [11] (а также, предположительно, на уровень щавелевой кислоты). В настоящее время актуальны методы снижения содержания оксалатов в пищевых продуктах. [12] Другое использование
Анализы на щавелевую кислоту Титрование перманганатом калия может выявить наличие щавелевой кислоты. Каталожные номера9 Бетше Т.; Фрецдорф, Б. (2005). «Биодеградация щавелевой кислоты из шпината с использованием зародышей злаков». J Agric Food Chem. 53 (25). PMID 16332126. | |
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Щавелевая кислота». Список авторов есть в Википедии. |
Формула щавелевой кислоты: структура, свойства, получение, применение
- Автор Сушмита Рут
- Последнее изменение 27-10-2022
Наши старейшины призывают нас потреблять достаточное количество зеленых листовых овощей. Это связано с тем, что в дополнение к высокому содержанию клетчатки зеленые листовые овощи являются хорошим источником щавелевой кислоты.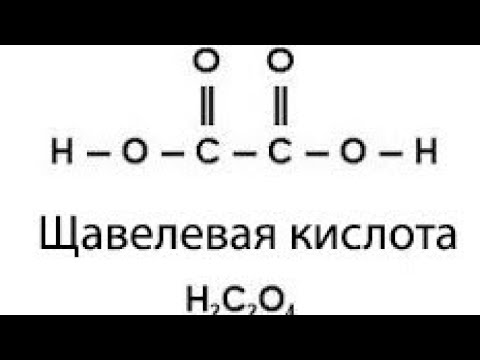 Щавелевая кислота является наиболее основной дикарбоновой кислотой и обычно используется в качестве основного стандартного раствора при кислотно-основном титровании. формула щавелевой кислоты представлена как \({({\rm{COOH}})_2}\).
Щавелевая кислота является наиболее основной дикарбоновой кислотой и обычно используется в качестве основного стандартного раствора при кислотно-основном титровании. формула щавелевой кислоты представлена как \({({\rm{COOH}})_2}\).
Название щавелевой кислоты по классификации ИЮПАК – этандиовая кислота. Он известен как простейшая дикарбоновая кислота. В этой статье мы предоставим подробную информацию о щавелевой кислоте. Прокрутите вниз, чтобы узнать больше!
Название щавелевой кислоты по классификации ИЮПАК – этандиовая кислота. Он принадлежит к функциональной группе карбоновой кислоты с сокращенной формулой \({{\rm{C}}_2}{{\rm{H}}_2}{{\rm{O}}_4}.\) Его химическая формула \({({\rm{COOH}})_2}\) Который является кристаллической формой. Однако молекулярная формула гидратированной щавелевой кислоты: \({({\rm{COOH}})_2} \cdot 2{{\rm{H}}_2}{\rm{O}}.\) 9{ – 1}}\)
Следовательно, один моль щавелевой кислоты весит \(90,03\) грамма.
Гибридизация щавелевой кислоты Щавелевая кислота является простейшей дикарбоновой кислотой. 2}}\) гибридных орбиталей.
2}}\) гибридных орбиталей.
На атоме кислорода карбонильной группы и атоме гидроксильной группы имеется две неподеленные пары. Гидроксильный кислород позволяет одному из его электронов неподеленной пары конъюгировать с пи-системой карбонильной группы. Это делает карбоксильную группу плоской по структуре.
Структура Льюиса щавелевой кислотыСтруктуры электронных точек или структуры Льюиса представляют собой двумерные диаграммы, используемые для представления валентных электронов между атомами молекулы. Связывающие, а также несвязывающие электроны (неподеленные пары), присутствующие в самой внешней оболочке атома, могут быть представлены с помощью структур Льюиса. 9*}4{\rm{O}}} \right) = 34\) электронов.
\(34\) валентных электронов распределены по \({\rm{C}},\,{\rm{H}}\) и \({\rm{O}}\), с атомом углерода как центральный атом. Распределение происходит таким образом, что атомы \({\rm{C}}\) и \({\rm{O}}\) удовлетворяют правилу октета, а водород удовлетворяет его дуплету.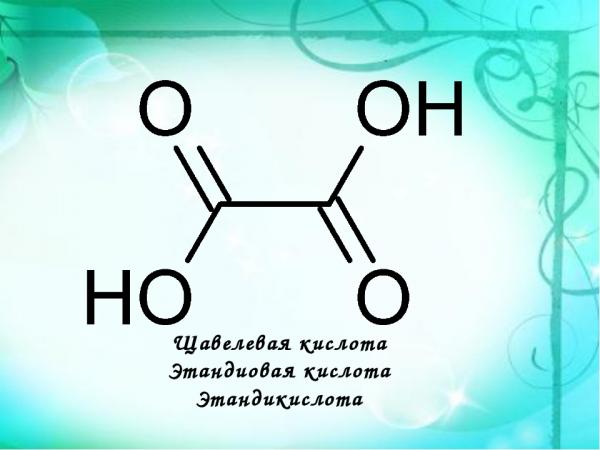 Остальные электроны присутствуют в виде неподеленных пар.
Остальные электроны присутствуют в виде неподеленных пар.
Два связывающих электрона образуют одинарную связь, а четыре связывающих электрона образуют двойную связь. Следовательно, структуру Льюиса щавелевой кислоты можно изобразить следующим образом:
Получение щавелевой кислотыПолучение щавелевой кислоты различными способами описано ниже:
Лабораторное получение щавелевой кислоты пентаоксид ванадия в качестве катализатора.
Промышленное получение щавелевой кислоты
Щавелевую кислоту обычно производят путем нагревания формиата натрия с гидроксидом натрия с образованием оксалата натрия. Затем его превращают в оксалат кальция и обрабатывают серной кислотой, чтобы получить свободную щавелевую кислоту. 9\circ {\rm{C}}\) и обычно встречается в гидратированной форме \({({\rm{COOH}})_2} \cdot 2{{\rm{H}}_2}{\rm{ O}}.\)
Химические свойства щавелевой кислоты следующие:
- Безводная щавелевая кислота гидрофильна и легко поглощает воду.

- Это самая сильная и простая дикарбоновая кислота, которая реагирует как обычная карбоновая кислота, образуя хлорангидрид и производные сложного эфира.
- Это отличный восстановитель, который может восстанавливать марганец из степени окисления \(+7\) в степень окисления \(+2\). Это свойство часто используют для количественного анализа перманганата калия.
\(5{{\rm{C}}_2}{{\rm{H}}_2}{{\rm{O}}_4} + 2{\rm{KMn}}{{\rm{O} }_4} + 3{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \to {{\rm{K}}_2}{\rm{S} }{{\rm{O}}_4} + 2{\rm{MnS}}{{\rm{O}}_4} + 8{{\rm{H}}_2}{\rm{O}} + 10{\rm{C}}{{\rm{O}}_2}\) - Щавелевая кислота может реагировать с пентахлоридом фосфора с образованием оксихлорида фосфора.
- При нагревании металлов со щавелевой кислотой образуется соль щавелевой кислоты, которая может терять монооксид углерода и образовывать карбонаты. Карбонаты можно дополнительно нагревать для разложения на оксид и диоксид углерода. Соль щавелевой кислоты никеля, кобальта и серебра может производить металл вместо оксида неметалла.

- Действует как превосходный хелатирующий лиганд для различных катионов металлов.
Использование щавелевой кислоты:
- Щавелевую кислоту можно использовать в качестве восстановителя, отбеливателя, протравы в красильной и полиграфической промышленности.
- Также используется при аффинаже редких металлов.
- Он используется в качестве аналитического реагента, лабораторных реагентов, реагента для хроматографического анализа и промежуточных красителей.
- Щавелевая кислота используется в производстве лекарств, таких как антибиотики.
Молекулярная формула дигидрата щавелевой кислоты: \({({\rm{COOH}})_2}.\,2{{\rm{H}}_2}{\rm {O}}\) с молекулярной массой \(126,07\;{\rm{г}}/{\rm{моль}}.\) 9+ }\) ионы. Это один из наиболее часто используемых первичных стандартных растворов, применяемых при титровании. Следовательно, важно изучить его структуру и связанные с ним свойства. Щавелевая кислота используется в производстве лекарств, таких как антибиотики. В этой статье мы узнали химическую формулу, химическое строение и свойства щавелевой кислоты. Мы также изучили его лабораторную и промышленную подготовку наряду с его использованием.
Следовательно, важно изучить его структуру и связанные с ним свойства. Щавелевая кислота используется в производстве лекарств, таких как антибиотики. В этой статье мы узнали химическую формулу, химическое строение и свойства щавелевой кислоты. Мы также изучили его лабораторную и промышленную подготовку наряду с его использованием.
Часто задаваемые вопросы о щавелевой кислоте
Q.1. Какова молекулярная формула щавелевой кислоты? 9{– 1}}\). Его дигидратная форма имеет молекулярную формулу \({({\rm{COOH}})_2} \cdot 2{{\rm{H}}_2}{\rm{O}}\).
Q.3. Для чего используется щавелевая кислота?
Ответ: Щавелевую кислоту можно использовать в качестве восстановителя, отбеливателя, протравы в красильной и полиграфической промышленности, а также при рафинировании редких металлов. Он также используется в качестве аналитического реагента, лабораторных реагентов, реагента для хроматографического анализа и в производстве лекарств, таких как антибиотики.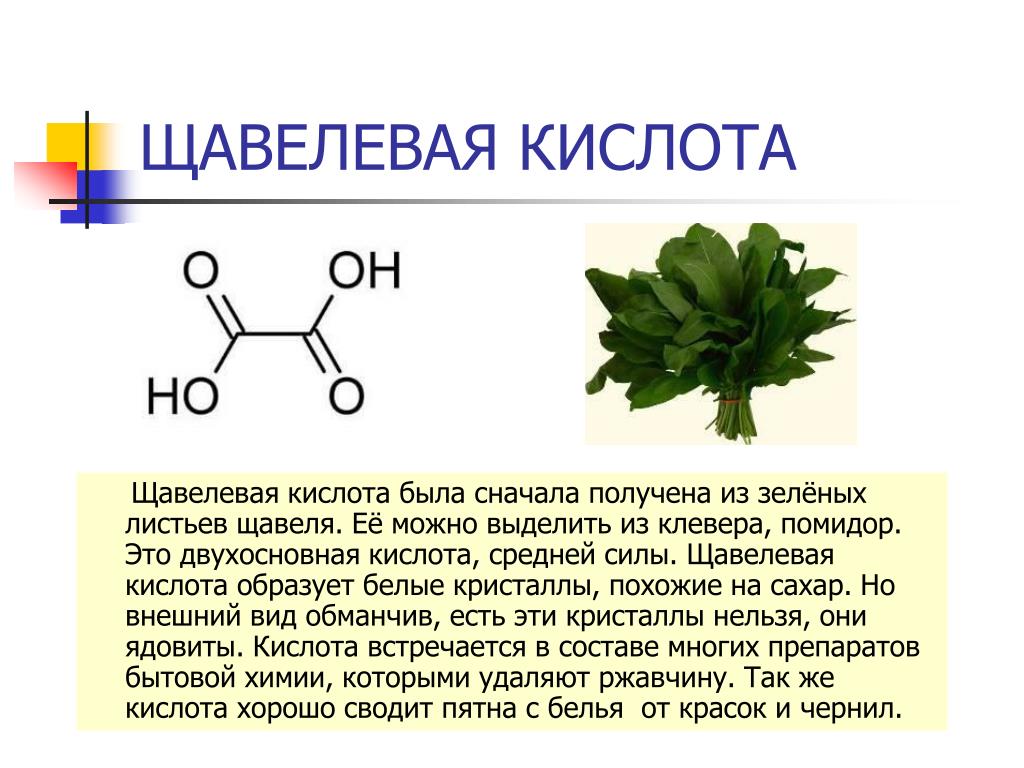

 [4]
[4] 
 Аскорбат мешает этому тесту, основанному на снижении мощности. По этой причине можно провести второй тест на сильные восстановители с использованием, например, йода. [ ссылка необходима ]
Аскорбат мешает этому тесту, основанному на снижении мощности. По этой причине можно провести второй тест на сильные восстановители с использованием, например, йода. [ ссылка необходима ]