Протеинкиназа — это… Что такое Протеинкиназа?
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путем фосфорилирования остатков аминокислот, имеющих гидроксильные группы (серин, треонин и тирозин, так и по гетероциклической аминогруппе гистидина).
Фосфорилирование, как правило, изменяет или модифицирует функции субстрата, при этом может изменяться ферментативная активность, положение белка в клетке, или взаимодействие с другими белками. Полагают, что до 30 % всех белков в клетках животных могут быть модифицированы протеинкиназами. В клетке протеинкиназы регулируют метаболические пути, а также пути сигнальной трансдукции и передачи сигналов внутри клетки.
Геном человека содержит около пятисот генов протеинкиназ, которые составляют около двух процентов всех генов.[1]
Химическая активность протеинкиназ заключается в отщеплении фосфатной группы от АТФ и ковалентном присоединении ее к остатку одной из трех аминокислот, которые имеют гидроксильные группы. Протеинкиназы оказывают значительный эффект на жизнедеятельность клетки и их активность тщательно регулируется фосфорилированием (в том числе и самофосфорилированием), связыванием с белками-активаторами или белками-ингибиторами и малыми молекулами.
Протеинкиназы регулируют клеточный цикл, рост и дифференцировку клеток, апоптоз. Нарушения работы протеинкиназ приводят к различным патологиям, в том числе, к возникновению некоторых видов рака.[2][3] Для лечения опухолей такой этиологии разрабатывают лекарства, ингибирующие специфические протеинкиназы.[4]
Протеинкиназы классифицируют по остаткам фосфорилируемых аминокислот. Выделяют протеинкиназы, специфичные к остаткам серина и треонина; тирозина; протеинкиназы двойной специфичности (фосфорилирующие остатки трех аминокислот).
Тирозиновые протеинкиназы
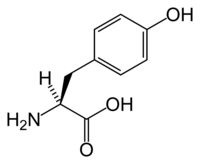
Тирозиновые протеинкиназы — ферменты, которые переносят фосфатную группу от АТФ на остаток аминокислоты тирозина в белке. [5] Большинство тирозиновых киназ имеют сопряженные тирозинфосфатазы. Тирозиновые киназы классифицируют на две группы: цитоплазматические и трансмембранные (связанные с рецептором).
Цитоплазматические протеинкиназы
Геном человека содержит 32 гена цитоплазматических тирозиновых протеинкиназ (КФ 2.7.10.2). Первым изученным геном тирозинкиназы, не связанной с рецептором, был ген из семейства Src, протоонкогенных тирозиновых киназ. Протеинкиназы этого семейства содержатся почти во всех клетках животных. Было показано, что вирус саркомы Рауса (англ.) (RSV) содержит мутантную копию нормального клеточного гена Src. Белки семейства Src регулируют многие процессы в клетке, участвуют в передаче интегрин-зависимых сигналов в клетку, которые побуждают ее деление.
Геном ретровирусов (в том числе и вируса саркомы Рауса) может содержать ген v-src (viral-sarcoma), который является онкогеном, он не содержит С-концевого участка, ингибирования фосфорилирования, и поэтому постоянно активен в клетке, чем отличается от c-src (клеточного гена), которые активируется только некоторыми внешними сигналами (например, факторами роста), и является протоонкогеном.
TCR (T-cell receptor, рецептор антигена Т-лимфоцитов), передает сигнал внутрь клетки путем активирования двух белков Lck и Fyn, относящихся к семейству Src. Этот сигнал приводит к пролиферации Т-лимфоцитов и усилению клеточного иммунитета.
Рецепторы, связанные с тирозинкиназами
Геном человека содержит 58 генов тирозиновых киназ,[6] связанных с рецепторами (КФ 2.7.10.1). Гормоны и факторы роста, которые взаимодействуют на поверхности клетки с рецепторами, связанными с тирозиновыми протеинкиназами, как правило, вызывают рост клеток и стимулируют клеточные деления (например, инсулин, инсулиноподобный фактор роста 1, эпидермальный фактор роста). Рецепторы, связанные с тирозиновыми протеинкиназами располагаются на поверхности клеток и связывают полипептидные факторы роста, цитокины и гормоны. Такие рецепторы не только регулируют клеточные процессы, но и играют критическую роль в развитии многих видов рака. [7]
Рецепторы с тирозинкиназной активностью по фосфорилируемому субстрату классифицируют на двадцать семейств (эпителиального фактора роста, инсулина, фактора роста тромбоцитов и другие). Инсулиновый рецептор является мультимерным комплексом, однако большинство рецепторов с тирозинкиназными активносятми имеют только одну субъединицу. Каждый мономер имеет один трансмембранный домен, состоящий из 25-38 аминокислотных остатков, внеклеточный N-концевой домен и внутриклеточный C-концевой домен. Внеклеточный домен очень крупный и отвечает за связывание лигандов (факторов роста или гормонов), внутриклеточный участок содержит домены с киназной активностью. Когда фактор роста или гормон соединяется с внеклеточным доменом рецептора тирозинкиназы, рецептор димеризуется и активирует соседние рецепторы. Димеризация рецепторов активирует цитоплазматические домены, которые осуществляют самофосфорилирование рецептора по многим аминокислотным остаткам.
Тирозиновые протеинкиназы принимают участие в передаче сигнала в клетке путем фосфорилирования специфических остатков тирозина белков-мишеней.[8] Специфические белки, содержащие Sh3-домены или домены связывания фосфотирозина (Src, фосфолипаза Сγ), соединяются с рецептором и фосфорилируются внутриклеточным доменом. Фосфорилирование приводит к активации белков и инициирует пути сигнальной трансдукции.[8] Активированные рецепторы могут взаимодействовать и с другими белками, не обладающими каталитическими активностями. Такие белки связывают рецепторы тирозиновых протеинкиназ со следующими этапами сигнальной трансдукции, например, с каскадом МАР-киназ.
Серин/треонин — специфичные протеинкиназы
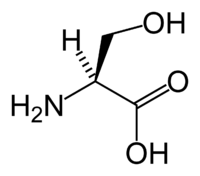
Аминокислота L-серин
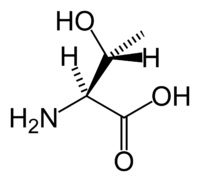
Аминокислота L-треонин
Серин-треониновые протеинкиназы (КФ 2.7.11.1) фосфоририруют гидроксильную группу в остатках серина или треонина.
Активность этих протеинкиназ регулируется несколькими событиями (например, повреждениями ДНК), а также некоторыми химическими сигналами, в том числе, cAMP, cGMP, диацилглицеролом, Ca2+кальмодулином.
Серин/треониновые протеинкиназы фосфорилируют остатки серина или треонина в консенсусных последовательностях, которые образуют фосфоакцепторный сайт. Эта последовательность остатков аминокислот в молекуле субстрата, позволяет осуществлять контакт каталитической щели протеинкиназы с фосфорилируемой областью. Эта особенность делает киназу специфичной не к какому-либо определенному субстрату, но к специфичному семейству белков с одинаковыми консенсусными последовательностями. В то время, как каталитические домены этих протеинкиназ высококонсервативны, последовательности узнавания отличаются, обуславливая узнавание разных субстратов.
Киназа фосфорилазы (КФ 2.7.11.19) была открыта Кребсом в 1959 году и является первым описанным ферментом семейства серин/треониновых протеинкиназ. Киназа фосфорилазы превращает неактивную гликогенфосфорилазу В в активную форму гликогенфосфорилазу A, последняя отщепляет от гликогена остатки глюкозо-1-фосфата. Киназа фосфорилазы активируется протеинкиназой А.
Протеинкиназа А
Протеинкиназа А, или цАМФ-зависимая протеинкиназа, (КФ 2.7.11.1) относится к семейству ферментов, активность которых зависит от уровня циклического АМФ (цАМФ) в клетке. Протеинкиназа А является самой изученной из всех протеинкиназ, ее функции разнообразны, она участвует в регуляции метаболизма гликогена, липидов и сахаров, ее субстратами могут быть другие протеинкиназы или другие метаболические ферменты.
Протеинкиназа А участвует в цАМФ-стимулируемой транскрипции генов, которые имеют цАМФ-реактивный элемент в регуляторном участке. Повышение концентрации цАМФ ведет к активации протеинкиназы А, которая фосфорилирует транскрипционный фактор CREB по остатку серина 133, CREB связывает своим фосфорилированным участком коактиватор транскрипции и стимулирует транскрипцию.
Молекула протеинкиназы А является холоферментом (то есть требует кофермент для работы) и в неактивном состоянии является тетрамером — состоит из двух регуляторных и двух каталитических субъединиц. Если уровень цАМФ в клетке низкий, холофермент остается интактным и каталитическая активность отсутствует. Когда концентрация цАМФ в клетке возрастает (если активируется аденилатциклаза , или ингибируются фосфодиэстеразы, расщепляющие цАМФ), цАМФ связывается с двумя сайтами связывания на регуляторных субъединицах, происходят конформационные изменения, диссоциация тетрамера на два каталитически активных димера (состоящих из одной каталитической и одной регуляторной субъединицы). Открытые активные центры каталитических субъединиц переносят концевой фосфат молекулы АТФ на остатки серина или треонина.
Протеинкиназы А представлены в многих типах клеток, и проявляют каталитические активности в отношении разных субстратов, поэтому, работа протеинкиназы А и концентрация цАМФ регулируется во многих биохимических путях. Следует отметить, что действие протеинкиназы А, вызванное фосфорилированием, как правило, кратковременное, так как протеинфосфатазы, сопряженные с протеинкиназами, быстро дефосфорилирует мишени.
Гормоны инсулин и глюкагон влияют на работу протеинкиназы А, изменяя уровень цАМФ в клетке по механизму активации (инсулин действует через тирозинкиназу), через аденилатциклазу. Инсулин активирует аденилатциклазу, повышая концентрацию цАМФ, протеинкиназа А фосфорилирует ферменты ацетил-КоА-карбоксилазу и пируватдегидрогеназу, направляя таким образом ацетил-КоА для синтеза липидов; глюкагон имеет противоположный эффект.
Работа протеинкиназы А регулируется и по механизму отрицательной обратной связи. Одним из субстратов, активируемых протеинкиназой А, является фосфодиэстераза, которая превращает цАМФ в АМФ, таким образом, снижая концентрацию цАМФ и ингибируя протеинкиназу А.
Протеинкиназа B (Akt)
Геном человека содержит семейство генов Akt1, Akt2, Akt3. Протеинкиназа Akt1 ингибирует процессы апоптоза, принимает участие в регуляции клеточного цикла, индуцирует синтез белка и поэтому является ключевым белком, регулирующим рост тканей, а также отвечает за развитие мышечной гипертрофии. Поскольку продукт гена Akt1 блокирует апоптоз, повышенный уровень экспрессии Akt1 отмечается во многих опухолях. Первоначально Akt1 был охарактеризован как онкоген в трансформирующем ретровирусе AKT8 в 1990 году.
Продукт гена Akt2 является важной сигнальной молекулой в пути передачи сигнала молекулой инсулина, этот белок требуется для транспорта глюкозы.
Показано, что Akt3
Мыши, нокаутные по гену Akt2, но имеющие Akt1, имели задержки роста и фенотипические проявления инсулин-зависимого диабета. Полученные данные указывали на роль Akt2 в проведении сигнала от инсулинового рецептора.[10]
Регуляция активности Akt осуществляется путем связывания фосфолипидов в мембране. Akt содержит PH-домен (Pleckstrin Homology domain, 120 остатков аминокислот), который высокоаффинно связывает фосфатидилинозитол-трифосфат (PIP3, ФИФ3) или фосфатидилинозитол-дифосфат (PIP2, ФИФ3). PH-домены выполняют функции заякоривания в мембранах. PIP2 может быть фосфорилирован только PIP3-киназами, и только в случае, когда клетка получила сигнал к росту. PIP3-киназы могут быть активированы или рецепторами с тирозинкиназной активностью (например, инсулиновым рецептором). Только после активации PIP3-киназы фосфорилируют PIP2 в PIP3.[11]
После связывания с PIP3 и закрепления в мембране Akt может быть активирована путем фосфорилирования фосфоинозитол-зависимыми киназами (PDK1 и PDK2, mTORC2). PDK1 фосфорилирует Akt, mTORC2 стимулирует фосфорилирование PDK1. Активированная Akt далее регулирует фосфорилированием активность многих субстратов. Показано, что Akt может быть активирована и без участия PIP3-киназ.
Соединения, повышающие концентрацию цАМФ могут активировать Akt через протеинкиназу А. Фосфатазы липидов контролируют концентрацию PIP3, например, супрессор опухолей PTEN (phosphatase and tensin homolog deleted on chromosome ten) работает как фосфатаза, и дефосфорилирует PIP3 в PIP2. Akt диссоциирует от плазматической мембраны и активность фермента значительно падает. Протеинфосфатазы контролируют количество фосфорилированного Akt. Фосфатазы PHLPP (PH domain and leucine rich repeat protein phosphatase) дефосфорилируют серин 473 в Akt и тем самым инактивируют ее.[12]
Akt регулирует многие процессы, направленные на выживание клетки. Например, Akt может фосфорилировать про-апоптотический белок BAD (из семейства Bcl-2) по остатку серина 136, что вызывает диссоциацию BAD из Bcl-2/Bcl-X комплекса и приводит к утере про-апоптотической функции. Также Akt активирует транскрипционный фактор NF-κB (nuclear factor-kappa B), и включает транскрипцию генов выживания.
Akt требуется для инсулин-индуцируемой транслокации транспортера глюкозы 4 (GLUT 4) в плазматическую мембрану. Киназа-3 гликогенсинтетазы (GSK 3) может быть ингибирована фосфорилированием Akt, что вызывает синтез гликогена.
Akt1 также связана с ростом сосудов и развитием опухолей. Недостаточность Akt1 у мышей ингибирует физиологический ангиогенез, но усиливает патологический рост сосудов и опухолей.[13]
Протеинкиназа С
Основная статья: Протеинкиназа С
Протеинкиназы С (PKC, КФ 2.7.11.13) — это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые классифицируют по вторичным посредникам на три семейства: традиционные, или классические (conventional), оригинальные (novel), или нестандартные и нетипичные (atypical). Традиционным протеинкиназам С для активации требуется Ca2+, диацилглицерол или фосфатидилхолин.
Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca2+. Традиционные и оригинальные протеинкиназы С активируются через сходные пути сигнальной трансдукции, например, с помощью фосфолипазы С. Нетипичные изоформы, не требуют ни Ca2+, ни диацилглицерола для активации.
Все протеинкиназы С состоят из регуляторного и каталитического доменов, связанных шарнирной областью. Каталитические районы высоко консервативны между разными изоформами, и значительно отличаются от каталитических районов других серин-треониновых протеинкиназ. Консервативность каталитических доменов связано с выполняемыми функциями, различия в регуляторных районах обуславливают различия во вторичных посредниках.
Регуляторный домен на N-конце протеинкиназы С содержит отдельные участки. С1 домен, представленный во всех изоформах протеинкиназы С, имеет сайт связывания диацилглицерола. С2 домен воспринимает ион Ca2+. Район псевдосвязывания субстрата представляет собой короткую последовательность аминокислот, которые подражают субстрату и занимают участок связывания субстрата в активном центре, делая фермент неактивным.
Ca2+ и диацилглицерол (DAG) связываются с доменами С2 и С1, соответственно, и вызывают прикрепление протеинкиназы С к плазматической мембране. Взаимодействие с мембраной вызывает освобождение псевдосубстрата из каталитического центра и активирует фермент. Для осуществления подобных аллостерических взаимодействий, протеинкиназе С требуется предварительное фосфорилирование каталитического района.
Протеинкиназа С должна быть предварительно фосфорилирована и для осуществления собственной киназной активности. Молекула протеинкиназы С содержит несколько сайтов фосфорилирования 3-фосфоинозитол-зависимой протеинкиназой-1 (PDK 1). После активации протеинкиназа С переносится к плазматической мембране и присоединяются к RACK-белкам (Receptor for Activated C-Kinase), аминокислотная последовательность которых на 47 % гомологична бета-субъединицам G-белков.
Для протеинкиназ С характерен длительный период активности, которая сохраняется, даже если первоначальный сигнал пропал или снизилась концентрация ионов Ca2+. Это достигается образованием диацилглицерола из фосфатидилхолина с помощью фосфолипазы С.
Последовательность остатков аминокислот в молекуле протеинкиназы С сходна с таковой для протеинкиназы А, и содержит остатки основных аминокислот вблизи остатков серина и треонина, подвергающихся фосфорилированию. Субстратами протеинкиназы С являются следующие белки: MAP-киназы, Raf-киназы, MARCKS (myristoylated alanine-rich C-kinase substrate, производные миристоленовой кислоты, богатые аланином, субстраты протеинкиназы С). Белки-субстраты протеинкиназы С играют важную роль в поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла. MARCKS вовлечены в процессы экзоцитоза некоторых секреторных пузырьков, содержащих, муцин и хромафин. MARCKS — кислые белки, содержат большое количество остатков аланина, глицина, пролина и глутаминовой кислоты. MARCKS связаны N-концом с липидами мембраны (через миристоленовую кислоту), регулируются ионами Ca2+, кальмодулином, протеинкиназой С.
VDR (Vitamin D receptor) — кальцитриоловый рецептор. Рецептор стероидных гормонов из семейства ядерных рецепторов. После активирования молекулой витамина D, образует гетеродимер с ретиноидным-Х-рецептором и связывается с регуляторными элементами на ДНК, изменяя экспрессию генов или снимая репрессоры генов. Глюкокортикоиды снижают экспрессию VDR во всех тканях.
Рецептор эпидермального фактора роста (EGFR) — относится к семейству рецепторов факторов роста, связывающих внеклеточные белковые лиганды и обладает тирозинкиназными активностями. Мутации, затрагивающие EGRF часто могут проявляться в раковом перерождении клетки. После связывания лиганда, рецептор димеризуется, происходит самофосфорилирование по пяти остаткам тирозина на С-конце рецептора, и EGRF приобретает внутриклеточную тирозинкиназную активность.[14]
Последующая активность EGRF связана с инициацией каскада сигнальной трансдукции, активируются MAPK, Akt, JNK — что приводит к синтезу ДНК и пролиферации. Киназный домен также может фосфорилировать другие рецепторы, связанные с EGRF по остаткам тирозина.
Ca2+/кальмодулин — зависимые протеинкиназы
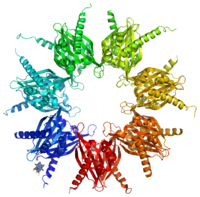
Ca2+/кальмодулин-зависимая киназа II
Са2+/кальмодулин — зависимые киназы, или СаМ киназы, (КФ 2.7.11.17) регулируются Са2+/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы (например, киназа легких цепей миозина, которая фосфорилирует молекулы миозина, вызывая мышечное сокращение) и многофункциональные СаМ киназы (играют роль во многих процессах, секреции нейромедиаторов, регуляции транскрипционных факторов, в метаболизме гликогена), порядка 2 % белков головного мозга представлены СаМ второго типа.[15]
Кальмодулин (СаМ) — это вездесущий, кальций-связывающий белок, который связывается с многими другими белками и регулирует их активность. Это маленький кислый белок, состоит из 148 аминокислотных остатков, содержит четыре домена связывания кальция.[16]
СаМ служит промежуточным звеном в воспалении, апоптозе, мышечных сокращениях, развитии кратковременной и длительной памяти, росте нервов и иммунном ответе. Кальмодулин экспрессируется во многих типах клеток и находится в цитоплазме, внутри органелл, а также находится в плазматической мембране и мембранах органелл.[17] Многие белки, которые связываются с кальмодулином, не могут сами связывать кальций и используют кальмодулин как «датчик» кальция и компонент системы передачи сигнала.
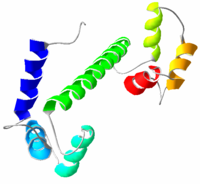
Кальмодулин
Кальмодулин также используется для запасания Ca2+ в эндоплазматическом и саркоплазматическом ретикулумах. После связывания кальция молекула кальмодулина претерпевает конформационные изменения, что позволяет молекуле связывать другие белки для осуществления специфического ответа. Молекула кальмодулина может связать до четырех ионов кальция, может подвергаться посттрансляционной модификации, например, фосфорилированию, ацетилированию, метилированию, протеолизу, причем эти модификации могут модулировать активность СаМ.
Киназа легких цепей миозина. Киназа легких цепей миозина (MLCK) фосфорилирует миозин. Киназа легких цепей миозина имеет ключевое значение в сокращении гладкой мускулатуры.[18] Сокращение гладких мышц может произойти после повышения концентрации кальция в результате притока из саркоплазматического ретикулюма или из внеклеточного пространства. Сперва кальций связывается с кальмодулином, это связывание активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи молекул миозина. Фосфорилирование позволяет молекулам миозина образовывать поперечные мостики и связываться с актиновыми филаментами и стимулирует мышечное сокращение. Данный путь является основным в механизме сокращения гладких мышц, так как гладкие мышцы не содержат тропонинового комплекса, в отличие от поперечно-полосатых.
МАРK (митоген-активируемые киназы)
Митоген-активируемые киназы (КФ 2.7.11.24) отвечают на внеклеточные стимулы (митогены) и регулируют многие клеточные процессы (экспрессию генов, деление, дифференцировку и апоптоз). МАРК вовлечены в работу многих неядерных белков — продуктов онкогенов. Внеклеточные стимулы ведут к активации МАРК через сигнальный каскад, который состоит из МАРК, МАРКК (МАР2К) и МАРККК (МАР3К). МАР3К активируется внеклеточными стимулами и фосфорилирует МАР2К, затем МАР2К фосфорилированием активирует МАРК. Такой сигнальный МАР-каскад консервативен для эукариот от дрожжей до млекопитающих.
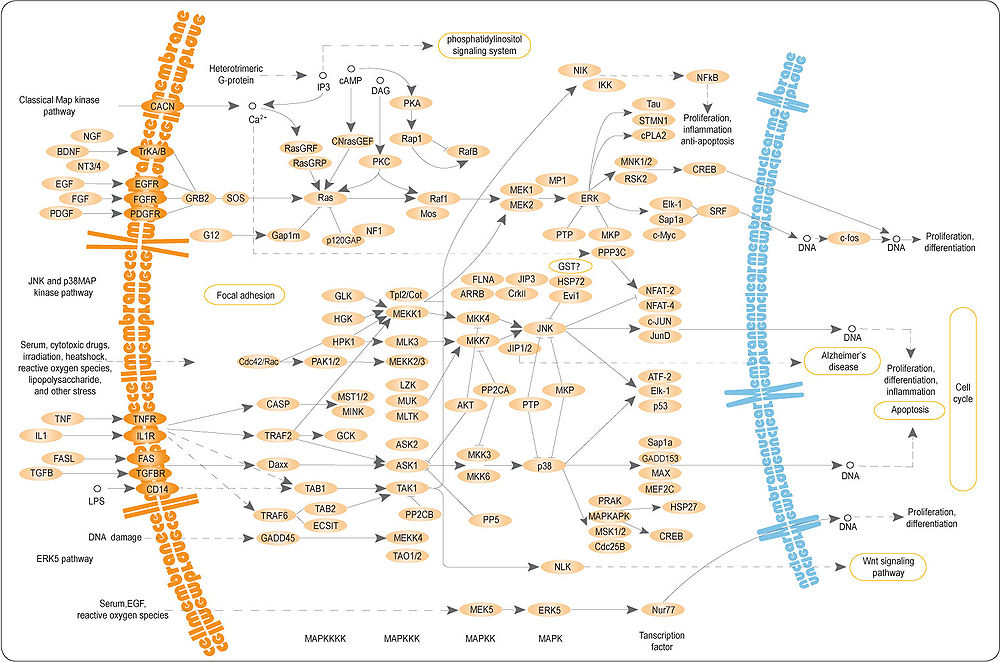
MAP/ERK система передачи сигнала
MAPK/ERK-киназы принимают участие в особом пути сигнальной трансдукции. ERK — или классические МАР-киназы, регулируются внеклеточными сигналами.[19]
Рецепторы, связанные с тирозиновыми киназами (например, EGFR), активируются внеклеточными лигандами. Связывание EGF с рецептором приводит к фосфорилированию EGFR. Белок GRB2, содержащий Sh3-домен, связывается с остатками фосфорилированного тирозина. Белок GRB2 своим Sh4-доменом связывается и активирует ГДФ от белка [20] Ras далее может связать ГТФ и активироваться.
Активный Ras активирует RAF-киназу (серин-треониновой специфичности). RAF-киназа фосфорилирует и активирует МЕК, другую серин-треониновую киназу. МЕК фосфорилирует и активирует МАРК. Эта серия киназ от RAF к МЕК и к МАРК является примером каскада протеинкиназ.[21]
Один из эффектов активации МАРК это изменение трансляции мРНК. МАРК фосфорилирует и активирует S6 киназу 40S рибосомных белков (RSK). RSK фосфорилирует рибосомный белок S6, и вызывает его диссоциацию от рибосомы.
МАРК регулирует активности нескольких транскрипционных факторов, например, C-myc. МАРК регулирует активность генов, контролирующих клеточный цикл.[19]
Гистидин — специфичные протеинкиназы
Гистидиновые киназы найдены в прокариотах и по своей структуре отличаются от других известных протеинкиназ. У прокариот гистидин-специфичные протеинкиназы работают как часть двухкомпонентной системы сигнальной трансдукции. В ходе фосфорилирования неорганический фосфат отщепляется от АТФ и присоединяется к собственному остатку гистидина, а затем переносится на остаток аспартата белка-мишени. Фосфорилирование аспартата приводит к дальнейшей передаче сигнала.
Гистидиновые киназы широко распространены среди прокариот, растений и грибов. Фермент пируватдегидрогеназа животных, относящийся к семейству протеинкиназ, структурно повторяет гистидиновые киназы, но фосфорилирует остатки серина, и, возможно, не использует гистидин-фосфатный интермедиат.
См. также
Примечания
- ↑ Stout TJ, Foster PG, Matthews DJ (2004). «High-throughput structural biology in drug discovery: protein kinases». Curr. Pharm. Des. 10 (10): 1069–82. PMID 15078142.
- ↑ http://cancerres.aacrjournals.org/cgi/content/full/66/16/8147 «Frequent Alterations in the Expression of Serine/Threonine Kinases in Human Cancers» Capra et al. Cancer Research. 2006
- ↑ http://cancerres.aacrjournals.org/cgi/content/abstract/65/8/3108 «The Serine/Threonine Protein Kinase, p90 Ribosomal S6 Kinase, Is an Important Regulator of Prostate Cancer Cell Proliferation» Cancer Research. 2005
- ↑ Zhao Y, Thomas HD, Batey MA, et al (May 2006). «Preclinical evaluation of a potent novel DNA-dependent protein kinase inhibitor NU7441». Cancer Res. 66 (10): 5354–62. DOI:10.1158/0008-5472.CAN-05-4275. PMID 16707462.
- ↑ Robert A. Weinberg The Biology Of Cancer. — New York: Garland Science, Taylor & Francis Group, LLC. — С. 757–759. — ISBN 0-8153-4076-1
- ↑ Robinson DR, Wu YM, Lin SF. (2000). «The protein tyrosine kinase family of the human genome». Oncogene 19 (49): 5548–5557. DOI:10.1038/sj.onc.1203957. PMID 11114734.
- ↑ Zwick, E. Bange, J. Ullrich, A. (2001). «Receptor tyrosine kinase signalling as a target for cancer intervention strategies». Endocr. Relat. Cancer 8 (3): 161–173. DOI:10.1677/erc.0.0080161. PMID 11566607.
- ↑ 1 2 Pawson, T. (1995). «Protein modules and signalling networks». Nature 373 (6515): 573–580. DOI:10.1038/373573a0. PMID 7531822.
- ↑ Easton RM, Cho H, Roovers K, Shineman DW, Mizrahi M, Forman MS, Lee VM, Szabolcs M, de Jong R, Oltersdorf T, Ludwig T, Efstratiadis A, Birnbaum MJ Role for Akt3/protein kinase Bgamma in attainment of normal brain size // Mol Cell Biol. — 2005. — Т. 25. — № 5. — С. 1869-78.
- ↑ McCurdy CE, Cartee GD Akt2 is essential for the full effect of calorie restriction on insulin-stimulated glucose uptake in skeletal muscle // Diabetes. — 2005. — Т. 54. — № 5. — С. 1349-56.
- ↑ Северин Е. С. Биохимия. — 5-ое. — Гэотар-Медиа, 2008. — 768 с. — ISBN 978-5-9704-0778-3
- ↑ Brognard J, Sierecki E, Gao T, Newton AC PHLPP and a second isoform, PHLPP2, differentially attenuate the amplitude of Akt signaling by regulating distinct Akt isoforms // Mol Cell. — 2007. — Т. 25. — № 6. — С. 917-31.
- ↑ Qiao M, Sheng S, Pardee AB Metastasis and AKT activation // Cell Cycle. — 2008. — Т. 7. — № 19. — С. 2991-6.
- ↑ Carpenter G. The EGF receptor: a nexus for trafficking and signaling. Bioessays. 2000 Aug;22(8):697-707. Review. PMID: 10918300
- ↑ Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (December 2002). «The protein kinase complement of the human genome». Science (journal) 298 (5600): 1912–34. DOI:10.1126/science.1075762. PMID 12471243.
- ↑ Chin D, Means AR (2000). «Calmodulin: a prototypical calcium sensor». Trends Cell Biol. 10 (8): 322–8. DOI:10.1016/S0962-8924(00)01800-6. PMID 10884684.
- ↑ Stevens FC (1983). «Calmodulin: an introduction». Can. J. Biochem. Cell Biol. 61 (8): 906–10. PMID 6313166.
- ↑ Gao Y, Ye LH, Kishi H, Okagaki T, Samizo K, Nakamura A, Kohama K (June 2001). «Myosin light chain kinase as a multifunctional regulatory protein of smooth muscle contraction». IUBMB Life 51 (6): 337–44. PMID 11758800.
- ↑ 1 2 Pearson G, Robinson F, Beers Gibson T, Xu BE, Karandikar M, Berman K, Cobb MH (2001). «Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions». Endocr. Rev. 22 (2): 153–83. DOI:10.1210/er.22.2.153. PMID 11294822.
- ↑ Bonni A, Brunet A, West AE, Datta SR, Takasu MA, Greenberg ME (1999). «Cell survival promoted by the Ras-MAPK signaling pathway by transcription-dependent and -independent mechanisms». Science 286 (5443): 1358–62. DOI:10.1126/science.286.5443.1358. PMID 10558990.
- ↑ Hazzalin CA, Mahadevan LC (2002). «MAPK-regulated transcription: a continuously variable gene switch?». Nat. Rev. Mol. Cell Biol. 3 (1): 30–40. DOI:10.1038/nrm715. PMID 11823796.
Литература
- Северин Е. С. Биохимия. — 5-ое. — Гэотар-Медиа, 2008. — 768 с. — ISBN 978-5-9704-0778-3
- Gomperts, Tatham, Kramer Signal transduction. — London: Elsevier Science, 2003. — 424 с. — ISBN 01-12-289631-9
- Gerhard Krauss Biochemistry of Signal Transduction and Regulation. — Second edition. — Germany: Wiley-VCH Verlag GmbH, 2001. — 495 с. — ISBN 3-527-30378-2
Ссылки
Wikimedia Foundation. 2010.
Протеинкиназы — это… Что такое Протеинкиназы?
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путем фосфорилирования остатков аминокислот, имеющих гидроксильные группы (серин, треонин и тирозин) или гетероциклической аминогруппы гистидина.
Фосфорилирование, как правило, изменяет или модифицирует функции субстрата, при этом может изменяться ферментативная активность, положение белка в клетке, или взаимодействие с другими белками. Полагают, что до 30 % всех белков в клетках животных могут быть модифицированы протеинкиназами. В клетке протеинкиназы регулируют метаболические пути, а также пути сигнальной трансдукции и передачи сигналов внутри клетки.
Геном человека содержит около пятисот генов протеинкиназ, которые составляют около двух процентов всех генов.[1]
Химическая активность протеинкиназ заключается в отщеплении фосфатной группы от АТФ и ковалентном присоединении её к остатку одной из трех аминокислот, которые имеют гидроксильные группы. Протеинкиназы оказывают значительный эффект на жизнедеятельность клетки и их активность тщательно регулируется фосфорилированием (в том числе и самофосфорилированием), связыванием с белками-активаторами или белками-ингибиторами и малыми молекулами.
Протеинкиназы регулируют клеточный цикл, рост и дифференцировку клеток, апоптоз. Нарушения работы протеинкиназ приводят к различным патологиям, в том числе, к возникновению некоторых видов рака.[2][3] Для лечения опухолей такой этиологии разрабатывают лекарства, ингибирующие специфические протеинкиназы.[4]
Протеинкиназы классифицируют по остаткам фосфорилируемых аминокислот. Выделяют протеинкиназы, специфичные к остаткам серина и треонина; тирозина; протеинкиназы двойной специфичности (фосфорилирующие остатки трех аминокислот).
Тирозиновые протеинкиназы
Тирозиновые протеинкиназы — ферменты, которые переносят фосфатную группу от АТФ на остаток аминокислоты тирозина в белке.[5] Большинство тирозиновых киназ имеют сопряженные тирозинфосфатазы. Тирозиновые киназы классифицируют на две группы: цитоплазматические и трансмембранные (связанные с рецептором).
Цитоплазматические протеинкиназы
Геном человека содержит 32 гена цитоплазматических тирозиновых протеинкиназ (КФ 2.7.10.2). Первым изученным геном тирозинкиназы, не связанной с рецептором, был ген из семейства Src, протоонкогенных тирозиновых киназ. Протеинкиназы этого семейства содержатся почти во всех клетках животных. Было показано, что вирус саркомы Рауса (англ.) (RSV) содержит мутантную копию нормального клеточного гена Src. Белки семейства Src регулируют многие процессы в клетке, участвуют в передаче интегрин-зависимых сигналов в клетку, которые побуждают её деление.
Геном ретровирусов (в том числе и вируса саркомы Рауса) может содержать ген v-src (viral-sarcoma), который является онкогеном, он не содержит С-концевого участка, ингибирования фосфорилирования, и поэтому постоянно активен в клетке, чем отличается от c-src (клеточного гена), которые активируется только некоторыми внешними сигналами (например, факторами роста), и является протоонкогеном.
TCR (T-cell receptor, рецептор антигена Т-лимфоцитов), передает сигнал внутрь клетки путем активирования двух белков Lck и Fyn, относящихся к семейству Src. Этот сигнал приводит к пролиферации Т-лимфоцитов и усилению клеточного иммунитета.
Рецепторы с тирозинкиназной активностью
Геном человека содержит 58 генов рецепторов-тирозинкиназ[6] (КФ 2.7.10.1). Гормоны и факторы роста, которые взаимодействуют на поверхности клетки с рецепторами, обладающими тирозинкиназной акитвностью, как правило, вызывают рост клеток и стимулируют клеточные деления (например, инсулин, инсулиноподобный фактор роста 1, эпидермальный фактор роста). Рецепторы с тирозинкиназной активностью располагаются на поверхности клеток и связывают полипептидные факторы роста, цитокины и гормоны. Такие рецепторы не только регулируют клеточные процессы, но и играют критическую роль в развитии многих видов рака.[7]
Рецепторы с тирозинкиназной активностью по фосфорилируемому субстрату делят на двадцать семейств (эпителиального фактора роста, инсулина, фактора роста тромбоцитов и другие). Инсулиновый рецептор является мультимерным комплексом, однако большинство рецепторов с тирозинкиназной активностью имеют только одну субъединицу. Каждый мономер имеет один трансмембранный домен, состоящий из 25-38 аминокислотных остатков, внеклеточный N-концевой домен и внутриклеточный C-концевой домен. Внеклеточный домен очень крупный и отвечает за связывание лигандов (факторов роста или гормонов), внутриклеточный участок содержит домены с киназной активностью. Когда фактор роста или гормон соединяется с внеклеточным доменом рецептора-тирозинкиназы, рецептор димеризуется. Димеризация рецепторов активирует цитоплазматические домены, которые осуществляют самофосфорилирование рецептора по многим аминокислотным остаткам.
Тирозиновые протеинкиназы принимают участие в передаче сигнала в клетке путем фосфорилирования специфических остатков тирозина белков-мишеней.[8] Специфические белки, содержащие Sh3-домены или домены связывания фосфотирозина (Src, фосфолипаза Сγ), соединяются с рецептором и фосфорилируются внутриклеточным доменом. Фосфорилирование приводит к активации белков и инициирует пути сигнальной трансдукции.[8] Активированные рецепторы могут взаимодействовать и с другими белками, не обладающими каталитическими активностями. Такие адапторные белки (scaffold proteins) связывают рецепторы-тирозинкиназы со следующими этапами сигнальной трансдукции, например, с каскадом МАР-киназ.
Серин/треонин — специфичные протеинкиназы
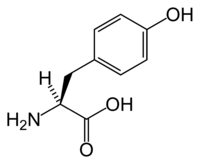
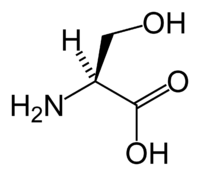 Аминокислота L-серин
Аминокислота L-серин 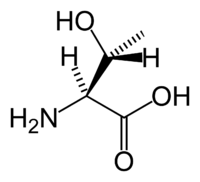 Аминокислота L-треонин
Аминокислота L-треонинСерин-треониновые протеинкиназы (КФ 2.7.11.1) фосфоририруют гидроксильную группу в остатках серина или треонина.
Активность этих протеинкиназ регулируется несколькими событиями (например, повреждениями ДНК), а также некоторыми химическими сигналами, в том числе, cAMP, cGMP, диацилглицеролом, Ca2+кальмодулином.
Серин/треониновые протеинкиназы фосфорилируют остатки серина или треонина в консенсусных последовательностях, которые образуют фосфоакцепторный сайт. Эта последовательность остатков аминокислот в молекуле субстрата, позволяет осуществлять контакт каталитической щели протеинкиназы с фосфорилируемой областью. Эта особенность делает киназу специфичной не к какому-либо определенному субстрату, но к специфичному семейству белков с одинаковыми консенсусными последовательностями. В то время, как каталитические домены этих протеинкиназ высококонсервативны, последовательности узнавания отличаются, обуславливая узнавание разных субстратов.
Киназа фосфорилазы (КФ 2.7.11.19) была открыта Кребсом в 1959 году и является первым описанным ферментом семейства серин/треониновых протеинкиназ. Киназа фосфорилазы превращает неактивную гликогенфосфорилазу В в активную форму гликогенфосфорилазу A, последняя отщепляет от гликогена остатки глюкозо-1-фосфата. Киназа фосфорилазы активируется протеинкиназой А.
Протеинкиназа А
Протеинкиназа А, или цАМФ-зависимая протеинкиназа, (КФ 2.7.11.1) относится к семейству ферментов, активность которых зависит от уровня циклического АМФ (цАМФ) в клетке. Протеинкиназа А является самой изученной из всех протеинкиназ, её функции разнообразны, она участвует в регуляции метаболизма гликогена, липидов и сахаров, её субстратами могут быть другие протеинкиназы или другие метаболические ферменты. Её следует отличать от АМФ-зависимой протеинкиназы, или АМФК, которая играет важную роль в поддержании энергетического баланса клетки и активируется посредством АМФ, а не цАМФ.
Протеинкиназа А участвует в цАМФ-стимулируемой транскрипции генов, которые имеют цАМФ-реактивный элемент в регуляторном участке. Повышение концентрации цАМФ ведет к активации протеинкиназы А, которая фосфорилирует транскрипционный фактор CREB по остатку серина 133, CREB связывает своим фосфорилированным участком коактиватор транскрипции и стимулирует транскрипцию.
Молекула протеинкиназы А является холоферментом (то есть требует кофермент для работы) и в неактивном состоянии является тетрамером — состоит из двух регуляторных и двух каталитических субъединиц. Если уровень цАМФ в клетке низкий, холофермент остается интактным и каталитическая активность отсутствует. Когда концентрация цАМФ в клетке возрастает (если активируется аденилатциклаза рецепторами, связанными с G-белками, или ингибируются фосфодиэстеразы, расщепляющие цАМФ), цАМФ связывается с двумя сайтами связывания на регуляторных субъединицах, происходят конформационные изменения, диссоциация тетрамера на два каталитически активных димера (состоящих из одной каталитической и одной регуляторной субъединицы). Открытые активные центры каталитических субъединиц переносят концевой фосфат молекулы АТФ на остатки серина или треонина.
Протеинкиназы А представлены в многих типах клеток, и проявляют каталитические активности в отношении разных субстратов, поэтому, работа протеинкиназы А и концентрация цАМФ регулируется во многих биохимических путях. Следует отметить, что действие протеинкиназы А, вызванное фосфорилированием, как правило, кратковременное, так как протеинфосфатазы, сопряженные с протеинкиназами, быстро дефосфорилирует мишени.
Гормоны инсулин и глюкагон влияют на работу протеинкиназы А, изменяя уровень цАМФ в клетке по механизму активации рецепторов, связанных с G-белками (инсулин действует через тирозинкиназу), через аденилатциклазу. Инсулин активирует аденилатциклазу, повышая концентрацию цАМФ, протеинкиназа А фосфорилирует ферменты ацетил-КоА-карбоксилазу и пируватдегидрогеназу, направляя таким образом ацетил-КоА для синтеза липидов; глюкагон имеет противоположный эффект.
Работа протеинкиназы А регулируется и по механизму отрицательной обратной связи. Одним из субстратов, активируемых протеинкиназой А, является фосфодиэстераза, которая превращает цАМФ в АМФ, таким образом, снижая концентрацию цАМФ и ингибируя протеинкиназу А.
Протеинкиназа B (Akt)
Геном человека содержит семейство генов Akt1, Akt2, Akt3. Протеинкиназа Akt1 ингибирует процессы апоптоза, принимает участие в регуляции клеточного цикла, индуцирует синтез белка и поэтому является ключевым белком, регулирующим рост тканей, а также отвечает за развитие мышечной гипертрофии. Поскольку продукт гена Akt1 блокирует апоптоз, повышенный уровень экспрессии Akt1 отмечается во многих опухолях. Первоначально Akt1 был охарактеризован как онкоген в трансформирующем ретровирусе AKT8 в 1990 году.
Продукт гена Akt2 является важной сигнальной молекулой в пути передачи сигнала молекулой инсулина, этот белок требуется для транспорта глюкозы.
Показано, что Akt3 преимущественно экспрессируется в мозге. Мыши, лишенные гена Akt3, имеют маленький мозг. Мыши, нокаутные по гену Akt1, но имеющие ген Akt2 имели меньший размер. Так как уровень глюкозы у таких мышей был в норме, была показана роль Akt1 в процессах роста.[9]
Мыши, нокаутные по гену Akt2, но имеющие Akt1, имели задержки роста и фенотипические проявления инсулин-зависимого диабета. Полученные данные указывали на роль Akt2 в проведении сигнала от инсулинового рецептора.[10]
Регуляция активности Akt осуществляется путем связывания фосфолипидов в мембране. Akt содержит PH-домен (Pleckstrin Homology domain, 120 остатков аминокислот), который высокоаффинно связывает фосфатидилинозитол-трифосфат (PIP3, ФИФ3) или фосфатидилинозитол-дифосфат (PIP2, ФИФ3). PH-домены выполняют функции заякоривания в мембранах. PIP2 может быть фосфорилирован только PIP3-киназами, и только в случае, когда клетка получила сигнал к росту. PIP3-киназы могут быть активированы рецепторами, связанными с G-белками или рецепторами с тирозинкиназной активностью (например, инсулиновым рецептором). Только после активации PIP3-киназы фосфорилируют PIP2 в PIP3.[11]
После связывания с PIP3 и закрепления в мембране Akt может быть активирована путем фосфорилирования фосфоинозитол-зависимыми киназами (PDK1 и PDK2, mTORC2). PDK1 фосфорилирует Akt, mTORC2 стимулирует фосфорилирование PDK1. Активированная Akt далее регулирует фосфорилированием активность многих субстратов. Показано, что Akt может быть активирована и без участия PIP3-киназ.
Соединения, повышающие концентрацию цАМФ могут активировать Akt через протеинкиназу А. Фосфатазы липидов контролируют концентрацию PIP3, например, супрессор опухолей PTEN (phosphatase and tensin homolog deleted on chromosome ten) работает как фосфатаза, и дефосфорилирует PIP3 в PIP2. Akt диссоциирует от плазматической мембраны и активность фермента значительно падает. Протеинфосфатазы контролируют количество фосфорилированного Akt. Фосфатазы PHLPP (PH domain and leucine rich repeat protein phosphatase) дефосфорилируют серин 473 в Akt и тем самым инактивируют её.[12]
Akt регулирует многие процессы, направленные на выживание клетки. Например, Akt может фосфорилировать про-апоптотический белок BAD (из семейства Bcl-2) по остатку серина 136, что вызывает диссоциацию BAD из Bcl-2/Bcl-X комплекса и приводит к утере про-апоптотической функции. Также Akt активирует транскрипционный фактор NF-κB (nuclear factor-kappa B), и включает транскрипцию генов выживания.
Akt требуется для инсулин-индуцируемой транслокации транспортера глюкозы 4 (GLUT 4) в плазматическую мембрану. Киназа-3 гликогенсинтетазы (GSK 3) может быть ингибирована фосфорилированием Akt, что вызывает синтез гликогена.
Akt1 также связана с ростом сосудов и развитием опухолей. Недостаточность Akt1 у мышей ингибирует физиологический ангиогенез, но усиливает патологический рост сосудов и опухолей.[13]
Протеинкиназа С
Основная статья: Протеинкиназа С
Протеинкиназы С (PKC, КФ 2.7.11.13) — это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые классифицируют по вторичным посредникам на три семейства: традиционные, или классические (conventional), оригинальные (novel), или нестандартные и нетипичные (atypical). Традиционным протеинкиназам С для активации требуется Ca2+, диацилглицерол или фосфатидилхолин.
Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca2+. Традиционные и оригинальные протеинкиназы С активируются через сходные пути сигнальной трансдукции, например, с помощью фосфолипазы С. Нетипичные изоформы, не требуют ни Ca2+, ни диацилглицерола для активации.
Все протеинкиназы С состоят из регуляторного и каталитического доменов, связанных шарнирной областью. Каталитические районы высоко консервативны между разными изоформами, и значительно отличаются от каталитических районов других серин-треониновых протеинкиназ. Консервативность каталитических доменов связано с выполняемыми функциями, различия в регуляторных районах обуславливают различия во вторичных посредниках.
Регуляторный домен на N-конце протеинкиназы С содержит отдельные участки. С1 домен, представленный во всех изоформах протеинкиназы С, имеет сайт связывания диацилглицерола. С2 домен воспринимает ион Ca2+. Район псевдосвязывания субстрата представляет собой короткую последовательность аминокислот, которые подражают субстрату и занимают участок связывания субстрата в активном центре, делая фермент неактивным.
Ca2+ и диацилглицерол (DAG) связываются с доменами С2 и С1, соответственно, и вызывают прикрепление протеинкиназы С к плазматической мембране. Взаимодействие с мембраной вызывает освобождение псевдосубстрата из каталитического центра и активирует фермент. Для осуществления подобных аллостерических взаимодействий, протеинкиназе С требуется предварительное фосфорилирование каталитического района.
Протеинкиназа С должна быть предварительно фосфорилирована и для осуществления собственной киназной активности. Молекула протеинкиназы С содержит несколько сайтов фосфорилирования 3-фосфоинозитол-зависимой протеинкиназой-1 (PDK 1). После активации протеинкиназа С переносится к плазматической мембране и присоединяются к RACK-белкам (Receptor for Activated C-Kinase), аминокислотная последовательность которых на 47 % гомологична бета-субъединицам G-белков.
Для протеинкиназ С характерен длительный период активности, которая сохраняется, даже если первоначальный сигнал пропал или снизилась концентрация ионов Ca2+. Это достигается образованием диацилглицерола из фосфатидилхолина с помощью фосфолипазы С.
Последовательность остатков аминокислот в молекуле протеинкиназы С сходна с таковой для протеинкиназы А, и содержит остатки основных аминокислот вблизи остатков серина и треонина, подвергающихся фосфорилированию. Субстратами протеинкиназы С являются следующие белки: MAP-киназы, Raf-киназы, MARCKS (myristoylated alanine-rich C-kinase substrate, производные миристоленовой кислоты, богатые аланином, субстраты протеинкиназы С). Белки-субстраты протеинкиназы С играют важную роль в поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла. MARCKS вовлечены в процессы экзоцитоза некоторых секреторных пузырьков, содержащих, муцин и хромафин. MARCKS — кислые белки, содержат большое количество остатков аланина, глицина, пролина и глутаминовой кислоты. MARCKS связаны N-концом с липидами мембраны (через миристоленовую кислоту), регулируются ионами Ca2+, кальмодулином, протеинкиназой С.
VDR (Vitamin D receptor) — кальцитриоловый рецептор. Рецептор стероидных гормонов из семейства ядерных рецепторов. После активирования молекулой витамина D, образует гетеродимер с ретиноидным-Х-рецептором и связывается с регуляторными элементами на ДНК, изменяя экспрессию генов или снимая репрессоры генов. Глюкокортикоиды снижают экспрессию VDR во всех тканях.
Рецептор эпидермального фактора роста (EGFR) — относится к семейству рецепторов факторов роста, связывающих внеклеточные белковые лиганды и обладает тирозинкиназными активностями. Мутации, затрагивающие EGRF часто могут проявляться в раковом перерождении клетки. После связывания лиганда, рецептор димеризуется, происходит самофосфорилирование по пяти остаткам тирозина на С-конце рецептора, и EGRF приобретает внутриклеточную тирозинкиназную активность.[14]
Последующая активность EGRF связана с инициацией каскада сигнальной трансдукции, активируются MAPK, Akt, JNK — что приводит к синтезу ДНК и пролиферации. Киназный домен также может фосфорилировать другие рецепторы, связанные с EGRF по остаткам тирозина.
Ca2+/кальмодулин — зависимые протеинкиназы
 Ca2+/кальмодулин-зависимая киназа II
Ca2+/кальмодулин-зависимая киназа IIСа2+/кальмодулин-зависимые киназы, или СаМ киназы, (КФ 2.7.11.17) регулируются Са2+/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы (например, киназа легких цепей миозина, которая фосфорилирует молекулы миозина, вызывая мышечное сокращение) и многофункциональные СаМ киназы (играют роль во многих процессах: секреции нейромедиаторов, регуляции транскрипционных факторов, в метаболизме гликогена), порядка 2 % белков головного мозга представлены СаМ второго типа.[15]
Кальмодулин (СаМ) — это вездесущий, кальций-связывающий белок, который связывается с многими другими белками и регулирует их активность. Это маленький кислый белок, состоит из 148 аминокислотных остатков, содержит четыре домена связывания кальция.[16]
СаМ служит промежуточным звеном в воспалении, апоптозе, мышечных сокращениях, развитии кратковременной и длительной памяти, росте нервов и иммунном ответе. Кальмодулин экспрессируется во многих типах клеток и находится в цитоплазме, внутри органелл, а также находится в плазматической мембране и мембранах органелл.[17] Многие белки, которые связываются с кальмодулином, не могут сами связывать кальций и используют кальмодулин как «датчик» кальция и компонент системы передачи сигнала.
 Кальмодулин
КальмодулинКальмодулин также используется для запасания Ca2+ в эндоплазматическом и саркоплазматическом ретикулумах. После связывания кальция молекула кальмодулина претерпевает конформационные изменения, что позволяет молекуле связывать другие белки для осуществления специфического ответа. Молекула кальмодулина может связать до четырёх ионов кальция, может подвергаться посттрансляционной модификации, например, фосфорилированию, ацетилированию, метилированию, протеолизу, причем эти модификации могут модулировать активность СаМ.
Киназа легких цепей миозина. Киназа легких цепей миозина (MLCK) фосфорилирует миозин. Киназа легких цепей миозина имеет ключевое значение в сокращении гладкой мускулатуры.[18] Сокращение гладких мышц может произойти после повышения концентрации кальция в результате притока из саркоплазматического ретикулюма или из внеклеточного пространства. Сперва кальций связывается с кальмодулином, это связывание активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи молекул миозина. Фосфорилирование позволяет молекулам миозина образовывать поперечные мостики и связываться с актиновыми филаментами и стимулирует мышечное сокращение. Данный путь является основным в механизме сокращения гладких мышц, так как гладкие мышцы не содержат тропонинового комплекса, в отличие от поперечно-полосатых.
МАРK (митоген-активируемые киназы)
Митоген-активируемые киназы (КФ 2.7.11.24) отвечают на внеклеточные стимулы (митогены) и регулируют многие клеточные процессы (экспрессию генов, деление, дифференцировку и апоптоз). МАРК вовлечены в работу многих неядерных белков — продуктов онкогенов. Внеклеточные стимулы ведут к активации МАРК через сигнальный каскад, который состоит из МАРК, МАРКК (МАР2К) и МАРККК (МАР3К). МАР3К активируется внеклеточными стимулами и фосфорилирует МАР2К, затем МАР2К фосфорилированием активирует МАРК. Такой сигнальный МАР-каскад консервативен для эукариот от дрожжей до млекопитающих.
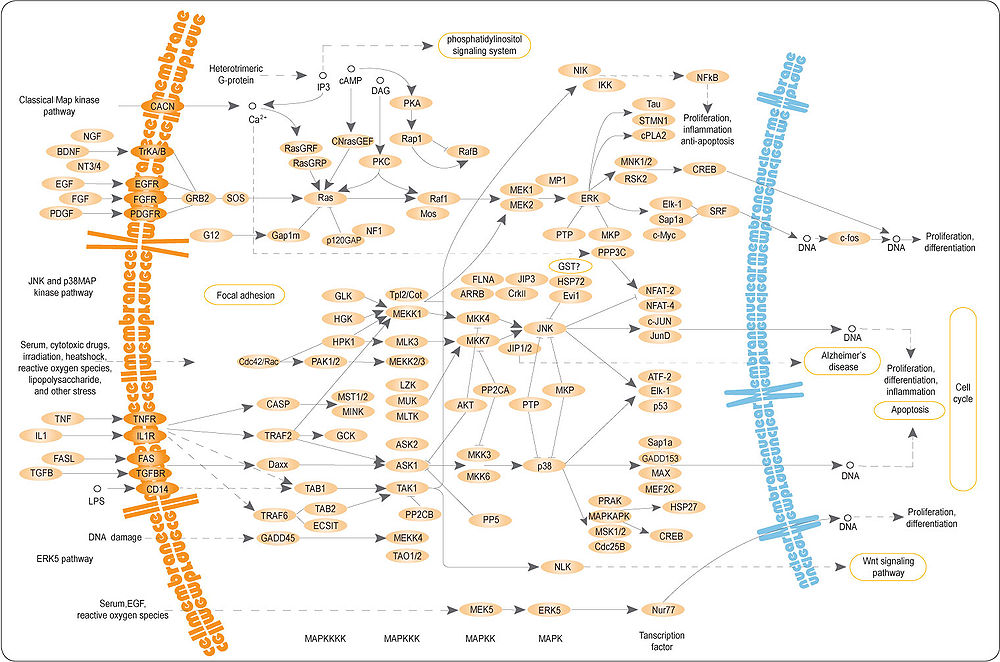
MAP/ERK система передачи сигнала
MAPK/ERK-киназы принимают участие в особом пути сигнальной трансдукции. ERK — или классические МАР-киназы, регулируются внеклеточными сигналами.[19]
Рецепторы, связанные с тирозиновыми киназами (например, EGFR), активируются внеклеточными лигандами. Связывание EGF с рецептором приводит к фосфорилированию EGFR. Белок GRB2, содержащий Sh3-домен, связывается с остатками фосфорилированного тирозина. Белок GRB2 своим Sh4-доменом связывается и активирует SOS (гуанин-нуклеотид заменяющим фактором). Активированный гуанин-нуклеотид заменяющий фактор отщепляет ГДФ от белка Ras,[20] Ras далее может связать ГТФ и активироваться.
Активный Ras активирует RAF-киназу (серин-треониновой специфичности). RAF-киназа фосфорилирует и активирует МЕК, другую серин-треониновую киназу. МЕК фосфорилирует и активирует МАРК. Эта серия киназ от RAF к МЕК и к МАРК является примером каскада протеинкиназ.[21]
Один из эффектов активации МАРК это изменение трансляции мРНК. МАРК фосфорилирует и активирует S6 киназу 40S рибосомных белков (RSK). RSK фосфорилирует рибосомный белок S6, и вызывает его диссоциацию от рибосомы.
МАРК регулирует активности нескольких транскрипционных факторов, например, C-myc. МАРК регулирует активность генов, контролирующих клеточный цикл.[19]
Гистидин — специфичные протеинкиназы
Гистидиновые киназы найдены в прокариотах и по своей структуре отличаются от других известных протеинкиназ. У прокариот гистидин-специфичные протеинкиназы работают как часть двухкомпонентной системы сигнальной трансдукции. В ходе фосфорилирования неорганический фосфат отщепляется от АТФ и присоединяется к собственному остатку гистидина, а затем переносится на остаток аспартата белка-мишени. Фосфорилирование аспартата приводит к дальнейшей передаче сигнала.
Гистидиновые киназы широко распространены среди прокариот, растений и грибов. Фермент пируватдегидрогеназа животных, относящийся к семейству протеинкиназ, структурно повторяет гистидиновые киназы, но фосфорилирует остатки серина, и, возможно, не использует гистидин-фосфатный интермедиат.
См. также
Примечания
- ↑ Stout TJ, Foster PG, Matthews DJ (2004). «High-throughput structural biology in drug discovery: protein kinases». Curr. Pharm. Des. 10 (10): 1069–82. PMID 15078142.
- ↑ http://cancerres.aacrjournals.org/cgi/content/full/66/16/8147 «Frequent Alterations in the Expression of Serine/Threonine Kinases in Human Cancers» Capra et al. Cancer Research. 2006
- ↑ http://cancerres.aacrjournals.org/cgi/content/abstract/65/8/3108 «The Serine/Threonine Protein Kinase, p90 Ribosomal S6 Kinase, Is an Important Regulator of Prostate Cancer Cell Proliferation» Cancer Research. 2005
- ↑ Zhao Y, Thomas HD, Batey MA, et al (May 2006). «Preclinical evaluation of a potent novel DNA-dependent protein kinase inhibitor NU7441». Cancer Res. 66 (10): 5354–62. DOI:10.1158/0008-5472.CAN-05-4275. PMID 16707462.
- ↑ Weinberg Robert A. The Biology Of Cancer. — New York: Garland Science, Taylor & Francis Group, LLC. — P. 757–759. — ISBN 0-8153-4076-1
- ↑ Robinson DR, Wu YM, Lin SF. (2000). «The protein tyrosine kinase family of the human genome». Oncogene 19 (49): 5548–5557. DOI:10.1038/sj.onc.1203957. PMID 11114734.
- ↑ Zwick, E. Bange, J. Ullrich, A. (2001). «Receptor tyrosine kinase signalling as a target for cancer intervention strategies». Endocr. Relat. Cancer 8 (3): 161–173. DOI:10.1677/erc.0.0080161. PMID 11566607.
- ↑ 1 2 Pawson, T. (1995). «Protein modules and signalling networks». Nature 373 (6515): 573–580. DOI:10.1038/373573a0. PMID 7531822.
- ↑ Easton RM, Cho H, Roovers K, Shineman DW, Mizrahi M, Forman MS, Lee VM, Szabolcs M, de Jong R, Oltersdorf T, Ludwig T, Efstratiadis A, Birnbaum MJ Role for Akt3/protein kinase Bgamma in attainment of normal brain size // Mol Cell Biol. — 2005. — Т. 25. — № 5. — С. 1869-78.
- ↑ McCurdy CE, Cartee GD Akt2 is essential for the full effect of calorie restriction on insulin-stimulated glucose uptake in skeletal muscle // Diabetes. — 2005. — Т. 54. — № 5. — С. 1349-56.
- ↑ Северин Е. С. Биохимия. — 5-е. — Гэотар-Медиа, 2008. — 768 с. — ISBN 978-5-9704-0778-3
- ↑ Brognard J, Sierecki E, Gao T, Newton AC PHLPP and a second isoform, PHLPP2, differentially attenuate the amplitude of Akt signaling by regulating distinct Akt isoforms // Mol Cell. — 2007. — Т. 25. — № 6. — С. 917-31.
- ↑ Qiao M, Sheng S, Pardee AB Metastasis and AKT activation // Cell Cycle. — 2008. — Т. 7. — № 19. — С. 2991-6.
- ↑ Carpenter G. The EGF receptor: a nexus for trafficking and signaling. Bioessays. 2000 Aug;22(8):697-707. Review. PMID: 10918300
- ↑ Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (December 2002). «The protein kinase complement of the human genome». Science (journal) 298 (5600): 1912–34. DOI:10.1126/science.1075762. PMID 12471243.
- ↑ Chin D, Means AR (2000). «Calmodulin: a prototypical calcium sensor». Trends Cell Biol. 10 (8): 322–8. DOI:10.1016/S0962-8924(00)01800-6. PMID 10884684.
- ↑ Stevens FC (1983). «Calmodulin: an introduction». Can. J. Biochem. Cell Biol. 61 (8): 906–10. PMID 6313166.
- ↑ Gao Y, Ye LH, Kishi H, Okagaki T, Samizo K, Nakamura A, Kohama K (June 2001). «Myosin light chain kinase as a multifunctional regulatory protein of smooth muscle contraction». IUBMB Life 51 (6): 337–44. PMID 11758800.
- ↑ 1 2 Pearson G, Robinson F, Beers Gibson T, Xu BE, Karandikar M, Berman K, Cobb MH (2001). «Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions». Endocr. Rev. 22 (2): 153–83. DOI:10.1210/er.22.2.153. PMID 11294822.
- ↑ Bonni A, Brunet A, West AE, Datta SR, Takasu MA, Greenberg ME (1999). «Cell survival promoted by the Ras-MAPK signaling pathway by transcription-dependent and -independent mechanisms». Science 286 (5443): 1358–62. DOI:10.1126/science.286.5443.1358. PMID 10558990.
- ↑ Hazzalin CA, Mahadevan LC (2002). «MAPK-regulated transcription: a continuously variable gene switch?». Nat. Rev. Mol. Cell Biol. 3 (1): 30–40. DOI:10.1038/nrm715. PMID 11823796.
Литература
- Северин Е. С. Биохимия. — 5-е. — Гэотар-Медиа, 2008. — 768 с. — ISBN 978-5-9704-0778-3
- Gomperts, Tatham, Kramer Signal transduction. — London: Elsevier Science, 2003. — 424 с. — ISBN 01-12-289631-9
- Gerhard Krauss Biochemistry of Signal Transduction and Regulation. — Second edition. — Germany: Wiley-VCH Verlag GmbH, 2001. — 495 с. — ISBN 3-527-30378-2
Ссылки
Свойства треонина в организме. Аминокислота, необходимая для производства коллагена

Скорее всего, вы не много слышали о треонине, но эта аминокислота участвует в ряде биологических процессов. Наиболее известные свойства треонина в организме — формировании основы соединительных тканей, таких как коллаген и эластин.
Она также помогает регулировать пищеварение, настроение и рост мышц.
Незаменимые аминокислоты такие как треонин, являются строительными блоками белков. Они играют жизненно важную роль в структуре наших костей, мышц и кожи.
Когда мы не употребляем достаточно продуктов с высоким содержанием этих важных соединений, мы можем испытывать симптомы дефицита. Это изменения настроения, раздражительность, спутанность сознания и проблемы с пищеварением.
Это одна из причин, по которой необходимо придерживаться сбалансированной диеты, включающей в себя ряд продуктов с высоким содержание белков. Эти продукты гарантируют получение достаточного количества незаменимых аминокислот.
Что такое треонин?
Треонин является незаменимой аминокислотой, которая играет важную роль в регулировании баланса белка в организме. Поскольку она считается «незаменимой аминокислотой», это означает, что организм не синтезирует аминокислоту. Поэтому для ее получения нам необходимо есть продукты с высоким содержанием треонина.
Аббревиатура треонина — Thr, а однобуквенный код — T. Правильное произношение треонина — «три-ух-необходимость».
Формула треонина — C4H9NO3, и он содержит — аминогруппу, карбоксильную группу и боковую цепь, содержащую гидроксильную группу. Это делает структуру треонина полярной незаряженной аминокислотой.
Аминокислота встречается в природе в L-форме, L-треонине. Это сопряженное основание L-треониния и сопряженная кислота L-треонината.
Вот некоторые общие вопросы о структуре аминокислоты треонина:
- Сколько стереоизомеров имеет треонин? Thr имеет четыре возможных стереоизомера: (2S, 3R), (2R, 3S), (2S, 3S) и (2R, 3R).
- Треонин положительно заряжен? Считается, что аминокислота T обладает полярными свойствами.
- Является ли треонин кислотным или основным? Thr считается полярным. Тогда как аминокислоты лизин и аргинин считаются основными и заряженными, а аспартат и глутамат являются кислыми и заряженными отрицательно.
- Что такое кодон треонина? Возможные треониновые кодоны включают ACA, ACC, ACG и ACT.
Аминокислота Т является предшественником серина и глицина, двух других аминокислот, необходимых для нормального функционирования организма.
Глицин является условно незаменимой аминокислотой. Это означает, что он вырабатывается организмом в небольших количествах. Он также доступен в продуктах питания, и многие люди могут извлечь выгоду из потребления большего количества из своего питания.
Это особенно верно, если у человека есть заболевание, ограничивающее синтез глицина.
Действие треонина в организме
1.Свойства треонина в организме – поддерживает здоровье пищеварительной системы

Треонин защищает пищеварительный тракт, создавая покрывающий его слой слизи и служит барьером для повреждения пищеварительных ферментов. Эта важная аминокислота также поддерживает здоровую функцию кишечника, способствуя защитным эффектам слизистого барьера кишечника.
Согласно исследованиям, опубликованным в Frontiers in Bioscience, большая часть пищевого треонина используется для синтеза белка слизистой оболочки кишечника. По этой причине потребление продуктов Thr может помочь улучшить здоровье кишечника в физиологических и патологических условиях как у людей, так и у животных.
2.Свойства треонина в организме — повышает иммунную систему 
Нам нужно достаточно треонина для поддержания правильной иммунной функции. Тимус использует незаменимую аминокислоту для производства Т-клеток или Т-лимфоцитов, которые борются с инфекциями в организме.
Исследования, опубликованные в «Cold Spring Harbor Perspectives in Biology», утверждают, что
«серин/треонинкиназы контролируют эпигенетические, транскрипционные и метаболические программы, определяющие функцию Т-клеток»
.Исследователи объясняют, что на базовом уровне серин и треонинкиназы работают как выключатели. Они запускают рецепторы антигена и цитокинов, которые составляют иммунную систему.
3.Свойства треонина в организме — улучшает мышечное сокращение
Есть некоторые свидетельства того, что треонин может способствовать развитию симптомов БАС, или болезни Лу Герига. Хотя необходимы дополнительные исследования, чтобы лучше понять его роль. Треонин работает на повышение уровня глицина в центральной нервной системе.
Глицин используется для лечения спастичности. Поэтому L-треонин был оценен по его способности улучшать спастичность или сокращать мышцы у пациентов с БАС.
В обзоре, проведенном в Австралии, исследователи обнаружили, что двойное слепое, плацебо-контролируемое исследование перорального приема L-треонина для лечения спастичности позвоночника указывает на умеренный спазмолитический эффект. Тем не менее, исследования с участием пациентов с БАС не показали улучшения при лечении L-треонина.
Эти смешанные обзоры показывают, что использование добавок L-треонина может помочь уменьшить мышечные сокращения. Однако, он может быть неэффективным для симптомов БАС.
4.Свойства треонина в организме в поддержании силы в мышцах и костях
Знаете ли вы, что белки коллагена и эластина нуждаются в треонине для правильного производства? Возможно, вы уже знаете, что коллаген является наиболее распространенным белком в организме. Он содержится в наших мышцах, костях, коже, кровеносных сосудах, сухожилиях и пищеварительной системе.
Поскольку треонин позволяет производить коллаген, он играет жизненно важную роль в здоровье костей и мышц.
Исследования, проведенные в Техасском университете A&M, показывают, что глицин из треонина, пролина и гидроксипролина составляет 57% от общего количества аминокислот в коллагене. Аминокислота треонин является предшественником глицина. Он также используется во время биосинтеза креатина, обеспечивая мышцы прямым источником топлива для восстановления повреждений.
Треонин также учитывает правильную функцию эластина. Эластин – это белок, содержащийся в соединительной ткани. Он позволяет коже, сухожилиям и связкам восстанавливать форму после растяжения или сокращения.
5.Свойства треонина в организме — помогает предотвратить ожирение печени
Аминокислота предотвращает накопление жира в печени. Это достигается путем регулирования жирового обмена и облегчения липотропной функции.
Липтропные соединения способствуют расщеплению жира во время обмена веществ. Без аминокислот — треонина, метионина и аспарагиновой кислоты это было бы невозможно. Дефицит треонина может привести к ожирению печени и даже к печеночной недостаточности.
Исследование на животных, опубликованное в Американском журнале физиологии, показало, что треонин — дефицитное питание увеличивают митохондриальное разобщение в печени. Питание, в котором отсутствуют качественные белковые продукты, может привести к неправильной работе клеток и накоплению жиров в печени.
6.Свойства треонина в организме — облегчает беспокойство и легкую депрессию
Исследования показывают, что изменения уровня аминокислот в сыворотке, включая серин и глицин, требующие треонин для производства, связаны с большой депрессией. Исследователи в Бельгии обнаружили — изменения уровня треонина, аспартата, аспарагина и серина могут предсказать реакцию пациента на лечение антидепрессантами. Они модулируют уровни аминокислот в организме.
Треонин является предшественником глицина, помогающего успокоить нервы и поддерживающего когнитивное здоровье. Его часто используют в качестве добавки для снятия признаков тревоги и депрессии. Глицин также известен своей способностью улучшать сон, умственную деятельность, настроение и память.
7.Свойства треонина в организме — ускоряет заживление ран
Треонин нужен для правильного производства коллагена, необходимого для формирования соединительной ткани и заживления ран.
Исследования показывают, что после ожогов или травм у людей наблюдается больший выброс треонина в моче. Это указывает на то, что аминокислота метаболизируется из тканей организма после травмы.
Увеличение потребления треонина через продуктов или добавки может помочь ускорить заживление ран, ожогов и других форм травм.
Симптомы и причины дефицита треонина
Дефицит треонина встречается редко, так как большинство людей получают достаточно аминокислот в употребляемых продуктах. Однако люди с несбалансированным питанием, веганы и вегетарианцы, могут не потреблять достаточное количество треониновой пищи. Что может вызвать низкий уровень аминокислот.
Дефицит треонина может вызывать следующие симптомы:
- проблемы с пищеварением
- раздражительность или эмоциональное возбуждение
- путаница
- повышенное содержание жира в печени
- плохое усвоение питательных веществ
Продукты и добавки
В чем содержится треонин?
Аминокислота треонин встречается в природе в форме L-треонина. Хорошо сбалансированное питание, включающее высококачественные белковые продукты, обеспечит организм достаточным количеством для поддержания нормального уровня.
Лучшие треониновые продукты включают в себя:
- Мясо свободного выгула (включая курицу, баранину, говядину и индейку)
- Выловленная рыба (в том числе лосось)
- Молочные продукты
- Творог
- Яйца
- Морковь
- Бананы
- Семена кунжута
- Семена тыквы
- Фасоль
- Эдамамэ
- Спирулина
- Чечевица
Дефицит треонина редко встречается у людей, придерживающихся сбалансированного питания с высоким содержанием белка. Для веганов и вегетарианцев употребление в пищу бобов, семян и гороха поможет поддерживать нормальный его уровень.
Порошок и капсулы L-треонина доступны в Интернете или в большинстве магазинов здоровой пищи. Вы также можете обнаружить, что добавки эластина содержат L-треонин.
Как принимать треонин и дозировка
Добавки треонина бывают в виде капсул по 500 мг, которые можно принимать до трех раз в день. Это в зависимости от потребностей в здоровье и уровня дефицита Т-аминокислот.
Наиболее распространенная доза L-треонина составляет 500–1000 мг в день. Исследования показывают, что дозы до четырех грамм в день в течение 12 месяцев безопасны.
Использование L-треонин для устранения дефицита или улучшения симптомов какого-либо заболевания лучше производить под наблюдением врача.
Если вы решили принимать треонин в форме добавок, рекомендуем рассмотреть следующие варианты:
Рецепты
Есть так много способов включить треонин в свой рацион. Сосредоточьтесь на получении достаточного количества белка в питании.
Вы можете сделать это с органическим мясом, пойманной в дикой природе рыбой, яйцами, бобами, орехами и семенами. Вот для начала несколько полезных и вкусных рецептов:
Риски и побочные эффекты
Хотя добавление треонина в соответствующих количествах обычно считается безопасным, некоторые люди могут испытывать незначительные побочные эффекты. Это головная боль, тошнота, расстройство желудка и кожная сыпь.
Недостаточно доказательств того, что беременным или кормящим женщинам следует принимать добавки треонина. Вместо этого лучше всего получать достаточно аминокислот из сбалансированного питания.
Люди, принимающие антагонисты NMDA под названием мемантин (Namenda), должны избегать использования этой добавки. Это один из видов лекарств от болезни Альцгеймера. Аминокислота может снизить эффективность этих лекарств.
Свойства треонина в организме — последние мысли
- Какова функция треонина? Треонина является незаменимой аминокислотой, которая играет важную роль в регулировании баланса белка в организме.
- Преимущества этой аминокислоты включают ее способность поддерживать здоровье пищеварительной системы, укреплять иммунную систему, улучшать мышечную силу. А также уменьшать мышечные спазмы, снимать беспокойство и легкую депрессию и ускорять заживление ран.
- Какие продукты с высоким содержанием треонина? Большое количество треонина содержат высококачественные белковые продукты, включая органическое мясо, пойманную в дикой природе рыбу. А также яйца, органические молочные продукты, семена и бобы.
- Кто не получает достаточное количества треонина в рационе питания, его прием в виде добавок может помочь поддерживать нормальный уровень. Капсулы и порошки доступны в интернете и в магазинах здоровой пищи.
ЧИТАЙТЕ ДАЛЕЕ: Удивительная польза тирозина для здоровья мозга и щитовидной железы. Информация о питании и дозировке
Поделиться с друзьями:
Треонин для печени и нервов: Незаменимая аминокислота | ФИТНЕС | ЗДОРОВЬЕ | СПОРТИВНОЕ ПИТАНИЕ | ВИТАМИНЫ | ТРЕНИРОВКИ | НОВОСТИ
 Треонин для печени и нервов. В семействе незаменимых кислот, которые наш организм не умеет самостоятельно синтезировать и должен получать с пищей, менее других известен треонин. Хотя про него пишут реже, чем про лейцин или валин, роль этого соединения в организме весьма значительная. Пора восстановить справедливость и рассказать про уникальные свойства треонина. Как и выше упомянутые вещества, он необходим для синтеза белка, а поэтому входит в число протеиногенных аминокислот. Благодаря этому треонин участвует в строительстве мышечной ткани, что делает его важным для спортсменов. Также это вещество необходимо для работы многих внутренних органов. В нашей статье мы расскажем, чем полезна незаменимая аминокислота треонин для печени, нервов и сердца.
Треонин для печени и нервов. В семействе незаменимых кислот, которые наш организм не умеет самостоятельно синтезировать и должен получать с пищей, менее других известен треонин. Хотя про него пишут реже, чем про лейцин или валин, роль этого соединения в организме весьма значительная. Пора восстановить справедливость и рассказать про уникальные свойства треонина. Как и выше упомянутые вещества, он необходим для синтеза белка, а поэтому входит в число протеиногенных аминокислот. Благодаря этому треонин участвует в строительстве мышечной ткани, что делает его важным для спортсменов. Также это вещество необходимо для работы многих внутренних органов. В нашей статье мы расскажем, чем полезна незаменимая аминокислота треонин для печени, нервов и сердца.
Треонин в оптимальной природной форме и дозировке содержится в продуктах пчеловодства — таких как цветочная пыльца, маточное молочко и трутневый расплод, которые входят в состав многих натуральных витаминно-минеральных комплексов компании «Парафарм»: «Леветон П», «Элтон П», «Леветон Форте», «Элтон Форте», «Апитонус П», «Остеомед», «Остео-Вит», «Остеомед Форте», «Эромакс», «Мемо-Вит» и «Кардиотон». Именно поэтому мы уделяем столько внимания каждому природному веществу, рассказывая о его важности и пользе для здорового организма.
Где содержится аминокислота
треонин
Полезная аминокислота треонин содержится в организме большинства известных животных, кроме некоторых птиц. Ее много в плазме крови младенцев, что говорит о сильных защитных свойствах данного вещества. Оно входит в состав многих белков, таких как пепсин, глиадин, фибрин и других.
В теле человека наибольшая концентрация треонина в нервных клетках, сердце, скелетных мышцах, печени. Данное вещество существует в виде четырех изомеров: L-треонин, D—треонин, L-аллотреонин, D-аллотреонин. В организме человека присутствует только первый из них, поэтому он нашел применение в фармацевтической промышленности.
У этого вещества много полезных функций, причем наука постоянно открывает новые полезные свойства треонина. Установлено, эта аминокислота отвечает за распад жиров и жирных кислот. Эта функция роднит треонин с другой незаменимой аминокислотой – метионином. Заметим, что данные вещества являются гепатопротектора
Латинское название соединения – treoninum. Температура его плавления – 256 градусов Цельсия. В чистом виде представляет собой белый кристаллический порошок, не имеющий запаха. Входит в состав различных лекарственных средств и пищевых добавок – вместе с лизином, метионином. Выпускается в таблетках, ампулах.
История открытия аминокислоты
треонин
Впервые треонин был получен в 1925 году учеными С. Шрайвером и Х. Бустоном, которые синтезировали его из белка овса. Через десять лет химик Уильям Камминг Роуз также сумел получить треонин. Этот ученый более известен, поскольку много работал и с другими аминокислотами, например, аргинином.
Уже через несколько десятилетий после открытия аминокислоты, началось ее промышленное производство. Сегодня в мире выпускается свыше 160 тысяч тонн этого вещества. В основном это лекарства, пищевые добавки и корм для скота.
Проводились многочисленные исследования данного соединения, в ходе которых были открыты его полезные свойства. Так в 1992 году изучалась группа больных рассеянным склерозом. Терапия препаратами треонина произвела эффект – у пациентов снизилась спастичность мышц. Ежедневная дозировка тогда составляла 7,5 г. В другом исследовании эту аминокислоту давали больным с боковым амиотрофическим склерозом. У тех испытуемых, которые принимали препарат, было замечено ухудшение работы легких. Но пока нельзя однозначно сказать, что на это повлиял именно треонин, поскольку нужны более масштабные исследования.
Важное свойство треонина –
переработка жиров
Доказано, что треонин выполняет в организме ряд важных функций. Например, многие ферменты без него просто не будут вырабатываться. В том числе он участвует в биосинтезе такой важной для спортсменов аминокислоты как изолейцин. Также треонин — это один из основных компонентов для производства пуринов в организме. Еще он способствует энергообмену в мышечных клетках. Другое полезное свойство треонина (незаменимой аминокислоты) — помощь печени в переработке жиров. Благодаря этой функции в клетках печени не скапливаются липиды, в итоге продлевается здоровье всего организма. Помимо этого аминокислота поддерживает функционирование нервной системы. Не случайно головной и спинной мозг содержат треонин в больших количествах.
Из-за этих уникальных свойств треонин используют для лечения больных алкоголизмом. Также аминокислота участвует в процессах роста тканей, и помогает выводить токсины. Нельзя обойти вниманием и другие свойства треонина.
- Важен для правильного протекания метаболических процессов.
- Укрепляет кости и зубную эмаль.
Треонин | Химия онлайн
Треонин – незаменимая α-аминокислота, входит в состав многих белков (пепсин, глиадин, фибрин и др.).
Треонин относится к группе аминокислот, которые имеют полярные, но нейтральные боковые цепи.
Присутствие большого количества полярных аминокислот повышает растворимость белков в воде, в то же время функциональные группы этих молекул часто играют важную роль в действии ферментов и определяют другие физиологические свойства белков.
Цистеин, в частности, ответственен за сохранение трехмерной структуры белков.
Треонин — 2-амино-3-гидроксибутановая (α-амино-β-гидроксимасляная или α-амино-β-оксимасляная) кислота.

Треонин (Тре, Thr , T) — гидроксиаминокислота, химическая формула HO2CCH (NH2) CH (OH) CH3.
Треонин был обнаружен в гусиных перьях Н.Д. Зелинским и В.С. Садиковым, впервые выделен в 1925 г. С. Шрайвером и X. Бустоном из белка овса.
Суточная потребность в треонине для взрослого человека составляет 0,5 грамм, для детей – около 3 грамм.
Физические свойства
Треонин представляет собой белый кристаллический порошок, не имеющий запаха, Температура его плавления — 2530С (с разл.). Растворяется в воде, не растворяется в этаноле и диэтиловом эфире.
Биологическая роль
Аминокислота треонин выполняет ряд важных биологических функций. Треонин участвует в построении мышечного белка и поддерживает нужный протеиновый баланс в организме.
Треонин улучшает состояние сердечнососудистой системы, печени, а также служит дополнительным источником энергии.
Активирует иммунную систему, участвуя в образовании иммуноглобулинов и антител.
Из треонина в организме синтезируются другие аминокислоты – глицин и серин, необходимые для построения мышечной ткани, коллагена и эластина.
Стимулирует процессы роста тканей, способствует энергообмену в мышечных клетках, обладает гликогенными воздействием.
Синтез иммунных белков и многих ферментов пищеварительной системы без треонина невозможен.
Треонин повышает прочность костей и эмали зубов.
Треонин улучшает липотропную функцию печени, способствуя нормализации жирового обмена.
Треонин содержится в молекуле инсулина человека.
Треонин помогает соединительным тканям (сухожилиям, костям, хрящам) и мышцам стать сильными и упругими.
Природные источники
Мясо (индейка, свинина), молочные продукты, рыба (горбуша, семга), соя, фасоль белая, сыр (моцарелла, твердый), чечевица, горох, печень говяжья,
грибы, яйца, различные крупы, меньше его в орехах, бобах и семенах.
При недостатке треонина отмечается потеря аппетита и повышенная возбудимость нервной системы с последующим ее истощением.
Недостаток треонина в рационах питания приводит к нарушению обмена нуклеиновых кислот и белков.
Дефицит треонина приводит к эмоциональному возбуждению, спутанности сознания, трудности с пищеварением, ожирение печени.
Наблюдаются сдвиги в метаболизме высокомолекулярной РНК и нарушения в синтезе белка, а также значительные нейрогуморальные изменения структур и функциональной активности мембран клеток и их органелл.
Недостаток этой аминокислоты обычно наблюдается у вегетарианцев.
Пищевые добавки, содержащие треонин, могут быть полезны вегетарианцам, употребляющим мало животных белков или не употребляющим вовсе.
Избыток треонина приводит к усиленному накоплению мочевой кислоты.
Области применения
Треонин оказывает антидепрессантное действие на организм и регулирует передачу нервных импульсов в мозг.
Треонин поддерживает нормальную работу пищеварительного тракта и принимает активное участие в процессах пищеварения и усвоения питательных веществ.
При недостатке другой аминокислоты – холина – функции треонина приобретают большее значение.
Треонин участвует в процессе обезвреживания токсинов и вместе с другими аминокислотами — цистеином, аланином, лизином и аспарагиновой кислотой укрепляет иммунитет.
Дополнительный прием треонина оказывает влияние на ослабление мышечного тонуса.
БАДы, содержащие треонин, должны включать витамины В3, В6 и магний.
Аминокислоты как лекарственные препараты
Серин и треонин являются необходимым компонентом инфузорных растворов для парентерального питания, особенно треонин – незаменимая аминокислота для человека, способствующая поддержанию нормального обмена в организме.
Рекомендуемый нормы серина и треонина составляет 4-6 грамм в день.
Биотреин применяется при снижении умственной работоспособности и хроническом алкоголизме.
Церебролизат применяется при нарушении корковых функций ЦНС.
Гепансол Нео применяется при печеночной коме с нарушениями функции мозга.
Кетостерил обеспечивает полное снабжение незаменимыми аминокислотами при минимальном введении азота. Улучшает азотистый обмен. Снижает ионы К+ и концентрацию в крови ионов Mg2+ и фосфатов.
Инфезол
Назначается в качестве парентерального питания, способен улучшить общее состояние организма, поддержать обмен веществ и уменьшить вероятность снижения массы тела при критическом состоянии.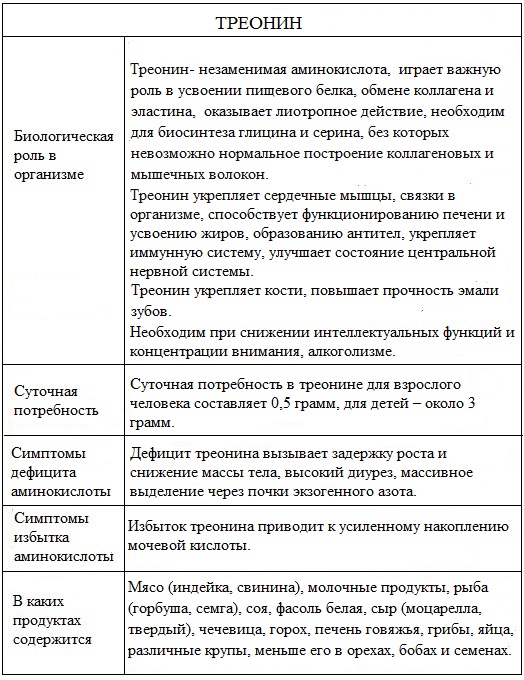
Аминокислоты
Классификация аминокислот
Что такое аминокислота треонин и его польза для организма
L — Треонин – незаменимая протеиногенная алкоаминокислота, которая участвует в построение всех органов и тканей организма человека. Прочитайте статью до конца и вы узнаете: чем L-треонин отличается от других треонинов? для чего нужен треонин в организме человека? функции треонина? биохимический обмен треонина. С вами Галина Батуро и аминокислота треонин.
Структурная формула треонина

Треонин — аминокислота, а значит она имеет аминную голову Nh3 и карбоксильный хвост CООН. Как у всех природных аминокислот, входящие в состав белков (протеиногенные), аминная голова и карбоксильный хвост присоединены к первому атому углерода, т.е. в альфа-положении. Кроме того, треонин имеет алко-группу ОН, которая присоединена к атому углерода в бетта-положении.
Молекула треонина имеет два центра вращения (хиральных центра), поэтому возможны 4 варианта взаиморасположения друг относительно друга амино- и алко- групп, именуемых оптическими изомерами или энантиомерами. В составе животных белков входит L-энантиомер треонина, но при химическом синтезе образуются все четыре изомера в равных пропорциях. Очистка продукта от нефункциональных изомеров – процесс не простой, и это увеличивает стоимость коммерческих препаратов. При прочих равных, более очищенный препарат будет стоить дороже менее очищенного. L-треонин обладает биологической ценностью, ибо входит в состав природных белков. Другие изомеры не играют важной физиологической роли. Попадая в организм человека, они разрушаются ферментами, катализирующими их распад. D-треонин не используется для роста и не подвергается действию оксидазы D-аминокислот.
Свойства треонина
Треонин на одну углеродную последовательность длиннее серина, спиртовая ОН – группа присоединена к молекуле углерода в β-положении, придавая аминокислоте как гидрофильные, так и липофильные свойства, что позволяет молекуле растворяться как в воде, так и в жирах.

При укладке треонина в кристалле образуется трехмерная сетка водородных связей. Связи между спиртовой группой ОН одной молекулы и аминной группой Nh4 другой молекулы объединяют молекулы треонина в спирали, параллельные оси углерода. Отдельные спирали объединяются в каркас водородными связями. Таким образом треонин поддерживает вторичную структуру белка, укрепляя ее водородными связями, что важно для правильного функционирования белковых молекул.
Ион водорода в гидроксильной группе ОН очень подвижен, способен легко отщепляться, поэтому молекула треонина служит местом связи белка с сахарами в соединениях, называемых гликопротеидами, которые входят в состав соединительной ткани. Соединительная ткань – это такая же опора для внутренних органов, как кости – опора для мышц.
Фосфорная кислота в некоторых видах белков соединена сложно-эфирной связью с белковой молекулой через спиртовую группу ОН треонина. Такие белки называется фосфопротеидами. К группе фосфопротеидов относят казеиноген молока, вителин и фосфитин желтков яиц и протеинов икры рыб. Много фосфопротеидов содержится в головном мозгу животных и человека.
Треонин является глюкогенной аминокислотой. Он повышает уровень инсулина в крови, является источником гликогена в печени, из него синтезируется глюкоза.
Будучи протеиногенной аминокислотой, треонин входит в состав практически всех белков организма человека.
Треонин не синтезируется в человеческом организме, являясь незаменимой аминокислотой. Для нормальной жизнедеятельности он должен в достаточном количестве поступать с продуктами питания.
Суточная потребность в треонине для взрослого человека – 0,5 г., для детей – 3 г.
Функции треонина
- Структурная
- Участие в углеводном обмене
- Участие в жировом обмене
- Пищеварительная
- Антитоксическая
- Иммуностимулирующая
- Нейромедиаторная
Структурная функция треонина
Треонин входит в состав практически всех белков человеческого организма, в т.ч. фермента пепсина, участвующего в переваривании протеинов в желудочно-кишечном тракте, а также белка соединительной ткани фибрина. В большинстве природных белков его содержание 2-6%.
Треонин – ведущая аминокислота для нормального функционирования соединительной ткани. Треонин – это здоровая гладкая сияющая кожа, ибо именно коллаген придает ей упругость.
Единственным отличием человеческого инсулина от инсулина других млекопитающих является наличие треонина в положении 3 О В-цепи инсулина.
Треонин входит в состав зубной эмали. Без достаточного потребления этой аминокислоты начнется разрушение структуры зубов, а там и кариес не за горами.
Гликопротеиды

Гликопротеиды — особый класс белков, которые образуются присоединением сахарного кольца к белку через спиртовую группе ОН треонина. Небелковая часть, присоединенная к белку, обеспечивающая выполнение функции, называется простетической группой. Простетической группой гликопротеидов являются различные ГликозоАминоГликаны, в частности гиалуроновая кислота. Белки соединительной ткани, выполняют функцию опоры для внутренних органов, заполняя все промежутки между функциональными тканями. Гликопептиды вместе с коллагеном и гиалуроновой кислотой – это такая набивка внутреннего пространства организма. Гиалуроновая кислота является каркасом, поддерживающим кожу. Она удерживает молекулы воды, что позволяет сохранять гладкость и тургор кожи. Другие гликопротеиды входят в состав суставных хрящей, обеспечивая их высокую подвижность. Треонин помогает соединительным тканям (сухожилиям, костям, хрящам) быть сильными и упругими.
Коллаген в организме есть везде. Мышечные фасции – пленки, структурирующие мышечное волокно, связки, сухожилия, чехлы, покрывающие внутренние органы – везде есть коллаген, погруженный в матрикс из гликопротеидов – этакого вязкого желе, которое сообщает упругость и растяжимость тканям.
Понятно, почему потребность в треонине в детском возрасте в 12 раз больше, чем во взрослом: дети интенсивно растут, т.е. растут кости, мышцы, связки, сосуды, а это значит, что на конвейер, вырабатывающий белки соединительной ткани должны постоянно поступать строительная аминокислота треонин, необходимая для синтеза гликопротеидов . Нет строй.материала – каркас дома-организма будет с дефектами: сколиоз, плоскостопие, вывихи шейных позвонков, мышечная дистрофия, слабость сердечной мышцы, и даже близорукость и кариес – это болезни, связанные с соединительно-тканной недостаточностью, которая в том числе возникает при недостатке соединительно-тканных аминокислот, в т.ч. треонина.
Даже во взрослом состоянии организм постоянно обновляет сам себя: старые белки разрушаются и их место занимают вновь синтезированные, в организме нет ничего неизменного, даже костная ткань обновляется, даже зубная эмаль создается заново. В процессе самообновления вновь и вновь синтезируется соединительная ткань, и для того, чтобы с возрастом ее качество не ухудшалось, необходимо достаточное поступление аминокислот, в т.ч. треонина.
Будучи соединительно-тканной аминокислотой, треонин необходим для восстановления после любых травм и операций, когда идет активное производство соединительной ткани для починки поврежденных структур.
Фосфопротеиды

Фосфопротеиды — особый класс белков, в которых фосфорная кислота соединена сложно-эфирной связью с белковой молекулой через аминокислоты треонин или серин. К белкам этого класса относятся казеин молока, вителлин и фосвитин, выделенный из яичного желтка, ихтулин икры рыб. Особенно много фосфопротеидов содержится в головном мозгу. Некоторые фосфопротеиды являются ферментами: фосфорилаза, гликогенсинтетаза, ТАГ-липаза. Фосфопротеиды содержат органически-связанный лабильный, т.е. способный как легко отщепляться, так и присоединяться, фосфат, что необходимо для выполнения клеткой важных биологических функций.
Особые ферменты — протеинкиназы присоединяют остаток фосфорной кислоты, отщепляя его от молекулы АТФ. Фосфорилирование происходит по спиртовой группе ОН, т.е. фосфорные хвостики навешиваются на белок там, где есть аминокислоты треонин, серин и фенилаланин. Фосфорилирование регулирует работу белка: усиливает или тормозит каталитическую функцию ферментных белков, сродство белка при связывании с другими молекулами, изменяет его стабильность. При фосфорилировании активность белка может измениться в 500 раз. Путем фосфорилирования организм осуществляет тонкую настройку биохимического конвейера, приспосабливая свою работу к меняющимся условиям внешней среды.
При фосфорилировании на долю треонина приходится 8-10% фосфатных групп.
Участие в аминокислотном обмене
Поступающий с пищей треонин используется для синтеза белка. Оставшийся невостребованным треонин подвергается распаду.
Долгое время считалось, что в печени треонин разлагается ферментом ТреонинАльдолазой на аминокислоту глицин и ацетальдегид. Реакция, которая описана во многих учебниках биохимии можно посмотреть здесь: Синтез глицина. Как выяснилось (1) за работу ТреонинАльдолазы принимали действие ферментов ТреонинДегидратазы и ЛактатДегидрогеназы. В печени млекопитающих содержится фермент АллоТреонинАльдолаза, который расщепляет АллоТреонин, изомер Треонина, не входящий в состав белков и не поддерживающий рост и не встречающийся, как природное вещество.
У человека треонин НЕ распадается до аминокислоты глицин и НЕ является источником глицина, т.к. в митохондриях отсутствует специфический фермент ТреонинДегидрогеназа.
Распад Треонина и углеводный обмен
В клетках печени аминокислота треонин распадается под действием фермента ТреонинДегидратазы с участием Пиридоксаль-5-фосфата (активная форма витамина B6). Фермент отсекает аминную голову треонина, происходит необратимое дезаминирование аминокислоты. Конечным продуктом реакции выступает α-КетоМасляная Кислота (α-КетоБутират).

В дальнейшем альфа-КетоМасляная кислота быстро и необратимо расщепляется на пропионовую кислоту и углекислый газ, а пропионовая кислота через образование янтарной кислоты (сукцината) включается в глюконеогенез. Для переработки пропионовой кислоты требуется витамин В 12. Таким образом треонин является источником глюкозы, которая запасается в виде гликогена в печени и по мере необходимости вновь отправляется в топку для выработки энергии.
Основная функция ТреонинДегидратазы в печени — мобилизовывать углерод треонина для глюконеогенеза и синтеза глюкозы в печени, когда глюкозы не хватает. Это состояние возможно при голодании, низкоуглеводистой диете или высокобелковой диете, когда белки поступают с избытком. Фермент активизируется при высоком поступлении белка с пищей, перегоняя избыточный белок на глюкозу. Вот такая засада. В погоне за снижением веса мы отказываемся от углеводов, увеличиваем потребление белка, а организм включает ТреониДегидратазу и изготавливает сахар.
В митохондриях некоторых млекопитающих (морских свинок, крыс, но не человека!) треонин распадается под действием фермента ТреонинДегидрогеназа при участии НАД+ до аминоацетона.

Аминоацетон в дальнейшем окисляется в митохондриях до ацетилКоА , который сгорает в цикле Кребса с выделением энергии. В печени крысы этим путем окисляется до 35% треонина. Эта реакция приведена во многих учебниках биохимии, причем без указания, что в организме человека данный процесс не происходит.
У человека отсутствует фермент ТреонинДегидрогеназа, поэтому распад треонина до аминоацетона невозможен.
Треонин — активная глюкогенная аминокислота. Академик А.А. Покровский считал треонин одной из пяти аминокислот, являющихся наиболее важными источниками углерода для синтеза глюкозы и гликогена. Потребление ее в больших количествах дает инсулиновую реакцию — выброс инсулина, как на потребление глюкозы. Организм как бы заранее готовится утилизировать сахар, на который будет переработан треонин.
Участие в жировом обмене
Треонин наряду с метионином и аспарагиновой кислотой помогает печени расщеплять жиры и жирные кислоты. Он входит в состав многих ферментов, утилизирующих жиры. Недостаток треонина в продуктах питания способствуют развитию жировой дистрофии печени
Пищеварительная функция треонина

Треонин входит в состав пищеварительного фермента пепсина, участвующего в расщеплении белков в желудочно-кишечном тракте. Он поддерживает нормальную работу кишечника, принимает активное участие в процессах пищеварения и усвоения питательных веществ. Функция треонина приобретает особое значение при недостатке аминокислоты холина.
Треонин помогает при непереносимости некоторых продуктов питания, например глютена пшеницы.
Антитоксическая функция треонина
За счет подвижной группы ОН, треонин соединяется с токсическими веществами и дезактивирует их, а потом выводит из организма
Иммуностимулирующая функция треонина
Треонин участвует в синтезе иммуноглобулинов и антител, которые защищают организм от инфекций.
Нейромедиаторная функция треонина

Треонин является источником для образования тормозного медиатора ГАМК. О его функции читайте здесь http://zaryad-zhizni.ru/tormoznyie-i-vozbuzhdayushhie-aminokislotyi/. Как предшественник нейромедиатора, он используется в комплексном лечении депрессии, и других заболеваний нервной системы.
Он улучшает память, повышает концентрацию внимания, увеличивает работоспособность, поднимает настроение. Он оказывает антидепрессантное действие и регулирует передачу нервного импульса в головном мозгу.
Добавки треонина бывают полезны при лечении бокового амиотрофического склероза и рассеянного склероза.
Применяется в комплексном лечении алкоголизма и наркомании, т.к. снижает тягу к веществам, вызывающим зависимость.
Продолжение читайте здесь: http://zaryad-zhizni.ru/treonin-v-produktah-pitaniya/.
Понравилась статья? Делитесь информацией в соц. сетях, оставляйте комментарии. С вами Галина Батуро и аминокислота треонин.
- Малиновский А.В. Переаминирование треонина. стр. 5-6.
Протеинкиназы — Серин/треонин специфичные протеинкиназы
Биология — Протеинкиназы — Серин/треонин специфичные протеинкиназы
08 февраля 2011Оглавление:
1. Протеинкиназы
2. Тирозиновые протеинкиназы
3. Серин/треонин специфичные протеинкиназы
4. Гистидин специфичные протеинкиназы
Аминокислота L-серин
Аминокислота L-треонин
Серин-треониновые протеинкиназы фосфоририруют гидроксильную группу в остатках серина или треонина.
Активность этих протеинкиназ регулируется несколькими событиями, а также некоторыми химическими сигналами, в том числе, cAMP, cGMP, диацилглицеролом, Caкальмодулином.
Серин/треониновые протеинкиназы фосфорилируют остатки серина или треонина в консенсусных последовательностях, которые образуют фосфоакцепторный сайт. Эта последовательность остатков аминокислот в молекуле субстрата, позволяет осуществлять контакт каталитической щели протеинкиназы с фосфорилируемой областью. Эта особенность делает киназу специфичной не к какому-либо определенному субстрату, но к специфичному семейству белков с одинаковыми консенсусными последовательностями. В то время, как каталитические домены этих протеинкиназ высококонсервативны, последовательности узнавания отличаются, обуславливая узнавание разных субстратов.
Киназа фосфорилазы была открыта Кребсом в 1959 году и является первым описанным ферментом семейства серин/треониновых протеинкиназ. Киназа фосфорилазы превращает неактивную гликогенфосфорилазу В в активную форму гликогенфосфорилазу A, последняя отщепляет от гликогена остатки глюкозо-1-фосфата. Киназа фосфорилазы активируется протеинкиназой А.
Протеинкиназа А
Протеинкиназа А, или цАМФ-зависимая протеинкиназа, относится к семейству ферментов, активность которых зависит от уровня циклического АМФ в клетке. Протеинкиназа А является самой изученной из всех протеинкиназ, её функции разнообразны, она участвует в регуляции метаболизма гликогена, липидов и сахаров, её субстратами могут быть другие протеинкиназы или другие метаболические ферменты.
Протеинкиназа А участвует в цАМФ-стимулируемой транскрипции генов, которые имеют цАМФ-реактивный элемент в регуляторном участке. Повышение концентрации цАМФ ведет к активации протеинкиназы А, которая фосфорилирует транскрипционный фактор CREB по остатку серина 133, CREB связывает своим фосфорилированным участком коактиватор транскрипции и стимулирует транскрипцию.
Молекула протеинкиназы А является холоферментом и в неактивном состоянии является тетрамером состоит из двух регуляторных и двух каталитических субъединиц. Если уровень цАМФ в клетке низкий, холофермент остается интактным и каталитическая активность отсутствует. Когда концентрация цАМФ в клетке возрастает, цАМФ связывается с двумя сайтами связывания на регуляторных субъединицах, происходят конформационные изменения, диссоциация тетрамера на два каталитически активных димера. Открытые активные центры каталитических субъединиц переносят концевой фосфат молекулы АТФ на остатки серина или треонина.
Протеинкиназы А представлены в многих типах клеток, и проявляют каталитические активности в отношении разных субстратов, поэтому, работа протеинкиназы А и концентрация цАМФ регулируется во многих биохимических путях. Следует отметить, что действие протеинкиназы А, вызванное фосфорилированием, как правило, кратковременное, так как протеинфосфатазы, сопряженные с протеинкиназами, быстро дефосфорилирует мишени.
Гормоны инсулин и глюкагон влияют на работу протеинкиназы А, изменяя уровень цАМФ в клетке по механизму активации рецепторов, связанных с G-белками, через аденилатциклазу. Инсулин активирует аденилатциклазу, повышая концентрацию цАМФ, протеинкиназа А фосфорилирует ферменты ацетил-КоА-карбоксилазу и пируватдегидрогеназу, направляя таким образом ацетил-КоА для синтеза липидов; глюкагон имеет противоположный эффект.
Работа протеинкиназы А регулируется и по механизму отрицательной обратной связи. Одним из субстратов, активируемых протеинкиназой А, является фосфодиэстераза, которая превращает цАМФ в АМФ, таким образом, снижая концентрацию цАМФ и ингибируя протеинкиназу А.
Протеинкиназа B
Геном человека содержит семейство генов Akt1, Akt2, Akt3. Протеинкиназа Akt1 ингибирует процессы апоптоза, принимает участие в регуляции клеточного цикла, индуцирует синтез белка и поэтому является ключевым белком, регулирующим рост тканей, а также отвечает за развитие мышечной гипертрофии. Поскольку продукт гена Akt1 блокирует апоптоз, повышенный уровень экспрессии Akt1 отмечается во многих опухолях. Первоначально Akt1 был охарактеризован как онкоген в трансформирующем ретровирусе AKT8 в 1990 году.
Продукт гена Akt2 является важной сигнальной молекулой в пути передачи сигнала молекулой инсулина, этот белок требуется для транспорта глюкозы.
Показано, что Akt3 преимущественно экспрессируется в мозге. Мыши, лишенные гена Akt3, имеют маленький мозг. Мыши, нокаутные по гену Akt1, но имеющие ген Akt2 имели меньший размер. Так как уровень глюкозы у таких мышей был в норме, была показана роль Akt1 в процессах роста.
Мыши, нокаутные по гену Akt2, но имеющие Akt1, имели задержки роста и фенотипические проявления инсулин-зависимого диабета. Полученные данные указывали на роль Akt2 в проведении сигнала от инсулинового рецептора.
Регуляция активности Akt осуществляется путем связывания фосфолипидов в мембране. Akt содержит PH-домен, который высокоаффинно связывает фосфатидилинозитол-трифосфат или фосфатидилинозитол-дифосфат. PH-домены выполняют функции заякоривания в мембранах. PIP2 может быть фосфорилирован только PIP3-киназами, и только в случае, когда клетка получила сигнал к росту. PIP3-киназы могут быть активированы рецепторами, связанными с G-белками или рецепторами с тирозинкиназной активностью. Только после активации PIP3-киназы фосфорилируют PIP2 в PIP3.
После связывания с PIP3 и закрепления в мембране Akt может быть активирована путем фосфорилирования фосфоинозитол-зависимыми киназами. PDK1 фосфорилирует Akt, mTORC2 стимулирует фосфорилирование PDK1. Активированная Akt далее регулирует фосфорилированием активность многих субстратов. Показано, что Akt может быть активирована и без участия PIP3-киназ.
Соединения, повышающие концентрацию цАМФ могут активировать Akt через протеинкиназу А. Фосфатазы липидов контролируют концентрацию PIP3, например, супрессор опухолей PTEN работает как фосфатаза, и дефосфорилирует PIP3 в PIP2. Akt диссоциирует от плазматической мембраны и активность фермента значительно падает. Протеинфосфатазы контролируют количество фосфорилированного Akt. Фосфатазы PHLPP дефосфорилируют серин 473 в Akt и тем самым инактивируют её.
Akt регулирует многие процессы, направленные на выживание клетки. Например, Akt может фосфорилировать про-апоптотический белок BAD по остатку серина 136, что вызывает диссоциацию BAD из Bcl-2/Bcl-X комплекса и приводит к утере про-апоптотической функции. Также Akt активирует транскрипционный фактор NF-κB, и включает транскрипцию генов выживания.
Akt требуется для инсулин-индуцируемой транслокации транспортера глюкозы 4 в плазматическую мембрану. Киназа-3 гликогенсинтетазы может быть ингибирована фосфорилированием Akt, что вызывает синтез гликогена.
Akt1 также связана с ростом сосудов и развитием опухолей. Недостаточность Akt1 у мышей ингибирует физиологический ангиогенез, но усиливает патологический рост сосудов и опухолей.
Протеинкиназа С
Протеинкиназы С это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые классифицируют по вторичным посредникам на три семейства: традиционные, или классические, оригинальные, или нестандартные и нетипичные. Традиционным протеинкиназам С для активации требуется Ca, диацилглицерол или фосфатидилхолин.
Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca. Традиционные и оригинальные протеинкиназы С активируются через сходные пути сигнальной трансдукции, например, с помощью фосфолипазы С. Нетипичные изоформы, не требуют ни Ca, ни диацилглицерола для активации.
Все протеинкиназы С состоят из регуляторного и каталитического доменов, связанных шарнирной областью. Каталитические районы высоко консервативны между разными изоформами, и значительно отличаются от каталитических районов других серин-треониновых протеинкиназ. Консервативность каталитических доменов связано с выполняемыми функциями, различия в регуляторных районах обуславливают различия во вторичных посредниках.
Регуляторный домен на N-конце протеинкиназы С содержит отдельные участки. С1 домен, представленный во всех изоформах протеинкиназы С, имеет сайт связывания диацилглицерола. С2 домен воспринимает ион Ca. Район псевдосвязывания субстрата представляет собой короткую последовательность аминокислот, которые подражают субстрату и занимают участок связывания субстрата в активном центре, делая фермент неактивным.
Ca и диацилглицерол связываются с доменами С2 и С1, соответственно, и вызывают прикрепление протеинкиназы С к плазматической мембране. Взаимодействие с мембраной вызывает освобождение псевдосубстрата из каталитического центра и активирует фермент. Для осуществления подобных аллостерических взаимодействий, протеинкиназе С требуется предварительное фосфорилирование каталитического района.
Протеинкиназа С должна быть предварительно фосфорилирована и для осуществления собственной киназной активности. Молекула протеинкиназы С содержит несколько сайтов фосфорилирования 3-фосфоинозитол-зависимой протеинкиназой-1. После активации протеинкиназа С переносится к плазматической мембране и присоединяются к RACK-белкам, аминокислотная последовательность которых на 47 % гомологична бета-субъединицам G-белков.
Для протеинкиназ С характерен длительный период активности, которая сохраняется, даже если первоначальный сигнал пропал или снизилась концентрация ионов Ca. Это достигается образованием диацилглицерола из фосфатидилхолина с помощью фосфолипазы С.
Последовательность остатков аминокислот в молекуле протеинкиназы С сходна с таковой для протеинкиназы А, и содержит остатки основных аминокислот вблизи остатков серина и треонина, подвергающихся фосфорилированию. Субстратами протеинкиназы С являются следующие белки: MAP-киназы, Raf-киназы, MARCKS. Белки-субстраты протеинкиназы С играют важную роль в поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла. MARCKS вовлечены в процессы экзоцитоза некоторых секреторных пузырьков, содержащих, муцин и хромафин. MARCKS кислые белки, содержат большое количество остатков аланина, глицина, пролина и глутаминовой кислоты. MARCKS связаны N-концом с липидами мембраны, регулируются ионами Ca, кальмодулином, протеинкиназой С.
VDR кальцитриоловый рецептор. Рецептор стероидных гормонов из семейства ядерных рецепторов. После активирования молекулой витамина D, образует гетеродимер с ретиноидным-Х-рецептором и связывается с регуляторными элементами на ДНК, изменяя экспрессию генов или снимая репрессоры генов. Глюкокортикоиды снижают экспрессию VDR во всех тканях.
Рецептор эпидермального фактора роста относится к семейству рецепторов факторов роста, связывающих внеклеточные белковые лиганды и обладает тирозинкиназными активностями. Мутации, затрагивающие EGRF часто могут проявляться в раковом перерождении клетки. После связывания лиганда, рецептор димеризуется, происходит самофосфорилирование по пяти остаткам тирозина на С-конце рецептора, и EGRF приобретает внутриклеточную тирозинкиназную активность.
Последующая активность EGRF связана с инициацией каскада сигнальной трансдукции, активируются MAPK, Akt, JNK что приводит к синтезу ДНК и пролиферации. Киназный домен также может фосфорилировать другие рецепторы, связанные с EGRF по остаткам тирозина.
Ca/кальмодулин зависимые протеинкиназы
Ca2+/кальмодулин-зависимая киназа II
Са/кальмодулин-зависимые киназы, или СаМ киназы, регулируются Са/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы и многофункциональные СаМ киназы, порядка 2 % белков головного мозга представлены СаМ второго типа.
Кальмодулин это вездесущий, кальций-связывающий белок, который связывается с многими другими белками и регулирует их активность. Это маленький кислый белок, состоит из 148 аминокислотных остатков, содержит четыре домена связывания кальция.
СаМ служит промежуточным звеном в воспалении, апоптозе, мышечных сокращениях, развитии кратковременной и длительной памяти, росте нервов и иммунном ответе. Кальмодулин экспрессируется во многих типах клеток и находится в цитоплазме, внутри органелл, а также находится в плазматической мембране и мембранах органелл. Многие белки, которые связываются с кальмодулином, не могут сами связывать кальций и используют кальмодулин как «датчик» кальция и компонент системы передачи сигнала.
Кальмодулин
Кальмодулин также используется для запасания Ca в эндоплазматическом и саркоплазматическом ретикулумах. После связывания кальция молекула кальмодулина претерпевает конформационные изменения, что позволяет молекуле связывать другие белки для осуществления специфического ответа. Молекула кальмодулина может связать до четырёх ионов кальция, может подвергаться посттрансляционной модификации, например, фосфорилированию, ацетилированию, метилированию, протеолизу, причем эти модификации могут модулировать активность СаМ.
Киназа легких цепей миозина. Киназа легких цепей миозина фосфорилирует миозин. Киназа легких цепей миозина имеет ключевое значение в сокращении гладкой мускулатуры. Сокращение гладких мышц может произойти после повышения концентрации кальция в результате притока из саркоплазматического ретикулюма или из внеклеточного пространства. Сперва кальций связывается с кальмодулином, это связывание активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи молекул миозина. Фосфорилирование позволяет молекулам миозина образовывать поперечные мостики и связываться с актиновыми филаментами и стимулирует мышечное сокращение. Данный путь является основным в механизме сокращения гладких мышц, так как гладкие мышцы не содержат тропонинового комплекса, в отличие от поперечно-полосатых.
МАРK
Митоген-активируемые киназы отвечают на внеклеточные стимулы и регулируют многие клеточные процессы. МАРК вовлечены в работу многих неядерных белков продуктов онкогенов. Внеклеточные стимулы ведут к активации МАРК через сигнальный каскад, который состоит из МАРК, МАРКК и МАРККК. МАР3К активируется внеклеточными стимулами и фосфорилирует МАР2К, затем МАР2К фосфорилированием активирует МАРК. Такой сигнальный МАР-каскад консервативен для эукариот от дрожжей до млекопитающих.
MAP/ERK система передачи сигнала
MAPK/ERK-киназы принимают участие в особом пути сигнальной трансдукции. ERK или классические МАР-киназы, регулируются внеклеточными сигналами.
Рецепторы, связанные с тирозиновыми киназами, активируются внеклеточными лигандами. Связывание EGF с рецептором приводит к фосфорилированию EGFR. Белок GRB2, содержащий Sh3-домен, связывается с остатками фосфорилированного тирозина. Белок GRB2 своим Sh4-доменом связывается и активирует SOS. Активированный гуанин-нуклеотид заменяющий фактор отщепляет ГДФ от белка Ras, Ras далее может связать ГТФ и активироваться.
Активный Ras активирует RAF-киназу. RAF-киназа фосфорилирует и активирует МЕК, другую серин-треониновую киназу. МЕК фосфорилирует и активирует МАРК. Эта серия киназ от RAF к МЕК и к МАРК является примером каскада протеинкиназ.
Один из эффектов активации МАРК это изменение трансляции мРНК. МАРК фосфорилирует и активирует S6 киназу 40S рибосомных белков. RSK фосфорилирует рибосомный белок S6, и вызывает его диссоциацию от рибосомы.
МАРК регулирует активности нескольких транскрипционных факторов, например, C-myc. МАРК регулирует активность генов, контролирующих клеточный цикл.
Просмотров: 14444
AATK — серин / треонин-протеинкиназа LMTK1 — Homo sapiens (человек)
AATK
Homo sapiens (человек)
Оценка за аннотацию:Оценка за аннотацию: 5 из 5
Оценка аннотации обеспечивает эвристический критерий содержания аннотации записи или протеома UniProtKB. Эту оценку нельзя использовать в качестве меры точности аннотации, поскольку мы не можем определить «правильную аннотацию» для любого данного белка.
-Экспериментальные данные на уровне белка иЭто указывает на тип доказательств, подтверждающих существование белка. Обратите внимание, что свидетельство «существования белка» не дает информации о точности или правильности отображаемых последовательностей.
Выберите раздел слева для просмотра содержимого.
В этом разделе представлена любая полезная информация о белке, в основном биологическая информация.
Function i
Может участвовать в дифференцировке нейронов.Информация, подобранная вручную, для которой опубликованы экспериментальные данные.
Ручное утверждение на основе эксперимента в iПриведено для: СПЕЦИФИЧНОСТЬ ТКАНИ, ПОДКЛЕТОЧНОЕ РАСПОЛОЖЕНИЕ, ФУНКЦИЯ.
В этом подразделе раздела Функция описывается каталитическая активность фермента, т. е. химическая реакция, которую фермент катализирует.
Каталитическая активность i
Сайты
| Функциональный ключ | Позиция (я) ) | Описание Действия | Графическое изображение | Длина |
|---|---|---|---|---|
В этом подразделе раздела Функция описывается взаимодействие между одной аминокислотой и другим химическим веществом.Приоритет отдается аннотации физиологических лигандов. Сайт связывания i | 156 | ATP Проверенная вручную информация, созданная автоматической системой аннотаций UniProtKB. Ручное утверждение согласно правилам i | 1 | |
Этот подраздел Function используется для ферментов и указывает остатки, непосредственно участвующие в катализе. Активный сайт i | 253 | Акцептор протонов Подтверждение вручную в соответствии с правилами i | 1 |
Области
| Функциональный ключ | Позиция (а) | Описание Действия | Графическое изображение | Длина |
|---|---|---|---|---|
Этот подраздел Функция описывается область в белке, которая связывает нуклеотид-фосфаты. Она всегда включает более одной аминокислоты и включает все остатки, участвующие в связывании нуклеотидов. < a href = '/ help / np_bind' target = '_ top'> Подробнее … Связывание нуклеотидов i | 131 — 139 | ATP Утверждение вручную в соответствии с правилами i | 9 |
Gene Ontology (GO) предоставляет набор иерархически управляемого словаря, разделенного на 3 категории:
GO — Молекулярная функция i
GO — Биологический процесс i
Ключевые слова UniProtKB представляют собой контролируемый словарь с иерархической структурой.Ключевые слова обобщают содержание записи UniProtKB и облегчают поиск интересующих белков.
Ключевые слова i
Базы данных ферментов и путей
Веб-ресурс Pathway Commons для данных о биологических путях Подробнее … PathwayCommons i | Q6ZMQ8 |
SignaLink: ресурс сигнального пути с многоуровневым регулированием сети Подробнее…SignaLink i | Q6ZMQ8 |
Сигнальная сеть SIGNOR Открытый ресурс Подробнее … SIGNOR i | Q6ZMQ8 |
В этом разделе представлена информация о белках и названиях генов и синонимах, а также об организме, являющемся источником последовательности белка.
Имена и таксономия i
Этот подраздел Имена и таксономия представлен исчерпывающий список всех названий белка, от широко используемых до устаревших, что позволяет однозначно идентифицировать белок. Названия белков i | Рекомендуемое название: Серин / треонин-протеинкиназа LMTK1 (EC: 2.7.11.1)Альтернативное название (я): Тирозинкиназа, ассоциированная с апоптозомКраткое название: AATYK Тирозинкиназа мозга, ассоциированная с апоптозом CDK5-связывающий белок Тирозинкиназа Lemur 1 связывающий белок Краткое название: p35BP |
Этот подраздел Имена и таксономия указаны названия гена (ов), кодирующих последовательность (и) белка, описанную в записи. Четыре существуют разные токены: «Имя», «Синонимы», «Упорядоченные имена локусов» и «Имена ORF». Имена генов i | Имя: AATK Синонимы: AATYK, KIAA0641, LMR1, LMTK1 |
Этот подраздел Имена и таксономия содержит информацию о названии (именах) организма, являющегося источником последовательности белка. Организм i | Homo sapiens (Human) |
В этом подразделе раздела Имена и таксономия показан уникальный идентификатор, присвоенный NCBI организм-источник белка.Это называется таксономическим идентификатором или taxid. Таксономический идентификатор i | 9606 [NCBI] |
Этот подраздел раздела Имена и таксономия содержит происхождение таксономической иерархической классификации источника. организм.В нем перечислены узлы в том виде, в каком они появляются сверху вниз в таксономическом дереве, причем сначала указывается более общая группировка. Таксономическая линия i | клеточных организмов ›Eukaryota› Opisthokonta ›Metazoa› Eumetazoa ›Bilateria› Deuterostomia ›Chordata› Craniata ›Vertebrata› Gnathostomata ›Teleostomi› Euteleostomini ›Sarcopterytrapodomipnode› Darcopterytrapodomipno Eutheria ›Boreoeutheria› Euarchontoglires ›Приматы› Haplorrhini ›Simiiformes› Catarrhini ›Hominoidea› Hominidae ›Homininae› Homo |
Этот подраздел Имена и таксономия присутствует для записей, которые являются частью протеом , то есть набора белков, которые, как считается, экспрессируются организмами, чьи геномы полностью секвенированы. Протеомы i |
|
Базы данных для конкретных организмов
В этом разделе представлена информация о расположении и топологии зрелого белка в клетке.
Субклеточное расположение i
Топология
| Функциональная клавиша | Позиция (с ) | Описание Действия | Графическое изображение | Длина |
|---|---|---|---|---|
В этом подразделе раздела «Субклеточное расположение» описывается размер покрывающей мембрану области белок.Это означает наличие как альфа-спиральных трансмембранных областей, так и участков мембранных трансмембранных белков бета-ствола. Трансмембрана i | 32 — 52 | HelicalAdd BLAST | 21 |
Ключевые слова — Клеточный компонент i
Цитоплазма, Мембрана В этом разделе представлена информация о заболеваниях и фенотипах, связанных с белком.
Патология и биотехнологии i
Базы данных для конкретных организмов
Разные базы данных
Pharos NIH Druggable Genome Knowledgebase Подробнее … Pharos i | Q6ZMQ8, Tbio |
Базы данных полиморфизма и мутаций
BioMuta курирует базу данных однонуклеотидных вариаций и ассоциаций болезней Подробнее…BioMuta i | AATK |
Картирование доменов мутаций болезни (DMDM) Подробнее … DMDM i | 114149222 |
В этом разделе описаны посттрансляционные модификации (PTM) и / или события обработки.
PTM / Processing i
Обработка молекул
| Функциональный ключ | Позиция (я) | Описание Действия | Графическое представление | Длина |
|---|---|---|---|---|
В этом подразделе раздела «PTM / Обработка» описывается протяженность полипептидной цепи в зрелом белке после процессинга или протеолитического расщепления. Цепь i PRO_0000248300 | 1 — 1374 | Серин / треонин-протеинкиназа LMTK1 Добавить BLAST | 1374 |
Модификации аминокислот
| Функциональный ключ | Позиция (я) | Описание Действия | Графический вид | Длина |
|---|---|---|---|---|
В этом подразделе раздела «PTM / Обработка» указываются положение и тип каждого измененного остатка, за исключением lipids , гликаны и перекрестные ссылки протеина . Подробнее … Модифицированный остаток i | 495 | Фосфосерин Подтвержденная вручную информация, полученная на основе экспериментальных и расчетных данных. Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 1 | |
| Модифицированный остаток i | 1029 | Фосфосерин Собранная вручную информация, полученная на основе экспериментально охарактеризованного белка. Ручное утверждение, выведенное из сходства последовательностей с i | 1 | |
| Модифицированный остаток i | 1168 | Фосфосерин Ручное утверждение, выведенное из сходства последовательностей с i | 1 | |
| Модифицированный остаток i | 1171 | Фосфосерин Ручное утверждение, выведенное из сходства последовательностей с i | 1 | |
| Модифицированный остаток i | 1184 | Фосфосерин Ручное утверждение сходство последовательности с i | 1 | |
| Модифицированный остаток i | 1187 | Фосфосерин Ручное утверждение, выведенное из сходства последовательности с i | 1 | |
| Модифицировано остаток i | 1262 | Phosphoserine Ручное утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 1 |
Этот подраздел PTM/processing описаны посттрансляционные модификации (PTM). Этот подраздел дополняет информацию, представленную на уровне последовательности, или описывает модификации для которых данные о позиции еще не доступны .
Подробнее … Посттрансляционная модификация i
Автофосфорилированная.Фосфорилируется CDK5.Ручное утверждение, основанное на эксперименте i
- «Тирозинкиназа, ассоциированная с апоптозом, является белком, связывающим активатор Cdk5 и p35».
Хонма Н., Асада А., Такешита С., Эномото М., Ямакава Э., Цуцуми К., Сайто Т., Сато Т., Ито Х., Казиро Ю., Кишимото Т., Хисанага С.
Biochem. Биофиз. Res. Commun. 310: 398-404 (2003) [PubMed] [Europe PMC] [Реферат]Цитируется по: АЛЬТЕРНАТИВНОЕ РАЗЛОЖЕНИЕ (ISOFORM 2), ВЗАИМОДЕЙСТВИЕ С CDK5, ФОСФОРИЛИРОВАНИЕ.
Ключевые слова — PTM i
PhosphoproteinПротеомные базы данных
Базы данных PTM
iPTMnet интегрированный ресурс для PTM в контексте системной биологии Подробнее … iPTMnet i | Q6ZMQ8 |
Исчерпывающий ресурс для изучения посттрансляционных модификаций белков (PTM) у человека, мыши и крысы. Подробнее … PhosphoSitePlus i | Q6ZMQ8 |
В этом разделе представлена информация об экспрессии гена на уровне мРНК или белка в клетках или тканях многоклеточных организмов.
Выражение i
В этом подразделе раздела «Экспрессия» представлена информация об экспрессии гена на уровне мРНК или белка в клетках или тканях многоклеточных организмов. По умолчанию информация получена из экспериментов на уровне мРНК, если не указано «на уровне белка».
Примеры: P92958 , Q8TDN4 , O14734
.Примеры: P92958 , Q8TDN4 , O14734
AKT1 — серин / треонин-протеинкиназа RAC-альфа — Homo sapiens (Человек)
AKT1
Homo sapiens (Человек)
Оценка за аннотацию:Оценка за аннотацию: 5 из 5
Оценка аннотации обеспечивает эвристический критерий содержания аннотации записи или протеома UniProtKB. Эту оценку нельзя использовать в качестве меры точности аннотации, поскольку мы не можем определить «правильную аннотацию» для любого данного белка.
-Экспериментальные данные на уровне белка иЭто указывает на тип доказательств, подтверждающих существование белка. Обратите внимание, что свидетельство «существования белка» не дает информации о точности или правильности отображаемых последовательностей.
Выберите раздел слева для просмотра содержимого.
В этом разделе представлена любая полезная информация о белке, в основном биологическая информация.
Function i
AKT1 является одной из 3-х близкородственных сериновых / треониновых протеинкиназ (AKT1, AKT2 и AKT3), называемых киназой AKT, и которые регулируют многие процессы, включая метаболизм, пролиферацию, выживаемость клеток, рост и ангиогенез (PubMed: 15526160, PubMed : 11882383, PubMed: 21620960, PubMed: 21432781).Это опосредуется фосфорилированием серина и / или треонина ряда субстратов, находящихся ниже по ходу процесса (PubMed: 15526160, PubMed: 11882383, PubMed: 21620960, PubMed: 21432781). На данный момент было зарегистрировано более 100 кандидатов в субстрат, но для большинства из них не сообщалось о специфичности изоформ (PubMed: 15526160, PubMed: 11882383, PubMed: 21620960, PubMed: 21432781). AKT отвечает за регуляцию захвата глюкозы, опосредуя индуцированную инсулином транслокацию транспортера глюкозы SLC2A4 / GLUT4 к поверхности клетки (по сходству).Фосфорилирование PTPN1 по «Ser-50» отрицательно модулирует его фосфатазную активность, предотвращая дефосфорилирование рецептора инсулина и ослабление передачи сигналов инсулина (по сходству). Фосфорилирование TBC1D4 запускает связывание этого эффектора с ингибирующими белками 14-3-3, что необходимо для стимулированного инсулином транспорта глюкозы (PubMed: 11994271). AKT регулирует также хранение глюкозы в форме гликогена путем фосфорилирования GSK3A по «Ser-21» и GSK3B по «Ser-9», что приводит к ингибированию его киназной активности (по сходству).Считается, что фосфорилирование изоформ GSK3 с помощью AKT является одним из механизмов, которым управляется пролиферация клеток (по сходству). AKT также регулирует выживаемость клеток посредством фосфорилирования MAP3K5 (киназа, связанная с сигналом апоптоза) (PubMed: 11154276). Фосфорилирование «Ser-83» снижает активность киназы MAP3K5, стимулированную окислительным стрессом, и тем самым предотвращает апоптоз (PubMed: 11154276). AKT опосредует стимулированный инсулином синтез белка путем фосфорилирования TSC2 по «Ser-939» и «Thr-1462», тем самым активируя передачу сигналов mTORC1 и приводя как к фосфорилированию 4E-BP1, так и к активации RPS6KB1 (PubMed: 12150915).AKT участвует в фосфорилировании членов факторов FOXO (семейство факторов транскрипции Forkhead), что приводит к связыванию белков 14-3-3 и цитоплазматической локализации (PubMed: 10358075). В частности, FOXO1 фосфорилируется по «Thr-24», «Ser-256» и «Ser-319» (PubMed: 10358075). FOXO3 и FOXO4 фосфорилируются по эквивалентным сайтам (PubMed: 10358075). AKT играет важную роль в регуляции транскрипции NF-каппа-B-зависимого гена и положительно регулирует активность CREB1 (белка, связывающего циклический AMP (цАМФ) -элемент, связывающий элемент) (PubMed: 9829964).Фосфорилирование CREB1 индуцирует связывание дополнительных белков, которые необходимы для транскрипции генов выживания, таких как BCL2 и MCL1 (PubMed: 9829964). AKT фосфорилирует «Ser-454» на цитратлиазе АТФ (ACLY), тем самым потенциально регулируя активность ACLY и синтез жирных кислот (по сходству). Активирует изоформу 3B циклической нуклеотидной фосфодиэстеразы (PDE3B) посредством фосфорилирования «Ser-273», что приводит к снижению уровней циклического АМФ и ингибированию липолиза (по сходству).Фосфорилирует PIKFYVE на «Ser-318», что приводит к увеличению активности PI 3 P-5 (по сходству). Белок, активирующий ГТФазу Rho, DLC1, является другим субстратом, и его фосфорилирование участвует в регуляции пролиферации и роста клеток. AKT играет роль ключевого модулятора сигнального пути AKT-mTOR, контролируя темп процесса интеграции новорожденных нейронов во время нейрогенеза у взрослых, включая правильное позиционирование нейронов, развитие дендритов и формирование синапсов (по сходству).Сигналы ниже фосфатидилинозитол 3-киназы (PI 3 K) для опосредования эффектов различных факторов роста, таких как фактор роста тромбоцитов (PDGF), эпидермальный фактор роста (EGF), инсулин и инсулиноподобный фактор роста I (IGF) -I) (PubMed: 12176338, PubMed: 12964941). AKT опосредует антиапоптотические эффекты IGF-I (по сходству). Важен для SPATA13-опосредованной регуляции клеточной миграции и сборки и разборки адгезии (PubMed: 19934221). Может участвовать в регуляции развития плаценты (по сходству).Фосфорилирует STK4 / MST1 по Thr-120 и Thr-387, что приводит к ингибированию его: киназной активности, ядерной транслокации, аутофосфорилирования и способности фосфорилировать FOXO3 (PubMed: 17726016). Фосфорилирует STK3 / MST2 по Thr-117 и Thr-384, что приводит к ингибированию его: расщепления, киназной активности, аутофосфорилирования по Thr-180, связывания с RASSF1 и ядерной транслокации (PubMed: 20086174, PubMed: 20231902). Фосфорилирует SRPK2 и усиливает его киназную активность в отношении SRSF2 и ACIN1 и способствует его ядерной транслокации (PubMed: 19592491).Фосфорилирует RAF1 по «Ser-259» и отрицательно регулирует его активность (PubMed: 10576742). Фосфорилирование BAD стимулирует его проапоптотическую активность (PubMed: 10926925). Фосфорилирует KAT6A по «Thr-369», и это фосфорилирование ингибирует взаимодействие KAT6A с PML и отрицательно регулирует его активность ацетилирования по отношению к p53 / TP53 (PubMed: 23431171). Фосфорилирует палладин (PALLD), регулируя организацию цитоскелета и подвижность клеток (PubMed: 20471940). Фосфорилаты запрещают (PHB), играющие важную роль в метаболизме и пролиферации клеток (PubMed: 18507042).Фосфорилирует CDKN1A, фосфорилирование которого по Thr-145 вызывает его высвобождение из CDK2 и цитоплазматическую релокализацию (PubMed: 16982699). Эти недавние открытия показывают, что изоформа AKT1 играет более специфическую роль в подвижности и пролиферации клеток (PubMed: 16139227). Фосфорилирует CLK2, тем самым контролируя выживание клеток под действием ионизирующего излучения (PubMed: 20682768). Фосфорилирует PCK1 по «Ser-90», снижая аффинность связывания PCK1 с оксалоацетатом и изменяя PCK1 на атипичную протеинкиназную активность с использованием GTP в качестве донора (PubMed: 32322062).Информация, подобранная вручную, основанная на утверждениях в научных статьях, для которых нет экспериментальной поддержки.
Ручное утверждение на основе заключения в iСобранная вручную информация, полученная на основе экспериментально охарактеризованного белка.
Ручное утверждение, выведенное из сходства последовательностей с iИнформация, подобранная вручную, для которой опубликованы экспериментальные данные.
Ручное утверждение на основе эксперимента в iЦитируется по: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ CREB1.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ FOXO1.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ RAF1, ВЗАИМОДЕЙСТВИЕ С RAF1.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ ПЛОХОГО, ВЗАИМОДЕЙСТВИЯ С ПЛОХИМ И PKN2.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ MAP3K5, ВЗАИМОДЕЙСТВИЕ С MAP3K5.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ TBC1D4.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ TSC2.
Процитировано для: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, ВЗАИМОДЕЙСТВИЕ С CCDC88A.
Указано для: ФУНКЦИЯ В ФОСФОРИЛИРОВАНИИ CDKN1A.
Процитировано для: ФУНКЦИЯ, ВЗАИМОДЕЙСТВИЕ С STK4 / MST1.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ ЗАПРЕЩАЕТСЯ.
Указано для: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ SRPK2, ВЗАИМОДЕЙСТВИЕ С SRPK2.
Указано для: ФУНКЦИЯ, ВЗАИМОДЕЙСТВИЕ С STK3 / MST2.
Указано для: ФУНКЦИЯ, ВЗАИМОДЕЙСТВИЕ С CLK2.
Указано за: ФУНКЦИЯ ФОСФОРИЛИРОВАНИЯ PALLD.
Указано для: ФУНКЦИЯ, ВЗАИМОДЕЙСТВИЕ С STK3 / MST2.
- «Глюконеогенный фермент PCK1 фосфорилирует INSIG1 / 2 для липогенеза».
Сюй Д., Ван З., Ся Ю., Shao F., Xia W., Wei Y., Li X., Qian X., Lee JH, Du L., Zheng Y., Lv G., Leu JS, Wang H., Xing D., Liang T. , Hung MC, Lu Z.
Nature 580: 530-535 (2020) [PubMed] [Europe PMC] [Abstract]Цитируется по: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ.
- Процитировано для: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (1,4 АНГСТРОМА) OF 1-123, ФУНКЦИЯ, ВЗАИМОДЕЙСТВИЕ С PTDINS (3,4,5) P3 И PTDINS (3,4) P2, МУТАГЕНЗ LYS-14; АРГ-25 И АРГ-86.
- Процитировано по: РЕНТГЕНОВСКАЯ КРИСТАЛЛОГРАФИЯ (0.98 АНГСТРОМЫ) ИЗ 1-121, НАЗНАЧЕНИЕ, ВЗАИМОДЕЙСТВИЕ С PTDINS (1,3,4,5) P4.
Осторожно
В свете сильной гомологии в первичной аминокислотной последовательности долгое время предполагалось, что 3 киназы AKT играют повторяющиеся и перекрывающиеся роли. Более поздние исследования поставили под сомнение избыточность изоформ AKT киназы и вместо этого указали на специфические функции изоформ при различных клеточных событиях и заболеваниях. AKT1 более конкретно участвует в путях выживания клеток путем ингибирования апоптотических процессов; тогда как AKT2 более специфичен для пути передачи сигналов рецептора инсулина.Более того, хотя AKT1 и AKT2 часто участвуют во многих аспектах клеточной трансформации, две изоформы действуют комплементарно противоположным образом. Роль AKT3 менее ясна, хотя, по-видимому, он преимущественно экспрессируется в головном мозге.
В этом подразделе раздела Функция описывается каталитическая активность фермента, т. е. химическая реакция, которую фермент катализирует.
Каталитическая активность i
- ATP + L -seryl- [белок] = ADP + H + + O -phospho- L -seryl- [protein]
Ручное утверждение на основе эксперимента в i
Процитировано для: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] ( ISOFORM 1), КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ.
- Указано для: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] OF 63-480 (ISOFORM 1), ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, СПЕЦИФИЧНОСТЬ ТКАНИ.
Процитировано для: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, ВЗАИМОДЕЙСТВИЕ С CCDC88A.
- «Глюконеогенный фермент PCK1 фосфорилирует INSIG1 / 2 для липогенеза».
Xu D., Wang Z., Xia Y., Shao F., Xia W., Wei Y., Li X., Qian X., Lee JH, Du L., Zheng Y., Lv G., Leu JS, Wang H., Xing D., Liang T., Hung MC, Lu Z.
Nature 580: 530-535 (2020) [PubMed] [Europe PMC] [Abstract]Цитируется по: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ .
Ручное утверждение на основе экспериментов в i
Цитируется по: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] (ISOFORM 1), КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ.
- Указано для: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] OF 63-480 (ISOFORM 1), ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, СПЕЦИФИЧНОСТЬ ТКАНИ.
Процитировано для: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, ВЗАИМОДЕЙСТВИЕ С CCDC88A.
- «Глюконеогенный фермент PCK1 фосфорилирует INSIG1 / 2 для липогенеза.»
Сюй Д., Ван З., Ся Ю., Шао Ф., Ся В., Вэй Ю., Ли Х., Цянь Х., Ли Дж. Х., Ду Л., Чжэн Ю., Львов Г., Leu JS, Wang H., Xing D., Liang T., Hung MC, Lu Z.
Nature 580: 530-535 (2020) [PubMed] [Europe PMC] [Abstract]Цитируется по: FUNCTION, CATALYTIC АКТИВНОСТЬ.
- ATP + L -threonyl- [белок] = ADP + H + + O -phospho- L -threonyl- [protein]
Ручное утверждение, основанное на эксперименте в i
Процитировано для: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] (ISOFORM 1), КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ.
- Указано для: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] OF 63-480 (ISOFORM 1), ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, СПЕЦИФИЧНОСТЬ ТКАНИ.
Процитировано для: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, ВЗАИМОДЕЙСТВИЕ С CCDC88A.
Ручное утверждение, основанное на эксперименте в i
Цитируется по: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] (ISOFORM 1), КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ.
- Указано для: ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕОТИДОВ [MRNA] OF 63-480 (ISOFORM 1), ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, СПЕЦИФИЧНОСТЬ ТКАНИ.
Процитировано для: ФУНКЦИЯ, КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ, ВЗАИМОДЕЙСТВИЕ С CCDC88A.
| Функциональный ключ | Позиция (я) | Описание Действия | Графическое изображение | Длина | 5 | 57 | Марганец 1 Ручное утверждение на основе эксперимента в i
| 1 |
|---|---|---|---|---|---|
| Металлическая связка i | 59 | Марганец 1 Ручное утверждение на основе эксперимента в i
| 1 | ||
| Металлическая связка i | 85 | Марганец 1 Утверждение вручную на основе эксперимента в i
| 1 | ||
| Металлическая связка i | 85 | Марганец 2 Ручное утверждение на основе эксперимента в i
| 1 | ||
| Металлическая связка i | 117 | Марганец 2 Утверждение вручную на основе эксперимента в i
| 1 | ||
Этот подраздел Function используется для ферментов и указывает остатки, непосредственно участвующие в катализе. Активный центр i | 118 | Донор протонов | 1 | ||
| Металлическое связывание i | 167 | Марганец 2 Ручное утверждение на основе эксперимента в i
| 1 | ||
| Металлическая связка i | 241 | Марганец 2 Ручное утверждение на основе эксперимента в i
| 1 |
В этом подразделе раздела Функция описывается взаимодействие между одной аминокислотой и другим химическим веществом. Приоритет отдается аннотации физиологических лигандов. Сайт связывания i | 599 | Аннотация ATPPROSITE-ProRule Подтвержденная вручную информация, созданная автоматической системой аннотаций UniProtKB. Ручное утверждение по правилам i Комбинированные источникиПодтвержденная вручную информация, полученная из экспериментальных и расчетных данных. Ручное утверждение, выведенное из комбинации экспериментальных и вычислительных данных i 2 ПубликацииРучное утверждение, основанное на эксперименте в i
| 1 | Этот подраздел раздела Функция используется для ферментов и указывает остатки, непосредственно участвующие в катализе. Активный сайт i | 688 | Протонный акцептор PROSITE-ProRule annotation Ручное утверждение согласно к правилам i По сходствуРучное утверждение, выведенное из сходства последовательностей с i | 1 | Сайт привязки i | 711 | ATP Комбинированные источники Комбинация экспериментальных и вычисленных вручную утверждений i 1 ПубликацияРучное утверждение на основе эксперимента в i
|

