Таблетки для лечения эндометриоза | Негормональные средства
Лечение эндометриоза — долгий и кропотливый процесс, к сожалению, не всегда успешный. Современные протоколы предполагают комплексный подход, состоящий из оперативного вмешательства и медикаментозной терапии. Препараты для лечения эндометриоза применяют самостоятельно в тех случаях, когда операцию провести невозможно. В основном используют гормоны или их синтетические аналоги.
Наиболее популярными препаратами для лечения эндометриоза на сегодняшний день являются:
- комбинированные оральные контрацептивы (КОК)
- агонисты гонадотропного рилизинг-гормона
- синтетические аналоги тестостерона и прогестерона
Противозачаточные таблетки
Контрацептивы были одними из первых препаратов для лечения эндометриоза. Сначала применяли однофазные прогестины, содержащие исключительно гестагены. Они подавляют процессы пролиферации и циклических изменений эндометрия как в самой матке, так и в эндометриозных очагах. Через некоторое время наблюдается склерозирование и регрессивное развитие очагов. При длительном употреблении эти препараты подавляют синтез гонадотропных гормонов. В результате снижается болевой синдром и другие проявления заболевания. Самым распространенным побочным действием такой терапии являются беспорядочные кровотечения. На сегодняшний день гестагеновые препараты немного утратили свою актуальность, уступив место эстроген-гестагеновым.
Через некоторое время наблюдается склерозирование и регрессивное развитие очагов. При длительном употреблении эти препараты подавляют синтез гонадотропных гормонов. В результате снижается болевой синдром и другие проявления заболевания. Самым распространенным побочным действием такой терапии являются беспорядочные кровотечения. На сегодняшний день гестагеновые препараты немного утратили свою актуальность, уступив место эстроген-гестагеновым.
Среди представителей данной группы на сегодняшний день назначаются следующие препараты:
- Дюфастон
- Норколут
- Премалют
С временем, для уменьшения побочных действий и большей эффективности, стали использовать КОК, содержащие эстрогены и гестагены. Курс подразумевает беспрерывный прием в продолжение 3-6 циклов следующих препаратов:
- Жанин
- Ярина
- Диане 35
- Джес
- Клайра
- Димиа
Препараты создают в организме женщины специфический гормональный фон, имитирующий ложную беременность.
Аналоги мужских гормонов для лечения эндометриоза
Аналоги андрогенов-метилстестостеронов – это первые препараты для лечения эндометриоза, которые начали использоваться в терапии этого заболевания приблизительно сорок лет назад. Основная цель их применения, как и контрацептивов, подавить менструальный цикл и связанную с ним пролиферацию эндометрия. Назначали таблетки для лечения эндометриоза в дозе 5-10 мг на протяжении полугода. Сейчас из этой группы более распространены производные 17а-этинил-тестостерона, например, даназол. Препарат снижает уровень гонадотропного гормона, блокирует в яичниках рецепторы прогестерона, эстрогенов и андрогенов.
У даназола достаточно много побочных действий, в числе которых:
- набор веса
- жировая себорея
- отеки
- угревая сыпь
- атрофия молочных желез
- изменение полового влечения
- симптомы климакса (приливы, нарушение сна, раздражительность, усталость, депрессия, нарушение цикла и кровотечения между менструациями)
- повышение в крови уровня липопротеинов низкой плотности, за счет чего увеличивается риск возникновения холестериновых бляшек в коронарных сосудах, стенокардии, инфаркта
Приблизительно такие же побочные эффекты возникают во время приема синтетических аналогов прогестерона, таких как Провера.
Также в числе этой группы – такие препараты, как:
- Дюфастон (дидрогестерон)
- Визанна (диеногест)
- Оргаметрил (линестренол)
Продолжительность приема препаратов 6-8 месяцев. Довольно часто после окончания курса у женщин наблюдаются рецидивы. Сейчас эта группа лекарств используется редко, их вытеснили противозачаточные таблетки для лечения эндометриоза и более современные препараты.
Агонисты гонадотропного рилизинг-гормона, как препараты для лечения эндометриоза
Эта группа препаратов представляет собой синтетический аналог релизинг-гормонов гипофиза, которые отвечают за синтез латинизирующего и фолликулостимулирующего гормона. Снижение их в крови вызывает уменьшение продукции прогестеронов желтым телом яичников во второй половине цикла. Как следствие – нет пролиферации эндометрия в эндометриозных очагах. Также снижается уровень эстрогенов, что ведет к состоянию искусственной обратимой менопаузы. Вводят препараты путем инъекций ежедневно, либо раз в 28 дней под кожу живота. Есть лекарства в форме спреев, которые впрыскиваются в нос.
Есть лекарства в форме спреев, которые впрыскиваются в нос.
Самыми известными препаратами для лечения эндометриоза из этой группы являются:
- Леупролид ацетат или Люпрон
- Нафарелина ацетат или Синарель
- Гозерелин ацетат или Золадекс.
Хоть на сегодняшний день агонисты гонадотропных рилизинг-гормонов считаются наиболее приемлемыми для медикаментозной терапии эндометриоза, побочные действия у них довольно серьезные. В первую очередь – это симптоматика менопаузы. Она включает:
- приливы
- раздражительность
- нарушения сна
- снижение работоспособности
- перепады настроения вплоть до депрессии
- набор веса
- судороги конечностей и признаки остеопороза вследствие нарушения усвоения кальция
- повышение риска стенокардии и инфаркта
В редких случаях менопауза может оказаться необратимой. Лекарства этой группы не рекомендуют принимать больше, чем шесть месяцев подряд.
Негормональные средства
Чтобы купировать болевой синдром, упадок сил и обильные выделения, назначают такие препараты, как:
- Ибупрофен
- Новиган
- Папаверин
Поддержать иммунитет, улучшить общее самочувствие помогут:
- Циклоферон
- Ретинол
- Аскорбиновая кислота
- Токоферол
- Тиамин
- Пиридоксин
Препараты разных групп
Довольно успешно сейчас начал применяться синтетический аналог стероидных гормонов — гестринон (производный 19-норстероида). Разработали его в конце 70-х годов, первоначально планировали использовать как пролонгированное противозачаточное средство. Гестринон блокирует рецепторы эстрогенов и прогестерона в ткани эндометрия. В результате начинается инволюция его эктопических очагов. Высокая активность препарата позволяет назначать его в небольших дозах, что значительно уменьшает побочные эффекты. За время применения гестринон показал свою эффективность, он хорошо снимает симптомы заболевания и за довольно непродолжительное время позволяет избавиться от небольших очагов эндометриоза.
Разработали его в конце 70-х годов, первоначально планировали использовать как пролонгированное противозачаточное средство. Гестринон блокирует рецепторы эстрогенов и прогестерона в ткани эндометрия. В результате начинается инволюция его эктопических очагов. Высокая активность препарата позволяет назначать его в небольших дозах, что значительно уменьшает побочные эффекты. За время применения гестринон показал свою эффективность, он хорошо снимает симптомы заболевания и за довольно непродолжительное время позволяет избавиться от небольших очагов эндометриоза.
Противопоказан препарат женщинам с почечной недостаточностью и тяжелыми болезнями печени. Основными побочными эффектами являются:
- потливость
- приливы
- увеличение аппетита
- раздражительность
- снижение работоспособности
- отеки
- набор веса
Данные симптомы менее выражены, чем во время приема агонистов гормонов гипофиза. Принимают препарат начиная от первого дня цикла, непрерывно, в течение полугода. У большинства пациенток в это время исчезают менструации, вместе с ними и болевой синдром.
У большинства пациенток в это время исчезают менструации, вместе с ними и болевой синдром.
Сейчас проводятся клинические испытания препарата для лечения эндометриоза мефистон. Он уже успешно используется для проведения медикаментозных абортов. Но было выявлено, что в дозе 50 мг в сутки он способен уменьшать размер эндометриозных очагов и снижать болевой синдром. При этом побочные действия незначительны, проявляются редкими приливами, потерей аппетита, усталостью.
Следует помнить, что таблетки для лечения эндометриоза не способны окончательно вылечить заболевание. Во многих случаях, после окончания курса, у женщин наступают рецидивы. Оперативное вмешательство тоже не является панацеей, и после него болезнь может вернуться. Потому современные протоколы предполагает комплексное лечение, консервативное и оперативное. Все пациентки обязательно должны после завершения курса состоять на учете, проходить раз в год осмотр и, при необходимости, повторять лечение. Проявления эндометриоза сами по себе исчезают при наступлении менопаузы.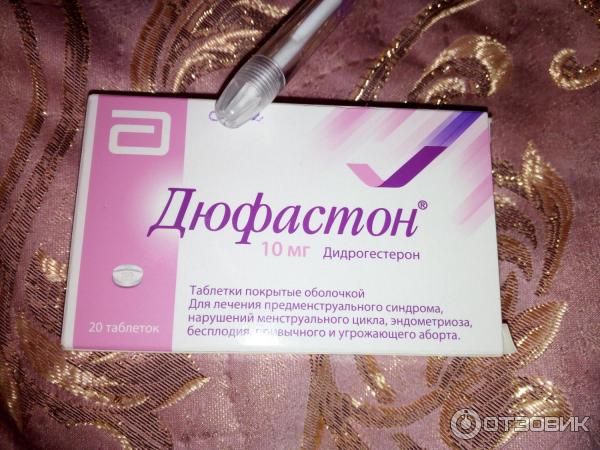
Бесплатный прием репродуктолога
по 30 ноября 2022
Осталось 35 дней
Уважаемые пациенты! Клиника «Центр ЭКО» приглашает вас на
Начните свой путь к счастью — прямо сейчас!
Имя *
Телефон *
E-mail *
Сообщение *
Отправляя данную форму, я подтверждаю, что в соответствии с требованиями “Федерального закона О персональных данных № 152-ФЗ” и в соответствии с Условиями даю согласие на обработку моих персональных данных
Leave this field blank
Другие статьи
Искусственное оплодотворение: что это такое и как его проводят?
Читать статью
Что можно и чего нельзя после ЭКО?
Читать статью
Лицензии и сертификаты
новый опыт негормональной лекарственной терапии
Эндометриоз — это патологический процесс, при котором за пределами полости матки происходит доброкачественное разрастание ткани, по морфологическим и функциональным свойствам подобной эндометрию.
В связи с этим обоснованы все новые исследования, направленные на диагностику и совершенствование существующих методов лечения этого заболевания. Перспективной является разработка препаратов, влияющих на звенья патогенеза через утилизацию эндометриальных клеток, расположенных в нетипичном месте, например путем активации апоптоза. В Российской Федерации разработан негормональный препарат «Эндоферин», который представляет собой комплекс белков, получаемых из фолликулов яичников крупного рогатого скота. Экспериментальные данные исследований препарата Эндоферин показали, что он оказывает ингибирующее влияние на эктопированную эндометриальную ткань, приводя к ее инактивации и атрофии. В экспериментах на животных (cамки кpыc линии Wistar) показано значительное подавление продукции провоспалительных цитокинов γ-интерферона и фактора некроза опухоли альфа (TNF-α) [8].
В Российской Федерации разработан негормональный препарат «Эндоферин», который представляет собой комплекс белков, получаемых из фолликулов яичников крупного рогатого скота. Экспериментальные данные исследований препарата Эндоферин показали, что он оказывает ингибирующее влияние на эктопированную эндометриальную ткань, приводя к ее инактивации и атрофии. В экспериментах на животных (cамки кpыc линии Wistar) показано значительное подавление продукции провоспалительных цитокинов γ-интерферона и фактора некроза опухоли альфа (TNF-α) [8].
Цель исследования — изучение эффективности и безопасности применения негормонального препарата Эндоферин для лечения эндометриоза у пациенток репродуктивного возраста.
Материал и методы
В рамках клинического открытого рандомизированного исследования «Эффективность и безопасность препарата «Эндоферин » (разработчик ЗАО «СКАЙ ЛТД», Россия) на базе ФГБУ «Федеральный научно-клинический центр физико-химической медицины Федерального медико-биологического агентства» (Москва) обследованы и пролечены 34 пациентки с эндометриозом матки.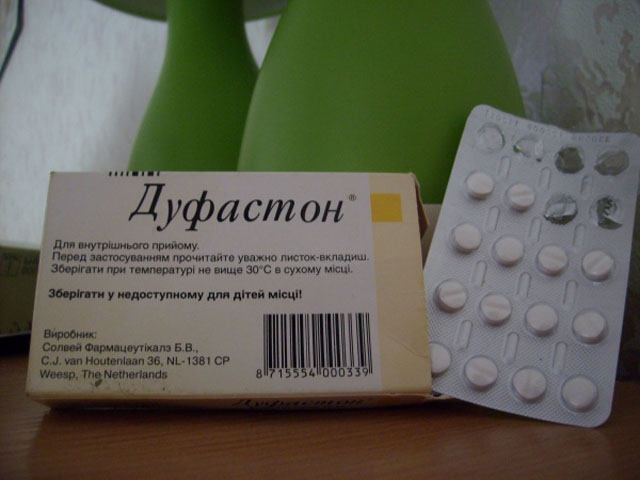
Критерии включения: женщины в возрасте 18—45 лет, с клиническими признаками эндометриоза, применявшие барьерные методы контрацепции; наличие информированного согласия.
Критерии исключения: беременность, лактация, детородный возраст, отсутствие адекватной контрацепции, злокачественные новообразования в анамнезе, острая и хроническая почечная и печеночная недостаточность, наличие декомпенсированных заболеваний или острых состояний, способных существенно повлиять на результат исследования, получение какой-либо иммуномодулирующей или гормональной терапии; участие в каком-либо клиническом испытании в течение последних 6 мес.
Из программы исключены, по разным причинам, 9 пациенток (в 2 случаях диагноз не подтвержден гистологически до лечения, у 6 пациенток гистологический препарат был неинформативным после лечения, у 1 пациентки на фоне приема препарата наступила беременность, которая затем прервана).
Группу сформировали из 25 пациенток в возрасте от 23 до 45 лет (средний возраст 37,1 года), которые полностью прошли обследование до, в процессе и после лечения препаратом Эндоферин, согласно протоколу исследования. Все пациентки получали препарат Эндоферин 0,3 мг внутримышечно 1 раз в день. Курс составлял по 10 инъекций в 1-ю фазу менструального цикла в течение 3 менструальных циклов, всего 30 инъекций. Эндоферин представляет собой лиофилизированный порошок для приготовления раствора по 0,3 мг, 10 флаконов в упаковке; предназначен для внутримышечного введения. Исходно и после 20 инъекций препарата, а также через 3 мес после начала терапии проводили оценку клинической характеристики пациенток. До лечения и через 3 мес после начала лечения определяли уровень эстрадиола в 1-ю фазу менструального цикла и уровень прогестерона во 2-ю фазу; уровень онкомаркера СА-125 [1, 9]; проведены эхография органов малого таза; гистероскопия с биопсией миометрия и его гистологическим и иммуноморфологическим исследованием, выполненным в ФГБНУ «Научно-исследовательский институт морфологии человека» (Москва). Обработка данных проведена с помощью пакета программ SPSS 15.0 (SPSS Inc., США) и AtteStat 10.8.6 (Россия).
Все пациентки получали препарат Эндоферин 0,3 мг внутримышечно 1 раз в день. Курс составлял по 10 инъекций в 1-ю фазу менструального цикла в течение 3 менструальных циклов, всего 30 инъекций. Эндоферин представляет собой лиофилизированный порошок для приготовления раствора по 0,3 мг, 10 флаконов в упаковке; предназначен для внутримышечного введения. Исходно и после 20 инъекций препарата, а также через 3 мес после начала терапии проводили оценку клинической характеристики пациенток. До лечения и через 3 мес после начала лечения определяли уровень эстрадиола в 1-ю фазу менструального цикла и уровень прогестерона во 2-ю фазу; уровень онкомаркера СА-125 [1, 9]; проведены эхография органов малого таза; гистероскопия с биопсией миометрия и его гистологическим и иммуноморфологическим исследованием, выполненным в ФГБНУ «Научно-исследовательский институт морфологии человека» (Москва). Обработка данных проведена с помощью пакета программ SPSS 15.0 (SPSS Inc., США) и AtteStat 10.8.6 (Россия).
Комплексное морфологическое (гистологическое, иммуногистохимическое и морфометрическое) исследование выполнено на кафедре патологической анатомии (заведующий кафедрой, заслуженный врач РФ, проф. , д.м.н. О.В. Зайратьянц) ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. Изучены биоптаты миометрия, полученные от 34 пациенток с аденомиозом до лечения и 29 — после лечения (5 больным повторные биопсии не производились). Повторные биоптаты от 6 (20,7%) пациенток после лечения оказались неинформативными в связи с небольшим объемом миометрия и исключены из исследования, при этом следует отметить, что очаги аденомиоза в них не выявлены. Поэтому нельзя исключить, что у некоторых из этих пациенток также наблюдался положительный эффект терапии. Для гистологического исследования биоптаты фиксировали в 10% нейтральном забуференном формалине, по общепринятой методике обезвоживали и заливали в парафин. Полученные на микротоме из парафиновых блоков гистологические срезы толщиной 3—4 мкм окрашивали гематоксилином и эозином. Иммуногистохимическое исследование для оценки активности очагов аденомиоза выполняли, используя серийные срезы из парафиновых блоков, отобранных в ходе гистологического исследования.
, д.м.н. О.В. Зайратьянц) ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. Изучены биоптаты миометрия, полученные от 34 пациенток с аденомиозом до лечения и 29 — после лечения (5 больным повторные биопсии не производились). Повторные биоптаты от 6 (20,7%) пациенток после лечения оказались неинформативными в связи с небольшим объемом миометрия и исключены из исследования, при этом следует отметить, что очаги аденомиоза в них не выявлены. Поэтому нельзя исключить, что у некоторых из этих пациенток также наблюдался положительный эффект терапии. Для гистологического исследования биоптаты фиксировали в 10% нейтральном забуференном формалине, по общепринятой методике обезвоживали и заливали в парафин. Полученные на микротоме из парафиновых блоков гистологические срезы толщиной 3—4 мкм окрашивали гематоксилином и эозином. Иммуногистохимическое исследование для оценки активности очагов аденомиоза выполняли, используя серийные срезы из парафиновых блоков, отобранных в ходе гистологического исследования. В качестве первичных использовали антитела к маркеру пролиферирующих клеток, негистоновому ядерному белку Ki-67 и сосудисто-эндотелиальному фактору роста СЭФР (клон G153−694 «DAKO», Германия и «Lab Vision», США). Морфометрическим методом для оценки пролиферативной активности клеток определяли долю их ядер с положительной иммуногистохимической реакцией с антителами к Ki-67 (на основании изучения ядер 500 эпителиальных, 500 стромальных клеток и 500 клеток миометрия — лейомиоцитов и эндотелии сосудов, в 10 полях зрения при увеличении микроскопа ×400). Для оценки экспрессии СЭФР использовали общепринятый полуколичественный морфометрический метод (Histoscore), вычисляя коэффициент экспрессии (КЭ). Отмечали интенсивность окраски в баллах от 0 до 3 (отрицательная, слабая, умеренная и выраженная) и подсчитывали процент позитивно окрашенных клеток при каждом значении интенсивности окраски. КЭ рассчитывали для каждого наблюдения по формуле: КЭ = ∑(БхП)/100,
В качестве первичных использовали антитела к маркеру пролиферирующих клеток, негистоновому ядерному белку Ki-67 и сосудисто-эндотелиальному фактору роста СЭФР (клон G153−694 «DAKO», Германия и «Lab Vision», США). Морфометрическим методом для оценки пролиферативной активности клеток определяли долю их ядер с положительной иммуногистохимической реакцией с антителами к Ki-67 (на основании изучения ядер 500 эпителиальных, 500 стромальных клеток и 500 клеток миометрия — лейомиоцитов и эндотелии сосудов, в 10 полях зрения при увеличении микроскопа ×400). Для оценки экспрессии СЭФР использовали общепринятый полуколичественный морфометрический метод (Histoscore), вычисляя коэффициент экспрессии (КЭ). Отмечали интенсивность окраски в баллах от 0 до 3 (отрицательная, слабая, умеренная и выраженная) и подсчитывали процент позитивно окрашенных клеток при каждом значении интенсивности окраски. КЭ рассчитывали для каждого наблюдения по формуле: КЭ = ∑(БхП)/100,
где Б — интенсивность окраски в баллах (от 0 до 3), П — процент окрашенных клеток (от 0 до 100%) для каждого значения Б. Результаты морфометрического исследования обрабатывали статистически с использованием программного обеспечения MS Office Excel и Statistica for Windows 10.0, представляли в виде среднего значения, стандартного квадратического отклонения (М±σ) и применяли метод непараметрического анализа Манна—Уитни. Величину критического уровня значимости принимали равной 0,05, т. е. различия признавали статистически значимыми при p<0,05.
Результаты морфометрического исследования обрабатывали статистически с использованием программного обеспечения MS Office Excel и Statistica for Windows 10.0, представляли в виде среднего значения, стандартного квадратического отклонения (М±σ) и применяли метод непараметрического анализа Манна—Уитни. Величину критического уровня значимости принимали равной 0,05, т. е. различия признавали статистически значимыми при p<0,05.
Результаты и обсуждение
Группу составили 25 женщин с гистологически верифицированными формами эндометриоза матки в возрасте от 23 до 45 лет (в среднем 37,1±6 года), которые получили лечение Эндоферином, согласно протоколу исследования (пациентки находились под клиническим наблюдением в динамике во время лечения и в течение 4 мес после его окончания (визиты 2—5). Диффузная форма заболевания диагностирована у 14 (56%), диффузно-узловая — у 11 (44%) женщин. В «изолированном» виде эндометриоз матки без подтвержденных при ультразвуковом исследовании (УЗИ) изменений малого таза выявлен у 20 (80%) пациенток, в сочетании с миомой матки — у 3 (12%), в сочетании с наружным генитальным эндометриозом (эндометриоз яичников) — у 2 (8%).
Сопутствующие заболевания представлены: патологией щитовидной железы у 9 (36%) больных (их них у 7 женщин обнаружены кисты, у 6 — узлы и у 2 — диффузные изменения), у 19 (76%) — фиброзно-кистозная мастопатия. Средний возраст начала первой менструаций у обследованных пациенток составил 13,2 года. В анамнезе имели беременность (от 1 до 13) 22 (88%) из 25 женщин, из них у 3 — 1 беременность, у 4 — 2, у 10 — 3, у 5 — 4 беременности и более; при этом роды (от 1 до 3) были у 21 (84%) из 25 пациенток, из них 1 раз рожали 14 женщин, 2 раза — 6, 3 раза — 1. Аборты (от 1 до 10) были у 16 (64%) из 25 женщин, из них 1 раз — у 8, 2 раза — у 4, более 2 раз — у 4 пациенток. Самопроизвольное прерывание беременности в анамнезе отмечено у 4 (16%) из 25 женщин. Операции по поводу внематочной беременности перенесли 5 (20%) из 25 женщин. Средняя длительность заболевания составила 4,6 года. Лечение эндометриоза матки ранее получали 6 (24%) женщин (4 — препаратами прогестагена, 2 — аГнРГ). Клинические проявления заболевания на момент начала исследования отмечены у всех пациенток. Скудные кровяные выделения до и после менструации исходно отмечены у 10 (40%) из 25 женщин, обильные менструации — у 20 (80%). Болевой синдром разной интенсивности отмечали 23 (92%) пациентки, выраженный болевой синдром, при котором требовалось применение анальгетиков, был у 16 (64%) больных.
Скудные кровяные выделения до и после менструации исходно отмечены у 10 (40%) из 25 женщин, обильные менструации — у 20 (80%). Болевой синдром разной интенсивности отмечали 23 (92%) пациентки, выраженный болевой синдром, при котором требовалось применение анальгетиков, был у 16 (64%) больных.
Результаты общеклинических анализов и уровни онкомаркеров СА 125, СА 19−9 и РЭА у всех пациенток были в пределах нормы. При первом УЗИ органов малого таза у 100% пациенток установлено наличие эндометриоза матки. Всем 25 больным с целью верификации диагноза проведена гистероскопия (у всех женщин визуально подтвержден аденомиоз) и гистерорезектоскопия с получением образца миометрия. Полученный материал исследован гистологически, и подтвержден диагноз эндометриоза. В ходе наблюдения проведены по 4 эхографических обследования малого таза и 2 раза (до начала и после окончания лечения) — гистерорезектоскопия, а также определение уровней гормонов, онкомаркеров и иммунограммы.
Показателем эффективности лечения считали происходящие на его фоне клинические изменения. Так, если исходно перименструальные кровяные выделения отмечены у 10 (40%) из 25 женщин, то при последующих визитах данный клинический признак не зафиксирован ни у одной из них. Анализ изменения оценки боли, выполненный с помощью критерия Фридмана, показал положительную динамику значений показателя (p<0,001). При попарном сравнении (критерий Уилкоксона) отмечено, что снижение выраженности боли происходило на каждом этапе исследования: в промежутке «визит 2 — визит 3» (p<0,001), «визит 3 — визит 4» (р=0,002), «визит 4 — визит 5» (р=0,025). Анализ изменения оценки обильности менструаций подтвердил в основном положительную динамику значений показателя (критерий Фридмана; p<0,001). При попарном сравнении (критерий Уилкоксона) отмечено, что снижение обильности менструаций происходило в промежутке «визит 2 — визит 3» (p<0,001) и «визит 4 — визит 5» (р=0,011), но не «визит 3 — визит 4» (р=0,109).
Так, если исходно перименструальные кровяные выделения отмечены у 10 (40%) из 25 женщин, то при последующих визитах данный клинический признак не зафиксирован ни у одной из них. Анализ изменения оценки боли, выполненный с помощью критерия Фридмана, показал положительную динамику значений показателя (p<0,001). При попарном сравнении (критерий Уилкоксона) отмечено, что снижение выраженности боли происходило на каждом этапе исследования: в промежутке «визит 2 — визит 3» (p<0,001), «визит 3 — визит 4» (р=0,002), «визит 4 — визит 5» (р=0,025). Анализ изменения оценки обильности менструаций подтвердил в основном положительную динамику значений показателя (критерий Фридмана; p<0,001). При попарном сравнении (критерий Уилкоксона) отмечено, что снижение обильности менструаций происходило в промежутке «визит 2 — визит 3» (p<0,001) и «визит 4 — визит 5» (р=0,011), но не «визит 3 — визит 4» (р=0,109).
Как указано выше, исходно признаки эндометриоза матки при УЗИ выявлены у всех женщин. После лечения при УЗИ отмечена следующая динамика. Выявлено статистически значимое уменьшение ширины матки (р=0,002), которое при попарном сравнении значений, зафиксированных во время отдельных визитов, подтверждено для промежутка «визит 2 — визит 5» (р=0,004). Величина уменьшения ширины матки составила в среднем 4,4 мм (при 95% доверительном интервале ДИ от 1,5 — до 7,2). Выявлено статистически значимое уменьшение объема матки (р<0,001), которое при попарном сравнении значений, во время отдельных визитов, подтверждено для промежутков «визит 2 — визит 3» (р=0,026), «визит 2 — визит 4» (р=0,005) и «визит 2 — визит 5» (р=0,014). Величина уменьшения исходных значений объема матки к визиту 3 составила в среднем 16 мм3 (при 95% ДИ 2—30), к визиту 4 — 22 мм3 (при 95% ДИ 7—36), к визиту 5 — 22 мм3 (при 95% ДИ от 5 до 39). Таким образом, дополнительного уменьшения объема матки к визиту 5 уже не происходило. В относительных единицах (в % от исходного значения) к визиту 3 уменьшение объема матки составило 6,7±19,9%; к визиту 4 — 10,0±21,6% .
После лечения при УЗИ отмечена следующая динамика. Выявлено статистически значимое уменьшение ширины матки (р=0,002), которое при попарном сравнении значений, зафиксированных во время отдельных визитов, подтверждено для промежутка «визит 2 — визит 5» (р=0,004). Величина уменьшения ширины матки составила в среднем 4,4 мм (при 95% доверительном интервале ДИ от 1,5 — до 7,2). Выявлено статистически значимое уменьшение объема матки (р<0,001), которое при попарном сравнении значений, во время отдельных визитов, подтверждено для промежутков «визит 2 — визит 3» (р=0,026), «визит 2 — визит 4» (р=0,005) и «визит 2 — визит 5» (р=0,014). Величина уменьшения исходных значений объема матки к визиту 3 составила в среднем 16 мм3 (при 95% ДИ 2—30), к визиту 4 — 22 мм3 (при 95% ДИ 7—36), к визиту 5 — 22 мм3 (при 95% ДИ от 5 до 39). Таким образом, дополнительного уменьшения объема матки к визиту 5 уже не происходило. В относительных единицах (в % от исходного значения) к визиту 3 уменьшение объема матки составило 6,7±19,9%; к визиту 4 — 10,0±21,6% .
При анализе гормональных показателей выявлено, что распределение значений уровня прогестерона и эстрадиола отличалось от нормального распределения (критерий Шапиро—Уилка: в обоих случаях р<0,001). Анализ динамики исследованных параметров не выявил статистически значимого изменения уровня прогестерона (критерий Уилкоксона, р=0,242), но показал снижение уровня эстрадиола (критерий Уилкоксона, р=0,009) (табл. 1). Таблица 1. Динамика показателей прогестерона и эстрадиола у обследованных больных до и после лечения
Анализ уровня онкомаркеров проводили 3 раза: до, в конце и через 3 мес после окончания лечения по общепринятой методике стандартными наборами. Распределение исходных значений уровня онкомаркеров отличалось от нормального (критерий Шапиро—Уилка: во всех случаях р<0,05). Динамику значений всех показателей анализировали с помощью теста Фридмана. Статистически значимого изменения значений исследуемых онкомаркеров не было (тест Фридмана: для СА125 р=0,123; для РЭА р=0,061; для СА 19−9 р=0,642) .
Гистологические изменения очагов аденомиоза выявляли на основании сравнения биоптатов миометрия, полученных у 23 пациенток до и после проведения курса терапии. Гистологически активность очагов аденомиоза определяли на основании общепринятых критериев [1, 5, 8, 9]. Во всех наблюдениях очаги аденомиоза представлены железистым и стромальным компонентами. Основные гистологические изменения после курса терапии наблюдались в их стромальном компоненте. Выявлены сходные изменения: уменьшение объема, степени васкуляризации и лимфомакрофагальной инфильтрации параллельно с нарастанием склероза. Железистый компонент менялся значительно меньше. Очаги аденомиоза гистологически не претерпели изменений или эти изменения были сомнительными в 10 (43,5%) наблюдениях, активность очагов аденомиоза заметно уменьшилась в 9 (39,1%), а в 4 (17,4%) — они не выявлены даже в материале биопсий, достаточно информативном по объему миометрия. Следует отметить, что в этих 4 наблюдениях граница эндометрия и миометрия утрачивала характерный для аденомиоза «зубчатый» вид за счет врастания базального слоя эндометрия в пограничный мышечный слой. Следовательно, положительный результат лечения подтвержден гистологически у 13 (56,5%) пациенток. Проведенное иммуногистохимическое исследование позволило уточнить число наблюдений с подавленной после курса терапии активностью очагов аденомиоза. В среднем при сопоставлении показателей двух групп биоптатов, полученных у 23 пациенток до и после лечения, в эпителии желез аденомиоза выявлена тенденция к снижению пролиферативной активности очагов Ki-67 (до лечения — 27,4±17,4, после — 24,6±17,3) и продукции СЭФР (до лечения — 1,8±0,7, после — 1,3±0,4). Такая же тенденция наблюдалась в стромальном компоненте и в миометрии (лейомиоцитах и эндотелии сосудов), окружающем очаги аденомиоза по сравнению с отдаленным миометрием (рис. 1, 2, Рис. 1. Экспрессия Ki-67 и СЭФР в очагах аденомиоза до (n=23) и после (n=19) лечения. Показатели экспрессии Ki- 67 представлены в относительных величинах (%), СЭФР — в виде коэффициента экспрессии (КЭ), различия показателей до и после лечения статистически незначимы (р>0,05).
Следовательно, положительный результат лечения подтвержден гистологически у 13 (56,5%) пациенток. Проведенное иммуногистохимическое исследование позволило уточнить число наблюдений с подавленной после курса терапии активностью очагов аденомиоза. В среднем при сопоставлении показателей двух групп биоптатов, полученных у 23 пациенток до и после лечения, в эпителии желез аденомиоза выявлена тенденция к снижению пролиферативной активности очагов Ki-67 (до лечения — 27,4±17,4, после — 24,6±17,3) и продукции СЭФР (до лечения — 1,8±0,7, после — 1,3±0,4). Такая же тенденция наблюдалась в стромальном компоненте и в миометрии (лейомиоцитах и эндотелии сосудов), окружающем очаги аденомиоза по сравнению с отдаленным миометрием (рис. 1, 2, Рис. 1. Экспрессия Ki-67 и СЭФР в очагах аденомиоза до (n=23) и после (n=19) лечения. Показатели экспрессии Ki- 67 представлены в относительных величинах (%), СЭФР — в виде коэффициента экспрессии (КЭ), различия показателей до и после лечения статистически незначимы (р>0,05). Рис. 2. Влияние курса терапии на активность очагов аденомиоза, выявленное с помощью гистологического и иммуногистохимического исследования (n=23). 3).
Рис. 2. Влияние курса терапии на активность очагов аденомиоза, выявленное с помощью гистологического и иммуногистохимического исследования (n=23). 3).
Большой разброс показателей экспрессии Ki-67 и СЭФР в эпителиальном и стромальном компонентах очагов аденомиоза, а также в окружающем их миометрии (рис. 4) Рис. 4. Экспрессия Ki-67 и СЭФР в миометрии до (n=23) и после (n=19) лечения. Показатели экспрессии Ki-67 представлены относительных величинах (%). СЭФР — в виде коэффициента экспрессии (КЭ), различия показателей до и после лечения статистически незначимы (р>0,05). Экспрессия биомаркеров в окружающем очаги аденомиоза миометрии в 1,3—2 раза выше, чем в лейомиоцитах и эндотелии сосудов миометрия, удаленного от них (р>0,05), и в последующем не менялась до и после лечения. не позволил получить статистически значимые (р<0,05) различия между группами наблюдений до и после лечения. Следует отметить, что экспрессия биомаркеров в окружающем очаги аденомиоза миометрии была в 1,3—2 раза выше, чем в лейомиоцитах и эндотелии сосудов миометрия, удаленного от них (р<0,05), и в последнем не менялась до и после лечения (см. рис. 3). Рис. 3. Результаты иммуногистохимического исследования. Распределение очагов аденомиоза по трем группам разной степени активности у пациенток до и после лечения (n=23). * — включая 4 пациенток, у которых очаги аденомиоза после лечения уже не выявлялись. Для выявления изменений активности очагов аденомиоза у конкретных больных показателей экспрессии, изученных биомаркеров ранжированы на три группы со слабой, умеренной и выраженной активностью экспрессии каждого из них. Так, например, для показателя экспрессии Ki-67 границы этих групп составили в эпителии от 4,5 до 18,8% (1-я группа, слабая экспрессия), от 18,9 до 33,0% (2-я группа, умеренно выраженная экспрессия) и от 33,1 до 47,3% (3-я группа, выраженная экспрессия) (табл. 2). Таблица 2. Границы показателей слабой, умеренной и выраженной экспрессии Ki-67 и СЭФР у обследованных больных до и после лечения Примечание. СЭФР — сосудисто-эндотелиальный фактор роста.
рис. 3). Рис. 3. Результаты иммуногистохимического исследования. Распределение очагов аденомиоза по трем группам разной степени активности у пациенток до и после лечения (n=23). * — включая 4 пациенток, у которых очаги аденомиоза после лечения уже не выявлялись. Для выявления изменений активности очагов аденомиоза у конкретных больных показателей экспрессии, изученных биомаркеров ранжированы на три группы со слабой, умеренной и выраженной активностью экспрессии каждого из них. Так, например, для показателя экспрессии Ki-67 границы этих групп составили в эпителии от 4,5 до 18,8% (1-я группа, слабая экспрессия), от 18,9 до 33,0% (2-я группа, умеренно выраженная экспрессия) и от 33,1 до 47,3% (3-я группа, выраженная экспрессия) (табл. 2). Таблица 2. Границы показателей слабой, умеренной и выраженной экспрессии Ki-67 и СЭФР у обследованных больных до и после лечения Примечание. СЭФР — сосудисто-эндотелиальный фактор роста.
Критерием отнесения наблюдения к 3-й группе считали выявление хотя бы одного показателя в ее границах, к 1-й — отсутствие показателей в границах 2-й и 3-й групп, а во 2-ю группу включали оставшиеся случаи.
Сравнение активности очагов аденомиоза с учетом выделения трех групп по степени выраженности экспрессии изученных биомаркеров показало, что их активность после лечения снизилась у 13 (56,5%) и осталась без изменений у 6 (26,1%) больных; еще у 4 (17,4%) — очаги аденомиоза после лечения не обнаружены. Следовательно, иммуногистохимический метод с морфометрической оценкой результата исследования позволил выявить положительный эффект лечения у 17 (73,9%) пациенток, что на 17,4% выше, чем по результатам гистологического метода.
Кроме того, результаты исследования показали, что до лечения очаги аденомиоза с выраженной активностью (3-я группа) были у 8 (34,8%) пациенток, умеренной (2-я группа) — у 10 (43,5%) и слабой (1-я группа) — у 5 (21,7%).
После лечения число наблюдений с очагами аденомиоза с выраженной активностью (3-я группа) снизилось в 4 раза (с 34,8 до 8,7%), с умеренной активностью — в 1,4 раза (с 43,5 до 30,4%), со слабо выраженной активностью выросло в 2,8 раза (вместе с 4 наблюдениями, в которых очаги аденомиоза не выявлены). Повышения активности очагов аденомиоза после лечения не выявлено ни в одном наблюдении (см. рис. 3).
Повышения активности очагов аденомиоза после лечения не выявлено ни в одном наблюдении (см. рис. 3).
Таким образом, поиск новых методов воздействия на множественные звенья патогенеза эндометриоза является обоснованным, поскольку гормональная терапия не всегда дает желаемый результат в связи с необходимостью длительного лечения и наличием побочных эффектов, отражающихся негативно на овариальной функции и минеральной плотности костной ткани [3, 10].
Заключение
На примере лечения 25 пациенток репродуктивного возраста с клиническими, ультразвуковыми и морфологическими признаками эндометриоза показана эффективность нового негормонального препарата Эндоферин. Комплексное клиническое обследование и морфологическое изучение биоптатов миометрия до и после лечения подтвердили положительное влияние курса терапии у 17 (73,9%) из 23 пациенток; число наблюдений, при которых обнаруживались очаги аденомиоза с выраженной активностью, снизилось в 4 раза (с 34,8 до 8,7%), с умеренной — в 1,4 раза (с 43,5 до 30,4%).
Изучение негормональных звеньев этиопатогенеза эндометриоза представляется перспективным направлением. Необходимы дальнейшие исследования для их изучения и обоснования таргетной терапии этого заболевания.
Участие авторов:
Концепция и дизайн исследования — Е.А., Л.А., О.З.
Сбор и обработка материала — О.З., Л.У.
Написание текста — Е.А., О.З.
Редактирование — Е.А., М.С.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Андреева Елена Николаевна — д.м.н., проф., директор Института репродуктивной медицины, зав. отделением эндокринной гинекологии, проф. кафедры эндокринологии ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, проф. каф. репродуктивной медицины и хирургии МГМСУ им. А.И. Евдокимова, Москва. Адрес: 127473, Москва, ул. Делегатская, д. 20, https://orcid.org/0000-0001-8425-0020; тел. 8(916)127-02-68; e-mail: [email protected]
20, https://orcid.org/0000-0001-8425-0020; тел. 8(916)127-02-68; e-mail: [email protected]
Адамян Лейла Владимировна — д.м.н., проф., академик РАН; заведующая кафедрой репродуктивной медицины и хирургии ФПДО ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, заместитель директора по научной работе ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России. Адрес: 127473, Москва, ул. Делегатская, д.20; https://orcid.org/ 0000-0003-4621-2079; тел.: 8(495)438-40-68; e-mail: [email protected]
Зайратьянц Олег Вадимович – д.м.н., проф., заслуженный врач РФ, заведующий кафедрой патологической анатомии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. Адрес: 127473, Москва, ул. Делегатская, д.20, https://orcid.org/ 0000-0003-3606-3823; тел.: 8(903)184-92-17; e-mail: [email protected]
Corresponding autor: Andreeva Elena Nikolaevna,
tel. : 8(916)127-02-68; e-mail: [email protected]
: 8(916)127-02-68; e-mail: [email protected]
Новые подходы к лечению эндометриоза помимо гормональной терапии
1. Фукунага М. Маткоподобное образование в шейке матки: поверхностный эндометриоз шейки матки с выраженной метаплазией гладких мышц? Арка Вирхова 2001 г.; 438:302–305.. doi: 10.1097/MD.0000000000004961. [PubMed] [Google Scholar]
2. Thomas MD, Berek JS, Rinehart RD. Гинекология Берека и Новака. 15-е изд. 2011 г.; Филадельфия: Липпинкотт Уильямс и Уилкинс, 518–519. [Академия Google]
3. Практический комитет Американского общества репродуктивной медицины. Лечение тазовой боли, связанной с эндометриозом: мнение комитета. Fertil Steril 2014; 101:927–935.. doi: 10.1016/j.fertnstert.2014.02.012. [PubMed] [Google Scholar]
4. Geoffron S, Cohen J, Sauvan M, Legendre G, Wattier JM, Darai E, et al.
Медикаментозное лечение эндометриоза: гормональное лечение боли и рецидивов эндометриоидных поражений. Рекомендации CNGOF-HAS по эндометриозу. Gynecol Obstet Fertil Senol 2018; 46:231–247.. doi: 10.1016/j.gofs.2018.02.011. [PubMed] [Google Scholar]
Gynecol Obstet Fertil Senol 2018; 46:231–247.. doi: 10.1016/j.gofs.2018.02.011. [PubMed] [Google Scholar]
5. Michel C, Jacques GD, David SG, Jouko KH, John AR, Robert SC, et al. Пересмотренная классификация эндометриоза Американского общества репродуктивной медицины: 1996 г. Fertil Steril 1997 год; 67:817–821.. doi: 10.1016/s0015-0282(97)81391-x. [PubMed] [Google Scholar]
6. Sterne JA, Hernán MA, Reeves BC, Savovic J, Berkman ND, Viswanathan M, et al. ROBINS-I: инструмент для оценки риска систематической ошибки в нерандомизированных исследованиях вмешательств. БМЖ 2016; 355:i4919.doi: 10.1136/bmj.i4919. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Rudzitis-Auth J, Nickels RM, Menger MD, Laschke MW. Ингибирование циклооксигеназы-2 подавляет рекрутирование эндотелиальных клеток-предшественников в микроциркуляторном русле очагов эндометриоза. Ам Дж. Патол 2018; 188:450–460 .. doi: 10.1016/j.ajpath.2017.10.013. [PubMed] [Google Scholar]
8. Machado DE, Berardo PT, Landgraf RG, Fernandes PD, Palmero C, Alves LM, et al.
Селективный ингибитор циклооксигеназы-2 подавляет рост эндометриоза с антиангиогенным эффектом в модели крыс. Fertil Steril 2010 г.; 93:2674–2679.. doi: 10.1016/j.fertnstert.2009.11.037. [PubMed] [Google Scholar]
Machado DE, Berardo PT, Landgraf RG, Fernandes PD, Palmero C, Alves LM, et al.
Селективный ингибитор циклооксигеназы-2 подавляет рост эндометриоза с антиангиогенным эффектом в модели крыс. Fertil Steril 2010 г.; 93:2674–2679.. doi: 10.1016/j.fertnstert.2009.11.037. [PubMed] [Google Scholar]
9. Nenicu A, Gu Y, Körbel C, Menger MD, Laschke MW. Комбинированная терапия телмисартаном и парекоксибом вызывает регресс эндометриоидных очагов. Бр Дж Фармакол 2017; 174:2623–2635 .. doi: 10.1111/bph.13874. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Dogan E, Saygili U, Posaci C, Tuna B, Caliskan S, Altunyurt S, et al. Регресс эксплантатов эндометрия у крыс, получавших ингибитор циклооксигеназы-2 рофекоксиб. Fertil Steril 2004 г.; 82: Suppl 3: 1115–1120 .. doi: 10.1016/j.fertnstert.2004.06.033. [PubMed] [Google Scholar]
11. Cobellis L, Razzi S, De Simone S, Sartini A, Fava A, Danero S, et al.
Лечение специфическим ингибитором ЦОГ-2 эффективно при лечении боли, связанной с эндометриозом. Eur J Obstet Gynecol Reprod Biol 2004 г.; 116:100–102.. doi: 10.1016/j.ejogrb.2004.02.007. [PubMed] [Google Scholar]
Eur J Obstet Gynecol Reprod Biol 2004 г.; 116:100–102.. doi: 10.1016/j.ejogrb.2004.02.007. [PubMed] [Google Scholar]
12. Бернье М. Безопасность рофекоксиба. Экспертное заключение по лекарственным препаратам 2005 г.; 4:491–499 .. doi: 10.1517/14740338.4.3.491. [PubMed] [Google Scholar]
13. Silveira CGT, Marschner G, Canny GO, Klocke S, Hunold P, Köster F, et al. Нарушение функции белка 1, связывающего Y-бокс, с помощью OSU-03012 предотвращает прогрессирование эндометриоза в моделях in vitro и in vivo. Reprod Sci 2017; 24:67–76.. doi: 10.1177/1933719116649695. [PubMed] [Google Scholar]
14. Оливарес С., Риччи А., Билотас М., Бараньяо Р.И., Мересман Г. Ингибирующее действие целекоксиба и розиглитазона на экспериментальный эндометриоз. Fertil Steril 2011 г.; 96:428–433.. doi: 10.1016/j.fertnstert.2011.05.063. [PubMed] [Google Scholar]
15. Chae U, Min JY, Kim SH, Ihm HJ, Oh YS, Park SY и другие.
Снижение соотношения рецепторов прогестерона В/А в клетках эндометрия под действием фактора некроза опухоли-альфа и перитонеальной жидкости у пациенток с эндометриозом. Йонсей Мед J 2016; 57:1468–1474.. doi: 10.3349/ymj.2016.57.6.1468. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Йонсей Мед J 2016; 57:1468–1474.. doi: 10.3349/ymj.2016.57.6.1468. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Salmeri FM, Lagana AS, Sofo V, Triolo O, Sturlese E, Retto G, et al. Поведение системы фактора некроза опухоли-альфа и рецептор фактора некроза опухоли 1/рецептор фактора некроза опухоли 2 в мононуклеарных клетках, выделенных из перитонеальной жидкости женщин с эндометриозом на разных стадиях. Reprod Sci 2015 г.; 22: 165–172 .. doi: 10.1177/1933719114536472. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Йилдирим Г., Аттар Р., Фичичиоглу С., Каратеке А., Озкан Ф., Есильдаглар Н. Этанерцепт вызывает регрессию эндометриоидных имплантатов у крыс. Arch Gynecol Obstet 2011 г.; 283:1297–1302 .. doi: 10.1007/s00404-010-1543-9. [PubMed] [Google Scholar]
18. Озчелик К., Капар М., Гази Укар М., Чакиотар Т., Озчелик Ф., Туян Ильхан Т.
Являются ли уровни цитокинов в сыворотке, ткани эндометрия и перитонеальной жидкости многообещающим предиктором диагностики эндометриоза-аденомиоза? Clin Exp Obstet Gynecol 2016; 43:569–572. . doi: 10.12891/ceoj.3022.2016. [PubMed] [Google Scholar]
. doi: 10.12891/ceoj.3022.2016. [PubMed] [Google Scholar]
19. Оналан Г., Тома Ю.А., Зейнелоглу Х.Б. Влияние этанерцепта на успех вспомогательных репродуктивных технологий у пациенток с эндометриомой. Гинекол Обстет Инвест 2018; 83: 358–364 .. doi: 10.1159/000484895. [PubMed] [Google Scholar]
20. Альборзи С., Готби С., Парсанежад М.Е., Дехбаши С., Альборзи С., Альборзи М. Терапия пентоксифиллином после лапароскопических операций по поводу различных стадий эндометриоза: проспективное двойное слепое рандомизированное плацебо-контролируемое исследование. J Миним инвазивный гинекол 2007 г.; 14:54–58.. doi: 10.1016/j.jmig.2006.06.024. [PubMed] [Google Scholar]
21. Balasch J, Creus M, Fabregues F, Carmona F, Martinez-Roman S, Manau D, et al.
Пентоксифиллин по сравнению с плацебо при лечении бесплодия, связанного с минимальным или легким эндометриозом: пилотное рандомизированное клиническое исследование. Репродукция гула 1997 год; 12:2046–2050 . . doi: 10.1093/humrep/12.9.2046. [PubMed] [Google Scholar]
. doi: 10.1093/humrep/12.9.2046. [PubMed] [Google Scholar]
22. Креус М., Фабрег Ф., Кармона Ф., дель Пино М., Манау Д., Балаш Дж. Комбинированная лапароскопическая хирургия и терапия пентоксифиллином для лечения бесплодия, связанного с эндометриозом: предварительное исследование. Гул Репрод 2008 г.; 23:1910–1916 .. doi: 10.1093/humrep/den167. [PubMed] [Google Scholar]
23. Kamencic H, Thiel JA. Пентоксифиллин после консервативной хирургии эндометриоза: рандомизированное контролируемое исследование. J Минимальный инвазивный гинекол 2008 г.; 15:62–66.. doi: 10.1016/j.jmig.2007.07.018. [PubMed] [Google Scholar]
24. Skaper SD, Facci L, Fusco M, Della Valle MF, Zusso M, Costa B, et al. Пальмитоилэтаноламид, природный модификатор болезни при невропатической боли. Инфламофармакология 2014; 22:79–94.. doi: 10.1007/s10787-013-0191-7. [PubMed] [Google Scholar]
25. Mattace Raso G, Russo R, Calignano A, Meli R.
Пальмитоилэтаноламид в здоровье и заболеваниях ЦНС. Фармакол Рез 2014; 86:32–41.. doi: 10.1016/j.phrs.2014.05.006. [PubMed] [Google Scholar]
Фармакол Рез 2014; 86:32–41.. doi: 10.1016/j.phrs.2014.05.006. [PubMed] [Google Scholar]
26. Джек Б.Д. Алиамиды: новый подход к лечению воспаления. Новости о наркотиках Перспектива 1996 год; 9:93–98.. [Google Scholar]
27. Брунер-Тран К.Л., Остин К.Г., Тейлор Х.С., Анна С., Кейтлин Х., Дулеба А.Дж. Ресвератрол ингибирует развитие экспериментального эндометриоза in vivo и снижает инвазивность стромальных клеток эндометрия in vitro. Биол Репрод 2011 г.; 84:106–112.. doi: 10.1095/biolreprod.110.086744. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Cobellis L, Castaldi MA, Giordano V, Trabucco E, De Franciscis P, Torella M, et al.
Эффективность ассоциации микронизированного N-пальмитоилэтаноламина (ФЭА)-трансполидатина при лечении хронической тазовой боли, связанной с эндометриозом, после лапароскопической оценки: пилотное исследование. Eur J Obstet Gynecol Reprod Bio 2011 г.; 158:82–86.. doi: 10.1016/j.ejogrb.2011. 04.011. [PubMed] [Академия Google]
04.011. [PubMed] [Академия Google]
29. Джульяно Э., Каньяццо Э., Соаве И., Ло Монте Г., Венгер Дж. М., Марси Р. Адъювантное использование N-пальмитоилэтаноламина и трансполидатина при лечении эндометриоидной боли. Eur J Obstet Gynecol Reprod Biol 2013; 168:209–213.. doi: 10.1016/j.ejogrb.2013.01.009. [PubMed] [Google Scholar]
30. Ricci AG, Olivares CN, Bilotas MA, Bastón JI, Singla JJ, Meresman GF, et al. Оценка естественных методов лечения эндометриоза. Репродукция гула 2013; 28:178–188.. дои: 10.1093/humrep/des369. [PubMed] [Google Scholar]
31. Rudzitisauth J, Menger MD, Laschke MW. Ресвератрол является мощным ингибитором васкуляризации и пролиферации клеток при экспериментальном эндометриозе. Репродукция гула 2013; 28:1339–1347 .. doi: 10.1093/humrep/det031. [PubMed] [Google Scholar]
32. Maia H, Jr, Haddad C, Pinheiro N, Casoy J.
Преимущества комбинации ресвератрола с оральными контрацептивами для лечения боли, связанной с эндометриозом. Int J Женское здоровье 2012 г.; 4:543–549 .. doi: 10.2147/IJWH.S36825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Int J Женское здоровье 2012 г.; 4:543–549 .. doi: 10.2147/IJWH.S36825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. da Silva DM, Gross LA, Neto EPG, Lessey BA, Savaris RF. Использование ресвератрола в качестве адъювантного лечения боли при эндометриозе: рандомизированное клиническое исследование. J Endocr Soc 2017; 1:359–369.. doi: 10.1210/js.2017-00053. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Laschke MW, Schwender C, Scheuer C, Vollmar B, Menger MD. Эпигаллокатехин-3-галлат ингибирует эстроген-индуцированную активацию клеток эндометрия in vitro и вызывает регресс эндометриоидных поражений in vivo. Гул Репрод 2008 г.; 23:2308–2318.. doi: 10.1093/humrep/den245. [PubMed] [Google Scholar]
35. Wang J, Man GCW, Chan TH, Kwong J, Wang CC.
Пролекарство полифенола (-)-эпигаллокатехин-3-галлата зеленого чая (Pro-EGCG) служит новым ингибитором ангиогенеза при раке эндометрия. Рак Летт 2018; 412:10–20.. doi: 10. 1016/j.canlet.2017.09.054. [PubMed] [Google Scholar]
1016/j.canlet.2017.09.054. [PubMed] [Google Scholar]
36. Wang CC, Xu H, Man GCW, Zhang T, Chu KO, Chu CY и др. Пролекарство эпигаллокатехин-3-галлата зеленого чая (Pro-EGCG) в качестве мощного средства против ангиогенеза при эндометриозе у мышей. Ангиогенез 2013; 16:59–69.. doi: 10.1007/s10456-012-9299-4. [PubMed] [Google Scholar]
37. Jiang HQ, Li YL, Jie Z. Влияние рекомбинантного человеческого эндостатина на эндометриоз у мышей. Чин Мед J 2007 г.; 120:1241–1246.. doi: 10.1097/00029330-200707020-00007. [PubMed] [Google Scholar]
38. Becker CM, Sampson DA, Rupnick MA, Rohan RM, Efstathiou JA, Short SM, et al. Эндостатин ингибирует рост очагов эндометриоза, но не влияет на фертильность. Fertil Steril 2005 г.; 84:1144–1155 .. doi: 10.1016/j.fertnstert.2005.04.040. [PubMed] [Google Scholar]
39. Ma Y, He Y.
Изучение генной терапии антиангиогенеза эндостатином при эндометриозе на модели голых мышей. Clin Exp Obstet Gynecol 2014; 41:328–334. . doi: 10.12891/ceog17172014. [PubMed] [Google Scholar]
. doi: 10.12891/ceog17172014. [PubMed] [Google Scholar]
40. Kim JG, Kim JY, Jee BC, Suh CS, Kim SH, Choi YM. Связь между эндометриозом и полиморфизмом эндостатина и сосудистого эндотелиального фактора роста и их уровней в сыворотке у корейских женщин. Fertil Steril 2008 г.; 89:243–245.. doi: 10.1016/j.fertnstert.2007.02.023. [PubMed] [Google Scholar]
41. Laschke M, Elitzsch A, Scheuer C, Holstein J, Vollmar B, Menger M. Рапамицин индуцирует регресс эндометриоидных поражений, ингибируя неоваскуляризацию и пролиферацию клеток. Бр Дж Фармакол 2006 г.; 149:137–144.. doi: 10.1038/sj.bjp.0706857. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Slomovitz BM, Lu KH, Johnston T, Coleman RL, Munsell M, Broaddus RR, et al. Фаза 2 исследования пероральной мишени ингибитора рапамицина эверолимуса у млекопитающих у пациентов с рецидивирующей карциномой эндометрия. Рак 2010 г.; 116:5415–5419.. doi: 10.1002/cncr.25515. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Novella-Maestre E, Carda C, Ruiz-Sauri A, Garcia-Velasco JA, Simon C, Pellicer A.
Идентификация и количественная оценка дофаминового рецептора 2 в эутопическом и эктопическом эндометрии человека: новая молекулярная мишень для терапии эндометриоза. Биол Репрод 2010 г.; 83:866–873.. doi: 10.1095/biolreprod.110.084392. [PubMed] [Google Scholar]
Novella-Maestre E, Carda C, Ruiz-Sauri A, Garcia-Velasco JA, Simon C, Pellicer A.
Идентификация и количественная оценка дофаминового рецептора 2 в эутопическом и эктопическом эндометрии человека: новая молекулярная мишень для терапии эндометриоза. Биол Репрод 2010 г.; 83:866–873.. doi: 10.1095/biolreprod.110.084392. [PubMed] [Google Scholar]
44. Scarpellini F, Sbracia M, Lecchini S, Scarpellini L. Антиангиогенное лечение талидомидом при эндометриозе: пилотное исследование. Fertil Steril 2002 г.; 78:S87.doi: 10.1016/S0015-0282(02)03609-9. [Google Scholar]
45. Hamid AMSA, Madkour WA, Moawad A, Elzaher MA, Roberts MP. Помогает ли каберголин уменьшить размер эндометриомы по сравнению с агонистом ЛГРГ? Проспективное рандомизированное исследование. Arch Gynecol Obstet 2014; 290:677–682 .. doi: 10.1007/s00404-014-3242-4. [PubMed] [Google Scholar]
46. Delgado-Rosas F, Gomez R, Ferrero H, Gaytan F, Garcia-Velasco J, Simon C, et al.
Эффекты спорыньи и агонистов дофамина, не полученных из спорыньи, в экспериментальной мышиной модели эндометриоза. Репродукция 2011 г.; 142:745–755 .. doi: 10.1530/rep-11-0223. [PubMed] [Google Scholar]
Репродукция 2011 г.; 142:745–755 .. doi: 10.1530/rep-11-0223. [PubMed] [Google Scholar]
47. Хинаголидное вагинальное кольцо на уменьшение поражения, оцененное с помощью МРТ у женщин с андометриозом/аденомиозом. ClinicalTrials.gov, 2018. Доступно по ссылке: https://clinicaltrials.gov/ct2/show/{«type»:»clinical-trial»,»attrs»:{«text»:»NCT03749109″,»term_id»:» NCT03749109″}}NCT03749109?cond=эндометриоз&intr=хинаголид&rank=1. [Последний доступ 24 октября 2019 г.] [Google Scholar]
48. Эсфандиари Н., Хазаи М., Ай Дж., Белецкий Р., Готлиб Л., Райан Э. и соавт. Влияние статина на модель эндометриоза in vitro. Fertil Steril 2007 г.; 87:257–262.. doi: 10.1016/j.fertnstert.2006.06.040. [PubMed] [Google Scholar]
49. Насу К., Юге А., Цуно А., Нарахара Х.
Симвастатин ингибирует пролиферацию и сократительную способность эндометриоидных стромальных клеток человека: многообещающее средство для лечения эндометриоза. Fertil Steril 2009 г.; 92: 2097–2099. . doi: 10.1016/j.fertnstert.2009.06.055. [PubMed] [Google Scholar]
. doi: 10.1016/j.fertnstert.2009.06.055. [PubMed] [Google Scholar]
50. Piotrowski PC, Kwintkiewicz J, Rzepczynska IJ, Seval Y, Cakmak H, Arici A, et al. Статины ингибируют рост стромальных клеток эндометрия человека независимо от наличия холестерина. Биол Репрод 2006 г.; 75:107–111.. doi: 10.1095/biolreprod.106.051763. [PubMed] [Google Scholar]
51. Октем М., Эсинлер И., Эроглу Д., Хаберал Н., Байрактар Н., Зейнелоглу Х. Высокие дозы аторвастатина вызывают регрессию эндометриоидных имплантатов: модель на крысах. Гул Репрод 2007 г.; 22:1474–1480 .. doi: 10.1093/humrep/del505. [PubMed] [Google Scholar]
52. Исследование эффективности аторвастатина в облегчении тазовой боли у женщин с эндометриозом. ClinicalTrials.gov, 2018. Доступно по адресу: https://clinicaltrials.gov/ct2/show/{«type»:»clinical-trial»,»attrs»:{«text»:»NCT00675779″,»term_id»:» NCT00675779″}}NCT00675779?titles=Эффективность+исследование+аторвастатина+в+тазовой+боли+облегчения+у+женщин+с+эндометриозом&rank=1. [Последний доступ 24 октября 2019 г.] [Google Scholar]
[Последний доступ 24 октября 2019 г.] [Google Scholar]
53. Zhang GQ, Tao YK, Bai YP, Yan ST, Zhao SP. Ингибирующее действие симвастатина на вызванный окисленными липопротеинами низкой плотности стресс эндоплазматического ретикулума и апоптоз в эндотелиальных клетках сосудов. Чин Мед J 2018; 131:950–955 .. doi: 10.4103/0366-6999.229891. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Брунер-Тран К.Л., Остин К.Г., Дулеба А.Дж. Симвастатин защищает от развития эндометриоза в модели голых мышей. J Клин Эндокринол Метаб 2009 г.; 94:2489–2494.. doi: 10.1210/jc.2008-2802. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Almassinokiani F, Mehdizadeh A, Sariri E, Rezaei M, Almasi A, Akbari H, et al. Эффекты симвастатина в предотвращении рецидивов боли после операции по поводу эндометриоза. Медицинский научный монитор 2013; 19:534–539.. doi: 10.12659/msm.883967. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Waiyaput W, Pumipichet S, Weerakiet S, Rattanasiri S, Sophonsritsuk A. Влияние симвастатина на экспрессию хемоаттрактантного белка-1 моноцитов у больных эндометриозом: рандомизированное контролируемое исследование. Женское здоровье BMC 2017; 17:89.doi: 10.1186/s12905-017-0446-3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Влияние симвастатина на экспрессию хемоаттрактантного белка-1 моноцитов у больных эндометриозом: рандомизированное контролируемое исследование. Женское здоровье BMC 2017; 17:89.doi: 10.1186/s12905-017-0446-3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Yee LD, Williams N, Wen P, Young DC, Lester J, Johnson MV, et al. Пилотное исследование терапии росиглитазоном у женщин с раком молочной железы: влияние краткосрочной терапии на опухолевые ткани и сывороточные маркеры. Клин Рак Рес 2007 г.; 13:246–252 .. doi: 10.1158/1078-0432.CCR-06-1947. [PubMed] [Google Scholar]
58. Блитек А, Шиманская М. Регуляция экспрессии и роль рецепторов, активируемых пролифератором пероксисом (PPAR), в люминальных эпителиальных и стромальных клетках эндометрия свиней. Териогенология 2019; 127:88–101.. doi: 10.1016/j.theriogenology.2019.01.002. [PubMed] [Google Scholar]
59. Демиртюрк Ф., Айтан Х., Калискан А.С., Айтан П., Косеоглу Д.Р.
Влияние агониста гамма-рецептора, активируемого пролифератором пероксисом, розиглитазона на индукцию эндометриоза в экспериментальной модели крыс. J Soc Gynecol Investig 2006 г.; 13:58–62 .. doi: 10.1016/j.jsgi.2005.10.002. [PubMed] [Google Scholar]
J Soc Gynecol Investig 2006 г.; 13:58–62 .. doi: 10.1016/j.jsgi.2005.10.002. [PubMed] [Google Scholar]
60. Лебович Д.И., Мвенда Дж.М., Чай Д.К., Мюллер М.Д., Санти А., Фиссеха С. и соавт. Лиганд рецептора PPAR-гамма вызывает регрессию эндометриальных эксплантатов у павианов: проспективное, рандомизированное, плацебо- и контролируемое исследование. Fertil Steril 2007 г.; 88:1108–1119 .. doi: 10.1016/j.fertnstert.2006.12.072. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Pich C, Meylan P, Mastelic-Gavillet B, Nguyen TN, Loyon R, Trang BK, et al. Индукция паракринной передачи сигналов в метастатических клетках меланомы агонистом PPARgamma розиглитазоном активирует стромальные клетки и усиливает рост опухоли. Рак Res 2018; 78:6447–6461.. doi: 10.1158/0008-5472.can-18-0912. [PubMed] [Google Scholar]
Новая негормональная мишень может сигнализировать об окончании болезненных менструаций
Источник: Science Photo Library/Getty Images Новое генетическое исследование предлагает альтернативный терапевтический вариант лечения болезненного эндометриоза без хирургического вмешательства или гормонов.
«Это захватывающая новая разработка в нашем поиске новых методов лечения эндометриоза, изнурительного и малоизвестного заболевания, от которого страдают 190 миллионов женщин во всем мире. У нас есть многообещающая новая негормональная мишень для дальнейшего изучения и разработки, которая, по-видимому, воздействует непосредственно на воспалительный и болевой компоненты заболевания», — говорит Крина Зондерван, доктор медицинских наук, заведующая кафедрой женского и репродуктивного здоровья, профессор репродуктивной и геномной медицины. эпидемиолог, содиректор Центра помощи при эндометриозе в Оксфорде и соответствующий автор исследования.
Эндометрий представляет собой внутреннюю выстилку стенки матки, которая периодически нарастает и отторгается в течение репродуктивного периода у женщин. У женщин, страдающих эндометриозом, эндометриоподобная ткань разрастается вне матки, что приводит к воспалению, сильным болям в животе, обычно связанным с менструациями, и бесплодию.
Хотя молекулярные причины эндометриоза неизвестны, наследуемость оценивается примерно в 50%, что указывает на сильный генетический компонент. Текущие варианты лечения включают гормональную терапию и хирургическое вмешательство с острой потребностью в негормональной терапии.
Текущие варианты лечения включают гормональную терапию и хирургическое вмешательство с острой потребностью в негормональной терапии.
Ученые из Медицинского колледжа Бейлора, Оксфордского университета, Университета Висконсин-Мэдисон и компании Bayer AG провели генетический анализ людей и макак-резусов — двух видов, у которых спонтанно развивается эндометриоз, — чтобы обнаружить, что ген NPSR1 ( рецептор нейропептида S 1) связан с заболеванием.
Для установления терапевтической эффективности авторы ингибируют NPSR1 на моделях мышей с использованием низкомолекулярного ингибитора SHA 68R и показывают, что это снижает аномальную инфильтрацию ткани эндометрия вне матки и в брюшину — мембрану, покрывающую все органы брюшной полости. — уменьшение воспаления, эндометриоза и боли.
Эти результаты опубликованы в статье в журнале Science Translational Medicine, под названием «Рецептор нейропептида S 1 является мишенью негормонального лечения эндометриоза». Если это подтвердится в испытаниях на приматах и людях, это может привести к созданию негормонального препарата для лечения эндометриоза.
Если это подтвердится в испытаниях на приматах и людях, это может привести к созданию негормонального препарата для лечения эндометриоза.
Исследователи секвенируют ДНК 32 человеческих семей, вносящих вклад в генетический сигнал сцепления на коротком плече седьмой хромосомы, и обнаруживают множество потенциально вредных вариантов низкочастотного кодирования в NPSR1 у лиц с эндометриозом III/IV стадии по сравнению со здоровыми людьми. Авторы видят аналогичную связь в генетическом исследовании 849 макак-резусов.
Крина Зондерван, доктор медицинских наук, заведующая кафедрой женского и репродуктивного здоровья, профессор репродуктивной и геномной эпидемиологии и содиректор Центра лечения эндометриоза в Оксфорде, является соответствующим автором статьи Оксфордская команда под руководством Зондервана, ранее обнаружил генетическую связь с эндометриозом на коротком плече хромосомы 7 путем анализа ДНК семей, состоящих как минимум из трех женщин, страдающих эндометриозом. Команда Бэйлора под руководством старшего автора Джеффри Роджерса, доктора философии, доцента Центра секвенирования генома человека в Бэйлоре, проверила эту генетическую связь в ДНК макак-резусов в Национальном исследовательском центре приматов Висконсина в Университете Висконсин-Мэдисон.
Команда Бэйлора под руководством старшего автора Джеффри Роджерса, доктора философии, доцента Центра секвенирования генома человека в Бэйлоре, проверила эту генетическую связь в ДНК макак-резусов в Национальном исследовательском центре приматов Висконсина в Университете Висконсин-Мэдисон.
«Это один из первых примеров секвенирования ДНК нечеловеческих приматов для проверки результатов исследований на людях и первый, который оказал значительное влияние на понимание генетики распространенных сложных метаболических заболеваний», — говорит Роджерс. «Исследования на приматах действительно помогли обеспечить уверенность на каждом этапе генетического анализа у людей и дали нам мотивацию продолжать поиск этих конкретных генов».
Джеффри Роджерс, доктор философии, доцент Центра секвенирования генома человека в Бэйлоре, является старшим автором статьи. Путем сравнительного исследования 3194 хирургически подтвержденных неродственных пациентов и 7060 нормальных субъектов авторы выявили распространенный вариант вставки/делеции, охватывающий NPSR1 , который тесно связан с эндометриозом III/IV стадии.
