Вирус Коксаки или турецкий грипп
- Главная
- Новости и акции
- Вирус Коксаки или турецкий грипп
4 июля 2019
Семейный отдых с детьми на морском курорте. Что может быть лучше для восстановления сил, укрепления иммунитета и восполнения энергии? Увы, но не всегда и не для всех отдых проходит безболезненно. Поговорим о нашумевшем вирусе Коксаки, так называемом турецком гриппе.
Вирус Коксаки является разновидностью энтеровирусной (кишечной) инфекции. Наиболее уязвимы перед болезнью дети до 5 лет.
Признаки заболевания:
-
температура, поднимающаяся выше 39-40 градусов и не снижающаяся после приема жаропонижающих средств;
-
сыпь на руках и ногах, слизистых рта, напоминающая аллергическую реакцию.

-
у детей заболевание часто сопровождается головной болью, недомоганием и слабостью, ломотой в мышцах;
-
возможны рвота и понос.
Заметив подобные симптомы у ребенка, советуем обратиться к педиатру, чтобы исключить возможность осложнений.
Где можно подхватить вирус Коксаки?
Самые благоприятные условия для распространения данного вируса – жаркая погода и влажный климат. Вопреки распространенному мнению, заразиться можно не только в Турции, но и в странах Европы, Азии и даже в России.
Как передается?
Один из основных способов – контактно-бытовой. Не случайно инфекцию называют «болезнью грязных рук». Заразиться можно через предметы, игрушки, немытые фрукты, овощи, воду (питьевую или в бассейне), песок, землю.
Второй способ – воздушно-капельный.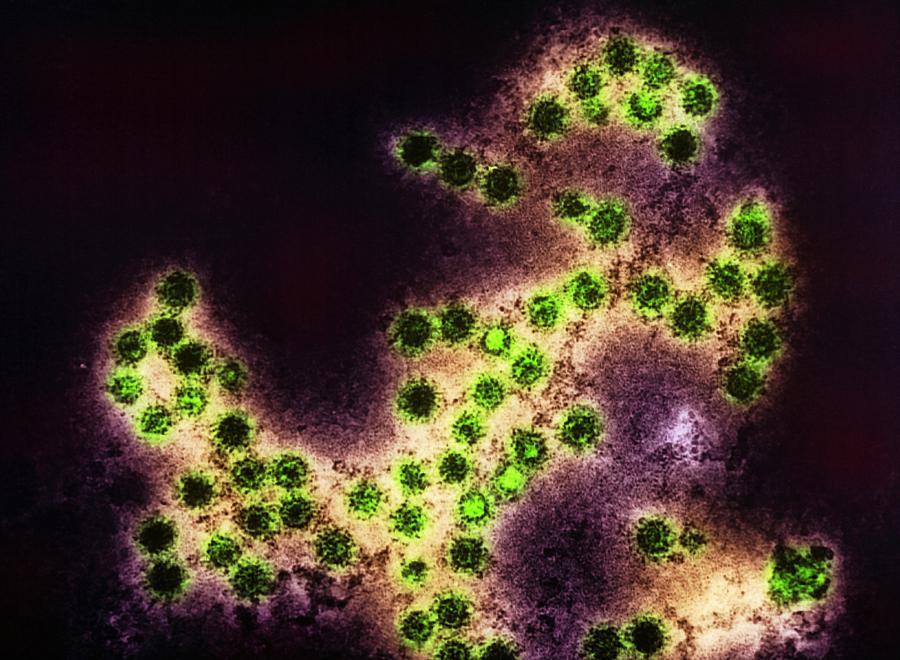 При кашле, чихании и даже разговоре частицы вируса попадают на слизистые полости носа, рта здорового человека. Иногда, чтобы заболеть, достаточно проехать с вирусоносителем в лифте.
При кашле, чихании и даже разговоре частицы вируса попадают на слизистые полости носа, рта здорового человека. Иногда, чтобы заболеть, достаточно проехать с вирусоносителем в лифте.
Вакцины против Коксаки еще нет, поэтому лучший способ защиты – профилактика.
Основные правила:
-
По возможности планируйте отдых с детьми в начале сезона, когда еще нет сильной жары и вирусы распространены минимально.
-
Приучите ребенка регулярно мыть руки и пользоваться антисептическими средствами.
-
Для питья используйте только фильтрованную бутилированную воду.
-
Минимизируйте пребывание в бассейне, старайтесь купаться только в море.
-
С осторожностью посещайте детский клуб, развлекательные мероприятия, особенно в «часы пик».
Фотогалерея
Оформите заявку на сайте, мы свяжемся с вами в ближайшее
время и ответим на все интересующие вопросы. | Запись онлайн |
Поделиться
Вернуться
Информация по энтеровирусной инфекции. | Городская детская поликника №6
Энтеровирусные инфекции у детей — острые инфекционные заболевания, возбудителями которых служат кишечные вирусы (энтеровирусы) из семейства пикорнавирусов. Клинические проявления энтеровирусной инфекции у детей полиморфны; заболевание может протекать в следующих формах: катаральной, гастроэнтеритической, энтеровирусной лихорадки, энтеровирусной экзантемы, герпангины, серозного менингита, миокардита, энцефаломиокардита новорожденных, конъюнктивита, увеита и др. Для обнаружения вирусов в биологических жидкостях используются методы ПЦР, ИФА, РПГА. Этиопатогенетическое лечение энтеровирусной инфекции у детей проводится интерферонами, иммуноглобулинами и другими препаратами.
- • Причины энтеровирусной инфекции у детей
• Классификация энтеровирусной инфекции у детей
• Симптомы энтеровирусной инфекции у детей
• Диагностика энтеровирусной инфекции у детей
• Лечение энтеровирусной инфекции у детей
• Прогноз и профилактика энтеровирусной инфекции у детей
• Цены на лечение
Энтеровирусная инфекция у детей
Энтеровирусные инфекции у детей – обширная группа заболеваний, вызываемых РНК-содержащими неполиомиелитными вирусами (Коксаки, ECHO, неклассифицированными энтеровирусами человека) и полиовирусом. В силу специфичности вызываемых поражений, полиомиелит стоит несколько обособленно в ряду энтеровирусных инфекций у детей, поэтому рассматривается нами отдельно. В рамках данного обзора остановимся на энтеровирусных инфекциях неполиомиелитной этиологии, распространенных среди детей.
В силу специфичности вызываемых поражений, полиомиелит стоит несколько обособленно в ряду энтеровирусных инфекций у детей, поэтому рассматривается нами отдельно. В рамках данного обзора остановимся на энтеровирусных инфекциях неполиомиелитной этиологии, распространенных среди детей.
Наряду с ОРВИ, энтеровирусные инфекции встречаются в педиатрии довольно часто. Ежегодно среди общего количества больных энтеровирусной инфекцией удельный вес детей составляет 80-90%; из них половина случаев заболевания приходится на детей младшего возраста. Учитывая полиморфизм клинических проявлений, энтеровирусные инфекции у детей представляют интерес не только для специалистов в области инфекционных болезней, но иневрологии, гастроэнтерологии, кардиологии, офтальмологии, отоларингологии.
Причины энтеровирусной инфекции у детей
Возбудителями энтеровирусных инфекций неполиомиелитной этиологии у детей выступают вирусы Коксаки А (24 серотипа), Коксаки В (6 серотипов), ECHO (34 серотипа) и неклассифицированные энтеровирусы человека 68-71 серотпипов. Всех неполиомиелитных энтеровирусов объединяет устойчивость к низким температурам (замораживанию, оттаиванию) и быстрая инактивация в условиях высокой температуры (при кипячении) или воздействии хлорсодержащих растворов, йода, формалина, перекиси водорода, УФО.
Всех неполиомиелитных энтеровирусов объединяет устойчивость к низким температурам (замораживанию, оттаиванию) и быстрая инактивация в условиях высокой температуры (при кипячении) или воздействии хлорсодержащих растворов, йода, формалина, перекиси водорода, УФО.
Источниками энтеровирусной инфекции могут служить дети и взрослые, являющиеся вирусоносителями или больными манифестной формой заболевания. Передача инфекции от человека к человеку осуществляется воздушно-капельным или фекально-оральным путями; реже отмечается трансплацентарная передача. Сезонные подъемы заболеваемости энтеровирусными инфекциями среди детей отмечаются в конце лета – начале осени. Наибольшая заболеваемость регистрируется среди детей в возрасте от 3 до 10 лет. Взрослые и дети старшего возраста заболевают реже, что объясняется наличием у них иммунитета, сформировавшегося вследствие бессимптомной инфекции. Наряду со спорадическими случаями и эпидемическими вспышками энтеровирусной инфекции в детских коллективах, встречаются крупные эпидемии, поражающие целые регионы.
Проникновение энтеровирусов в организм происходит через слизистые оболочки пищеварительного и респираторного тракта. Репликация вирусов происходит в лимфоидной ткани, эпителии ротоглотки и ЖКТ, поэтому ранними клиническими проявлениями энтеровирусной инфекции у ребенка могут быть герпетическая ангина, фарингит, диарея и пр. Дальнейшее распространение вирусов по организму происходит гематогенным путем. Обладая органотропностью, энтеровирусы могут поражать нервную ткань, мышцы, покровные ткани, сосуды глаз и т. д. После перенесенной энтеровирусной инфекции у детей формируется типоспецифический иммунитет к тому серологическому типу вируса, которым было вызвано заболевание.
Классификация энтеровирусной инфекции у детей
В зависимости ведущего клинического синдрома, различают типичные и атипичные энтеровирусные инфекции у детей. Типичные формы могут проявляться в виде изолированных или комбинированных поражений: герпетической ангины, катара верхних дыхательных путей,гастроэнтерита, эпидемической миалгии, энтеровирусной лихорадки, энтеровирусной экзантемы, гепатита. Поражение нервной системы при энтеровирусной инфекции у детей может протекать по типу энцефалита, серозного менингита, энцефаломиокардита новорожденных, параличей; поражение сердца – в виде миокардита и перикардита; поражение глаз – в виде геморрагического конъюнктивита и увеита; поражение мочеполовой системы – в форме геморрагического цистита, орхита, эпидидимита. К атипичным формам энтеровирусной инфекции у детей относятся случаи стертого и бессимптомного течения.
Поражение нервной системы при энтеровирусной инфекции у детей может протекать по типу энцефалита, серозного менингита, энцефаломиокардита новорожденных, параличей; поражение сердца – в виде миокардита и перикардита; поражение глаз – в виде геморрагического конъюнктивита и увеита; поражение мочеполовой системы – в форме геморрагического цистита, орхита, эпидидимита. К атипичным формам энтеровирусной инфекции у детей относятся случаи стертого и бессимптомного течения.
С учетом выраженности клинических признаков энтеровирусная инфекция у детей может иметь легкое, среднетяжелое и тяжелое течение. Критериями степени тяжести выступают выраженность местных изменений и интоксикационного синдрома. По характеру течения энтеровирусные инфекции у детей подразделяются на неосложненные и осложненные.
Симптомы энтеровирусной инфекции у детей
Несмотря на полиморфизм клинических проявлений, течению различных энтеровирусных инфекций у детей свойственны некоторые общие черты. Длительность инкубационного периода составляет от 2 до 10 дней (в среднем 2-4 дня).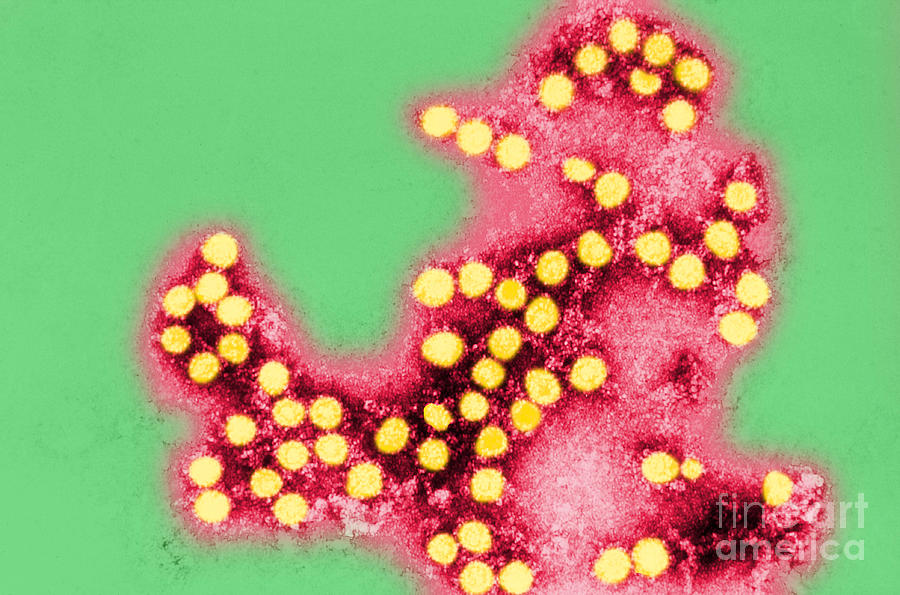 Манифестация заболевания происходит остро, с высокой лихорадки (39-40 °С), озноба, головной боли, слабости, нарушения сна, отсутствия аппетита, повторной рвоты.
Манифестация заболевания происходит остро, с высокой лихорадки (39-40 °С), озноба, головной боли, слабости, нарушения сна, отсутствия аппетита, повторной рвоты.
При любой форме энтеровирусной инфекции у детей отмечается гиперемия кожи лица, шеи и верхней половины туловища, инъекция сосудов конъюнктивы и склеры. Возможно появление полиморфной пятнисто-папулезной сыпи, гиперемии слизистой миндалин дужек и задней стенки глотки, шейного лимфаденита. Считается, что внутриутробное инфицирование энетровирусами может послужить причиной синдрома внезапной детской смерти. Также доказана связь между энтеровирусной инфекцией у детей и развитием сахарного диабета 1 типа.
Кроме общей симптоматики, в клинике различных форм энтеровирусной инфекции у детей присутствуют свои специфические проявления.
Энтеровирусная лихорадка у детей (малая болезнь, летний грипп, трехдневная лихорадка) вызывается разными серотипами вирусов Коксаки и ECHO. Для инфекции характерна острая манифестация с лихорадки, миалгии, умеренных катаральных явлений. У ребенка выражены общие признаки энтеровирусной инфекции: инъекция сосудов склер, гиперемия лица, увеличение лимфоузлов и др.; может отмечаться увеличение печени и селезенки. Данная форма энтеровирусной инфекции у детей протекает легко, обычно не более 2-4 дней. В редких случаях энтеровирусная лихорадка продолжается 1-1,5 недели или имеет волнообразное течение.
У ребенка выражены общие признаки энтеровирусной инфекции: инъекция сосудов склер, гиперемия лица, увеличение лимфоузлов и др.; может отмечаться увеличение печени и селезенки. Данная форма энтеровирусной инфекции у детей протекает легко, обычно не более 2-4 дней. В редких случаях энтеровирусная лихорадка продолжается 1-1,5 недели или имеет волнообразное течение.
Кишечная (гастроэнтеритическая) форма энтеровирусной инфекции чаще встречается у детей до 3-х лет. Заболевание протекает с незначительными катаральными явлениями (ринитом, заложенностью носа, гиперемией слизистых ротоглотки, кашлем) и диспепсическим синдромом (диареей, рвотой, метеоризмом). Тяжелая интоксикация, дегидратация и явленияколита не свойственны. Продолжительность кишечной формы энтеровирусной инфекции у детей составляет 1-2 недели.
Катаральная (респираторная) форма энтеровирусной инфекции у детей протекает по типу ОРЗ. Отмечается кратковременная лихорадка, ринофарингит, ларингит. Возможно развитие синдрома ложного крупа.
Энтеровирусная экзантема, ассоциированная с ECHO и Коксаки-вирусами, характеризуется появлением на высоте лихорадки кожной сыпи. По характеру сыпь может напоминать таковую при скарлатине, кори или краснухе; элементы располагаются преимущественно на коже лица и туловища. Реже встречаются пузырьковые высыпания в полости рта, напоминающие герпес(пузырчатка полости рта). Течение энтеровирусной инфекции у детей благоприятное; сыпь и лихорадка исчезают в течение 1-2 дней.
Эпидемическая миалгия (болезнь Борнхольма, плевродиния) – энтеровирусная инфекция у детей, вызываемая Коксаки и ECHO-вирусами. Ведущим проявлением заболевания служат интенсивные мышечные боли, сопровождающие высокую лихорадку. Чаще дети жалуются на боли в грудной клетке и верхней половине живота, реже – в спине и конечностях. При движении боли усиливаются, вызывая побледнение кожных покровов, обильное потоотделение, тахипноэ. Эпидемическая миалгия требует проведения дифференциальной диагностики с плевритом,острым аппендицитом или перитонитом. Вне болевого приступа дети чувствуют себя значительно лучше. Данная форма энтеровирусной инфекции у детей нередко протекает совместно с герпангиной и серозным менингитом.
Вне болевого приступа дети чувствуют себя значительно лучше. Данная форма энтеровирусной инфекции у детей нередко протекает совместно с герпангиной и серозным менингитом.
Серозный менингит является типичной формой энтеровирусной инфекции у детей. Клиническая картина характеризуется высокой температурой тела, сильной головной болью, повторной рвотой, беспокойством и возбуждением ребенка, бредом и судорогами. Со стороны респираторного тракта отмечаются явления фарингита. С первых дней выражены менингеальные симптомы: положительные симптомы Брудзинского и Кернига, ригидность мышц затылка. Обычно через 3-5 дней симптоматика регрессирует, однако постинфекционная астенияи остаточные явления могут сохраняться в течение 2-3 месяцев.
Полиомиелитоподобная (паралитическая) форма энтеровирусной инфекции у детей является одной из наиболее тяжелых. Как и при полиомиелите, повреждение передних рогов спинного мозга может приводить к развитию вялых параличей и парезов нижних конечностей. В легких случаях прихрамывающая походка, слабость в ногах, снижение мышечного тонуса являются обратимыми и постепенно исчезают через 4-8 недель. При тяжелых формах энтеровирусной инфекции у детей возможен летальный исход вследствие нарушением функции дыхательного и сосудодвигательного центров.
При тяжелых формах энтеровирусной инфекции у детей возможен летальный исход вследствие нарушением функции дыхательного и сосудодвигательного центров.
Энцефаломиокардит новорожденных вызывается вирусами Коксаки типа В и характерен длянедоношенных и детей первых месяцев жизни. На фоне общей симптоматики (вялости, отказа от груди, субфебрилитета) нарастают явления сердечной недостаточности (тахикардия, одышка, цианоз, аритмия, расширение границ сердца и печени). При энцефалите развивается выбухание родничков и судороги. Летальность при данной форме энтеровирусной инфекции среди детей достигает 60-80%.
Геморрагический конъюнктивит вызывается энтеровирусом типа 70. Проявляется светобоязнью, слезотечением, ощущением инородного тела в глазах. Объективно определяются отек и гиперемия конъюнктивы, точечные кровоизлияния. При присоединении вторичной инфекции может развиваться бактериальный конъюнктивит, кератит. Обычно все симптомы энтеровирусной инфекции у детей стихают через 10-14 дней.
Энтеровирусный увеит преимущественно поражает детей 1-го года жизни. Данная форма энтеровирусной инфекции протекает с лихорадкой, интоксикацией, кишечным и респираторным синдромом. Поражение сосудистой оболочки глаза носит стойкий характер и может привести к дистрофии радужки, помутнению роговицы, развитию увеальной катаракты и глаукомы, субатрофии глазного яблока.
Особенности течения герпетической ангины проанализированы в соответствующем обзоре.
Диагностика энтеровирусной инфекции у детей
Энтеровирусные инфекции у детей диагностируются на основании типичного симптомокомплекса с учетом сезонности и эпидемиологических данных. Обязательным для установления диагноза является лабораторное подтверждение энтеровирусной инфекции у детей: обнаружение РНК энтеровируса методом ПЦР, определение титра специфических антител с помощью ИФА, РСК или РПГА и др.
Лабораторная верификация возбудителей может проводиться в различных биологических жидкостях: в крови, отделяемом конъюнктивы, смыве из носоглотки, соскобах с кожных высыпаний, образцах фекалий, спинномозговой жидкости (при наличии показаний длялюмбальной пункции), биоптатах органов и др.
В зависимости от ведущего клинического синдрома дети могут нуждаться в консультации педиатра, детского кардиолога, детского невролога, детского отоларинголога, детского офтальмолога и др. специалистов.
Различные формы энтеровирусной инфекции у детей требуют проведения дифференциальной диагностики с полиомиелитом, корью, краснухой, скарлатиной, эпидемическим паротитом, ОРВИ, ОКИ.
Лечение энтеровирусной инфекции у детей
Лечение легких изолированных форм энтеровирусной инфекции у детей проводится амбулаторно; госпитализация требуется при серозном менингите, энцефалите, миокардите, тяжелых комбинированных поражениях. В лихорадочном периоде показаны покой, постельный режим, достаточный питьевой режим.
Этиопатогенетическая терапия энтеровирусной инфекции у детей включает применение рекомбинантных интерферонов (альфа интерферона), интерфероногенов ( оксодигидроакридинилацетата, меглюмина акридонацетата), полиспецифических иммуноглобулинов (при тяжелом течении).
При миокардите, менингите и др. формах показано назначение глюкокортикостероидов. Одновременно проводится симптоматическое лечение (прием жаропонижающих, дезинтоксикационная терапия, орошение полости носа, полоскание зева и др.).
формах показано назначение глюкокортикостероидов. Одновременно проводится симптоматическое лечение (прием жаропонижающих, дезинтоксикационная терапия, орошение полости носа, полоскание зева и др.).
Прогноз и профилактика энтеровирусной инфекции у детей
В большинстве случаев энтеровирусная инфекция у детей заканчивается реконвалесценцией. Наиболее серьезными в отношении прогноза являются энтеровирусные энцефалиты, энцефаломиокардиты новорожденных, менингиты, генерализованная инфекция, присоединение бактериальных осложнений.
Дети, заболевшие энтеровирусной инфекцией, подлежат изоляции; на контактных лиц накладывается карантин на 2 недели. В эпидемиологическом очаге проводятся дезинфекционные мероприятия. Ввиду большого разнообразия энтеровирусов специфическая вакцина против инфекции не разработана. Неспецифическая профилактика включаетэндоназальную инстилляцию лейкоцитарного интерферона детям и взрослым, контактировавшим с больным энтеровирусной инфекцией.
Источник: http://www. krasotaimedicina.ru/diseases/children/enterovirus-infection
krasotaimedicina.ru/diseases/children/enterovirus-infection
Скачать данную статью.
Вирус Коксаки группы B — StatPearls
Непрерывное обучение
Вирус Коксаки B принадлежит к семейству пикорнавирусов и может вызывать различные заболевания, включая желудочно-кишечные заболевания, миокардит, пневмонию, асептический менингит, энцефалит и гепатит. В этом задании описывается оценка и лечение инфекции Коксаки группы B, а также подчеркивается роль межпрофессиональной команды в улучшении ухода за пациентами с этим заболеванием.
Цели:
Опишите этиологию вирусных инфекций Коксаки группы В.
Обзор симптомов заражения вирусами группы Коксаки В.
Кратко опишите соответствующее лечение вирусных инфекций Коксаки группы B.
Объясните, как межпрофессиональная бригада должна знать о возможных тяжелых осложнениях и предвидеть необходимость поддерживающей терапии в таких ситуациях.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.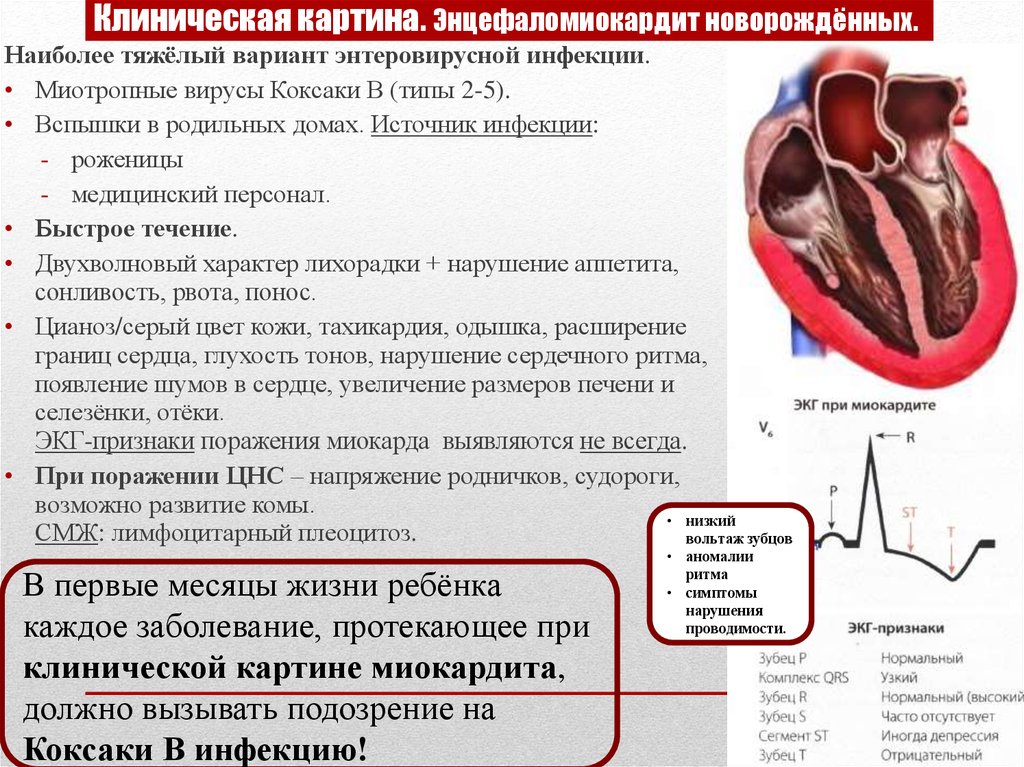
Введение
Вирус Коксаки группы B является представителем семейства Picornaviridae, рода Enterovirus. Энтеровирус (ЭВ) представляет собой одноцепочечный РНК-вирус с положительной чувствительностью, названный в честь его кишечного или желудочно-кишечного пути передачи [1]. Прежде чем они были переклассифицированы как EV A-D, энтеровирусы были классифицированы в соответствии с их патогенезом у людей и лабораторных животных на четыре группы: полиовирусы, вирусы Коксаки А (CA), вирусы Коксаки B (CB) и эховирусы.[2] К видам энтеровирусов, вызывающих заболевания у людей, относятся энтеровирусы A-D и риновирусы A-C.
Вирусы Коксаки представляют собой вирусы без оболочки с линейной одноцепочечной РНК. Было отмечено, что вирусы Коксаки группы А вызывают вялый паралич, который был вызван генерализованным миозитом. Напротив, вирусы Коксаки группы В вызывали спастический паралич из-за дегенерации нейронной ткани и очагового повреждения мышц. Распознаются не менее двадцати трех серотипов (1-22, 24) группы А и шести серотипов (1-6) группы В: CV-B1, CV-B2, CV-B3, CV-B4, CV-B5, и CV-B6. [3] Вирусы Коксаки группы B вызывают инфекцию сердца, плевры, поджелудочной железы и печени, вызывая плевродинию, миокардит, перикардит и гепатит.[4] Он также вызывает системное заболевание новорожденных.[5] В этой статье основное внимание будет уделено вирусу Коксаки подгруппы B.
[3] Вирусы Коксаки группы B вызывают инфекцию сердца, плевры, поджелудочной железы и печени, вызывая плевродинию, миокардит, перикардит и гепатит.[4] Он также вызывает системное заболевание новорожденных.[5] В этой статье основное внимание будет уделено вирусу Коксаки подгруппы B.
Этиология
Вирус Coxsackie Group B является ответственным за несколько синдромов:
Вирусный продром, включая лихорадку, усталость, недовольство, миалгия, желудочно -кишечная расстройство
- 1111114
- 1111111114
- 11114955
- 111149114
- 11111114
- 111114
- 11114
- 11114
- 11114
- 11114
- 114 911491149114
- 4
- 4
- 4
- 14
- 1114
- 4
- 1114
- 114
- 114
- 14.
Асептический менингит
Энцефалит
Плеродиния
Миоперициридит
Панкреатит, ведущий к разрушению бета-клеток и диабету типа один диабет.
Эпидемиология
Группа Коксаки В одинаково поражает мужчин и женщин и может встречаться во всем мире. Заражение обычно происходит в теплые летние месяцы.[8][9] В целом популяционные тенденции изучаются в соответствии с синдромами присутствующих заболеваний, а не с конкретными серотипами. В течение 2–3 лет коксакивирус B1 был преобладающим серотипом. Инфекции, вызванные вирусом Коксаки В4, были связаны с более высокой смертностью, чем другие серотипы. Возраст пациента, по-видимому, играет роль в развитии различных типов проявлений инфекции.[10] Дети и взрослые, как правило, имеют более легкое течение болезни с меньшей вероятностью тяжелых осложнений, чем новорожденные.[11][6]
Заражение обычно происходит в теплые летние месяцы.[8][9] В целом популяционные тенденции изучаются в соответствии с синдромами присутствующих заболеваний, а не с конкретными серотипами. В течение 2–3 лет коксакивирус B1 был преобладающим серотипом. Инфекции, вызванные вирусом Коксаки В4, были связаны с более высокой смертностью, чем другие серотипы. Возраст пациента, по-видимому, играет роль в развитии различных типов проявлений инфекции.[10] Дети и взрослые, как правило, имеют более легкое течение болезни с меньшей вероятностью тяжелых осложнений, чем новорожденные.[11][6]
Энтеровирусы являются основной причиной вирусного менингита у взрослых, но большинство случаев возникает у младенцев и детей в возрасте до пяти лет.[12][13][14] Энцефалит встречается во всех возрастных группах с умеренной склонностью к детскому и юношескому возрасту. Плевродиния наиболее распространена среди взрослых.[10] Из 21 вируса, который может вызывать сердечно-сосудистые заболевания, вирус Коксаки В является основной причиной вирусного миокардита, особенно у новорожденных и детей младшего возраста.
Патофизиология
Патогенез вирусов Коксаки зависит от специфических взаимодействий вирус-рецептор. Эти взаимодействия определяют локализацию и происхождение первичной инфекции, а также влияют на распространение вируса в другие органы на поствиремической стадии. Коксакивирус-аденовирусный рецептор (CAR) и фактор ускорения распада (DAF) являются известными рецепторными белками, которые играют важную роль в патогенезе инфекций, вызванных вирусом Коксаки В.
DAF экспрессируется в эпителиальных и эндотелиальных клетках. CAR присутствует во вставочных дисках, которые представляют собой структуры, связывающие клетки миокарда и передающие сигналы между клетками. Взаимодействия с этими рецепторами облегчают проникновение вируса Коксаки В в клетки миокарда, что в конечном итоге приводит к миокардиту.
Инфекции ЦНС могут возникать путем гематогенного распространения или аксонального транспорта. Репликация вируса или активация аутоиммунной системы могут привести к повреждению тканей ЦНС. Хотя точные механизмы, вызывающие повреждение и гибель клеток, остаются неизвестными, считается, что определенную роль играют вирусное ингибирование производства клеточных макромолекул, токсичность вирусных белков и вызванный вирусом апоптоз.
Хотя точные механизмы, вызывающие повреждение и гибель клеток, остаются неизвестными, считается, что определенную роль играют вирусное ингибирование производства клеточных макромолекул, токсичность вирусных белков и вызванный вирусом апоптоз.
Анамнез и физикальный
Симптомы заражения вирусами Коксаки В включают головную боль, лихорадку, боль в горле, желудочно-кишечные расстройства, сильную усталость, боль в груди и миалгию. Тяжесть инфекции варьируется в зависимости от возраста хозяина и иммунного статуса, а также от синдрома присутствующего заболевания и пораженной системы органов. Инкубационный период также различается в зависимости от синдрома, и максимальная передача происходит в течение первых двух недель после заражения.[19]
Экзантема представляет собой пятнисто-папулезные высыпания, окруженные эритематозным ореолом. Они появляются на лице и шее, а затем распространяются на туловище и конечности в течение суток. Поражения щадят ладони и подошвы.
 Они могут быть связаны с петехиями и цервикальной лимфаденопатией.[20][21]
Они могут быть связаны с петехиями и цервикальной лимфаденопатией.[20][21]Асептический менингит проявляется лихорадкой и раздражительностью у младенцев и лихорадкой, головной болью, ригидностью затылочных мышц, тошнотой и рвотой у детей и взрослых.[22][23]
Энцефалит проявляется спутанностью сознания и/или судорогами. Тяжесть может варьироваться от легкой до смертельной болезни.
Известно, что вирусы Коксаки связаны с эпидемической плевродинией или болезнью Борнхольма. Плевродиния характеризуется болью в груди, которая усиливается при дыхании, и ее часто можно спутать с инфарктом миокарда. Боль может длиться от двух дней до двух недель. Многие пациенты имеют сопутствующую лихорадку, боль в животе и болезненность мышц туловища и конечностей.[20]
Миоперикардит вызывает воспаление субэпикардиального миокарда и перикарда. Больные жалуются на одышку, боль в груди и нерегулярное сердцебиение. Болезнь может длиться от нескольких часов до нескольких месяцев.
 Тяжесть варьируется от бессимптомной до фульминантной сердечной недостаточности из-за дилатационной кардиомиопатии и иногда остановки сердца.[24]
Тяжесть варьируется от бессимптомной до фульминантной сердечной недостаточности из-за дилатационной кардиомиопатии и иногда остановки сердца.[24]Панкреатит проявляется болями в животе, тошнотой, рвотой и повышением уровня ферментов поджелудочной железы амилазы и липазы. Тяжелый панкреатит из-за Группа Коксаки B может привести к разрушению бета-клеток поджелудочной железы и развитию сахарного диабета первого типа.[7]
Оценка
Обычно клиническая диагностика — это все, что требуется из-за самокупирующегося течения инфекции. Однако в более тяжелых случаях, таких как миокардит, асептический менингит, энцефалит и неонатальная инфекция, иногда может потребоваться идентификация конкретного микроорганизма. Кроме того, лабораторная диагностика может быть полезна в эпидемиологическом отношении, особенно во время эпидемий.
Энтеровирусная инфекция диагностируется в основном с помощью ОТ-ПЦР, вирусных культур или серологических тестов. ОТ-ПЦР является наиболее часто используемым методом.[25] Он может обнаруживать РНК энтеровируса в выделениях из дыхательных путей, моче, сыворотке и спинномозговой жидкости. Хотя ОТ-ПЦР является быстрым и чувствительным тестом, он не может определить серотип.[26][27] Вирусные культуры позволяют типировать изолят, но требуют много времени и чувствительности от шестидесяти пяти до семидесяти пяти процентов.[28] Серологические тесты зарезервированы для диагностики энтеровирусной инфекции при подозрении на определенный серовар.[29]]
ОТ-ПЦР является наиболее часто используемым методом.[25] Он может обнаруживать РНК энтеровируса в выделениях из дыхательных путей, моче, сыворотке и спинномозговой жидкости. Хотя ОТ-ПЦР является быстрым и чувствительным тестом, он не может определить серотип.[26][27] Вирусные культуры позволяют типировать изолят, но требуют много времени и чувствительности от шестидесяти пяти до семидесяти пяти процентов.[28] Серологические тесты зарезервированы для диагностики энтеровирусной инфекции при подозрении на определенный серовар.[29]]
Other appropriate investigations include:
CBC
Comprehensive metabolic profile
Erythrocyte sedimentation rate
Chest X-ray
Abdominal CT
Head CT
Люмбальная пункция для подсчета клеток спинномозговой жидкости, посева и чувствительности, окрашивания по Граму, определения белка и глюкозы, вирусной ПЦР
Молочная кислота
Прокальцитонин
Лечение/управление
Вирус самоограничивается без специального рекомендованного лечения. Симптоматическая и поддерживающая терапия ассоциированных синдромов уместна. Пациентам с неврологическими осложнениями могут потребоваться противоэпилептические препараты при судорогах и седация при делирии.[30] Начальные поддерживающие меры при миокардите включают дополнительный кислород и инфузионную терапию. Кроме того, пациентам может также потребоваться терапия сердечной недостаточности и лечение аритмий.
Симптоматическая и поддерживающая терапия ассоциированных синдромов уместна. Пациентам с неврологическими осложнениями могут потребоваться противоэпилептические препараты при судорогах и седация при делирии.[30] Начальные поддерживающие меры при миокардите включают дополнительный кислород и инфузионную терапию. Кроме того, пациентам может также потребоваться терапия сердечной недостаточности и лечение аритмий.
Дифференциальный диагноз
При различных вирусных инфекциях наблюдается совпадение симптомов. Следует помнить о нескольких важных вирусах, которые имитируют группу Коксаки В, у которых могут быть целевые планы лечения или другие серьезные осложнения. К ним относятся:
Вирус иммунодефицита человека
Гепатиты В и С предрасполагают к гепатоцеллюлярной карциноме0005
Measles causes subacute sclerosis panencephalitis
Herpes simplex virus encephalitis
Rabies encephalitis
Poliomyelitis
Epstein Barr virus causes splenomegaly and possible splenic rupture
Цитомегаловирус
Прогноз
Инфекции обычно купируются самостоятельно.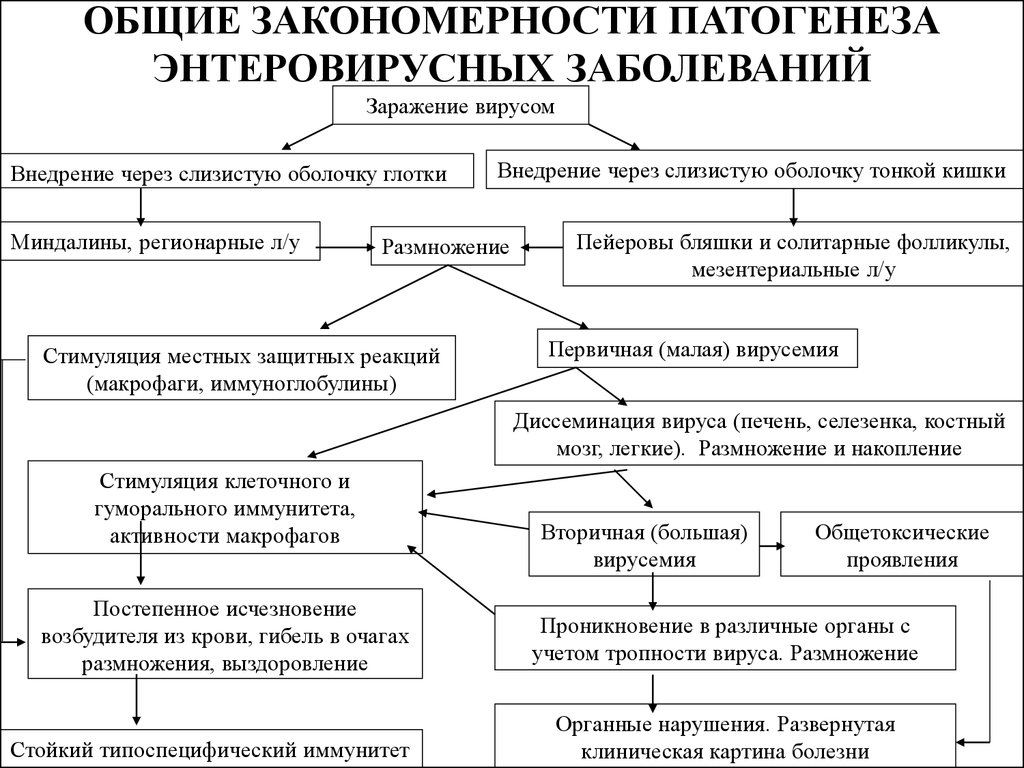 Большинство синдромов приводят к полному выздоровлению, за некоторыми исключениями. При асептическом менингите, вызванном Энтеровирус имеет отличный прогноз, некоторые пациенты могут испытывать недомогание и утомляемость в течение пары недель. Младенцы и дети, страдающие асептическим менингитом, могут иметь легкие умственные осложнения. Миокардиальные синдромы иногда могут приводить к неблагоприятным исходам.[30]
Большинство синдромов приводят к полному выздоровлению, за некоторыми исключениями. При асептическом менингите, вызванном Энтеровирус имеет отличный прогноз, некоторые пациенты могут испытывать недомогание и утомляемость в течение пары недель. Младенцы и дети, страдающие асептическим менингитом, могут иметь легкие умственные осложнения. Миокардиальные синдромы иногда могут приводить к неблагоприятным исходам.[30]
Осложнения
Осложнения возникают при инфекциях, поражающих центральную нервную систему, что приводит к асептическому менингиту и энцефалиту, а также поражению сердца, приводящему к вирусному миоперикардиту и фульминантной сердечной недостаточности.[1][6]
Сдерживание и просвещение пациентов
Поскольку никакое лечение или вакцина не защищает от заражения вирусом Коксаки B , медицинские работники должны уделять особое внимание продвижению стратегий инфекционного контроля, таких как поддержание эффективной гигиены рук и окружающей среды. [31] У беременных женщин могут развиться перинатальные осложнения, такие как тяжелое неонатальное заболевание, если они контактируют с людьми с энтеровирусной инфекцией, и поэтому им следует избегать контакта с кем-либо с подозрением на инфекцию.[6]
[31] У беременных женщин могут развиться перинатальные осложнения, такие как тяжелое неонатальное заболевание, если они контактируют с людьми с энтеровирусной инфекцией, и поэтому им следует избегать контакта с кем-либо с подозрением на инфекцию.[6]
Улучшение результатов работы бригады здравоохранения
Чтобы улучшить результаты лечения энтеровирусных инфекций, межпрофессиональная бригада должна знать о возможных тяжелых осложнениях и предвидеть необходимость поддерживающей терапии в таких ситуациях. Также крайне важно практиковать эффективное мытье рук и поддерживать надлежащую санитарную обработку, чтобы уменьшить передачу заболеваний среди пациентов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Каталожные номера
- 1.
Кюль Ю., Паушингер М., Нуциас М., Сиберг Б., Бок Т., Ласснер Д., Поллер В.
 , Кандольф Р., Шультайс Х.П. Высокая распространенность вирусных геномов и множественные вирусные инфекции в миокарде взрослых с «идиопатической» дисфункцией левого желудочка. Тираж. 2005 22 февраля; 111 (7): 887-93. [PubMed: 15699250]
, Кандольф Р., Шультайс Х.П. Высокая распространенность вирусных геномов и множественные вирусные инфекции в миокарде взрослых с «идиопатической» дисфункцией левого желудочка. Тираж. 2005 22 февраля; 111 (7): 887-93. [PubMed: 15699250]- 2.
ЭНТЕРОВИРУСЫ; Комитет по энтеровирусам, Национальный фонд детского паралича. Am J Общественное здравоохранение Здоровье наций. 1957 декабря; 47 (12): 1556-66. [Бесплатная статья PMC: PMC1551439] [PubMed: 13487867]
- 3.
Адамс М.Дж., Лефковиц Э.Дж., Кинг А.М., Харрах Б., Харрисон Р.Л., Ноулз Н.Дж., Кропински А.М., Крупович М., Кун А.Р., Мушегян Ниберт М., Сабанадзович С., Санфасон Х., Сидделл С.Г., Симмондс П., Варсани А., Зербини Ф.М., Горбаленя А.Е., Дэвисон А.Дж. Голосование по таксономическим предложениям в Международный комитет по таксономии вирусов (2016 г.). Арх Вирол. 2016 Октябрь; 161 (10): 2921-49. [Бесплатная статья PMC: PMC7086986] [PubMed: 27424026]
- 4.
Lim BK, Ju ES, Lao DH, Yun SH, Lee YJ, Kim DK, Jeon ES.
 Разработка системы диагностического анализа энтеровирусов для диагностики вирусного миокардита у людей. Микробиол Иммунол. 2013 Апрель; 57 (4): 281-7. [PubMed: 23586632]
Разработка системы диагностического анализа энтеровирусов для диагностики вирусного миокардита у людей. Микробиол Иммунол. 2013 Апрель; 57 (4): 281-7. [PubMed: 23586632]- 5.
Мюленбахс А., Бхатнагар Дж., Заки С.Р. Тканевая тропность, патология и патогенез энтеровирусной инфекции. Джей Патол. 2015 янв; 235(2):217-28. [PubMed: 25211036]
- 6.
Каплан М.Х., Кляйн С.В., Макфи Дж., Харпер Р.Г. Коксакивирусные инфекции группы В у детей младше трех месяцев: серьезное детское заболевание. Преподобный Заражает Дис. 1983 ноябрь-декабрь; 5(6):1019-32. [PubMed: 6318288]
- 7.
Sioofy-Khojine AB, Lehtonen J, Nurminen N, Laitinen OH, Oikarinen S, Huhtala H, Pakkanen O, Ruokoranta T, Hankaniemi MM, Toppari J, Väkähä-M, Ilonen J, Veijola R, Knip M, Hyöty H. Инфекции вирусом Коксаки B1 связаны с инициированием инсулинозависимого аутоиммунитета, который прогрессирует до диабета 1 типа. Диабетология. 2018 май;61(5):1193-1202.
 [PubMed: 29404673]
[PubMed: 29404673]- 8.
Gear JH, Measroch V. Коксакивирусные инфекции новорожденных. Прог Мед Вирол. 1973; 15:42-62. [PubMed: 4572439]
- 9.
Предотвращение опасности энтеровирусов для новорожденных. Ланцет. 1986 г., 25 января; 1 (8474): 194-5. [PubMed: 2868212]
- 10.
JOHNSSON T. Исследования этиологии борнхольмской болезни (эпидемическая плевродиния). II. Эпидемиологические наблюдения. Arch Gesamte Virusforsch. 1954 апр. 12; 5(4):401–412. [PubMed: 13171858]
- 11.
КИБРИК С. ТЕКУЩЕЕ СОСТОЯНИЕ ВИРУСОВ КОКСАКИ И ЭХО В БОЛЕЗНЯХ ЧЕЛОВЕКА. Прог Мед Вирол. 1964; 6:27-70. [PubMed: 14310575]
- 12.
Ротбарт Х.А. Вирусный менингит. Семин Нейрол. 2000;20(3):277-92. [PubMed: 11051293]
- 13.
Wilfert CM, Lehrman SN, Katz SL. Энтеровирусы и менингит. Педиатр Infect Dis. 1983 г., июль-август; 2(4):333-41. [В паблике: 6310537]
- 14.

Rotbart HA, Brennan PJ, Fife KH, Romero JR, Griffin JA, McKinlay MA, Hayden FG. Энтеровирусный менингит у взрослых. Клин Инфекция Дис. 1998 окт; 27 (4): 896-8. [PubMed: 9798053]
- 15.
Эсфандиарей М., Макманус Б.М. Молекулярная биология и патогенез вирусного миокардита. Анну Рев Патол. 2008;3:127-55. [PubMed: 18039131]
- 16.
Blauwet LA, Cooper LT. Миокардит. Prog Cardiovasc Dis. 2010 янв-февраль;52(4):274-88. [Бесплатная статья PMC: PMC5951175] [PubMed: 20109598]
- 17.
Selinka HC, Wolde A, Sauter M, Kandolf R, Klingel K. Взаимодействия вирус-рецептор вирусов Коксаки B и их предполагаемое влияние на кардиотропизм. Мед Микробиол Иммунол. 2004 май; 193 (2-3): 127-31. [PubMed: 12920584]
- 18.
Berger JR, Chumley W, Pittman T, Given C, Nuovo G. Персистирующий энцефалит Коксаки B: отчет о случае и обзор литературы. J Нейровирол. 2006 Декабрь; 12 (6): 511-6. [В паблике: 17162666]
- 19.

Ричардсон М., Эллиман Д., Магуайр Х., Симпсон Дж., Николл А. Доказательная база инкубационных периодов, периодов заразности и политик исключения для борьбы с инфекционными заболеваниями в школах и дошкольных учреждениях. Pediatr Infect Dis J. 2001 Apr;20(4):380-91. [PubMed: 11332662]
- 20.
АЛЬТМАН Р. КЛИНИЧЕСКИЕ АСПЕКТЫ ЭНТЕРОВИРУСНОЙ ИНФЕКЦИИ. последипломная мед. 1964 г., май; 35: 451-9. [PubMed: 14163253]
- 21.
Артенштейн М.С., Кадиган ФК, Бюшер Э.Л. Клинико-эпидемиологические особенности инфекций, вызываемых вирусами Коксаки группы В. Энн Интерн Мед. 1965 г., октябрь; 63 (4): 597–603. [PubMed: 5891278]
- 22.
Рорабо М.Л., Берлин Л.Е., Хелдрич Ф., Робертс К., Розенберг Л.А., Доран Т., Модлин Дж.Ф. Асептический менингит у детей младше 2 лет: острое заболевание и неврологические осложнения. Педиатрия. 1993 г., август 92(2):206-11. [PubMed: 8337018]
- 23.
Wilfert CM, Lauer BA, Cohen M, Costenbader ML, Myers E.
 Эпидемия эховирусного менингита 18. J заразить дис. 1975 г., январь; 131 (1): 75-8. [PubMed: 1167369]
Эпидемия эховирусного менингита 18. J заразить дис. 1975 г., январь; 131 (1): 75-8. [PubMed: 1167369]- 24.
Cooper LT. Миокардит. N Engl J Med. 2009 09 апреля; 360 (15): 1526-38. [Бесплатная статья PMC: PMC5814110] [PubMed: 19357408]
- 25.
Sawyer MH, Holland D, Aintablian N, Connor JD, Keyser EF, Waecker NJ. Диагностика энтеровирусной инфекции центральной нервной системы с помощью полимеразной цепной реакции во время крупной общественной вспышки. Педиатр Infect Dis J. 1994 марта; 13(3):177-82. [PubMed: 8177623]
- 26.
Rotbart HA, McCracken GH, Whitley RJ, Modlin JF, Cascino M, Shah S, Blum D. Клиническое значение энтеровирусов при тяжелых летних лихорадочных заболеваниях у детей. Pediatr Infect Dis J. 1999 Oct;18(10):869-74. [PubMed: 10530582]
- 27.
Rotbart HA, Ahmed A, Hickey S, Dagan R, McCracken GH, Whitley RJ, Modlin JF, Cascino M, O’Connell JF, Menegus MA, Blum D. Диагностика энтеровирусная инфекция с помощью полимеразной цепной реакции нескольких типов образцов.
 Педиатр Infect Dis J. 1997 апреля; 16 (4): 409-11. [PubMed: 9109145]
Педиатр Infect Dis J. 1997 апреля; 16 (4): 409-11. [PubMed: 9109145]- 28.
Rotbart HA, Sawyer MH, Fast S, Lewinski C, Murphy N, Keyser EF, Spadoro J, Kao SY, Loeffelholz M. Диагностика энтеровирусного менингита с помощью ПЦР с колориметрическим микролуночный анализ обнаружения. Дж. Клин Микробиол. 1994 г., 32 октября (10): 2590-2. [Бесплатная статья PMC: PMC264111] [PubMed: 7814507]
- 29.
Bell EJ, McCartney RA, Basquill D, Chaudhuri AK. ИФА с захватом мю-антител для экспресс-диагностики энтеровирусных инфекций у больных асептическим менингитом. J Med Virol. 1986 июля; 19 (3): 213-7. [PubMed: 3016164]
- 30.
Джубелт Б, Липтон ХЛ. Энтеровирусные/пикорнавирусные инфекции. Handb Clin Neurol. 2014;123:379-416. [PubMed: 25015496]
- 31.
Hyöty H, Leon F, Knip M. Разработка вакцины против диабета 1 типа путем воздействия на вирус Коксаки B. Expert Rev Vaccines. 2018 Декабрь; 17 (12): 1071-1083.
 [PubMed: 30449209]
[PubMed: 30449209]
Вирус Коксаки A6 и кистевидная, ящурная болезнь: три случая семейной передачи от ребенка к иммунокомпетентному взрослому и обзор литературы — Полный текст — Отчеты о случаях в дерматологии 2013, Vol. 5, № 2
Болезнь кистей, ящуров (HFMD) представляет собой высококонтагиозную вирусную инфекцию, характеризующуюся типичными макуло-папулезными или везикулярными высыпаниями на кистях и стопах и в ротовой полости. Поражает преимущественно детей и/или взрослых с ослабленным иммунитетом. Обычно протекает доброкачественно и самокупируется. Однако также сообщалось о случаях HFMD с тяжелыми или летальными осложнениями, такими как энцефалит, менингит, отек легких и миокардит, в основном у детей, но также и у взрослых. Высокая заразность HFMD способствовала нескольким крупным вспышкам этого заболевания в последние десятилетия в Восточной и Юго-Восточной Азии, США и Финляндии. Наиболее распространенными возбудителями были вирус Коксаки А16, энтеровирус 71, а в последнее время также вирусы Коксаки А6 и А10. Наблюдаются различия в течении HFMD в зависимости от типа вируса. В последнее время в литературе описано много случаев атипичной HFMD с необычной морфологией и/или локализацией кожных поражений. Атипичные проявления HFMD, включая везикулобуллезную экзантему, часто на туловище или конечностях, и поражение периоральной зоны, часто были вызваны инфекциями, вызванными вирусом Коксаки А6. Мы представляем 3 случая семейной передачи HFMD, вызванной вирусом Коксаки A6, с некоторыми атипичными признаками, доброкачественным течением и полным выздоровлением среди иммунокомпетентных взрослых.
Наблюдаются различия в течении HFMD в зависимости от типа вируса. В последнее время в литературе описано много случаев атипичной HFMD с необычной морфологией и/или локализацией кожных поражений. Атипичные проявления HFMD, включая везикулобуллезную экзантему, часто на туловище или конечностях, и поражение периоральной зоны, часто были вызваны инфекциями, вызванными вирусом Коксаки А6. Мы представляем 3 случая семейной передачи HFMD, вызванной вирусом Коксаки A6, с некоторыми атипичными признаками, доброкачественным течением и полным выздоровлением среди иммунокомпетентных взрослых.
Введение
Болезнь рук, ящура (HFMD) представляет собой высококонтагиозную вирусную инфекцию, поражающую преимущественно детей. HFMD обычно возникает летом и в начале осени. Заболевание имеет инкубационный период 3-6 дней. Продромальные симптомы включают субфебрилитет, недомогание и боль в горле. Эта начальная фаза обычно сопровождается энантемой и эритематозными, папулезными или везикулярными поражениями кожи, локализующимися преимущественно на ладонях и подошвах. Реже могут поражаться латеральная и тыльная поверхности кистей и стоп, периоральная кожа [1].
Реже могут поражаться латеральная и тыльная поверхности кистей и стоп, периоральная кожа [1].
Поскольку HFMD является преимущественно детским заболеванием или заболеванием, связанным с иммунодефицитом, до сих пор было зарегистрировано несколько случаев у иммунокомпетентных взрослых [2]. В настоящей статье мы описываем 3 случая HFMD, ассоциированного с вирусом Коксаки А6, с семейным путем передачи, доброкачественным течением и полным выздоровлением среди иммунокомпетентных взрослых.
Отчеты о болезни
Семья 1
Случай 1 : 35-летний мужчина, компьютерный техник, с не относящейся к делу историей болезни, поступил в нашу амбулаторную клинику в начале октября 2012 г. с двухдневным анамнезом. папулезные и везикулярные кожные высыпания. Он жаловался на лихорадку с ознобом, недомогание и боль в горле за 1 день до появления кожных симптомов. Кроме того, пациент сообщил о тесном контакте с ребенком, страдающим HFMD, во время семейной вечеринки за 1 неделю до появления симптомов.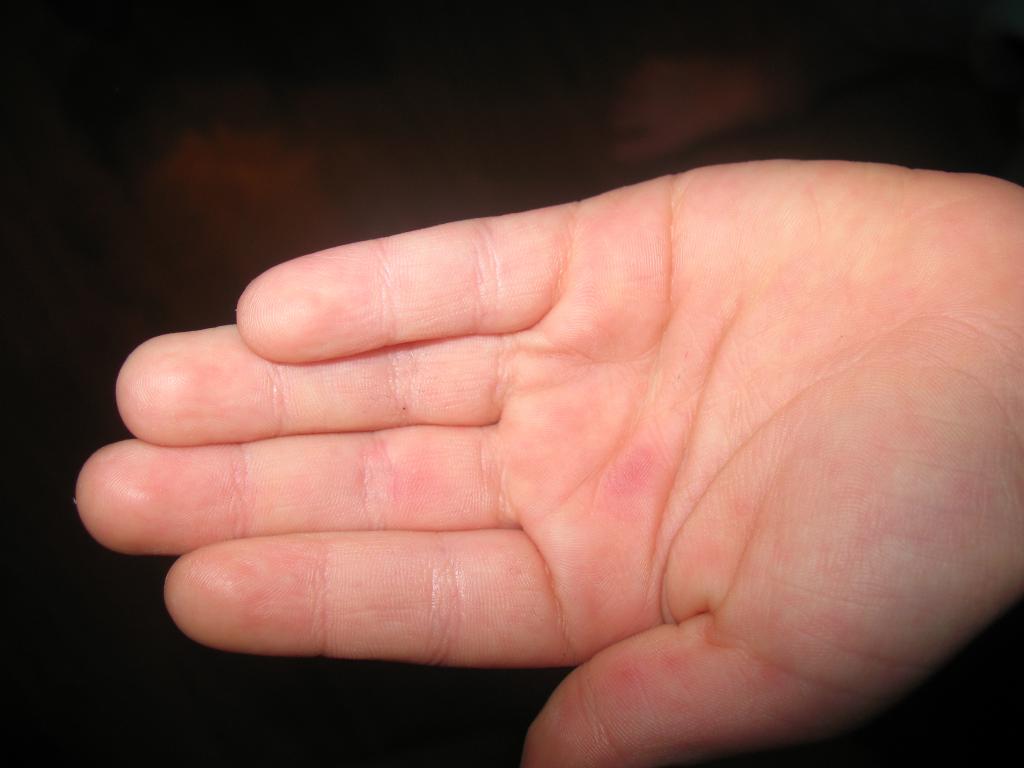
Физикальное обследование выявило эритематозные папуло-везикулярные поражения на задних отделах ротоглотки и множественные эритематозные папулы с последующими везикулярными поражениями на ладонях, подошвах и в периоральной зоне (рис. 1а, б, рис. 2а). Общий анализ крови не выявил отклонений. Скорость оседания эритроцитов увеличилась до 20 мм/ч. Биохимические анализы крови были в норме, за исключением уровня С-реактивного белка (СРБ), который был повышен до 12 мг/л. Серологические анализы на сифилис, ВИЧ и гепатиты В и С были отрицательными. Картина электрофореза белков сыворотки была нормальной, а первоначальная рентгенограмма грудной клетки и ЭКГ не выявили патологических изменений.
Рис. 1
a Семья 1, случай 1: эритематозные папулезные поражения ладоней, имитирующие многоформную эритему или вторичный сифилис. b Семейство 1, случай 1: папулезная энантема полости рта. c Семья 1, ребенок: онихомадез ногтя через 2 месяца после инфицирования вирусом Коксаки А6. d Семья 2, случай 3: эритематозные папуло-везикулярные поражения правой стопы.
d Семья 2, случай 3: эритематозные папуло-везикулярные поражения правой стопы.
Рис. 2
a Семья 1, случай 1: импетигоподобная клиническая картина с периоральными, эритематозными, папуло-везикулярными и чешуйчатыми поражениями кожи. b Семья 2, случай 3: полиморфная эритема, клиническая картина с периоральными и периназальными, эритематозными папулезными и везикулобуллезными поражениями.
Вирусную рибонуклеиновую кислоту экстрагировали из образцов везикулярной жидкости (из горла и кожи) и из плазмы. После этого его амплифицировали с помощью полимеразной цепной реакции (ПЦР) с обратной транскрипцией, как описано в другом месте [3], с использованием праймеров, которые позволяют амплифицировать все известные энтеровирусы человека и идентифицировать серотипы путем секвенирования ампликонов. Праймеры, использованные для полугнездовой стадии, амплифицировали часть 376 п.н. гена капсидного вирусного белка 1 (VP1). Секвенирование ампликона и сравнение с базой данных генов идентифицировали вирус Коксаки A6 как из везикул, так и из плазмы.
Гистологическое исследование биоптата кожи из ладонной папулы показало ортокератотический гиперкератоз с участками сливающегося паракератоза и наличие единичных базальных и супрабазальных некрозов кератиноцитов. Кроме того, лимфоцитарная воспалительная инфильтрация присутствовала в поверхностных слоях дермы вплоть до дермо-эпидермального перехода. Гистологические признаки соответствовали вирусной инфекции.
На основании характерных клинических проявлений, положительных результатов ПЦР-анализа энтеровирусов, молекулярного типирования вируса Коксаки А6 и результатов гистологического исследования установлен диагноз HFMD. Было введено симптоматическое лечение пероральным парацетамолом и пероральным спреем лидокаина. В течение 7 месяцев наблюдения осложнений не наблюдалось. Поражения кожи и слизистых оболочек полностью разрешились. Пока изменений ногтей не наблюдается, но у ребенка, заразившего больного вирусом Коксаки А6, через 2 мес развился онихомадез (рис. 1в).
Случай 2 : 37-летняя женщина, сестра описанного выше пациента, менеджер магазина одежды, с ничем не примечательным анамнезом, поступила в нашу поликлинику в середине октября 2012 г. с 1- дневная история характерной сыпи на ладонях и подошвах. Симптомам предшествовали боль в горле и субфебрильная температура. За десять дней до появления первых симптомов у нее был контакт с братом, который на момент встречи был бессимптомным. На следующий день у пациента мужского пола появились симптомы HFMD. Его заразила его племянница, страдающая HFMD, за 1 неделю до встречи братьев и сестер. Пациентка отсутствовала на семейной вечеринке, где присутствовал ребенок, страдающий HFMD. Физикальное обследование выявило единичные эритематозные макулярные и папулезные поражения на подошвах и ладонях пациента. Полость рта сохранена. Другое диагностическое исследование не проводилось в связи с отказом пациента. С учетом характерных клинических проявлений и недавнего контакта с человеком, страдающим ЛФМД, был поставлен диагноз ЛФМД. Лечение не назначалось, так как жалоб на нарушения не было. Полное разрешение заболевания наблюдалось в течение 2 нед.
с 1- дневная история характерной сыпи на ладонях и подошвах. Симптомам предшествовали боль в горле и субфебрильная температура. За десять дней до появления первых симптомов у нее был контакт с братом, который на момент встречи был бессимптомным. На следующий день у пациента мужского пола появились симптомы HFMD. Его заразила его племянница, страдающая HFMD, за 1 неделю до встречи братьев и сестер. Пациентка отсутствовала на семейной вечеринке, где присутствовал ребенок, страдающий HFMD. Физикальное обследование выявило единичные эритематозные макулярные и папулезные поражения на подошвах и ладонях пациента. Полость рта сохранена. Другое диагностическое исследование не проводилось в связи с отказом пациента. С учетом характерных клинических проявлений и недавнего контакта с человеком, страдающим ЛФМД, был поставлен диагноз ЛФМД. Лечение не назначалось, так как жалоб на нарушения не было. Полное разрешение заболевания наблюдалось в течение 2 нед.
Семья 2
Случай 3 : 21-летний мужчина, студент, с не относящейся к делу историей болезни, поступил в наше отделение дерматологии в апреле 2013 г. в тяжелом физическом состоянии, с 2-дневным ухудшением папулезной и везикулярной кожи. сыпь, сопровождающаяся 3-дневной высокой лихорадкой, ознобом и недомоганием. За две недели до появления симптомов во время семейного собрания у пациента был контакт с племянницей, страдающей HFMD. При физикальном обследовании выявлены многочисленные эритематозно-папулезные и везикулобуллезные высыпания, распространяющиеся по всей периоральной и периназальной зонам, полости рта, на ладонях и подошвах, а также в дистальных отделах нижних конечностей, вплоть до колен (рис. 1г, рис. 2б). Общий анализ крови выявил лимфоцитопению (1,29г/л), а скорость оседания эритроцитов увеличилась до 26 мм/ч. В биохимическом анализе крови выявлен повышенный уровень СРБ (56 мг/л). Серологические тесты на сифилис, ВИЧ, вирус Эпштейна-Барр, цитомегаловирус, корь и краснуху были отрицательными. Анализ ПЦР подтвердил вирус Коксаки А6 как в плазме, так и в жидкости подошвенных пузырьков. Назначено только симптоматическое лечение.
в тяжелом физическом состоянии, с 2-дневным ухудшением папулезной и везикулярной кожи. сыпь, сопровождающаяся 3-дневной высокой лихорадкой, ознобом и недомоганием. За две недели до появления симптомов во время семейного собрания у пациента был контакт с племянницей, страдающей HFMD. При физикальном обследовании выявлены многочисленные эритематозно-папулезные и везикулобуллезные высыпания, распространяющиеся по всей периоральной и периназальной зонам, полости рта, на ладонях и подошвах, а также в дистальных отделах нижних конечностей, вплоть до колен (рис. 1г, рис. 2б). Общий анализ крови выявил лимфоцитопению (1,29г/л), а скорость оседания эритроцитов увеличилась до 26 мм/ч. В биохимическом анализе крови выявлен повышенный уровень СРБ (56 мг/л). Серологические тесты на сифилис, ВИЧ, вирус Эпштейна-Барр, цитомегаловирус, корь и краснуху были отрицательными. Анализ ПЦР подтвердил вирус Коксаки А6 как в плазме, так и в жидкости подошвенных пузырьков. Назначено только симптоматическое лечение. После 3-дневной госпитализации состояние больного, воспалительные параметры улучшились, и он был выписан. Через 2 недели все высыпания полностью исчезли. В течение 2 месяцев наблюдения осложнений не наблюдалось.
После 3-дневной госпитализации состояние больного, воспалительные параметры улучшились, и он был выписан. Через 2 недели все высыпания полностью исчезли. В течение 2 месяцев наблюдения осложнений не наблюдалось.
Обсуждение
Термин HFMD происходит от типичных пятнисто-папулезных или везикулярных поражений кожи рук, ног и слизистой оболочки полости рта. Обычно наблюдается продромальная фаза, включающая субфебрилитет, недомогание и боль в горле. У взрослых клиническая картина кожно-слизистых поражений может имитировать многоформную эритему или другие инфекционные заболевания, например, сифилис. В большинстве случаев HFMD представляет собой доброкачественное и самокупирующееся течение. Поражения кожи обычно проходят в течение 1-2 недель без остаточных рубцов. Энантема обычно предшествует появлению кожной сыпи. Кроме того, поражения полости рта могут появляться при отсутствии кожных симптомов. Здесь мы описываем случай HFMD без видимых поражений слизистой оболочки во время физического осмотра (случай 2). Подобные случаи HFMD без орального поражения редко описаны в литературе [2]. Во время недавних вспышек HFMD в Испании и на Тайване, вызванных вирусом Коксаки А6, заболевание имело более широкий спектр проявлений [4]. Помимо типичной папуло-везикулярной сыпи на ладонях и подошвах и в полости рта, кожные высыпания присутствовали также на ягодицах, туловище и периоральной зоне. Некоторые поражения были везикулобуллезными, большими и присутствовали на разных участках тела. Оба наших пациента мужского пола, инфицированные вирусом Коксаки А6, имели многочисленные папуло-везикулярные поражения в периоральной зоне. Кроме того, у пациента из случая 3 были аналогичные, но более крупные поражения также на нижних конечностях, вплоть до колен. Насколько нам известно, это первое опубликованное сообщение об атипичном HFMD у взрослых, вызванном вирусом Коксаки A6. Точный патогенез этого атипичного клинического проявления до сих пор не выяснен. Неизвестно, мог ли вирус Коксаки А6 трансформироваться в более вирулентный штамм.
Подобные случаи HFMD без орального поражения редко описаны в литературе [2]. Во время недавних вспышек HFMD в Испании и на Тайване, вызванных вирусом Коксаки А6, заболевание имело более широкий спектр проявлений [4]. Помимо типичной папуло-везикулярной сыпи на ладонях и подошвах и в полости рта, кожные высыпания присутствовали также на ягодицах, туловище и периоральной зоне. Некоторые поражения были везикулобуллезными, большими и присутствовали на разных участках тела. Оба наших пациента мужского пола, инфицированные вирусом Коксаки А6, имели многочисленные папуло-везикулярные поражения в периоральной зоне. Кроме того, у пациента из случая 3 были аналогичные, но более крупные поражения также на нижних конечностях, вплоть до колен. Насколько нам известно, это первое опубликованное сообщение об атипичном HFMD у взрослых, вызванном вирусом Коксаки A6. Точный патогенез этого атипичного клинического проявления до сих пор не выяснен. Неизвестно, мог ли вирус Коксаки А6 трансформироваться в более вирулентный штамм. Однако эти необычные проявления могут быть полезны для ранней диагностики инфекции вирусом Коксаки А6 и иногда позволяют обойтись без ненужного и дорогостоящего молекулярного анализа.
Однако эти необычные проявления могут быть полезны для ранней диагностики инфекции вирусом Коксаки А6 и иногда позволяют обойтись без ненужного и дорогостоящего молекулярного анализа.
Связь между онихомадезом и HFMD была впервые предложена Clementz и Mancini [5] в 2000 г. и Bernier et al. [6] в 2001 г. Точный патомеханизм выпадения ногтей до сих пор не выяснен. Это самопроизвольное отделение ногтевой пластины от матрикса, начиная с проксимального края, наблюдалось в некоторых случаях HFMD через 1-2 месяца после начала заболевания. Изменения ногтей носили временный характер с последующим отрастанием ногтей в течение 1-4 мес. Хотя есть некоторые публикации, касающиеся онихомадеза, связанного с инфекцией вирусом Коксаки А6, не было продемонстрировано четкой корреляции между типом вируса и изменениями ногтей, связанными с HFMD [7]. До сих пор ни у одного из наших пациентов не было выявлено вышеуказанных изменений ногтей, но у ребенка, который заразил пациента 1 вирусом Коксаки А6, развился онихомадез через 2 месяца после начала HFMD.
Высокая заразность HFMD способствовала нескольким крупным вспышкам этого заболевания, произошедшим за последние 2 десятилетия в Восточной и Юго-Восточной Азии, США и Финляндии [8,9,10]. Во время этих вспышек большинство случаев HFMD протекало доброкачественно и самоизлечивалось. Однако сообщалось о случаях HFMD с тяжелыми или летальными осложнениями, такими как энцефалит, менингит, отек легких и миокардит, требующих госпитализации и, в некоторых случаях, экстракорпоральных методов жизнеобеспечения, в основном у детей, но также и у взрослых [7,11].
Возбудители HFMD включают неполиомиелитный род энтеровирусов (семейство Picornaviridae). Внутри этого рода наиболее распространенными возбудителями HFMD являются вирусы Коксаки A16, Enterovirus 71 и, в последнее время, также вирусы Коксаки A6 и A10 [8,12]. Генетическое типирование для определения точного штамма вируса обычно не требуется для подтверждения диагноза HFMD. Тем не менее, в некоторых случаях HFMD информация о точном типе вируса имеет решающее значение для надлежащего лечения заболевания и надежной оценки риска потенциальных осложнений. В литературе сообщаются о существенных различиях течения HFMD в зависимости от возбудителя; значительно большая частота летальных исходов и серьезных осложнений HFMD (особенно легочных и неврологических) наблюдалась в ассоциации с энтеровирусом 71 по сравнению с вирусом Коксаки А16 [13]. Следовательно, очень важно разработать быстрые и надежные методы диагностики, чтобы дифференцировать точный тип вируса HFMD.
В литературе сообщаются о существенных различиях течения HFMD в зависимости от возбудителя; значительно большая частота летальных исходов и серьезных осложнений HFMD (особенно легочных и неврологических) наблюдалась в ассоциации с энтеровирусом 71 по сравнению с вирусом Коксаки А16 [13]. Следовательно, очень важно разработать быстрые и надежные методы диагностики, чтобы дифференцировать точный тип вируса HFMD.
Лечение HFMD обычно симптоматическое и не влияет на течение инфекции. Дети и взрослые с ослабленным иммунитетом наиболее восприимчивы к HFMD. К другим группам риска относятся пожилые люди и беременные женщины. Насколько нам известно, в литературе описано лишь несколько случаев HFMD у иммунокомпетентных взрослых [2,8,14]. Передача заболевания среди членов семьи происходит часто и включает фекально-оральный и/или респираторный пути [2]. Дети обычно заражаются бессимптомными или слабосимптомными взрослыми. Однако в нашем случае тесный контакт с детьми с легкими симптомами, страдающими HFMD, инициировал сильную симптоматическую инфекцию у иммунокомпетентных взрослых (случаи 1 и 3). Один из взрослых передал заболевание другому взрослому с нормальным иммунитетом (случай 2). В литературе описано много случаев бытовой передачи HFMD от ребенка к ребенку и/или от взрослого к ребенку [15]. Насколько нам известно, это первое сообщение о симптоматической передаче HFMD среди иммунокомпетентных взрослых.
Один из взрослых передал заболевание другому взрослому с нормальным иммунитетом (случай 2). В литературе описано много случаев бытовой передачи HFMD от ребенка к ребенку и/или от взрослого к ребенку [15]. Насколько нам известно, это первое сообщение о симптоматической передаче HFMD среди иммунокомпетентных взрослых.
Заключение
Будучи высококонтагиозным заболеванием с редкими, но тяжелыми осложнениями, особенно у маленьких детей, пожилых людей или людей с ослабленным иммунитетом, ранняя и точная диагностика HFMD имеет решающее значение. HFMD, связанный с вирусом Коксаки A6, может иметь атипичную кожную картину с поражением лица и везикулобуллезными поражениями на теле. Следовательно, чтобы предотвратить распространение HFMD и вовремя распознать возможные осложнения, все дерматологи должны иметь глубокие знания об этом заболевании и должны знать, что оно также может возникать у иммунокомпетентных взрослых.
Заявление о раскрытии информации
Авторы заявляют об отсутствии конфликта интересов.
Лицензия открытого доступа: Это статья открытого доступа, лицензированная в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial 3.0 Unported (CC BY-NC) (www.karger.com/OA-license), применимой к онлайн-версии только статья. Распространение разрешено только в некоммерческих целях.




 Они могут быть связаны с петехиями и цервикальной лимфаденопатией.[20][21]
Они могут быть связаны с петехиями и цервикальной лимфаденопатией.[20][21] Тяжесть варьируется от бессимптомной до фульминантной сердечной недостаточности из-за дилатационной кардиомиопатии и иногда остановки сердца.[24]
Тяжесть варьируется от бессимптомной до фульминантной сердечной недостаточности из-за дилатационной кардиомиопатии и иногда остановки сердца.[24] , Кандольф Р., Шультайс Х.П. Высокая распространенность вирусных геномов и множественные вирусные инфекции в миокарде взрослых с «идиопатической» дисфункцией левого желудочка. Тираж. 2005 22 февраля; 111 (7): 887-93. [PubMed: 15699250]
, Кандольф Р., Шультайс Х.П. Высокая распространенность вирусных геномов и множественные вирусные инфекции в миокарде взрослых с «идиопатической» дисфункцией левого желудочка. Тираж. 2005 22 февраля; 111 (7): 887-93. [PubMed: 15699250] Разработка системы диагностического анализа энтеровирусов для диагностики вирусного миокардита у людей. Микробиол Иммунол. 2013 Апрель; 57 (4): 281-7. [PubMed: 23586632]
Разработка системы диагностического анализа энтеровирусов для диагностики вирусного миокардита у людей. Микробиол Иммунол. 2013 Апрель; 57 (4): 281-7. [PubMed: 23586632] [PubMed: 29404673]
[PubMed: 29404673]

 Эпидемия эховирусного менингита 18. J заразить дис. 1975 г., январь; 131 (1): 75-8. [PubMed: 1167369]
Эпидемия эховирусного менингита 18. J заразить дис. 1975 г., январь; 131 (1): 75-8. [PubMed: 1167369] Педиатр Infect Dis J. 1997 апреля; 16 (4): 409-11. [PubMed: 9109145]
Педиатр Infect Dis J. 1997 апреля; 16 (4): 409-11. [PubMed: 9109145] [PubMed: 30449209]
[PubMed: 30449209]