Формула сульфита натрия в химии
Определение и формула сульфита натрия
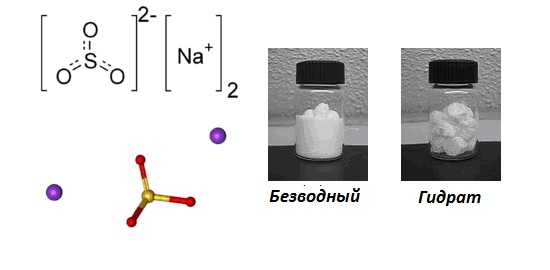
Формула –
Молярная масса равна г/моль.
Физические свойства – белое кристаллическое вещество, плавится без разложения под воздействием избыточного давления.
Данная соль образует кристаллогидрат с формулой .
Насыщенный водный раствор соли имеет . При выдержке его на воздухе, в конечном итоге он окисляется до сульфата натрия. Если сульфит натрия оставить кристаллизоваться из водного раствора при комнатной температуре или ниже, он превращается в кристаллогидрат. Безводная форма значительно устойчивее к окислению воздухом.
Получение
Сульфит натрия может быть получен в лабораторных условиях путем химического взаимодействия гидроксида натрия с диоксидом серы:
Химические свойства сульфита натрия
Применение
Сульфит натрия в основном используется в целлюлозно-бумажной промышленности. Он находит применение в обработке воды в качестве кислород очищающего агента, для очистки воды, подаваемой в паровые котлы, для избежания проблем с коррозией, в фотографической промышленности для защиты решений разработчиков от окисления, в текстильной промышленности в качестве отбеливающего, обессеривающего и дехлорирующего агента. Он используется в химическом производстве как сульфирующий и сульфометилирующий агент. Он применяется в производстве тиосульфата натрия.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
📌 Сульфит натрия — это… 🎓 Что такое Сульфит натрия?
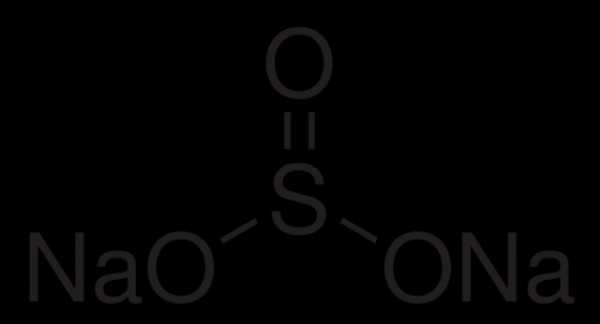
Натрия сульфит (сернисто-кислый натрий) — бесцветные кристаллы; соль. Химическая формула — Na2SO3.
Свойства
Натрия сульфит — сильный восстановитель. При обычной температуре из водных растворов кристаллизуется Na2SO3×7H2O. В водных растворах легко окисляется кислородом воздуха. В водных растворах Na2SO3 присоединяет при нагревании серу с образованием тиосульфата натрия.
Получение
Натрия сульфит получают:
- взаимодействием растворов Na2CO3 с SO2:
Na2CO3 + SO2 → Na2SO3 + CO2↑
- нейтрализацией раствора NaHSO3 раствором соды при 38—40 °C с последующим охлаждением и кристаллизацией гептагидрата.
NaHSO3 + NaOH → Na2SO3 + H2O
2NaOH + SO2 → Na2SO
Безводную соль:
- выделяют кристаллизацией при 95—100 °C или обезвоживанием гептагидрата;
- получают реакцией NaHSO3 с Са(ОН)2;
- получают как побочный продукт при производстве фенола из бензолсульфокислоты.
После проведения следующей реакции получим сульфит натрия:
Применение
Натрия сульфит применяют как компонент фиксажей и проявителей в фотографии, для удаления следов хлора после отбеливания тканей, для удаления S из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих Сr, входит в состав фотографических проявителей. Временно допустимая концентрация в воздухе 0,1 мг/м³.
Ссылки
- ГОСТ 5644-75 Сульфит натрия безводный. Технические условия
Растворимость кислот, оснований и солей в воде | |
|---|---|
{| border=»0″ cellpadding=»0″ cellspacing=»1″ |- | | | |H + | |Li+ | |K+ | |Na+ | |NH4+ | |Ba2+ | |Ca2+ | |Mg2+ | |Sr2+ | |Al3+ | |Cr3+ | |Fe2+ | |Fe3+ | |Ni2+ | |Co2+ | |Mn2+ | |Zn2+ | |Ag+ | |Hg2+ | |Hg22+ | |Pb2+ | |Sn2+ | |Cu+ | |Cu2+ |- | OH− | | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н |- | |F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |- | |Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |- | |Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |- | |I− |
dic.academic.ru
Сульфит натрия: где применяют соль
Эссенция из сульфита широко распространена в пищевой промышленности. Данный синтетический раствор часто используют на предприятиях как отбеливатель, антиоксидант, хладагент, стабилизатор окраски. Кроме того, Е 221 применяют как консервант для сохранения мяса и других продуктов.
Статьи по темеЧто такое сульфит натрия
Смесь сульфита (неорганическое соединение ) выглядит как порошок светло-розового цвета, с едва уловимым запахом и солоноватым вкусом. Сульфит натрия (или сернистокислый натрий) представляет собой соли сернистой кислоты и натрия (формула Na2SO3), растворяется в воде, образует кристаллогидраты, подвергается гидролизу. Na2SO3 – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. Это вещество является активным восстановителем,широко применяется в химической промышленности.


Применение сульфита натрия
Наибольшее распространение консервант получил в пищевой промышленности. Существует большое количество продуктов с применением сульфита натрия. Этот сернокислый химикат можно часто обнаружить среди ингредиентов в такой продукции:
- консервированных овощах, ягодах и даже морепродуктах;
- полуфабрикатах из картофеля и грибов;
- производстве прохладительных напитков, конфет;
- мармеладе, желе, джеме, варенье, их аналогах из фруктов;
- желирующих ягодных экстрактах, зефире;
- соленой или вяленой рыбе;
- кондитерской и колбасной продукции;
- вине, пиве.
Сернокислый натрий отвечает за сохранность продуктов питания, позволяет продлить их срок хранения. Особо популярен он при виноделии, потому что не дает размножаться микроорганизмам, улучшает окислительный потенциал готового вина. Это свойство также актуально для алкогольной продукции, хранящейся в упаковках тетра-пак. Безводный сульфит белого или желтоватого цвета применяют для дубления изделий из кожи, окраски тканей из хлопка, получения сернистого газа, проявления пленки, обработки сухофруктов.


Пищевая добавка Е 221
На упаковках с продукцией, при изготовлении которой использовался sodium sulphite, будет указано — пищевая добавка Е 221. Как и все вещества, отмеченные маркировкой «Е», он не очень полезен для здоровья. Этот химикат способен улучшать несвежий, вялый вид товара, устойчив к нагреванию и гидролизу. Na2SO3 (химическая формула Е 221) не первый год используется при производстве пищевых продуктов. При употреблении в небольших количествах он абсолютно безвреден, но не стоит злоупотреблять, потому что большие объемы вещества могут быть опасными.
Вред сульфита натрия
Вещество с химической формулой Na2SO3 допустимо использовать как раствор, в пределах нормы. Нужно избегать вдыхания или глотания, перед работой с ним защитить кожу, глаза. Вред сульфита натрия заключается в его негативном влиянии на желудочно-кишечный тракт. Признаком отравления добавкой могут быть боли в желудке, обезвоживание, тошнота или диарея. Нельзя часто употреблять консервы, вина с содержанием данного антиоксиданта, потому что могут наступить неприятные последствия. Под воздействием сернистокислого химиката разрушаются витамины Е, В 1.
Препарат может вызывать аллергические реакции, заболевания дыхательных путей — по этой причине нежелательно давать маленьким детям продукты с такой пищевой добавкой. Этот консервант может превратиться под воздействием кислот в диоксид серы, который относится к третьему классу опасности для человека. Данный химикат разрешен во всех европейских странах, но нужно очень тщательно относиться к выбору продуктов питания и внимательно изучать их состав, качество перед покупкой.


Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!Рассказать друзьям:Статья обновлена: 13.05.2019
sovets.net
Сульфит натрия Википедия
| Сульфит натрия | |
|---|---|
| < | |
| Хим. формула | Na2SO3 |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Т. плав. | 500 °C[1] |
| 600 °C[1] | |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| InChI | |
| екс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфи́т на́трия (сернистокислый натрий
) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.ru-wiki.ru
Общая характеристика cульфита натрия
Синонимы: сернистокислый натрий, Sodium sulfite, Na2SO3.Сульфит натрия представляет собой растворимую натриевую соль серной кислоты. Это продукт очистки газа (десульфурации дымовых газов). Он также используется как консервант для предотвращения изменения цвета сухофруктов для сохранения мяса. Используется таким же образом, как тиосульфат натрия для преобразования элементарных галогенов в их соответствующие галогенводородные кислоты. Применяется в фотографии и для снижения концентрации хлора в бассейнах.
Na2SO3 + 2 H+ → 2 Na+ + H2O + SO2
Насыщенный водный раствор имеет рН ~ 9. Водный раствор на воздухе, в конечном итоге окисляется до сульфата натрия. Если сульфит натрия оставляют для кристаллизации из водного раствора при комнатной температуре или ниже, то он преобразовывается в гептагидрат. Кристаллы-гептагидраты выветриваются на теплом сухом воздухе и окисляются с образованием сульфата. Безводная форма гораздо более устойчива к окислению на воздухе.
Получение cульфита натрия
Сульфит натрия может быть получен в лаборатории путем взаимодействия раствора гидроксида натрия с диоксидом серы:2NaOH+ SO2 → Na2SO3 + H2O
Выделиние SO2 добавлением нескольких капель концентрированной соляной кислоты укажет, что гидроксида натрия почти нет, так как он превратился в водный раствор сульфита натрия:
Na2SO3 + 2 HCl → 2 NaCl + SO2 + H2O
Сульфит натрия производится в промышленных масштабах взаимодействием диоксида серы с раствором карбоната натрия. Начальные комбинации генерируют бисульфит натрия (NaHSO3), который превращает в сульфит реакцией с гидроксидом натрия или карбонатом натрия:
Общая реакция:
SO2 + H2O + Na2CO3 → Na2SO3 + CO2
Применение cульфита натрия
Сульфит натрия в основном используется в целлюлозно-бумажной промышленности. Он применяется при очистке воды в качестве агента-поглотителя кислорода. В фотографической промышленности для защиты разработчиком растворов от окисления и (как гипопрозрачный раствор), чтобы вымыть фиксатор (тиосульфат натрия) из фотопленки, фотобумаги, эмульсии. В текстильной промышленности в качестве отбеливателя. Как дехлорирующей агент, а в кожаной торговли для сульфуризации дубильных экстрактов. Он используется для очистки TNT (тринитротолуол) для военных целей. Он применяется в производстве тиосульфата натрия.Характеристики cульфита натрия
| Характеристики | Показатели |
| CAS — номер | 7757-83-7 |
| Молекулярная формула | Na2SO3 |
| Молекулярный вес , г/моль | 126,037 |
| Плотность, г/см3 | 2,63 |
| Температура плавления, °C | 500 |
| Растворимость в воде (КТ), г/л | 678 |
Автор: Виктор Епифанов
unibrom.ru
Сульфит натрия — Википедия
| Сульфит натрия | |
| < | |
| Общие | |
|---|---|
| Хим. формула | Na2SO3 |
| Физические свойства | |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Химические свойства | |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| Классификация | |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Безопасность | |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
Физические свойства
Соединение имеет вид бесцветных кристаллов гексагональной сингонии с параметрами: a=0,5459 нм, с=0,6160 нм, z=2, пространственная группа C3. Плотность 2,633 г/см3. Растворим в воде, при этом с ростом температуры растворимость сначала растет (в 100 г воды): 14,29 г (при 0 °C), 26,10 г (при 20 °C), 36,99 г (при 40 °C), дальше падает: 29,20 г (при 80 °C). Предел температуры, после которой начинается уменьшение растворимости и начало кристаллизации — 33,4 °C[1].
Образует гептагидрат Na2SO3·7H2O при кристаллизации из водных растворов ниже 33,4 °C. Гептагидрат сульфита натрия имеет плотность 1,539 г/см3[1].
Химические свойства
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы[1].
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C[1].
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия[1]. Реагирует с перекисью водорода(реакция экзотермическая)
Na2SO3+h3O2 → Na2SO4+h3O+15°C
Фотографические свойства
| Зависимость скорости окисления водного раствора смеси сульфита и метола при pH 6,6[2]. Ось X — доля сульфита в смеси; Ось Y — скорость поглощения O2, см3/мин. |
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствии чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом[3].
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы[3].
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом[3]:
- + O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}} + Na2SO4 + NaOH
Получение
Сульфит натрия получают:
- взаимодействием растворов Na2CO3 с SO2:
- Na2CO3+SO2→Na2SO3+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}+SO_{2}\rightarrow Na_{2}SO_{3}+CO_{2}}}}
- NaHSO3+NaOH→Na2SO3+h3O{\displaystyle {\mathsf {NaHSO_{3}+NaOH\rightarrow Na_{2}SO_{3}+H_{2}O}}}
- 2NaOH+SO2→Na2SO3+h3O{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}}
Безводную соль:
- 2NaHSO3+Ca(OH)2⟶CaSO3↓+Na2SO3+2h3O{\displaystyle {\ce {2NaHSO3 + Ca(OH)2 -> CaSO3v + Na2SO3 + 2h3O}}}
Применение
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром.
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав других растворов[4].
Безопасность
Временно допустимая концентрация в воздухе 0,1 мг/м3[1].
Примечания
Литература
- Белоусова А. П. Натрия сульфит : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — ISBN 5-335-00125-4.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО «Профессионал», 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
Ссылки
- ГОСТ 5644-75 Сульфит натрия безводный. Технические условия
wikipedia.green
Натрия сульфит Википедия
| Сульфит натрия | |
|---|---|
| < | |
| Хим. формула | Na2SO3 |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Т. плав. | 500 °C[1] |
| 600 °C[1] | |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| InChI | |
| екс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
ru-wiki.ru
