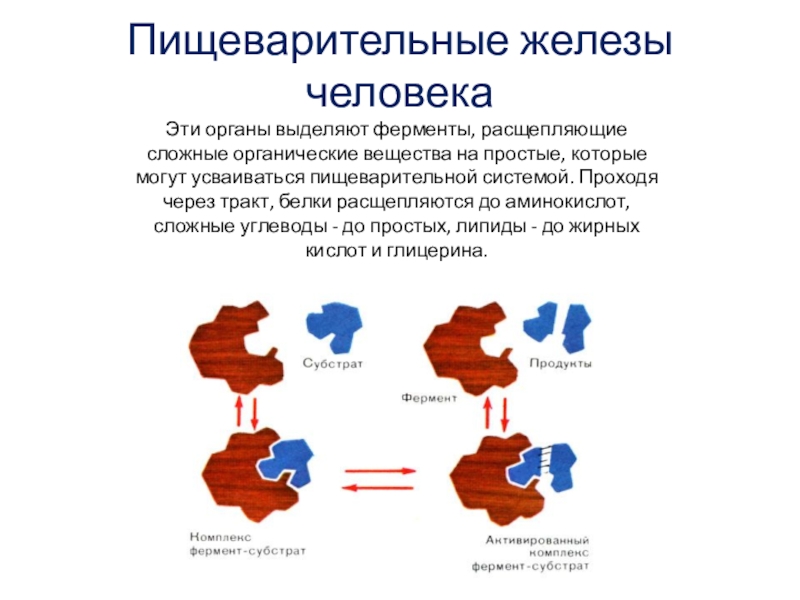
Чем являются ферменты по своей природе?
Значение ароморфозы растений
№1. А. Для вещества, имеющего строение Ch4 – CH – CH = CH – CH – Ch4 ׀ ׀ СН3 СН3 составьте структурные формулы: а) гомолога; б) изомера углеродной це … пи; в) изомера положения двойной связи. Б. Какие из веществ имеют полимерную структуру? а) аминокислоты; б) белки; в) жиры; г) воски. №2.Какой член гомологического ряда предельных углеводородов имеет молекулярную массу 142. Напишите его формулу. №3. Энергетический обмен. Этапы энергетического обмена и ихсущность. №4. У крупного рогатого скота черная масть полностью доминирует над рыжей.Скрещивается черный бык с рыжей коровой. Какое потомство можно ожидать приусловии, что производитель гомозиготен по масти? Что получается в потомстве отскрещивания гибридов между собой?
Даю 80 баллов, срочно помогите!!!!!!!!
Зразок містить фрагменти ДНК різних розмірів: 10000 п.н., 8000 п.н., 5500 п.н., 4000 п.н., 3000 п.н., 2500 п.н
… ., 1500 п.н.
Зразок містить фрагменти ДНК різних розмірів: 10000 п.н., 8000 п.н., 5500 п.н., 4000 п.н., 3000 п.н., 2500 п.н., 1500 п.н., 1000 п.н. Який з цих фрагм … ентів ДНК матиме найменшу швидкість руху в агарозній пластинці під час проведення гель-електрофорезу
что составляет основная ткань у растенийA) мякоть корнеплода,пробку, древесиныB) сердцевину стебля,столбчатую ткань листа, мякоть корнеплодаC) мякоть … корня,кору стебля,жилкуD) сердцевину,кожицу, мякоть листаE) мякоть листа, верхушка корня,конус роста почки.
в каком году был опубликован первый проектный вариант полной последовательности нуклеотидов в ДНК человека А) в октябре 1998 B) в феврале 1998 С) в ав … густе 1999 D) в апреле 1999
Метод, основанный на использовании как гемодиализа, так и гемофильтрации А) гемофильтрация B) гемосорбция C) гемодиафильтрация D) реабсорбция
Какая молекула АТФ превращается в АДФ, теряя одну молекулу фосфорной кислоты? A) Глюкоза B) поджелудочная железа C) Митахондрия D) Фосфор
сколько молей C6h22O6 были расщеплены полностью, если только на кислородном этапе расщепления получено 180 молей АТФ
сделать кроссворд на тему среда разработки мобильных приложений
Ферменты химическая природа — Справочник химика 21
ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ [c. 118]
118]Данные о важнейших коферментах и простетических группах ферментов, включая их наименования и структуру, химическую природу витамина, входящего в их состав, и характер выполняемой биохимической функции в метаболизме, детально рассмотрены в главах 7 и 9—13. [c.122]
Все ферменты по своей химической природ являются белками. Например, рибонуклеаза [c.654]
По своей химической природе рецепторы почти всех биологически активных веществ оказались гликопротеинами, причем узнающий домен (участок) рецептора направлен в сторону межклеточного пространства, в то время как участок, ответственный за сопряжение рецептора с эффекторной системой (с ферментом, в частности), находится внутри (в толще) плазматической мембраны. Общим свойством всех рецепторов является их высокая специфичность по отношению к одному определенному гормону (с константой сродства от 0,1 до 10 нМ). Известно также, что сопряжение рецептора с эффекторными системами осуществляется через так называемый С-белок, функция которого заключается в обеспечении многократного проведения гормонального сигнала на уровне плазматической мемб- [c.
 289]
289]Одним из характерных проявлений жизни является удивительная способность живых организмов кинетически регулировать химические реакции, подавляя стремление к достижению термодинамического равновесия. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, pH среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента. [c.134]
Химическая природа активной группы пируватдекарбоксилазы в настоящее время полностью выяснена. Она представляет собой соединение молекулы витамина В, и двух остатков фосфорной кислоты. Пируватдекарбоксилаза является примером фермента, активная группа которого содержит витамин. Как показали исследования, витамины являются неотъемлемой составной частью целого ряда важнейших ферментов (каталаза, пероксидаза и др.
В последние годы благодаря использованию ферментов функции ионселективных электродов удалось существенно расширить и сделать их применимыми для быстрого клинического анализа на глюкозу, мочевину, аминокислоты и другие метаболиты. Такие электроды называются ферментными электродами или электрохимическими сенсорами. Создание электродов с указанными свойствами оказывается возможным благодаря тому, что ряд ферментов обладает высокой специфичностью, т. е. способностью катализировать превращения одного единственного вещества из многих сотен и даже тысяч веществ близкой химической природы. Если, например, фермент катализирует реакцию, в ходе которой изменяется pH среды, то рН-чувствительный электрод, покрытый пленкой геля или полимера, содержащей этот фермент, позволит провести количественное определение только того вещества, которое превращается под действием данного фермента. Из мочевины в присутствии фермента уреазы образуются ионы МН+. Если ионселективный электрод, чувствительный к ионам ЫН , покрыть пленкой, содержащей уреазу, то при помощи его можно количественно определять мочевину.
Эти работы явились решающей предпосылкой для исследований строения активного центра. При этом внимание обращается на число активных центров в молекуле фермента, химическую природу групп, связывающих субстрат и активирующих его. [c.177]
Представляется целесообразным в качестве основы для классификации ферментов избрать или химическую характеристику реакций, катализируемых ферментами (химическая природа атакуемых связей или групп, подвергающихся переносу , или химическую природу субстрата, подвергающегося превращению. Так, можно один и тот же фермент называть или глюкозидазой, имея в виду расщепление глюкозидных связей, или карбогидразой, имея в виду, что субстрат по химической природе принадлежит к углеводам. В номенклатуре ферментов нередко удается совместить эти оба принципа, однако обычно путем усложнения наименования фермента.
Следовательно, структурные особенности поверхностного слоя белковых глобул позволяют сосредоточить в активном центре большое число различных по химической природе функциональных групп, способных не только сорбировать субстрат на ферменте,-но взаимодействовать с ним также и химически. [c.20]
Так, структурные особенности поверхностного слоя белковых глобул позволяют сосредоточить в активном центре большое число различных по химической природе функциональных групп, способных не только сорбировать молекулу субстрата, но также и взаимодействовать с ней химически (см. гл. I). Среда активного центра обладает высокоразвитой микрогетерогенностью, где гидрофобные участки с исключительно низкой диэлектрической проницаемостью и полярностью (по сравнению с водой) чередуются с сильно гидратированными полярными областями с высоким электростатическим потенциалом и т. д. Поверхностный слой характеризуется также и повышенной микровязкостью.
Функции солода и культур плесневых грибов не ограничиваются осахариванием крахмала, в них входят накопление в сусле достаточного количества органического азота для питания дрожжей и частичное растворение клеточных стенок эндосперма сырья. В осуществлении этих процессов, а также в выращивании солода и плесневых грибов участвуют многочисленные ферменты, поэтому необходимо знание их химической природы, строения и механизма действия.
Для фармации не менее важное значение имеет ферментативный катализ. Понимание механизма действия любого фермента возможно только на основе установления его химической природы и знания общей теории катализа. [c.10]
Сочетание этого кофактора с белком приводит к резкому увеличению активности фермента.
 Функции кофакторов (специфических небелковых фрагментов) в ферментативном катализе, как и их химическая природа, сложны и разнообразны. [c.187]
Функции кофакторов (специфических небелковых фрагментов) в ферментативном катализе, как и их химическая природа, сложны и разнообразны. [c.187] Химическая природа ферментов [c.355]
Учитывая тот факт, что все ферменты этого процесса связаны в единую тесную систему, можно представить и сами реакции в виде единой системы, которая отражает как химическую природу основных этапов, так и определенную степень их согласованности. [c.131]
Одним из путей ускорения медленной реакции является добавление к смеси незначительного количества катализатора. Катализаторы существенно различаются по химической природе. В частности, каталитическими эффектами обладают различные металлы, неметаллы и органические соединения (включая ферменты), которые увеличивают скорость некоторых реакций, находясь в водной среде. Это явление известно как гомогенный катализ. Если же в системе присутствует твердая фаза (например, электрод) или в общем случае имеется двухфазная система, то описываемое явление называют гетерогенным катализом.
Ферменты отличаются высокой специфичностью действия в отношении как химической природы субстрата, так и типа реакции, т.е. каждый фермент катализирует в основном только определенную химическую реакцию. Для каждого фермента характерны специфическая последовательность расположения аминокислотных остатков и пространственная конформация. Существенной особенностью ферментов является также то, что их активность в клетках строго контролируется как на генетическом уровне, [c.114]
При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено, что у сложных ферментов в состав активного центра входят также простетические группы. [c.122]
Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено, что у сложных ферментов в состав активного центра входят также простетические группы. [c.122]
До установления химической природы ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа. Повышение скорости химических реак- [c.129]
Существуют вещества различной химической природы, способные тормозить протекание биохимических реакций, в которых фермент является катализатором II, 22]. Торможение может быть как обратимым, так и необратимым. Ингибиторы, соответственно, делят на обратимые и необратимые. При воздействии обратимых ингибиторов активность фермента можно восстановить путем удаления ингибитора, например, с использованием селективных мембран или диализа. При действии же необратимых ингибиторов активность фермента не восстанавливается. [c.205]
Торможение может быть как обратимым, так и необратимым. Ингибиторы, соответственно, делят на обратимые и необратимые. При воздействии обратимых ингибиторов активность фермента можно восстановить путем удаления ингибитора, например, с использованием селективных мембран или диализа. При действии же необратимых ингибиторов активность фермента не восстанавливается. [c.205]
Позднее Бредиг показал, что при асимметрическом синтезе нитрила миндальной кислоты ио Розенталеру эмульсин можно заменить такими алкалоидами, как хинин или хинидин. Применение хинина приводит к образованию гликозида нитрила /-миндальной кислоты, применение хинидина — к образованию d-формы. В этом случае также приходится предположить, что асимметрическое течение реакции обусловлено промежуточным образованием продукта присоединения оптически деятельного хинина и H N или бензальдегида. Возможность использования хинина или хинидина вместо эмульсина имеет большое теоретическое значение, так как она показывает, что фермент, химическая природа которого не установлена, может быть с успехом заменен сравнительно просто построенными алкалоидами.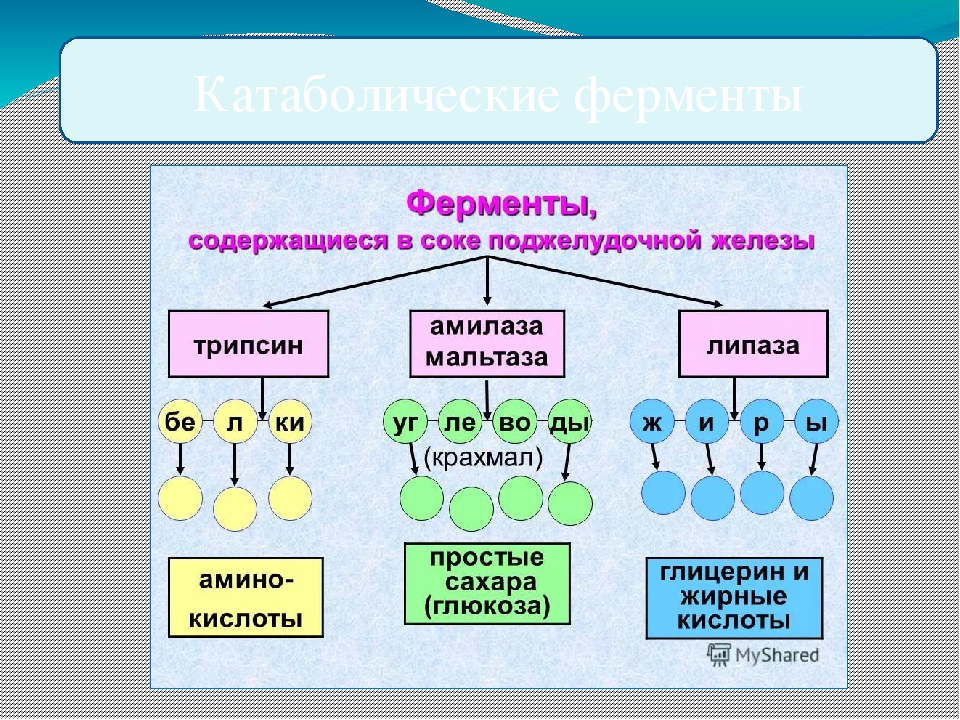 [c.672]
[c.672]
Характер структуры ферментов определяется строением а) их белковой части, б) активного центра и в) простетической группы (там, где она имеется). Для выяснения строения активных центров необходимо, прежде всего, знать их число в молекуле фермента, химическую природу тех групп центра, которые связывают и активируют субстрат, их взаимное расположение, возможные взаимодействия, свойства соседних групп и т. д. [c.71]
Изучение влияния различных факторов на скорость реакции дает возможность делать выводы о механизме действия ферментов, химической природе активных центров, последовательности стадий и т. д. Данные кинетических исследований необходимо сопоставлять с данными, полученныйи при изучении химических свойств и структуры ферментов, чтобы получить более глубокую характеристику процесса. [c.108]
На кафедре проводятся исследования по синтезу и изучению свойств синтетических неионных водорастворимых полимеров. Такие полимеры и гидрогели на их основе находят широкое применение в качестве флоку-лянтов для очистки сточных вод, для концентрирования и извлечения металлов, в качестве структурообразователей почв, в качестве плазмозаме-нителей, для стабилизации и очистки ферментов. Методом радикальной полимеризации синтезированы термоосаждаемые водорастворимые полимеры на основе винилкапролактама. Показано, что меняя природу со-мономера можно получать сополимеры с различной температурой фазового разделения., с различным конформационном состоянием макромолекул. При этом большое значение приобретает химическая природа растворителя. Способность к комплексообазованию таких полимеров позволило разработать способ получения гранулярного носителя и иммобилизации в него широкого спектра соединений, от пигментов до живых клеточных [c.115]
Такие полимеры и гидрогели на их основе находят широкое применение в качестве флоку-лянтов для очистки сточных вод, для концентрирования и извлечения металлов, в качестве структурообразователей почв, в качестве плазмозаме-нителей, для стабилизации и очистки ферментов. Методом радикальной полимеризации синтезированы термоосаждаемые водорастворимые полимеры на основе винилкапролактама. Показано, что меняя природу со-мономера можно получать сополимеры с различной температурой фазового разделения., с различным конформационном состоянием макромолекул. При этом большое значение приобретает химическая природа растворителя. Способность к комплексообазованию таких полимеров позволило разработать способ получения гранулярного носителя и иммобилизации в него широкого спектра соединений, от пигментов до живых клеточных [c.115]
Теперь дадим определение кофер-ментам. Коферменты — это органические природные низкомолекулярные соединения различной химической природы, необходимые для осуществления каталитического действия ферментов, катализирующих химические процессы in vivo. В чем же различие Скорее всего в том, что понятие витамины — более общее, а во-вторых, коферменты являются, как правило, производными витаминов. [c.267]
В чем же различие Скорее всего в том, что понятие витамины — более общее, а во-вторых, коферменты являются, как правило, производными витаминов. [c.267]
Чрезвычайно активным флавинсодержащим ферментом митохондрий животных является сукцинатдегидрогеназа [реакция (8-49)]. Этот фермент не только сам прочно встроен в мембраны крист митохондрий, но и содержит флавин, прикрепленный к белку с помощью ковалентной связи. Недавно была выяснена химическая природа этой связи выделен модифицированный FAD, содержащий 8a-(N-3-ги тидил)-рибофлавин [103—105] [c.259]
Общепринято, что хлорофилл в зеленом листе находится в агрегированном состоянии в двух фотосистемах (I и II) и включает в свое окружение, кроме белка и липидов, молекулы каротина, цитохромов, хинонов и др. В фотохимической стадии участвуют аденозинфосфаты (АДФ и АТФ), никотинамид-адениндинуклеотидфосфат (НАДФ), ферредоксин, до сотни различных ферментов, многочисленные молекулы неустановленной химической природы, условно называемые факторами. Хлорофилл обладает оптимальным набором свойств, [c.284]
Хлорофилл обладает оптимальным набором свойств, [c.284]
Характеристика продукции, сырья и полуфабрикатов. Сахар — практически чистая сахароза (СиНгзОц), обладающая сладким вкусом, легко и полностью усваиваемая организмом, способствующая быстрому восстановлению затраченной энергии. Сахароза —- это дисахарид, который под действием кислоты или фермента расщепляется на глюкозу и фруктозу (инвертный сахар). Сахароза может находиться в двух состояниях кристаллическом и аморфном. По химической природе сахар является слабой многоосновной кислотой, дающей с оксидами щелочных и щелочноземельных металлов соединения — сахараты. [c.59]
Механизм действия сульфгидрильных протеаз — папаина, фпцина и бромелаина — принципиально аналогичен изображенному на рис. 6.3. В роли акцептора ацильной группы здесь выступает сульфгидрильная группа входящего в состав активного центра остатка цистеина. Об этом свидетельствуют данные, полученные при изучении действия химических ингибиторов и рН-зависимости каталитической реакции (группа с р/Са 8,4 появляется на стадии ацилирования, а не на стадии деацилирования), а также тот факт, что методами спектроскопии в ацил-ферменте была обнаружена сложная тиоэфирная связь. При замене воды на оксид дейтерия катализируемые папаином реакции проявляют значительный кинетический изотопный эффект следовательно, лимитирующей стадией является перенос протона. О химической природе группы, выступающей в роли общего основного катализатора, мы уже говорили выше. Поскольку сложные тиоэфиры легче взаимодействуют с аминами, чем с кислородными сложными эфирами, папаин является лучшим катализатором реакции транспептидации по сравнению с химотрип-сином. [c.146]
При замене воды на оксид дейтерия катализируемые папаином реакции проявляют значительный кинетический изотопный эффект следовательно, лимитирующей стадией является перенос протона. О химической природе группы, выступающей в роли общего основного катализатора, мы уже говорили выше. Поскольку сложные тиоэфиры легче взаимодействуют с аминами, чем с кислородными сложными эфирами, папаин является лучшим катализатором реакции транспептидации по сравнению с химотрип-сином. [c.146]
Получены экспериментальные доказательства наличия в активном центре химотрипсина двух остатков гистидина и остатка серина, схематически представленных в трехмерной структурной модели предшественника этого фермента (рис. 4.3). Выявление химической природы и вероятной топографии групп активного центра—проблема первостепенной важности. Она сводится к определению природы аминокислот, их последовательности и взаиморасположения в активном центре. Для идентификации так называемых существенных аминокислотных остатков используют специфические ингибиторы ферментов (часто это субстратподобные вещества или аналоги коферментов), методы мягкого (ограниченного) гидролиза в сочетании с химической модификацией, включающей избирательное окисление, связывание, замещение остатков аминокислот и др. [c.123]
[c.123]
Таким образом, приведенные сведения о химической природе активного центра и аллостерических участках свидетельствуют о том, что в энзиматическом катализе, как и в реакции связывания субстрата, участвует не ограниченная и небольшая часть фермента, как предполагалось ранее, а значительно большая часть молекулы белка-фермента. Этими обстоятельствами, вероятнее всего, можно объяснить большие размеры и объемность трехмерной структуры молекулы фермента эти же обстоятельства следует учитывать в программах создания искусственных низкомолекулярных аналогов ферментов (синзимов), обладающих свойствами нативных ферментов (см. ранее). [c.126]
Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание), приводят к необратимой инактивации фермента. Однако подобное инак-тивирование относительно неспецифично, оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают свое действие на какой-либо один фермент или группу родственных ферментов, вызывая обратимое или необратимое ингибирование. Исследование этих ингибиторов имеет важное значение. Во-первых, ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, включая лекарственные препараты, специфически связывающие ту или иную функциональную группу в молекуле фермента, выключая ее из химической реакции. Так, йодацетат I H,—СООН, его амид и этиловый эфир, пара-хлормеркурибензоат lHg—С Н,—СООН и другие реагенты сравнительно легко вступают в химическую связь с некоторыми SH-группами ферментов. Если такие группы имеют существенное значение для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента [c.147]
Исследование этих ингибиторов имеет важное значение. Во-первых, ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, включая лекарственные препараты, специфически связывающие ту или иную функциональную группу в молекуле фермента, выключая ее из химической реакции. Так, йодацетат I H,—СООН, его амид и этиловый эфир, пара-хлормеркурибензоат lHg—С Н,—СООН и другие реагенты сравнительно легко вступают в химическую связь с некоторыми SH-группами ферментов. Если такие группы имеют существенное значение для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента [c.147]
Природные ингибиторы липаз в настоящее время выделены из растений. По своей химической природе они являются белками или липидами и обладают высокой активностью в отношении липазы, выделенной из поджелудочной железы. Имеются сведения, что липиды являются аллостерическими эффекторами и определяют конформаци-онное состояние ферментов [82]. [c.214]
Имеются сведения, что липиды являются аллостерическими эффекторами и определяют конформаци-онное состояние ферментов [82]. [c.214]
Чем являются ферменты по своей природе?
1) головной и спинной
В естественных условиях произрастания растения получают все необходимое из окружающей среды. Облик растений обусловлен средой, в которой они существуют. В комнатных условиях растения зависят от наших действий и условий в помещении. Зачастую выращиваются растения с разными условиями ухода. Одним нужна прохладная зимовка, а другим наоборот теплая и высокая влажность воздуха. Одним необходим яркий свет, а вот другим свет рассеянный.
Во всем этом вам поможет разобраться этот раздел, посвященный уходу за комнатными растениями. Свет, тепло, влажность воздуха играют огромную роль в жизни растения, поэтому, ухаживая за вашим любимцем, вы должны учитывать эти факторы. Первое время я отмечала свои действия в календаре, когда полила, опрыскала, пересадила, потом появился опыт и уверенность.
Свет, тепло, влажность воздуха играют огромную роль в жизни растения, поэтому, ухаживая за вашим любимцем, вы должны учитывать эти факторы. Первое время я отмечала свои действия в календаре, когда полила, опрыскала, пересадила, потом появился опыт и уверенность.
Если хотите, разговаривайте со своими растениями, даже можете дать им имена. Ухаживайте за ними и относитесь к ним с теплотой, а они подарят вам много приятного. Зимой, когда за окном холодно и зябко, мою семью радуют растения, и на душе становится чуточку теплее.
Тварини-будівельники.это наверно боберЗначение:Для многоклеточных и одноклеточных дыхание играет важную роль в жизнедеятельности. При дыхании организмы поглощают кислород с помощью которого организмы вырабатывают энергию а также расщепляют органические вещества.
При дыхании организмы поглощают кислород с помощью которого организмы вырабатывают энергию а также расщепляют органические вещества.
2 а Берем растение и помещаем его в стакан с водой,а также берем стакан с известковой водой.Помещаем это под колпак
б Произошла химичекая реакция Известковая вода помутнела.Это говорит о том что растение выделило углекислый газ.
Это может грозить резким снижением рождаемости лягушек
Переваривание и всасывание макронутриентов | Tervisliku toitumise informatsioon
Переваривание и всасывание белков
Белки – это состоящие из аминокислот макромолекулы. Во рту переваривания белков не происходит. Содержащаяся в желудке соляная кислота коагулирует пищевые белки. Это значит, что крупные молекулы пищевых белков разворачиваются и образующийся в желудке фермент пепсин может начинать частичное переваривание (гидролиз) белков.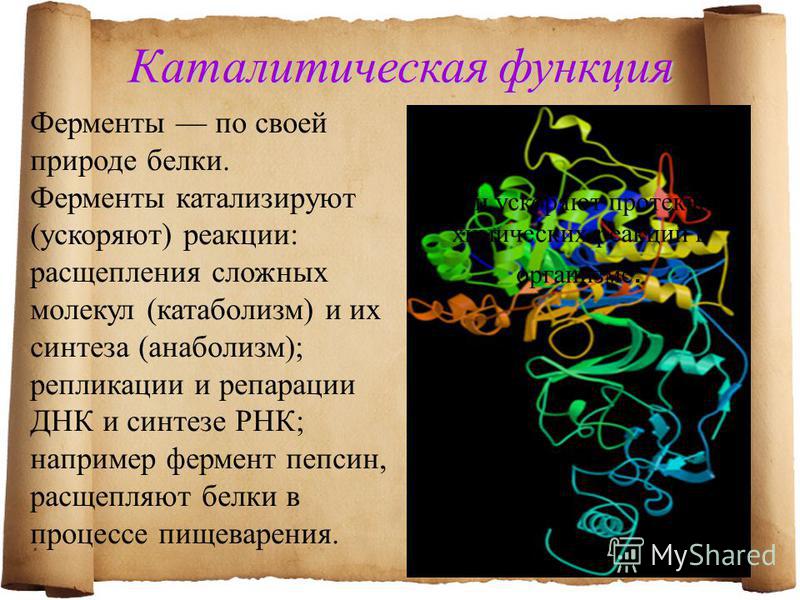
Ферменты, необходимые для окончательного переваривания белков, выбрасываются поджелудочной железой в верхний отдел тонкой кишки – двенадцатиперстную кишку. Работающий в желудке пепсин вместе с работающими в двенадцатиперстной кишке трипсином и другими ферментами расщепляют большинство пищевых белков до аминокислот. Образуется также небольшое количество коротких пептидов, которые расщепляются до аминокислот под воздействием ферментов каемчатых энтероцитов тонкой кишки.
Во время нахождения перевариваемой пищевой массы в тощей кишке, среднем отделе тонкой кишки, происходит всасывание образовавшихся из белков или присутствовавших в пище свободных аминокислот. Получившиеся вещества всасываются непосредственно в кровоток или лимфатическую систему. Кровь доставляет питательные вещества в первую очередь в печень, где происходит задействование аминокислот.
Переваривание и всасывание липидов
Жиры (триглицериды – состоят из трех жирных кислот и глицерола) составляют 95–98 % пищевых липидов.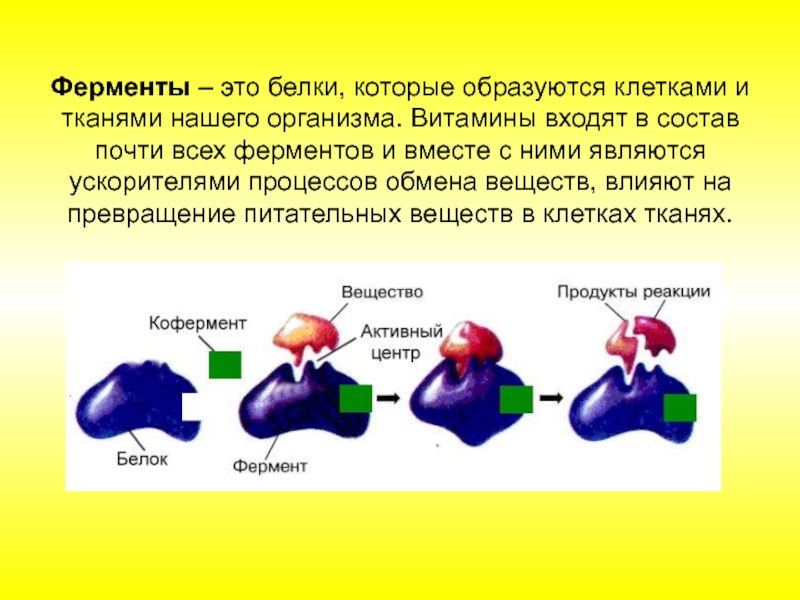 Основными присутствующими в пище липидами как раз и являются жиры. Существенного расщепления жиров во рту не происходит. Тем не менее, во рту присутствует образующийся под языком фермент липаза, который расщепляет небольшие количества жиров.
Основными присутствующими в пище липидами как раз и являются жиры. Существенного расщепления жиров во рту не происходит. Тем не менее, во рту присутствует образующийся под языком фермент липаза, который расщепляет небольшие количества жиров.
В желудке присутствует фермент желудочная липаза. Он обладает несильным действием, но поскольку он относительно стоек к воздействию кислоты, то в желудке происходит умеренное расщепление некоторого количества триглицеридов.
Триглицериды должны быть сначала преобразованы в верхнем отделе тонкой кишки – в двенадцатиперстной кишке – в тонкую эмульсию, и только затем соответствующие ферменты (липазы) смогут расщепить их на глицерол и жирные кислоты.
Чрезвычайно большую роль в образовании эмульсии играют желчные соки и их соли. Молочные белки (казеины) – тоже очень хорошие тонкие эмульгаторы пищи. Образованию тонкой эмульсии способствует также то, что выбрасываемые поджелудочной железой бикарбонаты реагируют с поступающей из желудка кислотной пищевой массой, в результате чего образуются необходимые для пищеварения газы, основательно перемешивающие эту пищевую массу. Перистальтика стенок кишечника также помогает перемешивать его содержимое.
Перистальтика стенок кишечника также помогает перемешивать его содержимое.
Из поджелудочной железы в двенадцатиперстную кишку поступает главный фермент процесса переваривания жиров – панкреатическая липаза. Он вместе с другими ферментами расщепляет пищевые липиды на простые соединения (триглицериды, глицерол, свободные жирные кислоты), а фосфолипиды – на их первичные компоненты.
Во время нахождения перевариваемой пищевой массы в среднем отделе тонкой кишки происходит всасывание образовавшихся из пищевых жиров глицерола и жирных кислот. Получившиеся вещества всасываются непосредственно в кровоток или лимфатическую систему.
Переваривание и всасывание крахмала
С точки зрения переваривания сложных углеводов наиболее важным является расщепление именно крахмала.
Из всех пищевых углеводов только крахмал начинает перевариваться во рту. Это осуществляется за счет содержащегося в слюне фермента амилазы. Под его воздействием часть крахмала расщепляется на более мелкие составляющие. Если долго пережевывать богатую крахмалом пищу (а это очень полезно), то небольшая часть крахмала будет расщеплена до гликозина (так при долгом жевании хлеба он становится сладким). Прочие содержащиеся в пище углеводы (например, сахароза и лактоза) во рту не расщепляются.
Если долго пережевывать богатую крахмалом пищу (а это очень полезно), то небольшая часть крахмала будет расщеплена до гликозина (так при долгом жевании хлеба он становится сладким). Прочие содержащиеся в пище углеводы (например, сахароза и лактоза) во рту не расщепляются.
Поскольку в желудке из-за соляной кислоты среда сильно кислотная, дальнейшего переваривания углеводов там практически не происходит. Соляная кислота нужна в первую очередь для превращения расщепляющего белки фермента пепсиногена в пепсин и высвобождения многих гормонов, обеспечивающих работу желудочного сока. Соляная кислота также истребляет бактерии.
Из поджелудочной железы в верхний отдел тонкой кишки, двенадцатиперстную кишку, выбрасывается панкреатическая амилаза. Это самый важный фермент для переваривания углеводов, который расщепляет основную часть крахмала. Панкреатическая амилаза вместе с собственными ферментами тонкой кишки доводит до конца процесс расщепления крахмала до глюкозы. Под воздействием ферментов каемчатых энтероцитов тонкой кишки (сахаразы, лактазы и других) происходит расщепление на компоненты также и сахарозы и лактозы.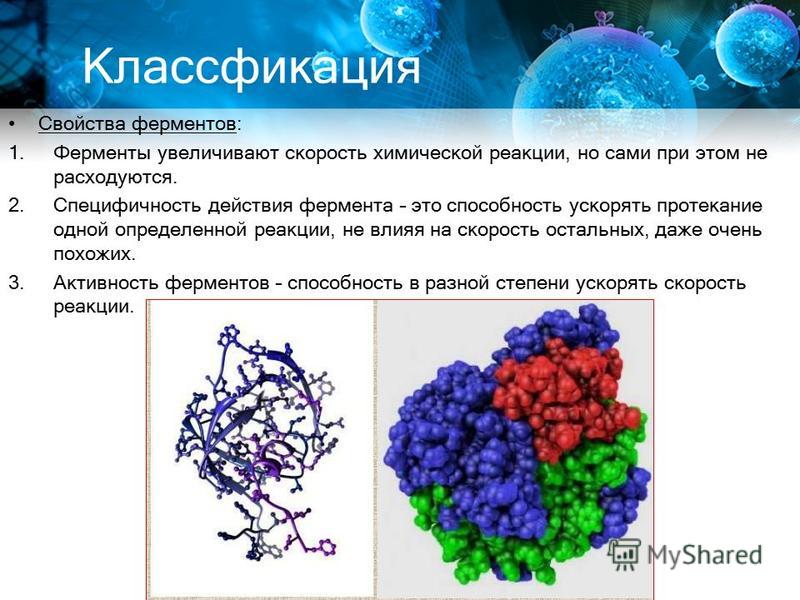
Во время нахождения перевариваемой пищевой массы в тощей кишке, среднем отделе тонкой кишки, происходит всасывание образовавшихся из сложных углеводов или присутствовавших в пище свободных глюкозы и фруктозы, которые всасываются напрямую в кровоток или лимфатическую систему. Кровь доставляет питательные вещества в первую очередь в печень, где происходит их использование.
Микроорганизмы, обитающие в толстой кишке, расщепляют клетчатку, которую пищеварительные ферменты расщепить не в состоянии. В ходе этого процесса образуются короткие жирные кислоты, которые всасываются в кровь и которые организм может использовать для получения энергии, а также активизации перистальтики. Микрофлора толстой кишки помогает расщепить значительную часть целлюлозы, в результате чего также образуются короткие жирные кислоты. Значительная часть этих жирных кислот всасывается в клетки слизистой оболочки толстой кишки, в которых их расщепление покрывает часть энергетической потребности данных клеток.
Решите пожалуйста тест. Даю 30 баллов 1 (3 балла). По своей природе энзимы – это: А….: Химия
Решите пожалуйста тест. Даю 30 баллов
1 (3 балла). По своей природе энзимы – это:
А. Белки.
Б. Жиры.
В. Углеводы.
Г. Углеводороды.
2 (3 балла). Ферменты не участвуют в реакциях разложения:
А. Белков.
Б. Жиров.
В. Полисахаридов.
Г. Нуклеиновых кислот.
3 (3 балла). Продуктами разложения жиров являются молекулы:
А. Глюкозы.
Б. Аминокислот.
В. Глицерина и жирных кислот.
Г. Сахарозы.
4 (3 балла). Ученый, который назвал ферменты «носителями жизни»:
А. Н. Пирогов.
Б. И. Павлов.
В. И. Мечников.
Г. И. Сеченов.
5 (3 балла). Ферменты способны максимально увеличить скорость реакции:
А. В 10 раз.
Б. В 102 раз.
В. В 105 раз.
Г. В 1015 раз.
6 (3 балла). Значение рН, при котором фермент крови каталаза наиболее активен:
А. 5,0.
Б. 6,0.
6,0.
В. 7,0.
Г. 8,0.
7 (3 балла). Производство, использующее фермент амилазу:
А. Кожевенное.
Б. Колбасное.
В. Сыродельное.
Г. Хлебопекарное.
8 (3 балла). Фермент, используемый в сыроделии для свертывания молока:
А. Амилаза.
Б. Каталаза.
В. Пепсин.
Г. Реннин.
9 (3 балла). Ферменты не используются при производстве:
А. Пива.
Б. Сыра.
В. Фарфора.
Г. Хлебобулочных изделий.
10 (3 балла). Будет ли действовать фермент желудочного сока пепсин в ротовой полости?
А. Да.
Б. Нет.
В. Начнет действовать через определенное время.
Г. Только совместно с амилазой.
Часть Б. Задания со свободным ответом
11 (10 баллов). По уравнению химической реакции
С6Н12О6 => 2С2Н5ОН + 2СО2
рассчитайте объем оксида углерода (IV), выделившегося при спиртовом брожении глюкозы, если получено 230г этилового спирта.
12 (6 баллов). В раствор пероксида водорода опустили поочередно по кусочку сырого и вареного картофеля. Предположите, что будет происходить в каждом случае. Дайте обоснованный ответ.
Предположите, что будет происходить в каждом случае. Дайте обоснованный ответ.
13 (4 балла). Запишите определение понятия «селективность ферментов»
Панкреатин таблетки
Общая характеристика:
Международное непатентованное название: Multienzymes (lipase, protease etc.).
Основные физико-химические свойства: Таблетки круглой формы с двояковыпуклой поверхностью, покрытые оболочкой розового цвета.
Состав лекарственного средства:
- действующее вещество: 1 таблетка содержит панкреатина 0,24 г, что соответствует активности не менее 8000 липолитических Ph. Eur. U., 5800 амилолитических Ph. Eur.U. и 380 протеолитических Ph. Eur. U.;
- вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, натрия хлорид, кремния диоксид коллоидный, магния стеарат, метакрилатного сополимера дисперсия, тальк, полиэтиленгликоль (макрогол), титана диоксид (Е 171), кармоизин (Е 122).

Лекарственная форма. Таблетки, покрытые оболочкой, кишечнорастворимые.
Фармакотерапевтическая группа. Средства, способствующие пищеварению, включая ферментные средства. Ферментные препараты. Код АТС А09АА02.
Фармакологические свойства. Ферментный препарат. Панкреатические ферменты (липаза, амилаза и протеаза), которые входят в его состав, облегчают переваривание жиров, углеводов, белков, что способствует их полному всасыванию в тонком кишечнике. При заболеваниях поджелудочной железы препарат компенсирует недостаточность ее внешнесекреторной функции и способствует улучшению процесса пищеварения.
Кислотоустойчивая оболочка таблеток защищает ферменты от инактивации желудочным соком. Только под действием нейтральной или слабощелочной среды тонкого кишечника происходит растворение оболочки и освобождение ферментов. Максимальная ферментная активность препарата отмечается через 30-45 мин после перорального приема.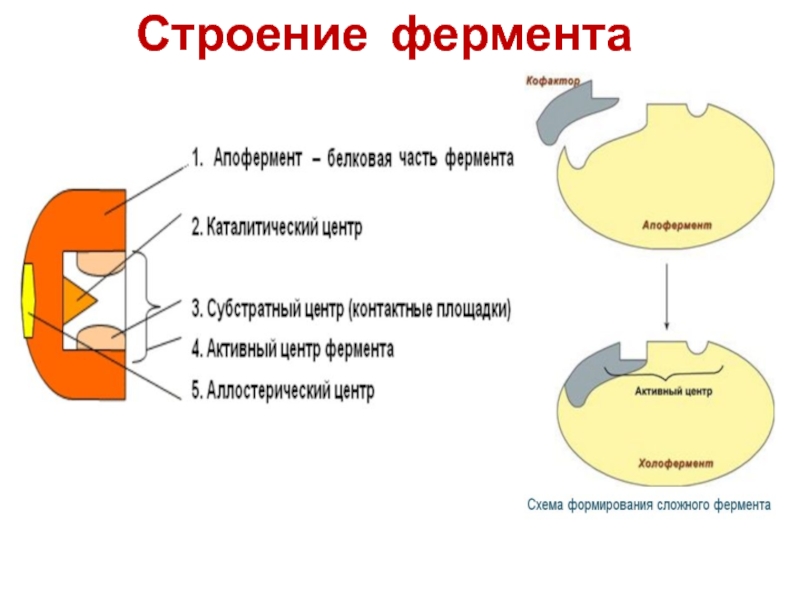
Трипсин активируется автокаталетически из трипсиногена или энтерокиназой тонкого кишечника и расщепляет пептиды на составляющие, действуя как эндопептидаза, расщепляя пептидные связи, представленные лизином и аргинином. Основываясь на последних исследованиях, предполагается, что секреция поджелудочной железы ингибируется активным трипсином в верхних отделах тонкой кишки по типу отрицательной обратной связи. Анальгетическое действие препаратов порошка поджелудочной железы, описанное в нескольких исследованиях, также приписывается данному эффекту.
Альфа-амилаза очень быстро расщепляет глюкозосодержащие полисахариды, действуя как эндоамилаза, поэтому ее активности хватает даже в случае значительного снижения секреторной активности поджелудочной железы вследствие болезни.
Панкреалипаза высвобождает жирные кислоты из молекулы триацилглицерида в положениях 1 и 3. В результате, образуются свободные жирные кислоты и 2-моноглицериды. С помощью желчных кислот образовавшиеся продукты быстро всасываются в основном в верхней части тонкого кишечника.
Панкреатические ферменты, являясь белками по своей природе, расщепляются путем протеолиза при пассаже по кишечнику и абсорбируются в виде пептидов и аминокислот.
Так как панкреатические ферменты не всасываются в ЖКТ, то данные по фармакокинетике и биодоступности препарата отсутствуют.
Показания к применению. Применяется для компенсации недостаточности внешнесекреторной функции поджелудочной железы при состояниях, сопровождающихся нарушением пищеварения.
Противопоказания. Гиперчувствительность к действующим веществам или любому из вспомогательных компонентов. Острый панкреатит, обострение хронического панкреатита.
Меры предосторожности. У больных муковисцидозом, которые применяли высокие дозы панкреатина наблюдались сужение илеоцекального отдела кишечника и толстой кишки (фиброзирующая колонопатия) и колит, поэтому при наличии симптоматики, которая напоминает это состояние, нужно помнить о возможных кишечных стриктурах.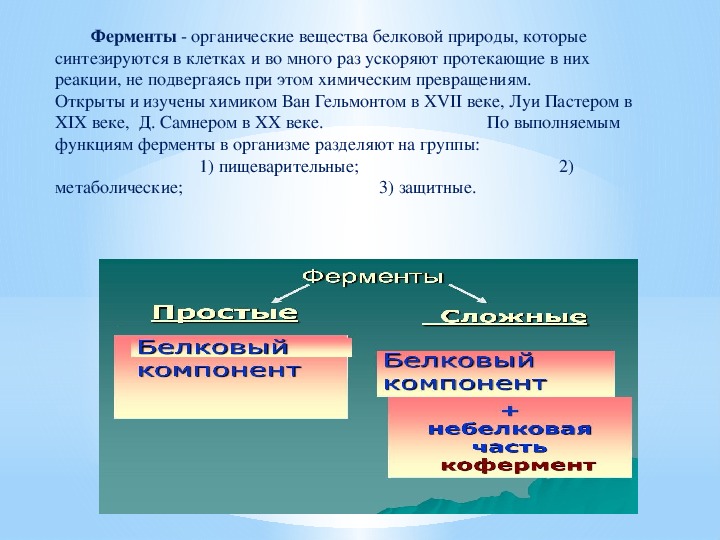 В случае появления в больного непривычных абдоминальных симптомов или изменении характера симптомов основного заболевания рекомендуется исключить возможность поражения толстой кишки, особенно в случае, когда пациент применяет дозу больше 10000 липолитических Ph. Eur. U./кг/сутки.
В случае появления в больного непривычных абдоминальных симптомов или изменении характера симптомов основного заболевания рекомендуется исключить возможность поражения толстой кишки, особенно в случае, когда пациент применяет дозу больше 10000 липолитических Ph. Eur. U./кг/сутки.
Кишечная непроходимость – частое осложнение у больных муковисцидозом, поэтому при наличии симптоматики, напоминающей это состояние, следует помнить о возможности появления кишечных стриктур.
Препарат содержит активные ферменты, которые могут повреждать слизистую оболочку ротовой полости, поэтому таблетки следует глотать целыми, не разжевывая.
Особые предостережения.
Применение при беременности или в период грудного вскармливания. Данные клинических исследований по применению Панкреатина 8000 у беременных отсутствуют. Данные доклинических исследований на животных по изучению влияния препарата на течение беременности, эмбриональное развитие, роды и постнатальное развитие являются недостаточными. Потенциальный риск для человека неизвестен. Поэтому Панкреатин 8000 не следует принимать во время беременности или в период грудного вскармливания.
Потенциальный риск для человека неизвестен. Поэтому Панкреатин 8000 не следует принимать во время беременности или в период грудного вскармливания.
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами. Предостережений нет.
Дети. Применяют детям в возрасте от 6 лет.
Способ применения и дозы. Доза препарата устанавливается индивидуально и зависит от тяжести заболевания и состава диеты.
Обычная начальная доза препарата составляет от 10000 до 25000 Ph. Eur. U. липазы во время каждого основного приема пищи. Доза лекарственного средства для приема во время основных приемов пищи может быть повышена до 25000-80000 Ph. Eur. U. липазы, а во время приема легкой закуски должна составлять половину рекомендуемой дозы. Увеличение дозы с целью уменьшения симптомов заболевания, например, стеатореи или боли в животе, нужно проводить только под контролем врача.
Суточная доза ферментов не должна превышать 15000-20000 Ph.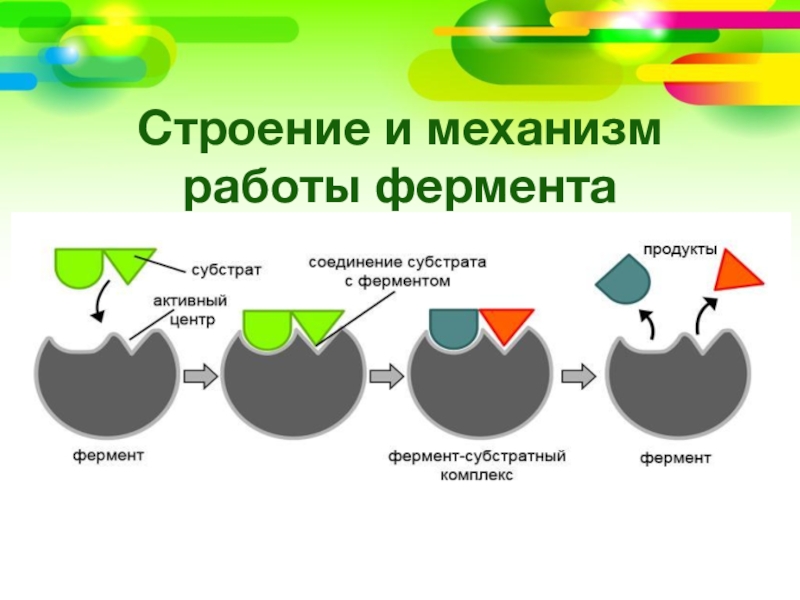 Eur. U. липазы на 1 кг массы тела.
Eur. U. липазы на 1 кг массы тела.
Длительность приема лекарственного средства зависит от течения болезни и определяется врачом.
Препарат рекомендуется принимать во время или сразу после еды. Таблетки следует глотать целыми, не разжевывая, запивая достаточным количеством жидкости, например стаканом воды.
Передозировка. Во время приема очень высоких доз других препаратов панкреатина наблюдались гиперурикемия и гиперурикозурия.
Лечение: терапия симптоматическая.
Побочные реакции. Со стороны иммунной системы: аллергические реакции, включая сыпь, зуд, чихание, крапивница, слезотечение, бронхоспазм, анафилактические реакции. За счет содержания кармоизина возможны аллергические реакции.
Со стороны пищеварительного тракта: у больных муковисцидозом при применении высоких доз панкреатина могут образовываться сужения в илеоцекальной области и в восходящей части ободочной кишки; диарея, боль в животе, тошнота, рвота, изменение характера стула; возможно развитие непроходимости кишечника, запор, вздутие.
Со стороны мочеполовой системы: у больных муковисцидозом возможно повышенное выделение мочевой кислоты с мочой, особенно при применении высоких доз панкреатина; во избежание образования мочекислых конкрементов у таких больных следует контролировать ее содержание в моче.
В случае появления каких-либо нежелательных явлений необходимо обратиться к врачу.
Взаимодействия с другими лекарственными средствами и другие виды взаимодействий. Уменьшает всасывание железа (особенно при продолжительном применении).
В результате применения препаратов, содержащих панкреатин, возможно уменьшение всасывания фолиевой кислоты, что может обусловить необходимость ее дополнительного поступления в организм.
Действие сахароснижающих препаратов акарбозы и миглитола может уменьшаться при одновременном приеме с панкреатином.
Срок годности. 2 года. Нельзя применять препарат после окончания срока годности, указанного на упаковке!
Условия хранения. Хранить в оригинальной упаковке при температуре не выше 25 °С. Хранить в недоступном для детей месте!
Хранить в оригинальной упаковке при температуре не выше 25 °С. Хранить в недоступном для детей месте!
Упаковка. По 10 таблеток в блистере из пленки поливинилхлоридной и фольги алюминиевой с покрытием термолаком и печатью, по 5 блистеров вместе с листком-вкладышем помещают в пачку из картона.
Категория отпуска. Без рецепта.
Название и местонахождение производителя. ООО «Тернофарм». Украина, 46010, г. Тернополь, ул. Фабричная, 4. Тел./факс: (0352) 521-444, www.ternopharm.com.ua
Ферменты и их функции
directions
В организме постоянно происходит ряд химических превращений веществ, поступающих извне. Эти реакции могут происходить только в присутствии определённых катализаторов. Последние в свою очередь представлены в виде веществ белковой природы – ферментов. Они ускоряют процесс обмена веществ, способствуют достижению равновесия. Благодаря воздействию ферментов реакции, происходящие в организме, ускоряются в сотни раз. Изменение концентрации этих веществ в организме указывает на развитие очень опасных заболеваний. При этом активность ферментов снижается намного раньше, чем появляются более явные признаки болезни. Данный вид анализа позволяет точно диагностировать наличие того или иного заболевания и своевременно приступить к лечению. В нашей лаборатории Вы сможете пройти все необходимые исследования.
Изменение концентрации этих веществ в организме указывает на развитие очень опасных заболеваний. При этом активность ферментов снижается намного раньше, чем появляются более явные признаки болезни. Данный вид анализа позволяет точно диагностировать наличие того или иного заболевания и своевременно приступить к лечению. В нашей лаборатории Вы сможете пройти все необходимые исследования.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Анализ на коронавирус методом ПЦР. Результат в течение 24 часов, с момента поступления биологического материала в лабораторию
Результат в течение 24 часов, с момента поступления биологического материала в лабораторию
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Свойства ферментов:
- В первую очередь, как уже было сказано выше, ферменты непосредственно влияют на скорость химических реакций, происходящих внутри организма.

- Специфичность действия. Так как в организме постоянно протекает огромное количество реакций, для ускорения каждой из них вырабатывается свой особый фермент, который не может действовать на другие процессы. В связи со специфичностью действия различают две группы ферментов:
- относительную — фермент катализирует определённый вид реакций;
- абсолютную — когда фермент отвечает за ход только одной реакции.
- Активность ферментов характеризует их способность в различной степени ускорять происходящие в организме реакции. Этот показатель зависит от следующих факторов: температуры, рН среды т. д.
Виды анализов на ферменты
Аланинаминотрансфераза (АЛТ) является ферментом печени и принимает участие в обмене аминокислот. При разрушении клеток почек, печени, скелетной мускулатуры и сердечной мышцы происходит увеличение концентрации АЛТ в крови. Результаты анализа могут указывать на следующие заболевания:
- вирусный гепатит А и другие виды гепатита;
- цирроз или рак печени;
- поражение печени токсинами;
- хронический алкоголизм;
- панкреатит;
- желтуха;
- инфаркт миокарда;
- ожоги.

Амилаза вырабатывается в поджелудочной и слюнных железах. Обеспечивает расщепление углеводов, поступающих в организм вместе с пищей. Повышенное содержание альфа-амилазы является симптомом следующих заболеваний: киста, перитонит, панкреатит, паротит, сахарный диабет, почечная недостаточность. Так же увеличение альфа-амилазы происходит при прерывании беременности или травме живота. Панкреатическая амилаза синтезируется в поджелудочной железе. Её уровень возрастает при травмах поджелудочной железы, острых панкреатитах, почечной недостаточности, алкоголизме, язве.
Аспартатаминотрансфераза (АСТ) — фермент, который содержится в нервной, скелетной тканях, а так же в клетках сердца, почек, печени и других органов. Результаты анализа могут давать как повышенные значения (при раке печени, гепатите, сердечной недостаточности, стенокардии), так показывать и низкий уровень вследствие разрыва печени и тяжёлых заболеваний.
Креатинкиназа входит в состав клеток головного мозга, лёгких, щитовидной железы, скелетной мускулатуры, сердечной мышцы. Повышение креатинкиназы отмечается, когда происходит нарушение в работе любого из перечисленных органов. Наиболее часто увеличение активности наблюдается при остром инфаркте миокарда, заболеваниях скелетных мышц, головного мозга, гипотериозе.
Повышение креатинкиназы отмечается, когда происходит нарушение в работе любого из перечисленных органов. Наиболее часто увеличение активности наблюдается при остром инфаркте миокарда, заболеваниях скелетных мышц, головного мозга, гипотериозе.
Липаза синтезируется органами для расщепления жиров. Анализ проводится для выявления и диагностики заболеваний. Повышенное содержание липазы в крови говорит о наличии следующих заболеваний:
- опухоли;
- панкреатит;
- болезни желчного пузыря;
- рак молочной железы;
- почечная недостаточность;
- ожирение;
- подагра.
Понижение уровня встречается в случае возникновения онкологических заболеваний.
Холинэстераза образуется в печени. Анализ на холинэстеразу проводится для оценки функции печени либо при отравлении инсектицидами. Содержание фермента резко снижается при тяжёлых заболеваниях печени, инфаркте миокарда, циррозе, онкологических заболеваниях, гепатите (например, при гепатите В). Понижение уровня этого фермента характерно на последнем сроке беременности, в то время как на начальном этапе отмечается его увеличение. Повышение холинэстеразы является симптомом следующих заболеваний: ожирение, рак молочной железы, столбняк, сахарный диабет, алкоголизм, маниакально-депрессивный психоз, неврозы.
Понижение уровня этого фермента характерно на последнем сроке беременности, в то время как на начальном этапе отмечается его увеличение. Повышение холинэстеразы является симптомом следующих заболеваний: ожирение, рак молочной железы, столбняк, сахарный диабет, алкоголизм, маниакально-депрессивный психоз, неврозы.
Щелочная фосфатаза принимает участие в обмене фосфорной кислоты. Проводят анализ для диагностики заболеваний печени, костной системы. Повышение щелочной фосфатазы встречается при миеломной болезни, рахите, инфекционном мононуклеозе, поражениях костей, заболеваниях печени, снижение – признак недостатка витаминов, магния, цинка, анемии. При мониторинге беременности так же проводится анализ на щелочную фосфатазу. Снижение её активности происходит в случае недостаточного развития плаценты.
1366,1305,1328,933,1300,1274
Задорожняя Мария Николаевна 11. 05.2021
23:33
05.2021
23:33 medi-center.ru
Хочу выразить благодарность врачу-гастроэнтерологу Банниковой Татьяне Петровне! Много лет меня курирует этот врач, всегда проводит правильную диагностику, назначает адекватное лечение!!! Лучший врач! По мимо профессиональных навыков, врач прекраснейший человек! По больше бы таких врачей! Спасибо Вам большое, Татьяна Петровна!
Смерткин Алексей Сергеевич 11.02.2021 19:40medi-center.ru
Хочу выразить благодарность врачу Саранчину Александру за качественный осмотр и рекомендации в лечении. Успехов Вам, Александр и профессионально развития.
Дашкина Альфия Рашитьевна 26. 12.2020
18:55
12.2020
18:55 medi-center.ru
Хочу поблагодарить терапевта Дерешовского Александра Сергеевича за внимательность, ответственность, и главное, за эффективность лечения! Александр Сергеевич был на связи все время, подробно и доступно все объяснял и отвечал на вопросы. Спасибо, Александр Сергеевич, за Ваш профессионализм и отношение к пациентам!
Антон Иванов 21.12.2020 17:50medi-center.ru
Огромная благодарность неврологу Соловьёву Даниилу Петровичу! Настоящий доктор, побольше бы таких докторов!
Жданова Анна Михайловна 25. 11.2020
14:32
11.2020
14:32 medi-center.ru
Хочу выразить огромную благодарность врачу терапевту Дерешовскому Александру Сергеевичу. На 28 неделе беременности не обошла стороной и нас эта зараза под названием COVID-19. В день вызова врача пришёл Александр Сергеевич, посмотрел, послушал, взял мазки на ковид, назначил грамотное лечение. И самое главное всегда со мной был на связи, и утром , и днём, и вечером. Зараза отступила. Спасибо Вам, Александр Сергеевич, за Ваш труд в столь не простое для всех время. Здоровья Вам и Вашим близким!????
Сайбель Ольга Евгеньевна 27.07.2020 16:07medi-center.ru
Я, Сайбель Ольга Евгеньевна, 05. 04.1976 года рождения, убедительно прошу вознаградить всех врачей, младший медицинский персонал и администраторов клиники ООО «Медицентр ЮЗ», г.Мурино, Охтинская аллея, д.18, за огромный вклад в деле спасении моей жизни.
У меня диагностирован рак подъязычной области полости рта. Абсолютно весь медицинский персонал этой клиники оказывали мне не только квалифицированную медицинскую помощь на высочайшем уровне, но и выходили за рамки должностных обязанностей, проявляя ко мне человеческое сочувствие, корректное отношение и искреннюю заинтересованность в оказании мне максимального содействия на пути к моему выздоровлению.
Огромное Вам спасибо!
Большое человеческое спасибо!!!
04.1976 года рождения, убедительно прошу вознаградить всех врачей, младший медицинский персонал и администраторов клиники ООО «Медицентр ЮЗ», г.Мурино, Охтинская аллея, д.18, за огромный вклад в деле спасении моей жизни.
У меня диагностирован рак подъязычной области полости рта. Абсолютно весь медицинский персонал этой клиники оказывали мне не только квалифицированную медицинскую помощь на высочайшем уровне, но и выходили за рамки должностных обязанностей, проявляя ко мне человеческое сочувствие, корректное отношение и искреннюю заинтересованность в оказании мне максимального содействия на пути к моему выздоровлению.
Огромное Вам спасибо!
Большое человеческое спасибо!!!
Natural Enzyme — обзор
16.4.1 Ферменты в пищевой промышленности
Ферменты использовались в обработке пищевых продуктов с 7000 г. до н.э. Первые известные случаи использования природных ферментов (то есть бактерий, грибков или дрожжей) были в производстве хлеба, йогурта и ферментированных напитков. Сегодня ферменты по-прежнему необходимы для пищевой промышленности. Например, основным применением ферментов в молочной промышленности является коагуляция молока, что является первым шагом в производстве сыра.Для этого используются ферменты как микробного, так и животного происхождения. В прошлом сычужный фермент теленка был единственным источником ферментов для свертывания крови. Сычужный фермент содержит два полезных фермента, химозин и пепсин. Сегодня в процессе используются недорогие микробные ферменты вместо стандартного животного сычужного фермента. Методики рекомбинантной ДНК позволили клонировать фактический ген химозина теленка в отобранные бактерии, дрожжи и грибы (Vallejo et al., 2008; Kapralek et al., 1998). Другим примером применения ферментов в молочном производстве является фермент лактаза (β-галактозидаза), который обычно используется для гидролиза лактозы, сахара молока, и для повышения усвояемости / усвояемости молока людьми с непереносимостью лактозы.Лактаза также используется для улучшения растворимости или сладости различных молочных продуктов (Horner et al.
Сегодня ферменты по-прежнему необходимы для пищевой промышленности. Например, основным применением ферментов в молочной промышленности является коагуляция молока, что является первым шагом в производстве сыра.Для этого используются ферменты как микробного, так и животного происхождения. В прошлом сычужный фермент теленка был единственным источником ферментов для свертывания крови. Сычужный фермент содержит два полезных фермента, химозин и пепсин. Сегодня в процессе используются недорогие микробные ферменты вместо стандартного животного сычужного фермента. Методики рекомбинантной ДНК позволили клонировать фактический ген химозина теленка в отобранные бактерии, дрожжи и грибы (Vallejo et al., 2008; Kapralek et al., 1998). Другим примером применения ферментов в молочном производстве является фермент лактаза (β-галактозидаза), который обычно используется для гидролиза лактозы, сахара молока, и для повышения усвояемости / усвояемости молока людьми с непереносимостью лактозы.Лактаза также используется для улучшения растворимости или сладости различных молочных продуктов (Horner et al. , 2011; Jarvis and Miller, 2002; Pivarnik et al., 1995).
, 2011; Jarvis and Miller, 2002; Pivarnik et al., 1995).
Другой крупный рынок ферментов — это хлебопекарная промышленность. Например, амилазы добавляют в тесто для получения качественного хлеба. Кроме того, α-амилазы могут увеличивать срок хранения хлеба, сохраняя его свежесть. Значительный антисталирующий эффект α-амилазы связан с модификациями крахмала, которые происходят вблизи температур, при которых большая часть крахмала начинает желатинизироваться.Полученные в результате гранулы модифицированного крахмала остаются более гибкими во время хранения, что дает хлебу, произведенному с α-амилазами, более мягкие и более эластичные крошки по сравнению с хлебом, произведенным с использованием эмульгаторов только что дистиллированных моноглицеридов (Palacios et al., 2004; Leon et al., 2002; Kulp и Понте, 1981). В пекарнях помимо α-амилаз используются другие ферменты, такие как гемицеллюлазы, ксиланазы, липазы и оксидоредуктазы, которые могут прямо или косвенно улучшить качество конечных продуктов за счет повышения прочности сформированных глютеновых сетей (Saarinen et al. , 2012; Дорнез и др., 2011).
, 2012; Дорнез и др., 2011).
Ферменты также используются в производстве соков. Растительный материал, например фрукты, обрабатывается смесями ферментов для разрушения клеточных стенок и дает более высокий выход сока, улучшает цвет и аромат экстрактов и очищает сок от трудноусвояемых частиц (Bogra et al., 2013).
Некоторые ферменты, используемые в пищевой промышленности, можно назвать «универсальными», поскольку они имеют множество применений в разных отраслях. Хорошим примером таких ферментов является трансглутаминаза (EC 2.3.2.13). Этот фермент катализирует образование изопептидной связи между аминогруппой в остатке лизина и карбоксиамидной группой в остатке глутамина. Эта реакция может образовывать перекрестную связь между двумя аминокислотами в одной или разных молекулах белка (Kieliszek and Misiewicz, 2014; Porta et al., 2011). Такое сшивание белков приводит к образованию высокомолекулярных белковых биополимеров, которые влияют на реологические свойства (т.е. гидратацию, гелеобразование, эмульгирование и вспенивание) конечных продуктов (Wilcox and Swaisgood, 2002). Исторически сложилось так, что трансглутаминаза давно использовалась в Японии для обработки специальной пасты из фарша из рыбы, известной как сурими (Banlue et al., 2010). Первая микробная трансглутаминаза была очищена в 1989 г. из Streptoverticillium sp. (Mariniello and Porta, 2005) и с тех пор коммерциализировалась.
Исторически сложилось так, что трансглутаминаза давно использовалась в Японии для обработки специальной пасты из фарша из рыбы, известной как сурими (Banlue et al., 2010). Первая микробная трансглутаминаза была очищена в 1989 г. из Streptoverticillium sp. (Mariniello and Porta, 2005) и с тех пор коммерциализировалась.
Трансглутаминаза широко используется в промышленных масштабах для изменения белков сыворотки, казеина, сои, мяса и рыбы. Фермент известен просто как «мясной клей». Он может производить реструктурированное мясо, связывая кусочки мяса вместе.В процессе связывания одновременно используются казеинат и трансглутаминаза (Ma et al., 2012). Казеинат, обработанный трансглутаминазой, действует как клей, скрепляющий компоненты пищи. Вышеупомянутая реструктуризация мясного фарша может эффективно использоваться для производства большого количества товаров, привлекательных для потребителей. Производство обработанных колбас с улучшенными текстурными качествами является одним из типичных применений трансглутаминазы.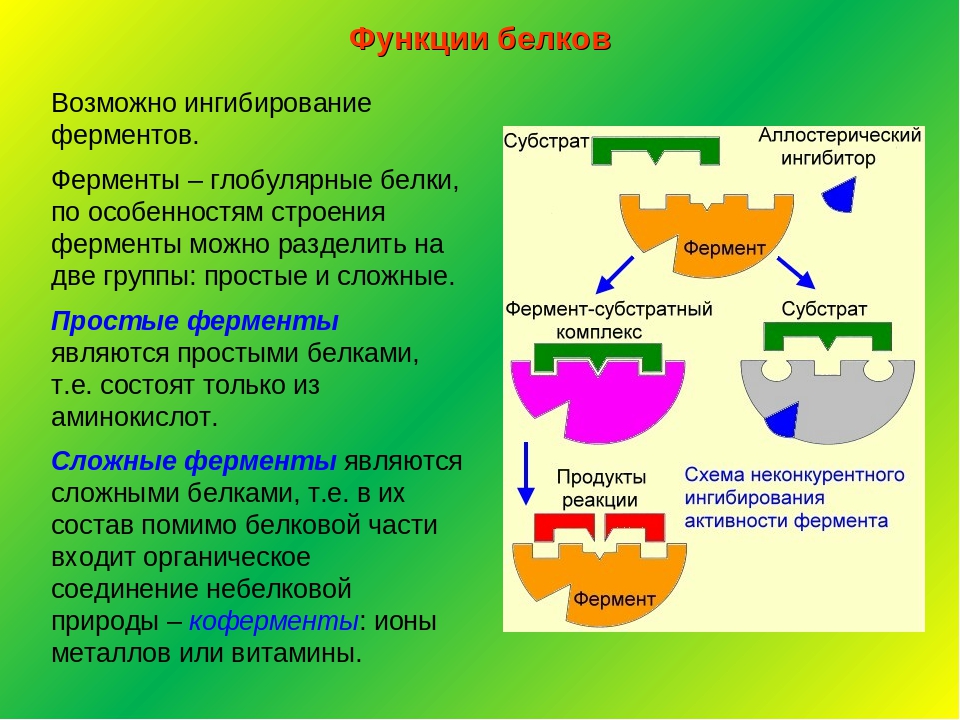 Внутренняя структура колбас, усиленная трансглютаминазой, может быть сделана более устойчивой к высоким температурам и циклам замораживания / оттаивания благодаря искусственно сформированным сшивающим связям (Ahhmed et al., 2007). Хэм — другой пример. В этом случае трансглутаминаза улучшает нарезку, что очень важно для производителей ветчины.
Внутренняя структура колбас, усиленная трансглютаминазой, может быть сделана более устойчивой к высоким температурам и циклам замораживания / оттаивания благодаря искусственно сформированным сшивающим связям (Ahhmed et al., 2007). Хэм — другой пример. В этом случае трансглутаминаза улучшает нарезку, что очень важно для производителей ветчины.
Аналогичным образом полимеризация молочных белков трансглутаминазой приводит к образованию белковых пленок, которые могут улучшить реологические свойства молочных продуктов (Rossa et al., 2011). Здесь фермент помогает сохранять йогурт в однородном состоянии, предотвращая некрасивое расслоение. В хлебопекарной промышленности трансглутаминаза широко используется для повышения качества муки, а также текстуры хлеба (Moore et al., 2006) и приготовленные макароны (Kuraishi et al., 1997). Наконец, используя уникальные свойства трансглутаминазы, можно создать необычные текстуры и необычные комбинации различных пищевых деликатесов, таких как лапша из креветок или паста с арахисовым маслом, без добавления цветов или яиц (Marques et al. , 2010; Buchert et al. ., 2010).
, 2010; Buchert et al. ., 2010).
Из-за первостепенной важности трансглутаминаз они были нацелены на молекулярную инженерию для улучшения качества обработки. Например, трансглутаминаза Streptomyces широко используется в пищевой промышленности.Фермент синтезируется естественным образом в виде зимогена (профермента), который позже обрабатывается с образованием активной формы путем отщепления и удаления N-концевого пропептида. Когда α-спираль (37G-42S) в пропептиде была заменена тремя глицинами и тремя аланинами, соответственно, мутанты проявляли более высокую специфическую активность и эффективность расщепления пропептида повышалась (Chen et al., 2013). Дальнейшие мутации были сконструированы путем введения линкерных пептидов в С-конец пропептида.Мутанты с линкерными пептидами GS (GGGGS) и PT (PTPPTTPT) проявляли удельную активность в 1,28 и 1,5 раза выше, чем фермент дикого типа, соответственно (Chen et al., 2013).
Используя ядерный магнитный резонанс, Shimba et al.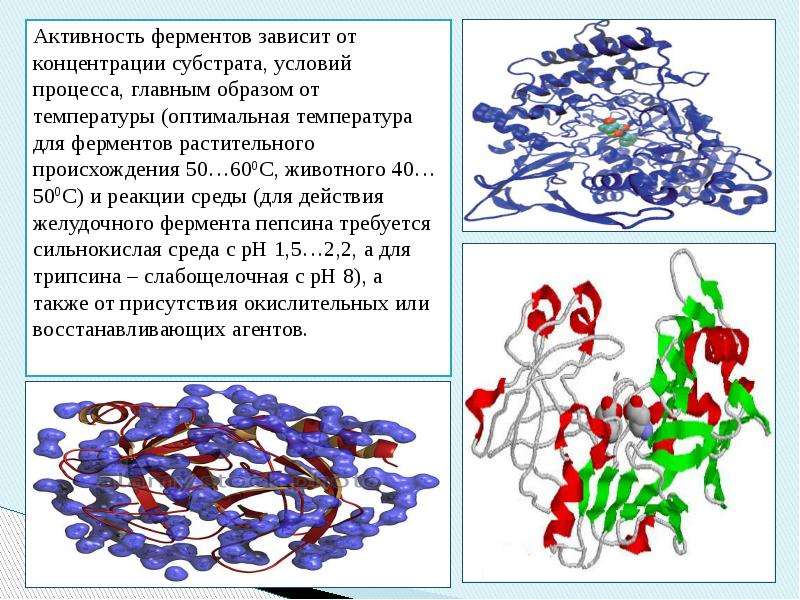 (2002) показали, что аминокислотные остатки, проявляющие относительно высокую гибкость в трансглютаминазах, локализованы в N-концевой области. Кроме того, было показано, что этот конец влияет на связывание с субстратом. Несколько мутантов с более высокой активностью были получены путем нацеливания на этот конец посредством сайт-направленного мутагенеза (del1-2, del1-3 и S2R) (Shimba et al., 2002).
(2002) показали, что аминокислотные остатки, проявляющие относительно высокую гибкость в трансглютаминазах, локализованы в N-концевой области. Кроме того, было показано, что этот конец влияет на связывание с субстратом. Несколько мутантов с более высокой активностью были получены путем нацеливания на этот конец посредством сайт-направленного мутагенеза (del1-2, del1-3 и S2R) (Shimba et al., 2002).
В последнее время условия экспрессии более легко растворимой рекомбинантной трансглутаминазы из Zea mays были оптимизированы в Pichia pastoris . Кодирующая последовательность была оптимизирована в соответствии со смещением кодонов P. pastoris и успешно трансформирована в штамм P. pastoris GS115 путем электропорации. Во время экспрессии использовали конечную концентрацию метанола 0,5%, и фермент трансглутаминаза был успешно очищен путем аффинного связывания с получением 4.4 мг / л фермента и удельная активность, близкая к 0,889 Ед / мг (Li et al. , 2013). Аналогичным образом Date et al. (2004) использовали химерный прорегион, состоящий из трансглутаминаз Streptomyces mobaraensis и Streptomyces cinnamoneus , для получения трансглутаминазы S. mobaraensis в Corynebacterium glutamicum . Было показано, что химерная прорегион имеет повышенную скорость секреции по сравнению с нативной прорегионом (Date et al., 2004).
, 2013). Аналогичным образом Date et al. (2004) использовали химерный прорегион, состоящий из трансглутаминаз Streptomyces mobaraensis и Streptomyces cinnamoneus , для получения трансглутаминазы S. mobaraensis в Corynebacterium glutamicum . Было показано, что химерная прорегион имеет повышенную скорость секреции по сравнению с нативной прорегионом (Date et al., 2004).
Наконец, широкое использование ферментов в пищевой промышленности приводит к появлению большого количества обработанных пищевых продуктов, содержащих остаточные ферменты.В этот момент ферменты, используемые во время обработки, становятся неотъемлемой частью этого конкретного продукта. Это основная причина, по которой правила безопасного использования ферментов имеют решающее значение (Pico et al., 1999). В Канаде использование ферментов в пищевой промышленности регулируется законом о пищевых добавках. Министерство здравоохранения Канады несет ответственность за проведение предпродажной оценки безопасности любого фермента, используемого в промышленности, и за одобрение их включения в такие процессы.
Среди факторов, влияющих на оценку безопасности, есть исходный организм.В целом съедобные растения и животные уже давно используются в пищевой промышленности в качестве источников ферментов. Любой микроорганизм, который будет использоваться для производства пищевых ферментов, должен быть хорошо охарактеризован. Готовый ферментный препарат не должен содержать патогенов, токсинов или антибиотиков. Почвенные микроорганизмы, которым люди обычно подвергаются через окружающую среду и диету, относятся к общепринятой группе микроорганизмов, которые могут использоваться в качестве естественных источников промышленных ферментов (Ladics, 2008; Woodcock et al., 2007). Еще одним важным соображением является наличие самой рецептуры фермента, в дополнение к коммерчески доступному конечному продукту, для прохождения тестов на токсичность до окончательной очистки (Ku et al., 2007; Olempska-Beer et al., 2006).
белков | Определение, структура и классификация
Белок , очень сложное вещество, которое присутствует во всех живых организмах. Белки имеют большую питательную ценность и непосредственно участвуют в химических процессах, необходимых для жизни.Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, производное от греческого prōteios , что означает «удерживать первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Белки имеют большую питательную ценность и непосредственно участвуют в химических процессах, необходимых для жизни.Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, производное от греческого prōteios , что означает «удерживать первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Популярные вопросы
Что такое белок?
Белок — это встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями.Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для дальнейшего использования в животных.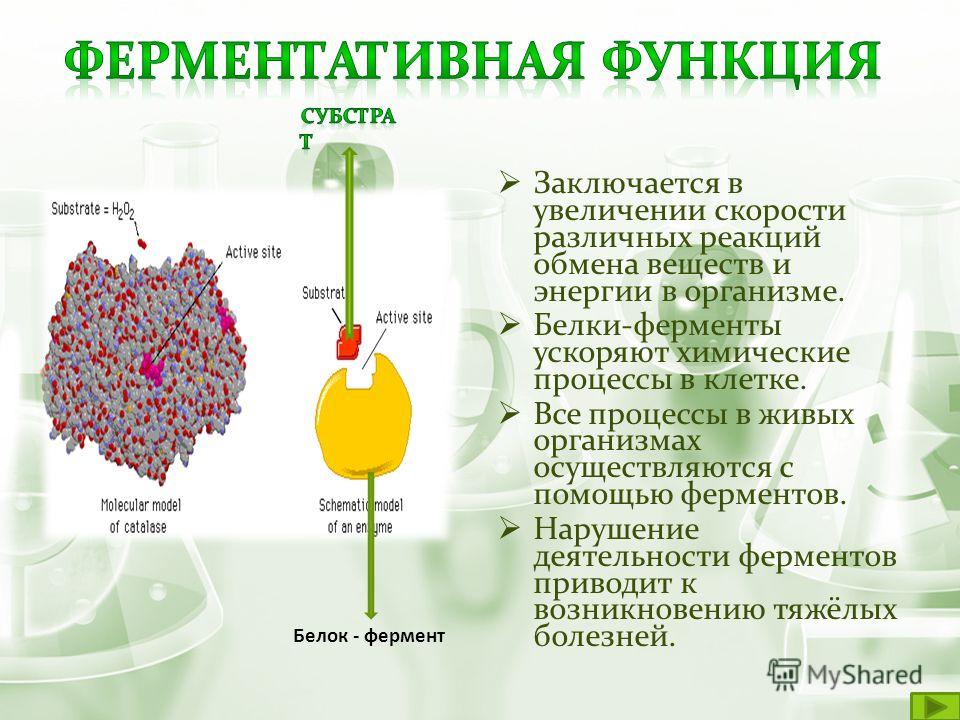 Когда животное потребляет избыток белков, они превращаются в жиры (глюкозу или триглицериды) и используются для снабжения энергией или создания энергетических запасов. Если животное не потребляет достаточное количество белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Когда животное потребляет избыток белков, они превращаются в жиры (глюкозу или триглицериды) и используются для снабжения энергией или создания энергетических запасов. Если животное не потребляет достаточное количество белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной деятельности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Белковая молекула очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных вместе, образуя длинные цепи, подобно тому, как бусинки расположены на нити. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка на основе его аминокислотной последовательности, установленные корреляции между структурой и функцией можно отнести к свойствам аминокислот, из которых состоят белки.
Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка на основе его аминокислотной последовательности, установленные корреляции между структурой и функцией можно отнести к свойствам аминокислот, из которых состоят белки.
Молекулярная структура пептида (небольшого белка) состоит из последовательности аминокислот.
© raimund14 / Fotolia Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, обеспечивающие азот, калий и другие вещества, необходимые для роста. В процессе фотосинтеза они используют углекислый газ, содержащийся в воздухе, для образования органических соединений, таких как углеводы.Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений низкое, очень большое количество растительного материала требуется животным, таким как жвачные животные (например, коровы), которые едят только растительный материал для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, в том числе люди, получают белки в основном от животных и их продуктов, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой, богатой белком пищи ( см. питание человека).
Поскольку содержание белка в большинстве растений низкое, очень большое количество растительного материала требуется животным, таким как жвачные животные (например, коровы), которые едят только растительный материал для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, в том числе люди, получают белки в основном от животных и их продуктов, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой, богатой белком пищи ( см. питание человека).
Бобовые, такие как фасоль, чечевица и горох, богаты белком и содержат много незаменимых аминокислот.
© Elenathewise / Fotolia Содержание белка в органах животных обычно намного выше, чем в плазме крови. Например, в мышцах содержится около 30 процентов белка, в печени — от 20 до 30 процентов, а в красных кровяных тельцах — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных намного меньше количества белка; Белковые молекулы производятся в клетках путем поэтапного выравнивания аминокислот и попадают в жидкости организма только после завершения синтеза.
Количество свободных аминокислот и пептидов у животных намного меньше количества белка; Белковые молекулы производятся в клетках путем поэтапного выравнивания аминокислот и попадают в жидкости организма только после завершения синтеза.
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые из наиболее важных белков, таких как ферменты и гормоны, присутствуют в очень малых количествах.Важность белков в основном связана с их функцией. Все идентифицированные ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни, — белки, нуклеиновые кислоты, углеводы и липиды, — превращать их в другие вещества и разлагать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями.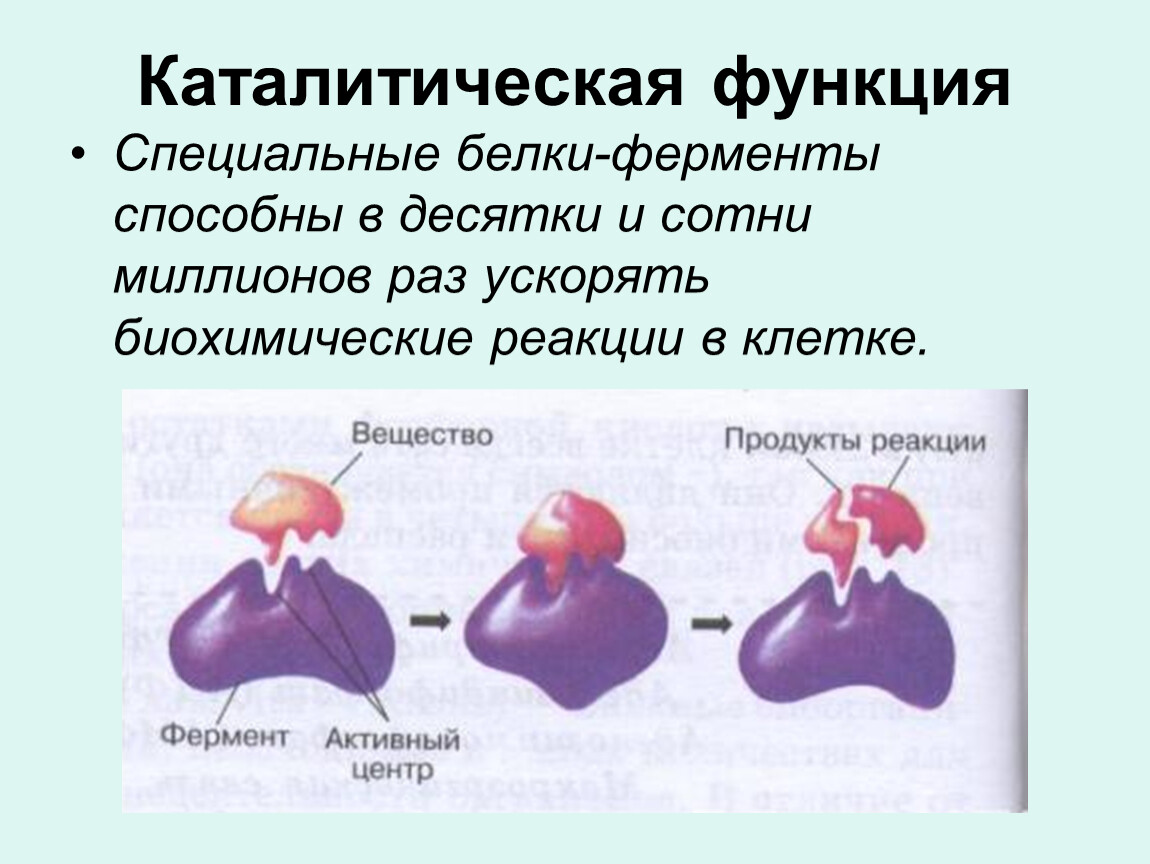 У всех позвоночных респираторный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела.Большая группа структурных белков поддерживает и защищает структуру тела животного.
У всех позвоночных респираторный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела.Большая группа структурных белков поддерживает и защищает структуру тела животного.
Гемоглобин — это белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ). Каждая цепь присоединена к группе гема, состоящей из порфирина (органическое кольцеобразное соединение), присоединенного к атому железа. Эти комплексы железо-порфирин обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в переносе кислорода в крови.
Encyclopædia Britannica, Inc.Центральная роль ферментов как биологических катализаторов — клетка
Фундаментальная задача белков — действовать как ферменты — катализаторы, которые увеличивают скорость практически всех химических реакций внутри клеток. Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками. В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что они не могут происходить в мягких условиях температуры и давления, совместимых с жизнью.Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, на которые в отсутствие катализа потребовались бы годы, могут происходить за доли секунды, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какая из многих возможных химических реакций действительно происходит внутри клетки.
В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что они не могут происходить в мягких условиях температуры и давления, совместимых с жизнью.Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, на которые в отсутствие катализа потребовались бы годы, могут происходить за доли секунды, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какая из многих возможных химических реакций действительно происходит внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя основными свойствами.Во-первых, они увеличивают скорость химических реакций, не будучи поглощенными реакцией и не подвергаясь ее постоянному изменению. Во-вторых, они увеличивают скорость реакции без изменения химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула, на которую воздействует фермент (называемая субстратом [ S ]), превращается в продукт ( P ) в результате реакции. В отсутствие фермента реакция может быть записана следующим образом:
В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено по соотношению скоростей прямой и обратной реакции ( S → P и P → S соответственно). В присутствии соответствующего фермента превращение S в P ускоряется, но равновесие между S и P не изменяется.Следовательно, фермент должен одинаково ускорять как прямую, так и обратную реакции. Реакция может быть записана следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется изменениями энергии, которые должны произойти во время превращения S в P (). Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция продолжилась, подложку необходимо сначала перевести в состояние с более высокой энергией, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для развития реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции.Повышенная скорость одинакова как в прямом, так и в обратном направлениях, поскольку оба должны проходить через одно и то же переходное состояние.
Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция продолжилась, подложку необходимо сначала перевести в состояние с более высокой энергией, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для развития реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции.Повышенная скорость одинакова как в прямом, так и в обратном направлениях, поскольку оба должны проходить через одно и то же переходное состояние.
Рис. 2.22
Энергетические диаграммы для катализированных и некаталитических реакций. Проиллюстрированная реакция представляет собой простое превращение субстрата S в продукт P . Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее …)
Для (подробнее …)
Каталитическая активность ферментов включает связывание их субстратов с образованием комплекса фермент-субстрат ( ES ).Субстрат связывается с определенной областью фермента, называемой активным центром. Связавшись с активным центром, субстрат превращается в продукт реакции, который затем высвобождается из фермента. Таким образом, реакция, катализируемая ферментами, может быть записана следующим образом:
Обратите внимание, что E остается неизменным с обеих сторон уравнения, поэтому равновесие не нарушается. Однако фермент обеспечивает поверхность, на которой реакции, превращающие S в P , могут протекать более легко.Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента является очень специфическим взаимодействием. Активные сайты — это щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, которые собраны вместе в третичной структуре свернутого белка. Субстраты изначально связываются с активным центром за счет нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Когда субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Субстраты изначально связываются с активным центром за счет нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Когда субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя простой пример, обсужденный в предыдущем разделе, включает только одну молекулу субстрата, большинство биохимических реакций включают взаимодействия между двумя или более различными субстратами. Например, образование пептидной связи включает соединение двух аминокислот.Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата сводятся вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции, также изменяя конформацию своих субстратов, чтобы приблизиться к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель с замком и ключом , в которой субстрат точно входит в активный центр (). Однако во многих случаях конфигурации как фермента, так и субстрата модифицируются связыванием субстрата — процесс, называемый индуцированной подгонкой . В таких случаях конформация субстрата изменяется так, что она больше напоминает конформацию переходного состояния.Напряжение, вызванное таким искажением подложки, может дополнительно облегчить ее переход в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется за счет его прочного связывания с ферментом, тем самым снижая требуемую энергию активации.
Рисунок 2.24
Модели взаимодействия фермент-субстрат. (A) В модели с замком и ключом субстрат точно входит в активный центр фермента. (B) В модели индуцированной подгонки связывание субстрата искажает конформации как субстрата, так и фермента.Это искажение (подробнее …)
(B) В модели индуцированной подгонки связывание субстрата искажает конформации как субстрата, так и фермента.Это искажение (подробнее …)
Помимо объединения нескольких субстратов и искажения конформации субстратов для достижения переходного состояния, многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях боковые цепи конкретных аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции. Кислые и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в следующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин является членом семейства ферментов (сериновых протеаз), которые переваривают белки, катализируя гидролиз пептидных связей. Реакцию можно записать следующим образом:
Различные члены семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) имеют различные субстратные специфичности; они предпочтительно расщепляют пептидные связи, прилегающие к различным аминокислотам. Например, в то время как химотрипсин расщепляет связи, соседние с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин.Однако все сериновые протеазы похожи по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три важные аминокислоты — серин, гистидин и аспартат, которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли серинового остатка.
Например, в то время как химотрипсин расщепляет связи, соседние с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин.Однако все сериновые протеазы похожи по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три важные аминокислоты — серин, гистидин и аспартат, которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли серинового остатка.
Субстраты связываются с сериновыми протеазами путем вставки аминокислоты, прилегающей к сайту расщепления, в карман на активном сайте фермента ().Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислотную аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами.Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. В химотрипсине карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее …)
Субстрат связывается с расщепляемой пептидной связью рядом с серином активного сайта (). Затем протон этого серина переносится на гистидин в активном центре. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным остатком аспартата.Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и С-концевая часть субстрата освобождается от фермента. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и обращает вспять предыдущие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа переносится на пептид, образуя второе тетраэдрическое переходное состояние.Затем протон переносится от гистидина обратно к серину, и пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.
Этот пример иллюстрирует несколько особенностей ферментативного катализа; специфичность взаимодействий фермент-субстрат, расположение различных молекул субстрата в активном центре и участие остатков активного сайта в формировании и стабилизации переходного состояния.Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, к их работе применимы одни и те же основные принципы.
Коферменты
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие небольшие молекулы, которые участвуют в катализе. Протезные группы — это небольшие молекулы, связанные с белками, в которых они играют важнейшие функциональные роли. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков.Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в определенных типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов, коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее они перерабатываются и могут участвовать во множестве ферментативных реакций.
Коферменты служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( NAD + ), который действует как переносчик электронов в реакциях окисления-восстановления (). NAD + может принимать ион водорода (H + ) и два электрона (e — ) от одной подложки, образуя NADH. Затем НАДН может отдавать эти электроны второй подложке, повторно образуя НАД + .Таким образом, NAD + переносит электроны от первой подложки (которая окисляется) ко второй (которая восстанавливается).
Рисунок 2.27
Роль NAD + в окислительно-восстановительных реакциях. (A) Никотинамидадениндинуклеотид (NAD + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (e —) с образованием NADH. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее …)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе множества дополнительных химических групп (e .g. карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые вносят часть или всю структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но они являются необходимыми компонентами рациона человека и других высших животных, которые утратили способность синтезировать эти соединения.
Регуляция активности ферментов
Важной особенностью большинства ферментов является то, что их активность непостоянна, а вместо этого может модулироваться. То есть активность ферментов можно регулировать таким образом, чтобы они функционировали надлежащим образом для удовлетворения разнообразных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование с обратной связью, при котором продукт метаболического пути подавляет активность фермента, участвующего в его синтезе.Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап этого пути катализируется ферментом треониндезаминазой, который ингибируется изолейцином, конечным продуктом пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, подавление обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин.Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но не тратит энергию на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Запрет обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента подавляется изолейцином, конечным продуктом метаболизма.
Ингибирование по обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется связыванием малых молекул с регуляторными участками фермента ().Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим сайтом, а с отдельным сайтом белка ( алло = «другой» и стерический = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) подавляет ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя целевые ферменты.
Рисунок 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция продолжается. Связывание (подробнее …)
Активность ферментов также может регулироваться их взаимодействием с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина.Фосфорилирование — особенно распространенный механизм регулирования активности ферментов; добавление фосфатных групп либо стимулирует, либо подавляет активность многих различных ферментов (). Например, мышечные клетки реагируют на адреналин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышенной мышечной активности. Распад гликогена катализируется ферментом гликогенфосфорилазой, который активируется фосфорилированием в ответ на связывание адреналина с рецептором на поверхности мышечной клетки.Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Рисунок 2.30
Фосфорилирование белков. Некоторые ферменты регулируются путем добавления фосфатных групп к ОН-группам боковой цепи серина (как показано здесь), треонина или тирозиновых остатков. Например, фермент гликогенфосфорилаза, который катализирует преобразование (подробнее …)
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Определение и примеры ферментов — Биологический онлайн-словарь
Рецензент: Тодд Смит, доктор философии
Определение
существительное
множественное число: ферменты
en · zyme, ˈɛnzaɪm
(11 biochemistry) который действует как катализатор для ускорения определенных химических реакций.Ферменты — это белки или молекулы РНК (рибозимы).
Обзор
Фермент — это биомолекула, которая может быть синтезирована биологическим путем (естественным путем) или посредством других процессов (синтетически). Его основная функция — действовать как катализатор, который ускоряет конкретную химическую реакцию, не изменяя себя в процессе. Ферменты — это обычно белковые молекулы с характерной последовательностью аминокислот, которые складываются, образуя определенную трехмерную структуру, которая придает молекуле уникальные свойства.
Белки — одна из основных биомолекул; другие — углеводы (особенно полисахариды), липиды и нуклеиновые кислоты. Ферменты, которые по своей природе являются белками, состоят из полимеров аминокислот. Аминокислоты соединены пептидными связями. Тип и последовательность аминокислот в ферментном белке кодируются ДНК в клетке, которая их производит. Хотя не все ферменты являются белками, не все белки также являются ферментами. Примером ферментов, не имеющих белковой природы, являются рибозимы.Рибозим — это фермент, состоящий из РНК, а не белка. Пример рибозима находится в рибосоме, которая представляет собой комплекс белков и каталитических единиц РНК.
Характеристики
Ферменты часто глобулярны. Они могут встречаться поодиночке или в составе комплекса. Они часто больше, чем их субстрат. Несмотря на большие размеры по сравнению с их субстратами, только небольшая часть фермента принимает непосредственное участие в катализе. Этот сайт, участвующий в катализе, называется каталитическим сайтом .Другой сайт в структуре фермента — это сайт связывания, через который субстрат реагирует или связывается с ним. Каталитический сайт и сайт связывания составляют активный сайт фермента. Аллостерический сайт фермента относится к сайту, где другая молекула может связываться, вызывая изменение конформации фермента, что затем приводит к его увеличению или снижению его активности. Есть два основных типа молекул, которые модулируют активность фермента: (1) ингибиторы и (2) активаторы.Ингибиторы — это молекулы, которые подавляют или снижают ферментативную активность. Активаторы — это молекулы, которые стимулируют или увеличивают ферментативную активность. Другими факторами, которые могут влиять на активность ферментов, являются денатурирующие вещества (хаотропные агенты). Воздействие температуры и pH за пределы оптимальных условий приводит к денатурации фермента. Денатурация приводит к потере ферментом своей структуры и каталитических свойств. Структура фермента имеет решающее значение для его функции. Специфика фермента основана на его уникальной трехмерной структуре.
Типы
Ферменты обычно классифицируют и называют в соответствии с реакциями, которые они катализируют. Международный союз биохимии и молекулярной биологии разработал номенклатуру ферментов, номера ЕС. Это следующие:
- EC 1 Оксидоредуктазы: катализируют реакции окисления / восстановления
- EC 2 Трансферазы: переносят функциональную группу (например, метильную или фосфатную группу)
- EC 3 Гидролазы: катализируют гидролиз различных связей
- EC 4 Лиазы: расщепляют различные связи способами, отличными от гидролиза и окисления
- EC 5 Изомеразы: катализируют изменения изомеризации в одной молекуле
- EC 6 Лигазы: соединяют две молекулы ковалентными связями
Общие биологические реакции
Производство ферментов По способу синтеза белка участвует транскрипция и трансляция .Внутри клеток фермент вырабатывается процессами транскрипции и трансляции. Транскрипция — это процесс, с помощью которого матрица мРНК, кодирующая последовательность аминокислот в форме тринуклеотидного кода, транскрибируется из ДНК для обеспечения матрицы для трансляции. Трансляция — это процесс, в котором аминокислоты соединяются в определенном порядке в соответствии с правилами, установленными генетическим кодом. Он состоит из четырех фаз: (1) активация (аминокислота ковалентно связана с тРНК), (2) инициация (малая субъединица рибосомы связывается с 5′-концом мРНК с помощью факторов инициации ), (3) удлинение (следующая аминоацил-тРНК в линии связывается с рибосомой вместе с GTP и фактором элонгации) и (4) терминация (сайт A рибосомы обращен к стоп-кодону).Новообразованная белковая структура подвергнется дальнейшим процессам, например посттрансляционная модификация и фальцовка.
Подобно любому катализатору, фермент может ускорить химическую реакцию, не изменяя равновесия реакции. Это означает, что катализатор в реакции не расходуется. Тем не менее, фермент отличается от небиологических катализаторов гораздо более специфичными. Прежде чем фермент сможет катализировать реакцию, он должен сначала связаться со своим субстратом. Согласно модели индуцированной подгонки, предложенной Дэниелом Кошландом в 1958 году, фермент претерпевает изменение формы при взаимодействии со своим субстратом, в то время как субстрат также может немного изменить форму, чтобы они в конечном итоге соответствовали друг другу.Фермент ускоряет биологический процесс за счет снижения энергии активации. Это достигается (1) за счет стабилизации переходного состояния, (2) за счет предоставления альтернативного пути и / или (3) за счет дестабилизации основного состояния субстрата.
Некоторым ферментам для их каталитической активности требуются небелковые молекулы, называемые кофакторами. Кофактор может быть органическим или неорганическим. Кофакторы обычно связываются с активным центром фермента. Когда кофактор не связан, фермент называют апоферментом; Связанный фермент называется холоферментом (однако, холофермент также относится к ферменту, содержащему несколько белковых субъединиц).
Кофермент — это молекула, которая переносит химические группы (например, гидрид-ион, фосфатную группу, ацетильную группу, метильную группу и т. Д.) От одного фермента к другому. Примерами коферментов являются NADH, NADPH, ATP, FMN (флавинмононуклеотид), FAD (флавинадениндинуклеотид), TPP (тиаминпирофосфат) и THF (тетрагидрофолат).
Биологические функции
Ферменты — это биологические катализаторы. Они ускоряют химические реакции. Почти во всех метаболических процессах используются ферменты, ускоряющие превращение субстратов в продукты.Ферменты ускоряют скорость реакции примерно в миллион раз быстрее, чем процесс без фермента.
Этимология
- Немецкий фермент , Средневековый греческий enzūmos , (дрожжевой)
Связанные термины:
См. Также
© Biology Online. Контент предоставлен и модерируется Biology Online Editors
Ферменты являются природными катализаторами — Бакман
Свяжитесь с нами
Имя *
Фамилия * E-mail *
Компания * Страна * — ArubaAfghanistanAngolaAnguillaÅland IslandsAlbaniaAndorraUnited Arab EmiratesArgentinaArmeniaAmerican SamoaAntarcticaFrench Южный TerritoriesAntigua и BarbudaAustraliaAustriaAzerbaijanBurundiBelgiumBeninBonaire, Синт-Эстатиус и SabaBurkina FasoBangladeshBulgariaBahrainBahamasBosnia и HerzegovinaSaint BarthélemyBelarusBelizeBermudaBolivia, многонациональное государство ofBrazilBarbadosBrunei DarussalamBhutanBouvet IslandBotswanaCentral Африканский RepublicCanadaCocos (Килинг) IslandsSwitzerlandChileChinaCôte d’IvoireCameroonCongo, Демократическая Республика theCongoCook IslandsColombiaComorosCape VerdeCosta RicaCubaCuraçaoChristmas IslandCayman IslandsCyprusCzech RepublicGermanyDjiboutiDominicaDenmarkDominican RepublicAlgeriaEcuadorEgyptEritreaWestern SaharaSpainEstoniaEthiopiaFinlandFijiFalkland острова (Мальвинские) FranceFaroe IslandsMicronesia, Федеративные Штаты ofGabonUnited KingdomGeorgiaGuernseyGhanaGibr altarGuineaGuadeloupeGambiaGuinea-BissauEquatorial GuineaGreeceGrenadaGreenlandGuatemalaFrench GuianaGuamGuyanaHong Island KongHeard и McDonald IslandsHondurasCroatiaHaitiHungaryIndonesiaIsle из ManIndiaBritish Индийского океана TerritoryIrelandIran, Исламская Республика ofIraqIcelandIsraelItalyJamaicaJerseyJordanJapanKazakhstanKenyaKyrgyzstanCambodiaKiribatiSaint Киттс и NevisKorea, Республика ofKuwaitLao Народная Демократическая RepublicLebanonLiberiaLibyaSaint LuciaLiechtensteinSri LankaLesothoLithuaniaLuxembourgLatviaMacaoSaint Мартин (французская часть) MoroccoMonacoMoldova, Республика ofMadagascarMaldivesMexicoMarshall IslandsMacedonia, бывшая югославская Республика ofMaliMaltaMyanmarMontenegroMongoliaNorthern Mariana IslandsMozambiqueMauritaniaMontserratMartiniqueMauritiusMalawiMalaysiaMayotteNamibiaNew CaledoniaNigerNorfolk IslandNigeriaNicaraguaNiueNetherlandsNorwayNepalNauruNew ЗеландияОманПакистанПанамаПиткэрнПеруФилиппиныПалауПапуа-Новая ГвинеяПольшаПуэрто-РикоКорея, Народно-Демократическая Республика ofPortugalParaguayPalestine, Государственный ofFrench PolynesiaQatarRéunionRomaniaRussian FederationRwandaSaudi ArabiaSudanSenegalSingaporeSouth Джорджия и Южные Сандвичевы IslandsSaint Елены, Вознесения и Тристан-да CunhaSvalbard и Ян MayenSolomon IslandsSierra LeoneEl SalvadorSan MarinoSomaliaSaint Пьер и MiquelonSerbiaSouth SudanSao Томе и PrincipeSurinameSlovakiaSloveniaSwedenSwazilandSint Маартен (Голландская часть) SeychellesSyrian Arab RepublicTurks и Кайкос IslandsChadTogoThailandTajikistanTokelauTurkmenistanTimor-LesteTongaTrinidad и TobagoTunisiaTurkeyTuvaluTaiwan, Провинция КитайТанзания, Объединенная Республика Уганда, Украина, Малые острова США, Уругвай, Соединенные Штаты, Узбекистан, Священное Пейзаж (государство-город Ватикан), Сент-Винсент и Гренадины, Венесуэла, Боливарианская Республика, Виргинские острова, Британские Виргинские острова, США.S.Viet NamVanuatuWallis и FutunaSamoaYemenSouth AfricaZambiaZimbabwe
Государство / Регион *
— Азия PacificChinaEurope, Ближний Восток, Н. AfricaLatin AmericaNorth АмерикаЮжная AfricaAlabamaAlaskaArizonaArkansasCaliforniaColoradoConnecticutDelawareWashington DCFloridaGeorgiaHawaiiIdahoIllinoisIndianaIowaKansasKentuckyLouisianaMaineMarylandMassachusettsMichiganMinnesotaMississippiMissouriMontanaNebraskaNevadaNew HampshireNew JerseyNew MexicoNew YorkNorth CarolinaNorth DakotaOhioOklahomaOregonPennslyvaniaRhode IslandSouth CarolinaSouth DakotaTennesseeTexasUtahVermontVirginiaWashingtonWest VirginiaWisconsinWyoming
Комментарий
Ферменты использовались в приготовлении пищи, хотя и неосознанно, на протяжении веков.Они играют ключевую роль в создании сыра, закваски хлеба, пива и виноделия, и это лишь некоторые из них. Они также широко используются в индустрии биотоплива для производства этанола из различных культур. В этих процессах они помогают экономить энергию и ресурсы, а также повышают общую эффективность. Ферменты снижают энергию активации, необходимую для многих ключевых химических реакций на этапах обработки, подобных упомянутым выше.
В тканевой промышленности мы используем ферменты для увеличения прочности волокон без негативных побочных эффектов рафинирующих смол или смол, повышающих прочность в сухом состоянии.В то время как смолы для повышения прочности в сухом состоянии часто применяются в количестве от 2 до 10 кг на тонну и требуют доставки автоцистернами каждые несколько недель, нормы добавления ферментов измеряются в граммах на тонну. Заказ на цистерну ферментов может прослужить вам десять лет! Таким образом, покупатели бумажных салфеток меньше обращаются с продуктом и меньше платят за доставку.
Назад к Maximyze for Tissue, стр.
Восстание мутантов: улучшение природных ферментов
Группа исследователей из Оттавского университета искала способы улучшить методологии разработки ферментов и недавно опубликовала свои результаты в Nature Communications .
Ферменты используются во многих промышленных и биотехнологических целях. Обладая многочисленными полезными свойствами, они являются наиболее эффективными известными катализаторами — они даже способны ускорять химические реакции более чем в миллиард раз. Но поскольку количество естественных ферментных активностей ограничено, количество применений также остается ограниченным. Хотя исследователям удалось создать искусственные ферменты, их каталитическая эффективность не достигает такого же уровня, как у природных ферментов.
Не могли бы вы рассказать нам больше об искусственно созданных ферментах?
«За последние 20 лет исследователи успешно разработали искусственные ферменты с нуля для различных модельных органических преобразований. Это было сделано с использованием процедуры, называемой« вычислительный дизайн ферментов », где каталитический сайт был создан с помощью вычислений на уже существующем белке. каркас, лишенный целевой каталитической активности.
Несмотря на успех, этот подход позволил получить исключительно искусственные ферменты, демонстрирующие каталитическую эффективность, которая на несколько порядков ниже, чем у природных ферментов, что требует последующей оптимизации с использованием так называемой «направленной эволюции» для повышения активности.Направленная эволюция — это процесс, при котором в белок вводятся случайные мутации для создания большой библиотеки мутантных ферментов, которые затем подвергаются скринингу для выявления полезных мутаций. Для значительного увеличения активности часто требуется несколько раундов случайного мутагенеза и скрининга ».
Как ваше исследование соотносится с направленной эволюцией?
« В нашей работе мы показываем, как направленная эволюция улучшает каталитическую эффективность компьютерно разработанного биокатализатора примерно на В 1000 раз, настроив ансамбль структурных подсостояний, которые может пробовать фермент, в пользу тех, которые являются каталитически компетентными.
Основываясь на этих наблюдениях, мы конструируем искусственный биокатализатор с каталитической эффективностью, сопоставимой с каталитической эффективностью среднего природного фермента ».
Что является важным открытием?
« Мы разработали новую вычислительную процедуру для дизайна ферментов, которая является более точной. чем предыдущие методы, поскольку они позволяют приблизительно оценить внутреннюю гибкость белкового каркаса, используемого в качестве шаблона для дизайна ».
Почему это важно?
« Это важно, потому что предыдущие методы были сосредоточены на создании стабильной структуры, которая игнорирует присущий динамизм природные ферменты, которые имеют решающее значение для их функции (т.е. ферменты должны «двигаться», чтобы быть эффективными катализаторами).
Ранее не было известно, можно ли с помощью вычислений создать искусственный фермент, демонстрирующий каталитическую эффективность наравне с природным ферментом. Мы показываем, что это возможно, но только при использовании структурного ансамбля белковых шаблонов, приближающих конформационную гибкость, вместо одного шаблона, как это делалось ранее.
Результаты, представленные в нашей рукописи, предполагают, что компьютерный дизайн ферментов с использованием структурного ансамбля может предотвратить необходимость направленной эволюции, позволяя отбирать каталитически компетентные подсостояния во время процедуры дизайна.