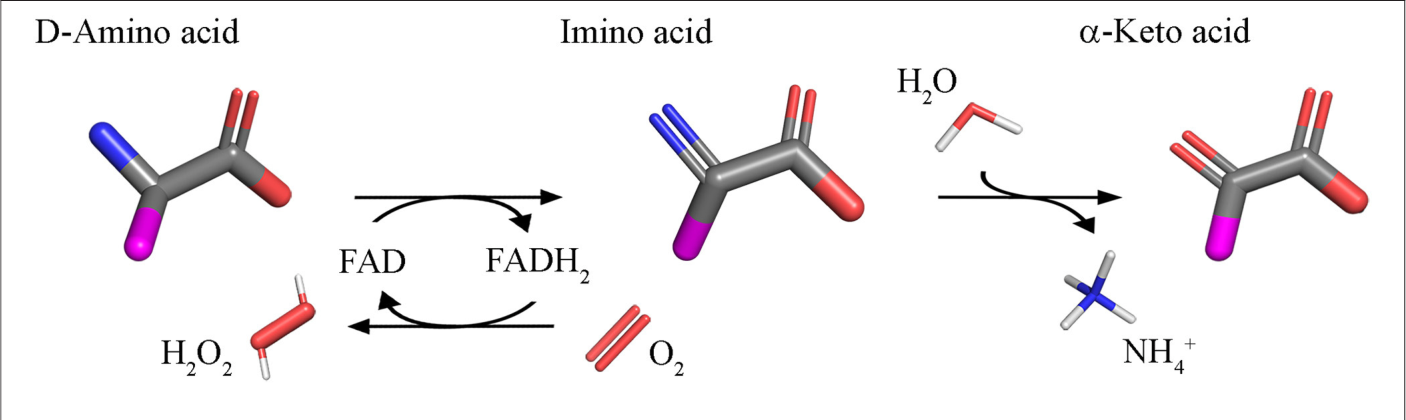
D-аминокислоты: не только в Зазеркалье
По до сих пор неизвестным причинам в состав белков живых организмов входят преимущественно L-энантиомеры (оптические изомеры) аминокислот, — за довольно редкими и разрозненными исключениями вроде пептидных веществ, образующихся в грибах и бактериях путём нерибосомного синтеза. (Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.
Верно ли, что Оспод и Погг, не ограничиваясь обычным загрязнением беззащитной, пустынной планеты, решили, по пьяному делу, учинить на ней, самым бесстыдным и возмутительным образом, биологическую эволюцию, какой еще свет не видывал? <.
..> Верно ли, что эти безобразники, лишенные всякого чувства приличия и нравственных тормозов, вылили на скалы безжизненной Земли шесть бочек заплесневелого желатинового клея и два ведра испорченной альбуминовой пасты, подсыпали туда забродившей рыбозы, пентозы и левуллозы и, словно им мало было всех этих гадостей, добавили три больших бидона с раствором прокисших аминокислот, а получившееся месиво взболтали угольной лопатой, скособоченной влево, и кочергой, скрученной в ту же сторону, в результате чего белки всех будущих земных существ стали ЛЕВОвращающими?!С. Лем,
«Звездные дневники Ийона Тихого. Путешествие восьмое» (1966 г.)
Вступив из своей комнаты в загадочный мир зазеркалья, маленькая героиня Льюиса Кэррола — английская девочка Алиса — узнала, что эти два мира, на первый взгляд выглядящие столь похожими, на самом деле существенно отличаются. Алиса интуитивно чувствует, что даже молоко в мире-отражении совсем не такое, как тот вкусный и полезный напиток, которым она привыкла наслаждаться у себя в Англии: «Впрочем, не знаю, можно ли пить зазеркальное молоко? Не повредит ли оно тебе, Китти. ..» [1]. И правда: то ли Кэррол (то есть, конечно, Чарльз Лютвидж Доджсон) уже знал о стереохимических свойствах органических соединений, то ли предвосхитил это знание, — но так или иначе, подавляющее большинство биологических молекул может существовать в виде двух зеркальных отражений друг друга, не совмещаемых простым наложением. Девятнадцать из 20 природных аминокислот (кроме глицина) являются хиральными, — то есть, расположение заместителей вокруг центрального атома углерода (Cα) может дать две зеркально-симметричные молекулы, похожие друг на друга как перчатки с левой и правой руки. Пары таких молекул называются
..» [1]. И правда: то ли Кэррол (то есть, конечно, Чарльз Лютвидж Доджсон) уже знал о стереохимических свойствах органических соединений, то ли предвосхитил это знание, — но так или иначе, подавляющее большинство биологических молекул может существовать в виде двух зеркальных отражений друг друга, не совмещаемых простым наложением. Девятнадцать из 20 природных аминокислот (кроме глицина) являются хиральными, — то есть, расположение заместителей вокруг центрального атома углерода (Cα) может дать две зеркально-симметричные молекулы, похожие друг на друга как перчатки с левой и правой руки. Пары таких молекул называются
Одной из самых интересных загадок зарождения жизни является преимущественное использование в качестве «строительных блоков» белков именно L-аминокислот, в то время как их D-аналоги долгое время считались чуть ли не биохимическим недоразумением, которым можно с чистой совестью пренебречь [2–4]. (Впрочем, определённые соображения на этот счет все же есть: см. эпиграф. — А. Ч.) Однако, время не стоит на месте: в журнале Science появилась статья, авторы которой бросают вызов этому устаревшему представлению и показывают, что D-аминокислоты играют важную роль в жизни бактерий, управляя их реакцией на различные пищевые стимулы [5].
(Впрочем, определённые соображения на этот счет все же есть: см. эпиграф. — А. Ч.) Однако, время не стоит на месте: в журнале Science появилась статья, авторы которой бросают вызов этому устаревшему представлению и показывают, что D-аминокислоты играют важную роль в жизни бактерий, управляя их реакцией на различные пищевые стимулы [5].
Если вернуться к Алисе, то её сомнения насчет молока были отнюдь не беспочвенными: ведь пара «зеркальных» молекул, хотя во многих отношениях и идентична (например, молекулярная масса, углы и длины связей у них равны), может иметь разительно отличающиеся биологические характеристики. В частности, Алисе вряд ли удалось бы переварить молоко, белки которого состоят исключительно из D-аминокислот. Такое смещение «равновесия» в сторону L-аминокилот, безусловно, ставит вопрос: а играют ли D-аминокислоты какую-то роль в природе? Исследование Губерта Лэма (Hubert Lam) [5] — учёного из Гарварда и Института Ховарда Хьюза в США, — а также его коллег, показывает, что неизвестное — не значит «не существующее»: согласно их данным, D-аминокислоты управляют у бактерий таким важным процессом как «сборка» клеточной стенки.
Клеточная стенка является, по сути, «крепостной стеной» бактериальной клетки, защищая её от разнообразных неблагоприятных факторов окружающей среды. Состоит она главным образом из пептидогликана — эластичного полимера, в котором сахара и аминокислоты «сшиваются» между собой подобно сетке и охватывают бактериальную мембрану целиком. Одна из ролей D-аминокислот здесь — образовывать поперечные пептидные сшивки между длинными углеводными тяжами пептидогликанов; эти сшивки обогащены D-аланином и D-глутаминовой кислотой, роль которых предположительно заключается в противостоянии расщеплению клеточной стенки враждебными ферментами-гидролазами, «настроенными» только на L-аминокислоты.
Для успешного роста и процветания микроорганизмов пептидогликан должен обладать незаурядной пластичностью: ведь бактерии, оказавшись в богатой питательными веществами среде, немедленно начинают делиться, и клеточная стенка должна делиться вместе с ними, чтобы не оставить потомство без защиты. В период сомнений и тягостных раздумий стресса же пептидогликан должен, наоборот, становиться жёстче, чтобы максимально усилить защиту бактерии.
Одним из объектов, с которым работала команда Лэма, является бактерия Vibrio cholerae, или холерный вибрион, являющийся возбудителем острой кишечной инфекции. Исследователи отметили, что состояние клеточной стенки бактерии меняется в зависимости от содержания в питательной среде определённых аминокислот. К удивлению учёных, D- (а не L-!) энантиомеры метионина и лейцина вызывали замедление синтеза пептидогликана и смену «режима» образования поперечных сшивок в клеточной стенке. Роль этих аминокислот в перестройке клеточной стенки была дополнительно подтверждена открытием у холерного вибриона нового фермента, синтезирующего эти D-аминокислоты. Что интересно, в аналогичный процесс у грамположительной бактерии
Как именно под действием D-аминокислот происходит перестройка клеточной стенки, пока в точности не ясно. По-видимому, увеличение их содержания как-то влияет на частоту и/или длину сшивок пептидогликана и, следовательно, на прочность и гибкость. Нельзя исключить также возможность, что D-аминокислоты регулируют активность периплазматических ферментов, синтезирующих и перестраивающих клеточную стенку.
По-видимому, увеличение их содержания как-то влияет на частоту и/или длину сшивок пептидогликана и, следовательно, на прочность и гибкость. Нельзя исключить также возможность, что D-аминокислоты регулируют активность периплазматических ферментов, синтезирующих и перестраивающих клеточную стенку.
Постепенно накапливаются и другие примеры функциональной важности D-аминокислот. У некоторых видов бацилл образование вегетативных клеток из спор регулируется именно относительным содержанием в среде L- и D-аминокислот, которые, соответственно, индуцируют или замедляют проращивание посредством взаимодействия со специальными рецепторами на поверхности спор [6]. На поверхности капсулы B. anthracis — возбудителя сибирской язвы — находятся полимеры с высоким содержанием D-глутаминовой кислоты, что, по-видимому, защищает бактерию от действия протеаз [7]. D-аминокислоты во множестве содержатся в природных антибиотиках, иммуносупрессорных лекарствах и противоопухолевых веществах [8].
Хотя еще совсем недавно D-аминокислоты считались исключительно «артефактом» бактерий и грибов, появляются данные и о роли этих веществ у эукариот. Эндогенный D-серин выполняет в мозгу млекопитающих функцию нейротрансмиттера [9]. D-аспарагиновая кислота найдена в нейроэндокринных тканях млекопитающих, где она модулирует гормональную секрецию [10].
Эндогенный D-серин выполняет в мозгу млекопитающих функцию нейротрансмиттера [9]. D-аспарагиновая кислота найдена в нейроэндокринных тканях млекопитающих, где она модулирует гормональную секрецию [10].
Возвращаясь напоследок снова к Алисе — точнее, к её создателю Чарлзу Доджсону, — можно высказать предположение, что он (Доджсон) всё-таки знал о вопросах, возникающих в стереохимии, поскольку Луи Пастер (знаменитый химик и микробиолог) был его современником. Пастер к тому моменту уже опубликовал несколько работ по хиральным свойствам винной кислоты, найденной
Открытия новых функций D-аминокислот, несомненно, продолжатся, и несправедливой дискриминации этих неплохих, в сущности, соединений недолго ещё осталось жить на Земле 🙂
По материалам рубрики «Перспектива» Science [11].
- Кэррол Л. Сквозь зеркало и что там увидела Алиса, или Алиса в Зазеркалье.
 М.: «Наука», 1991;
М.: «Наука», 1991; - Victor S Lamzin, Zbigniew Dauter, Keith S Wilson. (1995). How nature deals with stereoisomers. Current Opinion in Structural Biology. 5 , 830-836;
- Stephen F. Mason. (1984). Origins of biomolecular handedness. Nature. 311, 19-23;
- V Prelog. (1976). Chirality in chemistry. Science. 193, 17-24;
- H. Lam, D.-C. Oh, F. Cava, C. N. Takacs, J. Clardy, et. al.. (2009). D-Amino Acids Govern Stationary Phase Cell Wall Remodeling in Bacteria. Science. 325, 1552-1555;
- M. T. McKevitt, K. M. Bryant, S. M. Shakir, J. L. Larabee, S. R. Blanke, et. al.. (2007). Effects of Endogenous D-Alanine Synthesis and Autoinhibition of Bacillus anthracis Germination on In Vitro and In Vivo Infections. Infection and Immunity. 75, 5726-5734;
- J.
 W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol
W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol - J. Grunewald, M. A. Marahiel. (2006). Chemoenzymatic and Template-Directed Synthesis of Bioactive Macrocyclic Peptides. Microbiology and Molecular Biology Reviews. 70, 121-146;
- Aude Panatier, Dionysia T. Theodosis, Jean-Pierre Mothet, Bastien Touquet, Loredano Pollegioni, et. al.. (2006). Glia-Derived d-Serine Controls NMDA Receptor Activity and Synaptic Memory. Cell. 125, 775-784;
- A. S. Huang. (2006). D-Aspartate Regulates Melanocortin Formation and Function: Behavioral Alterations in D-Aspartate Oxidase-Deficient Mice. Journal of Neuroscience. 26, 2814-2819;
- S. R. Blanke. (2009). Expanding Functionality Within the Looking-Glass Universe. Science. 325, 1505-1506.

Роль D-аминокислот в патогенезе нейродегенеративных заболеваний и при нормальном старении Текст научной статьи по специальности «Фундаментальная медицина»
Роль D-аминокислот в патогенезе нейродегенеративных заболеваний и при нормальном старении
А.В. Червяков, М.Н. Захарова, Н.Б. Пестов
ФГБУ «Научный центр неврологии» РАМН; ФГБУ Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (Москва)
Недавние исследования показали, что D-аминокислоты широко представлены в тканях высших организмов, в том числе человека. Определены специфические функции отдельных D-аминокислот в здоровом организме: так, D-серин играет важную роль в нейропластичности, процессах памяти, обучения, а D-аспартат вовлечен в процессы развития и эндокринные функции. Натогенность D-аминокислот связана с гиперактивацией NMDA-рецепторов глутамата, изменением конформации нормальных белковых молекул при встраивании в полипептидную цепь, повышением концентрации активных форм кислорода при оксидазном метаболизме D-аминокислот.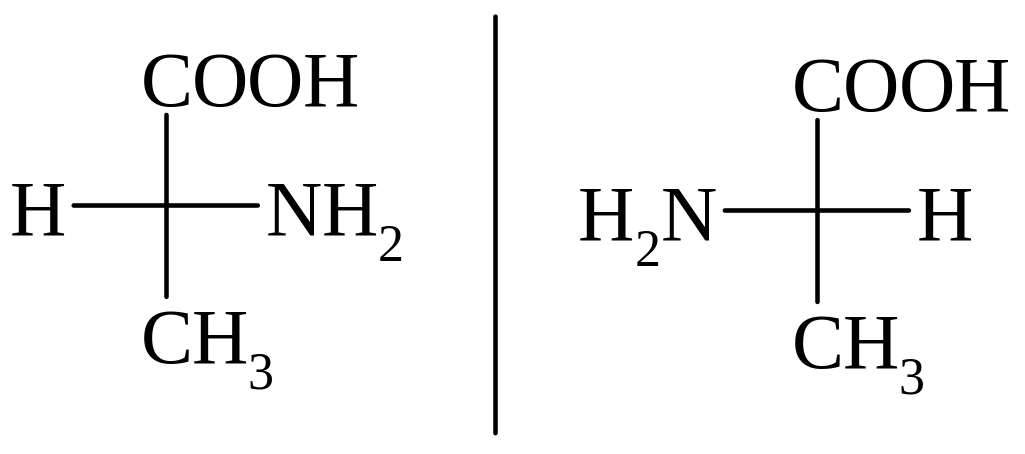 Оценка уровня D-аминокислот в биологических жидкостях, а также определение активности ферментов их метаболизма и мутаций кодирующих их генов могут служить диагностическим маркером при некоторых заболеваниях ЦНС (болезнь Альцгеймера, болезнь Наркинсона, боковой амиотрофическитй склероз и др.). Практический интерес к содержанию D-аминокислот и их функциям связан также с возможностями разработки новых терапевтических стратегий, направленных на коррекцию синтеза/деградации D-аминокислот и модуляцию активности соответствующих рецепторов.
Оценка уровня D-аминокислот в биологических жидкостях, а также определение активности ферментов их метаболизма и мутаций кодирующих их генов могут служить диагностическим маркером при некоторых заболеваниях ЦНС (болезнь Альцгеймера, болезнь Наркинсона, боковой амиотрофическитй склероз и др.). Практический интерес к содержанию D-аминокислот и их функциям связан также с возможностями разработки новых терапевтических стратегий, направленных на коррекцию синтеза/деградации D-аминокислот и модуляцию активности соответствующих рецепторов.
Ключевые слова: D-аминокислоты, NMDA-рецепторы, нейродегенеративные заболевания, старение.
Введение_
В 1848 г., изучая физические свойства винной кислоты, Луи Пастер обнаружил, что кислота, полученная при брожении, отличается по своим свойствам от химически синтезированной изомерной ей молекулы. Изучая кристаллы кислоты под микроскопом, он выделил два их типа, являющихся «зеркальным» отражением друг друга. Образец, состоящий из кристаллов одного типа, поворачивал плоскость поляризации по часовой стрелке, а другого — против. Пастер пришел к заключению, что кристаллы состоят из молекул различной структуры. Химические реакции создают оба их типа с одинаковой вероятностью, однако живые организмы используют лишь один из них. Таким образом, впервые была показана хиральность молекул — отсутствие симметрии относительно правой и левой стороны. Как было открыто позже, тем же свойством обладают и аминокислоты [10, 151, 152]. Позже было продемонстрировано, что оптическая активность обусловлена, прежде всего, свойствами молекул и молекулярных структур по отношению к операции зеркального отражения [114, 184].
Образец, состоящий из кристаллов одного типа, поворачивал плоскость поляризации по часовой стрелке, а другого — против. Пастер пришел к заключению, что кристаллы состоят из молекул различной структуры. Химические реакции создают оба их типа с одинаковой вероятностью, однако живые организмы используют лишь один из них. Таким образом, впервые была показана хиральность молекул — отсутствие симметрии относительно правой и левой стороны. Как было открыто позже, тем же свойством обладают и аминокислоты [10, 151, 152]. Позже было продемонстрировано, что оптическая активность обусловлена, прежде всего, свойствами молекул и молекулярных структур по отношению к операции зеркального отражения [114, 184].
„sc st\ nh3 h3n
r r
рис. 1: Пространственная структура двух оптических изомеров молекулы с одним асимметричным центром С* [1].
На рис. 1 показаны зеркальные изоформы молекулы аминокислоты, тетраэдрическая структура которой содержит асимметричный центр — атом углерода С*, связанный с четырьмя разными заместителями. Как известно, из таких молекул-звеньев построены белковые полимерные цепи, образующие белки-ферменты [1]. Если молекула имеет один асимметричный центр, то существуют только два оптических зеркальных ее изомера, которые называются энантиомерами и обозначаются соответственно как L (левый) и Б (правый). Если же молекула содержит N асимметричных центров, то всего имеется ее оптических изомеров. Раствор, содержащий только один энантиомер, обладает максимальной оптической активностью и называется оптически чистым [1].
1 показаны зеркальные изоформы молекулы аминокислоты, тетраэдрическая структура которой содержит асимметричный центр — атом углерода С*, связанный с четырьмя разными заместителями. Как известно, из таких молекул-звеньев построены белковые полимерные цепи, образующие белки-ферменты [1]. Если молекула имеет один асимметричный центр, то существуют только два оптических зеркальных ее изомера, которые называются энантиомерами и обозначаются соответственно как L (левый) и Б (правый). Если же молекула содержит N асимметричных центров, то всего имеется ее оптических изомеров. Раствор, содержащий только один энантиомер, обладает максимальной оптической активностью и называется оптически чистым [1].
Таким образом, Пастер пришел к выводу о том, что молекулярная основа жизни асимметрична [151, 152]. В природе ведущей физической основой асимметрии является слабое взаимодействие, «отдающее предпочтение», в частности, L-аминокислотам и Б-сахарам [126, 127].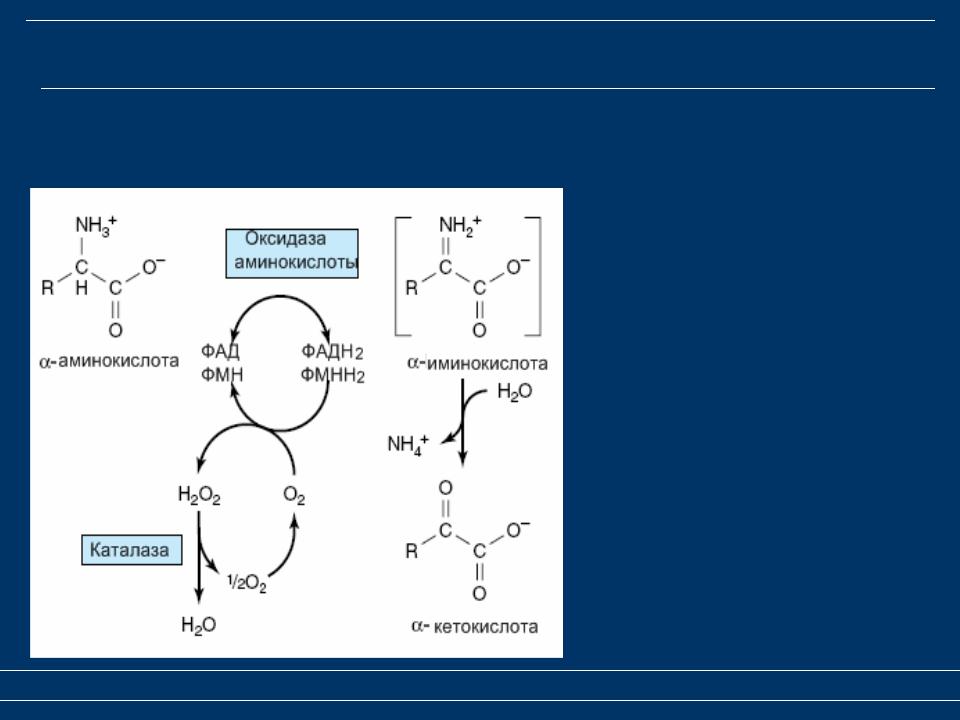 В живой клетке энантиомерный контроль осуществляется на системном уровне: определенные группы ферментов разрушают «неприродные» энантиомеры, возникающие спонтанно — в процессе старения либо под действием вредных экологических факторов, например, ионизирующего излучения [7, 21, 92]. Определенные группы ферментов там, где это необходимо, выполняют стереоспецифические функции [4].
В живой клетке энантиомерный контроль осуществляется на системном уровне: определенные группы ферментов разрушают «неприродные» энантиомеры, возникающие спонтанно — в процессе старения либо под действием вредных экологических факторов, например, ионизирующего излучения [7, 21, 92]. Определенные группы ферментов там, где это необходимо, выполняют стереоспецифические функции [4].
Механизмы действия некоторых лекарств основан на том, что разные энантиомерные формы одного и того же препарата могут привести к прямо противоположным результатам [1]. Известен случай трагических последствий игнорирования этого обстоятельства, когда испытания оптически чистой формы талидомида дали хорошие результаты, а выпуск рацемической (смешанной) формы этого привел к массовым тяжелейшим заболеваниям. Как потом выяснилось, виной всему оказался другой энантиомер, который тоже обладал сильной, но «отрицательной» биологической активностью. Еще пример: широко известный противо-
паркинсонический препарат L-ДОПА применяется только в данной оптической форме, так как D-энантиомер просто не проникает через гематоэнцефалический барьер [1].
До настоящего времени считалось, что все живые организмы содержат и используют в своей жизнедеятельности только L-аминокислоты, а D-аминокислоты элиминировались на заре возникновения жизни. В этой связи наличие и функция D-аминокислот в живых организмах долгое время оставались неочевидными [38]. Первые данные о наличии D-аминокислот в тканях животных выявлены у амфибий и беспозвоночных. Методом хроматографии свободный D-аланин был выделен из крови некоторых насекомых [20], а впоследствии стали появляться работы, описывающие наличие D-аланина, D-глутамата, D-орнитина, D-серина, D-аспарагина, D-цистеина и др. [23, 39, 111, 158] в составе полипептидов у животных. Было сделано предположение, что D-аминокислоты у млекопитающих появились из продуктов жизнедеятельности эндогенной флоры или при спонтанной рацемизации L-аминокислот в структуре полипептидов в процессе старения [83].
Исследования, выполненные на млекопитающих, показали наличие D-аспарагиновой кислоты ф-аспартата) в различных тканях организма, например в хрусталике [63, 128], головном мозге [160, 174], а также зубах, коже, костях, аорте, эритроцитах, легких и связках при старении [64]. D-серин был найден в структуре р-амилоида при болезни Альцгеймера (БА) [97, 160]. Некоторые D-аминокислоты присутствуют в тканях ЦНС млекопитающих и на периферии в неожиданно высоких концентрациях, иногда в более высоких, чем их L-энантиомеры [76]. Эти D-аминокисло-ты выполняют в организме специфические функции: так, D-серин играет важную роль в нейротрансмиссии, а D-аспартат — в процессе развития и эндокринной регуляции. Изменение уровня D- аминокислот может быть связано с различными патологическими состояниями.
D-серин был найден в структуре р-амилоида при болезни Альцгеймера (БА) [97, 160]. Некоторые D-аминокислоты присутствуют в тканях ЦНС млекопитающих и на периферии в неожиданно высоких концентрациях, иногда в более высоких, чем их L-энантиомеры [76]. Эти D-аминокисло-ты выполняют в организме специфические функции: так, D-серин играет важную роль в нейротрансмиссии, а D-аспартат — в процессе развития и эндокринной регуляции. Изменение уровня D- аминокислот может быть связано с различными патологическими состояниями.
По мнению ряда исследователей, появление асимметрии аминокислот на определенном этапе эволюции является ключевым в образовании первичных живых клеток на планете, а хиральность — фундаментальная основа асимметрии всех живых организмов [1, 3, 12-16, 32].
Распространенность и физиологическая роль Р-аминокислот в норме и при нормальном старении
В настоящее время для определения уровня D-аминокис-лот могут применяться ЯМР-спектроскопия, измерение оптической активности, рентгеноструктурный анализ, иммуногистохимические и разнообразные биосенсорные методы [2, 15, 61, 103, 153, 188]. Уровни D-аминокислот сильно зависят от возраста животных. D-аспартат показывает достоверно повышенные концентрации в ЦНС. В течение эмбрионального развития крыс D-аспартат первым появляется к коре мозга, стриатуме, среднем мозге, промежуточном мозге и мозжечке. Его низкие концентрации зафиксированы в мосту и в продолговатом мозге [165, 193]. Концентрация D-аспартата в лобной коре мозга человека на 14-й неделе гестации превышает концентрацию L-формы [73]. С возрастом концентрация D-аспартата снижается в крови, сетчатке, надпочечниках, шишковидной железе и семенниках [71, 143].
Уровни D-аминокислот сильно зависят от возраста животных. D-аспартат показывает достоверно повышенные концентрации в ЦНС. В течение эмбрионального развития крыс D-аспартат первым появляется к коре мозга, стриатуме, среднем мозге, промежуточном мозге и мозжечке. Его низкие концентрации зафиксированы в мосту и в продолговатом мозге [165, 193]. Концентрация D-аспартата в лобной коре мозга человека на 14-й неделе гестации превышает концентрацию L-формы [73]. С возрастом концентрация D-аспартата снижается в крови, сетчатке, надпочечниках, шишковидной железе и семенниках [71, 143].
D-аланин, D-лейцин, D-пролин и D-глутамат также были идентифицированы в мозге млекопитающих [70, 102].
н о
daao-fad™ + r-
nh.
О’
Т
daa0-fad_h — r —
nh.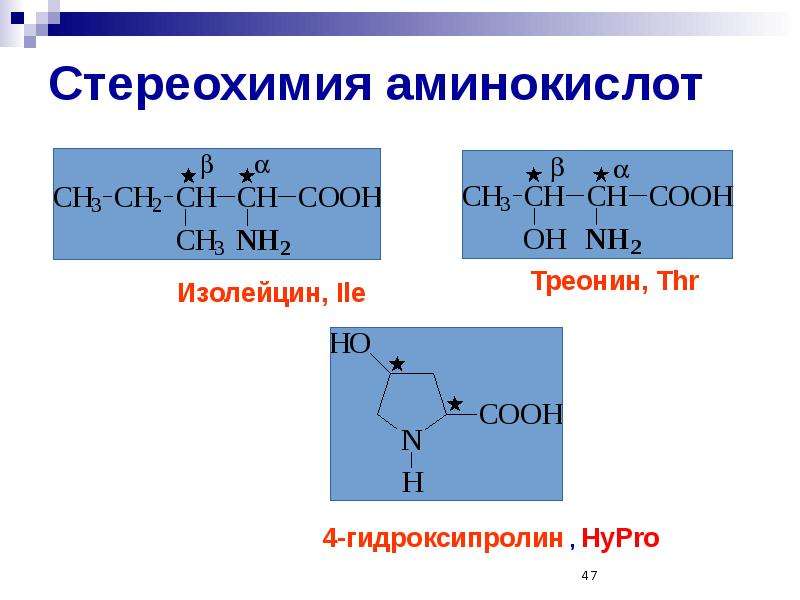 + П fljUj
+ П fljUj
рис. 2: Реакция ферментативного окислительного дезаминирования D-амино-кислот.
D-глутамат был выделен из печени и почек, где его концентрации превышали концентрацию D-аспартата [102]. Различные D-аминокислоты найдены у человека в сыворотке крови, моче, ликворе, амниотической жидкости с наибольшими концентрациями в моче и с наименьшими в амниотической жидкости и ликворе. Концентрации D-аминокислот были менее 1% от концентрации L-амино-кислот [19]. D-серин также был идентифицирован в значительных количествах в мозге грызунов и человека [77].
Источники, метаболизм и деградация D-аминокислот. D-аминокислоты поступают в организм млекопитающих с пищей при метаболизме кишечной флоры, а также в результате спонтанной рацемизации при старении и биосинтезе [105-107]. Деградация этих соединений происходит путем окислительного дезаминирования оксидазой D-аминокислот (DAAO) [202] с последующим неферментативным гидролизом (рис.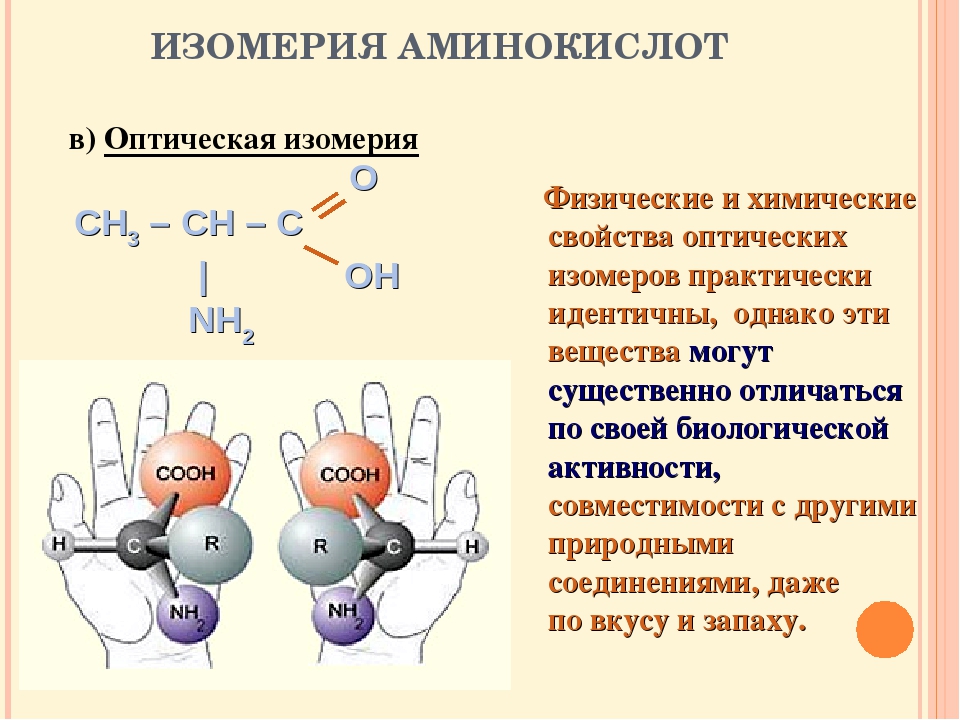 2) [15]. Характерной особенностью всех DAAO является высокая специфичность именно к D-изомерам аминокислот, но не к L-формам.
2) [15]. Характерной особенностью всех DAAO является высокая специфичность именно к D-изомерам аминокислот, но не к L-формам.
Впервые DAAO была описана H.A. Krebs в 1935 г. [110]. Этот фермент группирован из рацемизированных АК и аккумулирован в мозге [113]. Также этот фермент встречается в других белках и представлен в зубах, костях, аорте, коже и легких, т.е. распространен в природе — от микроорганизмов до млекопитающих. DAAO широко экспресси-руется у млекопитающих, особенно в почках, печени и ЦНС, наименьшие его концентрации отмечаются в периферических тканях [15, 199]. У микроорганизмов DAAO обеспечивает использование экзогенных D-аминокислот в качестве источника углерода, азота и энергии. У эукариот его роль заключается в поддержании определенного уровня D-аминокислот в клетке. Установлено, что наличие избыточного количества некоторых D-аминокислот в мозге мышей способствует длительной потенциации в гип-покампе и пространственному обучению: при экспериментах в водном лабиринте Морриса мутантные мыши, лишенные гена DAAO, обучались значительно быстрее, чем нормальные особи [123]. метил-D-аспартата (NMDA), которые играют важную роль во многих патофизиологических процессах. Свободный D-серин был найден в различных отделах мозга грызунов и человека — переднем мозге, церебральной коре, гиппокампе, стриатуме, лимбическом мозге, промежуточном и среднем мозге и в более низких концентрациях — в мосту, продолговатом мозге, мозжечке и спинном мозге [73, 139]. Концентрация D-серина в мозге крыс составлял 1/3 от концентрации L-серина. Наибольшая концентрация D-серина зафиксирована в астроцитах.
метил-D-аспартата (NMDA), которые играют важную роль во многих патофизиологических процессах. Свободный D-серин был найден в различных отделах мозга грызунов и человека — переднем мозге, церебральной коре, гиппокампе, стриатуме, лимбическом мозге, промежуточном и среднем мозге и в более низких концентрациях — в мосту, продолговатом мозге, мозжечке и спинном мозге [73, 139]. Концентрация D-серина в мозге крыс составлял 1/3 от концентрации L-серина. Наибольшая концентрация D-серина зафиксирована в астроцитах.
У грызунов концентрация D-серина повышается на 3-й неделе после рождения в коре большого мозга, в мозжечке уровень D-серина начинает повышаться на 1-й неделе постнатального развития и достигает наивысших значений ко 2-й неделе [78, 87]. В мозге человека наивысшие концентрации D-серина определены в лобной коре на 14-й неделе гестации и остаются на этом уровне до момента рождения [76]. Далее уровень D-серина постепенно снижается с возрастом [73].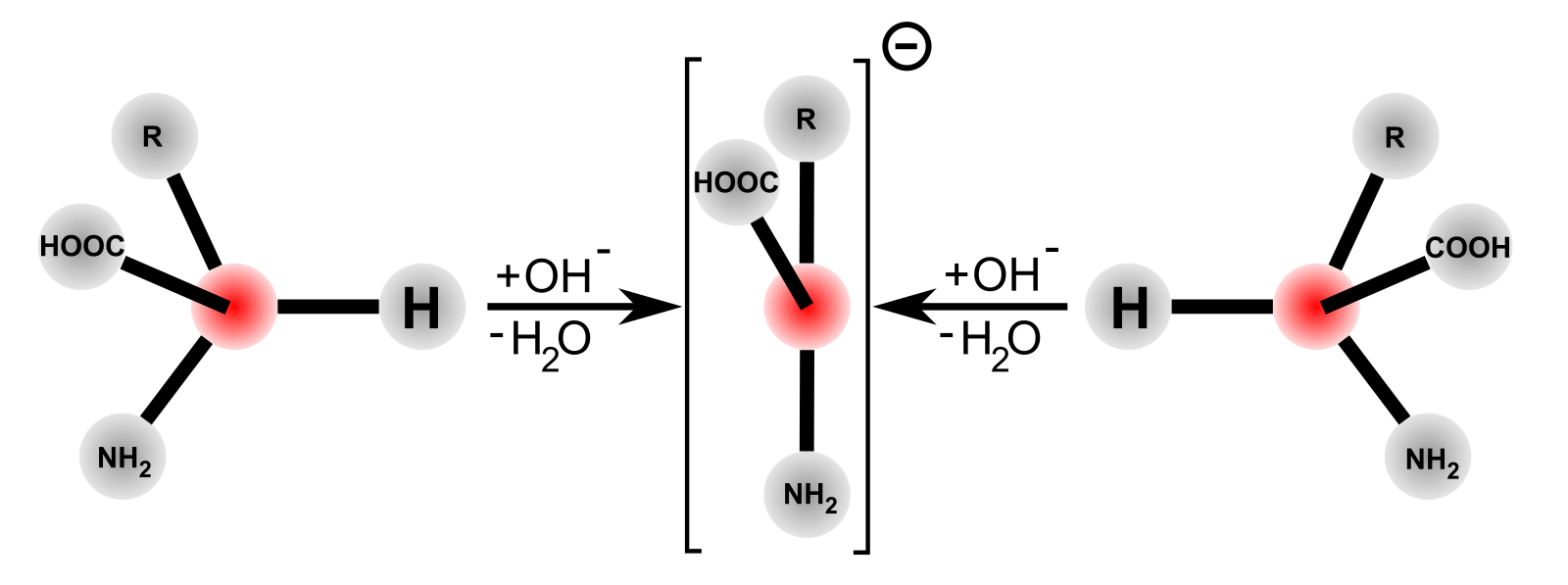 Наибольшее значение в появлении D-серина играет его биосинтез под действием специфического фермента — серин-рацемазы, превращающий L-форму в D в присутствии пиридоксальфосфата, ионов магния и АТФ [47, 164, 194].
Наибольшее значение в появлении D-серина играет его биосинтез под действием специфического фермента — серин-рацемазы, превращающий L-форму в D в присутствии пиридоксальфосфата, ионов магния и АТФ [47, 164, 194].
NMDA-рецепторы являются ключевыми возбуждающими рецепторами в головном мозге и вовлечены в формирование памяти, синаптичекую пластичность, процессы развития и др. [37, 46, 149]. Их активация приводит к повышению проницаемости мембраны клетки для ионов кальция (Ca2+) [46]. Гиперстимуляция NMDA-рецепторов приводит к формированию эффекта эксайтотоксичности — одного из фундаментальных понятий в современных нейронауках [33]. Глутамат является главным агонистом NMDA-рецеп-торов, но он не активирует рецепторы, если не происходит связывание ко-агонистов с активным сайтом рецептора -NR1 [94, 130]. D-серин, как предполагается, является физиологическим лигандом NMDA-рецепторов, связывающимся в качестве вышеупомянутого ко-агониста с активным сайтом, что приводит к запуску NMDA-опосре-дованных процессов [69, 96, 195, 200]. Ко-агонистом сайта NMDA-рецептора может также являться и глицин. Его связывание повышает афинность рецептора к глутамату [50], снижает его десенсибилизацию [115] и производит обновление NMDA-рецептора при его интернализации [145].
Ко-агонистом сайта NMDA-рецептора может также являться и глицин. Его связывание повышает афинность рецептора к глутамату [50], снижает его десенсибилизацию [115] и производит обновление NMDA-рецептора при его интернализации [145].
По сравнению с глицином D-серин — лиганд с высокой степенью сродства к NMDA-рецептору, и его афинность втрое выше, чем афинность глицина [66, 129]. Эндогенный D-серин участвует в нескольких NMDA-зависимых физиологических и патологических процессах, включая нормальную NMDA-рецепторную передачу сигнала, синапти-ческую пластичность [69, 96, 136, 148, 200], миграцию клеток [104] и нейротоксичность [98, 99, 196]. Структурное обоснование селективного эффекта D-серина на NMDA-рецепторы стало ясным после изучения пространственной структуры центра связывания NR1-субъединицы NMDA-рецептора. D-серин связывается с рецептором более плотно в сравнении с глицином, так как формирующиеся три дополнительные водородные связи вытесняет молекулу воды из центра связывания [66].
Наибольшие концентрации D-серина в мозге крысы определены в переднем обонятельном ядре, коре мозга, гиппо-кампе, молекулярном слое коры мозжечка, обонятельном бугороке, полосатом теле, таламусе [168]. Содержание D-серина в мозге составляет 1/3 от содержания L-серина, и его концентрация максимальна среди всех D-аминокислот [73]. В отличие от L-аминокислот, D-серин не включается в белки. Данные микродиализа показали, что внеклеточная концентрация D-серина в стриатуме в два раза выше, чем глицина, а в коре мозга — сопоставима с концентрацией глицина [75].
А. Hashimoto et al. впервые показали, что D-серин широко представлен в переднем мозге крыс, как и NMDA-рецепто-
ры [73]. Региональная представленность Б-серина в других отделах мозга также соотносится с распространением NMDA-рецепторов [169, 170]. Концентрация Б-серина ниже в каудальной части мозга, включая мозжечок и ствол, что связано с активностью БААО у взрослых животных в этих регионах [86, 170]. В отличие от Б-серина, иммуноре-активность глицина выше в каудальных отделах мозга [168].
В отличие от Б-серина, иммуноре-активность глицина выше в каудальных отделах мозга [168].
Как предполагается, Б-серин содержится в цитоплазме астроцитов и оттуда поступает в синаптическую щель [168, 169]. Для подтверждения роли Б-серина как ко-агониста глутамата в работе NMDA-рецепторов на культуре клеток смоделировали отсутствие Б-серина с помощью фермента БААО, избирательно разрушающего Б-аминокислоты. В таком эксперименте на 60% снизилась спонтанная активация NMDA-рецепторов на постсинаптической мембране, в то время как ответ от АМРА-рецептов не изменился [136]. Более того, Б-серин по сходному механизму способствовал продолжительной синаптической активации в нейронах гиппокампа — нейрофизиологическому аналогу процессов запоминания и обучения [96, 136, 195].
Б-серин синтезируется из L-серина под действием серин-рацемазы [47, 192]. Предварительные исследования показали, что у линии трансгенных мышей с «нокаутированным» геном серин-рацемазы зафиксировано снижение концентрации Б-серина в мозге на 80-90% [22, 121, 137, 203]. Также у этих мышей зафиксировано снижение передачи сигнала через NMDA-рецепторы, ухудшение длительного потенцирования синаптической активности в гиппо-кампе, животные этой линии были более устойчивыми к ишемии мозга после окклюзии средней мозговой артерии [121, 137]. В последнее время стали появляться данные, что Б-серин и Б-серин-рацемаза также встречаются в нейронах переднего мозга (при недостатке БААО), в пирамидных нейронах [108, 201].
Также у этих мышей зафиксировано снижение передачи сигнала через NMDA-рецепторы, ухудшение длительного потенцирования синаптической активности в гиппо-кампе, животные этой линии были более устойчивыми к ишемии мозга после окклюзии средней мозговой артерии [121, 137]. В последнее время стали появляться данные, что Б-серин и Б-серин-рацемаза также встречаются в нейронах переднего мозга (при недостатке БААО), в пирамидных нейронах [108, 201].
В ЦНС Б-аспартат может потенциировать NMDA-рецеп-торы посредством стимуляции глутаматного сайта рецептора [45, 51], но сродство NMDA-рецептора к Б-аспартату в 10 раз ниже, чем к L-глутамату [51], и локализация Б-аспартата не коррелирует с распределением NMDA-рецепторов [169]. Б-аспартат может, однако, усиливать активность NMDA- рецепторов после ферментного метилирования метилтрансферазой [45]. Б-аспартат участвует в секреции ряда гормонов — тестостерона [42, 45, 138], окси-тоцина [185], мелатонина [179], соматотропного и лютине-зирующего гормонов [185] и др.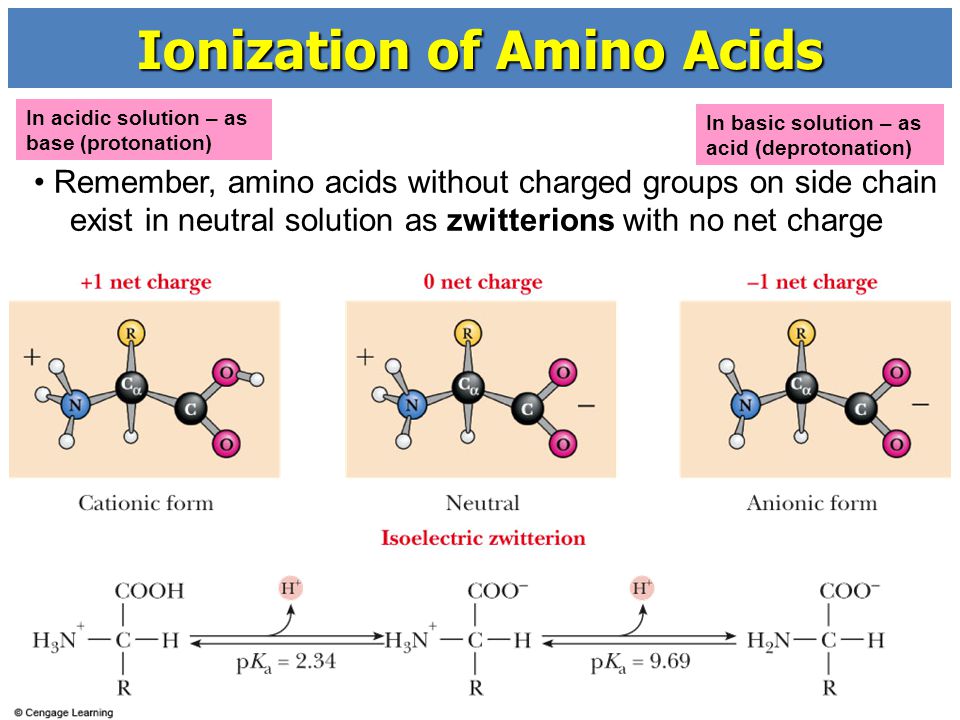 Б-аспартат в значительных количествах присутствует в тканях головного мозга, причем его концентрация увеличивается со скоростью до 0,14% в год [125, 156]. Наиболее высокая концентрация Б-аспартата наблюдается в железах внутренней секреции [49, 65]. Содержание Б-аспартата также увеличивается с возрастом в хрусталике, дентине, коленном хряще и белом веществе головного мозга [60, 84, 124].
Б-аспартат в значительных количествах присутствует в тканях головного мозга, причем его концентрация увеличивается со скоростью до 0,14% в год [125, 156]. Наиболее высокая концентрация Б-аспартата наблюдается в железах внутренней секреции [49, 65]. Содержание Б-аспартата также увеличивается с возрастом в хрусталике, дентине, коленном хряще и белом веществе головного мозга [60, 84, 124].
Показана роль Б-аминокислот в регуляции артериального давления. NG-нитроаргинин существует в клетке в виде L- и Б-изомеров, причем изначально синтезируется NG-нитро-D-аргинин, из которого затем образуется L-форма. Оба соединения причастны к повышению артериального давления, однако реакция организма на Б-изо-мер значительно медленнее и слабее, чем в случае L-формы [187]. Активность NG-нитро-D-аргинина связана с тем, что он является высокоэффективным ингибитором фермента NO-синтазы [186] — одного из ключевых
Лч
ОН
ч ^ и 1_-а-аспартил
¿^ 5
<7- * <>
VI ШкЫшЛк
¡. \
\
и К* !и м . У* н
°Разворачивание» » у’
1-р-аспартил О-р-аспартил О-н-аспарлил
рис. 3: Неферментная рацемизация аспартата.
регуляторов различных процессов в клетке [8]. Пролонгированное действие NG-нитро-D-аргинина обусловлено достаточно медленным процессом его рацемизации в почках. Установлено, что одним из основных ферментов, катализирующих процесс рацемизации NG-нитро-D-аргинина, является почечная DAAO [198]. D-аргинин также играет роль в орнитиновом цикле [163].
Б-аминокислоты при нормальном старении. Количественное соотношение ЦЮ энантиомеров изменяется в процессе развития и старения организма. При старении основную роль играет рацемизация Ц-аминокислот с переходом их в D-форму, причем в наибольшей степени подвержена рацемизации аспарагиновая кислота. -аспартата в белках показано на рис. 3 [64, 181].
-аспартата в белках показано на рис. 3 [64, 181].
Эксперименты, проведенные в 1970-х годах, четко показывают увеличение содержания D-аминокислот в белках тканей организмов человека и животных в процессе старения. Рацемизацию ускоряет действие ультрафиолетового излучения. В организме 60-летних людей около 8% всей аспарагиновой кислоты находится в D-форме. D-аспартат в фрагментах коллагена типа 1 найден в моче пожилых людей. Показана связь уровня D-серина и серин-рацемазы в гиппокампе стареющих мышей с показателями пролонгированной потенциации синаптиче-ской активности [96, 136]. В клетке концентрация D-про-лина вместе с D-лейцином находится на 4-м месте после D-серина, D-аспартата и D-аланина [71, 153]. В клетках долгоживущих тканей (дентин, зубная эмаль, хрусталик и др.) наблюдается четкая корреляция между возрастом человека и концентрацией D-оксипролина и D-аспартата [15]. Активно обсуждаются данные о нейро-, гепато- и нефротоксичности D-пролина для крыс [171].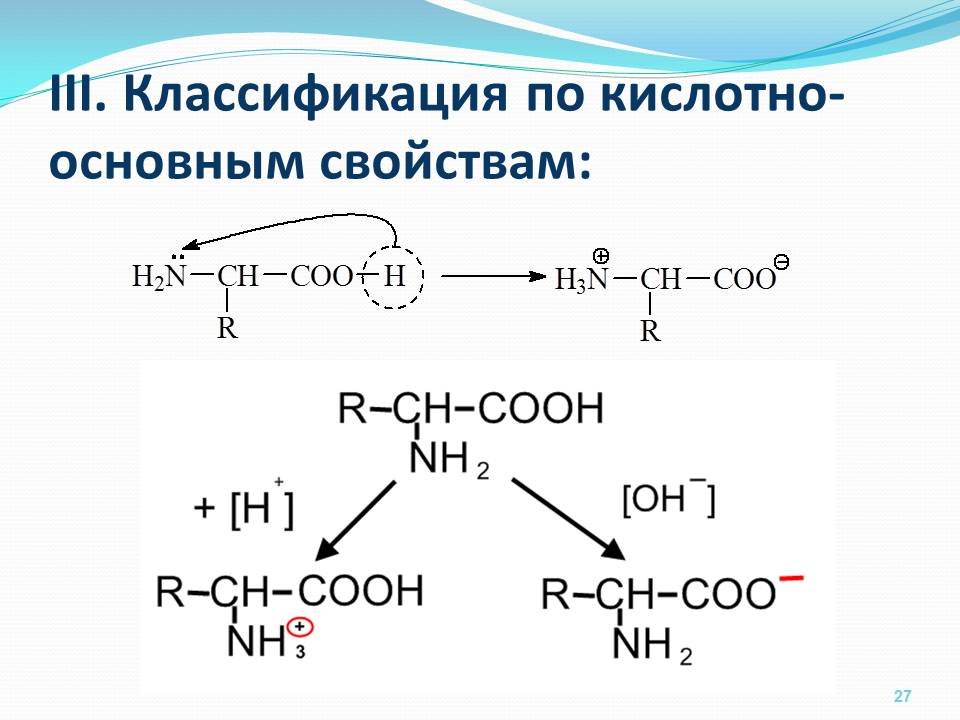 Изучение содержания D-пролина в различных тканях обычных и мутантных мышей (с отсутствием гена daao) показало, что у последних D-пролин в значительных количествах накапливается в почках, а его избыток выводится из организма естественным путем [71].
Изучение содержания D-пролина в различных тканях обычных и мутантных мышей (с отсутствием гена daao) показало, что у последних D-пролин в значительных количествах накапливается в почках, а его избыток выводится из организма естественным путем [71].
D-аминокислоггы при патологии головного и спинного мозга
Б-аминокислоты и боковой амиотрофический склероз (БАС). БАС — хроническое неуклонно прогрессирующее заболевание нервной системы, характеризующиеся массивной гибелью мотонейронов, появлением специфических включений в мотонейронах и астроцитах, а также глиозом в передних рогах спинного мозга [30]. Приблизительно 90% случаев БАС являются спорадическими, но 10% имеют наследственную природу. Около 20% наследственных случаев имеют мутацию в гене, кодирующем фермент супероксиддисмута-зу-1 (СОД1) [161]. Среди нескольких теорий патогенеза БАС теория глутаматной эксайтотоксичности представляется наиболее обоснованной [30, 183].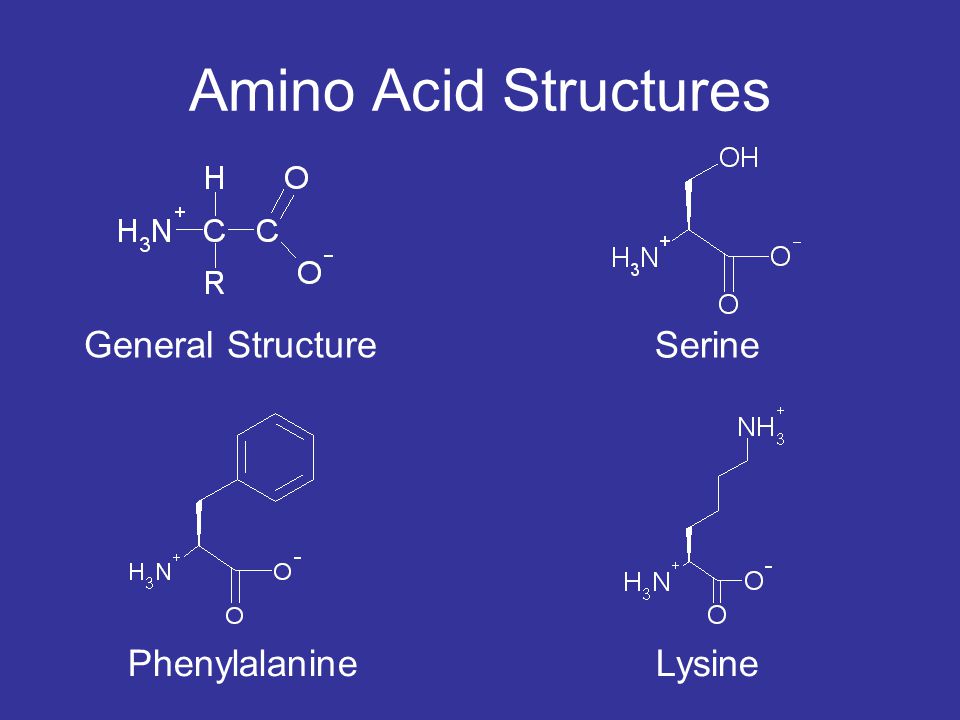 Она подтверждена наблюдениями, согласно которым в ликворе у 40% пациентов с БАС зафиксировано трехкратное повышение уровня глута-мата в результате снижения его захвата астроцитами [162]. При семейных и спорадических формах БАС выявлены угнетение глутаматного транспорта [162], нарушение различных звеньев метаболизма данного медиатора [41] и повышенная чувствительность нейронов к глутамат-опосре-дованным эксайтотоксическим эффектам [89, 162].
Она подтверждена наблюдениями, согласно которым в ликворе у 40% пациентов с БАС зафиксировано трехкратное повышение уровня глута-мата в результате снижения его захвата астроцитами [162]. При семейных и спорадических формах БАС выявлены угнетение глутаматного транспорта [162], нарушение различных звеньев метаболизма данного медиатора [41] и повышенная чувствительность нейронов к глутамат-опосре-дованным эксайтотоксическим эффектам [89, 162].
У 70% больных спорадической формой БАС имеется глубокий дефицит астроцитарного глутаматного транспортера ЕААТ2 в моторной коре и спинальных мотонейронах, обусловленный нарушением процессинга мРНК и синтезом аномального белкового продукта, подвергающегося быстрой деградации с потерей активности [117]. Предполагается, что данный молекулярный дефект может быть результатом окислительного повреждения ДНК и белков, регулирующих транскрипцию гена ЕААТ2 в периферических и центральных мотонейронах [117].
С позиций предотвращения эксайтотоксичности объясняется действие ингибитора глутамата рилузола — единственного препарата, показавший свою клиническую эффективность при БАС.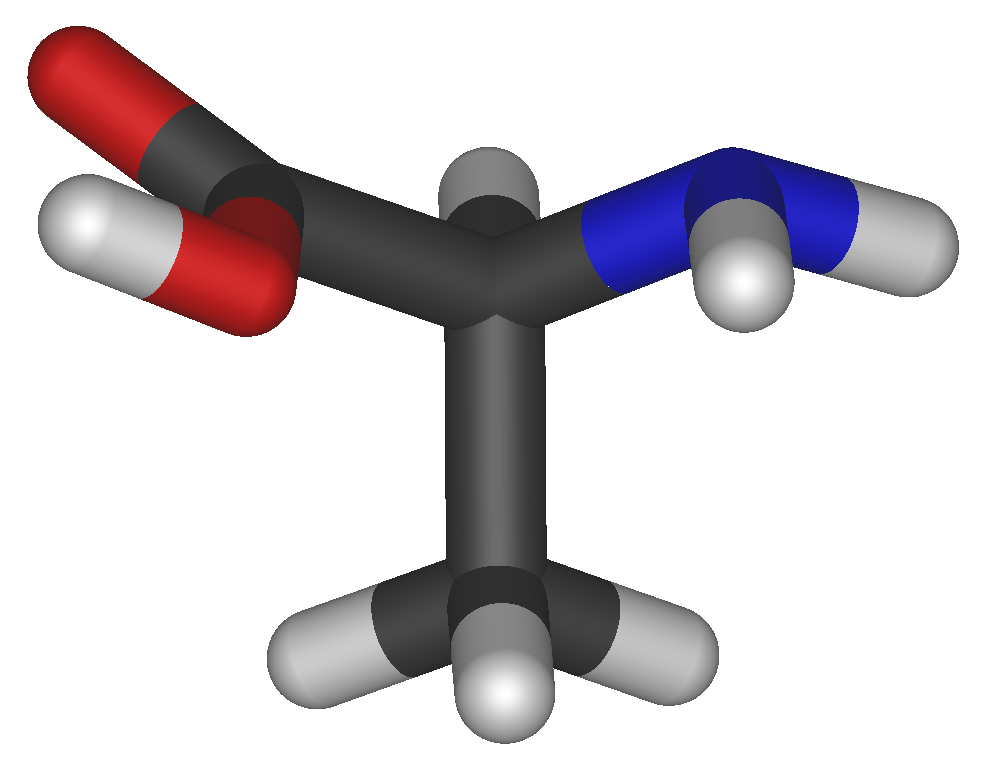 -аспартата (NMDA), рецепторы а-амино-3-гидрокси-5-метил-4-изоксазолеропропионо-вой кислоты (АМРА) и каинатные рецепторы [183]. АМРА-рецепторы играют ключевую роль в БАС-ассоциированной глутаматной эксайтотоксичности, существенное значение имеют также NMDA-рецепторы [100]. D-серин — физиологически доминантный ко-агонист специфической части глутаматного рецептора (см. выше) [148, 176]. Серин-раце-маза экспрессируется большей частью в клетках глии [192] и участвует в ее активации [196, 197]. Принимая во внимание, что повреждение мотонейронов происходит при активации глии [26, 36, 157], было предположено, что D-серин при БАС генерируется активированной глией и может вносить вклад в развитие глутаматной эксайтотоксичности.
-аспартата (NMDA), рецепторы а-амино-3-гидрокси-5-метил-4-изоксазолеропропионо-вой кислоты (АМРА) и каинатные рецепторы [183]. АМРА-рецепторы играют ключевую роль в БАС-ассоциированной глутаматной эксайтотоксичности, существенное значение имеют также NMDA-рецепторы [100]. D-серин — физиологически доминантный ко-агонист специфической части глутаматного рецептора (см. выше) [148, 176]. Серин-раце-маза экспрессируется большей частью в клетках глии [192] и участвует в ее активации [196, 197]. Принимая во внимание, что повреждение мотонейронов происходит при активации глии [26, 36, 157], было предположено, что D-серин при БАС генерируется активированной глией и может вносить вклад в развитие глутаматной эксайтотоксичности.
Исследование потенциальной роли D-серина при БАС проводилось на замороженном спинном мозге СОД1-транс-генных мышей на 9-й, 16-й и 21-й неделях. Определено, что концентрация D-серина в спинном мозге повышается по мере прогрессирования заболевания, начиная с досимп-томной стадии [95].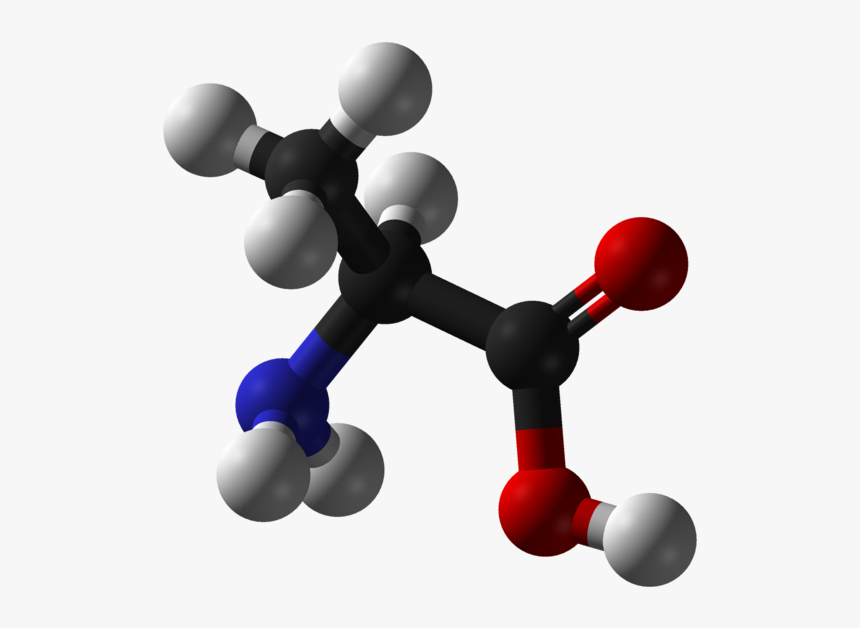 D-серин накапливается вокруг вакуо-
D-серин накапливается вокруг вакуо-
лизированных мотонейронов в передних рогах уже в дебюте БАС, что доказывает взаимосвязь между накоплением Б-серина и повреждением нейронов. Повышение уровня Б-серина наблюдалось не только в сером, но и в белом веществе. Б-серин был найден в активированной микро-глие и астроцитах на всех стадиях БАС [95].
Уровень Б-серина постоянно регулируется его деградацией. Как и другие Б-аминокислоты, Б-серин может селективно метаболизироваться ферментом БААО, находящимся в астроцитах. Количество БААО-позитивных клеток увеличивается при развитии заболевания, но при этом уровень экспрессии БААО не различается у здоровых мышей и мышей с БАС [182]. Данные результаты дают возможность предположить, что повышение БААО было недостаточным относительно повышения активности серин-рацемазы, а деградация Б-серина ферментом БААО не могла компенсировать его генерацию серин-рацемазой [95]. Предположено, что повышение концентрации Б-серина у мышей с БАС связано именно с дизрегуляцией серин-рацемазы. Кроме того, повышение уровня данной аминокислоты при БАС может свидетельствовать о дисбалансе между продукцией аминокислот в активированной микроглие и выведением/деградацией в астроцитах.
Предположено, что повышение концентрации Б-серина у мышей с БАС связано именно с дизрегуляцией серин-рацемазы. Кроме того, повышение уровня данной аминокислоты при БАС может свидетельствовать о дисбалансе между продукцией аминокислот в активированной микроглие и выведением/деградацией в астроцитах.
Описаны два основных механизма, приводящих к повышению продукции Б-серина глиальными клетками: 1) индукция провоспалительными факторами экспрессии серин-рацемазы в микроглие [196]; 2) стимуляция глутаматом АМРА-рецепторов, что вызывает повышение ферментной активности серин-рацемазы в микроглие.
Для определения вклада мутации СОД1 в регуляцию серин-рацемазы клетки были инфицированы аденовирусами, кодирующими нормальный тип СОД1 и мутацию G93A-СОД1 в микроглие. Установлено, что экспрессия G93A-СОД1, но не нормального типа СОД1, приводит к повышению экспрессия серин-рацемазы, причем данное повышение не ассоциировано с активацией каспазного пути в течение 72 час после инфицирования [95].
Изменения концентрации Б-серина были найдены при иммуногистохимическом анализе аутопсийного материала спинного мозга больных БАС. У пациента с семейной формой БАС и в двух из трех случаев спорадического БАС в спинном мозге (как в нейронах, так и в клетках глии) определялись повышенные уровни Б-серина. Это подтверждает, что глутаматная токсичность при БАС увеличивается под действием Б-серина не только на модели мышей, но и у людей. Также иммуногистохимический анализ показал, что увеличение серинрацемаза-позитивных клеток имело место в двух из трех случаев спорадической формы БАС и не зафиксировано при семейной форме. Найдено увеличение БААО-позитивных глиальных клеток при БАС в сравнении с контролем [95].
В 2010 г. была обследована семья с наследственной формой БАС, у которой определена новая мутация в гене DAAO. Мутация делала этот белок нефункциональным, что приводило к накоплению Б-серина в мотонейронах и их дегенерации по описанным выше механизмам [204].
Таким образом, была сформулирована новая гипотеза гибели нейронов при БАС. Повышение активации серин-рацемазы, индуцированной активацией глии или мутацией СОД1, повышает концентрацию Б-серина в активирован-
ной глие. Повышение D-серина в экстрацеллюлярном пространстве запускает каскад глутаматной эксайтоток-сичности в мотонейронах через NMDA-рецепторы.
D-аминокислоты и болезнь Альцгеймера. БА — прогрессирующее нейродегенеративное заболевание, при котором в клетках пораженного мозга появляется ß-амилоид (ßA) -ключевой молекулярный маркер патологического процесса. Ингибирование формирования ßA является одним из перспективных терапевтических направлений. В этом аспекте были идентифицированы D-аминокислоты, составляющие основу ßA. Как известно, D-аминокислоты менее подвержены протеазам и менее иммуногенны, чем L-энантомеры. Показано, что двенадцать D-пептидов входят в состав ßA.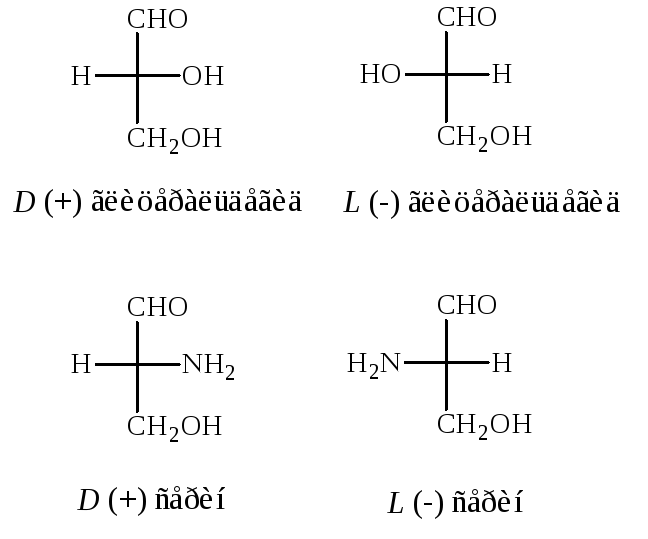 А.Е. Roher и соавт. предположили, что ßA сгруппирован из рацемизированных аминокислот и аккумулирован в мозге [160]. Позднее было достоверно определено влияние D-аминокислот на полимеризацию ßA и его токсичность: наличие D-аминокислот снижает размер ßA-агрегатов, но повышает их количество [189].
А.Е. Roher и соавт. предположили, что ßA сгруппирован из рацемизированных аминокислот и аккумулирован в мозге [160]. Позднее было достоверно определено влияние D-аминокислот на полимеризацию ßA и его токсичность: наличие D-аминокислот снижает размер ßA-агрегатов, но повышает их количество [189].
При БA содержание D-аланина в сером веществе головного мозга примерно в 2,2 раза выше, чем у здоровых людей [42, 54]. В ликворе таких больных отмечено повышенное содержание свободных D-аспартата и D-серина и общего количества D-аминокислот [59]. Данный эффект объясняют совокупным действием двух факторов — снижением активности DAAO и повышением активности соответствующих рацемаз по сравнению с таковыми в организме здорового человека.
При БA выявлено повышение концентрации D-аспартата в ликворе по сравнению с нормой [58], но содержание свободного D-аспартата было достоверно ниже в регионах мозга с патологическими изменениями [44], а также в белом веществе пациентов с БA по сравнению со здоровым мозгом [55]. Общее содержание D-аминокислот в вентри-кулярном пунктате в 1,48 раз выше, а в поясничном — в 1,43 раза выше у пациентов с БA по сравнению с контролем. Содержание D-аспартата в вентрикулярном ликворе в 2,74 раза выше, а в поясничном — в 1,5 раза выше у пациентов с БA в сравнении со здоровыми [56]. В многочисленных исследованиях показано, что ßA способствует нейро-дегенерации через стимуляцию микроглии и выделение аминокислот, включая D-серин [59, 175].
Общее содержание D-аминокислот в вентри-кулярном пунктате в 1,48 раз выше, а в поясничном — в 1,43 раза выше у пациентов с БA по сравнению с контролем. Содержание D-аспартата в вентрикулярном ликворе в 2,74 раза выше, а в поясничном — в 1,5 раза выше у пациентов с БA в сравнении со здоровыми [56]. В многочисленных исследованиях показано, что ßA способствует нейро-дегенерации через стимуляцию микроглии и выделение аминокислот, включая D-серин [59, 175].
D-аминокислоты и шизофрения. Уменьшение концентрации D-серина снижает функциональную активность NMDA-рецепторов, что может быть ассоциировано с развитием шизофрении [35, 37, 40, 67, 72, 82, 144]. В последнее время именно эта гипотеза принята за рабочую, так как в ее пользу свидетельствуют многочисленные экспериментальные данные [122, 147, 172]. Выделены два гена, мутации в которых повышают риск развития шизофрении: 1) ген активатора DAAO на 13-й хромосоме, кодирующей белок G72 -работа этого гена способствует снижению концентрации D-серина и гипофункции NMDA-рецепторов; 2) второй ген, имеющий отношение к регуляции активности DAAO, также находится на 13-й хромосоме. В гиппокампе больных шизофренией экспрессия и активность фермента DAAO в два раза выше, чем в норме, поэтому у пациентов больше D-серина метаболизируется и не участвует в ко-активации глутаматных рецепторов. Известен и полиморфный вариант гена серин-рацемазы, который менее активен, что приводит к уменьшению концентрации D-серина в мозге и гипофункции NMDA-рецепторов [11].
В гиппокампе больных шизофренией экспрессия и активность фермента DAAO в два раза выше, чем в норме, поэтому у пациентов больше D-серина метаболизируется и не участвует в ко-активации глутаматных рецепторов. Известен и полиморфный вариант гена серин-рацемазы, который менее активен, что приводит к уменьшению концентрации D-серина в мозге и гипофункции NMDA-рецепторов [11].
Применение антагонистов NMDA-рецепторов, таких как фенциклидин, вызывает шизофреноподобные симптомы здоровых волонтеров [67]. У мышей низкая экспрессия фрагмента NMDA-рецептора, отвечающего за связывание с глицином и D-серином, приводила к поведенческим нарушениям в виде снижения моторной активности, стереоти-пий, нарушения межвидового и межполового контакта [133].
У пациентов с шизофренией имеет место высокое значение отношения L-серина к D-серину в крови и ликворе [25, 79, 80].
Б-аминокислоты и болезнь Паркинсона (БП). Роль D-ами-нокислот в патогенез БП прицельно не изучалась. Считается, что важную роль в развитии данного заболевания, так же как при БА и БАС, играет глутаматная эксайто-токсичность [109]. Методом капиллярного электрофореза показаны отличия уровней D- и L-серина в среднем мозге у мышей с моделью паркинсонизма от нормы [116]. Согласно другим данным, при БП и БА концентрации D-серина в височной, теменной и префронтальных областях достоверно не изменялись [34, 112, 140]. Тем не менее у пациентов с БП антагонисты глициновых сайтов NMDA-рецепторов показали хорошую эффективность при моторных нарушениях [31].
Роль D-ами-нокислот в патогенез БП прицельно не изучалась. Считается, что важную роль в развитии данного заболевания, так же как при БА и БАС, играет глутаматная эксайто-токсичность [109]. Методом капиллярного электрофореза показаны отличия уровней D- и L-серина в среднем мозге у мышей с моделью паркинсонизма от нормы [116]. Согласно другим данным, при БП и БА концентрации D-серина в височной, теменной и префронтальных областях достоверно не изменялись [34, 112, 140]. Тем не менее у пациентов с БП антагонисты глициновых сайтов NMDA-рецепторов показали хорошую эффективность при моторных нарушениях [31].
Б-аминокислоты и эпилепсия. D-серин усиливает активность антиконвульсантов [154] и повышает порог судорожной готовности [120]. Предполагается, что серин-опосре-дованная активация NMDA-рецепторов необходима для усиления тормозного воздействия на ГАМКА-рецепторы, а нарушение данной активации может привести расторма-живанию нейронных сетей и склонности к эпилептическим пароксизмам [134, 141].
Б-аминокислоты и другие заболевания. В белках опухолевых клеток содержатся существенные количества D-аминокис-лот, в частности, D-глутамата, D-валина, D-лейцина и D-лизина [54]. После перинатальной асфиксии D-аспартат интенсивно синтезируется в ЦНС, по-видимому, из его предшественника аланина [159]. Повышение уровня сывороточного D-серина, D-пролина и D-аспарагина и/или D-аспартата ассоциировано со старением и заболеванием почек [29, 138]. Найдена положительная корреляция между концентрацией D-аминокислот и маркеров почечных заболеваний. Уровень D-серина повышается в мозге животных с моделью инсульта одновременно со снижением глицина и L-глутамата [119].
Таким образом, многие D-аминокислоты изменяют свои концентрации при заболеваниях мозга. На сегодняшний момент главным патогенетическим механизмом, в реализации которого участвуют D-формы аминокислот, является глутаматная эксайтотоксичность. Гиперстимуляция NMDA-рецепторов зафиксирована при большом числе острых и хронических заболеваний нервной системы, включая инсульт, эпилепсию, полинейропатии, хроническую боль, БАС, БП, БА и хорею Гентингтона [46]. Все эти факты являются основанием для поиска новых методов диагностики, лечения и профилактики заболеваний, связанных с изменением концентраций D-аминокислот.
Гиперстимуляция NMDA-рецепторов зафиксирована при большом числе острых и хронических заболеваний нервной системы, включая инсульт, эпилепсию, полинейропатии, хроническую боль, БАС, БП, БА и хорею Гентингтона [46]. Все эти факты являются основанием для поиска новых методов диагностики, лечения и профилактики заболеваний, связанных с изменением концентраций D-аминокислот.
Следует отдельно подчеркнуть, что D-аминокислоты имеют прямое отношение к такому универсальному механизму нейродегенерации, как конформационные изменения нейрональных белков [5, 6, 9, 24, 28]. Согласно имеющимся данным, встраивание D-аминокислот в L-полипеп-тидную цепочку приводит к формированию нерегулярной пространственной организации молекулы, цепочка начинает надламываться и изменять свое направление, при
таблица 1: Основные О-аминокислоты в организме животных и человека.
D-амино-кислоты Животное Локализация (источник) Происхождение Функция / ассоциированное заболевание Источник
О-серин Грызуны, человек ЦНС, ликвор, сетчатка, р-амилоидные бляшки в веществе мозга, сыворотка крови, моча Биосинтез, бактерии кишечника, пища Модулятор ШОД-рецепторов / все заболевания, связанные с дисфункцией N М ОА-рецепторов: БА, болезнь Паркинсона, шизофрения, БАС, эпилепсия, заболевания почек [64, 164]
О-аспартат Грызуны, человек ЦНС (миелин, р-амилоид), ликвор, сетчатка, хрусталик (оф-кристаллин), различные железы (семенники, надпочечники, шишковидная железа и др.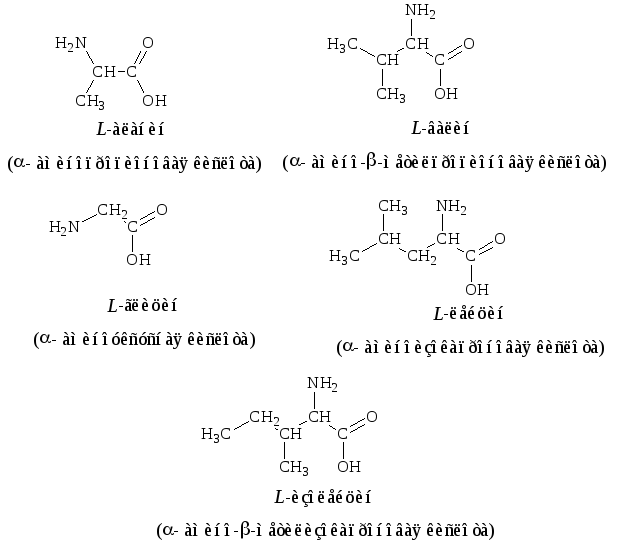 ), зубная эмаль, дентин, аорта (эластин), кость (остеокальцин) Биосинтез, бактерии кишечника, пища Участвует в процессах роста и развития и эндокринной регуляции / возможное участие в патогенезе заболеваний, ассоциированных с дисфункцией NMDA-рецепторов (БА, атеросклероз, катаракта, эла-стоз, заболевания почек) и механизмах старения [64, 164]
), зубная эмаль, дентин, аорта (эластин), кость (остеокальцин) Биосинтез, бактерии кишечника, пища Участвует в процессах роста и развития и эндокринной регуляции / возможное участие в патогенезе заболеваний, ассоциированных с дисфункцией NMDA-рецепторов (БА, атеросклероз, катаракта, эла-стоз, заболевания почек) и механизмах старения [64, 164]
О-глутамат Крысы Мозг, печень, почки ? [102]
О-аланин Крысы, человек, мыши с выбитым геном ЭДДО Слизистые железы, ЦНС, сыворотка крови, слюна, моча Бактерии кишечника БА, старение, заболевания почек [64, 164, 106, 146, 107, 57, 29, 42, 138]
О-лейцин Крысы, мыши, мыши с выбитым геном ЭДДО ЦНС (шишковидная железа, гиппокамп) ? [70, 71]
О-пролин Крысы, мыши, мыши с выбитым геном ЭДДО ЦНС (шишковидная железа, гипофиз) ? [70, 71]
Человек Сыворотка крови, слюна, моча ? Заболевания почек [64, 138, 164]
О-метионин Человек Сыворотка крови, слюна, моча Пища ? [106, 107]
О-аспарагин + О-аспартат Человек Сыворотка крови, слюна, моча ? Заболевания почек [55, 64, 164]
О-аргинин Человек ? ? Участвует в орнитиновом цикле [64, 164]
этом изменяется и ориентация лигандов [2].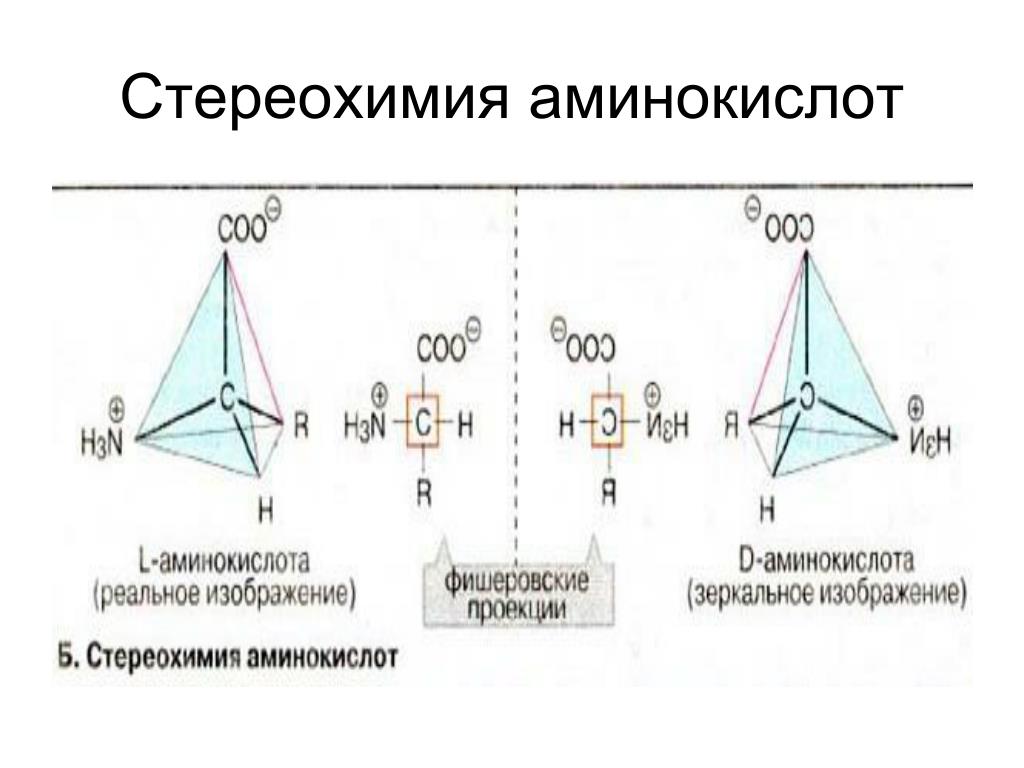 Все это неизбежно приведет к искажению и нестабильности третичной структуры белка. Таким образом, появление D-аминокислот может явиться самодостаточным фактором, приводящим к формированию аномальных белков и развитию конформационных болезней мозга.
Все это неизбежно приведет к искажению и нестабильности третичной структуры белка. Таким образом, появление D-аминокислот может явиться самодостаточным фактором, приводящим к формированию аномальных белков и развитию конформационных болезней мозга.
В табл. 1 приведены основные D-аминокислоты, найденные в тканях и жидкостях человека и животных в норме, при старении и патологии ЦНС.
Клиническое применение Р-аминокислот и ферментов, участвующих в их метаболизме_
Высокочувствительные методы определения D-аминокис-лот и их ферментов в биологических образцах могут быть использованы для ранней диагностики и мониторинга ряда заболеваний, в том числе нейродегенеративной, иммунной и онкологической природы [29, 52, 53, 68, 91, 101, 112, 140 142, 166, 167, 173, 178].
Весьма перспективны поиски соединений, увеличивающих концентрации D-серина в тканях мозга, которые тем самым обеспечивали бы лечение шизофрении путем стимуляции NMDA-рецепторов [17].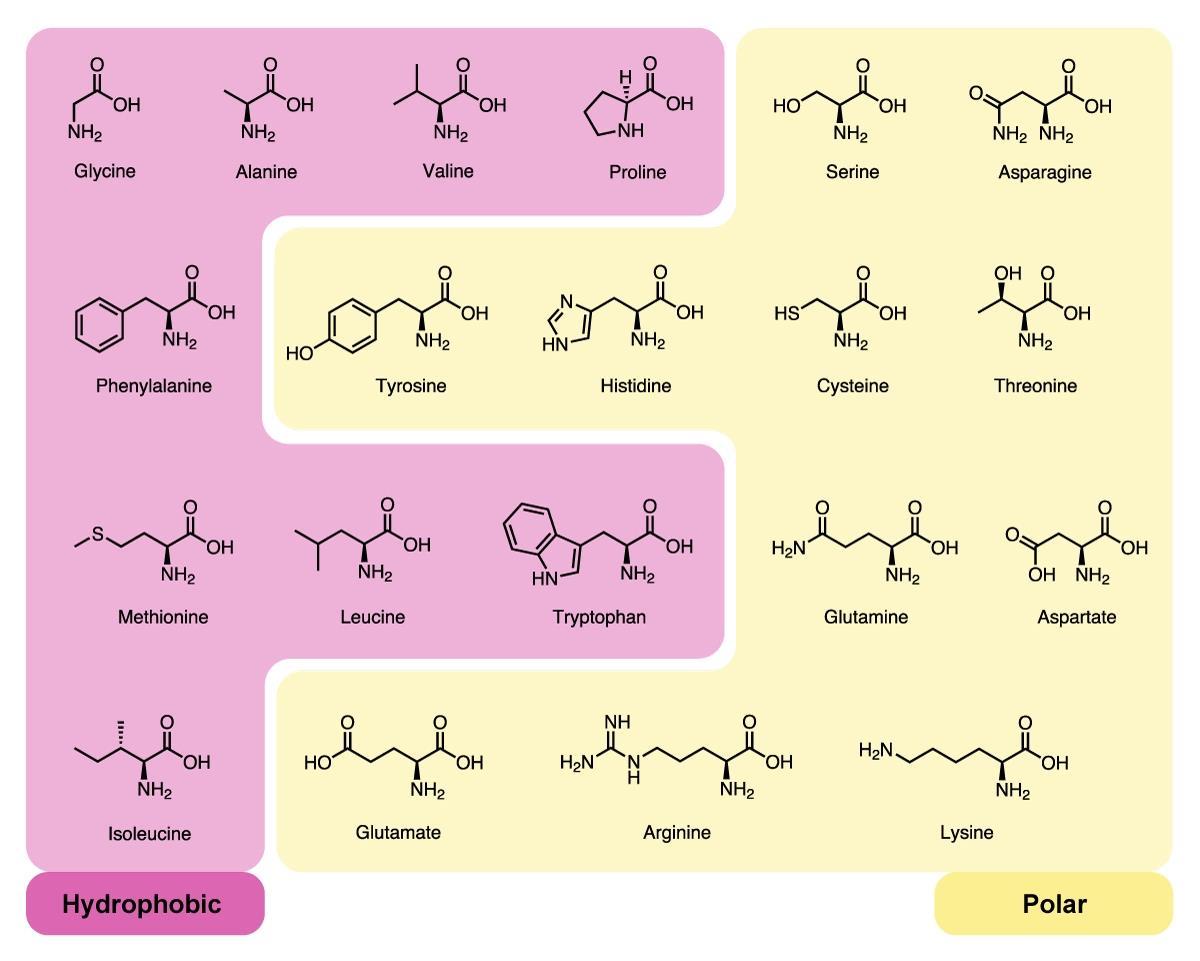 Другим разрабатываемым подходом является повышение эффективности функционирования NMDA-рецепторов за счет перорального или инъекционного введения D-серина дополнительно к антипсихотической терапии [81, 135, 180]. Для реализации первого подхода предложена методика высокоэффективного скрининга активности DAAO в клетках для автоматизированного поиска ингибиторов данного фермента: в результате было отобрано 1966 потенциальных ингибиторов для дальнейших исследований. В качестве лекарственного средства предложено использовать, в частности, 5-метилпиразол-3-карбоновую кислоту [27]. Результаты тестирования у крыс показали, что разовая инъекция ингибитора DAAO приводит к значительному увеличению содержания D-серина в полушарной коре и среднем мозге, причем непрерывное введение препарата в течение 4 нед не вызывало побочных эффектов. Назначение D-серина совместно с нейролептиками уменьшает выраженность позитивных, негативных и когнитивных симптомов при шизофрении [85, 93, 180]. В настоящее время проводятся клинические испытания препаратов на основе D-серина у пациентов с шизофренией.
Другим разрабатываемым подходом является повышение эффективности функционирования NMDA-рецепторов за счет перорального или инъекционного введения D-серина дополнительно к антипсихотической терапии [81, 135, 180]. Для реализации первого подхода предложена методика высокоэффективного скрининга активности DAAO в клетках для автоматизированного поиска ингибиторов данного фермента: в результате было отобрано 1966 потенциальных ингибиторов для дальнейших исследований. В качестве лекарственного средства предложено использовать, в частности, 5-метилпиразол-3-карбоновую кислоту [27]. Результаты тестирования у крыс показали, что разовая инъекция ингибитора DAAO приводит к значительному увеличению содержания D-серина в полушарной коре и среднем мозге, причем непрерывное введение препарата в течение 4 нед не вызывало побочных эффектов. Назначение D-серина совместно с нейролептиками уменьшает выраженность позитивных, негативных и когнитивных симптомов при шизофрении [85, 93, 180]. В настоящее время проводятся клинические испытания препаратов на основе D-серина у пациентов с шизофренией.
При изучении NMDA-токсичности на клеточной модели БАС было показано, что добавление D-серина в культуру
спинальных мотонейронов усиливает NMDA-токсичность. При добавлении в культуру ингибитора серин-рацемазы -феназинметосульфата [104] установлено, что данное соединение по мере угнетения активности серин-рацемазы снижает проявления NMDA-токсичности у мышей с моделью БАС.
Полученные результаты позволили начать поиск специфических лекарственных препаратов на основе DAАО, направленных на связывание D-серина и предотвращение феномена глутаматной эксайтотоксичности. Был синтезирован фермент дезаминаза D-серина, который обладает высоким сродством и специфичностью к D-серину и эффективно разрушает его в культуре клеток [98]. На срезах гиппокампа определено, что снижение уровня эндогенного D-серина фактически нивелирует NMDA-зависимую нейротоксичность.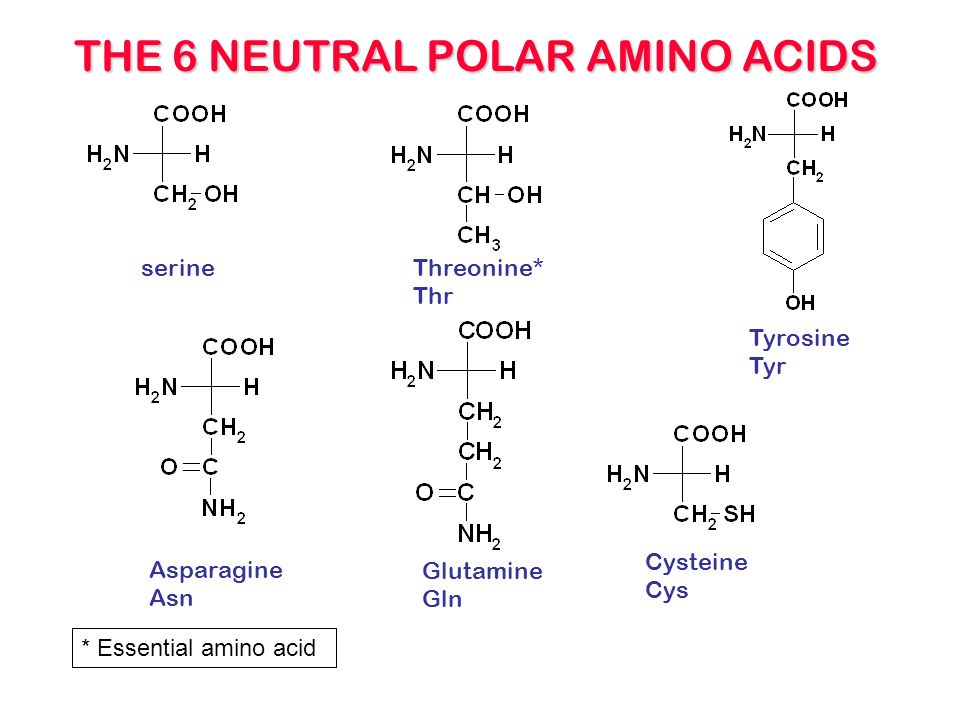 Это показывает, что именно D-серин, а не глицин, является главным ко-агонистом NMDA-рецеп-торов при гибели нейронов в гиппокампе. Показано значение D-серина в модуляции активности NMDA-рецепторов и в других отделах мозга — супраоптическом ядре гипоталамуса [148], сетчатке, коре мозга [99].
Это показывает, что именно D-серин, а не глицин, является главным ко-агонистом NMDA-рецеп-торов при гибели нейронов в гиппокампе. Показано значение D-серина в модуляции активности NMDA-рецепторов и в других отделах мозга — супраоптическом ядре гипоталамуса [148], сетчатке, коре мозга [99].
Общеизвестно, что чрезмерная активация глутаматом NMDA-рецепторов и, соответственно, избыточный вход кальция в клетку играет важную роль не только при хронических (нейродегенеративных и др.), но и при острых заболеваниях нервной системы [33, 46]. Так, блокада NMDA-рецептов имеет нейропротективный эффект на модели инсульта у животных, но не всегда полностью воспроизводится в клинических исследованиях [118, 150]. С этой позиции селективные ингибиторы серин-рацемазы рассматриваются как новая стратегия защиты от повреждения нейронов при нарушении мозгового кровообращения и гибели клеток при нейродегенеративных заболеваниях.
Разработка методов лечения, основанных на контроле уровня соответствующих D-аминокислот в клетках определенных тканей путем изменения активности DAAO, является сложной задачей, поскольку фермент DAAO одновременно участвует в регуляции совершенно разных процессов.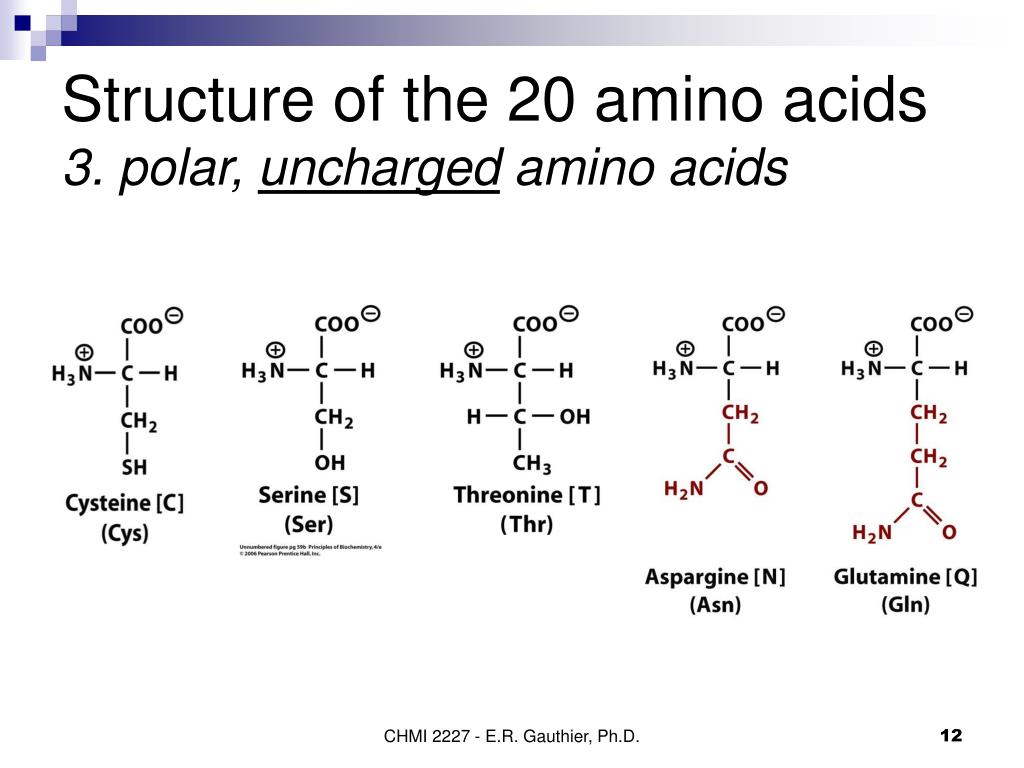 Выходом из этой ситуации может быть использование тканеспецифичной генотерапии [15] и нанокон-струкций [190], видоизменяющих профиль субстратной специфичности. В этом случае при неизменном уровне биосинтеза фермента можно будет селективно влиять на уровень только одной определенной D-аминокислоты. Реализация такого подхода является задачей ближайшего будущего.
Выходом из этой ситуации может быть использование тканеспецифичной генотерапии [15] и нанокон-струкций [190], видоизменяющих профиль субстратной специфичности. В этом случае при неизменном уровне биосинтеза фермента можно будет селективно влиять на уровень только одной определенной D-аминокислоты. Реализация такого подхода является задачей ближайшего будущего.
Список литературы см. на сайте журнала annaly-nevrologii.ru
D-amino acids in the pathogenesis of neurodegenerative diseases and in normal ageing
A.V. Chervyakov, M.N. Zaharova, N.B. Pestov
Research Center of Neurology, Russian Academy of Medical Sciences; Institute of Bioorganic Chemistry, Russian Academy of Sciences (Moscow)
Keywords: D-amino acids, NMDAreceptors, neurodegenerative diseases, aging.
Recent studies have shown that D-amino acids (DAA) are widely represented in tissues of higher organisms, including man. Specific functions of particular DAA in a healthy body are determined: for instance, D-serine plays an important role in neuro-plasticity, memory and learning, while D-aspartate is involved in the development processes and endocrine functions. Pathogenicity of DAA is associated with over-activation of NMDA glutamate receptors, conformational changes of normal protein molecules upon incorporation in the polypeptide chain, and increase inconcentration of reactive oxygen species during
oxidase metabolism of DAA. Assessment of the levels of DAA in biological fluids, as well as detection of enzyme activity and mutations of the respective genes may serve as diagnostic mark-ersin a number of the diseases of the central nervous system (Alzheimer’s disease, Parkinson’s disease, amyotrophic lateral sclerosis, etc).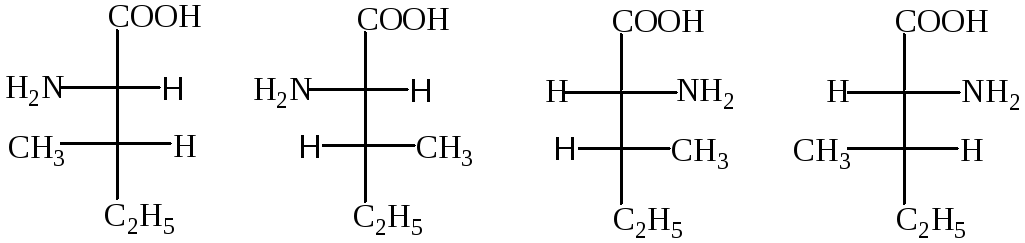 Practical interest to the content and the functions of DAA is also related to perspectives of elaborating novel therapeutic strategies aimed at correcting the synthesis/degradation of DAA and modulation of activity of the their receptors.
Practical interest to the content and the functions of DAA is also related to perspectives of elaborating novel therapeutic strategies aimed at correcting the synthesis/degradation of DAA and modulation of activity of the their receptors.
Контактный адрес: Червяков Александр Владимирович — канд. мед. наук, науч. сотр. отд. нейрореабилитации ФГБУ «НЦН» РАМН. 125367 Москва, Волоколамское ш., д. 80. E-mail: [email protected];
Захарова М.Н. — вед.науч. сотр. VI неврол. отд. ФГБУ «НЦН» РАМН;
Пестов Н.Б. — старш. науч. сотр. группы кросс-сшивающих ферментов ИБХ РАН.
Аминокислота — d-ряд — Большая Энциклопедия Нефти и Газа, статья, страница 1
Аминокислота — d-ряд
Cтраница 1
Аминокислоты D-ряда называют иногда неприродным так как они не используются для построения белков челове ского организма. D-a — аминокислоты встречаются во мно природных пептидах, продуцируемых микроорганизмами, нап мер в антибиотиках ( грамицидин, актиномицин, полимикси а также в составе биополимеров клеточной стенки бактер например остаток D-глутаминовой кислоты — в оболочке бак рий сибирской язвы.
[1]
D-a — аминокислоты встречаются во мно природных пептидах, продуцируемых микроорганизмами, нап мер в антибиотиках ( грамицидин, актиномицин, полимикси а также в составе биополимеров клеточной стенки бактер например остаток D-глутаминовой кислоты — в оболочке бак рий сибирской язвы.
[1]
В большинстве случаев аминокислоты D-ряда сладкие на вкус, L-ряда — горькие или безвкусные. [2]
Замена аминокислоты L-ряда на аминокислоту D-ряда или замена даже одной L-аминокислоты на другую может привести к полному исчезновению биологической активности пептида. [3]
Интересно, что в тканях значительно скорее дезаминируются не L-аминокисло-ты, входящие в состав белков, а ненатуральные аминокислоты D-ряда. Ткани почек, например, оказались более богаты таким ферментом, действующим на D-аминокисло-ты. Таким образом, в тканях большее распространение имеет океидаза D-аминокислот. Эта дегидрогеназа оказалась по своему строению флавиновым ферментом, кофермент-ной группой которого является рибофлавинадениновый динуклеотид.
[4]
Эта дегидрогеназа оказалась по своему строению флавиновым ферментом, кофермент-ной группой которого является рибофлавинадениновый динуклеотид.
[4]
Интересно, что человек может уже по вкусу отличить оптические антиподы аминокислот: аминокислоты L-ряда горькие или безвкусные, аминокислоты D-ряда обычно сладкие. [5]
Отнесение делается по аналогии с глицериновым альдегидом, НОСН2СН ( ОН) СНО, проекционная формула левовращающего изомера которого содержит гидроксил слева от вертикальной линии. Аминокислоты D-ряда содержатся в некоторых антибиотиках. [6]
Физиологическое значение и обмен L — и D-аминокислот совершенно р з-личны. Можно считать, что аминокислоты D-ряда, как правило, или совершенно не усваиваются животными и растениями, или усваиваются гораздо хуже, поскольку ферментные системы животных и растений специфически приспособлены к L-аминокислотам. [7]
[7]
Интересно отметить различие в физиологическом действии аминокислот L — и D-рядов. Большинство аминокислот L-ряда имеет сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные. [8]
Пенициллин ингибирует фермент только у микроорганизмов. Ферментная система животного организма, не способная использовать аминокислоты D-ряда, не затрагивается. [10]
Интересно отметить различие в физиологическом действии аминокислот L — и D-рядов. Большинство аминокислот L-ряда имеет сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные. [11]
В В-цепи окисленного инсулина эти протеазы гидролизовали пептидные связи по карбоксильным группам тех же аминокислот, проявляя специфичность, близкую к специфичности панкреатического химотрипсина. Пептиды, в которых х-аминокислотой были глицин, валин, пролин и пептиды, содержащие аминокислоты D-ряда, а также амиды КБО-лейцина и бензоилтирозина, исследуемыми протеазами практически не гидролизовались.
[12]
Пептиды, в которых х-аминокислотой были глицин, валин, пролин и пептиды, содержащие аминокислоты D-ряда, а также амиды КБО-лейцина и бензоилтирозина, исследуемыми протеазами практически не гидролизовались.
[12]
Окислительное дезаминирование а-амино-кислот в а-кетокислоты и моноаминов в альдегиды. Окислительное дезаминирование а-аминокислот катализируют флавопротеиды-оксидазы L-аминокислот, катализирующие окисление природных аминокислот L-ряда, и оксидазы D-аминокислот, действующие на неприродные аминокислоты D-ряда. [13]
Полученную оптически активную кислоту обрабатывали тионилхлоридом. Основываясь на представлении о том, что в процессе образования активной а-бромпропионовой кислоты из L-аланина имеет место вальденовское обращение, Фишер считал, что для синтеза пептидов, состоящих из L-аминокислот, необходимо галоид кислоты синтезировать из аминокислот D-ряда. [14]
[14]
Растения по-разному относятся к D — и L-формам аминокислот, и если L-формы хорошо усваиваются растениями и легко включаются в различные процессы обмена веществ, то D-формы растениями не ассимилируются, а иногда даже ингибируют процессы обмена. Это объясняется тем, что ферментативные системы организмов специфически приспособлены к L-аминокис-лотам. Большинство аминокислот D-ряда имеет сладкий вкус, а природные L-формы — горькие или безвкусные. Для разделения аминокислот на оптические антиподы пользуются химическими, микробиологическими и ферментативными методами. [15]
Страницы: 1 2
ХиМиК.ru — Стереохимия аминокислот
Большинство аминокислот содержит асимметрический атом углерода (у α-аминокислот это α-углеродный атом) и может существовать в виде оптических изомеров:При установлений конфигурации аминокислот их принято сравнивать с L— и D-молочными кислотами, конфигурации которых установлены по L- и D-глицериновым альдегидам.
В природе встречаются только оптически активные аминокислоты, причем подавляющее большинство их относится к L-ряду. D-Формы аминокислот сравнительно редки (они входят в состав некоторых антибиотиков).
Интересно отметить физиологическое отличие аминокислот D- и L-рядов. При реакциях, происходящих в организме под действием ферментов, превращениям, как правило, подвергаются L-аминокислоты и их производные (гидролиз ацилированных аминокислот, эфиров, пептидов). Обратные примеры встречаются значительно реже (одним из примеров может служить избирательное окисление D-аминокислот в кетокислоты под влиянием фермента, содержащегося в почках млекопитающих).
Синтетически полученные аминокислоты являются рацемическими смесями антиподов. Для их разделения могут быть использованы химические методы. Очень удобна, например, дробная кристаллизация солей дибензоил-D-винной кислоты с эфирами аминокислот.
Особое значение приобрели ферментативные методы расщепления рацемических аминокислот. Чаще всего для этого используется ацилаза — фермент, выделяемый из почек свиней. Разделяемую аминокислоту (например, D,L-аланин) ацетилируют и полученный ацетил-D,L-аланин обрабатывают в водном растворе аодлазой, под действием которой происходит стереоспецифический гидролиз L-ацетилаланина:
Чаще всего для этого используется ацилаза — фермент, выделяемый из почек свиней. Разделяемую аминокислоту (например, D,L-аланин) ацетилируют и полученный ацетил-D,L-аланин обрабатывают в водном растворе аодлазой, под действием которой происходит стереоспецифический гидролиз L-ацетилаланина:
Образовавшийся свободный L-аланин легко отделяется от устойчивого к действию ацилазы ацетил-D-аланина, из которого путем кислотного гидролиза в жестких условиях можно получить свободную D-аминокислоту. Обе стереоизомерные аминокислоты удается при этом выделить с высокими выходами.
Аминокислоты — это… Что такое Аминокислоты?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 10 апреля 2012. 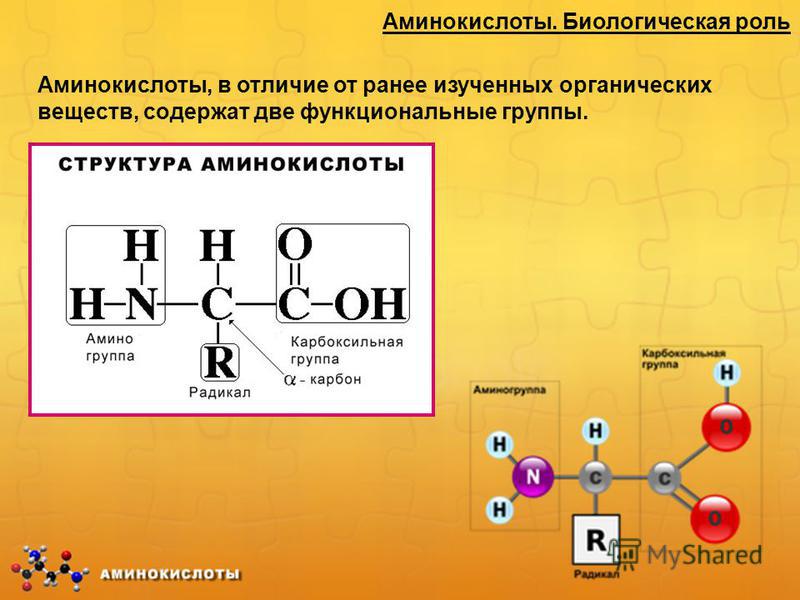 |
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
История
Открытие аминокислот в составе белков
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т. е. находятся в состоянии внутренних солей.
е. находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.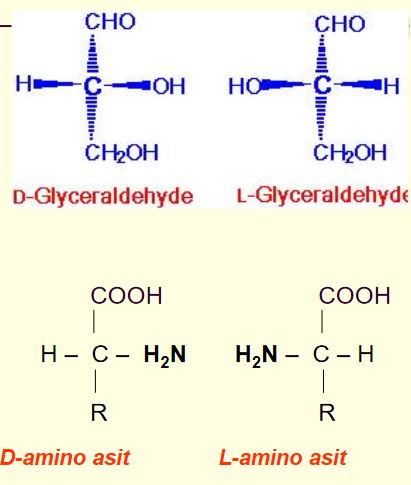
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью.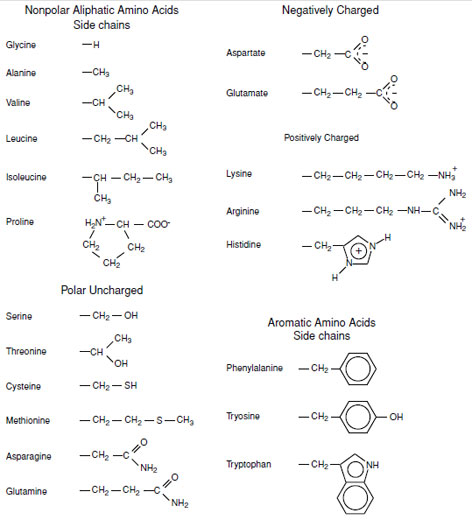 Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: так в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[2], что может быть использовано для определения возраста млекопитающих. Рацемизация остатков аспарагиновой также отмечена при старении коллагена, предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутремолекулярном ацилировании пептидного азота свободной карбоксильной группой аспарагиновой кислоты[3].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
Классификация
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH<7: аспартат, глутамат
- Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
Примечания
См. также
Ссылки
Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с. [1]
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
Синтетическая биология: новые аминокислоты, новые белки | Научные открытия и технические новинки из Германии | DW
Первые в истории человечества искусственные постройки были сооружены, конечно же, из природных материалов — глины, древесины, камней. Сегодня строители располагают поистине необъятным ассортиментом искусственных материалов — от бетона и стали до пластмасс и стекла. Столь широкий выбор стройматериалов и связанные с ними новые возможности предопределили и изменения в архитектуре сооружений. Похоже, сходные метаморфозы ждут нас и в биологии.
Новые задачи требуют новых белков
Природа создала практически все живые организмы — от бактерии до человека — по одному рецепту: наследственная информация, закодированная в генах, определяет состав и последовательность синтеза белков в клетках. Именно белки, собственно, и являются основой жизни — по крайней мере, в той форме, в которой она существует на Земле. Белки же представляют собой высокомолекулярные органические вещества, состоящие преимущественно из аминокислот. Набор аминокислот, образующих белки, невелик: их всего 20, так что все гигантское многообразие свойств белковых молекул определяется лишь различными комбинациями этих аминокислот.
Так задумала природа. Однако эти рамки представляются некоторым исследователям слишком узкими. В их числе и Недилько Будиша (Nediljko Budiša), хорватский ученый, работающий в Германии, в Институте биохимии Общества Макса Планка в Мартинсриде близ Мюнхена: «Все живые организмы используют эти 20 основных кирпичиков для синтеза белков, — поясняет ученый. — Но природа не могла предусмотреть, что мы поставим перед собой какие-то новые цели и начнем развивать биотехнологии».
Это и побудило исследователя взяться за создание новых аминокислот — с тем, чтобы использовать их в качестве составных элементов новых белков. Он начал с того, что сконструировал две не существующие в природе аминокислоты, а затем ему удалось заставить бактерии производить белки, в состав которых вошли и эти самые искусственные субстанции. Сегодня ученый уже владеет богатым ассортиментом приемов, с помощью которых он может заставить бактерии встраивать в синтезируемые ими белки самые разные химические элементы, природой там отнюдь не предусмотренные.
Фторопласты, липазы и катализаторы
«Фтор — это элемент, который природа практически никогда не использовала, или использовала крайне редко, — говорит Недилько Будиша. — Так, в организме человека фтор содержится разве что в зубной эмали. Это связано, прежде всего, с тем, что фториды — кристаллические соединения, в форме которых фтор встречается в природе, — нерастворимы в воде. Между тем, за последние годы и десятилетия в мире сформировалось целое направление органической химии, занимающееся фторсодержащими соединениями. Это чрезвычайно перспективное направление, здесь уже имеются весьма значительные достижения. Если мы искусственно создадим фторсодержащую аминокислоту и встроим ее в белок, то такой белок может и в органических растворителях быть таким же активным, как в воде».
Химической промышленности такие фторсодержащие белки будут как нельзя более кстати. Ведь сегодня фторопласты, то есть полимеры, содержащие атомы фтора и обладающие поэтому высокой химической стойкостью, получают чисто химическим путем, используя метод электролиза. Между тем, в биореакторах синтез фторопластов был бы более экологичным и обходился бы дешевле, — уверен Недилько Будиша.
Еще один пример — это липазы, водорастворимые ферменты, помогающие расщеплять жиры. Они широко применяются в моющих средствах и стиральных порошках. Путем внедрения в состав этих ферментов целого ряда специальных, не существовавших ранее в природе, аминокислот исследователю удалось существенно повысить эффективность моющих средств.
«Если говорить о важных в промышленном отношении ферментах, то их эффективность — как, например, в случае с этими липазами, — можно повысить ни много ни мало в 10 раз, — подчеркивает Недилько Будиша. — Ну, скажем, в 10 раз уменьшить расход катализаторов, необходимых для поддержания технологических процессов. Ведь эти катализаторы чрезвычайно дороги, и вот появляется возможность повысить их эффективность в 10 раз».
То, что поначалу выглядело — а возможно, и было, — забавой, сегодня стало уже серьезной инновацией. Казалось бы, промышленность должна двумя руками ухватиться за эту разработку. Но не тут-то было, — сетует Недилько Будиша: «Сравнивая свою ситуацию с ситуацией моих американских коллег, я должен сказать, что немецкая промышленность не проявляет особого интереса к новым технологиям. Она берет только то, что полностью готово к внедрению и не требует никаких дополнительных капиталовложений».
Впрочем, 20-ти аминокислотам потребовалось 3,5 миллиарда лет на то, чтобы прочно занять свое место в составе белков. Ясно, что новичкам приходится туго.
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
Аминокислоты и ацилкарнитины как потенциальные метаболомные маркеры шизофрении: новые подходы к диагностике и терапии | Меднова
1. Davalieva K., Maleva Kostovska I., Dwork A.J. Proteomics research in schizophrenia. Frontiers in Cellular Neuroscience. 2016; 10: 18. DOI: 10.3389/fncel.2016.00018.
2. Guest F.L., Guest P.C., Martins-de-Souza D. The emergence of point-of-care blood-based biomarker testing for psychiatric disorders: enabling personalized medicine. Biomarkers in Medicine. 2016; 10 (4): 431–443. DOI: 10.2217/bmm-2015-0055.
3. Li C., Wang A., Wang C., Ramamurthy J., Zhang E., Guadagno E., Trakadis Y. Metabolomics in patients with psychosis: a systematic review. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics. 2018; 177 (6): 580–588. DOI: 10.1002/ajmg.b.32662.
4. Pedrini M., Cao B., Nani J.V.S., Cerqueira R.O., Mansur R.B., Tasic L., Hayashi M.A.F., McIntyre R.S., Brietzke E. Advances and challenges in development of precision psychiatry through clinical metabolomics on mood and psychotic disorders. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 2019; 93: 182–188. DOI: 10.1016/j.pnpbp.2019.03.010.
5. Бойко А.С., Бохан Н.А. Бунева В.Н., Ветлугина Т.П., Зозуля С.А., Иванова С.А., Клюшник Т.П., Корнетова Е.Г., Лосенков И.С., Олейчик И.В., Семке А.В., Смирнова Л.П., Узбеков М.Г., Федоренко О.Ю. Биологические маркеры шизофрении: поиск и клиническое применение / под. ред. Н.А. Бохана, С.А. Ивановой. Новосибирск: Изд-во СО РАН, 2017: 146.
6. Hisamatsu T., Okamoto S., Hashimoto M., Muramatsu T., Andou A., Uo M., Kitazume M.T., Matsuoka K., Yajima T., Inoue N., Kanai T., Ogata H., Iwao Ya., Yamakado M., Sakai R., Ono N., Ando T., Suzuki M., Hibi T. Novel, objective, multivariate biomarkers composed of plasma amino acid profiles for the diagnosis and assessment of inflammatory bowel disease. PLoS One. 2012; 7 (1): e31131. DOI: 10.1371/journal.pone.0031131. 7. Kim J.S., Kornhuber H.H., Schmid-Burgk W., Holzmьller B. Low cerebrospinal fluid glutamate in schizophrenic patients and a new hypothesis on schizophrenia. Neuroscience Letters. 1980; 20 (3): 379–382. DOI: 10.1016/0304-3940(80)90178-0.
7. Van de Kerkhof N.W., Fekkes D., van der Heijden F.M., Hoogendijk W.J., Stцber G., Egger J.I., Verhoeven W.M. Cycloid psychoses in the psychosis spectrum: evidence for biochemical differences with schizophrenia. Neuropsychiatric Disease and Treatment. 2016; 12: 1927–1933. DOI: 10.2147/NDT.S101317.
8. Nagai T., Kirihara K., Tada M., Koshiyama D., Koike S., Suga M., Araki T., Hashimoto K., Kasai K. Reduced mismatch negativity is associated with increased plasma level of glutamate in first-episode psychosis. Scientific Reports. 2017; 7 (1): 2258. DOI: 10.1038/s41598-017-02267-1.
9. Steen N.E., Dieset I., Hope S., Vedal T.S.J., Smeland O.B., Matson W., Kaddurah-Daouk R., Agartz I., Melle I., Djurovic S., Jцnsson E.G., Bogdanov M., Andreassen O.A. Metabolic dysfunctions in the kynurenine pathway, noradrenergic and purine metabolism in schizophrenia and bipolar disorders. Psychological Medicine. 2019; 1–12. DOI: 10.1017/S0033291719000400.
10. McDonald J.W., Johnston M.V. Physiological and pathophysiological roles of excitatory amino acids during central nervous system development. Brain Research Reviews. 1990; 15 (1): 41–70. DOI: 10.1016/0165-0173(90)90011-C.
11. Macciardi F., Lucca A., Catalano M., Marino C., Zanardi R., Smeraldi E. Amino acid patterns in schizophrenia: some new findings. Psychiatry Research. 1990; 32 (1): 63–70. DOI: 10.1016/0165-1781(90)90136-s.
12. Oresic M., Tang J., Seppanen-Laakso T., Mattila I., Saarni S.E., Saarni S.I., Lonnqvist J., Sysi-Aho M., Hyotylainen T., Perala J., Suvisaari J. Metabolome in schizophrenia and other psychotic disorders: a general population-based study. Genome Medicine. 2011; 3 (3): 19. DOI: 10.1186/gm233.
13. Yang J., Chen T., Sun L., Zhao Z., Qi X., Zho K., Cao Y., Wang X., Qiu Y., Su M., Zhao A., Wang P., Yang P., Wu J., Feng G., He L., Jia W., Wan C. Potential metabolite markers of schizophrenia. Molecular Psychiatry. 2013; 18 (1): 67–78. DOI: 10.1038/mp.2011.131.
14. Van der Heijden F.M.M.A., Fekkes D., Tuinier S., Sijben A.E.S., Kahn R.S., Verhoeven W.M.A. Amino acids in schizophrenia: evidence for lower tryptophan availability during treatment with atypical antipsychotics? Journal of Neural Transmission. 2005; 112 (4): 577–585. DOI: 10.1007/s00702-004-0200-5.
15. Madeira C., Alheira F.V., Calcia M.A., Silva T.C., Tannos F.M., Vargas-Lopes C., Fisher M., Goldenstein N., Brasil M.A., Vinogradov S., Ferreira S.T., Panizzutti R. Blood levels of glutamate and glutamine in recent onset and chronic schizophrenia. Frontiers in Psychiatry. 2018; 9: 713. DOI: 10.3389/fpsyt.2018.00713.
16. Fukushima T., Iizuka H., Yokota A., Suzuki T., Ohno C., Kono Y., Nishikiori M., Seki A., Ichiba H., Watanabe Y., Hongo S., Utsunomiya M., Nakatani M., Sadamoto K., Yoshio T. Quantitative analyses of schizophrenia-associated metabolites in serum: serum D-lactate levels are negatively correlated with gamma-glutamylcysteine in medicated schizophrenia patients. PLoS One. 2014; 9 (7): e101652. DOI: 10.1371/journal.pone.0101652.
17. Ivanova S.A., Boyko A.S., Fedorenko O.Y., Krotenko N.M., Semke A.V., Bokhan N.A. Glutamate concentration in the serum of patients with schizophrenia. Procedia Chemistry. 2014; 10: 80–85. DOI: 10.1016/j.proche.2014.10.015.
18. Smith Q.R. Transport of glutamate and other amino acids at the blood-brain barrier. The Journal of Nutrition. 2000; 130 (4): 1016–1022S. DOI: 10.1093/jn/130.4.1016S.
19. Shulman Y., Grant S., Seres P., Hanstock C., Baker G., Tibbo P. The relation between peripheral and central glutamate and glutamine in healthy male volunteers. Journal of Psychiatry and Neuroscience. 2006; 31 (6): 406–410.
20. McGale E.H.F., Pye I.F., Stonier C., Hutchinson E.C., Aber G.M. Studies of the inter-relationship between cerebrospinal fluid and plasma amino acid concentrations in normal individuals. Journal of Neurochemistry. 1977; 29 (2): 291–297. DOI: 10.1111/j.1471-4159. 1977.tb09621.x.
21. Alfredsson G., Wiesel F.A., Lindberg M. Glutamate and glutamine in cerebrospinal fluid and serum from healthy volunteers-analytical aspects. Journal of Chromatography B: Biomedical Sciences and Applications. 1988; 424 (2): 378–384. DOI: 10.1016/S0378-4347(00)81116-0.
22. Bjerkenstedt L., Edman G., Hagenfeldt L., Sedvall G., Wiesel F.A. Plasma amino acids in relation to cerebrospinal fluid monoamine metabolites in schizophrenic patients and healthy controls. The British Journal of Psychiatry. 1985; 147 (3): 276–282. DOI: 10.1192/bjp.147.3.276.
23. Misiak B., Wisniewski J., Fleszar M.G., Frydecka D. Alterations in l-arginine metabolism in first-episode schizophrenia patients: Further evidence for early metabolic dysregulation. Schizophrenia Research. 2016; 178 (1–3): 56–57. DOI: 10.1016/j.schres.2016.08.032.
24. Sumiyoshi T., Anil A.E., Jin D., Jayathilake K., Lee M., Meltzer H.Y. Plasma glycine and serine levels in schizophrenia compared to normal controls and major depression: relation to negative symptoms. International Journal of Neuropsychopharmacology. 2004; 7 (1): 1–8. DOI: 10.1017/S1461145703003900.
25. Calcia M.A., Madeira C., Alheira F.V., Silva T.C., Tannos F.M., Vargas-Lopes C., Goldenstein N., Brasil M.A., Ferreira S.T., Panizzutti R. Plasma levels of D-serine in Brazilian individuals with schizophrenia. Schizophrenia Research. 2012; 142 (13): 83–87. DOI: 10.1016/j.schres.2012.09.014.
26. Hashimoto K., Fukushima T., Shimizu E., Komatsu N., Watanabe H., Shinoda N., Nakazato M., Kumakiri C., Okada S., Hasegawa H., Imai K., Masaomi I. Decreased serum levels of D-serine in patients with schizophrenia: evidence in support of the N- methyl-D-aspartate receptor hypofunction hypothesis of schizophrenia. Archives of General Psychiatry. 2003; 60 (6): 572–576. DOI: 10.1001/archpsyc.60.6.572.
27. Takano Y., Ozeki Y., Sekine M., Fujii K., Watanabe T., Okayasu H., Shinozaki T., Aoki A., Akiyama K., Homma H., Shimoda K. Multi-regression analysis revealed a relationship between l-serine and methionine, a component of one-carbon metabolism, in the normal control but not in the schizophrenia. Annals of General Psychiatry. 2016; 15 (1): 23. DOI: 10.1186/s12991-016-0113-3.
28. Bendikov I., Nadri C., Amar S., Panizzutti R., De Miranda J., Wolosker H., Agam G. A CSF and postmortem brain study of D-serine metabolic parameters in schizophrenia. Schizophrenia Research. 2007; 90 (1–3): 41–51. DOI: 10.1016/j.schres.2006.10.010.
29. Hashimoto K., Engberg G., Shimizu E., Nordin C., Lindstrцm L.H., Iyo M. Reduced D-serine to total serine ratio in the cerebrospinal fluid of drug naive schizophrenic patients. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2005; 29 (5): 767–769. DOI: 10.1016/j.pnpbp.2005.04.023.
30. Reveley M.A., De Belleroche J., Recordati A., Hirsch S.R. Increased CSF amino acids and ventricular enlargement in schizophrenia: a preliminary study. Biological Psychiatry. 1987; 22 (4): 413–420. DOI: 10.1016/0006-3223(87)90163-6.
31. El-Tallawy H.N., Saleem T.H., El-Ebidi A.M., Hassan M.H., Gabra R.H., Farghaly W.M., El-Maal N.A., Sherkawy H.S. Clinical and biochemical study of D-serine metabolism among schizophrenia patients. Neuropsychiatric Disease and Treatment. 2017; 13: 1057–1063. DOI: 10.2147/NDT.S126979.
32. Genchi G. An overview on D-amino acids. Amino Acids. 2017; 49 (9): 1521–1533. DOI: 10.1007/s00726-017-2459-5.
33. Saleem S., Shaukat F., Gul A., Arooj M., Malik A. Potential role of amino acids in pathogenesis of schizophrenia. International Journal of Health Sciences. 2017; 11 (3): 63–68.
34. Ozeki Y., Sekine M., Fujii K., Watanabe T., Okayasu H., Takano Y., Shinozaki T., Aoki A., Akiyama K., Homma H., Shimoda K. Phosphoserine phosphatase activity is elevated and correlates negatively with plasma D-serine concentration in patients with schizophrenia. Psychiatry Research. 2016; 237: 344–350. DOI: 10.1016/j.psychres.2016.01.010.
35. He Y., Yu Z., Giegling I., Xie L., Hartmann A.M., Prehn C., Adamski J., Kahn R., Li Y., Illig T., Wang-Sattler R., Rujescu D. Schizophrenia shows a unique metabolomics signature in plasma. Translational Psychiatry. 2012; 2: e149. DOI: 10.1038/tp.2012.76.
36. Cao B., Wang D., Brietzke E., McIntyre R.S., Pan Z., Cha D., Rosenblat J.D., Zuckerman H., Liu Y., Xie Q., Wang J. Characterizing amino-acid biosignatures amongst individuals with schizophrenia: a case-control study. Amino Acids. 2018; 50(8): 1013–1023. DOI: 10.1007/s00726-018-2579-6.
37. Chiappelli J., Postolache T.T., Kochunov P., Rowland L.M., Wijtenburg S.A., Shukla D.K., Tagamets M., Du X., Savransky A., Lowry C.A., Can, A., Fuchs D., Hong L.E. Tryptophan metabolism and white matter integrity in schizophrenia. Neuropsychopharmacology. 2016; 41 (10): 2587–2595. DOI: 10.1038/npp.2016.66.
38. Giesbertz P., Ecker J., Haag A., Spanier B., Daniel H. An LC-MS/MS method to quantify acylcarnitine species including isomeric and odd-numbered forms in plasma and tissues. Journal of Lipid Research. 2015; 56 (10): 2029–2039. DOI: 10.1194/jlr.D061721.
39. Liu M.L., Zhang X.T., Du X.Y., Fang Z., Liu Z., Xu Y., Zheng P., Xu X.J., Cheng P.F., Huang T., Bai S.J., Zhao L.B., Qi Z.G., Shao W.H., Xie P. Severe disturbance of glucose metabolism in peripheral blood mononuclear cells of schizophrenia patients: a targeted metabolomics study. Journal of Translational Medicine. 2015; 13 (1): 226. DOI: 10.1186/s12967-015-0540-y.
40. Cao B., Wang D., Pan Z., Brietzke E., McIntyre R.S., Musial N., Mansur R.B., Subramanieapillai M., Zeng J., Huang N., Wang J. Characterizing acyl-carnitine biosignatures for schizophrenia: a longitudinal pre- and post-treatment study. Translational Psychiatry. 2019; 9 (1): 19. DOI: 10.1038/s41398-018-0353-x.
41. Rao M.L., Gross G., Strebel B., Brдunig P., Huber G., Klosterkцtter J. Serum amino acids, central monoamines, and hormones in drug-naive, drug-free, and neuroleptic-treated schizophrenic patients and healthy subjects. Psychiatry Research. 1990; 34 (3): 243–257. DOI: 10.1016/0165-1781(90)90003-n.
42. Wei J., Xu H., Ramchand C. N., Hemmings G.P. Low concentrations of serum tyrosine in neuroleptic-free schizophrenics with an early onset. Schizophrenia Research. 1995; 14 (3): 257–260. DOI: 10.1016/0920-9964(94)00080-R.
43. Tortorella A., Monteleone P., Fabrazzo M., Viggiano A., De Luca B., Maj M. Plasma concentrations of amino acids in chronic schizophrenics treated with clozapine. Neuropsychobiology. 2001; 44 (4): 167–171. DOI: 10.1159/000054937.
44. Evins A.E., Amico E.T., Shih V., Goff D.C. Clozapine treatment increases serum glutamate and aspartate compared to conventional neuroleptics. Journal of Neural Transmission. 1997; 104 (6–7): 76–766. DOI: 10.1007/BF01291892.
45. Yamamori H., Hashimoto R., Fujita Y., Numata S., Yasuda Y., Fujimoto M., Ohi K., Umeda-Yano S., Ito A., Ohmorie T., Hashimoto, K., Takeda M. Changes in plasma D-serine, L-serine, and glycine levels in treatment-resistant schizophrenia before and after clozapine treatment. Neuroscience Letters. 2014; 582: 93–98. DOI: 10.1016/j.neulet.2014.08.052.
46. Neeman G., Blanaru M., Bloch B., Kremer I., Ermilov M., Javitt D.C., Heresco-Levy U. Relation of plasma glycine, serine, and homocysteine levels to schizophrenia symptoms and medication type. American Journal of Psychiatry. 2005; 162 (9): 1738–1740. DOI: 10.1176/appi.ajp.162.9.1738.
47. Xuan J., Pan G., Qiu Y., Yang L., Su, M., Liu Y., Chen J., Feng G., Fang Y., Jia W., Xing Q., He L. Metabolomic profiling to identify potential serum biomarkers for schizophrenia and risperidone action. Journal of Proteome Research. 2011; 10 (12): 5433–5443. DOI: 10.1021/pr2006796.
48. Cao B., Jin M., Brietzke E., McIntyre R.S., Wang D., Rosenblat J.D., Ragguett R.M., Zhang C., Sun X., Rong C., Wang J. Serum metabolic profiling using small molecular water-soluble metabolites in individuals with schizophrenia: A longitudinal study using a pre-post-treatment design. Psychiatry and Clinical Neurosciences. 2019; 73 (3): 100–108. DOI: 10.1111/pcn.12779.
49. Misiak B., Frydecka D., Laczmanski., Slezak R., Kiejna A. Effects of second-generation antipsychotics on selected markers of one-carbon metabolism and metabolic syndrome components in first-episode schizophrenia patients. European Journal of Clinical Pharmacology. 2014; 70 (12): 1433–1441. DOI: 10.1007/s00228-014-1762-2.
50. Leppik L., Kriisa K., Koido K., Koch K., Kajalaid K., Haring L., Vasar E., Zilmer M. Profiling of amino acids and their derivatives biogenic amines before and after antipsychotic treatment in first-episode psychosis. Frontiers in Psychiatry. 2018; 9: 155. DOI: 10.3389/fpsyt.2018.00155.
51. Ivanova S.A., Loonen A.J.M., Pechlivanoglou P., Freidin M.B., Al Hadithy A.F.Y., Rudikov E.V., Zhukova I.A., Govorin N.V., Sorokina V.A., Fedorenko O.Y., Alifirova V.M., Semke A.V., Brouwers J.R., Wilffert B. NMDA receptor genotypes associated with the vulnerability to develop dyskinesia. Translational Psychiatry. 2012; 2: e67. DOI: 10.1038/tp.2011.66.
52. Ward K.M., Yeoman L., McHugh C., Kraal A.Z., Flowers S.A., Rothberg A.E., Karnovsky A., Das A.K., Ellingrod V.L., Stringer K.A. Atypical antipsychotic exposure may not differentiate metabolic phenotypes of patients with schizophrenia. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 2018; 38 (6): 638–650. DOI: 10.1002/phar.2119.
53. Javitt D.C., Silipo G., Cienfuegos A., Shelley A.M., Bark N., Park M., Lindenmayer J.P., Suckow R., Zukin S.R. Adjunctive high-dose glycine in the treatment of schizophrenia. International Journal of Neuropsychopharmacology. 2001; 4 (4): 385–391. DOI: 10.1017/S1461145701002590.
54. Javitt D.C. Glycine transport inhibitors in the treatment of schizophrenia. Novel Antischizophrenia Treatments. 2012; 367–399. DOI: 10.1007/978-3-642-25758-2_12.
55. Heresco-Levy U., Ermilov M., Lichtenberg P., Bar G., Javitt D. C. High-dose glycine added to olanzapine and risperidone for the treatment of schizophrenia. Biological Psychiatry. 2004; 55 (2): 165–171. DOI: 10.1016/S0006-3223(03)00707-8.
56. Greenwood L.M., Leung S., Michie P.T., Green A., Nathan P.J., Fitzgerald P., Johnston P., Solowij N., Kulkarni J., Croft R.J. The effects of glycine on auditory mismatch negativity in schizophrenia. Schizophrenia Research. 2018; 191: 61–69. DOI: 10.1016/j.schres.2017.05.031.
57. Kato Y., Hin N., Maita N., Thomas A.G., Kurosawa S., Rojas C., Yorita K., Slusher B.S., Fukui K., Tsukamoto T. Structural basis for potent inhibition of d-amino acid oxidase by thiophene carboxylic acids. European Journal of Medicinal Chemistry. 2018; 159: 23–34. DOI: 10.1016/j.ejmech.2018.09.040.
58. Koсyigit Y., Yoca G., Karahan S., Ayhan Y., Yazici M.K. L-arginine add-on treatment for schizophrenia: a randomized, double-blind, placebo-controlled, crossover study. Turk Psikiyatri Dergisi. 2018; 29 (3): 147–153. DOI: 10.5080/u22702.
59. Tayeb H.O., Murad H.A., Rafeeq M.M., Tarazi F.I. Pharmacotherapy of schizophrenia: toward a metabolomic-based approach. CNS Spectrums. 2018; 24 (3): 1–6. DOI: 10.1017/S1092852918000962.
60. Serrita J., Ralevski E., Yoon G., Petrakis I. A pilot randomized, placebo-controlled trial of glycine for treatment of schizophrenia and alcohol dependence. Journal of Dual Diagnosis. 2019; 15 (1): 1–10. DOI: 10.1080/15504263.2018.1549764.
61. MacKay M.B., Kravtsenyuk M., Thomas R., Mitchell N.D., Dursun S.M., Baker G.B. D-serine: potential therapeutic agent and/or biomarker in schizophrenia and depression? Frontiers in Psychiatry. 2019; 10: 25. DOI: 10.3389/fpsyt.2019.00025.
62. Tsai G., Yang P., Chung L.C., Lange N., Coyle J.T. D-serine added to antipsychotics for the treatment of schizophrenia. Biological Psychiatry. 1998; 44 (11): 1081–1089. DOI: 10.1016/S0006-3223(98)00279-0.
63. Heresco-Levy U., Javitt D.C., Ebstein R., Vas A., Lichtenberg P., Bar G., Catinari S., Ermilov M. D-serine efficacy as add-on pharmacotherapy to risperidone and olanzapine for treatment-refractory schizophrenia. Biological Psychiatry. 2005; 57 (6): 577–585. DOI: 10.1016/j.biopsych.2004.12.037.
64. Kantrowitz J.T., Malhotra A.K., Cornblatt B., Silipo G., Balla A., Suckow R.F., Souza C.D., Saksa J., Woods S.W., avitt D.C. High dose D-serine in the treatment of schizophrenia. Schizophrenia Research. 2010; 121 (1–3): 125–130. DOI: 10.1016/j.schres.2010.05.012.
65. Kantrowitz J.T., Epstein M.L., Lee M., Lehrfeld N., Nolan K.A., Shope C., Petkova E., Silipo G., Javitt D.C. Improvement in mismatch negativity generation during d-serine treatment in schizophrenia: correlation with symptoms. Schizophrenia Research. 2018; 191: 70–79. DOI: 10.1016/j.schres.2017.02.027.
66. Weise M., Heresco-Levy U., Davidson M., Javitt D.C., Werbeloff N., Gershon A.A., Abramovich Y., Amital D., Doron A., Konas S., Levkovitz Y., Liba D., Teitelbaum A., Mashiach M., Zimmerman Y. A multicenter, addon randomized controlled trial of low-dose d-serine for negative and cognitive symptoms of schizophrenia. The Journal of Clinical Psychiatry. 2012; 73 (6): 728–734.
67. DOI: 10.4088/JCP.11m07031. 68. Tsai G.E., Yang P., Chang Y.C., Chong M.Y. D-alanine added to antipsychotics for the treatment of schizophrenia. Biological Psychiatry. 2006; 59 (3): 230–234. DOI: 10.1016/j.biopsych.2005.06.032.
68. Umbricht D., Alberati D., Martin-Facklam M., Borroni E., Youssef E.A., Ostland M., Wallace T.L., Knoflach F., Dorflinger E., Wettstein J.G., Bausch, A., Garibaldi G., Santarelli L. Effect of bitopertin, a glycine reuptake inhibitor, on negative symptoms of schizophrenia: a randomized, double-blind, proof-of-concept study. JAMA Psychiatry. 2014; 71 (6): 637–646. DOI: 10.1001/jamapsychiatry.2014.163.
69. Lane H.Y., Lin C.H., Green M.F., Hellemann G., Huang C.C., Chen P.W., Tun R., Chang Y.C., Tsai G.E. Addon treatment of benzoate for schizophrenia: a randomized, double-blind, placebo-controlled trial of D-amino acid oxidase inhibitor. JAMA Psychiatry. 2013; 70 (12): 1267–1275. DOI: 10.1001/jamapsychiatry.2013.2159.
70. Bruno A., Pandolfo G., Crucitti M., Lorusso S., Zoccali R.A., Muscatello M.R.A. Acetyl-L-carnitine augmentation of clozapine in partial-responder schizophrenia: a 12-week, open-label uncontrolled preliminary study. Clinical Neuropharmacology. 2016; 39 (6): 277–280. DOI: 10.1097/WNF.0000000000000170.
71. Chen A.T., Chibnall J.T., Nasrallah H.A. A meta-analysis of placebo-controlled trials of omega-3 fatty acid augmentation in schizophrenia: Possible stage-specific effects. Annals of Clinical Psychiatry. 2015; 27 (4): 289–296.
72. Sethi S., Brietzke E. Omics-based biomarkers: application of metabolomics in neuropsychiatric disorders. International Journal of Neuropsychopharmacology. 2015; 19 (3): pyv096. DOI: 10.1093/ijnp/pyv096.
73. Chan M.K., Gottschalk M.G., Haenisch F., Tomasik J., Ruland T., Rahmoune H., Guest P. C., Bahn S. Applications of blood-based protein biomarker strategies in the study of psychiatric disorders. Progress in Neurobiology. 2014; 122: 45–72. DOI: 10.1016/j.pneurobio.2014.08.002.
74. Nascimento J.M., Martins-de-Souza D. The proteome of schizophrenia. NPJ Schizophrenia. 2015; 1: 14003. DOI: 10.1038/npjschz.2014.3.
Роль D-аминокислот в организме человека
Спонсируемый контент Pittcon 4 марта 2021 г.
В этом интервью доктор Дэниел Армстронг из Техасского университета в Арлингтоне рассказывает News-Medical Life Sciences о своей предстоящей презентации Pittcon.
Не могли бы вы рассказать нам, что такое D-аминокислоты и какую роль они играют в здоровом организме человека?
Все живые системы состоят из L-аминокислот — мы будем называть их левосторонними аминокислотами — и D-аминокислоты являются их зеркальным отображением.Мы будем называть их правосторонними аминокислотами. Как и ваша правая и левая рука, одно не накладывается на другое зеркальное отображение.
Изначально считалось, чтоD-аминокислоты неестественны и бесполезны. Теперь мы знаем, что это не так. Мы обнаружили, что они играют важную роль в различных биологических процессах.
Кредит изображения: Shutterstock / Christoph Burgstedt
Какие методы аналитической химии были наиболее важными в ваших исследованиях D-аминокислот?Разделение энантиомеров с помощью ВЭЖХ на сегодняшний день является наиболее важным методом.Масс-спектрометрия более или менее бесполезна для качественного анализа, потому что энантиомеры имеют точно такую же массу, но она полезна в качестве чувствительного детектора для ВЭЖХ.
Каковы последствия этого исследования рака и неврологических расстройств? Могут ли они действовать как биомаркеры болезней?Да, могут. При раке, по-видимому, происходит повышенная регуляция некоторых аминокислот, что означает, что они находятся в более высокой концентрации, чем вы обычно найдете. Три, в частности, D-аспарагиновая кислота, D-серин и D-аланин, являются агонистами рецепторов NMDA (N-метил-D-аспартат).Это ионные каналы, которые активируются в нервных тканях, головном мозге, а также в раковых клетках.
Неврологически было обнаружено, что D-аминокислота останавливает тяжелые припадки, другие являются нейротрансмиттерами, а некоторые являются агонистами нейротрансмиттеров. Мы не совсем уверены в полном механизме (ах) действия, потому что только сейчас выясняем, что эти вещи существуют.
Какие знания предоставлены вашим исследованием, особенно в отношении болезни Альцгеймера?Основным белком или пептидом у пациентов с болезнью Альцгеймера является так называемый бета-амилоид.Он имеет цепь из 42 аминокислот и накапливается в бляшках между нервными клетками у пациентов с болезнью Альцгеймера.
Обнаружено, что бета-амилоид эпимеризует. Некоторые аминокислоты эпимеризуются в бета-амилоид в определенных местах, и оказывается, что эти аминокислоты в основном представляют собой аспарагиновую кислоту и серин.
До сих пор не было хорошего способа проанализировать такие аберрации в бета-амилоиде, и мы нашли ряд методов, которые не только обнаруживают его, но и могут точно указать, где в цепи бета-амилоида происходит аберрация. и если у пациентов с болезнью Альцгеймера больше аберраций, чем у нормальных людей.
Кредит изображения: Shutterstock / Tavarius
Не могли бы вы рассказать нам немного о своей работе над свободными L-амино и D-аминокислотами в культивируемых клетках рака груди человека?Мы обнаружили, что некоторые аминокислоты повышены в раковых клетках по сравнению с неканцерогенными клетками. Возникает вопрос, почему? Это также означает, что они могут использоваться в качестве онкометаболитов, которые просто повышены в раковой клетке или больном раком по сравнению с тем, что есть у здорового человека.
В качестве диагностического теста вы можете пройти, и если вы обнаружите этот онкометаболит, это признак того, что есть рак, который необходимо исследовать или искать более внимательно. Таким образом, его можно использовать как систему раннего предупреждения, что немаловажно.
Как эта работа была использована для разработки простого индикатора злокачественности для выявления рака груди и к какому результату это привело при клиническом осмотре?Недавно мы предположили, что существует возможный тест в качестве индикатора злокачественности с использованием соотношения определенных D- и L-аминокислот, который, похоже, работает в ограниченной среде для роста клеток, в которой мы работали.Однако перед тем, как появятся какие-либо клинические применения, его необходимо протестировать дополнительно и более подробно.
Изображение предоставлено: Shutterstock / CI Photos
Может ли ваше исследование D-аминокислот быть использовано фармацевтической промышленностью для разработки лекарств и методов лечения болезней человека?Совершенно возможно, и как минимум двумя способами. Во-первых, как онкометаболиты, которые мы обсуждали, как индикатор раннего предупреждения рака.Во-вторых, вмешиваясь в производство D-аминокислот раковыми клетками.
Мы думаем, что раковые клетки на самом деле вырабатывают D-аминокислоты, чтобы защитить себя от определенных противораковых препаратов. Таким образом, они сопротивляются, и они могут сделать это за считанные минуты или часы. Никто не осознавал этого раньше, но, зная это, мы можем разработать лекарства, которые препятствуют производству D-аминокислот раковыми клетками. Это сделает другие лекарства от рака более эффективными.
Как, по вашему мнению, будут развиваться исследования D-аминокислот и их роли в организме человека в будущем?Эта работа будет значительно расширена.Мы находимся только в самом начале и все еще пытаемся убедить людей, что это важно и что нужно изучить. Я думаю, что эта битва окончена, и вот-вот начнется грандиозный натиск исследований.
Роль D-аминокислот, будь то свободные D-аминокислоты или пептиды и белки, будет открываться все больше и больше. Это исследование будет значительно расширяться. Я думаю, вы обнаружите, что область протеомики D-аминокислот, которую мы предлагаем, будет стремительно развиваться.
Ваша работа охватывает несколько областей интересов, таких как молекулярная биология и аналитическая химия. Как влияние вашего исследования зависит от его междисциплинарного характера?В профессии академика хорошо то, что я могу исследовать все, что считаю интересным, независимо от области. Чтобы сосредоточиться только на одном деле всю свою жизнь, нужно иметь довольно ограниченное воображение.
Открытия в одной области обычно влияют на другие области, поэтому новый аналитический метод можно использовать во многих областях.После того, как вы изобрели новый метод или технику, даже самые ограниченные исследователи смогут использовать и используют их во многих важных областях. Важное значение имеет изобретение новой эффективной техники.
Газовая хроматография, очевидно, является полезным методом разделения проб на химические соединения для анализа. Можете ли вы сказать нам, почему это такая важная техника?Газовая хроматография и жидкостная хроматография являются доминирующими методами анализа большинства вещей; газовая хроматография, если они летучие, жидкостная хроматография, если они не являются летучими.Они используются как для идентификации, так и для количественного определения материалов, в том числе очень сложных смесей. Когда вы попадаете в реальную среду, биологические образцы — это очень сложные смеси.
Интересно, что основным источником занятости во всех областях химии является сепарация. Если вы будете заниматься разделением, то у вас будет работа. Хотя во время пандемии возможности трудоустройства сократились, мы этого не испытали. Наши студенты получали предложения о работе прямо через COVID, даже при дистанционном собеседовании.
В этом году на Pittcon вы представляете «Границы газовой хроматографии для нефтехимической лаборатории — от отбора проб до обнаружения». Не могли бы вы рассказать нам немного о своем исследовании и о том, что вы собираетесь представить в этом году?Я буду говорить о новых колонках на основе ионных жидкостей. Ионная жидкость — это жидкость, в которой все компоненты являются ионами, например соль (хлорид натрия), только вместо того, чтобы быть твердым телом, она является жидкостью. Эти вещи имеют очень высокую полярность и могут быть разработаны с очень высокой термической стабильностью.Они очень полезны в качестве стационарных фаз ГХ, о которых я и буду говорить. Они действительно полезны в качестве растворителей в свободном пространстве для анализа проб окружающей среды и биологических проб. Мы используем его для анализа воды и всевозможных материалов.
В этом суть того, о чем я буду говорить, новых ионных жидкостей, которые обладают высокой полярностью, высокой стабильностью и могут использоваться для необычных анализов, с которыми обычные стационарные фазы и обычные методы затрудняются.
Какие аналитические методы потребуются для продвижения в этом исследовании? Будут ли какие-то новые, усовершенствованные техники? Методыпостоянно развиваются, и области, в которых они будут использоваться, будут практически неограниченными.Например, нефтехимия — это всего лишь одна область, хотя об этом и идет речь. Они столь же полезны в анализе окружающей среды, анализе продуктов питания и напитков, ароматизаторах, судебной медицине. Он затрагивает все эти области, поэтому исследования с использованием ионных жидкостей или с их использованием могут идти в любом направлении.
Кредит изображения: Shutterstock / KrisanaAntharith
Принимая во внимание обе темы, которые мы обсудили, к чему, по вашему мнению, приведет ваше исследование в будущем?Как и в прошлом, надеюсь, новые технологии и новые знания пригодятся в будущем.Это также важно, потому что, проводя мои исследования, следующее поколение ученых получает образование и может продолжать такую работу еще долго после того, как я уйду. Так развивается наука, часто таща за собой человечество.
Вы постоянный клиент Pittcon. Что это событие предлагает исследователям всего мира?Pittcon предлагает простое сетевое взаимодействие с очень большим количеством ученых из разных областей, собранных в одном месте. Легче услышать более широкий спектр разговоров, чем на любой другой встрече, на которой я был, поэтому количество людей, с которыми вы можете получить доступ и поговорить, на Pittcon намного проще, чем на любой другой встрече в мире.
Какое влияние оказывают такие мероприятия, как Pittcon, на коммуникацию и дальнейшее развитие ваших исследований?Я думаю, что это может быть лучший форум или площадка для взаимодействия и общения большого количества ученых, как академических, так и промышленных. Кроме того, здесь присутствуют студенты, и это лучшая возможность для них услышать вашу работу, а вам также узнать, чем они занимаются.
Этот год был немного другим, и нам пришлось проводить много интервью виртуально.Как вы думаете, почему такие мероприятия, как Pittcon, сейчас важнее, чем когда-либо?Это одно из крупнейших собраний аналитиков и других ученых, и тем не менее, все презентации проводятся в относительно локализованной области, поэтому можно легко получить доступ к большему разнообразию тем и ученых за ограниченное время. Это также одна из крупнейших выставок в мире, и ее проведение может предоставить полезную техническую информацию, часто неизвестную или необъяснимую в академических беседах.
Я привожу на Pittcon значительное количество студентов. Чтобы присутствовать, они должны выступить с докладом или выступить с плакатом. Я считаю, что это действительно важно, потому что это хорошо для них. Им нравится весь опыт, от нетворкинга, проведения презентаций, знакомства с новыми темами, новыми частями страны. Многие из них не путешествовали, так что это прекрасная возможность. Вот почему мы всегда приводим как можно больше студентов, чтобы они участвовали; им это нравится.
О Дэне Армстронге
Дэниел В.Armstrong имеет более 750 публикаций, в том числе 35 глав в книгах, одну книгу («Использование заказных носителей в химическом разделении») и 35 патентов. Он был назван индексом научного цитирования одним из самых цитируемых ученых мира, и он прочитал ~ 580 приглашенных / основных / пленарных лекций и коллоквиумов по всему миру. Его работы цитировались более 46000 раз, а его индекс Хирша составляет ~ 109 (G.S.).
Дэниел Армстронг считается «отцом» разделения мицелл и циклодекстрина, он объяснил первый механизм хирального распознавания циклодекстринами, он был первым, кто разработал макроциклические антибиотики в качестве хиральных селекторов, и он является одним из ведущих мировых авторитетов в области теория, механизм и использование энантиоселективных молекулярных взаимодействий.Более 30 различных колонок для ЖХ и ГХ, которые первоначально были разработаны в его лабораториях, были коммерциализированы и / или скопированы по всему миру. Его работа и колонки были частично ответственны за революцию в хиральном разделении, вызванную хроматографией и электрофорезом, за последние два с половиной десятилетия. В настоящее время разработанные им колонки, хиральные селекторы и методы доминируют в мире аналитического энантиомерного разделения.
Он разработал наиболее эффективный способ характеризовать свойства растворителя ионных жидкостей при комнатной температуре (RTIL).Это оказалось важным и эффективным способом объяснения влияния RTIL на органические реакции и в различных аналитических методологиях. Была продемонстрирована агрегация поверхностно-активного вещества с образованием нормальных мицелл в RTIL. Первые матрицы MALDI-MS и высокостабильные стационарные фазы ГХ на основе RTIL были разработаны в его лабораториях и недавно были коммерциализированы Supelco / Sigma / Aldrich. В его лаборатории был разработан новый усовершенствованный метод масс-спектрометрии PIESI (парная ионная ионизация с электрораспылением), который является одним из самых чувствительных методов ультра-следовых анионных анализов и видообразования.Он разработал первый высокоэффективный подход к разделению КЭ для микроорганизмов (например, бактерий, вирусов, грибов и т. Д.). Это расширит сферу науки о разделении на основное направление биологии и коллоидной науки.
Он основал или стал соучредителем двух отдельных компаний, специализирующихся на производстве новых разделительных сред и их использовании для сложных анализов.
D-аминокислот в белке: зеркало жизни как молекулярный показатель старения
Основные моменты
- •
Гомохиральность аминокислот не гарантируется в белках старых живых тканей.
- •
Установлен экспресс-анализ d-аминокислот, связанных с белками, с помощью ЖХ-МС / МС.
- •
Образование D-Asp в белке происходит относительно быстро и происходит в течение всей жизни человека.
- •
остатка d-Asp могут изменять структуру и функцию белков более высокого порядка.
Abstract
Белки состоят исключительно из l-аминокислот. Однако у пожилых людей остатки d-аспарагиновой кислоты (d-Asp) были обнаружены в хрусталике глаза и головном мозге, а также в других тканях.Присутствие d-Asp может изменять структуру белка более высокого порядка, что, в свою очередь, может играть роль в возрастных расстройствах, таких как катаракта и болезнь Альцгеймера. d-Asp возникает в результате спонтанной рацемизации остатков Asp в чувствительных белках. Во время старения природные остатки lα-Asp в белках неферментативно изомеризуются через сукцинимидиловый промежуточный продукт в l-β-, d-α- и d-β-изомеры. Эта изомеризация не происходит равномерно, а вместо этого происходит на определенных остатках, которые подвержены изомеризации из-за их последовательности или структурного контекста.Таким образом, необходимо установить природу каждого отдельного остатка Asp в чувствительных белках. Недавно был описан новый метод, основанный на ЖХ-МС / МС, для анализа изомеризации Asp в определенных белковых сайтах. В этом обзоре мы сначала показываем, что гомохиральность аминокислот в белках не гарантируется на протяжении всей жизни. Затем мы описываем разработку нового метода анализа связанных с белками d-аминокислот и обсуждаем негативное влияние d-Asp на структуру и функцию белка.
Сокращения
PTMпосттрансляционные модификации
RP-HPLCвысокоэффективная жидкостная хроматография с обращенной фазой
LC-MSжидкостная хроматография
LC-MS / MSжидкостная хроматография в сочетании с тандемной масс-спектрометрией
PIMTl-isoas метилтрансфераза
AMDвозрастная дегенерация желтого пятна
Ключевые слова
d-аминокислота
Старение
Изоаспартат
Катаракта
LC-MS / MS
Proteomics
Посмотреть полный текст статей © 2018 Эльзевьер Б.V. Все права защищены.
Рекомендуемые статьи
Цитирование статей
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
пептидов, содержащих D-аминокислоту, в биомедицинских подходах.
D-аминокислоты, энантиомеры природных богатых L-аминокислот, обладают уникальными стереохимическими свойствами, которые приводят к устойчивости к большинству эндогенных ферментов. Предыдущие работы продемонстрировали применение D-аминокислот в терапевтических разработках с помощью зеркального фагового дисплея и ретро-инверсного пептидного синтеза. В этом обзоре мы освещаем недавний прогресс и проблемы в исследовании D-аминокислот на стыке химии и наук о жизни.Во-первых, мы познакомимся с некоторым прогрессом, достигнутым в традиционном применении D-аминокислот для повышения биостабильности пептидных терапевтических средств. Затем мы обсудим некоторые работы, в которых исследуются относительно малоизученные взаимодействия между ферментом и D-аминокислотами и ферментативные реакции D-аминокислот. Чтобы выделить ферментативные реакции D-аминокислот, мы опишем несколько новых работ по ферментно-управляемой самосборке (EISA) и их потенциальному применению в селективной противовоспалительной или противоопухолевой терапии.В конце мы кратко упомянем проблемы и возможные направления на будущее.
Ссылки
1. Schleifer KH, Kandler O. Пептидогликановые типы стенок бактериальных клеток и их таксономическое значение. Bacteriol Rev 1972; 36: 407–77. Искать в Google Scholar
2. Доусон П.Е., Мьюир Т.В., Кларк-Льюис И., Кент С. Синтез белков путем нативного химического лигирования. С 1994 г .; 266: 776–9. Искать в Google Scholar
3. Milton Rd, Milton S, Kent S. Полный химический синтез D-фермента: энантиомеры протеазы ВИЧ-1 демонстрируют реципрокную хиральную субстратную специфичность [исправлено].Science 1992; 256: 1445–8. Искать в Google Scholar
4. Шумахер Т.Н., Майр Л.М., Минор Д.Л., Милхоллен М.А., Берджесс М.В., Ким П.С. Идентификация лигандов D-пептида с помощью фагового дисплея в зеркальном отображении. Science 1996; 271: 1854–7. Искать в Google Scholar
5. Экерт Д.М., Малашкевич В.Н., Хонг Л.Х., Карр П.А., Ким П.С. Ингибирование проникновения ВИЧ-1: открытие ингибиторов D-пептида, которые нацелены на карман спиральной спирали gp41. Cell 1999; 99: 103–15. Искать в Google Scholar
6. Лю М., Ли Ц., Пазгиер М., Ли Ц., Мао Y, Ур. Y, Гу Б, Вэй Г, Юань В, Чжань Ц., Лу Вай.D-пептидные ингибиторы взаимодействия p53-MDM2 для таргетной молекулярной терапии злокачественных новообразований. Proc Natl Acad Sci USA 2010; 107: 14321–6. Искать в Google Scholar
7. Гудман М., Хорев М. О концепции линейных модифицированных ретропептидных структур. Acc Chem Res 1979; 12: 1–7. Искать в Google Scholar
8. Guichard G, Benkirane N, Zeder-Lutz G, Van Regenmortel M, Briand J-P, Muller S. Антигенная мимикрия природных L-пептидов с ретро-инверсо-пептидомиметиками. Proc Natl Acad Sci USA 1994; 91: 9765–9.Искать в Google Scholar
9. Wei XL, Zhan CY, Shen Q, Fu W, Xie C, Gao J, Peng CM, Zheng P, Lu WY. D-пептидный лиганд никотиновых ацетилхолиновых рецепторов для адресной доставки лекарств в мозг. Angew Chem Int Ed 2015; 54: 3023–7. Искать в Google Scholar
10. Li C, Pazgier M, Li J, Li C, Liu M, Zou G, Li Z, Chen J, Tarasov SG, Lu W-Y. Ограничения ретро-инверсной изомеризации пептидов в молекулярной мимикрии. J Biol Chem 2010; 285: 19572–81. Искать в Google Scholar
11.Li J, Kuang Y, Gao Y, Du X, Shi J, Xu B. D-аминокислоты повышают селективность и дают супрамолекулярные гидрогели нестероидного противовоспалительного препарата (NSAID). J Am Chem Soc 2013; 135: 542–5. Искать в Google Scholar
12. Li JY, Gao Y, Kuang Y, Shi JF, Du XW, Zhou J, Wang HM, Yang ZM, Xu B. Дефосфорилирование производных D-пептида с образованием биофункциональных, супрамолекулярных нановолокон / гидрогелей и их потенциальные применения для внутриклеточной визуализации и внутриопухолевой химиотерапии. J Am Chem Soc 2013; 135: 9907–14.Искать в Google Scholar
13. Ян З., Лян Г., Сюй Б. Ферментативное гидрогелирование малых молекул. Acc Chem Res 2008; 41: 315–26. Искать в Google Scholar
14. Чжоу Дж., Ду XW, Ли Дж., Ямагата Н., Сюй Б. Таурин усиливает клеточное поглощение малых D-пептидов для управляемой ферментами внутриклеточной молекулярной самосборки. J Am Chem Soc 2015; 137: 10040–3. Искать в Google Scholar
15. Zhao F, Gao Y, Shi J, Browdy HM, Xu B. Новый анизотропный супрамолекулярный гидрогель с высокой стабильностью в широком диапазоне pH.Langmuir 2010; 27: 1510–2. Искать в Google Scholar
16. Брюкнер Х., Фуджи Н. D-аминокислоты: в химии, науках о жизни и биотехнологии. Weinheim, Германия: Wiley-VCH, 2011. Поиск в Google Scholar
17. Tugyi R, Uray K, Iván D, Fellinger E, Perkins A, Hudecz F. Частичная замена D-аминокислоты: улучшенная ферментативная стабильность и сохраненное распознавание Ab пептида эпитопа MUC2. Proc Natl Acad Sci USA 2005; 102: 413–8. Искать в Google Scholar
18. Уэйд Д., Боман А., Волин Б., Дрейн С., Андреу Д., Боман Х.Г., Меррифилд РБ.Каналообразующие пептиды антибиотика, содержащие все D-аминокислоты. Proc Natl Acad Sci USA, 1990; 87: 4761–5. Искать в Google Scholar
19. Эллер М., Ярв Дж., Тоомик Р., Рагнарссон Ю., Экман П., Энгстром Л. Субстрат-специфичность протеинкиназы-с изучалась с пептидами, содержащими D-аминокислотные остатки. J Biochem 1993; 114: 177–80. Искать в Google Scholar
20. Merrifield EL, Mitchell SA, Ubach J, Boman HG, Andreu D, Mer rifield RB. D-энантиомеры гибридов цекропина а-мелиттина, состоящих из 15 остатков.Int J Pept Protein Res 1995; 46: 214–20. Искать в Google Scholar
21. Ши Дж, Ду Х, Юань Д, Чжоу Дж, Чжоу Н, Хуанг Y, Сюй Б. D-аминокислоты модулируют клеточный ответ супрамолекулярных нановолокон малых пептидов, управляемых ферментами. Биомакромолекулы 2014; 15: 3559–68. Искать в Google Scholar
22. Ван Х, Ван Й, Хан А, Цай Й, Сяо Н., Ван Л., Дин Д., Ян З. Обогащение клеточной мембраны самособирающимися D-пептидами для инженерии клеточной поверхности. ACS Appl Mater Interfaces 2014; 6: 9815–21.Искать в Google Scholar
23. Liang G, Yang Z, Zhang R, Li L, Fan Y, Kuang Y, Gao Y, Wang T, Lu WW, Xu B. Супрамолекулярный гидрогель дипептида D-аминокислоты для контролируемого препарата выпуск in vivo. Langmuir 2009; 25: 8419–22. Искать в Google Scholar
24. Li XM, Du XW, Li JY, Gao Y, Pan Y, Shi JF, Zhou N, Xu B. Введение D-аминокислоты или простого гликозида в небольшие пептиды, чтобы позволить супрамолекулярным гидрогелаторам сопротивляться протеолизу . Langmuir 2012; 28: 13512–7. Искать в Google Scholar
25.d’Amours D, Desnoyers S, d’Silva I, Poirier GG. Реакции поли (АДФ-рибозилирования) в регуляции ядерных функций. Biochem J 1999; 342: 249–68. Искать в Google Scholar
26. Pardridge WM. Рецептор-опосредованный транспорт пептидов через гематоэнцефалический барьер. Endocr Rev 1986; 7: 314–30. Искать в Google Scholar
27. Futaki S, Suzuki T, Ohashi W, Yagami T, Tanaka S, Ueda K, Sugiura Y. Пептиды, богатые аргинином. Обильный источник проницаемых для мембран пептидов, имеющих потенциал в качестве носителей для доставки внутриклеточного белка.J Biol Chem 2001; 276: 5836–40. Искать в Google Scholar
28. Levine AJ, Momand J, Finlay CA. Ген-супрессор опухоли p53. Nature 1991; 351: 453–6. Искать в Google Scholar
29. Haupt Y, Maya R, Kazaz A, Oren M. Mdm2 способствует быстрой деградации p53. Nature 1997; 387: 296–9. Искать в Google Scholar
30. Wong C-H, Whitesides GM. Ферменты в синтетической органической химии. Кембридж, США: Academic Press, 1994. Поиск в Google Scholar
31. Wehofsky N, Pech A, Liebscher S, Schmidt S, Komeda H, Asano Y, Bordusa F.Специфические для D-аминокислот протеазы и нативные L-белки: удобная комбинация для полусинтеза. Angew Chem Int Ed 2008; 47: 5456–60. Искать в Google Scholar
32. Naghavi M, Wang H, Lozano R, Davis A, Liang X, Zhou M, Vollset SE, Ozgoren AA, Abdalla S, Abd-Allah F. Глобальные, региональные и национальные с учетом возраста и пола Смертность от всех причин и от конкретных причин для 240 причин смерти, 1990–2013 гг .: систематический анализ для исследования глобального бремени болезней 2013 г. Lancet 2015; 385: 117–71.Искать в Google Scholar
33. Zhao F, Ma ML, Xu B. Молекулярные гидрогели терапевтических агентов. Chem Soc Rev 2009; 38: 883–91. Искать в Google Scholar
34. Gao Y, Kuang Y, Guo Z-F, Guo Z, Krauss IJ, Xu B. Самосборка молекул с помощью ферментов дает нановолокна и супрамолекулярный гидрогель производного таксола. J Am Chem Soc 2009; 131: 13576–7. Искать в Google Scholar
35. Burtis CA, Ashwood ER, Burns DE. Учебник Тиц по клинической и молекулярной диагностике. Сондерс, Св.Луи, США: Elsevier, 2006. Поиск в Google Scholar
36. Ян З., Сюй К., Го З., Гуо З., Сюй Б. Внутриклеточное ферментативное образование нановолокон приводит к гидрогелированию и регулируемой гибели клеток. Adv Mater 2007; 19: 3152–6. Искать в Google Scholar
37. Куанг Й, Ши Дж, Ли Дж, Юань Д., Альберти К.А., Сюй Q, Сюй Б. Перицеллюлярный гидрогель / наносетки ингибируют раковые клетки. Angew Chem Int Ed 2014; 53: 8104–7. Искать в Google Scholar
38. Ли Дж., Куанг Й., Ши Дж., Чжоу Дж., Медина Дж. Э., Чжоу Р., Юань Д., Ян Ц., Ван Х., Ян З.Управляемая ферментом внутриклеточная молекулярная самосборка для повышения активности цисплатина против устойчивых к лекарствам клеток рака яичников. Angew Chem Int Ed 2015; 127: 13505–9. Искать в Google Scholar
39. Ян Ц., Чу Л., Чжан И, Ши И, Лю Дж, Лю Ц., Фань С., Ян З, Дин Д., Конг Д. Динамическая биостабильность, биораспределение и токсичность L / D- супрамолекулярные нановолокна на основе пептидов. ACS Appl Mater Interfaces 2015; 7: 2735–44. Искать в Google Scholar
40. Ou C, Zhang J, Shi Y, Wang Z, Wang L, Yang Z, Chen M.Пептидный допинговый гидрогель с D-аминокислотой для производства клеточной колонии. RSC Adv 2014; 4: 9229–32. Искать в Google Scholar
41. Marchesan S, Easton C, Styan K, Waddington L, Kushkaki F, Goodall L, McLean K, Forsythe J, Hartley P. Влияние хиральности в каждой позиции аминокислоты на самосборку трипептида в гидрогелевые биоматериалы . Nanoscale 2014; 6: 5172–80. Искать в Google Scholar
42. Marchesan S, Easton CD, Kushkaki F, Waddington L, Hartley PG. Трипептидные самоорганизующиеся гидрогели: неожиданные повороты хиральности.Chem Commun 2012; 48: 2195–7. Искать в Google Scholar
43. Rabideau AE, Pentelute BL. D-аминокислота на N-конце белка отменяет его деградацию с помощью пути правила N-конца. ACS Cent Sci 2015; 1: 423–30. Искать в Google Scholar
A2. Стереохимия аминокислот — Биология LibreTexts
Все аминокислоты хиральные, за исключением глицина, боковая цепь которого — H. Как и в случае липидов, биохимики используют номенклатуру L и D. Все встречающиеся в природе белки всех живых организмов состоят из L аминокислот.Абсолютная стереохимия связана с L-глицеральдегидом, как и в случае триацилглицеридов и фосфолипидов. Большинство встречающихся в природе хиральных аминокислот — это S, за исключением цистеина. Как показано на диаграмме ниже, абсолютная конфигурация аминокислот может быть показана с обозначением H, направленным назад, группами COOH, направленными влево, группой R, вправо и группой Nh4, направленными вверх. Вы можете запомнить это с помощью анаграммы CORN.
Рисунок: стереохимия аминокислот.
Почему Биохимия до сих пор использует D и L для сахаров и аминокислот? Это объяснение (взято из приведенной ниже ссылки) кажется разумным.
«Кроме того, однако, химики часто нуждаются в однозначном определении конфигурации в отсутствие какого-либо эталонного соединения, и для этой цели идеально подходит альтернативная (R, S) система, поскольку она использует правила приоритета для определения конфигураций. Эти правила иногда приводят к абсурдным результатам, когда они применяются к биохимическим молекулам. Например, как мы видели, все распространенные аминокислоты являются L, потому что все они имеют точно такую же структуру, включая положение группы R, если мы просто напишем Группа R как R.Однако не все они имеют одинаковую конфигурацию в системе (R, S): L-цистеин также является (R) -цистеином, но все другие L-аминокислоты являются (S), но это просто отражает решение человека. дать атому серы более высокий приоритет, чем атому углерода, и не отражает реальной разницы в конфигурации. Более серьезные проблемы могут иногда возникать в реакциях замещения: иногда инверсия конфигурации может не привести к изменению префикса (R) или (S); а иногда сохранение конфигурации может привести к изменению префикса.
Отсюда следует, что не только консерватизм или непонимание системы (R, S) заставляет биохимиков продолжать использовать D и L: просто система DL удовлетворяет их потребности намного лучше. Как уже упоминалось, химики также используют D и L, когда они соответствуют их потребностям. Приведенное выше объяснение того, почему система (R, S) мало используется в биохимии, таким образом, почти полностью противоположно реальности. Эта система на самом деле является единственным практическим способом однозначного представления стереохимии сложных молекул с несколькими асимметричными центрами, но она неудобна для регулярных серий молекул, таких как аминокислоты и простые сахара.«
Если бы я сказал вам нарисовать правильную стереохимию молекулы с 1 хиральным C (например, S-изомер) и дал вам заместители, вы могли бы легко сделать это, следуя правилам приоритета R, S. Однако как бы вы нарисовали правильный изомер для L-изомера аминокислоты аланина? Вы не смогли бы сделать это без предварительного знания абсолютной конфигурации родственной молекулы, L-глицеральдегида, или если вы не помните анаграмму CORN. Однако этот недостаток более чем компенсируется тем фактом, что разные L-аминокислоты с одинаковой абсолютной стереохимией могут быть помечены как R или S, что делает эту номенклатуру непривлекательной для биохимиков.
Авторы и авторство
Высокоселективный синтез d-аминокислот посредством стереоинверсии соответствующего аналога фабрикой каскадных клеток in vivo | Фабрики микробных клеток
Построение мультиферментной каскадной системы
Совместная экспрессия нескольких ферментов в одном хозяине с помощью общего механизма синтеза белка может снизить затраты на производство ферментов по сравнению с затратами на индивидуальную экспрессию фермента в нескольких хозяевах, за которыми следует фермент коктейль [21].Однако совместная экспрессия нескольких белков может привести к метаболической нагрузке во время роста клеток, что может привести к плохой сверхэкспрессии и, таким образом, к ухудшению каталитических характеристик [21, 22, 30]. Реализация мультиферментной каскадной системы in vivo в разработанном клеточном катализаторе требует точной настройки уровней экспрессии. Точная стратегия коэкспрессии влияет на экспрессию целевых ферментов и каталитическую эффективность системы коэкспрессии [17, 21, 31]. Как показано на схеме 1, в нашем исследовании разработанный каскадный путь in vivo в основном состоял из двух модулей: модуля окислительного дезаминирования, катализируемого дезаминазой l-аминокислоты, и модуля восстановительного аминирования, катализируемого дегидрогеназой d-аминокислоты и дегидрогеназой формиата.Чтобы улучшить общую каталитическую эффективность системы коэкспрессии, использовали три стратегии для регулирования уровней экспрессии ферментов. (1) Три ферментных гена laad , dapdh и fdh , которые составляют модуль окислительного дезаминирования (LAAD) и модули восстановительного аминирования (DAPDH и FDH), были клонированы в одной плазмиде pET-28a. Учитывая, что активность LAAD была выше, чем у DAPDH; соответственно, чтобы усилить экспрессию DAPDH и FDH, соответствующие последовательности RBS были добавлены к dapdh и fdh [8].Чтобы регулировать и уравновешивать интенсивность экспрессии трех ферментных генов, положения двух модулей на плазмиде были скорректированы. (2) Модуль окислительного дезаминирования и модуль восстановительного аминирования были сконструированы на двух разных плазмидах, pET-21b и pET-28a, соответственно (pET-21b и pET-28a оба содержали промотор Т7 с генами ампициллина и канамицина соответственно). Таким образом, экспрессия генов двух модулей будет регулироваться промотором Т7 на двух плазмидах для независимой экспрессии двух модулей, тем самым минимизируя взаимодействия между тремя генами.(3) Поскольку LAAD был мембрано-связывающим белком, метка MBP была добавлена к двойной плазмидной системе для улучшения растворимой экспрессии LAAD. Согласно этой стратегии экспрессии четыре штамма коэкспрессии, названные E. coli pET-28a- laad — dapdh — fdh , E. coli pET-28a- dapdh — fdh — laad , E. coli pET-21b- laad / pET-28a- dapdh — fdh и E.coli pET-21b-MBP- laad / pET-28a- dapdh — fdh .
Как показано на фиг. 1a, когда гены laad , dapdh и fdh были клонированы в плазмиде pET-28a, положение laad оказало большое влияние на цельноклеточный катализатор. Когда laad находился рядом с первой позицией промотора Т7, хотя экспрессия LAAD была очень высокой, она в основном экспрессировалась в виде телец включения, а DAPDH и FDH демонстрировали определенную степень нерастворимой экспрессии (рис.1б). Кроме того, каталитическая активность цельноклеточного биокатализатора E. coli pET-28a- laad — dapdh — fdh была низкой (катализирующая 30 мМ l-Phe), при концентрации продукта только 1,5 мМ. , d-Phe. Имеются данные о том, что чем ближе ген находится к концу полицистронного оперона, тем ниже его экспрессия [31]. Следовательно, первая и последняя позиции в полицистроне будут иметь наибольшее влияние на экспрессию генов. Учитывая, что LAAD является мембрано-связывающим белком, он может влиять на экспрессию DAPDH и FDH, когда он расположен рядом с первой позицией промотора T7.Таким образом, в нашем исследовании ген laad был размещен на конце от промотора Т7. Неожиданно оказалось, что все три фермента показали нормальную экспрессию, а цельноклеточный биокатализатор E. coli pET-28a- dapdh — fdh — laad обладал высокой каталитической активностью. Концентрация d-Phe в реакционной системе составляла 28 мМ, как показано на фиг. 1a и b. Впоследствии, laad , dapdh и fdh были сконструированы в двух разных плазмидах, и были исследованы экспрессия и каталитическая эффективность трех генов в системе совместной экспрессии двойной плазмиды.Когда три гена коэкспрессируются в двух плазмидах ( laad или MBP- laad в плазмиде pET-21b, dapdh и fdh в плазмиде pET-28a одновременно), два штамма, E. coli pET-21b-MBP- laad / pET-28a- stdapdh — fdh и E. coli pET-21b- laad / pET-28a- dapdh — fdh оба обладают высокой каталитической активностью; концентрации d-Phe в реакционной системе составляли 23 и 28 мМ.Как показано на фиг. 1b, кроме того, когда гены laad , dapdh и fdh были клонированы в pET-28a с laad в первом положении, близком к промотору T7, экспрессия laad увеличилось. Когда laad находился далеко от промотора Т7, экспрессия dapdh и fdh была усилена, тогда как экспрессия laad была ослаблена. В системе коэкспрессии двойной плазмиды экспрессия dapdh и fdh регулируется pET-28a отдельно.Экспрессия dapdh и fdh была усилена, тогда как экспрессия laad была ослаблена. Следовательно, экспрессия laad в pET-21b не приводила к образованию тела включения в такой степени, как в pET-28a, когда laad был помещен в первое положение. Следовательно, мы получили три штамма коэкспрессии с высокой каталитической активностью для последующих анализов. Условия экспрессии и каталитические условия штаммов были изучены для дальнейшего повышения каталитической эффективности и, таким образом, для получения оптимизированного биокатализатора для цельноклеточной коэкспрессии.
Рис. 1Построение мультиферментной каскадной системы путем регуляции экспрессии ферментов. a Оптимизация экспрессии гена с помощью плазмид для биотрансформации l-Phe в d-Phe. Реакции проводили в буфере Tris-HCl (50 мМ, pH 9,0) при 30 ° C. Реакционная смесь содержала 50 мг / мл цельноклеточного биокатализатора, НАДФ + (3 мМ), NH 4 Cl (90 мМ), формиат натрия (60 мМ) и 1-Phe (30 мМ). Все реакции проводили в буфере Tris-HCl (50 мМ, pH 9.0) при 30 ° C и 220 об / мин. Значения были усреднены по результатам трех измерений. b SDS-PAGE рекомбинантной E. coli pET-28a- laad — dapdh — fdh (1), E. coli pET28a- dapdh — laadh — laadh (2), E. coli pET21b- laad / pET-28a- dapdh — fdh (3) и E. coli pET-21b-MBP- laad / pET-28a -dapdh — fdh (4).Т: общий клеточный лизат; S: растворимая фракция. Образцы были получены из 50 мг / мл. E. coli
Влияние условий коэкспрессии на каталитическую эффективность
Исследовали влияние различных условий экспрессии на каталитическую эффективность рекомбинантных штаммов. Как упоминалось выше, концентрация субстрата составляла 30 мМ, и каталитические реакции в основном проводились для измерения каталитической активности сконструированных цельноклеточных катализаторов и для определения возможности каскадной реакции in vivo.Для дальнейшего повышения каталитической эффективности оптимизацию условий экспрессии рекомбинантных клеток проводили при более высокой концентрации субстрата. Таким образом, в следующих исследованиях концентрация l-Phe была выбрана равной 50 мМ.
Для оптимизации условий экспрессии белка влияние концентрации IPTG и температуры индукции на активность биокатализатора E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh , Э.coli pET-21b- laad / pET-28a- dapdh — fdh и E. coli pET-28a- dapdh — fdh — laad . Как показано на фиг. 2a, когда концентрация IPTG составляла 0,75 мМ, каталитическая активность E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh целиком. биокатализатор был самым высоким. Кроме того, более высокие концентрации IPTG (1 и 1,5 мМ) подавляли каталитическую активность рекомбинантного E.coli pET-21b-MBP- laad / pET-28a- dapdh — fdh . Как определено с помощью SDS-PAGE, все три белка в некоторой степени экспрессировали тельца включения, когда концентрации IPTG составляли 1 и 1,5 мМ (дополнительный файл 1: фиг. S1). Следовательно, оптимальная концентрация IPTG для E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh составляла 0,75 мМ. Более того, как показано на рис. 2b и c, оптимальные концентрации IPTG для E. coli pET-21b- laad / pET-28a- dapdh — fdh и E.coli pET28a- dapdh — fdh — laad составляли 1,5 и 0,75 мМ соответственно. Влияние концентрации IPTG на экспрессию белка E. coli pET-21b- laad / pET-28a- dapdh — fdh и E. coli pET-28a- dapdh — fdh — laad резюмированы Дополнительный файл 1: Рис. S2 – S3.
Фиг.2Влияние условий экспрессии на каталитическую эффективность E.coli pET-21b-MBP -laad / pET-28a -dapdh-fdh, E. coli pET-21b -laad / pET-28a -dapdh-fdh и E. coli pET -28a -dapdh-fdh-laad . a Влияние концентрации IPTG на каталитическую активность E. coli pET-21b-MBP -laad / pET-28a -dapdh-fdh . Температура индукции 17 ° C. b Влияние концентрации IPTG на каталитическую активность E. coli pET-21b -laad / pET-28a -dapdh-fdh .Температура индукции 17 ° C. c Влияние концентрации IPTG на каталитическую активность E. coli pET-28a -dapdh-fdh-laad . Температура индукции 17 ° C. d Влияние температуры индукции на каталитическую активность E. coli pET-21b-MBP -laad / pET-28a -dapdh-fdh . Концентрация IPTG составляла 0,75 мМ. e Влияние температуры индукции на каталитическую активность E.coli pET-21b -laad / pET-28a -dapdh-fdh . Концентрация IPTG составляла 1,5 мМ. f Влияние температуры индукции на каталитическую активность E. coli pET-28a -dapdh-fdh-laad . Концентрация IPTG составляла 0,75 мМ. Реакционная смесь содержала 50 мг / мл цельноклеточного биокатализатора, НАДФ + (5 мМ), NH 4 Cl (150 мМ), формиат натрия (100 мМ) и 1-Phe (50 мМ). Все реакции проводили в буфере Tris-HCl (50 мМ, pH 9.0) при 30 ° C и 220 об / мин в течение 6 ч. Значения были усреднены из трех измерений.
Влияние температуры индукции на каталитическую активность было дополнительно исследовано. Как показано на рис. 2d-f, для всех трех совместно экспрессируемых штаммов каталитическая активность цельноклеточного биокатализатора возрастала с увеличением температуры индукции. Когда температура индукции составляла 30 ° C, каталитическая активность цельноклеточного биокатализатора была максимальной. В то же время при оптимальных условиях индукции E.coli pET-21b-MBP- laad / pET-28a- dapdh — fdh имела самую высокую каталитическую активность (оптимальная концентрация IPTG составляла 0,75 мМ, а оптимальная температура индукции составляла 30 ° C). Согласно нашим предыдущим исследованиям, слияние MBP-tag не только улучшает растворимую экспрессию мембраносвязанного LAAD, но также увеличивает его каталитические свойства [29]. Следовательно, в системе коэкспрессии E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh улучшение каталитической активности LAAD увеличивало каталитическую активность Э.coli pET-21b-MBP- laad / pET-28a- dapdh — fdh цельноклеточный катализатор. Хотя активность LAAD была выше, чем у DAPDH, уровень его активной экспрессии был низким из-за свойства связывания с мембраной [8]. Каталитическая эффективность модуля окислительного дезаминирования будет ниже, чем у модуля восстановительного аминирования, который управляет реакционным балансом в сторону накопления целевого продукта, а модуль окислительного дезаминирования будет этапом, ограничивающим скорость.Следовательно, каталитические характеристики цельноклеточного катализатора были улучшены после оптимизации конструкции, включающей RBS, промоторы, положения генов и теги слияния. Следовательно, рекомбинантный E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh был выбран для дальнейших анализов.
Влияние компонентов реакции на каталитическую эффективность
Для дальнейшего улучшения асимметричного производства d-Phe с помощью биокатализа целых клеток, условия реакции были систематически оптимизированы.В нашей предыдущей работе по созданию системы каскадных каталитических реакций in vitro цельноклеточный биокатализатор LAAD и фермент DAPDH были более активными при pH 9,0, что было благоприятным для модуля окислительного дезаминирования и модуля восстановительного аминирования [8]. Таким образом, в этой работе значение pH реакции определялось в соответствии с ранее оптимизированными каталитическими условиями для каскадной реакции. Что касается компонентов реакции, то сначала оценивали влияние концентрации цельноклеточного биокатализатора E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh на скорость превращения.Общая скорость превращения d-Phe увеличивалась по мере увеличения концентрации цельноклеточного биокатализатора с 10 до 75 мг / мл влажных клеток (рис. 3а). Более того, самая высокая степень конверсии 84,5% была достигнута при использовании влажных клеток 75 мг / мл после 6 часов трансформации. Поскольку не наблюдалось явного увеличения скорости превращения от 100 до 125 мг / мл влажных клеток, более высокая концентрация цельноклеточного катализатора может привести к снижению скорости массопереноса в реакционной системе, что снижает каталитическую эффективность цельноклеточных клеток. катализатор.Затем влажные клетки с концентрацией 75 мг / мл были выбраны в качестве оптимального количества для трансформации целых клеток и использовались для последующих экспериментов.
Рис. 3Влияние различных концентраций цельноклеточного биокатализатора, NH 4 Cl, формиата натрия и NADP + на каталитическую эффективность. a Влияние концентрации цельноклеточного биокатализатора на каталитическую активность цельных клеток. Концентрация НАДФ + составляла 5 мМ, концентрация NH 4 Cl составляла 150 мМ, а концентрация формиата натрия составляла 100 мМ. b Влияние концентрации NH 4 Cl на биокаталитическую активность целых клеток. Концентрация цельноклеточного биокатализатора составляла 75 мг / мл влажных клеток, концентрация NADP + составляла 5 мМ, а концентрация формиата натрия составляла 100 мМ. c Влияние концентрации формиата натрия на биокаталитическую активность целых клеток. Концентрация цельноклеточного биокатализатора составляла 75 мг / мл влажных клеток, концентрация NADP + составляла 5 мМ, а концентрация NH 4 Cl составляла 200 мМ. d Влияние концентрации НАДФ + на биокаталитическую активность целых клеток. Концентрация цельноклеточного биокатализатора составляла 75 мг / мл влажных клеток, концентрация NH 4 Cl составляла 200 мМ, а концентрация формиата натрия составляла 150 мМ. Все реакции проводили в буфере Tris-HCl (50 мМ, pH 9,0) при 30 ° C и 220 об / мин в течение 6 часов. Значения были усреднены из трех измерений.
NH 4 Cl и формиат натрия использовали в качестве доноров аммиака и сопубстратов в ранее созданной каталитической системе in vitro.Хотя NH 4 + , произведенный из LAAD, мог быть переработан DAPDH, степень использования образующегося NH 4 + была очень низкой. Чтобы гарантировать эффективность реакции, необходимо добавить экзогенный донор аммиака в каскадную каталитическую систему in vivo. Соответственно, было исследовано влияние концентраций NH 4 Cl и формиата натрия на каталитическую активность каскадной системы in vivo. Как показано на рис. 3b и c, каталитическая активность E.coli pET-21b-MBP- laad / pET-28a- dapdh — fdh цельноклеточный биокатализатор увеличивался по мере увеличения отношения NH 4 Cl и формиата натрия к субстрату. Когда концентрация NH 4 Cl в 4 раза превышала концентрацию субстрата, а концентрация формиата натрия в 3 раза превышала концентрацию субстрата, каталитическая активность цельноклеточного биокатализатора была наивысшей. Очевидно, что степень превращения не увеличивается с увеличением соотношения NH 4 Cl и формиата натрия.Следовательно, оптимальное соотношение NH 4 Cl к субстрату составляло 4,0, а оптимальное количество формиата натрия было в 3 раза больше концентрации субстрата.
Наконец, было изучено влияние концентрации НАДФ + на эффективность цельноклеточного биокатализатора. Как показано на фиг. 3d, 1-Phe был полностью преобразован в фенилпировиноградную кислоту (PPA) с конверсией, достигающей 100%; в то время как преобразование PPA в d-Phe варьировалось с изменением концентрации NADP + .Для отношения НАДФ + к субстрату ниже 0,2 концентрация НАДФ + оказывала небольшое влияние на эффективность цельноклеточного биокатализатора с конверсией более 80%, а 0,1-кратный НАДФ + давал высокую каталитическую эффективность. . Однако для отношения НАДФ + к субстрату более 0,2 увеличение концентрации НАДФ + снижает каталитическую эффективность цельноклеточного биокатализатора, и конверсия составляет только 74% при 0,4-кратном увеличении НАДФ + . добавлен в реакционную систему.Соответственно, оптимальная концентрация NADP + в 0,1 раза превышала концентрацию субстрата. В процессе реакции клеточная мембрана цельноклеточного катализатора может быть до определенной степени разрушена, что повысит проницаемость клеточной мембраны и использование экзогенного НАДФ + для регенерации кофактора в каскадной реакции [27, 32,33,34].
В каскадном каталитическом пути NH 4 Cl и формиат натрия важны как донор аммиака и вспомогательный субстрат [8].Формиат аммония может играть двойную роль как вспомогательный субстрат, так и донор NH 4 + для восстановительного аминирования. Поэтому формиат аммиака был добавлен в реакционную систему для замены NH 4 Cl и формиата натрия в молярном соотношении от 1: 1 до 5: 1 (поддерживая постоянную концентрацию субстрата на уровне 50 мМ). Как показано на фиг. 4, когда соотношение формиата аммония к субстрату составляло 1: 1, конверсия d-Phe составляла 45%. Активность цельноклеточного биокатализатора существенно улучшалась в присутствии избытка формиата аммония.Активность увеличивалась в два раза при молярном соотношении 2: 1, вероятно, потому, что избыток формиата ускорял реакцию, катализируемую BsFDH, и, таким образом, увеличивал эффективность регенерации кофактора. Кроме того, избыток NH 4 + может ускорить восстановительное аминирование PPA. Однако не было обнаружено дальнейшего увеличения активности биокатализатора, когда молярное соотношение было дополнительно увеличено выше 2: 1. Следовательно, оптимальное молярное отношение формиата аммония к субстрату для получения d-Phe составляло 2: 1, и это соотношение использовалось в дальнейших экспериментах.
Рис. 4Влияние концентрации формиата аммония на биокаталитическую активность целых клеток. Концентрация влажных клеток E. coli pET-21b-MBP -laad / pET-28a -dapdh-fdh составляла 75 мг / мл, концентрация NADP + составляла 5 мМ, а концентрация l-Phe составлял 50 мМ. Все реакции проводили в буфере Tris-HCl (50 мМ, pH 9,0) при 30 ° C и 220 об / мин в течение 6 часов. Значения были усреднены из трех измерений.
Асимметричный синтез d-Phe из l-Phe
На основании результатов однофакторных экспериментов по оптимизации, асимметричное восстановление l-Phe при концентрациях субстрата 50–150 мМ на E .coli pET-21b-MBP- laad / pET-28a- dapdh — fdh , и временные характеристики биоконверсии показаны на фиг. 5. Формиат аммиака в концентрации, в два раза превышающей концентрацию субстрата. добавлен в реакционную систему в качестве донора аммиака и вспомогательного субстрата. При концентрации l-Phe 50–100 мМ субстрат полностью превращался в течение 10 ч. На ранней стадии реакции наблюдалась определенная степень накопления промежуточного продукта PPA, но он быстро превращался в конечный продукт.Однако дальнейшее увеличение концентрации l-Phe до 150 мМ полностью трансформировало субстрат в d-Phe в течение 24 часов. Накопление промежуточного продукта, PPA, в процессе реакции почти не наблюдалось. Это можно объяснить высокой концентрацией субстрата, l-Phe, который может в определенной степени ингибировать каталитическую эффективность LAAD, тем самым уменьшая выход промежуточных продуктов с быстрым превращением DAPDH. При использовании NH 4 Cl и формиата натрия в качестве донора аммиака и со-субстрата, соответственно, E.coli pET-21b-MBP- laad / pET-28a- dapdh — fdh , катализируемый 100 и 150 мМ l-Phe, со степенью конверсии 82,3% и 59,5% через 48 часов соответственно (дополнительный файл 1 : Рис. S4A и B). Это согласуется с предыдущими результатами для каскадной системы in vitro с NH 4 Cl и формиатом натрия в качестве донора аммиака и со-субстрата [8]. Следовательно, добавление формиата аммиака может улучшить каталитическую эффективность цельноклеточного биокатализатора E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh .При использовании полученной in vivo фабрики каскадных клеток E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh , следовательно, 150 мМ l-Phe было стереоинвертировано в d-Phe с высокая эффективность преобразования и оптическая чистота (коэффициент преобразования, 100%; ee > 99%), что дает увеличение концентрации субстрата почти в 1,9 раза по сравнению с предыдущей каскадной системой in vitro. Следовательно, эта каскадная каталитическая система in vivo, построенная в данной работе, показала высокую каталитическую эффективность для стереоинверсии l-аминокислот при повышенной концентрации субстрата.Кроме того, концентрация формиата аммиака должна быть только вдвое выше концентрации субстрата, что улучшает каталитическую эффективность при одновременном снижении затрат, тем самым согласуясь с точкой зрения зеленой химии.
Рис. 5Динамика образования d-Phe для различных концентраций l-Phe, включая a 50 мМ, b 80 мМ, c 100 мМ и d 150 мМ. Концентрация влажных клеток E. coli pET-21b-MBP -laad / pET-28a -dapdh-fdh составляла 75 мг / мл, дозировка NADP + составляла 0.В 1 раз превышала концентрацию субстрата, а дозировка формиата аммония была в два раза больше концентрации субстрата. Все реакции проводили в буфере Tris-HCl (50 мМ, pH 9,0) при 30 ° C и 220 об / мин. Значения были усреднены из трех измерений.
Асимметричный синтез d-аминокислот из соответствующих аналогов
Применимость E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh Был проведен анализ цельноклеточного биокатализатора для асимметричного преобразования различных природных и неканонических l-аминокислот в соответствующие d-аминокислоты.Как показано в таблице 1, l-аминокислоты (30 мМ) в основном превращались в желаемые d-аминокислоты. Для субстратов с объемными группами, таких как 1-Phe, 1-гомофенилаланин, 2-хлор-1-фенилаланин, 3-хлор-1-фенилаланин и 4-хлор-1-фенилаланин, которые являются ароматическими аминокислотами, E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh цельноклеточный биокатализатор продуцировал соответствующие d-аминокислоты с высокой степенью конверсии (100%) и оптической чистотой (> 99%). ee ).Кроме того, цельноклеточный биокатализатор может эффективно преобразовывать алифатические аминокислоты, такие как l-лейцин, l-норвалин, l-глутаминовая кислота и l-метионин, в соответствующие d-аминокислоты с d-лейцином, d- глутаминовая кислота, d-метионин и d-норвалин, полученные при количественном превращении и> 99% ee . В частности, когда субстратами были l-глутаминовая кислота и l-метионин, степень превращения составляла 100%, а оптическая чистота составляла> 99% ee . Также можно было наблюдать, что каскадная каталитическая система in vivo катализирует ограниченную алифатическую 1-аминокислоту с высокой эффективностью преобразования, что может быть связано с несколько низкой активностью LAAD и DAPDH по отношению к определенным видам субстратов.Эти результаты согласуются с результатами для каскадной каталитической системы in vitro в нашем предыдущем исследовании [8]. Следовательно, цельноклеточный биокатализатор E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdh может катализировать множество природных и неканонических l-аминокислот с высокой концентрацией субстрата и высокая эффективность. Следовательно, мультиферментная каскадная система in vivo эффективна и применима для асимметричного синтеза d-аминокислот посредством стереоинверсии.
Таблица 1 Скорости стереоинверсии различных l-аминокислот с использованием E. coli pET-21b-MBP- laad / pET-28a- dapdh — fdhПереключение хиральности в аминокислотах | Исследования
Международная группа ученых разработала чисто химический подход к взаимному преобразованию L- и D-аминокислот. Этот метод может конкурировать с ферментативными методами, используемыми в промышленности, и позволить более дешевое производство некоторых фармацевтических препаратов.В то время как L-аминокислоты являются недорогим и возобновляемым источником хиральных молекул, используемых всеми клетками для синтеза белков, D-аминокислоты в природе редки и, следовательно, более дороги.Несмотря на их редкость в биологических системах, D-аминокислоты широко используются в фармацевтической промышленности, присутствуя во многих лекарствах, включая антибиотики, такие как пенициллин, и противораковые агенты, такие как гозерелин.
В настоящее время D-аминокислоты получают промышленным способом путем ферментативного разделения рацемических смесей аминокислот. Легкодоступный источник D-аминокислот устранит необходимость в разделении, упростив пути синтеза для многих фармацевтических препаратов.
Вадим Солошонок, профессор икербаскских исследований Университета Страны Басков, Испания, и его коллеги использовали недорогой ацетат никеля (II) и хиральный лиганд модульной конструкции, полученный из а- (фенил) этиламина, для преобразования природных аминокислот в их неестественные энантиомеры.Аминокислотный комплекс основания Шиффа Ni (II) с тремя стереогенными центрами, включая стереогенный азот, был образован в мягких и простых в эксплуатации условиях реакции. Комплекс позволяет стереоконтролируемому депротонированию α-углерода аминокислот, чтобы инвертировать их стереохимию.
Солошонок говорит, что эта методология может иметь потенциально огромное влияние на многомиллиардный рынок аминокислот. «D-аминокислоты являются исходным материалом для синтеза фармацевтических препаратов, и если мы сможем снизить цену на исходные материалы, мы сможем сделать фармацевтические препараты более доступными для людей.

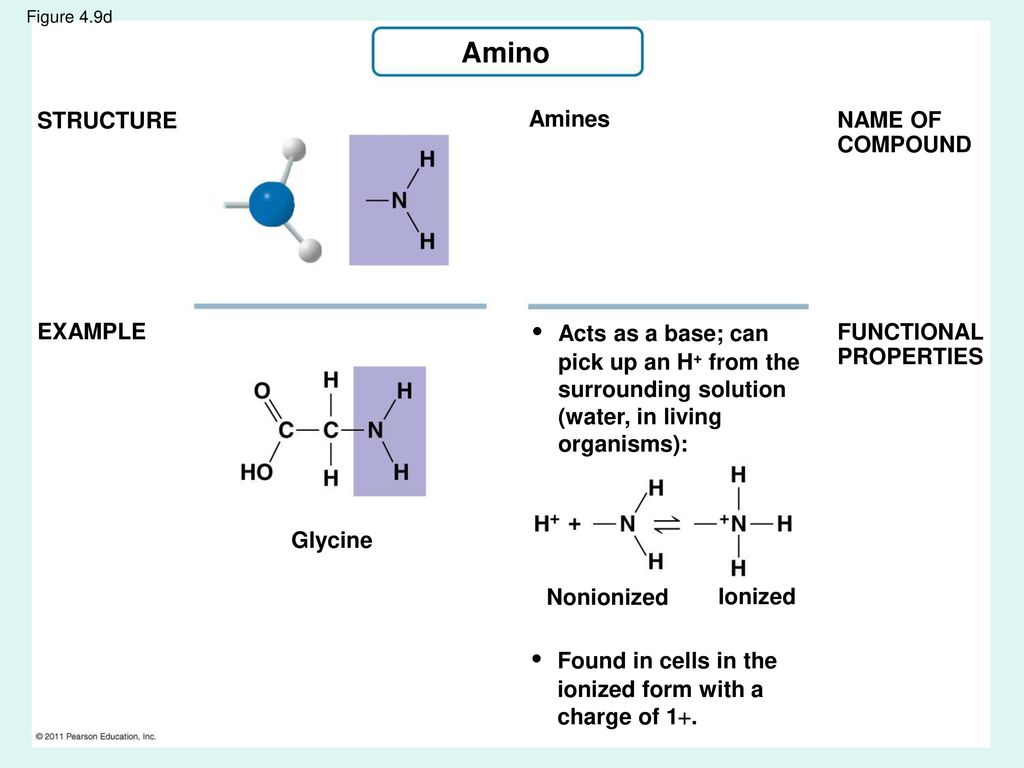
 М.: «Наука», 1991;
М.: «Наука», 1991; W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol
W. Ezzell, S. L. Welkos. (1999). The capsule of Bacillus anthracis, a review. J Appl Microbiol