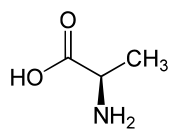
D-аминокислота
Cтраница 1
Некоторые D-аминокислоты при включении их в рацион взамен соответствующих L-изомеров могут поддерживать рост животных и размножение микроорганизмов. В большинстве случаев эти D-изомеры, очевидно, превращаются в L-аминокислоты путем окислительного дезаминирования с образованием а-кето-кислот и последующего реаминирования в результате переами-нирования. Следует подчеркнуть, что такой механизм инверсии D-аминокислот в организме нельзя считать полностью доказанным; однако эти представления находятся в согласии с данными, свидетельствующими о возможности обеспечения роста животных и микроорганизмов при помощи а-кетоаналогов некоторых аминокислот, а также с существованием и широким распространением оксидазы D-аминокислот и различных транс-аминаз. Наблюдения над ростом молодых крыс показали, что вместо D-аминокислот, которые заменяют соответствующие L-аминокислоты, можно вводить в организм и соответствующие а-кетопроизводные. Вместе с тем в некоторых случаях а-кето-кислоты ( например, а-кетоаналоги лейцина и изолейцина) обеспечивают рост молодых животных, тогда как соответствующие им D-аминокислоты не используются растущим организмом; эти данные позволяют предполагать, что скорость окислительного дезаминирования D-аминокислот не всегда достаточно высока, чтобы обеспечить рост животных. [1]
L-и D-аминокислоты различаются, кроме того, по вкусу: первые-горькие, вторые-сладкие. [2]
Определяли следующие D-аминокислоты: D-фенилаланин, — аланин, — валин, — метионин, — лейцин и изолейцин, которые могут вступать в реакции типа ( XI. [3]
Оксидаза D-аминокислот в организме млекопитающих находится только в тканях печени и почек, причем активность ее в почках значительно выше, чем в печени. Фермент окисляет множество различных D-аминокислот и не проявляет поддающейся обнаружению активности по отношению к L-аминокисло-там. В связи с этим следует напомнить, что его используют для обнаружения ничтожных количеств D-аминокислот в присутствии высоких концентраций соответствующих L-изомеров ( стр. [4]
Оксидазы D-аминокислот найдены у ряда плесеней и бактерий; субстратами этих ферментов могут служить встречающиеся в некоторых микроорганизмах D-аминокислоты. [5]
Остатки D-аминокислот обнаружены в немногих простых пептидах, содержащихся в живых организмах. [7]
Оксидаза D-аминокислот с простетической группой ФАД [369] окисляет в соответствующие иминокислоты DL-лейцин, D — и DL-метионин, D — и DL-аланин, DL-a — аминомасляную кислоту. Оксидаза L-аминокислот, содержащая ФАД, дезаминирует L-аргинин в a — кето-б — гуанидовалериановую кислоту, L-орнитин в a — кето-б-аминовалериановую кислоту, L-лизин в г-кето-е-аминокапроновую кислоту. [8]
Остатки D-аминокислот входят в состав многих природных пепти дов, прежде всего антибиотиков В частности, в грамицидин S входит D-фенилаланин, в грамицидин А — D-валин, D-лейцин, D трипто фан, в актиномнцин D D изолейцин, в полимнксин D-серин D-Пролин встречается в эргоалкалоидах. [9]
Остатки D-аминокислот обнаружены в немногих простых пептидах, содержащихся в живых организмах. [11]
Распространение D-аминокислот пока еще представляется несколько ограниченным. [12]
главное отличие между L и D аминокислотами является то, что аминогруппа L-аминокислот встречается в левой части, когда она изображена в проекции Фишера, сохраняя группу карбоновой кислоты сверху и уг
главное отличие между L и D аминокислотами является то, что аминогруппа L-аминокислот встречается в левой части, когда она изображена в проекции Фишера, сохраняя группу карбоновой кислоты сверху и углеродную цепь внизу, тогда как аминогруппа D-аминокислот встречается в право.
L- и D-аминокислоты являются двумя изомерными формами аминокислот, которые встречаются в природе. L-аминокислоты — это форма, используемая клетками для синтеза белков.
Ключевые области покрыты
1. Что такое L-аминокислота
— Определение, стереоструктура, значение
2. Что такое аминокислота
— Определение, стереоструктура, значение
3. Каковы сходства между L и D аминокислотами
— Краткое описание общих черт
4. В чем разница между L и D аминокислотами
— Сравнение основных различий
Основные условия
Аминокислоты, D аминокислоты, энантиомеры, проекция Фишера, L аминокислоты, белки
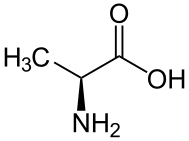
Что такое L-аминокислота
L-аминокислоты являются формой стереоизомеров, используемых клетками для производства белков. Они встречаются во всех белках, вырабатываемых животными, растениями, грибами и бактериями. Эти белки играют как структурную, так и функциональную роль внутри клетки. Они служат ферментами, которые катализируют биохимические реакции, а также гормонами, которые регулируют биологические процессы в высших организмах. Кроме того, они являются формой аминокислот, которые вырабатываются молниеносными реакциями.
Рисунок 1: Аминокислоты L и D
В проекции Фишера аминогруппа этих аминокислот встречается на левой стороне.
Что такое D-аминокислота
D-аминокислоты являются другой формой стереоизомеров, которые встречаются в природе. Аминогруппа этих аминокислот встречается в правой части проекции Фишера.
Рисунок 2: Общая структура аминокислоты
Как правило, клетки не включают D-аминокислоты в белки. Но некоторые белки продуцируются ферментативными посттрансляционными модификациями у конусных улиток. С другой стороны, некоторые D-аминокислоты также встречаются в клеточных стенках пептидогликана бактерий. Кроме того, D-серин служит нейромедиатором в мозге.
Сходства между L и D аминокислотами
- L- и D-аминокислоты являются двумя возможными ориентациями конкретной аминокислоты в природе.
- Они являются зеркальным отражением друг друга.
- Также их можно рассматривать как изомерные формы, стереоизомеры или энантиомеры.
- Однако самая простая аминокислота, глицин, не имеет стереоизомеров.
- Оба содержат группу карбоновой кислоты, аминогруппу, углеродную цепь и атом водорода, связанный с центральным атомом углерода аминокислоты.
- Кроме того, этот центральный атом углерода называется альфа-углеродом или хиральным углеродом.
Разница между L и D аминокислотами
Определение
L-аминокислота относится к стереоизомеру конкретной аминокислоты, аминогруппа которого находится на левой стороне в ее проекции Фишера, в то время как D-аминокислота относится к другому стереоизомеру аминокислоты, аминогруппа которого находится на правой стороне в ее Fisher. проекция. Это объясняет основное различие между L и D аминокислотами.
Вращение плоскополяризованного света
Кроме того, в то время как L-аминокислоты могут вращать плоскополяризованный свет против часовой стрелки в процессе, называемом левовращением, D-аминокислоты могут вращать плоскополяризованный свет по часовой стрелке в процессе, называемом правовращением.
Обозначение R / S
Другое различие между L и D аминокислотами состоит в том, что L-аминокислоты были заменены R-нотацией, в то время как D-аминокислоты были заменены S-нотацией.
значение
Кроме того, L-аминокислоты используются клеткой для производства белков, в то время как D-аминокислоты встречаются в клеточной стенке бактерий.
Заключение
L-аминокислоты представляют собой форму стереоизомеров, у которых аминная группа находится в левой части проекции Фишера. С другой стороны, D-аминокислоты являются другой формой стереоизомеров, у которых аминная группа находится на правой стороне проекции Фишера. L-аминокислоты являются формой стереоизомера, который в изобилии содержится в белках. В этом разница между L и D аминокислотами.
Ссылка:
1. Кожо, Сёсуке. «L-аминокислоты, ключевые для эволюции жизни, произошли из внеземного пространства?» Атлас науки,
Список аминокислот и их свойства
Оглавление
- Аланин
- Аргинин
- Аспарагин
- Карнитин
- Цитруллин
- Цистеин и цистин
- Диметилглицин
- Гамма-аминомасляная кислота
- Глютаминовая кислота
- Глютамин
- Глютатион
- Глицин
- Гистидин
- Изолейцин
- Лейцин
- Лизин
- Метионин
- Орнитин
- Фенилаланин
- Пролин
- Серин
- Таурин
- Треонин
- Триптофан
- Тирозин
- Валин
Аминокислоты представляют собой структурные химические единицы или «строительные кирпичики», образующие белки. Аминокислоты на 16% состоят из азота, это является их основным химическим отличием от двух других важнейших элементов питания – углеводов и жиров. Важность аминокислот для организма определяется той огромной ролью, которую играют белки во всех процессах жизнедеятельности.
 Любой живой организм от самых крупных животных до крошечных микробов состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти. Белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит этих элементов питания в организме может привести к нарушению водного баланса, что вызывает отеки.
Любой живой организм от самых крупных животных до крошечных микробов состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти. Белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит этих элементов питания в организме может привести к нарушению водного баланса, что вызывает отеки.
Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания. Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них выполняют роль нейромедиаторов (нейротрансмиттеров) или являются их предшественниками.
Нейромедиаторы – это химические вещества, передающие нервный импульс от одной нервной клетки другой. Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга. Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции. Некоторые аминокислоты непосредственно снабжают энергией мышечную ткань.
В организме человека многие аминокислоты синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. К таким незаменимым аминокислотам относятся – гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аминокислоты, которые синтезируются в печен: аланин, аргинин, аспарагин, аспарагиновая кислота, цитруллин, цистеин, гамма-аминомасляную кислоту, глютамин и глютаминовая кислота, глицин, орнитин, пролин, серин, таурин, тирозин.
Процесс синтеза белков идет в организме постоянно. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам – от нарушения пищеварения до депрессии и замедления роста.
Как возникает такая ситуация? Легче, чем это можно себе представить. Многие факторы приводят к этому, даже, если ваше питание сбалансировано и вы потребляете достаточное количество белка. Нарушение всасывания в желудочно-кишечном тракте, инфекция, травма, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме – все это может привести к дефициту незаменимых аминокислот.
Следует иметь в виду, что все вышесказанное вовсе не означает, что потребление большого количества белков поможет решить любые проблемы. В действительности, это не способствует сохранению здоровья.
Избыток белков создает дополнительный стресс для почек и печени, которым надо перерабатывать продукты метаболизма белков, основным из них является аммиак. Он очень токсичен для организма, поэтому печень немедленно перерабатывает его в мочевину, которая затем поступает с током крови в почки, где отфильтровывается и выводится наружу.
До тех пор, пока количество белка не слишком велико, а печень работает хорошо, аммиак нейтрализуется сразу же и не причиняет никакого вреда. Но если его слишком много и печень не справляется с его обезвреживанием (в результате неправильного питания, нарушения пищеварения и/или заболеваний печени) – в крови создается токсический уровень аммиака. При этом может возникнуть масса серьезных проблем со здоровьем, вплоть до печеночной энцефалопатии и комы.
Слишком высокая концентрация мочевины также вызывает повреждение почек и боли в спине. Следовательно, важным является не количество, а качество потребляемых с пищей белков. В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок.
Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
 Имеются разные виды добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей. Есть в продаже формулы, содержащие комплексы аминокислот или содержащие одну или две аминокислоты. Они представлены в различных формах: в капсулах, таблетках, жидкостях и порошках.
Имеются разные виды добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей. Есть в продаже формулы, содержащие комплексы аминокислот или содержащие одну или две аминокислоты. Они представлены в различных формах: в капсулах, таблетках, жидкостях и порошках.
Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин.
D означает dextra (правая на латыни), а L – levo (соответственно, левая). Эти термины обозначают направление вращения спирали, являющейся химической структурой данной молекулы. Белки животных и растительных организмов созданы в основном L-формами аминокислот (за исключением фенилаланина, который представлен D, L формами).
Пищевые добавки, содержащие L-аминокислоты, считаются более подходящими для биохимических процессов человеческого организма.
Свободные, или несвязанные, аминокислоты представляют собой наиболее чистую форму. Поэтому при выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты, стандартизированные по Американской Фармакопее (USP). Они не нуждаются в переваривании и абсорбируются непосредственно в кровоток. После приема внутрь всасываются очень быстро и, как правило, не вызывают аллергических реакций.
Отдельные аминокислоты принимают натощак, лучше всего утром или между приемами пищи с небольшим количеством витаминов В6 и С. Если вы принимаете комплекс аминокислот, включающий все незаменимые, это лучше делать через 30 минут после или за 30 минут до еды. Лучше всего принимать и отдельные нужные аминокислоты, и комплекс аминокислот, но в разное время. Отдельно аминокислоты не следует принимать в течение длительного времени, особенно в высоких дозах. Рекомендуют прием в течение 2 месяцев с 2-месячным перерывом.
Аланин
Аланин способствует нормализации метаболизма глюкозы. Установлена взаимосвязь между избытком аланина и инфицированием вирусом Эпштейна-Барра, а также синдромом хронической усталости. Одна из форм аланина – бета-аланин является составной частью пантотеновой кислоты и коэнзима А – одного из самых важных катализаторов в организме.
Аргинин
Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты. В связи с этим аргинин полезен людям, страдающим ВИЧ-инфекцией и злокачественными новообразованиями.
Его также применяют при заболеваниях печени (циррозе и жировой дистрофии), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака). Семенная жидкость содержит аргинин, поэтому его иногда применяют в комплексной терапии бесплодия у мужчин. В соединительной ткани и в коже также находится большое количество аргинина, поэтому его прием эффективен при различных травмах. Аргинин – важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аргинин помогает снизить вес, так как вызывает некоторое уменьшение запасов жира в организме.
 Аргинин входит в состав многих энзимов и гормонов. Он оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста. Хотя аргинин синтезируется в организме, его образование может быть снижено у новорожденных. Источниками аргинина являются шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Аргинин входит в состав многих энзимов и гормонов. Он оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста. Хотя аргинин синтезируется в организме, его образование может быть снижено у новорожденных. Источниками аргинина являются шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Люди, имеющие вирусные инфекции, в том числе Herpes simplex, не должны принимать аргинин в виде пищевых добавок и должны избегать потребления продуктов, богатых аргинином. Беременным и кормящим грудью матерям не следует употреблять пищевые добавки с аргинином. Прием небольших доз аргинина рекомендуется при заболеваниях суставов и соединительной ткани, при нарушениях толерантности к глюкозе, заболеваниях печени и травмах. Длительный прием не рекомендован.
Аспарагин
Аспарагин необходим для поддержания баланса в процессах, происходящих в центральной нервной системе: препятствует как чрезмерному возбуждению, так и излишнему торможению. Он участвует в процессах синтеза аминокислот в печени.
Так как эта аминокислота повышает жизненную силу, добавку на ее основе применяют при усталости. Она играет также важную роль в процессах метаболизма. Аспартовую кислоту часто назначают при заболеваниях нервной системы. Она полезна спортсменам, а также при нарушениях функции печени. Кроме того, он стимулирует иммунитет за счет повышения продукции иммуноглобулинов и антител.
Аспартовая кислота в больших количествах содержится в белках растительного происхождения, полученных из пророщенных семян и в мясных продуктах.
Карнитин
Строго говоря, карнитин не является аминокислотой, но его химическая структура сходна со структурой аминокислот, и поэтому их обычно рассматривают вместе. Карнитин не участвует в синтезе белков и не является нейромедиатором. Его основная функция в организме – это транспорт длинноцепочечных жирных кислот, в процессе окисления которых выделяется энергия. Это один из основных источников энергии для мышечной ткани. Таким образом, карнитин увеличивает переработку жира в энергию и предотвращает отложение жира в организме, прежде всего в сердце, печени, скелетной мускулатуре.
Карнитин снижает вероятность развития осложнений сахарного диабета, связанных с нарушениями жирового обмена, замедляет жировое перерождение печени при хроническом алкоголизме и риск возникновения заболеваний сердца. Он обладает способностью снижать уровень триглицеридов в крови, способствует снижению массы тела и повышает силу мышц у больных с нервно-мышечными заболеваниями и усиливает антиоксидантное действие витаминов С и Е.
Считается, что некоторые варианты мышечных дистрофий связаны с дефицитом карнитина. При таких заболеваниях люди должны получать большее количество этого вещества, чем это положено по нормам.
Он может синтезироваться в организме при наличии железа, тиамина, пиридоксина и аминокислот лизина и метионина. Синтез карнитина осуществляется в присутствии также достаточного количества витамина С. Недостаточное количество любого из этих питательных веществ в организме приводит к дефициту карнитина. Карнитин поступает в организм с пищей, прежде всего с мясом и другими продуктами животного происхождения.
 Большинство случаев дефицита карнитина связано с генетически обусловленным дефектом в процессе его синтеза. К возможным проявлениям недостаточности карнитина относятся нарушения сознания, боли в сердце, слабость в мышцах, ожирение.
Большинство случаев дефицита карнитина связано с генетически обусловленным дефектом в процессе его синтеза. К возможным проявлениям недостаточности карнитина относятся нарушения сознания, боли в сердце, слабость в мышцах, ожирение.
Мужчинам вследствие большей мышечной массы требуется большее количество карнитина, чем женщинам. У вегетарианцев более вероятно возникновение дефицита этого питательного вещества, чем у невегетарианцев, в связи с тем, что карнитин не встречается в белках растительного происхождения.
Более того, метионин и лизин (аминокислоты, необходимые для синтеза карнитина) также не содержатся в растительных продуктах в достаточных количествах.
Для получения необходимого количества карнитина вегетарианцы должны принимать пищевые добавки или есть обогащенные лизином продукты, такие как кукурузные хлопья.
Карнитин представлен в биологически активных пищевых добавках в различных формах: в виде D, L-карнитина, D-карнитина, L-карнитина, ацетил-L-карнитина.
Предпочтительнее принимать L-карнитин.
Цитруллин
Цитруллин преимущественно находится в печени. Он повышает энергообеспечение, стимулирует иммунную систему, в процессе обмена веществ превращается в L-аргинин. Он обезвреживает аммиак, повреждающий клетки печени.
Цистеин и цистин
Эти две аминокислоты тесно связаны между собой, каждая молекула цистина состоит из двух молекул цистеина, соединенных друг с другом. Цистеин очень нестабилен и легко переходит в L-цистин, и, таким образом, одна аминокислота легко переходит в другую при необходимости.
Обе аминокислоты относятся к серосодержащим и играют важную роль в процессах формирования тканей кожи, имеют значение для дезинтоксикационных процессов. Цистеин входит в состав альфа-кератина – основного белка ногтей, кожи и волос. Он способствует формированию коллагена и улучшает эластичность и текстуру кожи. Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов.
Цистеин помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации. Он представляет собой один из самых мощных антиоксидантов, при этом его антиоксидантное действие усиливается при одновременном приеме с витамином С и селеном.
Цистеин является предшественником глютатиона – вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме. Цистеин растворяется лучше, чем цистин, и быстрее утилизируется в организме, поэтому его чаще используют в комплексном лечении различных заболеваний. Это аминокислота образуется в организме из L-метионина, при обязательном присутствии витамина В6.
Дополнительный прием цистеина необходим при ревматоидном артрите, заболеваниях артерий, раке. Он ускоряет выздоровление после операций, ожогов, связывает тяжелые металлы и растворимое железо. Эта аминокислота также ускоряет сжигание жиров и образование мышечной ткани.
L-цистеин обладает способностью разрушать слизь в дыхательных путях, благодаря этому его часто применяют при бронхитах и эмфиземе легких. Он ускоряет процессы выздоровления при заболеваниях органов дыхания и играет важную роль в активизации лейкоцитов и лимфоцитов.
Так как это вещество увеличивает количество глютатиона в легких, почках, печени и красном костном мозге, оно замедляет процессы старения, например, уменьшая количество старческих пигментных пятен. N-ацетилцистеин более эффективно повышает уровень глютатиона в организме, чем цистин или даже сам глютатион.
Люди с сахарным диабетом должны быть осторожны при приеме добавок с цистеином, так как он обладает способностью инактивировать инсулин. При цистинурии, редком генетическом состоянии, приводящем к образованию цистиновых камней, принимать цистеин нельзя.
Диметилглицин
Диметилглицин – это производная глицина – самой простой аминокислоты. Он является составным элементом многих важных веществ, таких как аминокислоты метионин и холин, некоторых гормонов, нейромедиаторов и ДНК.
 В небольших количествах диметилглицин встречается в мясных продуктах, семенах и зернах. Хотя с дефицитом диметилглицина не связано никаких симптомов, прием пищевых добавок с диметилглицином оказывает целый ряд положительных эффектов, включая улучшение энергообеспечения и умственной деятельности.
В небольших количествах диметилглицин встречается в мясных продуктах, семенах и зернах. Хотя с дефицитом диметилглицина не связано никаких симптомов, прием пищевых добавок с диметилглицином оказывает целый ряд положительных эффектов, включая улучшение энергообеспечения и умственной деятельности.
Диметилглицин также стимулирует иммунитет, уменьшает содержание холестерина и триглицеридов в крови, помогает нормализации артериального давления и уровня глюкозы, а также способствует нормализации функции многих органов. Его также применяют при эпилептических припадках.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота (GABA) выполняет в организме функцию нейромедиатора центральной нервной системы и незаменима для обмена веществ в головном мозге. Образуется она из другой аминокислоты – глютаминовой. Она уменьшает активность нейронов и предотвращает перевозбуждение нервных клеток.
Гамма-аминомасляная кислота снимает возбуждение и оказывает успокаивающее действие, ее можно принимать также как транквилизаторы, но без риска развития привыкания. Эту аминокислоту используют в комплексном лечении эпилепсии и артериальной гипертензии. Так как она оказывает релаксирующее действие, ее применяют при лечении нарушений половых функций. Кроме того, GABA назначают при синдроме дефицита внимания. Избыток гамма-аминомасляной кислоты, однако, может увеличить беспокойство, вызывает одышку, дрожание конечностей.
Глютаминовая кислота
Глютаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер.
Эта аминокислота может использоваться клетками головного мозга в качестве источника энергии. Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты – глютамина. Этот процесс – единственный способ обезвреживания аммиака в головном мозге.
Глютаминовую кислоту применяют при коррекции расстройств поведения у детей, а также при лечении эпилепсии, мышечной дистрофии, язв, гипогликемических состояний, осложнений инсулинотерапии сахарного диабета и нарушений умственного развития.
Глютамин
Глютамин – это аминокислота, наиболее часто встречающаяся в мышцах в свободном виде. Он очень легко проникает через гематоэнцефалический барьер и в клетках головного мозга переходит в глютаминовую кислоту и обратно, кроме того увеличивает количество гамма-аминомасляной кислоты, которая необходима для поддержания нормальной работы головного мозга.
Эта аминокислота также поддерживает нормальное кислотно-щелочное равновесие в организме и здоровое состояние желудочно-кишечного тракта, необходим для синтеза ДНК и РНК.
Глютамин – активный участник азотного обмена. Его молекула содержит два атома азота и образуется из глютаминовой кислоты путем присоединения одного атома азота. Таким образом, синтез глютамина помогает удалить избыток аммиака из тканей, прежде всего из головного мозга и переносить азот внутри организма.
Глютамин находится в больших количествах в мышцах и используется для синтеза белков клеток скелетной мускулатуры. Поэтому пищевые добавки с глютамином применяются культуристами и при различных диетах, а также для профилактики потери мышечной массы при таких заболеваниях, как злокачественные новообразования и СПИД, после операций и при длительном постельном режиме.
Дополнительно глютамин применяют также при лечении артритов, аутоиммунных заболеваниях, фиброзах, заболеваниях желудочно-кишечного тракта, пептических язвах, заболеваниях соединительной ткани.
 Эта аминокислота улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении и сенильной деменции. L-глютамин уменьшает патологическую тягу к алкоголю, поэтому применяется при лечении хронического алкоголизма.
Эта аминокислота улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении и сенильной деменции. L-глютамин уменьшает патологическую тягу к алкоголю, поэтому применяется при лечении хронического алкоголизма.
Глютамин содержится во многих продуктах как растительного, так и животного происхождения, но он легко уничтожается при нагревании. Шпинат и петрушка являются хорошими источниками глютамина, но при условии, что их потребляют в сыром виде.
Пищевые добавки, содержащие глютамин, следует хранить только в сухом месте, иначе глютамин переходит в аммиак и пироглютаминовую кислоту. Не принимают глютамин при циррозе печени, заболеваниях почек, синдроме Рейе.
Глютатион
Глютатион, так же как и карнитин, не является аминокислотой. По химической структуре это трипептид, получаемый в организме из цистеина, глютаминовой кислоты и глицина.
Глютатион является антиоксидантом. Больше всего глютатиона находится в печени (некоторое его количество высвобождается прямо в кровоток), а также в легких и желудочно-кишечном тракте.
Он необходим для углеводного обмена, а также замедляет старение за счет влияния на липидный обмен и предотвращает возникновения атеросклероза. Дефицит глютатиона сказывается прежде всего на нервной системе, вызывая нарушения координации, мыслительных процессов, тремор.
Количество глютатиона в организме уменьшается с возрастом. В связи с этим пожилые люди должны получать его дополнительно. Однако предпочтительнее употреблять пищевые добавки, содержащие цистеин, глютаминовую кислоту и глицин – то есть вещества, синтезирующие глютатион. Наиболее эффективным считается прием N-ацетилцистеина.
Глицин
Глицин замедляет дегенерацию мышечной ткани, так как является источником креатина – вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК. Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме.
Он входит в состав многих антацидных препаратов, применяемых при заболеваниях желудка, полезен для восстановления поврежденных тканей, так как в больших количествах содержится в коже и соединительной ткани.
Эта аминокислота необходима для нормального функицонирования центральной нервной системы и поддержки хорошего состояния предстательной железы. Он выполняет функцию тормозного нейромедиатора и, таким образом, может предотвратить эпилептические судороги.
Глицин применяют в лечении маниакально-депрессивного психоза, он также может быть эффективен при гиперактивности. Избыток глицина в организме вызывает чувство усталости, но адекватное количество обеспечивает организм энергией. При необходимости глицин в организме может превращаться в серин.
Гистидин
Гистидин – это незаменимая аминокислота, способствующая росту и восстановлению тканей, которая входит в состав миелиновых оболочек, защищающих нервные клетки, а также необходима для образования красных и белых клеток крови. Гистидин защищает организм от повреждающего действия радиации, способствует выведению тяжелых металлов из организма и помогает при СПИДе.
Слишком высокое содержание гистидина может привести к возникновению стресса и даже психических нарушений (возбуждения и психозов).
Неадекватное содержание гистидина в организме ухудшает состояние при ревматоидном артрите и при глухоте, связанной с поражением слухового нерва. Метионин способствует понижению уровня гистидина в организме.
 Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Он также способствует возникновению полового возбуждения. В связи с этим одновременный прием биологически активных пищевых добавок, содержащих гистидин, ниацин и пиридоксин (необходимых для синтеза гистамина), может оказаться эффективным при половых расстройствах.
Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Он также способствует возникновению полового возбуждения. В связи с этим одновременный прием биологически активных пищевых добавок, содержащих гистидин, ниацин и пиридоксин (необходимых для синтеза гистамина), может оказаться эффективным при половых расстройствах.
Так как гистамин стимулирует секрецию желудочного сока, применение гистидина помогает при нарушениях пищеварения, связанных с пониженной кислотностью желудочного сока.
Люди, страдающие маниакально-депрессивным психозом, не должны принимать гистидин, за исключением случаев, когда дефицит этой аминокислоты точно установлен. Гистидин находится в рисе, пшенице и ржи.
Изолейцин
Изолейцин – одна из аминокислот BCAA и незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.Метаболизм изолейцина происходит в мышечной ткани.
Совместный прием с изолейцином и валином (BCAA) увеличиваtт выносливость и способствуют восстановлению мышечной ткани, что особенно важно для спортсменов.
 Изолейцин необходим при многих психических заболеваниях. Дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Изолейцин необходим при многих психических заболеваниях. Дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
К пищевым источниками изолейцина относятся миндаль, кешью, куриное мясо, турецкий горох, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соевые белки.
Имеются биологически активные пищевые добавки, содержащие изолейцин. При этом необходимо соблюдать правильный баланс между изолейцином и двумя другими разветвленными аминокислотами BCAA – лейцином и валином.
Лейцин
Лейцин – незаменимая аминокислота, вместе с изолейцином и валином относящаяся к трем разветвленным аминокислотам BCAA. Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций.
Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. К пищевым источникам лейцина относятся бурый рис, бобы, мясо, орехи, соевая и пшеничная мука.
Биологически активные пищевые добавки, содержащие лейцин, применяются в комплексе с валином и изолейцином. Их следует принимать с осторожностью, чтобы не вызвать гипогликемии. Избыток лейцина может увеличить количество аммиака в организме.
Лизин
Лизин – незаменимая аминокислота, входящая в состав практически любых белков. Он необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых.
Эта аминокислота участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Лизин применяют в восстановительный период после операций и спортивных травм. Он также понижает уровень триглицеридов в сыворотке крови.
Лизин оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции. Прием добавок, содержащих лизин в комбинации с витамином С и биофлавоноидами, рекомендуется при вирусных заболеваниях.
Дефицит этой незаменимой аминокислоты может привести к анемии, кровоизлияниям в глазное яболко, ферментным нарушениям, раздражительности, усталости и слабости, плохому аппетиту, замедлению роста и снижению массы тела, а также к нарушениям репродуктивной системы.
Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Метионин
 Метионин – незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и на стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает дезинтоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Метионин – незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и на стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает дезинтоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Эту аминокислоту применяют в комплексной терапии ревматоидного артрита и токсикоза беременности. Метионин оказывает выраженное антиоксидантное действие, так как является хорошим источником серы, инактивирующей свободные радикалы. Его применяют при синдроме Жильбера, нарушениях функции печени. Метионин также необходим для синтеза нуклеиновых кислот, коллагена и многих других белков. Его полезно принимать женщинам, получающим оральные гормональные контрацептивы. Метионин понижает уровень гистамина в организме, что может быть полезно при шизофрении, когда количество гистамина повышено.
Метионин в организме переходит в цистеин, который является предшественником глютатиона. Это очень важно при отравлениях, когда требуется большое количество глютатиона для обезвреживания токсинов и защиты печени.
Пищевые источники метионина: бобовые, яйца, чеснок, чечевица, мясо, лук, соевые бобы, семена и йогурт.
Орнитин
Орнитин помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином. Орнитин также необходим для иммунной системы и работы печени, участвуя в дезинтоксикационных процессах и восстановлении печеночных клеток.
Орнитин в организме синтезируется из аргинина и, в свою очередь, служит предшественником для цитруллина, пролина, глютаминовой кислоты. Высокие концентрации орнитина обнаруживаются в коже и соединительной ткани, поэтому эта аминокислота способствует восстановлению поврежденных тканей.
Нельзя давать биологически активные пищевые добавки, содержащие орнитин, детям, беременным и кормящим матерям, а также лицам с шизофренией в анамнезе.
Фенилаланин
Фенилаланин – это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту – тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Его используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона и шизофрении.
Фенилаланин встречается в трех формах: L-фенилаланин (естественная форма и именно она входит в состав большинства белков человеческого тела), D-фенилаланин (синтетическая зеркальная форма, обладает анальгирующим действием), DL-фенилаланин (объединяет полезные свойства двух предыдущих форм, ее обычно применяют при предменструальном синдроме.
Биологически активные пищевые добавки, содержащие фенилаланин, не дают беременным женщинам, лицам с приступами беспокойства, диабетом, высоким артериальным давлением, фенилкетонурией, пигментной меланомой.
Пролин
Пролин улучшает состояние кожи, за счет увеличения продукции коллагена и уменьшения его потери с возрастом. Помогает в восстановлении хрящевых поверхностей суставов, укрепляет связки и сердечную мышцу. Для укрепления соединительной ткани пролин лучше применять в комбинации с витамином С.
Пролин поступает в организм преимущественно из мясных продуктов.
Серин
Серин необходим для нормального обмена жиров и жирных кислот, роста мышечной ткани и поддержания нормального состояния иммунной системы.
Серин синтезируется в организме из глицина. В качестве увлажняющего вещества входит в состав многих косметических продуктов и дерматологических препаратов.
Таурин
Таурин в высокой концентрации содержится в сердечной мышце, белых клетках крови, скелетной мускулатуре, центральной нервной системе. Он участвует в синтезе многих других аминокислот, а также входит в состав основного компонента желчи, которая необходима для переваривания жиров, абсорбции жирорастворимых витаминов и для поддержания нормального уровня холестерина в крови.
Поэтому таурин полезен при атеросклерозе, отеках, заболеваниях сердца, артериальной гипертонии и гипогликемии. Таурин необходим для нормального обмена натрия, калия, кальция и магния. Он предотвращает выведение калия из сердечной мышцы и потому способствует профилактике некоторых нарушений сердечного ритма. Таурин оказывает защитное действие на головной мозг, особенно при дегидратации. Его применяют при лечении беспокойства и возбуждения, эпилепсии, гиперактивности, судорог.
Биологически активные пищевые добавки с таурином дают детям с синдромом Дауна и мышечной дистрофией. В некоторых клиниках эту аминокислоту включают в комплексную терапию рака молочной железы. Избыточное выведение таурина из организма встречается при различных состояниях и нарушениях обмена.
 Аритмии, нарушения процессов образования тромбоцитов, кандидозы, физический или эмоциональный стресс, заболевания кишечника, дефицит цинка и злоупотребление алкоголем приводят к дефициту таурина в организме. Злоупотребление алкоголем к тому же нарушает способность организма усваивать таурин.
Аритмии, нарушения процессов образования тромбоцитов, кандидозы, физический или эмоциональный стресс, заболевания кишечника, дефицит цинка и злоупотребление алкоголем приводят к дефициту таурина в организме. Злоупотребление алкоголем к тому же нарушает способность организма усваивать таурин.
При диабете увеличивается потребность организма в таурине, и наоборот, прием БАД, содержащих таурин и цистин, уменьшает потребность в инсулине. Таурин находится в яйцах, рыбе, мясе, молоке, но не встречается в белках растительного происхождения.
Он синтезируется в печени из цистеина и из метионина в других органах и тканях организма, при условии достаточного количества витамина В6. При генетических или метаболических нарушениях, мешающих синтезу таурина, необходим прием БАД с этой аминокислотой.
Треонин
Треонин – это незаменимая аминокислота, способствующая поддержанию нормального белкового обмена в организме. Она важна для синтеза коллагена и эластина, помогает работе печени и участвует в обмене жиров в комбинации с аспартовой кислотой и метионином.
Треонин находится в сердце, центральной нервной системе, скелетной мускулатуре и препятствует отложенную жиров в печени. Эта аминокислота стимулирует иммунитет, так как способствует продукции антител. Треонин очень в незначительных количествах содержится в зернах, поэтому у вегетарианцев чаще возникает дефицит этой аминокислоты.
Триптофан
Триптофан – это незаменимая аминокислота, необходимая для продукции ниацина. Он используется для синтеза в головном мозге серотонина, одного из важнейших нейромедиаторов. Триптофан применяют при бессоннице, депрессии и для стабилизации настроения.
Он помогает при синдроме гиперактивности у детей, используется при заболеваниях сердца, для контроля за массой тела, уменьшения аппетита, а также для увеличения выброса гормона роста. Помогает при мигренозных приступах, способствует уменьшению вредного воздействия никотина. Дефицит триптофана и магния может усиливать спазмы коронарных артерий.
К наиболее богатым пищевым источникам триптофана относятся бурый рис, деревенский сыр, мясо, арахис и соевый белок.
Тирозин
Тирозин является предшественником нейромедиаторов норэпинефрина и допамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Поэтому неудивительно, что низкое содержание тирозина в плазме связано с гипотиреозом.
Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тела и синдром беспокойных ног.
 Биологически активные пищевые добавки с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости и нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств. Тирозин может быть полезен при болезни Паркинсона. Естественные источники тирозина – миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Биологически активные пищевые добавки с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости и нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств. Тирозин может быть полезен при болезни Паркинсона. Естественные источники тирозина – миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Тирозин может синтезироваться из фенилаланина в организме человека. БАД с фенилаланином лучше принимать перед сном или вместе с продуктами питания, содержащими большое количество углеводов.
На фоне лечения ингибиторами моноаминоксидазы (обычно их назначают при депрессии) следует практически полностью отказаться от продуктов, содержащих тирозин, и не принимать БАД с тирозином, так как это может привести к неожиданному и резкому подъему артериального давления.
Валин
Валин – незаменимая аминокислота, оказывающая стимулирующее действие, одна из аминокислот BCAA, поэтому может быть использована мышцами в качестве источника энергии. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме.
Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Его чрезмерно высокий уровень в организме может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Валин содержится в следующих пищевых продуктах: зерновые, мясо, грибы, молочные продукты, арахис, соевый белок.
Прием валина в виде пищевых добавок следует сбалансировать с приемом других разветвленных аминокислот BCAA – L-лейцина и L-изолейцина.
Аминокислоты — Википедия
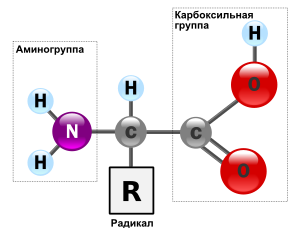
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO—
N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
Аминокислоты — Википедия

Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO—
N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
Строение основных аминокислот: 20 «магических», входящих в состав белка. Структура. Классификации. Таблицы с формулами. Название и международные сокращения протеиногенных аминокислот. С вами я, Галина Баева, 20 «магических» аминокислот и красивые таблицы со структурными формулами природных аминокислот.
Природные аминокислоты — это структурные единицы (мономеры) белков. В состав белков входят всего 20 т.н. «магических» аминокислот, которые также называются протеиногенными. Все они имеют сходное строение.
Кроме протеиногенных аминокислот в организме присутствуют и непротеиногенные, которые выполняют различную работу, в основном это промежуточные соединения в биохимическом конвейере, как например, орнитин, сигнальные молекулы, как β-аланин или нейромедиаторы, как ГАМК.
Особенности строения природных аминокислот
Строение аминокислот тесно связано с их функциями. Сходные по химической структуре вещества делают сходную работу. Попробуем разобраться, чтобы потом не путаться в аннотациях к препаратам.
Все аминокислоты слеплены по одному лекалу.
Голова – аминный остаток, содержащий азот N.
Углеродный скелет, состоящий из цепочки атомов углерода (в простейшем случае – один углерод, к которому «спереди» прицеплен аминный остаток, а сзади – карбоновый хвост)
Хвост – остаток карбоновой кислоты – СООН
Сбоку к углеродному скелету может быть присоединена еще какая-нибудь химическая группировка, которая придает данному веществу особые свойства.
Углеродная цепочка вместе с кислотным хвостом, присоединенная к аминной голове, называется мудреным словом «алифатический радикал».
Номенклатура аминокислот
Углеродная цепочка (скелет) может состоять как из 1 атома углерода, так и из нескольких. В последнем случае имеет значение, к какому атому углерода, начиная счет от карбоксильной группы, присоединится аминная голова. Это может быть как 1-ый атом углерода, так и 2-ой, 3-ий и далее. Химики договорились обозначать атомы углерода не цифрами, а буквами греческого алфавита: α — 1-ый атом углерода, начиная с карбоксильного хвоста, β— 2-ой, γ — 3-й, и т.д.
Если аминогруппа присоединяется к углероду в α-положении, такую аминокислоту называют α-аминокислотой, соответственно, если аминогруппа присоединена в β-положении — то это β-аминокислота, если в γ — то γ -аминокислота.
Все 20 природных протеиногенных аминокислот относятся к группе α -аминокислот.
Из β — аминокислот наиболее известен β-аланин, а из γ-аминокислот наиболее известна γ-аминомасляная кислота (ГАМК). Их структурные формулы приведены ниже.
Таблица 1 Строение протеиногенных аминокислот
Таблица 2 Структурные формулы аминокислот
Таблица 3 Модели структурных формул аминокислот
Классификация аминокислот
Существует несколько классификаций аминокислот:
- В зависимости от строения алифатического радикала, аминокислоты подразделяются на следующие группы:
- Просто аминокислоты с алифатическим радикалом, т.е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин
- Аминокислоты с разветвленной боковой цепью, у которых углеродный скелет образует боковые вилки: валин, лейцин, изолейцин. Изолейцин по химическому составу не отличим от лейцина, но его углеродный скелет по-другому загнут, т.е. он является стереоизомером. Иногда его выделяют в отдельную аминокислоту, а иногда – нет. Аминокислоты с разветвленной боковой цепью тоже относятся к группе МоноАминоМоноКарбоновых аминокислот.
- Аминокислоты, у которых в алифатическом радикале имеются разные группировки:
Спиртовая – ОН. Их называют ОксиМоноАминоМоноКарбоновые: серин и треонин
Карбоксильная, т.е. второй кислотный хвост. Это МоноАминоДиКарбоновые аминокислоты: аспарагиновая кислота (аспартат) и глутаминовая кислота (глутамат). Их называют еще Кислые аминокислоты, этакое «масло масляное».
Амидная. Карбоксильный хвост отрастил себе вторую аминную голову: аспарагин и глутамин. Кажется, понятным, что это производные соответственно аспартата и глутамата. Их называют Амиды МоноАминоДиКарбоновых аминокислот
Аминная. Вторая аминная голова присоединилась к углеродному скелету: лизин
Гуанидиновая: дополнительные аминные вставки — аргинин
Лизин и Аргинин относят также к группе ДиАминоМоноКарбоновых аминокислот, ибо у них есть по второй аминной группе. Поскольку эти аминокислоты в нейтральной среде (вода, рН=7), проявляют щелочные (основные) свойства, повышая водородный показатель (рН становится › 7), то их относят к группе Основных аминокислот
Серосодержащие аминокислоты. Имеют в радикале атом серы S: цистеин, метионин
Аминокислоты, содержащие ароматический радикал– углеродное колечко или Ароматические аминокислоты фенилаланин, тирозин, триптофан
Аминокислоты с гетероциклическим радикалом – колечко с атомом азота вместо углерода, поэтому он «гетеро» — «разнообразный»: триптофан и гистидин.
Нетрудно заметить, что триптофан входит в группу как ароматических аминокислот, так и в группу аминокислот с гетероциклическим радикалом, а все потому, что у него есть как гетороциклический радикал, так и ароматический.
Иминокислоты – углеродный скелет не вытянут в цепочку, а замкнут в колечко, из которого торчат аминная голова и рядом кислотный хвост: пролин и оксипролин
2. Классификация, в основу которой положена полярность алифатического радикала.
- Неполярные (гидрофобные) аминокислоты. Они имеют неполярные связи между атомами C-C, C-H. Это глицин, аланин, валин, лейцин, изолейцин, пролин, триптофан — 8 аминокислот
- Полярные незаряженные (гидрофильные) аминокислоты. Они имеют полярные связи между атомами С-О, C-N, O-H, S-H. Это серин, аспарагин, глутамин, треонин, метионин — 5 аминокислот
- Полярные отрицательно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН = 7) заряжены отрицательно, т.е. они выступают как отрицательно-заряженный ион (анион). Это аспарагиновая и глутаминовая кислоты, тирозин, цистеин — 4 аминокислоты
- Полярные положительно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН=7) заряжены положительно, т.е. они выступают как положительно-заряженный ион (катион). Это лизин, аргинин, гистидин — 3 аминокислоты.
Чем больше в белке аминокислот, обладающих полярностью, тем выше способность белка к химическим реакциям, т.е. его реактогенность. С реактогенностью белка непосредственно связаны его функции. Белки соединительной ткани, например кератин, входящий в состав волос и ногтей, имеет мало полярных аминокислот. Напротив, ферменты — белки-катализаторы биохимических реакций, обладают аминокислотным составом с множеством полярных групп.
3. Классификация по отношению к водородному показателю (рН)
- Аминокислоты, обладающие нейтральными свойствами с рН 5,97 – 6,02. Это глицин, аланин, серин, валин, лейцин, изолейцин,треонин, цистин, метионин — 9 аминокислот. Они имеют одну аминную голову и один карбоксильный хвост
- Аминокислоты, обладающие слабокислыми свойствами рН 3,0 – 5,7. Это аспарагиновая и глутаминовая кислоты. Они имеют одну аминную голову, но два карбоксильных хвоста, поэтому их называют «кислотами».
- Аминокислоты, обладающие щелочными свойствами с рН 9,7 – 10,7. У них две аминные головы и один карбоксильный хвост. Это лизин, аргинин, гистидин.
4. Классификация по способности к синтезу в организме человека и животных.
- Заменимые аминокислоты: глицин, серин, аланин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин
- Условно-заменимые аминокислоты: аргинин, гистидин, тирозин, цистеин
- Незаменимые аминокислоты: валин, лейцин, изолейцин, треонин, лизин, триптофан, фенилаланин, метионин
Подробнее о них рассказывается здесь: Аминокислоты заменимые и незаменимые: где взять.
5. Классификация аминокислот по путям биосинтеза.
В живых организмах аминокислоты могут производится (синтезироваться) из других соединений. Путь биосинтеза — это последовательность химических реакций, которые обусловлены наследственной (генетической) матрицей. Он записан в генетическом коде и обусловлен наличием ферментов, запускающих данные реакции. Биосинтез идет не хаотично, а количество исходных и промежуточных соединений ограничено. Так из всего многообразия природных аминокислот для синтеза белка используются только 20. Соответственно, исходные и промежуточные соединения на путях биосинтеза отдельных аминокислот образуют кластеры или семейства, где соединения могут преобразовываться друг в друга.
- Семейство аспартата: аспарагиновая кислота (аспартат), аспарагин, изолейцин, лизин, треонин, метионин
- Семейство глутамата: глутаминовая кислота (глутамат), глутамин, пролин, аргинин
- Семейство пирувата: аланин, валин, лейцин
- Семейство серина: серин, глицин, цистеин
- Семейство пентоз: гистидин, триптофан, фенилаланин, тирозин
- Семейство шикимата: триптофан, фенилаланин, тирозин
Надо сказать, что данные пути метаболизма реализуются в биологических системах, но не все они имеются в организме человека. Так высшие животные и человек не способны синтезировать ароматическое кольцо, поэтому путь шикимата — это не для нас. Аналогично с другими путями синтеза незаменимых аминокислот. Для наглядности незаменимые аминокислоты выделены жирным шрифтом.
6. Классификация аминокислот по путям катаболизма
Катаболизм — процесс распада, противоположен анаболизму или процессу синтеза. В организме катаболизм также обусловлен генетической программой и набором ферментов. Конечным итогом деградации аминокислот является аммиак, вода и углекислый газ, а также выделяется энергия в виде тепла или связанная в молекулах АТФ. В зависимости от промежуточных соединений, дающих энергию, аминокислоты подразделяются на следующие группы:
- Глюкогенные: дающие метаболиты (промежуточные соединения), из которых может быть синтезирована глюкоза: глицин, аланин, серин, треонин, валин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, аргинин, гистидин, цистин, метионин
- Кетогенные: распадающиеся до ацетоацетилКоА и ацетилКоА, из которых могут быть синтезированы кетонные тела: лизин, лейцин
- Промежуточные: при распаде этих аминокислот образуются метаболиты обоих типов: изолейцин, триптофан, фенилаланин, тирозин
Подробнее о глюкогенных и кетогенных аминокислотах можно прочитать здесь: Гликогенные аминокислоты
Правые и левые аминокислоты
В зависимости от прикрепления аминогруппы по отношению к карбоксильному хвосту в углеродной цепочке, аминокислоты могут быть «правыми» или «левыми», иначе говоря, их относят к D- или L- изомерам. Такие формы называют оптически активными, они не отличаются по химическому составу, но в пространстве относятся друг другу, как левая и правая рука.
В белковые молекулах присутствуют только L (левые) -изомеры аминокислот, правые (D) -изомеры могут обладать особыми свойствами и выступать как медиаторы, т.е. сигнальные молекулы, но чаще они образуют балласт. В обычных продуктах питания D-аминокислот практически нет. Они образуются при химическом синтезе и могут встречаться в искусственных протеинах, используемых в спортивном питании или в качестве биологически-активных добавок к пище. D-аминокислоты с трудом расщепляются ферментами, ибо они не физиологичны. В печени и почках содержится особый фермент — оксидаза D-аминокислот, предполагают, что она превращает нефизиологичные правые аминокислоты в физиологичные левые. Количество ее невелико, т.к. обычно в пище содержится очень мало D-аминокислот.
При химическом синтезе образуется равное количество D- и L- изомеров, но в синтезе белка участвуют аминокислоты только L – ряда. Это следует учитывать лицам, принимающим препараты аминокислот: L-аминокислоты будут существенно дороже из-за необходимости их выделения из смеси, но эффект от их применения будет существенно выше
Читайте далее о том, что делает в организме каждая аминокислота. Поверьте, им есть, чем заняться. С вами была Галина Батуро. Делитесь информацией в соц.сетях, оставляйте комментарии.
Аминокислоты — Википедия. Что такое Аминокислоты

Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO—
N+H3 —CH2COO—
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
D-аминокислота — Википедия переиздано // WIKI 2
D-аминокислоты являются аминокислотами, в которых стереогенный альфа-углерод к аминогруппе имеет D-конфигурацию. Для большинства встречающихся в природе аминокислот этот углерод имеет L-конфигурацию. D-аминокислоты чаще всего встречаются в природе в виде остатков в белках. Они образованы из остатков D-аминокислот, полученных из рибосомальных соединений.
Структура и общие свойства
L- и D-аминокислоты обычно являются энантиомерами.Исключение составляют две аминокислоты с двумя стереогенными центрами, треонин и изолейцин. Помимо этих двух особых случаев, L- и D-аминокислоты имеют идентичные свойства (цвет, растворимость, температура плавления) при многих условиях. Однако в биологическом контексте, который является хиральным, эти энатиомеры могут вести себя очень по-разному. Таким образом, D-аминокислоты имеют низкую пищевую ценность, отчасти потому, что они плохо усваиваются. [1]
Биосинтез
Два фермента превращают L-аминокислоты в D-аминокислоты.Рацемаза D-аминокислоты, PLP-зависимый фермент, рацемизирует аминокислоты посредством образования альфа-иминокислот, где теряется стереогенный центр. L-аминокислотные оксидазы превращают L-аминокислоты в альфа-кетокислоты, которые подвержены восстановительному аминированию. Некоторые аминокислоты склонны к рацемизации, одним примером является лизин, который рацемизируется с образованием пипеколиновой кислоты.
В пептидах остатки L-аминокислот медленно рацемизируются, что приводит к образованию некоторых остатков D-аминокислот.Рацемизация происходит посредством депротонирования метина, который является альфа-амидогруппой. Ставки увеличиваются с ростом pH.
Многие D-аминокислоты, обнаруженные в высших организмах, получены из микробных источников. D-аланин в пептидогликанах, которые содержат бактериальные клеточные стенки, помогает его хозяину противостоять атакам протеолитических ферментов. Несколько антибиотиков, например бацитрацин, содержит остатки D-аминокислот. [1]
Список литературы
 Последний раз эта страница редактировалась 25 апреля 2020 года, в 09:31.
,
Последний раз эта страница редактировалась 25 апреля 2020 года, в 09:31.
,D-аминокислот в нервной и эндокринной системах
Аминокислоты являются важными компонентами для пептидов и белков и действуют в качестве передатчиков сигналов. Только L-аминокислоты были сочтены необходимыми у млекопитающих, включая людей. Однако у млекопитающих обнаружены разнообразные D-аминокислоты, такие как D-серин, D-аспартат, D-аланин и D-цистеин. Физиологическая роль этих D-аминокислот не только в нервной системе, но и в эндокринной системе постепенно раскрывается. Рецепторы N-метил-D-аспартата (NMDA) связаны с обучением и памятью.D-серин, D-аспартат и D-аланин могут связываться с рецепторами NMDA. H 2 S, образующийся из D-цистеина, уменьшает дисульфидные связи в рецепторах и усиливает их активность. Активность аберрантных рецепторов связана с заболеваниями центральной нервной системы (ЦНС), такими как болезнь Альцгеймера, боковой амиотрофический склероз и шизофрения. Кроме того, D-аминокислоты обнаруживаются в частях эндокринной системы, таких как шишковидная железа, гипоталамус, гипофиз, поджелудочная железа, надпочечники и яички.D-аспартат исследуется на предмет регуляции высвобождения гормонов из различных эндокринных органов. Здесь мы сосредоточились на недавних открытиях, касающихся синтеза и физиологических функций D-аминокислот в нервной и эндокринной системах.
1. Введение
Аминокислоты важны не только как важные компоненты для строительных блоков пептидов и белков, но и как биохимические регуляторы, такие как нейротрансмиттеры [1–4] и регуляторы аутофагии [5–8]. D-аминокислоты являются энантиомерами L-аминокислот и считаются отсутствующими и неприродными аминокислотами у млекопитающих в течение длительного времени.Однако недавняя разработка чувствительных аналитических методов выявила присутствие D-аминокислот, таких как D-серин, D-аспартат и D-аланин, у млекопитающих [9–11]. Кроме того, исследования ферментов, которые синтезируют или метаболизируют D-аминокислоты, также прояснили локализацию и функции D-аминокислот в нервной и эндокринной системах и обнаружили, что синтез и метаболизм D-аминокислот регулируются физиологически [12–15]. , Здесь мы сосредоточились на последних достижениях в понимании синтеза, метаболизма и физиологической роли D-аминокислот в нервной и эндокринной системах.
2. D-серин
Отмеченные уровни D-серина были обнаружены в центральной нервной системе (ЦНС) грызунов и людей. Обильными областями D-серина в ЦНС были кора головного мозга, гиппокамп и полосатое тело. Кроме того, D-серин также обнаруживается в других регионах, таких как средний мозг, мозжечок и спинной мозг грызунов и людей [16–19]. Внеклеточные уровни D-серина в медиальной префронтальной коре и стриатуме крыс составляют примерно 20% от общего уровня серина [20].D-серин биосинтезируется сериновой рацемазой (SR) в ЦНС грызунов и человека [21–23]. Кроме того, уровень D-серина в ЦНС значительно снижается у Sr нокаутных мышей [24, 25].
Было показано, что SR локализуется в астроцитах, а также в нейронах, и D-серин высвобождается из обоих [22, 23, 26–29]. Кроме того, D-серин в нейронах генерируется из L-серина, получаемого из астроцитов [27]. Модель челнока D-серина описывает оптимальную D-серин-опосредованную активность рецептора N-метил-D-аспартата (NMDA), предполагая, что D-серин транспортируется между нейронами и астроцитами [30, 31].Эта модель челнока D-серина работает следующим образом. Астроциты поглощают глюкозу из кровеносных сосудов с помощью транспортера глюкозы 1 и затем 3-фосфоглицератдегидрогеназы (Phgdh), которая в основном локализуется в астроцитах и превращает глюкозу в L-серин. L-серин экспортируется из астроцитов и импортируется в нейроны через аланин / серин / цистеин / треониновые транспортеры (ASCT). В нейроне L-серин преобразуется в D-серин с помощью SR. D-серин высвобождается из нейронов через аланин-серин-цистеиновый транспортер-1 (Asc-1) или другими путями в синапс, где он может регулировать активность рецептора NMDA.Высвобожденный D-серин также может быть импортирован в астроциты через ASCT. Способность SR к рацемизации L-серина в D-серин положительно регулируется пиридоксаль-5′-фосфатом (PLP), двухвалентными катионами и АТФ [22, 32, 33]. С другой стороны, активность SR ингибируется его транслокацией из цитозоля в мембраны, которые содержат фосфатидилинозитол 4,5-бисфосфат (PIP 2 ), такие как ядерный, эндоплазматический ретикулум (ER) и плазматические мембраны [34 -37]. SR также регулируется взаимодействием с другими белками (рис. 1).Было обнаружено, что белок 1, взаимодействующий с рецептором глутамата (GRIP1) [38], и белок, взаимодействующий с C-киназой (PICK1) [39, 40], активируют SR, взаимодействуя с ним в астроцитах грызунов. GRIP1 связывается с α -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислотой (AMPA) и высвобождается после стимуляции L-глутаматом. Высвобожденный GRIP1 связывает и активирует SR [38]. Было обнаружено, что белок постсинаптической плотности 95 (PSD95) / большой диск / ZO-1 (PDZ) в С-концевой области GRIP1 отвечает за взаимодействие с SR [38, 41].PICK1 имеет домен PDZ, который связывается с SR [39], и домен Bin / amphiphysin / Rvs (BAR), который взаимодействует с мембранами [42]. PICK1 ассоциирует с продуцирующим эритропоэтин гепатоцеллюлярным рецептором (Eph) B3 или EphA4 в астроцитах. После того, как ephrinB3, который экспрессируется на постсинаптических нейронах, связывается с рецептором EphB3 или EphA4, PICK1 высвобождается в цитозоль. Усиление ассоциации между высвобождаемым PICK1 и SR увеличивает синтез D-серина в астроцитах мышей [40]. Stargazin и белок F-box only 22 (FBXO22) также регулируют активность SR, влияя на субклеточную локализацию SR.Старгазин образует комплекс с покоящимся рецептором AMPA, PSD-95 и SR, ингибируя активность SR, способствуя локализации мембраны в нейронах мышей. После активации рецептора AMPA SR выделяется из старгазина и плазматической мембраны, что приводит к активации SR [43]. FBXO22 связывает и активирует SR, предотвращая его связывание с мембраной ER в нейронах и астроцитах крыс. FBXO22 может блокировать липидсвязывающую область SR [35].
.
 Аминокислоты являются конечным продуктом белка. Общая структура α-аминокислоты с аминогруппой слева и карбоксильной группой справа.
Аминокислоты являются конечным продуктом белка. Общая структура α-аминокислоты с аминогруппой слева и карбоксильной группой справа.Аминокислоты являются строительными блоками белков. У эукариот есть 20 стандартных аминокислот, из которых сделаны почти все белки.
В биохимии аминокислотой является любая молекула, которая имеет как функциональные группы амина (NH 2 + R), так и карбоксильные (C = O).В биохимии этот термин относится к альфа-аминокислотам с общей формулой H 2 NCHRCOOH, где R является одной из многих боковых групп (см. Диаграмму).
Известно около 500 аминокислот. [1] Для животных самая важная вещь, которую делают аминокислоты, состоит в том, чтобы сделать белки, которые являются очень длинными цепями аминокислот. Каждый белок имеет свою собственную последовательность аминокислот, и эта последовательность заставляет белок принимать разные формы и выполнять разные функции. Аминокислоты подобны алфавиту для белков; даже если у вас есть только несколько букв, если вы соедините их, вы можете сделать много разных предложений.
Девять из 20 стандартных аминокислот являются «незаменимыми» аминокислотами для человека. Они не могут быть построены (синтезированы) из других соединений человеческим организмом, и поэтому должны приниматься в пищу. Другие могут быть необходимы для некоторых возрастов или заболеваний. Незаменимые аминокислоты также могут различаться у разных видов. Травоядные должны получать свои незаменимые аминокислоты из своего рациона, который для некоторых является почти полностью травой. Жвачные, такие как коровы, получают первые аминокислоты через микробы в первых двух камерах желудка.
Аминокислота является органическим химическим веществом. Он состоит из атома α-углерода, который ковалентно связан с четырьмя группами. [2]
- атом водорода
- аминогруппа (-NH 2 )
- карбоксильная группа (-COOH)
- переменная группа R
Каждая аминокислота имеет по крайней мере одну аминогруппу (-NH 2) и одну карбоксильную группу (-COOH), кроме пролина.
Это протеиногенные аминокислоты, которые являются строительными блоками для белков.Они производятся клеточным механизмом, закодированным в генетическом коде любого организма. [3]
| Аминокислота | Short | Аббревиатура. | кодонов | Возникновение в белках человека (%) | Основные ‡ в людях |
|---|---|---|---|---|---|
| аланин | А | Ала | GCU, GCC, GCA, GCG | 7,8 | нет |
| цистеин | С | Cys | UGU, UGC | 1.9 | условно |
| аспарагиновая кислота | D | Асп | GAU, GAC | 5,3 | нет |
| Глутаминовая кислота | E | Глу | GAA, GAG | 6,3 | условно |
| Фенилаланин | F | Phe | UUU, UUC | 3,9 | Да |
| Глицин | г | Гли | GGU, GGC, GGA, GGG | 7.2 | условно |
| гистидин | Н | его | CAU, CAC | 2,3 | Да |
| Изолейцин | я | Иль | AUU, AUC, AUA | 5,3 | Да |
| лизин | К | Lys | AAA, AAG | 5,9 | Да |
| лейцин | л | лей | UUA, UUG, CUU, CUC, CUA, CUG | 9.1 | Да |
| метионин | М | встретил | авг | 2,3 | Да |
| аспарагин | N | Asn | AAU, AAC | 4,3 | нет |
| пирролизин | О | пил | UAG * | 0 | нет |
| пролин | П | Pro | CCU, CCC, CCA, CCG | 5.2 | нет |
| глютамин | Q | Глн | CAA, CAG | 4,2 | нет |
| аргинин | р | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5,1 | условно |
| серин | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6,8 | нет |
| треонин | т | Чт | ACU, ACC, ACA, ACG | 5.9 | Да |
| селеноцистеин | U | сек | UGA ** | > 0 | нет |
| Валин | В | Val | GUU, GUC, GUA, GUG | 6,6 | Да |
| триптофан | Вт | трл | UGG | 1,4 | Да |
| тирозин | Y | тыр | UAU, UAC | 3.2 | условно |
| Стоп кодон † | — | Срок | UAA, UAG, UGA †† | — | — |
* UAG обычно является янтарным стоп-кодоном, но кодирует пирролизин, если присутствует элемент PYLIS.
** UGA обычно является опаловым (или янтарным) стоп-кодоном, но кодирует селеноцистеин, если присутствует элемент SECIS.
† Стоп-кодон не является аминокислотой, но включен для полноты.
†† UAG и UGA не всегда действуют как стоп-кодоны (см. Выше).
‡ Незаменимая аминокислота не может быть синтезирована у людей. Это должно быть включено в рацион. Условно незаменимые аминокислоты, как правило, не требуются в рационе, но должны поставляться населению, которое недостаточно его потребляет.
С этими α-аминокислотами далее в процессах биосинтеза, возникающих как несущественные, структурно (здесь с использованием обозначения SMILES) связаны:
OC (= O) C (N) —
- ├ ч .. 🅖 глицин
- ├ C .. 🅐 Аланин
- │├ C., 2-аминобутановая кислота
- ││├ C .. Норвалин
- │││├ –2H .. 🅟 пролин (дегидронорвалин)
- │││├ C .. Норлейцин
- ││││└ ш .. ys лизин
- ° C (= O) C1N = CCC1C .. пирролизин
- │││└ NC (= N) N .. 🅡 Аргинин
- ││├ C (= O) N .. 🅠 Глютамин
- ││├ C (= O) O .. 🅔 Глутаминовая кислота
- ││├ O .. Гомосерин
- ││└ S. Гомоцистеин
- ││ └ C .. 🅜 Метионин
- │├ C (C) C .. 🅛 Лейцин
- │├ C (= O) N., Para аспарагин
- │├ C (= O) O .. 🅓 Аспарагиновая кислота
- │├ C1 = ЧПУ = N1 .. 🅗 Гистидин
- │├ c1ccccc1 .. 🅕 Фенилаланин
- │├ c1ccc (O) cc1 .. 🅨 Тирозин
- │├ C1 = CNc2ccccc12 .. 🅦 Триптофан
- С1 = CNc2ccc (O) cc12 .. Окситриптан
- │├ c (cc1I) cc (I) c1-O-c2cc (I) c (O) c (I) c2 .. Тироксин
- │├ O .. 🅢 Серин
- │├ S .. 🅒 Цистеин
- │└ [SeH] .. 🅤 селеноцистеин
- ├ C (C) C .. 🅥 Валин
- ├ C (C) O., 🅣 Треонин
- └ C (C) CC .. 🅘 Изолейцин
аминокислот — Proteopedia, жизнь в 3D
из протеопедии
(Перенаправлено с аминокислот) протеопедия ссылка proteopedia linkДля общего ознакомления с аминокислотами см. Аминокислоты в Википедии.
22 Стандартные аминокислоты и мнемоника
Вот названия двадцати двух стандартных аминокислот с их трех и однобуквенными [1] сокращениями. Мнемонические имена предназначены для того, чтобы помочь вам запомнить однобуквенные коды, но не являются правильными именами.
Ala A A lanine | Lys K Lysine | мнемоника: | мнемоника: |
Gln Q Глютамин | сек. U селеноцистеин * | ||
* С середины 20-го века было 20 стандартных аминокислот.В начале 21 века,
генетически закодированный
Селеноцистеин и пирролизин включены в стандарт Всемирным банком белковых данных [2] . | |||
Нажмите на изображение ниже, чтобы увидеть его в полном размере с подробной информацией о 21 аминокислоте.
Существует также список стандартных аминокислот в банке данных белка.
L- и D-аминокислоты
PDB Номенклатура | |
L-форма | D-форма |
ALA | DAL |
Асимметричный α-углерод в 21 из стандартных аминокислот (все, кроме глицина) представляет собой хиральный (стереогенный) центр [3] .Таким образом, каждая аминокислота может существовать в виде одного из двух оптических изомеров или энантиомеров (зеркальные изображения), обозначенных L-формой и D-формой. Почти все встречающиеся в природе аминокислоты являются L-аминокислотами, названными так потому, что они аналогичны L-форме глицеральдегида [3] . (Не все L-аминокислоты являются левовращающими; некоторые вращают поляризованный свет по часовой стрелке [3] ).
Более 700 записей в PDB содержат одну или несколько D аминокислот. Хотя D-аминокислоты редки по природе, они встречаются (см. Естественное изобилие в Википедии).D-аланин (DAL) встречается в более чем 100 записях в PDB, D-лейцин (DLE), D-фенилаланин (DPN), D-серин (DSN) и D-валин (DVA) каждый встречается более чем в 50. Некоторые из этих записей химически синтезированы, не встречаются в природе. Грамицидин — это природный антибиотик, содержащий несколько D-аминокислот, например, 1nrm. 4glu представляет собой цепочку аминокислот VEGF-A из 102 аминокислот, полностью синтезированную из D-аминокислот.
необычных аминокислот
Существует, по крайней мере, две исторически «нестандартные» аминокислоты, которые в настоящее время признаны генетически кодируемыми, что обсуждается ниже.В 2014 году PDB начал включать эти две, чтобы получить 22 стандартных аминокислоты [2] .
Селеноцистеин: 21-я аминокислота
Редкие белки во всех областях жизни включают селеноцистеина (Sec, U) , обозначенную как 21-я аминокислота [4] . Более 70 записей в PDB включают селеноцистеин, идентифицированный как SEC.
Пирролизин: 22-я аминокислота
пирролизин (Pyl, O) [5] представляет собой генетически кодируемую аминокислоту, которая встречается в природе у метаногенных архей и теперь называется 22-й аминокислотой [6] .Это происходит в нескольких записях в PDB. Смотрите более подробную информацию.
Нет 23-й аминокислоты?
. 21-я и 22-я аминокислоты определяются стоп-кодонами UGA и UAG, соответственно, модифицированными нижестоящими структурами стволовых петель в мРНК. Лобанов и соавт. [7] исследовали «16 архейных и 130 бактериальных геномов для тРНК с антикодонами, соответствующими трем стоп-сигналам». Их данные свидетельствуют о том, что «появление дополнительных аминокислот, которые широко распространены и генетически кодируются, маловероятно.»
селенометионин
См. Селенометионин.
Пострансляционные модификации
Многие необычные аминокислоты образуются в результате катализируемых ферментами реакций, которые модифицируют генетически кодированную стандартную аминокислоту после ее включения в полипептид; они называются посттрансляционными модификациями. Среди них:
- фосфорилирование серина, треонина или тирозина
- гидроксилирование пролина (чтобы получить гидроксипролин, e.грамм. в коллагене)
- ацетилирование лизина или N-конец
- Пример N-концевого ацетилирования: 4mdh
- метилирование лизина
- карбоксилирование аспартата или глутамата
- нитрозилирование, например, производить нитротирозин
- ацилирование жирной кислотой (см. N-концевое миристоилирование рековерина)
- прениляция
- гликозилирование серина, треонина или аспарагина (с получением гликопротеинов)
- Пример N-связанного гликолилирования: 1igy
Структура, свойства, поведение в белках
Angel Herráez предоставил учебное введение в структуру аминокислот, в котором 20 аминокислот можно визуализировать в 3D с помощью JSmol.
Пожалуйста, помогите расширить список ниже, чтобы включить все 22 аминокислоты.
Глицин
Gly G: Маленький.
См. Также Глицин в Протеопедии и Глицин в Википедии, где показана структура. Глицин — самая маленькая аминокислота, так как его боковая цепь — не что иное, как единственный водород. Глицин часто встречается по очереди, поскольку стерические столкновения с более крупными аминокислотами будут проблематичными. Повороты обычно происходят на поверхностях белков, между бета-нитями или альфа-спиралями.Распространено обнаруживать высококонсервативных глицинов по очереди на белковых поверхностях , поскольку мутация в более крупном остатке будет мешать складке. Глицин также встречается в бета-нитях и альфа-спиралях, хотя его частота в альфа-спиралях низка (второе место после пролина, стр. 125 в [8] ). Глицин обычно находится на С-конце альфа-спиралей и считается терминатором спирали (стр. 125 в [8] ).
гистидин
Его H: Заряжен: Basic , Ароматный, Громоздкий
См. Гистидин в Википедии, где показана структура.Боковая цепь His может быть положительно заряжена (протонирована), и в этом случае оба атома азота в имидазольном кольце боковой цепи имеют атомы водорода, и заряд делокализован между ними. РКа для протонирования составляет 6,1. Это означает, что в среднем в любой момент половина его боковых цепей протонируется при pH 6,1. При рН крови 7,4 ± 0,05 Его боковые цепи заряжены положительно менее чем в 10% случаев. Поэтому His не входит в обычный список положительно заряженных аминокислот (лизин и аргинин).
Фенилаланин
Phe F: Нейтральный, Ароматический, Громоздкий
См. Фенилаланин в Википедии, где показана структура. Фе участвует в катион-пи взаимодействиях. Фенилкетонурия — это генетическое заболевание, при котором фермент, превращающий фенилаланин в тирозин, не функционирует, что приводит к токсичности от избытка фенилаланина и дефициту тирозина.
Триптофан
трп W: Нейтральный, полярный, ароматический, громоздкий
См. Триптофан в Википедии, где показана структура.В трансмембранных белках триптофаны часто лежат на границе между водой и липидом. Примером является калиевый канал, например, 1bl8. Чтобы увидеть их позиции, используйте диалог Find в FirstGlance в Jmol. Trp участвует в катион-пи взаимодействиях.
тирозин
Tyr Y: Нейтральный, полярный, ароматический, громоздкий
См. Тирозин в Википедии, где показана структура, и Нитротирозин. Тир участвует в катион-пи взаимодействиях.
См. Также
Список литературы
- one Однобуквенная запись для аминокислотных последовательностей (окончательные правила).IUPAC — Комиссия IUB по биохимической номенклатуре, стр. 639-645, Международный союз теоретической и прикладной химии и Международный союз биохимии, Butterworths, Лондон, 1971. Полный текст.
- ↑ 2,0 2,1 Объявление: стандартизация аминокислотной номенклатуры, World Wide Protein Data Bank, 8 января 2014 г.
- ↑ 3.0 3.1 3.2 См. Хиральность в Википедии].
- ↑ Аткинс Дж. Ф., Гестеланд РФ. Двадцать первая аминокислота.Природа. 2000 сент. 28; 407 (6803): 463, 465. PMID: 11028985 дои: 10.1038 / 35035189
- ↑ См. Пирролизин в Википедии.
- ↑ Хао B, Чжао G, Кан PT, Соареш JA, Фергюсон TK, Gallucci J, Krzycki JA, Чан MK. Реакционная способность и химический синтез L-пирролизина — 22-й генетически кодируемой аминокислоты. Chem Biol. 2004 сентябрь; 11 (9): 1317-24. PMID: 15380192 дои: 10.1016 / j.chembiol.2004.07.011
- ↑ Лобанов А.В., Крюков Г.В., Хатфилд Д.Л., Гладышев В.Н. Есть ли двадцать третья аминокислота в генетическом коде? Тенденции Генет.2006 Jul; 22 (7): 357-60. Epub 2006 19 мая. PMID: 16713651 doi: 10.1016 / j.tig.2006.05.002
- ↑ 8,0 8,1 Кессель, Амит и Нир Бен-Тал. Введение в белки: структура, функции и движение . CRC Press, 2011. 653 с.

 N+H3 —CH2COO—
N+H3 —CH2COO—