Бром (Br, Bromum) — влияние на организм, польза и вред, описание
История брома
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.
Общая характеристика Брома
Бром (от древне-греческого βρῶμος , в дословном переводе «вонючий», «зловоние», «вонючка») является элементом главной подгруппы VII группы четвёртого периода периодической системы химических элементов Д.И. Менделеева (в новой классификации – элементом 17-й группы). Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904. Для обозначения применяется символ Br (от латинского Bromum).
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа (79Br и 81Br), молекула брома состоит из двух атомов и имеет химическую формулу Br 2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
Опасность и вред брома
Элементарный бром – сильнодействующий яд, принимать внутрь его категорически запрещено. Пары брома могут вызвать отёк лёгких, особенно у тех, кто склонен к аллергическим реакциям или имеет заболевания лёгких и дыхательных путей (очень опасны пары брома для астматиков).
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья. Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна. Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин. Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях. Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.
Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
в чем содержится и чем помогает нашему организму?
СОДЕРЖАНИЕ СТАТЬИ:
Этот неметалл был обнаружен французским исследователем А.Ж. Баларом, когда тот изучал состав рассолов средиземноморской воды на соляных промыслах.
Им была выделена жидкость красновато-бурого цвета, отличительной особенностью которой был отвратительный запах.
Кстати, именно благодаря своему свойству раздражать обоняние человека, бром и был назван именно так. В переводе с греческого языка это слово значит «вонючий», «зловонный».
Да, как ни удивительно, но наш организм содержит эту, мягко скажем, дурно пахнущую жидкость, причем в довольно ощутимых объемах. Так, в теле взрослого человека может присутствовать до 300 мг брома, при этом в крови – до 10 мг на литр.
К содержаниюГде спрятан бром внутри нас?
 Бром скапливается в почках и щитовидной железе.
Бром скапливается в почках и щитовидной железе.Преимущественно он концентрируется в таких органах, как почки, щитовидная железа, гипофиз, а также в крови, в мышцах и в костной ткани. Очень важно регулярно пополнять запасы данного микроэлемента, так как он в своем естественном виде без труда выводится из тела с мочеиспусканием и потоотделением.
Конечно, самые лучшие источники любых питательных веществ – это свежая растительная пища, ведь природа уже позаботилась обо всем наилучшим образом. И бром в продуктах в данном случае не является исключением.
Какие продукты содержат бром?
 Водоросли — один из натуральных источников брома.
Водоросли — один из натуральных источников брома.Этот минерал широко распространен в природе – в морской воде, в соляных озерах, в подземных источниках, в горных породах и даже в атмосфере, а потому некоторым растениям не составляет особого труда накапливать его.
Вот почему продукты, богатые бромом, в основном имеют растительное происхождение. Из злаков выделяют пшеницу и ячмень. Я бы посоветовала вам приобретать не магазинные каши, которые в большинстве своем лишены ценной оболочки, а цельные зерна указанных растений.
Просто замочите горсть пшеницы или ячменя на ночь в чистой воде, утром промойте зерна проточной водой и оставьте без жидкости до вечера – на ужин вы получите проростки, полезные свойства которых известны всем. В них будет не только природный бром, но и целый комплекс витаминов и минералов, сбалансированный самой природой.
 Проростки также содержат большое количество брома.
Проростки также содержат большое количество брома.Можно оставлять ростки длиной 1-2 мм, а можно выращивать из указанных злаков зелень, чтобы затем добавлять ее в коктейли и салаты. Тем более, интересующий нас минерал имеет свойство концентрироваться именно в зеленой части растений. А наши нехитрые действия улучшают усвоение брома.
Способны накапливать это вещество и бобовые – чечевица, фасоль, горох, арахис. Продукты, в которых содержится бром: орехи, особенно грецкие, а также миндаль и фундук, приобретенные в скорлупе. Кстати, орешки, как и злаки, тоже нужно есть размоченными в воде.
Это особенно актуально в том случае, если они не являются свежим урожаем, а хранились довольно длительное время. Вода разрушает защитные ингибиторы орехов и высвобождает кладезь «полезностей» для нашего организма.
Выше я озвучила природное местонахождение брома, так что, вполне логично, что мы можем получать этот микроэлемент из морских водорослей, а также из натуральной морской или неочищенной каменной соли. Это естественные источники брома.
Примечательно, что люди, живущие у моря, ежедневно пополняют свои запасы этого минерала во время прогулок по пляжу или по набережной, просто вдыхая морской воздух.
Как видите, бром в питании – явление не такое уж и редкое. Уверена, в ежедневном меню сыроеда или вегетарианца содержится достаточное количество данного вещества.
К содержаниюДля чего нужен бром нашему организму?
 Павлов Иван Петрович
Павлов Иван ПетровичО том, что бром для здоровья нам необходим, говорил еще знаменитый русский физиолог Иван Петрович Павлов. Он утверждал, что с помощью этого уникального вещества, или, как его называл сам ученый, «бесценного препарата», можно эффективно лечить расстройства ЦНС.
Действительно, соли данного минерала – бромиды, попадая в наш организм, оказывают седативное воздействие на центральную нервную систему, несколько затормаживая ее работу.
Однако в этом месте я считаю нужным подчеркнуть, что сам Павлов говорил о сверхмалых дозах брома и о его строго индивидуальном расчете, который зависел от природных данных больного и от его текущего состояния.
В своем натуральном виде, то есть бром в еде, также способен успокаивать нервную систему и снимать возбужденные состояния.
К содержаниюОдним из ярчайших симптомов нехватки брома является повышенная раздражительность.
Для чего полезен бром в организме человека?
- Оказывает на весь организм успокаивающее и снотворное воздействие, а также обладает противосудорожным эффектом.
- Благотворно влияет на поджелудочную железу – повышает активность важнейших ферментов, таких, как: пепсин, липаза, амилаза, что повышает качество процесса пищеварения и способствует хорошему усвоению жиров и углеводов.
- Нормализует уровень кислотности желудочного сока, а потому нередко используется в лечении заболеваний данного органа – например, при язвах.
Некоторое время назад считалось, что действие брома на мужской организм способно уменьшать половое влечение. Его даже планировали использовать в армии для коррекции возбудимости у военнослужащих. Хорошо, что сторонники необоснованной теории не успели этого сделать.
 Бром для солдата как валерьянка для кота.
Бром для солдата как валерьянка для кота.Исследователи опровергли указанные ошибочные утверждения – функции брома не имеют отношения к мужской потенции, а, как я уже отметила выше, просто погружают весь организм в состояние покоя и сонливости. Таким образом, солдаты избежали рассеянности, которое может быть очень опасным для службы в армии.
Более того, препараты на основе брома не следует принимать тем людям, чья работа связана с повышенной концентрацией внимания – работникам производства, монтажникам-высотникам, водителям транспортных средств.
К содержаниюЧем вреден бром?
 Если что не так с бромом — отвечать щитовидке.
Если что не так с бромом — отвечать щитовидке.Хочу акцентировать ваше внимание еще на одной особенности данного минерала. Дело в том, что он является антагонистом йода – то есть, веществом, которое препятствует его усвоению. Бром конкурирует с ним за рецепторы и сдерживает захват йода в щитовидной железе, что, в свою очередь, угнетает ее деятельность.
Казалось бы, в случае гиперфункции данного органа, это вроде бы и неплохо, однако такой механизм в итоге может спровоцировать развитие гипотериоза, то есть, стойкого недостатка гормонов «щитовидки».
При избытке гормонов этой железы существует другая опасность – увеличение ее в размерах с целью захватить-таки как можно больше йода. Это заболевание называется «эндемический зоб». Регулярное поступление брома в организм считается профилактикой данного недуга. Но чем выше уровень брома, тем меньше йода, а, значит, щитовидная железа все же разрастается.
Более того, вытеснение йода из организма чревато развитием онкологических и аутоиммунных заболеваний. Вот почему так важно регулировать количество брома, поступающего в наш организм извне.
К содержаниюМожет ли быть полезным токсичное вещество?
 Раздражены? Бром вас успокоит.
Раздражены? Бром вас успокоит.В самом начале статьи я озвучила некое противоречие: «Бром нам необходим для жизни, но он токсичен». Так и есть! Вот только следует различать формы данного вещества.
Все полезные свойства брома присущи тому его виду, который содержится в пище и в морской воде, то есть, в его естественных источниках. И именно в такой природной форме лучше всего употреблять данный минерал при беременности.
В медицинской практике это вещество применяют при неврологических расстройствах, при повышенной раздражительности, истериках, бессоннице, эпилептических припадках, а также в случаях нервного перенапряжения.
Имейте в виду, что здесь речь идет не о чистом броме, а слабых растворах его солей (бромида натрия или калия). Именно об аптечном препарате говорил Иван Павлов и именно эти вещества в крошечных концентрациях используется в медицине. Их суточная норма должна быть строго рассчитана – как я уже говорила, с учетом физиологических особенностей пациента.
Выделенный чистый или элементарный бром – сильнодействующий яд, высокотоксичное вещество, которое нельзя применять в качестве лекарства.
Однако потребность в данном минерале никто не отменял, ведь дефицит брома может иметь негативные последствия – такие, как:
- ухудшение качества желудочного сока;
- понижение гемоглобина в крови;
- отсутствие сна;
- чрезмерная раздражительность;
- повышенная возбудимость нервной системы.
Суточная потребность в броме для взрослых мужчин и женщин — примерно 0,5–1 г. Если превысить указанную дозу, то можно нажить серьезные проблемы со здоровьем, ведь избыток брома в организме гораздо опаснее, чем его недостаток.
Он выражается следующими симптомами:
- тошнотой и рвотой;
- головокружениями;
- кожными высыпаниями;
- раздражением слизистых оболочек;
- носовыми кровотечениями;
- расстройством пищеварения;
- диареей;
- проблемами с речью;
- нервными расстройствами;
- ухудшением памяти;
- кашлем и спазмами органов дыхания.
Как уменьшить вредные свойства токсичного брома?
 Работать на токсичном производстве — это так романтично! 😆
Работать на токсичном производстве — это так романтично! 😆На вредном производстве при непосредственном контакте с бромом важно соблюдать технику безопасности – использовать специальную одежду, защитные перчатки и противогаз.
Опасной для здоровья дозой данного вещества являются 14 мг на кг массы тела.
Однако не стоит думать, что, если вы работаете в офисе или даже занимаетесь фрилансом дома, то отравление бромом вам не грозит. Современный мир, в котором доминирует все искусственное, таит в себе множество опасностей. Это токсичное вещество может встретиться вам:
- в бассейне – в качестве компонента дезинфицирующего средства;
- в компьютере – он входит в состав пластмассы;
- в еде, обработанной пестицидами в виде бромистого метила;
- в безалкогольных напитках промышленного производства с «цитрусовым» вкусом и ароматом;
- в аптечных спреях для носа и обезболивающих средствах;
- в собственном доме и на рабочем месте – в коврах, мягкой мебели, тканях в составе антипренов (противопожарных средств).
При этом вовсе не обязательно бросать цивилизацию и уходить жить в глушь, хотя именно об этом мечтают многие осознанные люди, в том числе и сыроеды.
В ваших силах минимизировать вредное воздействие брома на свое здоровье. Скажем, от мебели, штор и компьютера вы вряд ли сможете отказаться, а вот прекратить пить вредную газировку и употреблять чудеса фармацевтической продукции вы вполне можете.
Также можно вымачивать продукты, содержащие пестициды, в подсоленной воде, чтобы уменьшить их вред.
А что делаете вы, чтобы сбалансировать поступление брома в свой организм?
Бром: забытое лекарство
 Успокоительное средство, использовавшееся почти полтора века, – нейротоксичный яд, постоянный герой новостей о техногенных катастрофах, а также источник одного из самых живучих околомедицинских мифов. Познакомимся поближе с этим веществом.
Успокоительное средство, использовавшееся почти полтора века, – нейротоксичный яд, постоянный герой новостей о техногенных катастрофах, а также источник одного из самых живучих околомедицинских мифов. Познакомимся поближе с этим веществом. Из пены морской
Права на открытие этого химического элемента принадлежат Монпелье. Неподалеку от этого французского города, на побережье Средиземного моря, находились солевые прииски. Добыча велась нехитрым способом: морскую воду заливали в неглубокие бассейны, оставляли на солнце и через некоторое время вычерпывали выкристаллизовавшуюся соль. А оставшийся раствор выливали обратно в море.
Ассистент кафедры естественных наук местного университета Антуан Жером Балар изучал воду из бассейнов – ее состав был его первой самостоятельной исследовательской темой. Подойдя к работе со всей серьезностью, молодой человек испробовал все имевшиеся у него реагенты. Особенно интересным оказался результат пропускания газообразного хлора: раствор стал красно-бурым. Что вызвало изменение цвета, было непонятно, и Балар продолжил опыты. И после ряда неудачных попыток смог с помощью пиролюизита (оксида марганца (II)) и серной кислоты получить зловонную и тяжелую красно-бурую жидкость, которая не подходила ни под одно известное описание.
Сообщение о неожиданной находке поступило в Парижскую академию наук в 1825 году. Комиссия в составе 3 выдающихся французских химиков – Луи Воклена, Луи Тенара и Жозефа Гей-Люссака – подтвердила, что никому не известный 23-летний исследователь действительно совершил выдающееся открытие.
Новый элемент решили назвать по аналогии с его ближайшими родственниками хлором и йодом. В качестве имен для них использовались греческие слова, обозначавшие одно из свойств: хлор – от χλωρός, «зелёный», а йод — ἰώδης, «фиалковый». Поскольку пахло открытие Балара довольно неприятно, выбор остановили на βρῶμος – «вонь», «зловоние».
Повышенным содержанием соединений брома объясняются целебные свойства воды Мертвого моря и подземных источников
Всех излечит, исцелит…
Уже через 10 лет после открытия бром пришел в медицину. У растворов бромидов натрия и калия обнаружились легкие седативные свойства. Намного позже ученик Павлова П.М. Никифоровский,уточнил механизм действия брома, показав, что он не уменьшает возбуждение в коре головного мозга, а усиливает торможение.В различных модификациях препараты с бромом применялись вплоть до конца XX века, а эфиры бромизовалериановой кислоты до сих пор можно найти в домашних аптечках россиян. Трибромфенолят висмута, более известный как ксероформ, показал себя как неплохой антисептик и даже входил в состав знаменитой мази Вишневского. Можно вспомнить еще брометон, бромалин, бромурал и бромтетрациклин. Почему все они со временем вышли из употребления?
Жертвы успокоительных
Дело в том, что бром токсичен. При длительном приеме его солей внутрь развивается состояние, именуемое бромизмом. По данным некоторых недавних исследований, в XIX–XX веках от 5 до 10% стационарной психиатрической патологии приходилось именно на пролеченных бромсодержащими препаратами, а также на тех, кто применял их в целях самолечения.Симптомы бромизма связаны со снижением способности мембран нейронов реагировать на проходящие по ним импульсы. Если учесть, что период полувыведения бромидов составляет 9–12 дней, накопить опасную дозу не такая уж сложная задача. Тем более что эти препараты назначались в дозировке 3–5 г в сутки нередко длительными курсами. По современным представлениям для развития токсического эффекта достаточно 0,–1 г в сутки в течение нескольких недель (срок варьируется в зависимости от индивидуальной чувствительности).
В начале Первой мировой войны французские войска применяли против немцев этилбромацетат в качестве слезоточивого газа. Позже это позволило германской пропаганде заявлять о том, что страны Антанты первыми применили химическое оружие
Спектр возможных неприятностей – от сомноленции до полноценного делирия. Возможны нарушения речи, частичная утрата рефлексов, например глотательного, тремор, атаксия. Раздражающее действие на слизистые оболочки приводит к поносу и бронхиту.Характерная для отравления бромом сыпь – бромодерма – представляет собой темно-красные узелки с уплотненным основанием и красным венчиком вокруг узелка. Они появляются на лице, затылке, спине и груди, иногда сливаясь в большие бляшки, покрытые коркой. Если ее удалить, обнаруживается мокнущая поверхность с обильным отделением. Бромодерма часто наблюдалась у грудных детей, матери которых принимали бромиды в качестве успокоительных.
После прекращения приема лекарств симптомы постепенно проходили в течение нескольких недель. И хотя летальных исходов официально зарегистрировано не было, в связи с большим количеством сообщений о нежелательных реакциях в 1975 году Администрация по продуктам и лекарствам США запретила использование препаратов брома в клинической практике. В СССР и России прямого запрета не было, однако со временем произошло естественное вытеснение бромидов более эффективными и безопасными ЛС.
Желтый туман
Бром широко используется в химической промышленности, так что аварии, связанные с его разливом, не редкость. Последний широко известный случай произошел в 2011 году в Челябинской области, когда пострадали несколько десятков человек. Желтое облако, накрывшее окрестности железнодорожной станции, где произошло ЧП, показывали по всем телеканалам.Бромированные растительные масла используются в производстве газированных напитков
Разлитый чистый бром действует как удушающее отравляющее вещество. До более летучего и ядовитого хлора ему далеко, но головокружение, слюно- и слезотечение, кашель и приступы удушья он вызывает при самых незначительных концентрациях в воздухе – от 0,001%. Возможен и летальный исход, правда, для этого нужно очень долго оставаться в эпицентре разлива.Поскольку бром все-таки жидкость, хотя и быстро образующая пары, спастись от него можно, просто выбравшись на возвышение. Надев противогаз, а еще лучше костюм химзащиты (ОЗК), можно чувствовать себя в полной безопасности. А вот медицинские маски и противопылевые респираторы в данном случае совершенно бесполезны.
Жидкий бром, попавший на кожу, нужно смыть большим количеством воды. Если под рукой есть сода – добавить ее в воду и использовать этот раствор. Отравление бромом успешно лечится введением в организм большого количества хлоридов – например, физраствора. Летальных исходов почти всегда удается избежать. Равно как и долговременных последствий – бромизм у пострадавших не развивается.
Солдатский чай
Естественно, не обойтись в рассказе о броме без разоблачения мифа о том, что это вещество якобы добавляют в чай солдатам, чтобы они меньше думали о прекрасном поле. Как военный врач, работавший в войсковом звене, ответственно заявляю: ничего подобного в армии нет и никогда не было.Во-первых, подобные манипуляции определенно должны быть обязанностью медицинской службы. Соответственно имелись бы инструкция, приказ или другие руководящие документы, регулирующие планирование, учет препарата, его хранение на складах и так далее. А ведь бромида понадобилось бы немало – на часть в 2500 человек примерно 25 кг в год. Никакой подобной отчетности и документации не существует.
Во-вторых, судя по количеству ЗППП среди солдат, проходивших через мой медпункт, с либидо у них было все в порядке. В-третьих, не надо забывать о бромизме. Передозировка бромидами при регулярном употреблении очень вероятна. А если учесть, что речь идет о людях, которым выдают оружие, последствия могут быть самыми печальными.
Наконец, в армии есть куда более действенные способы немедикаментозного «укрощения плоти»: интенсивные физические нагрузки довольно ощутимо снижают сексуальную напряженность. И мысль у солдата под вечер только одна – добраться до подушки.
В 2003 году New England Journal of Medicine опубликовал описание случая развития бромодермы у 63-летнего любителя газировки, выпивавшего до 8 литров напитка в день
Но ведь что-то же сыплют! Многие видели, как медик (фельдшер, санинструктор, иногда и лично начмед), подкравшись к чану с компотом, сдабривал его каким-то белым порошком, да еще и в поистине промышленных количествах! Без паники: это обычный витамин С. Медслужба исправно получает десятки килограммов аскорбинки для витаминизации третьего блюда, и это мероприятие детально оговорено массой документов, указывающих, что, куда и сколько сыпать. Ну и напоследок: бромиды дают соленый вкус, так что добавить их незаметно куда-либо просто невозможно. Соленого чая с компотом не бывает даже в армии.Алексей Водовозов
Журнал «Российские аптеки» №20, 2012
Вам могут понравиться другие статьи:
 Подробности
ПодробностиГлобальное перегревание
Жара в городе переносится тяжелее, чем в сельской местности, особенно, если приходится долго стоять в пробках. Организм в такой ситуации подвергается тепловой травме, которая очень быстро переходит…
Подробнее Подробности
ПодробностиСолнце будет
Несмотря на то что у многих сорвались отпускные планы, лето и солнце никто не отменял. Кожу защищать от ультрафиолета нужно даже в средних широтах, не говоря уже о южны…
Подробнее Подробности
ПодробностиСобираем дорожную аптечку
Непростая ситуация с коронавирусом нарушила запланированные еще зимой отпускные зарубежные выезды, но собрать аптечку для поездок на дачи и более близких путешествий никогда не помешает. Какие сред…
Подробнее Подробности
ПодробностиИнтернет после пандемии
У COVID-19 множество самых различных последствий, в основном негативных. Но есть и несомненные плюсы: толчок к развитию науки, переосмысление роли медицины в обществе, ну и значимость Всемирной сет…
Подробнее Подробности
ПодробностиБархатные ручки
Салоны красоты, закрытые в апреле, заставили многих вспомнить о домашнем уходе за руками и ногтями. Ассортимент средств, которым под силу сделать кожу бархатистой, а ногти блестящими, действительно…
Подробнее Подробности
ПодробностиCила волос
Красивые волосы – это особое богатство, обладать которым хотели бы многие. Поэтому покупатели часто интересуются, какие именно средства помогут сделать их волосы более крепкими, густыми и блест…
ПодробнееБРОМ | Энциклопедия Кругосвет
Содержание статьиБРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79,904. Природный бром состоит из двух стабильных изотопов: 79Br (50,69 ат.%) и 81Br (49,31 ат.%), а всего известно 28 изотопов с массовыми числами от 67 до 94. В химических соединениях бром проявляет степени окисления от –1 до +7, в природе встречается исключительно в степени окисления –1.
История открытия.
Вплотную к открытию брома практически одновременно подошли сразу трое ученых, но официально признанным первооткрывателем суждено было стать только одному из них.
В 1825 молодой французский химик Антуан Жером Балар (Antoine-Jérôme Balard), работавший препаратором в Фармакологической школе при университете небольшого южного городка Монпелье, приступил к своим первым самостоятельным научным исследованиям. С древнейших времен Монпелье был знаменит своими соляными промыслами. Для добычи соли на берегу моря вырывали бассейны и заполняли их морской водой. После того, как под действием солнечных лучей вода испарялась, выпавшие кристаллы соли вычерпывали, а оставшийся маточный раствор (рапу) возвращали обратно в море.
Руководитель Балара, профессор Жозеф Англада (Joseph Anglada), поручил ему изучить химический состав сливаемого рассола и прибрежных морских водорослей. Действуя на рапу различными реактивами, Болар заметил, что при пропускании через нее хлора раствор приобретает интенсивный желтый цвет. Аналогично окрашивал хлор и щелочной экстракт золы водорослей. Вначале Балар предположил, что наблюдаемая окраска вызвана присутствием в исследуемых образцах иода, который, реагируя с хлором, и образует неизвестное вещество. Для начала он экстрагировал его последовательно эфиром и водным гидроксидом калия. Обработав полученный щелочной раствор пиролюзитом (MnO2) в сернокислой среде, Балар выделил неприятно пахнущую красно-бурую жидкость и попробовал разделить ее на составные части. Когда все попытки не принесли результата, стало ясно, что это новый элемент. Определив плотность и температуру кипения жидкости, а также изучив ее важнейшие химические свойства, 30 ноября 1825 Балар отправил доклад о своих опытах в Парижскую академию наук. В нем, в частности, для нового элемента было предложено название «мурид» (от латинского слова «muria» – рассол).
Для проверки сообщения была назначена комиссия из трех химиков: Луи Вокелена (Louis Nicolas Vauquelin), Луи Тенара (Louis Jacques Thénard) и Жозефа Гей-Люссака. Повторив описанные эксперименты, они подтвердили выводы Балара, но название «мурид» признали неудачным, т.к. что соляная кислота называлась тогда acidum muriaticum – муриевой (от гипотетического элемента мурия), а ее соли – муриатами и употребление столь похожих названий «мурид» и «мурий» могло вызвать недоразумения. Согласно рекомендации номенклатурного комитета при академии наук новый элемент было предложено назвать бромом от греческого brwmoV – зловонный. В России название «бром» утвердилось не сразу, в течение долгого времени для элемента № 35 использовались названия «вром», «мурид», и «вромид».
Позднее выяснилось, что впервые элементарный бром получил не Балар а студент известного немецкого химика Леопольда Гмелина Карл Левиг (Carl Jacob Löwig, Leopold Gmelin), который в 1825 в Гейдельбергском университете выделил его из воды источника в Крейцнахе. Пока он приготовлял большее количество препарата для исследования, появилось сообщение Балара.
Вплотную к открытию брома подошел и знаменитый немецкий химик Юстус Любих, точно так же, как и Балар, принявший его за соединение хлора и иода.
Можно сказать, что открытие брома лежало на поверхности, и французский химик Шарль Жерар (Charles Frédéric Gerhardt) сказал даже, что «Не Балар открыл бром, а бром открыл Балара».
В природе бром почти всегда встречается вместе с хлором в виде изоморфной примеси в природных хлоридах (до 3% в сильвине KCl и карналлите KCl·MgCl2·6H2O). Собственные минералы брома: бромаргирит AgBr, бромсильвинит KMgBr3·6H2O и эмболит Ag(Br, Cl) – встречаются редко и промышленного значения не имеют. Они были открыты гораздо позже элементарного брома (бромаргирит – в Мексике, в 1841). Кларк (среднее содержание в земной коре) брома в земной коре составляет 2,1·10–4%.
Большое количество брома содержится в гидросфере Земли (около 3/4 от имеющегося в земной коре): в океанах (6,6·10–3%), соляных озерах, подземных рассолах и грунтовых водах. Наибольшая концентрация растворенных бромидов – около 6 мг/л – отмечена в воде Мертвого моря, а общее количество брома в нем оценивается в 1 млрд. тонн. Вместе с брызгами соленой воды соединения брома попадают в атмосферу.
Бром есть и в живых организмах. Содержание брома в живой фитомассе составляет 1,6·10–4%. В человеческом теле средняя концентрация брома составляет около 3,7 мг/кг, большая часть его сосредоточена в мозге, печени, крови и почках. Среди неорганических анионов, входящих в состав крови бромид-ион занимает пятое место по количеству после хлорида, гидрокарбоната, фосфата и сульфата; его концентрация в плазме крови находится в пределах 20–150 мкмоль/л. Некоторые животные, грибы и растения (прежде всего бобовые), способны накапливать бром, особенно много его в морских рыбах и водорослях.
Получение брома.
Промышленное производство брома началось в 1865 на базе Страссфуртского соляного месторождения в Германии, двумя годами позже бром стали добывать в США, в штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована возможность добычи брома из морской воды, а в 1934 организовано промышленное производство, основанное на этом методе. В России первый бромный завод был построен в 1917 на соляном озере Сакское.
Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
MgBr2 + Cl2 = MgCl2 + Br2
При получении брома методом выдувания исходное сырье (рапу соляных озер, попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой до pH»3,5 и обрабатывают избыточным количеством хлора. Затем рассол, содержащий растворенный бром, подают в верхнюю часть колонны, заполненной небольшими керамическими кольцами. Раствор стекает по кольцам, а навстречу ему продувают мощную струю воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь пропускают через раствор карбоната натрия:
3Na2CO3 + 3Br2 = 5NaBr + NaBrO3 + 3CO2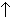
Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
5NaBr + NaBrO3 + 3H2SO4 = 3Na2SO4 + 3Br2 + 3H2O
Если содержание бромидов в исходном сырье достаточно велико, то вместо воздуха экономически выгоднее использовать водяной пар.
Другие предложенные способы извлечения брома из хлорированного рассола: экстракция углеводородами или адсорбция ионообменными смолами – не получили широкого распространения.
Часть используемых в промышленности растворов бромидов (в США до 35%) отправляют на повторную переработку с целью получения дополнительных количеств брома.
Мировое производство брома (по данным на 2003) составило около 550 тыс. тонн в год, большая часть его производится в США (39,4%), Израиле (37,6%), и Китае (7,7%). Динамика производства брома в различных странах мира приведена в таблице 1.
| Табл. 1. ДИНАМИКА МИРОВОГО ПРОИЗВОДСТВА БРОМА (в тыс. тонн). | |||||
| Страна | 1999 | 2000 | 2001 | 2002 | 2003 |
| США | 239 | 228 | 212 | 222 | 216 |
| Израиль | 181 | 210 | 206 | 206 | 206 |
| Китай | 42 | 42 | 40 | 42 | 42 |
| Великобритания | 55 | 32 | 35 | 35 | 35 |
| Иордания | – | – | – | 5 | 20 |
| Япония | 20 | 20 | 20 | 20 | 20 |
| Украина | 3 | 3 | 3 | 3 | 3 |
| Азербайджан | 2 | 2 | 2 | 2 | 2 |
| Франция | 1,95 | 2 | 2 | 2 | 2 |
| Индия | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Германия | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Италия | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| Туркменистан | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| Испания | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Всего в мире | 547 | 542 | 523 | 540 | 548 |
Цена элементного брома колеблется от 700 до 1000 долл. за тонну. Годовая потребность России в броме оценивается в 20–25 тыс. тонн, она удовлетворяется, в основном, за счет импорта из США и Израиля.
В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде.
MnO2 + 2H2SO4 + 2NaBr = Br2 + MnSO4 + Na2SO4
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
Простое вещество.
Бром – единственный неметалл, жидкий при комнатной температуре. Элементный бром представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20° C – 3,1 г/см3, температура кипения +59,82° C), пары брома имеют желто-бурый цвет. При температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском.
В твердом, жидком и газообразном состоянии бром существует в виде двухатомных молекул Br2, заметная диссоциация на атомы начинается только при 800° C, диссоциация происходит и под действием света. Элементный бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами, эти реакции зачастую сопровождаются воспламенением (например, с фосфором, сурьмой, оловом):
2S + Br2 = S2Br2
2P + 3Br2 = 2PBr3; PBr3 + Br2 = 2PBr5
2Al + 3Br2 = 2AlBr3
Ni + Br2 = NiBr2
Многие металлы медленно реагируют с безводным бромом из-за образования на их поверхности пленки бромида, нерастворимого в броме. Из металлов наиболее устойчивы к действию брома (даже при повышенных температурах и в присутствии влаги) серебро, свинец, платина и тантал. Золото, в отличие от платины, легко реагирует с ним, образуя AuBr3.
В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты:
2NH3 + 6Br2 = N2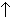 + 6HBr
+ 6HBr
3Br2 + S + 4H2O = 6HBr + H2SO4
Бром умеренно растворим в воде (3,58 г в 100 г при 20° C), при охлаждении этого раствора до 6° C из него выпадают гранатово-красные кристаллы клатратного гидрата брома состава 6Br2·46H2O. Растворимость брома существенно возрастает при добавлении бромидов за счет образования прочных комплексных соединений:
KBr + Br2 = KBr3
В водном растворе брома («бромной воде») существует равновесие между молекулярным бромом, бромид-ионом и оксокислотами брома:
Br2 + H2O = HBr + HBrO
В насыщенном растворе бром диссоциирован на 0,85%, в 0,001-молярном – на 17%.
При хранении бромной воды на свету она постепенно разлагается с выделением кислорода из-за фотолиза бромноватистой кислоты:
2HOBr + hv = 2HBr + O2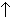
При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы:
Br2 + 2NaOH = NaBr + NaBrO + H2O (при t
3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
Вследствие высокой химической активности брома, для его транспортировки используются цистерны с внутренней свинцовой или никелевой обкладкой. Малые объемы брома хранят в стеклянной посуде.
Соединения брома.
Известны химические соединения брома, в которых он может проявлять степени окисления –1, 0, +1, +3, +5 и +7. Наибольший практический интерес представляют вещества, содержащие бром в степени окисления –1, к ним относятся бромоводород, а также неорганические и органические бромиды. Соединения брома в положительных степенях окисления представлены, в основном, кислородными кислотами брома и их солями; все они являются сильными окислителями.
Бромоводород HBr, представляет собой ядовитый (ПДК = 2 мг/м3) бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. При охлаждении до –67° C бромоводород переходит в жидкое состояние. HBr хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода, в растворе HBr диссоциирует на ионы:
HBr + H2O = H3O+ + Br–
Водный раствор HBr называется бромоводородной кислотой, она относится к числу сильных кислот (pKa = –9,5). В HBr бром имеет степень окисления –1 и поэтому бромоводородная кислота проявляет восстановительные свойства, она окисляется концентрированной серной кислотой и кислородом воздуха (на свету):
H2SO4 + 2HBr = Br2 + SO2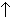 + 2H2O
+ 2H2O
4HBr + O2 = 2Br2 + 2H2O
При взаимодействии с металлами, а также с оксидами и гидроксидами металлов бромоводородная кислота образует соли – бромиды:
HBr + KOH = KBr + H2O
В промышленности бромоводород получают прямым синтезом из элементов в присутствии катализатора (платины или активированного угля) H2 + Br2 = 2HBr и, в качестве побочного продукта, при бромировании органических соединений:
В лаборатории HBr может быть получен при действии концентрированной фосфорной кислоты на бромиды щелочных металлов при нагревании:
NaBr + H3PO4 = NaH2PO4 + HBr
Удобным лабораторным методом синтеза HBr является также взаимодействие брома с бензолом или декалином в присутствии железа:
C10H18 + Br2 = C10H17Br + HBr
Бромоводород применяется для получения бромидов и некоторых органических соединений брома.
Бромид калия KBr – бесцветное кристаллическое вещество, хорошо растворимое в воде (65 г в 100 г воды при 20° C), tпл = 730° C. Бромид калия применяется при изготовлении фотоэмульсий и в качестве противовуалирующего вещества в фотографии. KBr хорошо пропускает инфракрасные лучи и поэтому служит материалом для изготовления линз для ИК-спектроскопии.
Бромид лития LiBr, представляет собой бесцветное гигроскопичное вещество (tпл = 552° C), хорошо растворимое в воде (63,9% при 20° C). Известен кристаллогидрат LiBr·2H2O. Бромид лития получают при взаимодействии водных растворов карбоната лития и бромоводородной кислоты:
Li2CO3 + 2HBr = 2LiBr + H2O + CO2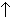
Бромид лития применяют при лечении психических заболеваний и хронического алкоголизма. Из-за высокой гигроскопичности LiBr используется как осушающее вещество в системах кондиционирования воздуха и для обезвоживания минеральных масел.
Бромноватистая кислота HOBr относится к слабым кислотам, она существует лишь в разбавленных водных растворах, которые получают взаимодействием брома с суспензией оксида ртути:
2Br2 + 2HgO + H2O = HgO·HgBr2Ї + 2HOBr
Соли бромноватистой кислоты называются гипобромитами, они могут быть получены взаимодействием брома с холодным раствором щелочи (см. выше), при нагревании щелочных растворов гипобромиты диспропорционируют:
3NaBrO = 2NaBr + NaBrO3
Степени окисления брома +3 соответствует бромистая кислота HBrO2, которая в настоящее время не получена. Известны только ее соли – бромиты, которые можно получить окислением гипобромитов бромом в щелочной среде:
Ba(BrO)2 + 2Br2 + 4KOH = Ba(BrO2)2 + 4KBr + 2H2O
Бромноватая кислота HBrO3 получена в растворах при действии разбавленной серной кислоты на растворы ее солей – броматов:
Ba(BrO3)2 + H2SO4 = 2HBrO3 + BaSO4Ї
При попытке получения растворов с концентрацией выше 30% бромноватая кислота разлагается со взрывом.
Бромноватая кислота и броматы являются сильными окислителями:
2S + 2NaBrO3 = Na2SO4 + Br2+ SO2.
Бромат калия KBrO3 – бесцветное кристаллическое вещество, растворимое в воде (в 100 г воды при 20° C растворяется 6,9 г KBrO3, при 100° C – 49,7 г). При нагревании до 434° C разлагается без плавления:
2KBrO3 = 2KBr + 3O2
Бромат калия получают электролизом растворов KBr или взаимодействием гидроксида калия с бромом и хлором:
12KOH + Br2 + 5Cl2 = 2KBrO3 + 10KCl +6H2O
KBrO3 применяется в аналитической химии в качестве окислителя при броматометрическом титровании, он входит в состав нейтрализаторов для химической завивки.
Наиболее устойчивой из оксокислот брома является бромная кислота HBrO4, которая существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 – самый сильный окислитель среди кислородных кислот брома, окислительно-восстановительные реакции с ее участием протекают очень медленно. Так, например, бромная кислота не выделяет хлор из одномолярного раствора соляной кислоты, хотя эта реакция термодинамически выгодна. Особая устойчивость иона BrO4– связана с тем, что атомы кислорода, окружая атом брома по тетраэдру, эффективно защищают его от атаки восстановителя. Растворы бромной кислоты можно получить подкислением растворов ее солей – перброматов, которые, в свою очередь, синтезируют электролизом растворов броматов, а также окислением щелочных растворов броматов фтором или фторидами ксенона:
NaBrO3 + XeF2 + 2NaOH = NaBrO4 + 2NaF + Xe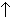 + H2O
+ H2O
Из-за сильных окислительных свойств перброматов они были синтезированы только во второй половине 20 в. американским ученым Эваном Эпплманом (Evan H.Appelman) в 1968.
Кислородные кислоты брома и их соли могут быть использованы в качестве окислителей.
Биологическая роль и токсичность соединений брома.
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Некоторые исследователи полагают, что соединения брома участвуют в деятельности эозинофилов – клеток иммунной системы. Пероксидаза эозинофилов окисляет бромид-ионы до бромноватистой кислоты, которая помогает разрушать чужеродные клетки, в том числе и раковые. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи.
Элементный бром ядовит. Жидкий бром вызывает трудно заживающие ожоги, при попадании на кожу его нужно смыть большим количеством воды или раствора соды. Пары брома в концентрации 1мг/м3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м3) – удушье и смерть. При отравлении парами брома рекомендуется вдыхать аммиак. Токсичность соединений брома менее велика, тем не менее, при длительном употреблении бромсодержащих препаратов может развиться хроническое отравление – бромизм. Его симптомы – общая вялость, появление сыпи на коже, апатия, сонливость. Бромид-ионы, поступая в организм в течение длительного времени, препятствуют накоплению иода в щитовидной железе, угнетая ее деятельность. Для ускорения выведения брома из организма назначают диету с большим содержанием соли и обильное питье.
Применение брома и его соединений.
Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до нашей эры из моллюсков вида «мурекс», накапливающих бром из морской воды. Процесс извлечения красителя был очень трудоемок (из 8000 моллюсков можно получить всего 1 грамм пурпура) и позволить себе носить окрашенную им одежду могли только очень богатые люди. В древнем Риме носить ее могли только представители высшей власти, поэтому он получил название «королевский пурпур». Структуру действующего начала этого красителя установили только во второй половине 19 в., им оказалось соединение брома – 6,6’– диброминдиго. Бромпроизводные индиго, синтезируемые искусственно, используются для окрашивания тканей (в основном, хлопковых) и сейчас.
В 19 в. главными областями использования соединений брома были фотография и медицина.
Бромид серебра AgBr стал применяться как светочувствительный материал около 1840. Современные фотоматериалы на основе AgBr позволяют делать снимки с выдержкой 10–7 секунды. Для изготовления фотопленки на основе бромида серебра, эта соль синтезируется в водном растворе желатина, при этом выпавшие кристаллики AgBr равномерно распределяются по всему объему раствора. После застывания желатина образуется тонкодисперсная суспензия, которую тонким слоем (толщиной от 2 до 20 мкм) равномерно наносят на поверхность носителя – прозрачной пленки, изготовленной из ацетата целлюлозы. В каждом квадратном сантиметре полученного слоя содержится несколько сот миллионов зерен бромида серебра, окруженных желатиновой пленкой. При попадании света на такую фотопленку происходит фотолитическое разложение AgBr:
AgBr + hv = Ag + Br
Протеканию в фотоэмульсии обратного процесса – окисления серебра бромом, препятствует желатина. Фотолиз приводит к образованию в микрокристаллах AgBr групп атомов серебра с размерами 10–7–10–8 см, так называемых центров скрытого изображения. Для получения видимого изображения бромид серебра на засвеченных участках восстанавливают до металлического серебра. Центры скрытого изображения катализируют (ускоряют) реакцию восстановления и позволяют провести ее, практически не затронув неосвещенных кристалликов AgBr. После растворения оставшегося бромида серебра на фотопленке получается черно-белое изображение (негатив), устойчивое к действию света. Для создания позитивного изображения нужно повторить процесс, освещая (обычно) фотобумагу через пленку, на которой с негативным изображением.
Соли брома оказались очень эффективными лекарственными средствами для лечения многих нервных болезней. Знаменитый русский физиолог И.П.Павлов сказал: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром». Использование KBr в медицине в качестве седативного (успокоительного) и противосудорожного средства при лечении эпилепсии началось в 1857. В то время водные растворы бромида калия и натрия были известны под общим названием «бром». В течение долгого времени механизм действия препаратов брома оставался неизвестным, считалось, что бромиды уменьшают возбудимость, действуя аналогично снотворным. Лишь в 1910 один из учеников Павлова П.М.Никифоровский экспериментально показал, что бромиды усиливают процессы торможения в центральной нервной системе. Сейчас бромиды натрия и калия практически вышли из употребления при лечении нервных заболеваний. Они были вытеснены более эффективными броморганическими препаратами.
В начале 20 в. открылась новая область применения брома. С распространением автомобилей появилась нужда в больших количествах дешевого бензина, вместе с тем существующая в то время нефтяная промышленность не могла производить требуемые объемы высокооктанового горючего. Для улучшения качества топлива – уменьшения его способности к детонации в двигателе – в 1921 американский инженер Томас Мидгли (Thomas Midgley) предложил вводить в бензин дополнительный компонент – тетраэтилсвинец (Pb(C2H5)4, ТЭС). Эта добавка оказалась очень эффективной, но при ее использовании возникла новая проблема – отложения свинца в двигателях. Чтобы избежать их образования, ТЭС растворяют в бромуглеводородах – 1,2 -дибромэтане (BrCH2CH2Br) и этилбромиде (C2H5Br), полученная смесь получила название «этиловая жидкость» (см. ОКТАНОВОЕ ЧИСЛО). Механизм ее действия заключается в том, что при совместном сгорании бромуглеводородов и ТЭС образуются летучие бромиды свинца, которые выносятся из двигателя вместе с выхлопными газами. В середине прошлого века на производство этиловой жидкости расходовалась большая часть производимого брома – 75% в 1963. Сейчас использование этиловой жидкости не соответствует современным требованиям экологической безопасности и ее мировое производство сокращается: в России, например, доля этилированного (содержащего этиловую жидкость) бензина в общем объеме автомобильного топлива составляла в 1995 более 50%, а в 2002 – 0,4%. В России использование ТЭС запрещено с 2003, а в некоторых регионах– еще раньше (в Москве – с 1993).
Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества, защищающие материалы органического происхождения от воспламенения. Их используют для пропитки тканей, изделий из древесины и пластмасс, производства негорючих красок. В качестве антипиренов применяются, в основном, ароматические бромпроизводные: дибромстирол, тетрабромфталевый ангидрид, декабромдифенилоксид, 2,4,6-трибромфенол и другие. Бромхлорметан используется в качестве наполнителя огнетушителей, предназначенных для тушения электропроводки.
Значительная часть брома (в США – 24%) в форме бромидов кальция, натрия и цинка расходуется для изготовления буровых растворов, которые закачивают в скважины для увеличения объема добытой нефти.
До 12% брома идет на синтез пестицидов и инсектицидов, используемых в сельском хозяйстве и для защиты деревянных изделий (метилбромид).
Элементный бром и его соединения применяются в процессах водоочистки и водоподготовки. Бром иногда используют для мягкой дезинфекции воды в бассейнах при повышенной чувствительности к хлору. На эти цели расходуется 7% производимого брома.
Около 17% брома расходуется на производство фотографических материалов, фармацевтических препаратов и высококачественной резины (бромбутилкаучука).
Органические соединения брома применяют для ингаляционного наркоза (галотан – 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
Бромбутилкаучук получают в промышленности при неполном бромировании бутилкаучука – сополимера 97–98% изобутилена CH2=C(CH3)2 и ne 2–3% изопрена CH2=C(CH3)CH=CH2. В этом процессе происходит бромирование только изопреновых звеньев макромолекулы каучука:
–CH2 –C(CH3)=CH–CH2– + Br2 = –CH2–CBr(CH3) –CHBr–CH2–
Введение брома в бутилкаучук существенно повышает скорость его вулканизации. Бромбутилкаучук не имеет запаха, не выделяет вредных веществ при хранении и переработке, он отличается высокой степенью совулканизации с ненасыщенными каучуками и лучшей, чем у бутилкаучука, адгезией к другим полимерам. Галогенированные бутилкаучуки используются для герметизации резиновых изделий из других полимеров (например, в производстве автомобильных шин), для изготовления теплостойких транспортных лент с высоким сопротивлением истиранию, резиновых пробок, химически стойких обкладок емкостей.
Юрий Крутяков
Бром и его действие на организм человека. Справка
При обычных условиях бром – тяжелая жидкость с резким запахом, в отраженном свете темно фиолетового, почти черного цвета, в проходящем – темно красного; легко образует желто бурые пары. Температура плавления 7,25 °С, температура кипения 59,2 °С.
Бром растворим в воде (3,58 г в 100 г при 20 °С), в присутствии хлоридов (химические соединения хлора) и особенно бромидов (химические соединения брома) растворимость повышается, а в присутствии сульфатов понижается.
По реакционной способности бром занимает промежуточное положение между хлором и йодом. С другими галогенами (фтором, хлором, йодом) образует неустойчивые соединения, отличающиеся высокой химической активностью.
С кислородом и азотом бром непосредственно не реагирует даже при повышенных температурах, его нестойкие соединения с этими элементами получают косвенными методами. Бром также не вступает в реакцию с углеродом.
При взаимодействии со многими металлами бром образует бромиды. К действию брома устойчивы тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром – сильный окислитель.
Бром – довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37х10 4 (примерно 50 е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия, калия, магния и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома – бромаргирит (бромид серебра) и эмболит (смешанный хлорид и бромид серебра) – чрезвычайно редки.
Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в Кулундинской степи на Алтае.
Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения. Широко известны содержащие бром лекарственные препараты.
Бром ядовит: токсическая доза для организма составляет 3 г, летальная – от 35 г.
При содержании брома в воздухе 0,001% наблюдаются раздражение слизистых оболочек, головокружение, кровотечение из носа. При концентрации 0,02% – удушье, спазмы, заболевание дыхательных путей. Попадание на кожу жидкого брома вызывает зуд, при длительном действии образуются медленно заживающие язвы.
Бром оказывает очень глубокое действие на лимфатические железы, в особенности на околоушную железу, яичники и яички. Он вызывает быстрое увеличение их в объеме и особого рода затвердение: пораженная железа тверда, как камень. Важная характеристика: поражаются железы только на левой стороне.
При внутреннем употреблении малых доз и очень высоких разведений бром производит своеобразное действие на головной и спинной мозг – он понижает интеллектуальную работоспособность и подавляет рефлекторную возбудимость, возбуждает сонливость.
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух. Для восстановления дыхания можно пользоваться тампоном, смоченным нашатырным спиртом, периодически поднося его к носу пострадавшего на короткое время. Дальнейшее лечение должно проводиться под наблюдением врача.
При бытовом отравлении бромом или бромидами, принятыми внутрь: дать пострадавшему молока с размешанным в нем яйцом, несколько раз вызвать рвоту, контролируя, чтобы рвотные массы не попали в дыхательные пути. Можно также дать выпить теплый крахмальный или мучной клейстер и активированный уголь. Внутрь для выведения брома из организма в течение дня необходимо принять 10 30 г поваренной соли в большом количестве воды (3 5 л). Дальнейшее лечение – симптоматическое.
Кожа, обожженная жидким бромом, промывается многократно водой.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Мерами индивидуальной защиты являются применение фильтрующих промышленных противогазов, резиновых перчаток, сапог, фартуков, строгое выполнение правил техники безопасности.
Материал подготовлен на основе информации открытых источников
Для чего нужен бром — Симптомы нехватки брома
Это вещество необходимо организму для погашения сильного возбуждения, гневливости, раздражительности, а еще бром нужен для выполнения различных функций в организме:
- Данный элемент возбуждает половую функцию, повышая число эякулята и сперматозоидов в нем,
- Располагает сдерживающим влиянием на ЦНС.
- Данный полезный микроэлемент имеется в содержании желудочного сока, оказывая влияние (вместе с хлором) на уровень его кислотности.
Ценность этого элемента для человека и ответ на вопрос ”для чего нужен бром?”, обозначил физиолог И.П. Павлов, утверждающий, что бром незаменимое вещество для нервной системы.
 креветки содержат бром
креветки содержат бромБром — когда нервы «шалят»
При повышенной нервности, степень этого полезного элемента в мозге и кровяном потоке, уменьшается.
Применяемые при терапии бромиды, при их приеме внутрь, расщепляются, что помогает выделиться ионам этого элемента, которые способны усилить процессы сдерживания.
Вследствие этих процессов, нормальные пропорции восстанавливаются, и функции ЦНС упорядочиваются.
Кроме того, этот полезный микроэлемент:
- Хранит от усиленной деятельности эндокринной железы, предупреждает возникновение эндемического зоба;
- Усиливает действие пепсина, амилазы, для переработки углеводов и жиров;
- Упорядочивает кислотность желудка;
- Гарантирует равновесие актов торможения, возбуждения ЦНС, обнаруживает успокоительное, антисудорожное влияние;
- Снижает умственные функции;
- Усиливает энергичность сперматозоидов;
- Активизирует работу надпочечников.
 фасоль содержит бром
фасоль содержит бромДопустимые дозы
Предположительная ежесуточная нуждаемость в броме: 0,5-2 мг.
Продукты содержащие бром
Источники микроэлемента.
В природе это вещество распространено в морских водах и в соленых озерах и в части хлорсодержащих веществ. Этим микроэлементом изобилуют:
- Фасоль;
- Горох;
- Чечевица; хранит от усиленной деятельности
 чечевица фасоль
чечевица фасольКроме того,
в 100 гр. Продукта, мкг
Морская капуста 250
Креветки 230
Треска 230
Пшеница 80
Ячневая крупа 70
Горох 40
Фасоль 40
Чечевица 40
Грецкие орехи 60
Арахис 60
Миндаль 60
Фундук 60
К существенным источникам этого вещества относятся ряд бромсодержащих лечебных препаратов.
Симптомы нехватки брома
Проявления дефицита:
- Увеличенная нервозность;
- Импотенция;
- Нарушение сна;
- Задержка роста у детей;
- Уменьшение числа гемоглобина;
- Повышенный риск выкидышей;
- Снижение длительности жизни;
- Низкая кислотность желудочного сока;
 треска
трескаПричины возникновения нехватки микроэлемента
Недостача микроэлемента отмечается сравнительно редко. Обычно, с пищевыми продуктами, его поступает достаточно, даже с погрешностями в рационе.
Иногда нехватку этого микроэлемента вызывают мочегонные средства, принимаемые в чрезмерном числе, поскольку он прекрасно растворяется в воде и удаляется вместе с мочой.
Препараты содержащие бром
Бромиды — медикаментозные препараты, с бромом, обладающие успокоительным влиянием:Натрия бромид, Калия бромид, Аммония бромид.
Признаки избытка
Главными приметами излишка этого микроэлемента являются:
- Снижение качества памяти;
- Расстройство сна;
- Раздражение кожных покровов;
- Сбои функции пищеварения,
- Бронхит;
- Энтерит;
- Неврологические отклонения;
Так как это вещество относится к токсичным элементам, то поступление чрезмерного его числа в организм повлечет за собой тяжелые нарушения.
Излишек этого микроэлемента может произойти по различным причинам, в частности:
- Превышение разрешенной концентрации данного элемента в воздухе;
- Непомерный прием средств, заключающих бром;
- По причине расстройства обменных процессов;
- При несоблюдении правил безопасности при производстве работ с этим токсичным веществом;
Бром — это… Что такое бром?
бромбром (от — «вонючка», «вонючий») — Химически активный неметалл, относится к группе галогенов. Простое вещество бром при нормальных условиях является тяжёлой едкой жидкостью красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно иода и хлора.
бромм.
1.Химический элемент, тяжелая красно-бурая жидкость с едким запахом, используемая в медицине, фотографии и т.п.
2.Лекарственный препарат, содержащий это вещество или его соединения ( обычно соли ) , применяемый как успокоительное и снотворное средство.
бром(( гр. bromos зловоние) хим. элемент из группы галогенов, символ Br ( лат. bromum), красно-бурая жидкость с резким, неприятным запахом; соединения примен. в медицине, фотографии, как инсектициды и др.
бромм.
1) Химический элемент, тяжелая красно-бурая жидкость с едким запахом, используемая в медицине, фотографии и т.п.
2) Лекарственный препарат, содержащий это вещество или его соединения (обычно соли), применяемый как успокоительное и снотворное средство.
муж. одно из химических начал, стихий, неразлагаемых или простых веществ, по свойствам своим близкое к иоду. Бромовый, состоящий из брома или от него происходящий; бромистый, содержащий в себе несколько брома.
бром[хим. элемент из группы галогенов, символ вг (лат. bromum), красно-бурая жидкость с резким, неприятным запахом; соединения примен. в медицине, фотографии, как инсектициды и др.
бромхимический элемент, красно-бурая дымящаяся на воздухе едкая жидкость, употребляемая в химии, а также в медицине, фотографии
бром(лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Назван от греч. bromos — зловоние. Тяжелая красно-бурая дымящая на воздухе жидкость с резким неприятным запахом; плотность 3,1 г/см3, tпл -7,25 °С, tкип 59,2 °С. Применяют как бромирующий агент, для получения бромидов, органических и других соединений брома, в аналитической химии. Бром ядовит.
бромм.
1) Химический элемент, тяжелая красно-бурая жидкость с едким запахом, используемая в медицине, фотографии и т.п.
2) Лекарственный препарат, содержащий это вещество или его соединения (обычно соли), применяемый как успокоительное и снотворное средство.
брома, м. (греч. bromos – дурной запах). Химический элемент, едкая жидкость буро-красного цвета с сильным запахом (хим.). Бром употребляется в медицине, фотографии и технике. || Бромистые соединения, употр. в медицине (апт.). Врач прописал мне бром.
бром(bromum, br; греч. bromos зловоние) химический элемент подгруппы галогенов VII группы периодической системы Д. И. Менделеева, ат. номер 35, ат. масса 79,904; тяжелая темно-бурая жидкость с резким запахом; Б. (в т. ч. его пары) токсичен для человека; используется для приготовления лекарственных средств.
бром(лат. Bromum), Br, химический элемент VII группы периодической системы Менделеева, относится к галогенам ; атомный номер 35, атомная масса 79,904; красно-бурая жидкость с сильным неприятным запахом. Б. открыт в 1826 французским химиком А. Ж. Баларом при изучении рассолов средиземноморских соляных промыслов; назван от греческого bromos — зловоние. Природный Б. состоит из 2 стабильных изотопов 79Br (50,54%) и 81Вг (49,46%). Из искусственно полученных радиоактивных изотопов Б. наиболее интересен 80Br, на примере которого И. В. Курчатовым открыто явление изомерии атомных ядер . Нахождение в природе. Содержание Б. в земной коре (1,6T10-4% по массе) оценивается в 1015-1016 т . В главной своей массе Б. находится в рассеянном состоянии в магматических породах, а также в широко распространённых галогенидах. Б. — постоянный спутник хлора. Бромистые соли (NaBr, KBr, MgBr
2) встречаются в отложениях хлористых солей (в поваренной соли до 0,03% Br, в калийных солях — сильвине и карналлите — до 0,3% Br), а также в морской воде (0,065% Br), рапе соляных озёр (до 0,2% Br) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1% Br). Благодаря хорошей растворимости в воде бромистые соли накопляются в остаточных рассолах морских и озёрных водоёмов. Б. мигрирует в виде легко растворимых соединений, очень редко образуя твёрдые минеральные формы, представленные бромиритом AgBr, эмболитом Ag (Cl, Br) и иодэмболитом Ag (Cl, Br, I). Образование минералов происходит в зонах окисления сульфидных серебросодержащих месторождений, формирующихся в засушливых пустынных областях. См. также Бромиды природные . Физические и химические свойства. При -7,2|С жидкий Б. застывает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском. Пары Б. жёлто-бурого цвета, t kип 58,78|С. Плотность жидкого Б. (при 20|С) 3,1 г/см
3. В воде Б. растворим ограниченно, но лучше других галогенов (3,58 г Б. в 100 г h3O при 20|С). Ниже 5,84|С из воды осаждаются гранатово-красные кристаллы Br2T8h3O. Особенно хорошо растворим Б. во многих органических растворителях, чем пользуются для извлечения его из водных растворов. Б. в твёрдом, жидком и газообразном состоянии состоит из 2-атомных молекул. Заметная диссоциация на атомы начинается при температуре около 800 |С; диссоциация наблюдается и при действии света. Конфигурация внешних электронов атома Б. 4 s 24 p 5 Валентность Б. в соединениях переменна, степень окисления равна — 1 (в бромидах, например KBr), + 1 (в гипобромитах, NaBrO), + 3 (в бромитах, NaBrO
4), + 5 (в броматах, KBrO
3) и + 7 (в перброматах, NaBrO
4). Химически Б. весьма активен, занимая по реакционной способности место между хлором и йодом. Взаимодействие Б. с серой, селеном, теллуром, фосфором, мышьяком и сурьмой сопровождается сильным разогреванием, иногда даже появлением пламени. Так же энергично Б. реагирует с некоторыми металлами, например калием и алюминием. Однако многие металлы реагируют с безводным Б. с трудом из-за образования на их поверхности защитной плёнки бромида, нерастворимого в Б. Из металлов наиболее устойчивы к действию Б., даже при повышенных температурах и в присутствии влаги, серебро, свинец, платина и тантал (золото, в отличие от платины, энергично реагирует с Б.). С кислородом, азотом и углеродом Б. непосредственно не соединяется даже при повышенных температурах. Соединения Б. с этими элементами получают косвенным путём. Таковы крайне непрочные окислы Br2O, BrO2 и Br3O8 (последний получают, например, действием озона на Б. при 80|С). С галогенами Б. взаимодействует непосредственно, образуя BrF3, BrF5, BrCl, IBr и др. (см. Межгалогенные соединения ). Б. — сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота (3Вr2 + 8Mh4 N2 + 6Nh5Br). Б. вытесняет йод из его соединений, но сам вытесняется хлором и фтором. Свободный Б. выделяется из водных растворов бромидов также под действием сильных окислителей (KMnO4, K2Cr2O
7) в кислой среде. При растворении в воде Б. частично реагирует с нейс образованием бромистоводородной кислоты HBr и неустойчивой бромноватистой кислоты HBrO. Раствор Б. в воде называется бромной водой . При растворении Б. в растворах щелочей на холоду происходит образование бромида и гипобромита (2NaOH + Br2 NaBr + NaBrO + h3O), а при повышенных температурах (около 100|С) — бромида и бромата (6NaOH + 3Br2 5NaBr + NaBrO3 + ЗН2О). Из реакций Б. с органическими соединениями наиболее характерны присоединение по двойной связи СС, а также замещение водорода (обычно при действии катализаторов или света). Получение и применение. Исходным сырьём для получения Б. служат морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие Б. в виде бромид-иона Br- (от 65 г/м 3в морской воде до 3-4 кг/м 3и выше в щелоках калийного производства). Б. выделяют при помощи хлора (2Вг- + Cl2 Br2 + 2С1-) и отгоняют из раствора водяным паром или воздухом. Отгонку паром ведут в колоннах, изготовленных из гранита, керамики или иного стойкого к Б. материала. Сверху в колонну подают подогретый рассол, а снизу — хлор и водяной пар. Пары Б., выходящие из колонны, конденсируют в керамиковых холодильниках. Далее Б. отделяют от воды и очищают от примеси хлора дистилляцией. Отгонка воздухом позволяет использовать для получения Б. рассолы с его низким содержанием, выделять Б. из которых паровым способом в результате большого расхода пара невыгодно. Из получаемой бромовоздушной смеси Б. улавливают химическими поглотителями. Для этого применяют растворы бромистого железа (2 FeBr2 + Br2 2FeBr
3), которое, в свою очередь, получают восстановлением FeBr3 железными стружками, а также растворы гидроокисей или карбонатов натрия или газообразный сернистый ангидрид, реагирующий с Б. в присутствии паров воды с образованием бромистоводородной и серной кислот (Br2 + 3O2 + 2h3O 2HBr + h3SO
4). Из полученных полупродуктов Б. выделяют действием хлора (из FeBr3 и HBr) или кислоты (5NaBr+ NaBrO3 + 3Н2SO4 3Вr2 + 3Na2SO4 + 3Н2О). В случае необходимости полупродукты перерабатывают на бромистые соединения, не выделяя элементарного Б. Вдыхание паров Б. при содержании их в воздухе 1 мг/м 3 и более вызывает кашель, насморк, носовое кровотечение, головокружение, головную боль; при более высоких концентрациях — удушье, бронхит, иногда смерть. Предельно допустимые концентрации паров Б. в воздухе 2 мг/м
3. Жидкий Б. действует на кожу, вызывая плохо заживающие ожоги. Работы с Б. следует проводить в вытяжных шкафах. При отравлении парами Б. рекомендуется вдыхать аммиак, используя для этой цели сильно разбавленный раствор его в воде или в этиловом спирте. Боль в горле, вызванную вдыханием паров Б., устраняют приёмом внутрь горячего молока. Б., попавший на кожу, смывают большим количеством воды или сдувают сильной струей воздуха. Обожжённые места смазывают ланолином. Б. применяют довольно широко. Он — исходный продукт для получения ряда бромистых солей и органических производных. Большие количества Б. расходуют для получения бромистого этила и ди-бромэтана — составных частей этиловой жидкости, добавляемой к бензинам для повышения их детонационной стойкости (см. Антидетонаторы ). Соединения Б. применяют в фотографии, при производстве ряда красителей, бромистый метил и некоторые другие соединения Б. — как инсектициды. Некоторые органические соединения Б. служат эффективными огнетушащими средствами. Б. и бромную воду используют при химических анализах для определения многих веществ. В медицине используют бромиды натрия, калия, аммония, а также органические соединения Б., которые применяют при неврозах, истерии, повышенной раздражительности, бессоннице, гипертонической болезни, эпилепсии и хорее.Лит.: Ксензенко В. И., Стасиневич Д. С., Технология брома и йода, М., 1960; Позин М. Е., Технология минеральных солей, 2 изд., Л., 1961; Bromine and its compounds, ed. Z. Е. Jolles, L.,
1966. В. К. Бельский, Д. С. Стасиневич.Бром в организме. Б. — постоянная составная часть тканей животных и растений. Наземные растения содержат в среднем 7T10-4% Б. на сырое вещество, животные ~1T10-4%/ Б. найден в различных секретах (слезах, слюне, поте, молоке, желчи). В крови здорового человека содержание Б. колеблется от 0,11 до 2,00 мг %. С помощью радиоактивного Б. (82Br) установлено избирательное поглощение его щитовидной железой, мозговым слоем почек и гипофизом. Введённые в организм животных и человека бромиды усиливают концентрацию процессов торможения в коре головного мозга, содействуют нормализации состояния нервной системы, пострадавшей от перенапряжения тормозного процесса. Одновременно, задерживаясь в щитовидной железе, Б. вступает в конкурентные отношения с йодом , что влияет на деятельность железы, а в связи с этим — и на состояние обмена веществ.Лит.: Войнар А. И., Биологическая роль микроэлементов в организме животных и человека, 2 изд., М., 1960; Верховская И. Н., Бром в животном организме и механизм его действия, М.,
1962. В. В. Ковальский.
бромпростое вещество Br2, в нормальных условияхкрасно-бурая жидкость с сильным неприятным запахом , микстура успокаивающего действия, содержащая бромид натрия или калия
Простая английская Википедия, бесплатная энциклопедия
 Пробирка с бромом в ней. Внизу находится бром в виде жидкости, а над ним — бром в виде газа. Трубка запаяна в акриловый куб.
Пробирка с бромом в ней. Внизу находится бром в виде жидкости, а над ним — бром в виде газа. Трубка запаяна в акриловый куб.Бром (Br) — химический элемент. Его атомный номер (то есть количество протонов в нем) — 35, а его атомный вес — 80. Он является частью элементов 7-й группы (галогенов) периодической таблицы. Он двухатомный, что означает, что два атома слипаются, образуя молекулу в любом образце брома.
Физические свойства [изменить | изменить источник]
Бром — жидкость красно-коричневого цвета. Жидкие элементы встречаются редко; только бром и ртуть являются жидкими при комнатной температуре. Он легко испаряется, образуя удушающие коричневые пары. Имеет неприятный запах. Его название означает «зловоние козлов». Он может стать металлом при очень высоких давлениях.
Имеет два стабильных изотопа. Это 79 рублей и 81 рублей. Есть около 29 других радиоактивных изотопов.
Химические свойства [изменить | изменить источник]
Бром довольно реакционноспособен.Его реакционная способность находится между хлором, который более активен, и йодом, который имеет меньшую реакционную способность. Реагирует с металлами и неметаллами. Фосфор бурно реагирует с бромом. Аналогично реагирует и алюминий. Он может отбеливать такие вещи, как хлор. Лучше реагирует на свет. Немного растворяется в воде. Горячая вода делает ее непропорциональной на бромистоводородную и бромистоводородную кислоты. Бром может образовывать соединения с такими веществами, как натрий, с образованием бромида натрия.
Химические соединения [изменить | изменить источник]
Бром образует соединения во многих степенях окисления: –1, +1, +3, +5 и (иногда) +7.–1 является наиболее распространенным. Встречается в виде бромида. Бромиды не реагируют. Это бесцветные твердые вещества, легко растворяющиеся в воде. Ковалентные бромиды могут быть жидкостями или газами. Все остальные соединения являются сильными окислителями. Их хлорные собратья встречаются чаще. +1 имеет гипобромиты, которые нестабильны. +3 имеет бромиты. Диоксид брома — единственное распространенное соединение брома, обнаруженное в степени окисления +4. +5 имеет броматы, которые встречаются чаще, чем все остальные, кроме бромидов.Броматы — сильные окислители, иногда их добавляют в муку. +7 имеет перброматы. Перброматы очень нестабильны.
Бром находится в виде бромида в океане и в бассейнах с рассолом. В Мертвом море много бромида. Бром не является важной частью нашего тела, в отличие от его родственников хлора и йода.
Бром получают барботированием газообразного хлора через раствор бромида.Бромид окисляется до брома, а хлор восстанавливается до хлорида.
В основном используется для получения броморганических соединений, органических соединений с бромом. Броморганические соединения используются для тушения пожаров. Раньше их добавляли в бензин. Некоторые использовались как пестициды. Некоторые неорганические бромиды использовались в качестве седативных средств. Бром также можно использовать в качестве дезинфицирующего средства. Бромид серебра используется в пленке.
Бром токсичен и вызывает коррозию кожи. Газообразный бром также вызывает раздражение при вдыхании.Бром может бурно реагировать со многими вещами.
,брома | Свойства, использование и факты
Бром (Br) , химический элемент, темно-красная ядовитая жидкость и член галогеновых элементов или Группы 17 (Группа VIIa) периодической таблицы.
бром Бром. Британская энциклопедия, Inc.Британская викторина
118 символов и названий периодической таблицы викторины
Si
| атомный номер | 35 |
|---|---|
| атомный вес | 79.909 |
| точка плавления | −7,2 ° C (19 ° F) |
| точка кипения | 59 ° C (138 ° F) |
| удельный вес | 3,12 при 20 ° C (68 ° F) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | (Ar) 3 d 10 4 с 2 4 p. 5 |
История
Бром был открыт в 1826 году французским химиком Антуаном-Жеромом Баларом в остатках (биттерах) производства морской соли в Монпелье.Он освободил элемент, пропустив хлор через водный раствор остатков, который содержал бромид магния. Перегонка материала с диоксидом марганца и серной кислотой дает красные пары, которые конденсируются в темную жидкость. Сходство этой процедуры с получением хлора подсказало Баларду, что он получил новый элемент, похожий на хлор. (Немецкий химик Юстус фон Либих, кажется, получил этот элемент раньше Баларда, но он ошибочно считал его хлоридом йода.) Из-за неприятного запаха элемента Французская академия наук предложила название бром от греческого слова bromos , что означает «неприятный запах» или «зловоние».
Возникновение и распространение
Редкий элемент, бром, встречается в природе и рассредоточен по всей земной коре только в виде растворимых и нерастворимых бромидов. Некоторое обогащение происходит в океанской воде (65 частей на миллион по весу), в Мертвом море (примерно 5 граммов на литр [0,7 унции на галлон]), в некоторых термальных источниках и в редких нерастворимых минералах бромида серебра (таких как бромирит, найдено в Мексике и Чили).Природные солевые отложения и рассолы являются основными источниками брома и его соединений. Иордания, Израиль, Китай и Соединенные Штаты были мировыми лидерами по производству брома в начале 21 века; другие важные страны-производители брома в этот период включают Японию, Украину и Индию.
Природный бром представляет собой смесь двух стабильных изотопов: брома-79 (50,54 процента) и брома-81 (49,46 процента). Из 17 известных радиоактивных изотопов элемента бром-77 имеет самый продолжительный период полураспада (57 часов).
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской. Подпишитесь сегодняФизические и химические свойства
Свободный бром представляет собой красновато-коричневую жидкость с заметным давлением пара при комнатной температуре. Пары брома имеют янтарный цвет. Бром имеет резкий запах и раздражает кожу, глаза и дыхательную систему. Воздействие концентрированных паров брома даже в течение короткого времени может быть смертельным. Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Около 3,41 грамма (0,12 унции) брома растворяются в 100 миллилитрах (0,1 кварте) воды при комнатной температуре. Раствор известен как бромная вода. Как и хлорная вода, он является хорошим окислителем, и он более полезен, потому что не так легко разлагается. Освобождает свободный йод из йодсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свете бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Из бромной воды можно выделить гидрат (клатрат), который содержит 172 молекулы воды и 20 полостей, способных вместить молекулы брома.Бром растворяется в водных растворах гидроксида щелочного металла с образованием бромидов, гипобромитов или броматов, в зависимости от температуры. Бром легко экстрагируется из воды органическими растворителями, такими как четыреххлористый углерод, хлороформ или сероуглерод, в которых он хорошо растворим. В органических растворителях дает оранжевый раствор.
Сродство к электрону у брома высокое и аналогично сродству хлора. Однако это менее мощный окислитель, в основном из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом.Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и эта разница отражается в химической реакционной способности брома, которая находится между реакционной способностью хлора и йода. Броморганическое соединение напоминает соответствующее хлорпроизводное, но обычно является более плотным, менее летучим, менее горючим и менее стабильным.
Бром сильно соединяется со щелочными металлами и фосфором, мышьяком, алюминием и сурьмой, но в меньшей степени с некоторыми другими металлами.Бром вытесняет водород из насыщенных углеводородов и присоединяется к ненасыщенным углеводородам, хотя и не так легко, как хлор.
Наиболее стабильная степень окисления элемента -1, в которой бром встречается в природе. Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO — ), +3 (бромит, BrO — 2 ), +5 (бромат, BrO — 3 ) и +7 (пербромат, BrO — 4 ).Первая энергия ионизации брома высока, и соединения, содержащие бром с положительной степенью окисления, стабилизируются соответствующими лигандами, в основном кислородом и фтором. Все соединения с степенями окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Производство и использование
Основным коммерческим источником брома является океаническая вода, из которой элемент извлекается путем химического замещения (окисления) хлором в присутствии серной кислоты посредством реакции
Продукт реакция представляет собой разбавленный раствор брома, из которого элемент удаляется продувкой воздуха.Затем свободный бром смешивается с диоксидом серы, и смешанные газы проходят вверх по колонне, по которой струйками стекает вода. В колонне происходит следующая реакция:
, в результате чего образуется смесь кислот, которая намного богаче бромид-ионом, чем морская вода. Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Технический бром обычно содержит до 0,3% хлора. Обычно его хранят в стеклянных бутылках или в бочках, покрытых свинцом или монелем.
В промышленном использовании брома преобладали соединения бромистого этилена (C 2 H 4 Br 2 ), который однажды добавляли в бензин с тетраэтилсвинцом для предотвращения осаждения свинца в двигателе. После отказа от этилированного бензина соединения брома в основном использовались в антипиренах, но бромистый этилен по-прежнему остается важным соединением из-за его использования для уничтожения нематод и других вредителей в почве. Бром также используется в производстве катализаторов, таких как бромид алюминия.
Бром используется и для других целей, например, для изготовления различных красителей и соединений тетрабромэтана (C 2 H 2 Br 4 ) и бромоформа (CHBr 3 ), которые используются в качестве жидкостей в датчиках из-за их высокого содержания. удельный вес. До появления барбитуратов в начале 20 века бромиды калия, натрия, кальция, стронция, лития и аммония широко использовались в медицине из-за их седативного действия. Бромид серебра (AgBr), важный компонент фотопленки, подобно хлориду и йодиду серебра, чувствителен к свету.Следы бромата калия (KBrO 3 ) добавляют в пшеничную муку для улучшения выпечки. Другие важные соединения брома включают бромистый водород (HBr), бесцветный газ, используемый в качестве восстановителя и катализатора в органических реакциях. Раствор газа в воде называется бромистоводородной кислотой, сильной кислотой, которая по своей активности по отношению к металлам, их оксидам и гидроксидам напоминает соляную кислоту.
.CDC | Факты о броме
CDC | Факты о бромеЧто такое бром
- Бром — это элемент природного происхождения, который при комнатной температуре является жидкостью.
- Имеет коричневато-красный цвет с запахом отбеливателя, растворяется в воде.
Где находится и как используется бром
- Бром естественным образом содержится в земной коре и морской воде в различных химических формах. Бром также можно найти в качестве альтернативы хлору в плавательных бассейнах.
- Продукты, содержащие бром, используются в сельском хозяйстве и санитарии, а также в качестве антипиренов (химические вещества, которые помогают предотвратить возгорание предметов).
- Некоторые бромсодержащие соединения исторически использовались в качестве седативных средств (лекарств, которые успокаивают или вызывают сонливость). Однако эти препараты по большей части больше не продаются на рынке США.
Как вы могли подвергнуться воздействию брома
- После попадания брома в воду вы можете подвергнуться воздействию зараженной воды.
- Если пища загрязнена бромом, вы можете подвергнуться воздействию этого зараженного продукта.
- После выброса газообразного брома в воздух вы можете подвергнуться опасности, вдыхая его пары.
- Воздействие брома на кожу может происходить при прямом контакте с жидким или газообразным бромом.
- Газообразный бром тяжелее воздуха, поэтому он оседает в низинах.
Как работает бром
- Бром действует путем прямого раздражения кожи, слизистых оболочек и тканей.
- Серьезность отравления, вызванного бромом, зависит от количества, пути и продолжительности воздействия, а также от возраста и состояния здоровья человека, подвергшегося воздействию.
Непосредственные признаки и симптомы воздействия брома
- Вдыхание газообразного брома может вызвать кашель, затрудненное дыхание, головную боль, раздражение слизистых оболочек (внутри рта, носа и т. Д.), Головокружение или слезотечение.
- Попадание на кожу жидкого или газообразного брома может вызвать раздражение кожи и ожоги. Жидкий бром, попадающий на вашу кожу, может сначала вызвать ощущение охлаждения, за которым следует чувство жжения.
- Проглатывание бромсодержащих соединений (комбинаций брома с другими химическими веществами) может вызвать различные эффекты в зависимости от соединения. Проглатывание большого количества брома за короткий период времени может вызвать такие симптомы, как тошнота и рвота (желудочно-кишечные симптомы).
- Эти признаки и симптомы не обязательно означают, что человек подвергался воздействию брома.
Долгосрочные последствия воздействия брома на здоровье
- У людей, переживших серьезное отравление, вызванное вдыханием (вдыханием) брома, могут быть долговременные проблемы с легкими.
- Люди, пережившие серьезное отравление бромом, также могут иметь долгосрочные последствия от повреждений, вызванных так называемым системным отравлением, например, повреждение почек или мозга из-за низкого кровяного давления.
Как защитить себя и что делать, если вы подверглись воздействию брома
- Во-первых, выйдите на свежий воздух, выйдя из зоны выброса брома. Переезд на свежий воздух — хороший способ снизить вероятность негативных последствий для здоровья от воздействия брома.
- Если выброс брома происходил на открытом воздухе, отойдите от области, где произошел выброс брома. Поднимитесь на как можно более высокую поверхность, потому что бром тяжелее воздуха и опускается на низины.
- Если выброс брома был в помещении, выйдите из здания.
- Если вы находитесь рядом с выбросом брома, координаторы по чрезвычайным ситуациям могут посоветовать вам либо эвакуироваться (покинуть) зону, либо «укрыться на месте» (оставаться на месте) внутри здания, чтобы избежать воздействия химического вещества.Для получения дополнительной информации об эвакуации во время химической чрезвычайной ситуации см. «Факты об эвакуации». Для получения дополнительной информации о укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте».
- Если вы считаете, что подверглись воздействию брома, вам следует снять одежду, быстро вымыть все тело водой с мылом и как можно скорее обратиться за медицинской помощью.
- Снятие одежды:
- Быстро снимите одежду, на которой может быть бром.Любую одежду, которую нужно натягивать через голову, следует отрезать от тела, а не надевать через голову.
- Если вы помогаете другим людям снимать одежду, старайтесь не прикасаться к загрязненным участкам и снимайте одежду как можно быстрее.
- Мытье себя:
- Как можно быстрее смойте с кожи весь бром большим количеством воды с мылом. Умывание водой с мылом поможет вам и другим людям избавиться от любых химических веществ на вашем теле.
- Если ваши глаза горят или ваше зрение нечеткое, промойте глаза простой водой в течение 10–15 минут. Если вы носите контакты, снимите их и наденьте вместе с загрязненной одеждой. Не кладите контакты обратно в глаза (даже если они не одноразовые). Если вы носите окуляр
Что такое бром? (с иллюстрациями)
Бром — это неметаллический химический элемент, который отличается тем, что является единственным неметаллическим элементом, который является жидким при комнатной температуре. Он очень токсичен и чрезвычайно реактивен, поэтому при обращении с ним требуется особая осторожность. Бром используется в различных промышленных соединениях и чистящих средствах, и его легко получить из ряда источников. Люди, у которых есть бассейн или гидромассажная ванна, возможно, уже знакомы с этим элементом в виде таблеток, которые используются для очистки воды.
 Чтобы активировать бром в гидромассажной ванне, необходимо использовать другие химические вещества.
Чтобы активировать бром в гидромассажной ванне, необходимо использовать другие химические вещества.Элемент обозначен символом Br в периодической таблице элементов, и он имеет атомный номер 35.Название происходит от греческого bromos , что означает «зловоние», что означает характерный резкий и неприятный запах брома. Он классифицируется среди галогенных элементов, которые обладают высокой реакционной способностью и способностью образовывать соли при воздействии металлов. Кроме того, все галогеновые элементы неметаллические, и они существуют во всех трех состояниях вещества при комнатной температуре или около нее.
 Поскольку запах брома, скорее всего, вытеснит человека из комнаты, некоторые химики считают, что им будет сложно получить серьезные травмы.
Поскольку запах брома, скорее всего, вытеснит человека из комнаты, некоторые химики считают, что им будет сложно получить серьезные травмы.Сам по себе бром представляет собой тяжелую красновато-коричневую жидкость. Он очень коррозионный, поэтому обращение с ним без защиты крайне нецелесообразно, а также он очень летуч. Пар имеет довольно неприятный запах, который также предупреждает людей об опасно высоких концентрациях брома.Некоторые химики считают, что тяжело получить серьезные травмы от брома, потому что запах выгонит человека из комнаты до того, как элемент нанесет ему вред. При работе с бромом по-прежнему рекомендуется прикрывать глаза, нос и рот, при этом всегда следует надевать перчатки.
 Мертвое море богато бромом.
Мертвое море богато бромом.Элемент был открыт в 1826 году Антуаном Баларом, который исследовал содержание воды в морских болотах. Помимо открытия и названия брома, Балард также работал над другими элементами, такими как хлор.К 1860 году элемент в больших масштабах производился из морской воды и отложений солей. Колодцы с рассолом по-прежнему являются одним из основных источников, а Мертвое море — еще одним богатым источником этого полезного элемента.
 Бром иногда используют для очистки воды в плавательных бассейнах.
Бром иногда используют для очистки воды в плавательных бассейнах.Бром используется не только для очистки воды, но и как антисептическое и дезинфицирующее средство. Фотохимические вещества также содержат его, и его можно найти в красителях, фумигантах и антидетонационных смесях для автомобилей. Люди могут заметить, что многие из этих соединений считаются токсичными и что их указания по обращению включают защиту глаз, дыхательных путей и кожи.
 Бром обозначен символом Br в периодической таблице элементов, и он имеет атомный номер 35.
Бром обозначен символом Br в периодической таблице элементов, и он имеет атомный номер 35.  Известно, что бром имеет резкий и неприятный запах.,
Известно, что бром имеет резкий и неприятный запах.,



