Aминокислоты — урок. Химия, 8–9 класс.
Аминокислоты — это органические вещества, в молекулах которых содержатся две функциональные группы: карбоксильная −COOH и аминогруппа −Nh3.
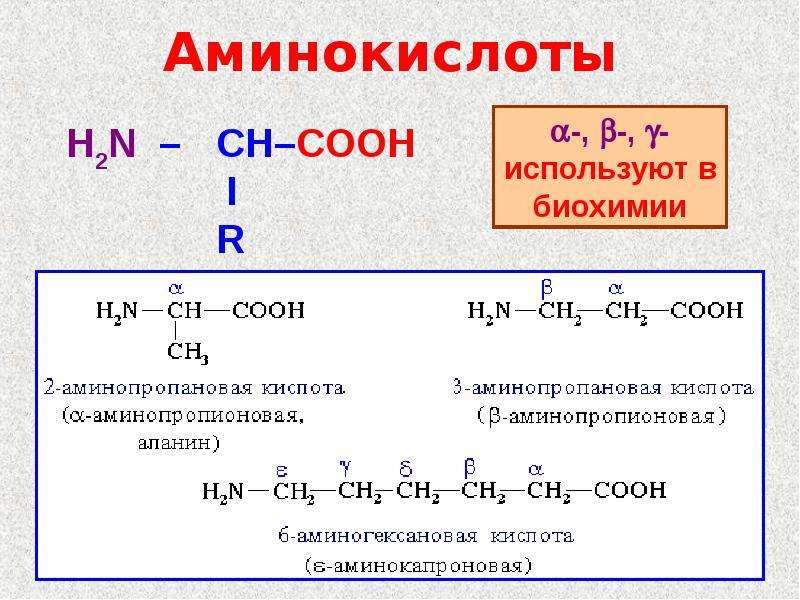
Состав аминокислот можно выразить формулой:
Примеры аминокислот
Аминокислоты — это производные карбоновых кислот, в молекулах которых вместо атома водорода содержится аминогруппа.
Самая простая аминокислота — аминоуксусная, или глицин .
Гомологом глицина является аланин. Его формулу можно записать следующим образом:
Аминокислоты могут содержать в радикале разные группы атомов. Так, в молекуле фенилаланина содержится бензольное кольцо. Его структурная формула:
В молекуле серина содержится гидроксильная группа:
В состав аминокислот могут также входить атомы некоторых элементов. Например, в молекуле цистеина содержится атом серы. Формула цистеина может быть представлена следующим образом:
Физические свойства
Аминокислоты — кристаллические вещества, хорошо растворимые в воде.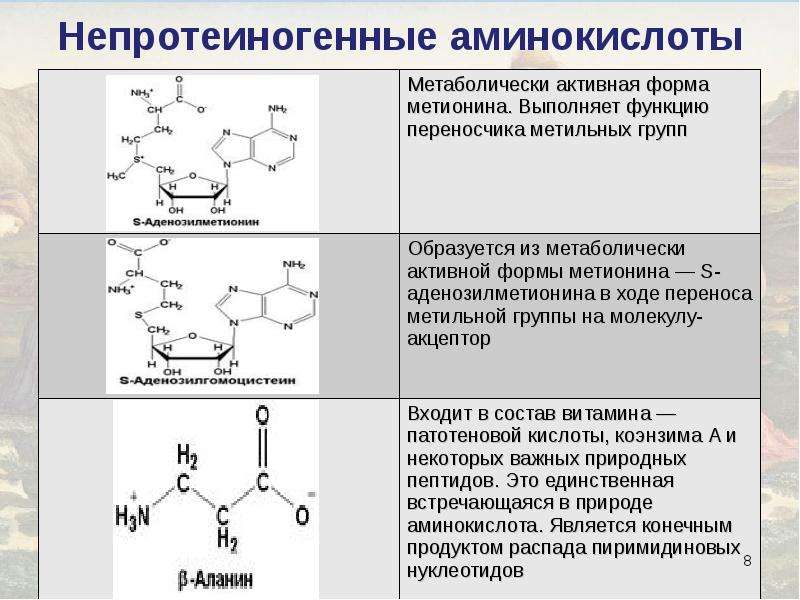 Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.
Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.Химические свойства
Функциональные группы определяют химические свойства аминокислот: карбоксильная — кислотные, а аминогруппа — основные. Основность аминогруппы связана со способностью атома азота присоединять к себе протоны водорода за счёт свободной электронной пары:
−N..h3+H+→−Nh4+.
Аминокислоты способны реагировать как с кислотами, так и с основаниями с образованием солей:
Аминокислоты — амфотерные органические соединения, имеющие одновременно кислотные и основные свойства.
Благодаря наличию двух функциональных групп аминокислоты способны взаимодействовать друг с другом и соединяться в более сложные вещества — пептиды:
При взаимодействии аминокислот образуются молекулы полимера (полипептида) и воды.
Реакция образования полимера, сопровождающаяся выделением низкомолекулярного вещества, называется реакцией поликонденсации.
Пептидная связь — связь, возникающая между остатком аминогруппы одной молекулы аминокислоты и остатком карбоксильной группы другой молекулы аминокислоты −NH−CO− в полипептидах.
Применение аминокислот
Аминокислоты используются как лекарства. В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).Урок 12. аминокислоты. белки — Химия — 10 класс
Химия, 10 класс
Урок № 12. Аминокислоты. Белки
Перечень вопросов, рассматриваемых в теме:
Глоссарий
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
Получение аминокислот
В промышленности α-аминокислоты получают гидролизом белков.
Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
Cl-CH2-COOH + 2NH3 → NH2-CH2-COOH + NH4Cl
Физические и химические свойства аминокислот
Аминокислоты – кристаллические вещества без цвета и запаха, сладковатые на вкус. Хорошо растворяются в воде.
Аминокислоты – амфотерные соединения, так как аминогруппа проявляет основные свойства, а карбоксильная группа – кислотные.
Карбоксильная группа в составе аминокислот позволяет им реагировать со спиртами. В результате реакции образуются сложные эфиры.
Ион водорода от карбоксильной группы может переходить к аминогруппе, в результате образуется биполярный ион.
Пептиды
Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.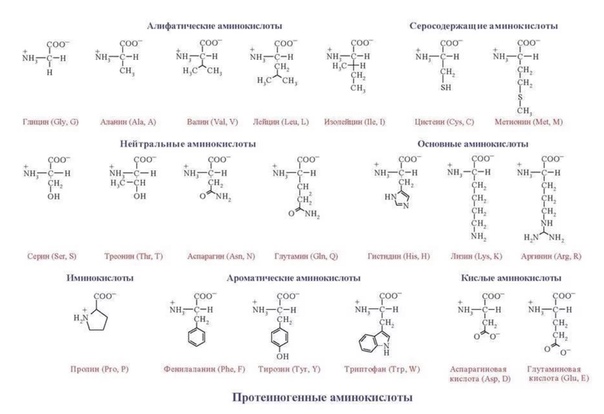
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
Структура белков
Последовательность остатков аминокислот в молекуле белка образует первичную структуру белка.
Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль.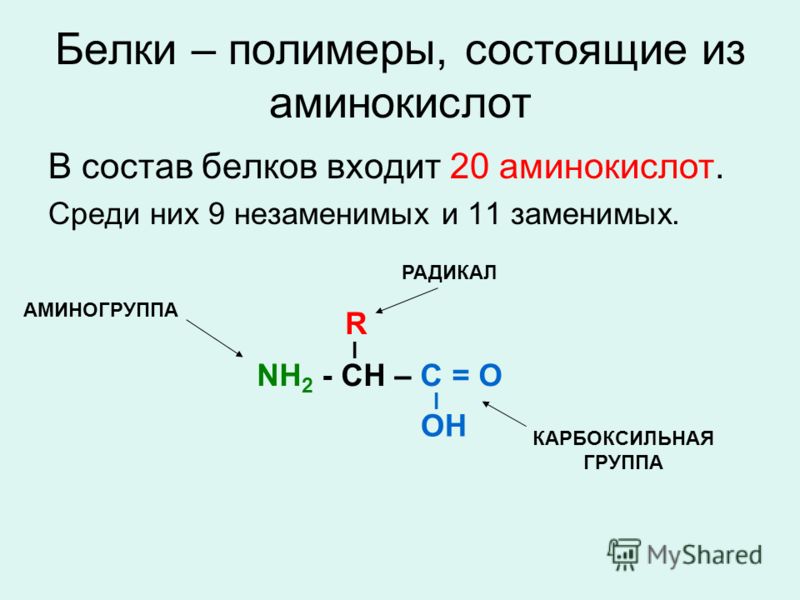 Образуется вторичная структура белка.
Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
Химические свойства белков
В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Превращения белков в организме
Белки являются обязательными компонентами в пищевом рационе человека. В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты. Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку.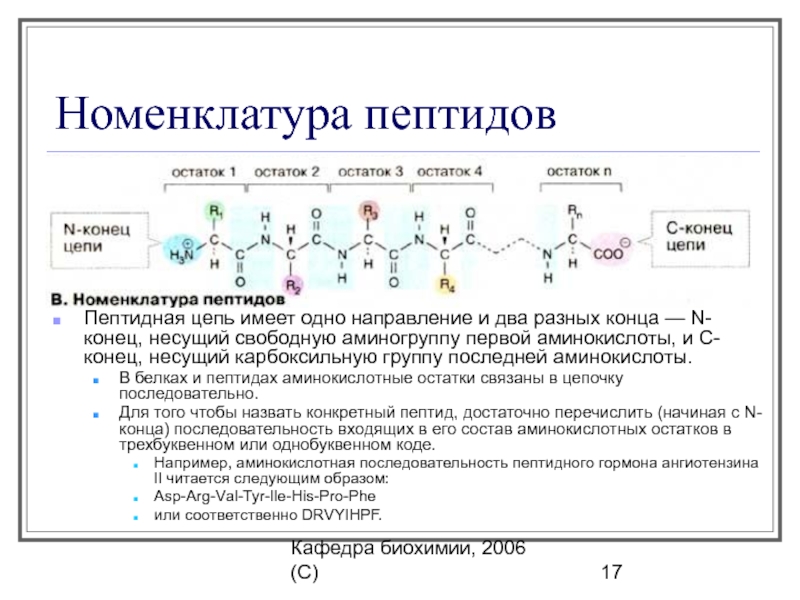 Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Успехи в изучении и синтезе белков
В 1954 г. британский биолог Фредерик Сенгер впервые расшифровал строение белка инсулина. Каждая молекула инсулина состоит из двух полипептидов, в одном из которых 21 остаток аминокислоты, а в другом – 30 аминокислотных остатков.
В 1967 г. был создан прибор – секвенатор, позволяющий определять последовательность остатков аминокислот в макромолекуле белка.
Первый белок, синтезированный в лаборатории в 1953 г. был окситоцин.
В настоящее время развивается наука, которая занимается синтезом искусственных белков, – генная инженерия.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Условие задачи: вычислите массовую долю азота в молекуле аспаргина
. Ответ запишите с точностью до десятых долей.
Ответ запишите с точностью до десятых долей.
Шаг первый: вычислить относительную молекулярную массу молекулы аспаргина:
М = 4·12 + 8·1 + 2·14 + 3·16 = 132 а.е.м.
Шаг второй: определить количество атомов азота в молекуле аспаргина и определить их относительную атомную массу:
2·14 = 28 а.е.м.
Шаг третий: определить массовую долю азота как отношение относительной атомной массы азота к относительной молекулярной массе аспаргина:
(28 : 132)·100 = 21,2 %.
Ответ: 21,2.
2. Решение задачи на определение количества различных олигопептидов, которые можно получить из определённого набора аминокислот.
Условие задачи: Сколько ди- и трипептидов можно составить из двух молекул аланина и одной молекулы цистеина?
Шаг первый: определить количество возможных дипептидов.
Из двух молекул аланина и одной молекулы цистеина можно составить три дипептида: Ala-Ala, Ala-Cys и Cys-Ala (два последних дипептида – разные соединения, так как в молекуле Ala-Cys карбоксильная группа аланина соединяется с аминогруппой цистеина, а в молекуле Cys-Ala карбоксильная группа цистеина соединяется с аминогруппой аланина).
Шаг второй: определить количество возможных трипептидов.
Ala-Ala-Cys, Ala-Cys-Ala, Cys-Ala-Ala – возможно составить 3 трипептида.
Ответ: 3 дипептида и 3 трипептида.
Химические свойства аминокислот | Химия онлайн
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворахВ водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН<7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+.
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН— .
2. Взаимодействие с основаниями и кислотамиАминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
Образуются соли:
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Образуются амиды:
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т. е представляют собой продукт поликонденсации a-аминокислот.
е представляют собой продукт поликонденсации a-аминокислот.
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Аминокислоты
Аминокислоты | CHEMEGE.RU
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) | цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) | NH2-CH(CH2C6H5)-COOH фенилаланин _________________________________ тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т.
 д.
д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| 2 – Аминобутановая кислота | 3-Аминобутановая кислота |
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
| α-Аминомасляная кислота | β-Аминомасляная кислота |
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):
| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |
1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
| Например, глицин реагирует с аланином с образованием дипептида (глицилаланин): |
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Например:
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита. Пример:
Для a-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы Nh3 – триамино и т.д.
Пример:
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
Тривиальные названия:
- Оптическая изомерия
Все a-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде зеркальных антиподов.
Оптическая изомерия природных a-аминокислот играет важную роль в процессах биосинтеза белка.
Свойства аминокислот
Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе
Химические свойства
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е.являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl = Cl— [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH = H2N–CH2–COO— Na+ + H2O
б) сложные эфиры
H+
H2N–CH2–COOH + C2H5OH = H2N–CH2–COOC2H5 + H2O
в) амиды
H2N–R–COOH + NH3 = H2N–R–CONH2 + H2O
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция для g-, d- e- и т.д. аминокислот), так и принадлежащих разным молекулам (межмолекулярная реакция).
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой кислоты, в результате которого образуется e-капролактам – полупродукт для получения капрона.
Межмолекулярное взаимодействие a-аминокислот приводит к образованию пептидов. При взаимодействии двух a-аминокислот образуется дипептид Межмолекулярное взаимодействие трех a-аминокислот приводит к образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
ХиМиК.ru — Химические реакции
I. Реакции карбоксильной группы. 1. Образование солей с основаниями. Подобно алифатическим кислотам, аминокислоты образуют соли с основаниями.Кроме обычных солей, они в известных условиях могут образовывать внутрикомплексные соли с катионами металлов. Очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные соли аминокислот с медью:
2. Образование эфиров. Действием на аминокислоты спирта и хлористого водорода получаются эфиры аминокислот:
Очень удобно проводить этерификацию аминокислот в присутствии хлористого тионила:
Метиловые и этиловые эфиры аминокислот — жидкости, легко перегоняющиеся в вакууме. Поэтому они были использованы для разделения смесей аминокислот (Э. Фишер).
Большое значение получили бензиловые эфиры аминокислот, применяемые в синтезе пептидов. Их получают действием бензилового спирта на аминокислоту в присутствии НСl или n-толуолсульфокислоты как катализатора;
Эфиры аминокислот под действием аммиака или аминов легко превращаются в соответствующие амиды
при обработке гидразином образуют гидразиды:
Действуя на гидразиды ацилированных аминокислот азотистой кислотой, можно получить азиды ациламинокислот
применяемые в синтезе пептидов.
При действии литийалюминийгидрида эфиры аминокислот восстанавливаются до аминоспиртов.
3. Образование галоидангидридов. При взаимодействии с пятихлористым фосфором аминокислоты образуют галоидангидриды:
Они крайне неустойчивы и существуют только в виде солей. Более устойчивы применяемые в синтезе пептидов галоидангидриды ацилированных аминокислот:
4. Д ек ар б о к си л и р о в а н и е. При отщеплении от аминокислот карбоксильной группы образуются амины:
II. Реакции аминной группы. 1. Образование солей с кислотами. С минеральными кислотами аминокислоты подобно аминам дают соли.
2. Действие азотистой кислоты. При действии азотистой кислоты образуется оксикислота и выделяются азот и вода:
Этой реакцией пользуются для количественного газометрического определения аминогрупп в аминокислотах, а также в белках и продуктах их распада (метод Ван-Сляйка).
Эфиры α-аминокислот образуют с азотистой кислотой стойкие и реакционноспособные диазосоединения.
3. Образование N-a ц и л и р о в а н н ы х производн ы х. Аминокислоты реагируют с хлорангидридами и ангидридами кислот, образуя N-ацилированные производные. Реакция проходит до конца только в водно-щелочных или неводных средах, так как во взаимодействие вступает аминная, а не аммонийная группа:
N-Ацилированные производные аминокислот имеют большое применение при синтезе пептидов.
Некоторые ацилированные аминокислоты имеют биологическое значение. С их образованием связано обезвреживание ядовитых веществ, всасывающихся в кровь из кишечника. Так, например, ядовитая бензойная кислота связывается глицином и удаляется из организма с мочой в форме гиппуровой кислоты:
4. Получение N-aлкилированных производн ы х. При действии галоидных алкилов, алкилсульфатов или диазометана на аминокислоты получаются моно- или ди-N-алкилзамещенные, называемые также вторичными и третичными аминокислотами. При дальнейшем алкилировании могут получаться четвертичные аммониевые основания. Их внутренние соли носят название бетаинов.
5. Получение N-a рилированных производных. Большое значение приобрели 2,4-динитрофенильные N-производные аминокислот, которые применяются для характеристики и количественного определения аминокислот, а также для исследования строения пептидов и белков. Эти производные получаются при взаимодействии аминокислот с 2,4-динитрофторбензолом в щелочной среде:
Так как в нитро- и динитробензолах в о— и п-положениях электронная плотность понижена (см. правила замещения в бензольном ядре), приведенная выше динитрофенильная группировка обладает ярко выраженными электроноакцепторными свойствами. Поэтому она оттягивает свободную электронную пару от атома азота, лишая его основных свойств. Этим объясняется тот факт, что в отличие от аминокислот динитрофениламинокислоты не амфотерны и хорошо растворимы в органических растворителях. Для N-(2,4-динитрофенил)-аминокислот характерна яркая желтая окраска и способность поглощать свет в ультрафиолетовой части спектра.
6. Получение аралкиламинокислот. При действии трифенилхлорметана в слабощелочной среде аминокислоты дают N-трифенилметильные («тритильные») производные:
Основные свойства аминогруппы в таких соединениях заметно ослаблены, а связь С—N сравнительно непрочна. Поэтому они легко гидролизуются при нагревании с разбавленной уксусной кислотой:
Эта особенность N-(трифенилметил)-аминокислот обусловила их использование в пептидном синтезе.
7. Взаимодействие с альдегидами. Аминокислоты легко реагируют с альдегидами. При взаимодействии с формальдегидом образуются N-монооксиметил аминокислоты и N,N-диоксиметиламинокислоты:
Эти производные титруются как алифатические кислоты, что используется для количественного определения аминокислот (Серенсен). При восстановлении N,N-диоксиметиламинокислот получаются N,N-диметиламинокислоты.
8. Взаимодействие с кетокислотами. α-Аминокислоты реагируют с кетокислотами при нагревании в водных растворах. В первой стадии реакции образуется нестойкое иминопроизводное
в котором затем происходит перемещение двойной связи, причем одновременно отщепляется двуокись углерода и мигрирует, атом водорода:
После гидролиза образуется новая аминокислота и альдегид:
В 1937 г. А. Н. Браунштейн и М. Г Крицман открыли происходящую в организме животных реакцию, получившую название реакции переаминирования. В результате этой реакции, протекающей по более сложному механизму, чем рассмотренный выше, аминогруппа переходит от α-аминокислоты к кетокислоте:
Реакции переаминирования принадлежит большая роль в процессах обмена аминокислот в природе.
9. Окислительное дезаминирование. Аминокислоты под влиянием многих окислителей, таких, как гипохлориты, хлорамин Т, персульфаты, отщепляя аммиак, превращаются в соответствующие кетокислоты:
Эта реакция, получившая название окислительного дезаминирования, протекает в организме животных под влиянием специфических ферментов.
10. Нингидринная реакция. В качестве реактива для качественного и количественного определения аминокислот широко применяется нингидрин (трикетогидринденгидрат). При нагревании с аминокислотой нингидрин восстанавливается до дикетооксигидриндена, а аминокислота окисляется и распадается на альдегид, двуокись углерода и аммиак:
Выделившийся аммиак конденсируется с молекулой образовавшегося дикетооксигидриндена и со второй молекулой нингидрина:
Аммонийная соль енольной формы образовавшегося соединения
благодаря наличию системы сопряженных двойных связей окрашена в интенсивный сине-фиолетовый цвет. По интенсивности окрашивания можно определить содержание аминокислоты в растворе. Иногда для этой цели измеряют количества двуокиси углерода, альдегида или аммиака, выделившихся при реакции с нингидрином.
Необходимо иметь в виду, что окрашивание с нингидрином дают не только аминокислоты, но также пептиды, первичные и вторичные амины.
III. Реакции, протекающие с одновременным участием карбоксильной и аминной групп. 1. Превращения аминокислот при нагревании. α-Аминокислоты, а еще легче их эфиры, при нагревании образуют циклические пептиды — дикетопиперазины:
β-Аминокислоты при нагревании образуют α,β-ненасыщенные кислоты с отщеплением аминогруппы и водорода от соседних атомов углерода:
γ-, δ- и ε-Аминокислоты, как и соответствующие оксикислоты, легко отщепляют воду и циклизуются, образуя внутренние амиды — лактамы:
Известны и β-лактамы, соответствующие β-аминокислотам. В частности, β-лактамное кольцо имеется в молекуле антибиотика пенициллина. Однако синтетическое получение β-лактамов сопряжено с большими трудностями.
2. Образование гидантоинов. α-Аминокислоты реагируют с мочевиной. Эта реакция проходит с участием аминной и карбоксильной групп и приводит к образованию гидантоинов:
При взаимодействии аминокислот с тиомочевиной образуются аналогично построенные тиогидантоины:
Химические свойства — Аминокислоты — Азотосодержащие органические соединения — Органическая химия
11 января 2007
Аминокислоты – это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н2N-СН2-СООН + HCl→ Сl[Н3N-СН2-СООН],
Н2N-СН2-СООН + NaOH → H2N-CH2-COONa + Н2О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2—СООН +Н3N-СН2—СОO–.
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин – щелочной (одна группа -СООН, две -NH2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H2N-CH(R)-COOH + R’OH H2N-CH(R)-COOR’ + Н2О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов.
Качественные реакции.
1) Все аминокислоты окисляются нингидрином
с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — желтый).
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рис. 1: Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху, синий кружок; внизу, все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизируются тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, растворенные в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембраны. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, а диаграмма отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
аминокислот | Введение в химию
Цель обучения
- Опишите структуру аминокислоты и особенности, которые придают ее специфическим свойствам
Ключевые моменты
- Каждая аминокислота содержит центральный атом C, аминогруппу (Nh3), карбоксильную группу (COOH) и определенную группу R.
- Группа R определяет характеристики (размер, полярность и pH) для каждого типа аминокислоты.
- Пептидные связи образуются между карбоксильной группой одной аминокислоты и аминогруппой другой путем дегидратационного синтеза.
- Цепочка аминокислот представляет собой полипептид.
Условия
- полипептид Любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.
- Группа R Группа R представляет собой боковую цепь, специфичную для каждой аминокислоты, которая придает определенные химические свойства этой аминокислоте.
- аминокислот Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном атоме углерода) и различные боковые цепи, которые объединяются через пептидные связи с образованием белков.
Структура аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и водородом. атом.В водной среде клетки как аминогруппа, так и карбоксильная группа ионизируются в физиологических условиях, и поэтому имеют структуры -NH 3 + и -COO —, соответственно. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R. Эта группа R или боковая цепь придает каждой аминокислоте специфические характеристики белков, включая размер, полярность и pH.
Аминокислотная структура Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).Эта аминокислота неионизирована, но если ее поместить в воду с pH 7, ее аминогруппа получит другой водород и положительный заряд, а гидроксил в своей карбоксильной группе потеряет водород и получит отрицательный заряд.Типы аминокислот
Название «аминокислота» происходит от аминогруппы и карбоксикислотной группы в их основной структуре. В белках присутствует 21 аминокислота, каждая из которых имеет определенную R-группу или боковую цепь. Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и они должны быть получены с пищей.Все организмы имеют разные незаменимые аминокислоты в зависимости от их физиологии.
Типы аминокислот В белках обычно встречается 21 общая аминокислота, каждая из которых имеет свою группу R (группа вариантов), которая определяет ее химическую природу. 21-я аминокислота, не показанная здесь, представляет собой селеноцистеин с группой R -CH 2 -SeH.Характеристики аминокислот
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Химический состав боковой цепи определяет характеристики аминокислоты.Аминокислоты, такие как валин, метионин и аланин, неполярны (гидрофобны), тогда как аминокислоты, такие как серин, треонин и цистеин, полярны (гидрофильны). Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные (с высоким pH) аминокислоты. Пролин является исключением из стандартной структуры анимокислоты, поскольку его группа R связана с аминогруппой, образуя кольцеобразную структуру.
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением.Например, валин обозначается буквой V или трехбуквенным символом val.
Пептидные облигации
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь. Когда две аминокислоты ковалентно связаны пептидной связью, карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются и высвобождают молекулу воды.Любая реакция, которая объединяет два мономера в реакцию, в которой образуется H 2 O в качестве одного из продуктов, известна как реакция дегидратации, поэтому образование пептидной связи является примером реакции дегидратации.
Образование пептидной связи Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.Полипептидные цепи
Образовавшаяся цепочка аминокислот называется полипептидной цепью.Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. При считывании или сообщении аминокислотной последовательности белка или полипептида принято использовать направление от N к C. То есть предполагается, что первая аминокислота в последовательности находится на N-конце, а последняя аминокислота — на C-конце.
Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой любой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые сложены должным образом, в сочетании с любыми дополнительными компонентами, необходимыми для правильного функционирования, и являются теперь работоспособен.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота AlaАланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость.В биосинтезе белков участвует только l-стереоизомер.
Аминокислота ArgУ человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован человеческим организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования в этих областях все еще продолжаются.Аргинин также может быть получен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота AsnВ 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка.Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Аминокислота GlnГлутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У человека глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота GluГлутаминовая кислота была выделена из пшеничного глютена в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычного промежуточного продукта α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты может действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (без d- или l-стереоизомеров). ). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Аминокислота His
Гистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Иле-аминокислота
Изолейцин был выделен из сахарной патоки свеклы в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он включен.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота лей
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма.Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота Lys
Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в способ функционирования гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете.Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Аминокислота Met
Метионин был выделен из казеина молочного белка в 1922 году, и его структура была решена лабораторным синтезом в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Аминокислота Phe
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Человеческое тело обычно способно расщеплять фенилаланин до тирозина, однако У людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен.Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro аминокислота
В 1900 году пролин был синтезирован химическим путем. На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих.Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота Ser
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года.Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота Thr
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота Trp
Структура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих.В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота Tyr
В 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году.Присутствующий только в l-стереоизомере в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится характерной, темнея на воздухе.
Val аминокислота
Структура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году. В белке млекопитающих присутствует только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным при отсутствии лечения.
Базовый
Структура Гли к Leu Asp к Gln Ала к Трп Тест
себя Автор
из 1 буквенных кодов | The Химия аминокислот Введение Аминокислоты играют центральную роль как строительные блоки белков и как промежуточные звенья в метаболизме. 20 аминокислот, которые содержатся в белки обладают широким спектром химической универсальности. В точное содержание аминокислот и последовательность этих аминокислот конкретный белок, определяется последовательностью оснований в ген, кодирующий этот белок.Химические свойства аминокислот белков определяют биологическую активность белка. Белки не только катализируют все (или большую часть) реакций в живых клетках, они контролировать практически все клеточные процессы. Кроме того, белки содержат в их аминокислотных последовательностях необходимая информация для определения как этот белок сворачивается в трехмерную структуру, и устойчивость полученной конструкции.Поле сворачивания белка и стабильность была критически важной областью исследований в течение многих лет, и остается сегодня одной из величайших неразгаданных загадок. Однако это активно исследуются, и прогресс наблюдается каждый день. Когда мы узнаем об аминокислотах, важно помнить, что из наиболее важных причин для понимания структуры и свойств аминокислот уметь понимать структуру и свойства белка.Мы будем увидеть, что чрезвычайно сложные характеристики даже небольшого, относительно Простые белки — это совокупность свойств аминокислот, которые содержат белок. Верх 10 аминокислот, которые мы можем производить, это аланин, аспарагин, аспарагиновая кислота. кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин. Тирозин вырабатывается из фенилаланина, поэтому при дефиците в рационе в фенилаланине также потребуется тирозин.Незаменимая аминокислота кислоты — аргинин (необходим молодым, но не взрослым), гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Эти аминокислоты необходимы в рационе. Растения, конечно, должен уметь производить все аминокислоты. С другой стороны, люди делают не иметь всех ферментов, необходимых для биосинтеза всех аминокислоты. Зачем изучать эти структуры
и свойства? | Атомы
в аминокислотах |
Первичная структура: аминокислоты связаны пептидными связями с образованием полипептидных цепей — биохимия
Белки представляют собой линейные полимеры , образованные путем связывания α-карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты с пептидная связь (также называемая амидной связью ).Образование дипептида из двух аминокислот сопровождается потерей молекулы воды (). Равновесие этой реакции находится на стороне гидролиза, а не синтеза. Следовательно, биосинтез пептидных связей требует ввода свободной энергии. Тем не менее, пептидные связи достаточно стабильны кинетически; время жизни пептидной связи в водном растворе в отсутствие катализатора приближается к 1000 лет.
Рис. 3.18
Образование пептидной связи. Связывание двух аминокислот сопровождается потерей молекулы воды.
Ряд аминокислот, соединенных пептидными связями, образуют полипептидную цепь , , и каждая аминокислотная единица в полипептиде называется остатком . Полипептидная цепь имеет полярность , потому что ее концы разные, с α-аминогруппой на одном конце и α-карбоксильной группой на другом. По соглашению, , амино-конец считается началом полипептидной цепи, , и поэтому последовательность аминокислот в полипептидной цепи записывается, начиная с аминоконцевого остатка.Таким образом, в пентапептиде Tyr-Gly-Gly-Phe-Leu (YGGFL) фенилаланин является амино-концевым (N-концевым) остатком, а лейцин — концевым карбоксильным (C-концевым) остатком (). Leu-Phe-Gly-Gly-Tyr (LFGGY) — это другой пентапептид с разными химическими свойствами.
Рисунок 3.19
Аминокислотные последовательности имеют направление. Эта иллюстрация пентапептида Tyr-Gly-Gly-Phe-Leu (YGGFL) показывает последовательность от аминоконца до карбоксильного конца. Этот пентапептид, лей-энкефалин, представляет собой опиоидный пептид, который модулирует восприятие (подробнее…)
Полипептидная цепь состоит из регулярно повторяющейся части, называемой основной цепью или основной цепью, и вариабельной части, содержащей отличительные боковые цепи (). Основа полипептида богата потенциалом водородных связей. Каждый остаток содержит карбонильную группу, которая является хорошим акцептором водородных связей, и, за исключением пролина, группу NH, которая является хорошим донором водородных связей. Эти группы взаимодействуют друг с другом и с функциональными группами из боковых цепей для стабилизации конкретных структур, как будет подробно описано.
Рисунок 3.20
Компоненты полипептидной цепи. Полипептидная цепь состоит из постоянной основной цепи (показана черным) и вариабельных боковых цепей (показана зеленым).
Большинство природных полипептидных цепей содержат от 50 до 2000 аминокислотных остатков и обычно называются белками . Пептиды, состоящие из небольшого количества аминокислот, называются олигопептидами или просто пептидами . Средняя молекулярная масса аминокислотного остатка составляет около 110, поэтому молекулярная масса большинства белков составляет от 5500 до 220 000.Мы также можем относиться к массе белка, которая выражается в дальтонах; один дальтон равен одной атомной единице массы. Белок с молекулярной массой 50 000 имеет массу 50 000 дальтон или 50 кД (килодальтон).
Дальтон—
Единица массы, почти равная единице массы атома водорода. Назван в честь Джона Далтона (1766-1844), который разработал атомную теорию материи.
В некоторых белках линейная полипептидная цепь сшита. Наиболее распространенными поперечными связями являются дисульфидные связи , из которых образуются в результате окисления пары остатков цистеина ().Полученная единица связанных цистеинов называется цистином . Внеклеточные белки часто имеют несколько дисульфидных связей, тогда как внутриклеточные белки их обычно не имеют. В некоторых белках редко присутствуют недисульфидные поперечные связи, происходящие из других боковых цепей. Например, таким образом укрепляются коллагеновые волокна в соединительной ткани и фибриновые сгустки крови.
Килодальтон (кД) —
Единица массы, равная 1000 дальтон.
Рисунок 3.21
Перекрестные ссылки.Образование дисульфидной связи из двух остатков цистеина является реакцией окисления.
3.2.1. Белки имеют уникальные аминокислотные последовательности, которые определяются генами
В 1953 году Фредерик Сэнджер определил аминокислотную последовательность инсулина, белкового гормона (). Эта работа является вехой в биохимии, поскольку она впервые показала, что белок имеет точно определенную аминокислотную последовательность . Более того, он продемонстрировал, что инсулин состоит только из 1 аминокислот, связанных пептидными связями между α-амино и α-карбоксильными группами.Это достижение побудило других ученых провести исследования последовательностей широкого спектра белков. Действительно, сейчас известны полные аминокислотные последовательности более чем 100 000 белков. Поразительным фактом является то, что каждый белок имеет уникальную, точно определенную аминокислотную последовательность . Аминокислотная последовательность белка часто упоминается как его первичная структура .
Серия точных исследований, проведенных в конце 1950-х и начале 1960-х годов, показала, что аминокислотные последовательности белков детерминированы генетически.Последовательность нуклеотидов в ДНК, молекула наследственности, определяет комплементарную последовательность нуклеотидов в РНК, которая, в свою очередь, определяет аминокислотную последовательность белка. В частности, каждая из 20 аминокислот репертуара кодируется одной или несколькими конкретными последовательностями из трех нуклеотидов (раздел 5.5).
Знание аминокислотных последовательностей важно по нескольким причинам. Во-первых, знание последовательности белка обычно необходимо для выяснения механизма его действия (например,g., каталитический механизм фермента). Более того, белки с новыми свойствами могут быть получены путем изменения последовательности известных белков. Во-вторых, аминокислотные последовательности определяют трехмерную структуру белков. Аминокислотная последовательность — это связь между генетическим посланием в ДНК и трехмерной структурой, которая выполняет биологическую функцию белка. Анализ отношений между аминокислотными последовательностями и трехмерными структурами белков раскрывает правила, которые управляют складыванием полипептидных цепей.В-третьих, определение последовательности — это компонент молекулярной патологии, быстро развивающейся области медицины. Изменения в аминокислотной последовательности могут вызвать нарушение функции и заболевание. Тяжелые, а иногда и смертельные заболевания, такие как серповидно-клеточная анемия и кистозный фиброз, могут быть результатом изменения одной аминокислоты в белке. В-четвертых, последовательность белка многое говорит о его эволюционной истории (см. Главу 7). Белки похожи друг на друга по аминокислотной последовательности только в том случае, если у них есть общий предок.Следовательно, молекулярные события в эволюции можно проследить по аминокислотным последовательностям; молекулярная палеонтология — это процветающая область исследований.
3.2.2. Полипептидные цепи гибкие, но с ограничениями по конформации
Изучение геометрии белкового остова выявляет несколько важных особенностей. Во-первых, пептидная связь по существу плоская (). Таким образом, для пары аминокислот, связанных пептидной связью, шесть атомов лежат в одной плоскости: α-атом углерода и группа CO от первой аминокислоты и группа NH и α-атом углерода от второй аминокислоты.Природа химической связи внутри пептида объясняет это геометрическое предпочтение. Пептидная связь имеет значительный характер двойной связи , который предотвращает вращение вокруг этой связи.
Рис. 3.23
Пептидные связи плоские. В паре связанных аминокислот шесть атомов (C α , C, O, N, H и C α ) лежат в одной плоскости. Боковые цепи показаны зелеными шарами.
Неспособность связи вращаться ограничивает конформацию пептидного остова и объясняет планарность связи.Этот характер двойной связи также выражается в длине связи между группами CO и NH. Расстояние C-N в пептидной связи обычно составляет 1,32 Å, что находится между значениями, ожидаемыми для одинарной связи C-N (1,49 Å) и двойной связи C = N (1,27 Å), как показано на. Наконец, пептидная связь не заряжается, что позволяет полимерам аминокислот, связанных пептидными связями, образовывать плотно упакованные глобулярные структуры.
Рис. 3.24
Типичная длина связи внутри пептидной единицы. Пептидная единица показана в транс-конфигурации.
Для плоской пептидной связи возможны две конфигурации. В транс-конфигурации два α-углеродных атома находятся на противоположных сторонах пептидной связи. В цис-конфигурации эти группы находятся на одной стороне пептидной связи. Почти все пептидные связи в белках являются транс-. Такое предпочтение транс-цис-формы можно объяснить тем, что стерические столкновения между группами, присоединенными к α-атомам углерода, препятствуют образованию цис-формы, но не происходят в транс-конфигурации ().Безусловно, наиболее распространенными цис-пептидными связями являются связи X-Pro. Такие связи менее предпочтительны для транс-конфигурации, поскольку азот пролина связан с двумя тетраэдрическими атомами углерода, ограничивая стерические различия между транс- и цис-формами ().
Рис. 3.25
Транс- и цис-пептидные связи. Трансформация пользуется большой популярностью из-за стерических конфликтов, которые происходят в цис-форме.
Рис. 3.26
Облигации Trans- и Cis X-Pro. Энергии этих форм относительно сбалансированы, поскольку стерические столкновения происходят в обеих формах.
В отличие от пептидной связи, связи между аминогруппой и α-атомом углерода и между α-атомом углерода и карбонильной группой являются чистыми одинарными связями. Две соседние жесткие пептидные единицы могут вращаться вокруг этих связей, принимая различную ориентацию. Эта свобода вращения вокруг двух связей каждой аминокислоты позволяет белкам складываться по-разному . Повороты вокруг этих связей могут быть заданы двугранными углами (). Угол поворота вокруг связи между атомами азота и α-углерода называется phi (φ).Угол поворота вокруг связи между α-углеродом и карбонильными атомами углерода называется psi (ψ). Поворот по часовой стрелке вокруг любой связи, если смотреть спереди на заднюю группу, соответствует положительному значению. Углы φ и ψ определяют путь полипептидной цепи.
Двугранный угол —
Мера поворота вокруг связки, обычно принимаемая в пределах от -180 ° до + 180 °. Двугранные углы иногда называют торсионными углами.
Рисунок 3.27
Вращение связей в полипептиде. Структуру каждой аминокислоты в полипептиде можно регулировать вращением вокруг двух одинарных связей. (A) Phi (φ) — угол поворота вокруг связи между атомами азота и α-углерода, (подробнее …)
Возможны ли все комбинации φ и ψ? Г. Н. Рамачандран признал, что многие комбинации запрещены из-за стерических столкновений между атомами. Допустимые значения могут быть визуализированы на двумерном графике, который называется диаграммой Рамачандрана ().Три четверти возможных комбинаций (φ, ψ) исключаются просто из-за локальных стерических столкновений. Стерическое исключение, тот факт, что два атома не могут находиться в одном и том же месте одновременно, может быть мощным организующим принципом .
Рисунок 3.28
Диаграмма Рамачандрана, показывающая значения φ и ψ. Не все значения φ и ψ возможны без столкновений между атомами. Наиболее благоприятные регионы показаны темно-зеленым; пограничные области показаны светло-зеленым. (более…)
Способность биологических полимеров, таких как белки, складываться в четко определенные структуры, является замечательной термодинамически. Рассмотрим равновесие между развернутым полимером, который существует как случайный клубок, то есть как смесь многих возможных конформаций, и свернутой формой, которая принимает уникальную конформацию. Благоприятная энтропия, связанная с большим количеством конформаций в развернутой форме, противодействует сворачиванию и должна преодолеваться взаимодействиями, благоприятствующими свернутой форме. Таким образом, очень гибкие полимеры с большим количеством возможных конформаций не складываются в уникальные структуры. Жесткость пептидной единицы и ограниченный набор допустимых углов φ и ψ ограничивает количество структур, доступных для развернутой формы, в достаточной степени, чтобы позволить происходить сворачивание белка .
Гидрофобные, гидрофильные, полярные и заряженные
Каждая из 20 наиболее распространенных аминокислот имеет свои специфические химические характеристики и свою уникальную роль в структуре и функции белка. Например, исходя из склонности боковой цепи к контакту с водой, аминокислоты можно классифицировать как гидрофобные (низкая склонность к контакту с водой), полярные и заряженные (энергетически благоприятные контакты с водой).
Заряженные аминокислоты
Легко увидеть, какие аминокислоты заряжены, просто потому, что при нейтральном pH (около 7) они содержат один заряд. Их четыре: две основные аминокислоты, лизин (Lys) и аргинин (Arg) с положительным зарядом при нейтральном pH, и две кислые, аспартат (Asp) и глутамат (Glu), несущие отрицательный заряд при нейтральном pH. Было обнаружено, что так называемые солевые мостики, которые образуются в результате взаимодействия между положительно и отрицательно заряженными боковыми цепями аминокислот, важны для стабилизации трехмерной структуры белка.Например, заряженные аминокислоты в белках термофильных организмов (организмов, которые живут при повышенных температурах, до 80-90 ° C или даже выше) часто образуют обширную сеть солевых мостиков на поверхности этих белков, способствуя их термостабильности и предотвращение денатурации при высоких температурах. Связывание ионов металлов в белках — еще одна функция отрицательно заряженных карбоксильных групп Asp и Glu. Металлопротеины и связывание металлов — увлекательная область структурной биологии.Я надеюсь, что когда-нибудь в будущем я дополню этот сборник главой о связывании металлов в белках.
Полярные аминокислоты
При рассмотрении полярности некоторые аминокислоты легко назначить, в то время как в других случаях могут возникнуть разногласия. Например, серин (Ser), треонин (Thr) и тирозин (Tyr) явно полярны, поскольку они несут гидроксильную (-OH) группу. Эта полярная группа может участвовать в образовании водородной связи с другой полярной группой, отдавая или принимая протон.Аспарагин (Asn) и глутамин (Gln) также полярны, они несут полярную амидную группу. С другой стороны, гистидин (His) может быть как полярным, так и заряженным, в зависимости от окружающей среды и pH. Он имеет две группы –NH со значением pKa около 6. Когда обе группы протонированы, боковая цепь имеет заряд +1. PKa может модулироваться белковой средой таким образом, что боковая цепь может отдавать протон и становиться нейтральной или принимать протон, становясь заряженным. Эта способность делает гистидин полезным в активных центрах ферментов, когда для химической реакции требуется экстракция протонов.Ароматические аминокислоты триптофан (Trp) и ранее упомянутый Tyr, а также неароматический метионин (Met) иногда называют амфипатическими из-за их способности иметь как полярный, так и неполярный характер. Эти остатки можно найти рядом с границей раздела между белком и растворителем. Здесь следует отметить, что боковые цепи гистидина, тирозина, фенилаланина и триптофана также способны образовывать слабые водородные связи типов OH-π и CH-O, используя электронные облака внутри своих кольцевых структур.Для обсуждения типов водородных связей OH-π и CH-O см. Scheiner et al., 2002.
Гидрофобные аминокислоты
Гидрофобные аминокислоты включают аланин (Ala, A), валин (Val, V), лейцин (Leu, L), изолейцин (Ile, I), пролин (Pro, P), фенилаланин (Phe, F) и цистеин (Cys). Эти остатки обычно расположены внутри ядра белка, изолированного от растворителя. Они участвуют в ван-дер-ваальсовых взаимодействиях, которые необходимы для стабилизации белковых структур.Кроме того, остатки Cys участвуют в стабилизации трехмерной структуры за счет образования дисульфидных (S-S) мостиков, которые могут соединять разные части белковой структуры или даже разные субъединицы в комплексе. Здесь следует отметить, что и в случае Cys существуют некоторые разногласия по поводу его отнесения к гидрофобной группе. Например, согласно некоторым схемам, он является гидрофобным, в то время как другие считают его полярным, так как он часто находится вблизи или на поверхности белков.
Глицин и пролин
Глицин (Gly), являясь одной из распространенных аминокислот, не имеет боковой цепи. Он часто находится на поверхности белков, в областях петель или клубков (без определенной вторичной структуры), обеспечивая высокую гибкость полипептидной цепи. Эта гибкость требуется для облегчения резких поворотов полипептидов в областях петель. С другой стороны, пролин, как правило, неполярен и имеет свойства, противоположные свойствам Gly, он обеспечивает жесткость полипептидной цепи, накладывая определенные торсионные углы на сегмент структуры (Morgan & Rubenstein, 2013).Причина этого в том, что его боковая цепь создает ковалентную связь с основной цепью, которая ограничивает угол фи полипептида в этом месте (см. Часть графика Рамачандрана). Иногда Pro называют разрушителем спирали, поскольку он часто находится в конце α-спирали и по очереди. Важность Gly и Pro в сворачивании белков обсуждается в (Krieger et al., 2005).
Ниже перечислены 20 наиболее распространенных аминокислот в белках с трехбуквенным и однобуквенным кодами:
Charged ( боковых цепей часто образуют солевые мостики ):
• Аргинин — Arg — R
• Лизин — Lys — K
• Аспарагиновая кислота — Asp — D
• Глутаминовая кислота — Glu — E
Polar ( образуют водородные связи в качестве доноров или акцепторов протонов ):
• Глутамин — Gln — Q
• Аспарагин — Asn — N
• Гистидин — His — H
• Серин — Ser — S
• Треонин — Thr — T
• Тирозин — Tyr — Y
• Цистеин — Cys — C
Амфипатический ( часто встречается на поверхности белков или липидных мембран, иногда также классифицируется как полярный ):
• Триптофан — Trp — W
• Тирозин — Tyr — Y
• Метионин — Met — M (может действовать как лиганд для ионов металлов)
Гидрофобный ( обычно находится внутри ядра белка) :
• Аланин — Ala — A
• Изолейцин — Ile — I
• Лейцин — Leu — L
• Метионин — Met — M
• Фенилаланин — Phe — F
• Валин — Val — V
• Пролин — Pro — P
• Глицин — Gly — G
Аминокислоты — обзор
Электролитные и кислотно-основные свойства
Аминокислоты — это амфолиты; я.е. они содержат как кислотные, так и основные группы. Свободные аминокислоты никогда не могут встречаться в виде неионных молекул . Вместо этого они существуют как нейтральные цвиттер-ионы , которые содержат как положительно, так и отрицательно заряженные группы. Цвиттерионы электрически нейтральны и поэтому не мигрируют в электрическом поле. В кислом растворе (ниже pH 2,0) преобладающая разновидность аминокислоты заряжена положительно и мигрирует к катоду. В щелочном растворе (pH выше 9,7) преобладающая разновидность аминокислоты заряжена отрицательно и мигрирует к аноду.
Изоэлектрическая точка (pI) аминокислоты — это pH, при котором молекула имеет нулевой средний суммарный заряд и, следовательно, не перемещается в электрическом поле. PI рассчитывается путем усреднения значений pK ‘для двух функциональных групп, которые вступают в реакцию, когда цвиттерион попеременно становится одновалентным катионом или одновалентным анионом.
При физиологическом pH моноаминомонокарбоновые аминокислоты, например, глицин и аланин, существуют в виде цвиттерионов. То есть при pH 6.9–7.4, α-карбоксильная группа (pK ‘= 2,4) диссоциирует с образованием отрицательно заряженного карбоксилатного иона (COO —), в то время как α-аминогруппа (pK ′ =. 7) протонируется с образованием аммонийного группа (NH 3 + ). Значение pK ‘α-карбоксильной группы значительно ниже, чем у сопоставимой алифатической кислоты, например, уксусной кислоты (pK’ = 4,6). Эта более сильная кислотность связана с захватом электронов положительно заряженным ионом аммония и, как следствие, повышенной склонностью карбоксильного водорода к диссоциации в виде H + .Группа α-аммония, соответственно, является более слабой кислотой, чем алифатический ион аммония, например этиламин (pK ‘= 9,0), поскольку индуктивный эффект отрицательно заряженного карбоксилат-аниона имеет тенденцию предотвращать диссоциацию H + . Профиль титрования глицина (рис. 3.6) почти идентичен профилям всех других моноаминомонокарбоновых аминокислот с неионизируемыми R-группами (Ala, Val, Leu, Ile, Phe, Ser, Thr, Gln, Asn, Met и Pro). .
Рисунок 3.6. Профиль титрования глицина, моноаминомонокарбоновой кислоты.
Титрование глицина имеет следующие основные особенности. Титрование инициируют гидрохлоридом глицина, Cl — (H 3 + NCH 2 COOH), который является полностью протонированной формой аминокислоты. В этой форме молекула содержит две кислотные функциональные группы; следовательно, для полного титрования 1 моля гидрохлорида глицина требуется два эквивалента основания. Имеются два значения pK ‘: pK’1 из-за реакции карбоксильной группы и pK’2 из-за реакции аммониевой группы.Добавление 0,5 экв. Основания к 1 моль гидрохлорида глицина повышает pH 2,34 (pK’1), тогда как добавление 1,5 экв. Дополнительно увеличивает pH до 9,66 (pK’2). При низких значениях pH (например, 0,4) молекулы представляют собой преимущественно катионы с одним положительным зарядом; при значениях pH 5–7 у большинства молекул чистый заряд равен нулю; при высоких значениях pH (например, 11,7) все молекулы по существу являются анионами с одним отрицательным зарядом. Середина между двумя значениями pK ‘[т.е. при pH = (2,34 + 9,66) / 2= 6,0] — это pI. Таким образом, pI — это среднее арифметическое значений pK′1 и pK′2 и точка перегиба между двумя сегментами профиля титрования.
Буферная способность слабых кислот и слабых оснований максимальна при их значениях pK ‘. Таким образом, моноаминомонокарбоновые кислоты проявляют наибольшую буферную способность в двух диапазонах pH, близких к двум их значениям pK ‘, а именно, pH 2,3 и pH 9,7 (рис. 3.6). Ни эти аминокислоты, ни α-амино- или α-карбоксильные группы других аминокислот (которые имеют аналогичные значения pK ‘) не обладают значительной буферной способностью в нейтральном (физиологическом) диапазоне pH. Единственными аминокислотами с R-группами, которые обладают буферной способностью в физиологическом диапазоне pH, являются гистидин (имидазол; pK ‘= 6.0) и цистеин (сульфгидрил; pK ‘= 8,3). Значения pK и pI для выбранных аминокислот перечислены в таблице 3.2. Значения pK ‘для R-групп меняются в зависимости от ионного окружения.
Таблица 3.2. Значения pK ‘и pI выбранных свободных аминокислот при 25 ° C *
| Аминокислота | pK’1 (α-COOH) | pK’2 | pK’3 | pI |
|---|---|---|---|---|
| Аланин | 2,34 | 9,69 (β-Nh4 +) | 6,00 | |
| Аспарагиновая кислота | 2.09 | 3,86 (γ-COOH) | 9,82 (α-Nh4 +) | 2,98 (pK’1 + pK’22) |
| Глутаминовая кислота | 2,19 | 4,25 (γ-COOH) 9,6393 ( α-Nh4 +) | 3,22 (pK’1 + pK’22) | |
| Аргинин | 2,17 | 9,04 (α-Nh4 +) | 12,48 (Гуанидиний) | 10,76K’32 + pK’2) |
| Гистидин | 1,82 | 6,00 (имидазолий) | 9,17 (Nh4 +) | 7,59 (pK’2 + pK’32) |
| Лизин | 2.18 | 8,95 (α-Nh4 +) | 10,53 (ε-Nh4 +) | 9,74 (pK’2 + pK’32) |
| Цистеин | 1,71 | 8,33 (SH) | ) | 5,02 (pK’1 + pK’22) |
| Тирозин | 2,20 | 9,11 (α-Nh4 +) | 10,07 (Фенол ОН) | 5,66 (pK’1 + pK’22) |
| Серин | 2,21 | 9,15 (α-Nh4 +) | 13,6 (Спирт ОН) | 5,68 (pK’1 + pK’22) |
Значения pK ‘для функциональных групп в белках могут значительно различаться от значений свободных аминокислот.

 д.
д.