Бром и его действие на организм человека. Справка
1 сентября 2011 года произошла утечка брома в одном из вагонов грузового состава на станции «Челябинск Главный» Южно-Уральской железной дороги (ЮУЖД). Из-за происшествия в ряде школ Челябинска отменены праздничные школьные линейки. 36 человек обратились за медицинской помощью.
Бром (от греч. bromos – зловоние; название связано с неприятным запахом брома), Br – химический элемент VII гр. периодической системы Дмитрия Менделеева, относится к галогенам.
Открыт в 1825 году французским химиком Антуаном Баларом, который, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно бурую дурно пахнущую жидкость. Определив плотность и температуру кипения жидкости, а также изучив ее важнейшие химические свойства, Балар отправил доклад о своих опытах в Парижскую академию наук. В нем, в частности, для нового элемента было предложено название «мурид» (от лат. muria – соляной раствор, рассол). Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом.
Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом.
При обычных условиях бром – тяжелая жидкость с резким запахом, в отраженном свете темно фиолетового, почти черного цвета, в проходящем – темно красного; легко образует желто бурые пары. Температура плавления 7,25 °С, температура кипения 59,2 °С.
Бром растворим в воде (3,58 г в 100 г при 20 °С), в присутствии хлоридов (химические соединения хлора) и особенно бромидов (химические соединения брома) растворимость повышается, а в присутствии сульфатов понижается.
По реакционной способности бром занимает промежуточное положение между хлором и йодом. С другими галогенами (фтором, хлором, йодом) образует неустойчивые соединения, отличающиеся высокой химической активностью.
С кислородом и азотом бром непосредственно не реагирует даже при повышенных температурах, его нестойкие соединения с этими элементами получают косвенными методами. Бром также не вступает в реакцию с углеродом.
При взаимодействии со многими металлами бром образует бромиды. К действию брома устойчивы тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром – сильный окислитель.
Бром – довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37х10 4 (примерно 50 е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия, калия, магния и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома – бромаргирит (бромид серебра) и эмболит (смешанный хлорид и бромид серебра) – чрезвычайно редки.
Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в Кулундинской степи на Алтае.
Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения. Широко известны содержащие бром лекарственные препараты.
Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения. Широко известны содержащие бром лекарственные препараты.
Бром ядовит: токсическая доза для организма составляет 3 г, летальная – от 35 г.
При содержании брома в воздухе 0,001% наблюдаются раздражение слизистых оболочек, головокружение, кровотечение из носа. При концентрации 0,02% – удушье, спазмы, заболевание дыхательных путей. Попадание на кожу жидкого брома вызывает зуд, при длительном действии образуются медленно заживающие язвы.
Бром оказывает очень глубокое действие на лимфатические железы, в особенности на околоушную железу, яичники и яички. Он вызывает быстрое увеличение их в объеме и особого рода затвердение: пораженная железа тверда, как камень. Важная характеристика: поражаются железы только на левой стороне.
При внутреннем употреблении малых доз и очень высоких разведений бром производит своеобразное действие на головной и спинной мозг – он понижает интеллектуальную работоспособность и подавляет рефлекторную возбудимость, возбуждает сонливость.
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух. Для восстановления дыхания можно пользоваться тампоном, смоченным нашатырным спиртом, периодически поднося его к носу пострадавшего на короткое время. Дальнейшее лечение должно проводиться под наблюдением врача.
При бытовом отравлении бромом или бромидами, принятыми внутрь: дать пострадавшему молока с размешанным в нем яйцом, несколько раз вызвать рвоту, контролируя, чтобы рвотные массы не попали в дыхательные пути. Можно также дать выпить теплый крахмальный или мучной клейстер и активированный уголь. Внутрь для выведения брома из организма в течение дня необходимо принять 10 30 г поваренной соли в большом количестве воды (3 5 л). Дальнейшее лечение – симптоматическое.
Кожа, обожженная жидким бромом, промывается многократно водой.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Мерами индивидуальной защиты являются применение фильтрующих промышленных противогазов, резиновых перчаток, сапог, фартуков, строгое выполнение правил техники безопасности.
Материал подготовлен на основе информации открытых источников
Бром
| Бром | |
|---|---|
| Атомный номер | 35 |
| Внешний вид простого вещества | красно-бурая жидкость с сильным неприятным запахом |
| Свойства атома | |
|
Атомная масса (молярная масса) |
79,904 а.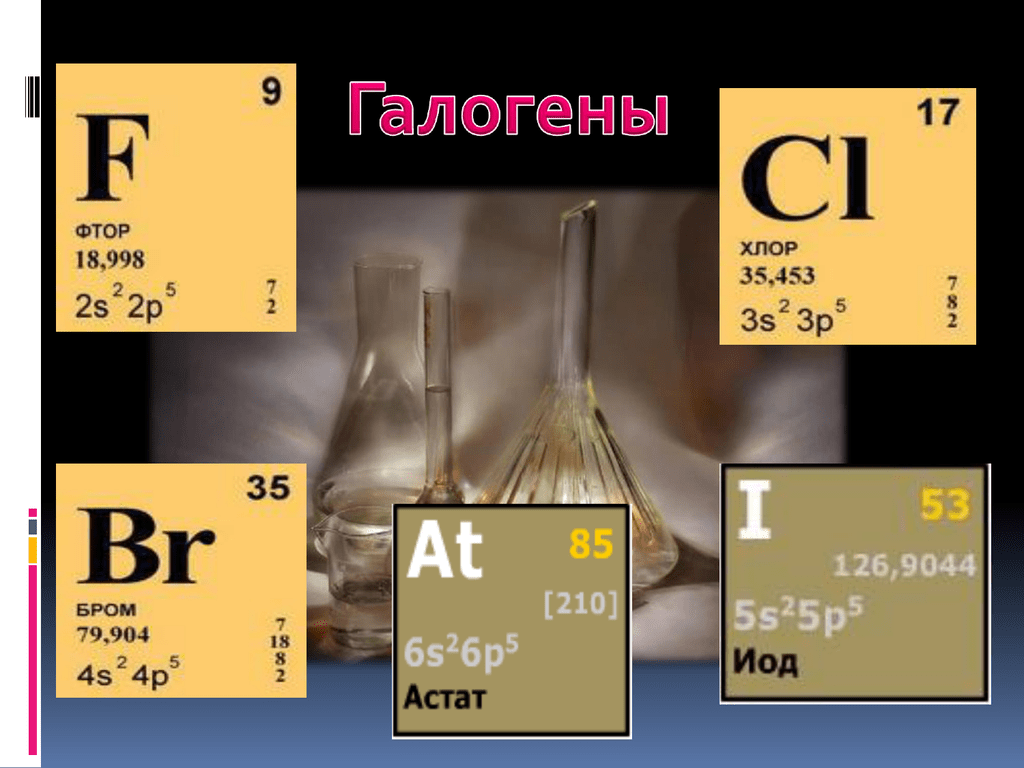 е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1142,0 (11,84) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p5 |
| Химические свойства | |
| Ковалентный радиус | 114 пм |
| Радиус иона | (+5e)47 (-1e)196 пм |
|
Электроотрицательность (по Полингу) |
2,96 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 3,12 г/см³ |
| Молярная теплоёмкость | 75,69 Дж/(K·моль) |
| Теплопроводность | 0,005 Вт/(м·K) |
| Температура плавления | 265,9 K |
| Теплота плавления | (Br—Br) 10,57 кДж/моль |
| Температура кипения | 331,9 K |
| Теплота испарения | (Br—Br) 29,56 кДж/моль |
| Молярный объём | 23,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=6,67 b=4,48 c=8,72 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| Br | 35 |
| 79,904 | |
| [Ar]3d104s24p5 | |
| Бром | |
Бром — элемент главной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 35. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2).
И. Менделеева, атомный номер 35. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2).
История
Схема атома брома
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорченный тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда. Фраза-то была, но принадлежала она не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Сорбонне занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Балар.
Происхождение названия
Название элемента происходит βρῶμος — зловоние.
Получение
Бром получают химическим путём из рассола Br
Физические свойства
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Плотность при 0 °C — 3, 19 г./см³. Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br²/Вr— в водном растворе равен +1,065 В.
Обычный бром состоит из изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены радиоактивные изотопы.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Br2 + H2O → HBr + HBrO.
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Br2 + 2KI → I2↓ + 2KBr.
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
Cl
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF 5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C2H4 + Br2 → C2H4Br2.
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
3Br2 + 3Na2CO3 → 5NaBr + NaBrO3+ 3CO2↑.
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
Вещества на основе брома широко применяются в основном органическом синтезе.
В технике
— Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
— Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
— 1,2-дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца.
— Растворы бромидов используются в нефтедобыче.
В медицине
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия
Со времен Первой Мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо залить раствором сульфита натрия Na2SO3
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Этот миф не имеет под собой никаких оснований — влечение успешно снижают физические нагрузки, а действительно добавляемые в еду добавки чаще всего оказываются аскорбиновой кислотой для предотвращения авитаминоза. К тому же, препараты брома соленые на вкус и не влияют ни на влечение, ни на потенцию. Они обладают снотворным и успокаивающим эффектом.
CDC | Факты о броме
Что такое бром
- Бром – это встречающийся в природе элемент, который представляет собой жидкость при комнатной температуре.
- Имеет коричневато-красный цвет с запахом отбеливателя, растворяется в воде.
Где встречается бром и как он используется
- Бром естественным образом содержится в земной коре и в морской воде в различных химических формах.
 Бром также можно найти в качестве альтернативы хлору в плавательных бассейнах.
Бром также можно найти в качестве альтернативы хлору в плавательных бассейнах. - Продукты, содержащие бром, используются в сельском хозяйстве и санитарии, а также в качестве антипиренов (химических веществ, которые помогают предотвратить возгорание).
- Некоторые бромсодержащие соединения исторически использовались в качестве седативных средств (лекарств, которые могут сделать людей спокойными или сонными). Однако эти препараты по большей части больше не продаются на рынке Соединенных Штатов.
Как вы можете подвергнуться воздействию брома
- После попадания брома в воду вы можете подвергнуться воздействию, выпив загрязненную воду.
- Если пища загрязнена бромом, вы можете заразиться, употребляя в пищу зараженную пищу.
- После выброса газообразного брома в воздух вы можете заразиться, вдыхая пары.
- Воздействие брома на кожу может произойти при прямом контакте с жидким или газообразным бромом.
- Газообразный бром тяжелее воздуха, поэтому он будет оседать в низинах.

Как действует бром
- Бром оказывает непосредственное раздражающее действие на кожу, слизистые оболочки и ткани.
- Серьезность отравления, вызванного бромом, зависит от количества, пути и продолжительности воздействия, а также от возраста и ранее существовавшего состояния здоровья человека, подвергшегося воздействию.
Непосредственные признаки и симптомы воздействия брома
- Вдыхание газообразного брома может вызвать кашель, проблемы с дыханием, головную боль, раздражение слизистых оболочек (внутри рта, носа и т. д.), головокружение, или слезятся глаза.
- Попадание жидкого или газообразного брома на кожу может вызвать раздражение кожи и ожоги. Жидкий бром, попадая на кожу, может сначала вызвать ощущение охлаждения, за которым вскоре следует чувство жжения.
- Проглатывание бромсодержащих соединений (сочетаний брома с другими химическими веществами) может вызвать различные эффекты в зависимости от соединения.
 Проглатывание большого количества брома за короткий промежуток времени может вызвать такие симптомы, как тошнота и рвота (желудочно-кишечные симптомы).
Проглатывание большого количества брома за короткий промежуток времени может вызвать такие симптомы, как тошнота и рвота (желудочно-кишечные симптомы). - Наличие этих признаков и симптомов не обязательно означает, что человек подвергся воздействию брома.
Долгосрочные последствия воздействия брома на здоровье
- Выжившие после серьезного отравления, вызванного вдыханием (вдыханием) брома, могут иметь длительные проблемы с легкими.
- У людей, переживших серьезное отравление бромом, могут также наблюдаться долгосрочные последствия повреждений, вызванных так называемым системным отравлением, например поражением почек или головного мозга из-за низкого кровяного давления.
Как защитить себя и что делать при воздействии брома
- Во-первых, выйти на свежий воздух, покинув место выброса брома. Переезд в район со свежим воздухом — хороший способ снизить вероятность негативных последствий для здоровья от воздействия брома.

- Если выброс брома произошел на открытом воздухе, отойдите от места, где произошел выброс брома. Поднимитесь на максимально возможную высоту, потому что бром тяжелее воздуха и опустится в низменности.
- Если выброс брома произошел в помещении, выйдите из здания.
- Если вы находитесь вблизи места выброса брома, координаторы по чрезвычайным ситуациям могут попросить вас либо эвакуироваться (покинуть) район, либо «укрыться на месте» (оставаться на месте) внутри здания, чтобы избежать воздействия химиката. Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см. «Факты об укрытии на месте».
- Если вы считаете, что могли подвергнуться воздействию брома, вам следует снять одежду, быстро вымыть все тело водой с мылом и как можно быстрее обратиться за медицинской помощью.
- Снятие одежды:
- Быстро снять одежду, на которой может быть бром.
 Любая одежда, которую нужно надевать через голову, должна быть срезана с тела, а не натянута через голову.
Любая одежда, которую нужно надевать через голову, должна быть срезана с тела, а не натянута через голову. - Если вы помогаете другим людям снимать одежду, старайтесь не прикасаться к загрязненным участкам и снимайте одежду как можно быстрее.
- Быстро снять одежду, на которой может быть бром.
- Мыться:
- Как можно быстрее смойте бром с кожи большим количеством воды с мылом. Мытье водой с мылом избавит вас и других людей от любых химических веществ на вашем теле.
- Если ваши глаза горят или ваше зрение затуманено, промывайте глаза простой водой в течение 10–15 минут. Если вы носите контактные линзы, снимите их и положите вместе с загрязненной одеждой. Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их.
- Утилизация одежды:
- После того, как вы вымылись, положите одежду в полиэтиленовый пакет.
 Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, где находятся загрязненные участки, наденьте резиновые перчатки или положите одежду в мешок с помощью щипцов, рукояток инструментов, палок или подобных предметов. Все, что касается загрязненной одежды, также должно быть помещено в пакет. Если вы носите контактные линзы, положите их тоже в полиэтиленовый пакет.
Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, где находятся загрязненные участки, наденьте резиновые перчатки или положите одежду в мешок с помощью щипцов, рукояток инструментов, палок или подобных предметов. Все, что касается загрязненной одежды, также должно быть помещено в пакет. Если вы носите контактные линзы, положите их тоже в полиэтиленовый пакет. - Запечатайте пакет, а затем запечатайте этот пакет в другом пластиковом пакете. Утилизация одежды таким образом поможет защитить вас и других людей от любых химических веществ, которые могут быть на вашей одежде.
- Когда прибудут сотрудники местного или государственного департамента здравоохранения или службы экстренной помощи, сообщите им, что вы сделали со своей одеждой. Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно.
- Для получения дополнительной информации об очистке тела и утилизации одежды после выброса химикатов см.
 «Химические агенты: факты о личной чистке и утилизации загрязненной одежды».
«Химические агенты: факты о личной чистке и утилизации загрязненной одежды». - Если кто-то проглотил бром, не пытайтесь вызвать у него рвоту или давать пить.
- Немедленно обратитесь за медицинской помощью. Наберите 911 и объясните, что произошло
- После того, как вы вымылись, положите одежду в полиэтиленовый пакет.
Как лечат отравление бромом
Отравление бромом лечат поддерживающей медицинской помощью (например, кислородом, введением жидкостей через иглу в вену) в условиях больницы. Специфического антидота при отравлении бромом не существует. (Противоядие — это лекарство, нейтрализующее действие яда.) Самое главное, чтобы люди удалились с места воздействия и как можно скорее обратились за медицинской помощью.
Как получить дополнительную информацию о броме
Вы можете связаться с одним из следующих:
- Региональный токсикологический центр: 1-800-222-1222
- Центры по контролю и профилактике заболеваний
- Горячая линия общественного реагирования (CDC)
- 800-CDC-INFO
- 888-232-6348 (TTY)
- Электронная почта: cdcinfo@cdc.
 gov
gov
- Горячая линия общественного реагирования (CDC)
- Центры по контролю и профилактике заболеваний (CDC), Национальный институт охраны труда и здоровья (NIOSH), Карманный справочник по химическим опасностям
Центры по контролю и профилактике заболеваний (CDC) защищают здоровье и безопасность людей, предотвращая и контролируя болезни и травмы; улучшает решения в области здравоохранения, предоставляя достоверную информацию о критических проблемах со здоровьем; и продвигает здоровый образ жизни посредством прочных партнерских отношений с местными, национальными и международными организациями.
бром | Свойства, использование и факты
бром
См. все среды
- Ключевые люди:
- Антуан-Жером Балар Виктор Мейер
- Похожие темы:
- химический элемент галоген
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
бром (Br) , химический элемент, темно-красная ядовитая жидкость, член группы галогенов или группы 17 (группа VIIa) периодической таблицы.
| atomic number | 35 |
|---|---|
| atomic weight | [79.901, 79.907] |
| melting point | −7.2 °C (19 °F) |
| boiling точка | 59 °C (138 °F) |
| удельный вес | 3,12 при 20 °C (68 °F) |
| степени окисления | −1, +5, +1, +3, +3 7 |
| электронная конфигурация | (Ar)3 d 10 4 s 2 4 p 5 |
History
Bromine was discovered in 1826 by the French chemist Antoine-Jérôme Balard in the остатки (горечь) от производства морской соли в Монпелье. Он освободил элемент, пропуская хлор через водный раствор остатков, который содержал бромид магния. Перегонка материала с диоксидом марганца и серной кислотой дала красные пары, которые конденсировались в темную жидкость. Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно полагал, что это хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром, от греческого слова bromos , что означает «неприятный запах» или «вонь».
Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно полагал, что это хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром, от греческого слова bromos , что означает «неприятный запах» или «вонь».
Наличие и распространение
Бром, редкий элемент, встречается в природе в рассеянном состоянии по всей земной коре только в виде растворимых и нерастворимых бромидов. Некоторое обогащение происходит в океанской воде (65 частей на миллион по весу), в Мертвом море (приблизительно 5 граммов на литр [0,7 унции на галлон]), в некоторых термальных источниках и в редких нерастворимых минералах бромида серебра (таких как бромирит, встречается в Мексике и Чили). Природные месторождения солей и рассолы являются основными источниками брома и его соединений. Иордания, Израиль, Китай и Соединенные Штаты лидировали в мире по производству брома в начале 21 века; другие важные страны-производители брома в этот период включают Японию, Украину и Индию.
Бром природный представляет собой смесь двух стабильных изотопов: брома-79 (50,54%) и брома-81 (49,46%). Из 17 известных радиоактивных изотопов элемента бром-77 имеет самый длительный период полураспада (57 часов).
Викторина «Британника»
118 Имена и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Физические и химические свойства
Свободный бром представляет собой красновато-коричневую жидкость с заметным давлением паров при комнатной температуре. Пары брома имеют янтарный цвет. Бром имеет резкий запах и раздражает кожу, глаза и дыхательную систему. Воздействие паров концентрированного брома даже на короткое время может привести к летальному исходу. Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Около 3,41 г (0,12 унции) брома растворяется в 100 мл (0,1 кварты) воды при комнатной температуре. Раствор известен как бромная вода. Подобно хлорной воде, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Он высвобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свету бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Подобно хлорной воде, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Он высвобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свету бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Из бромной воды можно выделить гидрат (клатрат), который содержит 172 молекулы воды и 20 полостей, способных вмещать молекулы брома. Бром растворяется в водных растворах гидроксидов щелочных металлов, давая бромиды, гипобромиты или броматы, в зависимости от температуры. Бром легко извлекается из воды органическими растворителями, такими как четыреххлористый углерод, хлороформ или сероуглерод, в которых он хорошо растворим. В органических растворителях дает оранжевый раствор.
Сродство к электрону брома высокое и аналогично сродству хлора. Однако он является менее сильным окислителем, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом. Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической активности брома, которая находится между реакционной способностью хлора и йода. Органическое соединение брома похоже на соответствующее производное хлора, но обычно более плотное, менее летучее, менее горючее и менее стабильное.
Однако он является менее сильным окислителем, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом. Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической активности брома, которая находится между реакционной способностью хлора и йода. Органическое соединение брома похоже на соответствующее производное хлора, но обычно более плотное, менее летучее, менее горючее и менее стабильное.
Бром бурно соединяется с щелочными металлами, а также с фосфором, мышьяком, алюминием и сурьмой, но менее бурно с некоторыми другими металлами. Бром вытесняет водород из насыщенных углеводородов и присоединяется к ненасыщенным углеводородам, хотя и не так быстро, как это делает хлор.
Наиболее стабильной степенью окисления элемента является -1, при которой бром встречается в природе. Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO — ), +3 (бромит, BrO — 2 ), +5 (бромат, BrO — 3 ) и +7 (пербромат, BrO — 4 ) также известны. Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Производство и использование
Основным коммерческим источником брома является морская вода, из которой элемент извлекают путем химического замещения (окисления) хлором в присутствии серной кислоты по реакции
Продукт реакции представляет собой разбавленный раствор брома, из которого элемент удаляют продуванием воздуха. Затем свободный бром смешивают с двуокисью серы, и смешанные газы пропускают вверх по башне, по которой стекает вода. В градирне происходит следующая реакция:
, в результате чего получается смесь кислот, которая намного богаче ионами брома, чем морская вода. Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Товарный бром обычно содержит до 0,3% хлора. Обычно его хранят в стеклянных бутылках или в бочках, покрытых свинцовым или монель-металлическим покрытием.
В промышленном использовании брома преобладало соединение бромистого этилена (C 2 H 4 Br 2 ), которое когда-то добавляли в бензин с тетраэтилсвинцом для предотвращения отложения свинца в двигателе. После отказа от этилированного бензина соединения брома в основном использовались в антипиренах, но бромистый этилен по-прежнему остается важным соединением, поскольку он используется для уничтожения нематод и других вредителей в почве. Бром также используется в производстве катализаторов, таких как бромид алюминия.
Бром используется и в других целях, например, в производстве различных красителей и соединений тетрабромэтана (C 2 H 2 Br 4 ) и бромоформа (CHBr 3 ), которые используются в качестве жидкостей в манометрах из-за их высокой удельный вес.

 Бром также можно найти в качестве альтернативы хлору в плавательных бассейнах.
Бром также можно найти в качестве альтернативы хлору в плавательных бассейнах.
 Проглатывание большого количества брома за короткий промежуток времени может вызвать такие симптомы, как тошнота и рвота (желудочно-кишечные симптомы).
Проглатывание большого количества брома за короткий промежуток времени может вызвать такие симптомы, как тошнота и рвота (желудочно-кишечные симптомы).
 Любая одежда, которую нужно надевать через голову, должна быть срезана с тела, а не натянута через голову.
Любая одежда, которую нужно надевать через голову, должна быть срезана с тела, а не натянута через голову. Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, где находятся загрязненные участки, наденьте резиновые перчатки или положите одежду в мешок с помощью щипцов, рукояток инструментов, палок или подобных предметов. Все, что касается загрязненной одежды, также должно быть помещено в пакет. Если вы носите контактные линзы, положите их тоже в полиэтиленовый пакет.
Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, где находятся загрязненные участки, наденьте резиновые перчатки или положите одежду в мешок с помощью щипцов, рукояток инструментов, палок или подобных предметов. Все, что касается загрязненной одежды, также должно быть помещено в пакет. Если вы носите контактные линзы, положите их тоже в полиэтиленовый пакет. «Химические агенты: факты о личной чистке и утилизации загрязненной одежды».
«Химические агенты: факты о личной чистке и утилизации загрязненной одежды». gov
gov