ХиМиК.ru — Химические реакции
I. Реакции карбоксильной группы. 1. Образование солей с основаниями. Подобно алифатическим кислотам, аминокислоты образуют соли с основаниями.Кроме обычных солей, они в известных условиях могут образовывать внутрикомплексные соли с катионами металлов. Очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные соли аминокислот с медью:
2. Образование эфиров. Действием на аминокислоты спирта и хлористого водорода получаются эфиры аминокислот:
Очень удобно проводить этерификацию аминокислот в присутствии хлористого тионила:
Метиловые и этиловые эфиры аминокислот — жидкости, легко перегоняющиеся в вакууме. Поэтому они были использованы для разделения смесей аминокислот (Э. Фишер).
Большое значение получили бензиловые эфиры аминокислот, применяемые в синтезе пептидов. Их получают действием бензилового спирта на аминокислоту в
Эфиры аминокислот под действием аммиака или аминов легко превращаются в соответствующие амиды
при обработке гидразином образуют гидразиды:
Действуя на гидразиды ацилированных аминокислот азотистой кислотой, можно получить азиды ациламинокислот
применяемые в синтезе пептидов.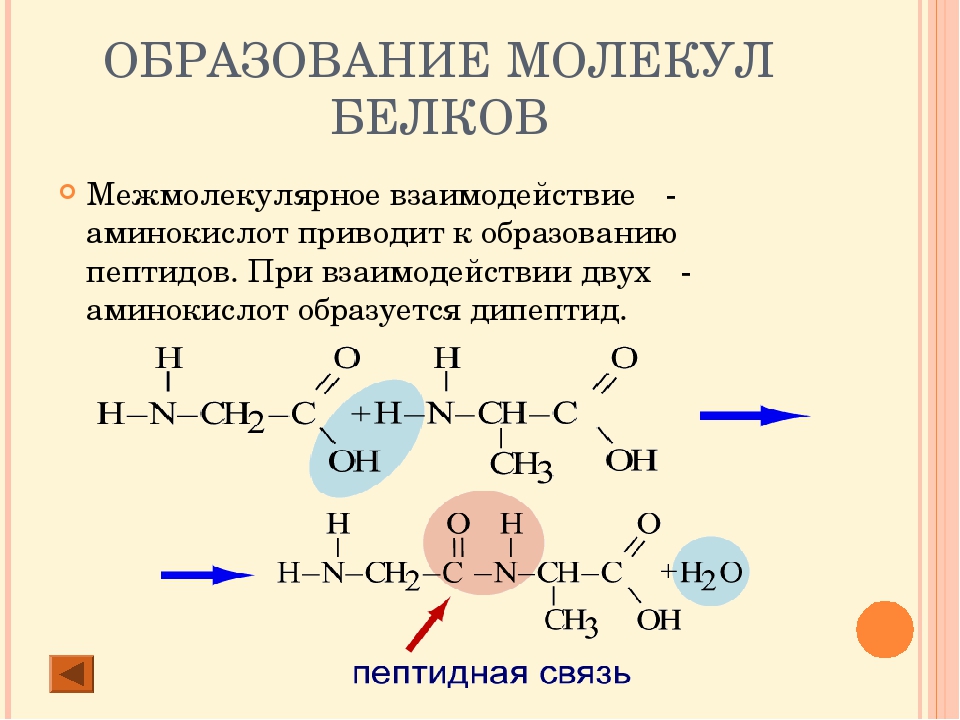
При действии литийалюминийгидрида эфиры аминокислот восстанавливаются до аминоспиртов.
3. Образование галоидангидридов. При взаимодействии с пятихлористым фосфором аминокислоты образуют галоидангидриды:
Они крайне неустойчивы и существуют только в виде солей. Более устойчивы применяемые в синтезе пептидов галоидангидриды ацилированных аминокислот:
4. Д ек ар б о к си л и р о в а н и е. При отщеплении от аминокислот карбоксильной группы образуются амины:
II. Реакции аминной группы. 1. Образование солей с кислотами. С минеральными кислотами аминокислоты подобно аминам дают соли.
2. Действие азотистой кислоты. При действии азотистой кислоты образуется оксикислота и выделяются азот и вода:
Этой реакцией пользуются для количественного газометрического определения аминогрупп в аминокислотах, а также в белках и продуктах их распада (метод Ван-Сляйка).
Эфиры α-аминокислот образуют с азотистой кислотой стойкие и реакционноспособные диазосоединения.
3. Образование N-a ц и л и р о в а н н ы х производн ы х. Аминокислоты реагируют с хлорангидридами и ангидридами кислот, образуя N-ацилированные производные. Реакция проходит до конца только в водно-щелочных или неводных средах, так как во взаимодействие вступает аминная, а не аммонийная группа:
N-Ацилированные производные аминокислот имеют большое применение при синтезе пептидов.
Некоторые ацилированные аминокислоты имеют биологическое значение. С их образованием связано обезвреживание ядовитых веществ, всасывающихся в кровь из кишечника. Так, например, ядовитая бензойная кислота связывается глицином и удаляется из организма с мочой в форме гиппуровой кислоты:
4. Получение N-aлкилированных производн ы х. При действии галоидных алкилов, алкилсульфатов или диазометана на аминокислоты получаются моно- или ди-N-алкилзамещенные, называемые также вторичными и третичными аминокислотами. При дальнейшем алкилировании могут получаться четвертичные аммониевые основания. Их внутренние соли носят название бетаинов.
Их внутренние соли носят название бетаинов.
5. Получение N-a рилированных производных. Большое значение приобрели 2,4-динитрофенильные N-производные аминокислот, которые применяются для характеристики и количественного определения аминокислот, а также для исследования строения пептидов и белков. Эти производные получаются при взаимодействии аминокислот с 2,4-динитрофторбензолом в щелочной среде:
Так как в нитро- и динитробензолах в о— и п-положениях электронная плотность понижена (см. правила замещения в бензольном ядре), приведенная выше динитрофенильная группировка обладает ярко выраженными электроноакцепторными свойствами. Поэтому она оттягивает свободную электронную пару от атома азота, лишая его основных свойств. Этим объясняется тот факт, что в отличие от аминокислот динитрофениламинокислоты не амфотерны и хорошо растворимы в органических растворителях. Для N-(2,4-динитрофенил)-аминокислот характерна яркая желтая окраска и способность поглощать свет в ультрафиолетовой части спектра.
6. Получение аралкиламинокислот. При действии трифенилхлорметана в слабощелочной среде аминокислоты дают N-трифенилметильные («тритильные») производные:
Основные свойства аминогруппы в таких соединениях заметно ослаблены, а связь С—N сравнительно непрочна. Поэтому они легко гидролизуются при нагревании с разбавленной уксусной кислотой:
Эта особенность N-(трифенилметил)-аминокислот обусловила их использование в пептидном синтезе.
7. Взаимодействие с альдегидами. Аминокислоты легко реагируют с альдегидами. При взаимодействии с формальдегидом образуются N-монооксиметил аминокислоты и N,N-диоксиметиламинокислоты:
Эти производные титруются как алифатические кислоты, что используется для количественного определения аминокислот (Серенсен). При восстановлении N,N-диоксиметиламинокислот получаются N,N-диметиламинокислоты.
8. Взаимодействие с кетокислотами. α-Аминокислоты реагируют с кетокислотами при нагревании в водных растворах.
в котором затем происходит перемещение двойной связи, причем одновременно отщепляется двуокись углерода и мигрирует, атом водорода:
После гидролиза образуется новая аминокислота и альдегид:
В 1937 г. А. Н. Браунштейн и М. Г Крицман открыли происходящую в организме животных реакцию, получившую название реакции переаминирования. В результате этой реакции, протекающей по более сложному механизму, чем рассмотренный выше, аминогруппа переходит от α-аминокислоты к кетокислоте:
Реакции переаминирования принадлежит большая роль в процессах обмена аминокислот в природе.
9. Окислительное дезаминирование. Аминокислоты под влиянием многих окислителей, таких, как гипохлориты, хлорамин Т, персульфаты, отщепляя аммиак, превращаются в соответствующие кетокислоты:
Эта реакция, получившая название окислительного дезаминирования, протекает в организме животных под влиянием специфических ферментов.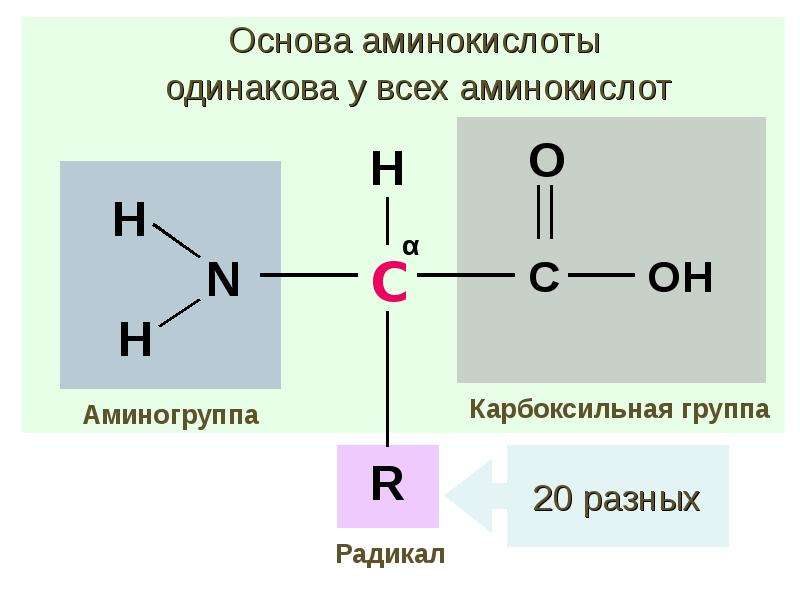
10. Нингидринная реакция. В качестве реактива для качественного и количественного определения аминокислот широко применяется нингидрин (трикетогидринденгидрат). При нагревании с аминокислотой нингидрин восстанавливается до дикетооксигидриндена, а аминокислота окисляется и распадается на альдегид, двуокись углерода и аммиак:
Выделившийся аммиак конденсируется с молекулой образовавшегося дикетооксигидриндена и со второй молекулой нингидрина:
Аммонийная соль енольной формы образовавшегося соединения
благодаря наличию системы сопряженных двойных связей окрашена в интенсивный сине-фиолетовый цвет. По интенсивности окрашивания можно определить содержание аминокислоты в растворе. Иногда для этой цели измеряют количества двуокиси углерода, альдегида или аммиака, выделившихся при реакции с нингидрином.
Необходимо иметь в виду, что окрашивание с нингидрином дают не только аминокислоты, но также пептиды, первичные и вторичные амины.
III. Реакции, протекающие с одновременным участием карбоксильной и аминной групп. 1. Превращения аминокислот при нагревании. α-Аминокислоты, а еще легче их эфиры, при нагревании образуют циклические пептиды — дикетопиперазины:
1. Превращения аминокислот при нагревании. α-Аминокислоты, а еще легче их эфиры, при нагревании образуют циклические пептиды — дикетопиперазины:
β-Аминокислоты при нагревании образуют α,β-ненасыщенные кислоты с отщеплением аминогруппы и водорода от соседних атомов углерода:
γ-, δ- и ε-Аминокислоты, как и соответствующие оксикислоты, легко отщепляют воду и циклизуются, образуя внутренние амиды — лактамы:
Известны и β-лактамы, соответствующие β-аминокислотам. В частности, β-лактамное кольцо имеется в молекуле антибиотика пенициллина. Однако синтетическое получение β-лактамов сопряжено с большими трудностями.
2. Образование гидантоинов. α-Аминокислоты реагируют с мочевиной. Эта реакция проходит с участием аминной и карбоксильной групп и приводит к образованию гидантоинов:
При взаимодействии аминокислот с тиомочевиной образуются аналогично построенные тиогидантоины:
Мономерами каких органических веществ являются аминокислоты и что это значит?
Мономерами каких органических веществ являются аминокислоты и что это значит?
Мономеры – это микромолекулы, составляющие структуру макромолекул биополимеров. К ним относят аминокислоты, моносахариды и нуклеотиды. Мономерами каких биополимеров являются аминокислоты?
К ним относят аминокислоты, моносахариды и нуклеотиды. Мономерами каких биополимеров являются аминокислоты?
Мономеры – это повторяющиеся звенья макромолекул органических соединений под названием биополимеры. К биополимерам относят полисахариды, нуклеиновые кислоты и белки. Аминокислоты являются мономерами белков, моносахариды – полисахаридов, нуклеотиды – нуклеиновых кислот.
Полимеры могут разрушиться до мономеров, из которых сложена их молекула. Такой процесс происходит в пищеварительной системе живых существ. Крупные вещества расщепляются до мелких, которые способны всосаться в кровь. В дальнейшем они используются для формирования новых макромолекул, необходимых организму.
Состав аминокислот
В состав аминокислот входят по одной или по две аминогруппы и карбоксильной группы. Первые обладают щелочными, а вторые кислотными свойствами. Этим обусловлены амфотерные свойства аминокислот, за счет которых они выполняют функции буферных соединений.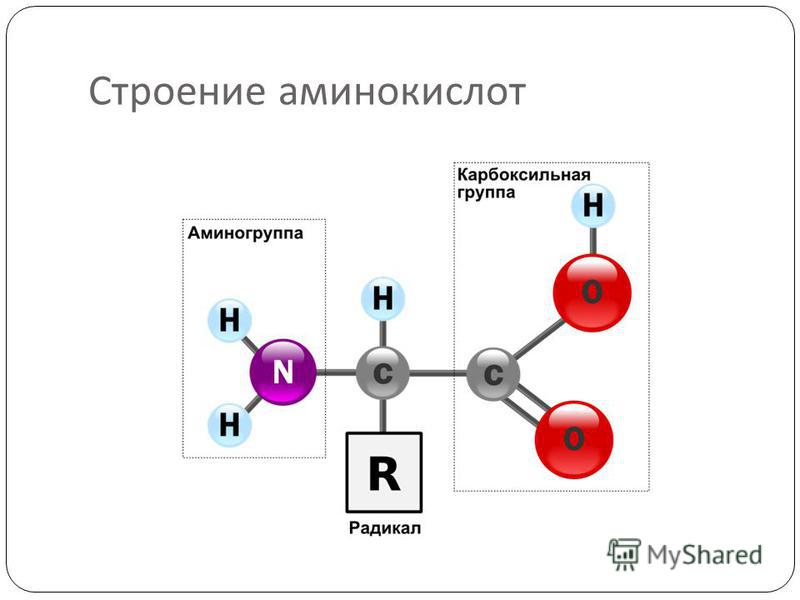
Внимание! У большинства аминокислот есть 1 карбоксильная и 1 аминогруппа. Они являются нейтральными.
Как аминокислоты образуют белки?
Аминогруппа аминокислоты может реагировать с карбоксильной группой другой аминокислоты. В ходе реакции выделяются 1 молекула воды и 2 аминокислотных остатка, соединенные крепкой пептидной связью. Соединение, образуемое при конденсации 2 аминокислот, называется дипептид.
При дальнейшем объединении аминокислот посредством пептидных связей образуется полипептидная цепь. Ее называют первичной структурой белка.
Сколько аминокислот образуют все многообразие белков?
Существует 26 аминокислот. В образовании всех белков участвуют лишь 20 из них. Протеиногенные, или мажорные аминокислоты бывают заменимыми и незаменимыми.
Аминокислоты заменимые
Заменимые аминокислоты поступают в организм с пищей и образуются в нем из других аминокислот.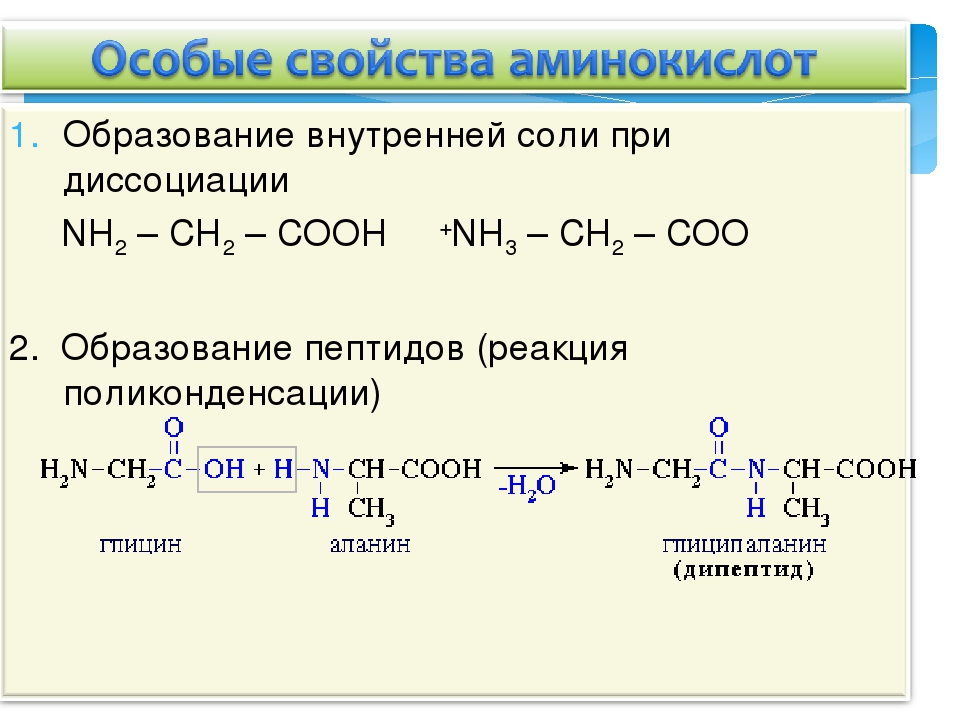 Всего их 12:
Всего их 12:
- аланин;
- аспарагиновая кислота;
- аспарагин;
- гистидин;
- серин;
- цистеин;
- аргинин;
- глютаминовая кислота;
- глютамин;
- пролин;
- тирозин.
Аминокислоты незаменимые
Незаменимые аминокислоты организмом не вырабатываются, но необходимы ему для полноценной жизнедеятельности, поэтому должны поступать с пищей. Всего их 8:
- лизин;
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин.
Внимание! Без аминокислот невозможна жизнедеятельность организма. Без них он не сможет производить белки, которые составляют основу всех его тканей. Кроме того, белки участвуют почти во всех физиологических процессах.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Аминокислоты (32 показателя) сдать в Подольске и Королёве
ОписаниеАминокислоты — это органические соединения, являющиеся строительным материалом для белков и мышечных тканей. Нарушение обмена аминокислот является причиной многих заболеваний (печени и почек). Анализ аминокислот (мочи и крови) является основным средством оценки степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических нарушений.
ПАланин (ALA), Аргинин (ARG), Аспарагиновая кислота (ASP), Цитруллин (CIT),
Глутаминовая кислота (GLU), Глицин (GLY),
Метионин (MET), Орнитин (ORN),
Фенилаланин (PHE), Тирозин (TYR), Валин
(VAL), Лейцин (LEU), Изолейцин (ILEU),
Гидроксипролин (HPRO), Серин (SER),
Аспарагин (ASN), a-аминоадипиновая к-та
(AAA), Глутамин (GLN), b-аланин (BALA),
Таурин (TAU), Гистидин (HIS), Треонин
(THRE), 1-метилгистидин (1MHIS),
3-метилгистидин (3MHIS), y-аминомасляная к-та (GABA), b-аминоизомасляная к-та (BAIBA), a-аминомасляная к-та (AABA),
Пролин (PRO), Цистатионин (CYST), Лизин
(LYS), Цистин (CYS), Цистеиновая кислота
(CYSA) — в крови
Аминокислоты представляют собой структурные химические единицы, образующие белки.
Нарушение обмена аминокислот является причиной многих заболеваний (печени и почек). Анализ аминокислот (мочи и крови) является основным средством оценки степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических нарушений.
ПАланин (ALA), Аргинин (ARG), Аспарагиновая кислота (ASP), Цитруллин (CIT),
Глутаминовая кислота (GLU), Глицин (GLY),
Метионин (MET), Орнитин (ORN),
Фенилаланин (PHE), Тирозин (TYR), Валин
(VAL), Лейцин (LEU), Изолейцин (ILEU),
Гидроксипролин (HPRO), Серин (SER),
Аспарагин (ASN), a-аминоадипиновая к-та
(AAA), Глутамин (GLN), b-аланин (BALA),
Таурин (TAU), Гистидин (HIS), Треонин
(THRE), 1-метилгистидин (1MHIS),
3-метилгистидин (3MHIS), y-аминомасляная к-та (GABA), b-аминоизомасляная к-та (BAIBA), a-аминомасляная к-та (AABA),
Пролин (PRO), Цистатионин (CYST), Лизин
(LYS), Цистин (CYS), Цистеиновая кислота
(CYSA) — в крови
Аминокислоты представляют собой структурные химические единицы, образующие белки.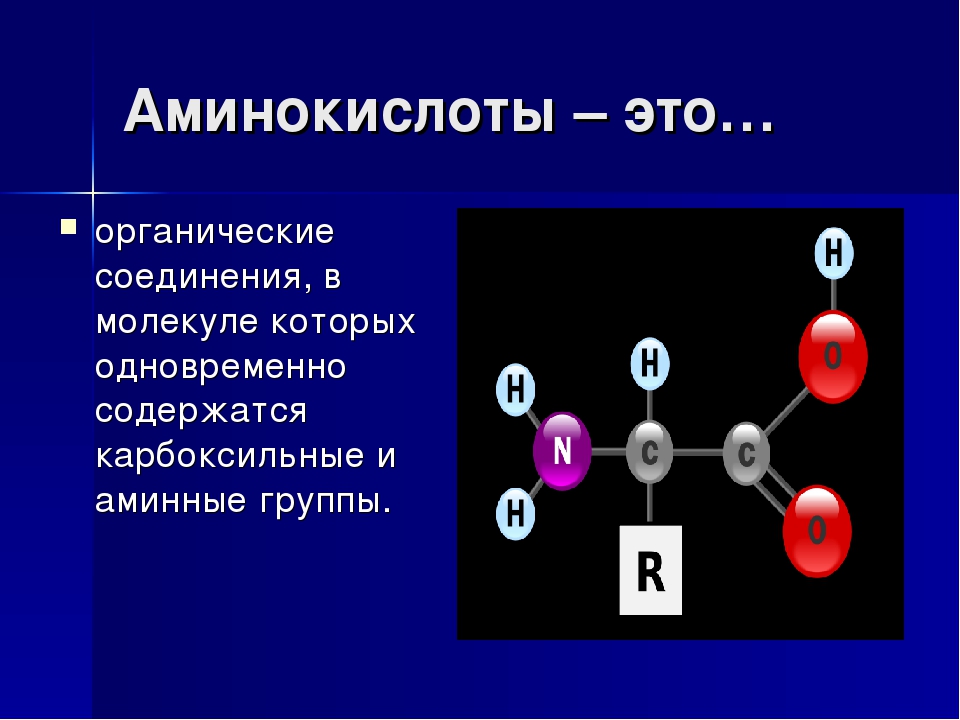 В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей.
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них:
выполняют роль нейромедиаторов (биологически активные химические вещества, посредством которых осуществляется передача электрического импульса от нервной клетки) или являются их предшественниками;
способствуют тому, что витамины и минералы адекватно выполняют свои функции;
непосредственно снабжают энергией мышечную ткань;
участвуют в ферментативных реакциях, метаболизме многих биологических веществ, иммунных реакциях, процессах детоксикации, выполняют регуляторную функцию и многое другое.
Если человеческий организм испытывает нехватку одной из обязательных аминокислот, начинаются серьёзные проблемы – депрессия, ожирение, проблемы с пищеварением и так далее, вплоть до замедления роста.
В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей.
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них:
выполняют роль нейромедиаторов (биологически активные химические вещества, посредством которых осуществляется передача электрического импульса от нервной клетки) или являются их предшественниками;
способствуют тому, что витамины и минералы адекватно выполняют свои функции;
непосредственно снабжают энергией мышечную ткань;
участвуют в ферментативных реакциях, метаболизме многих биологических веществ, иммунных реакциях, процессах детоксикации, выполняют регуляторную функцию и многое другое.
Если человеческий организм испытывает нехватку одной из обязательных аминокислот, начинаются серьёзные проблемы – депрессия, ожирение, проблемы с пищеварением и так далее, вплоть до замедления роста.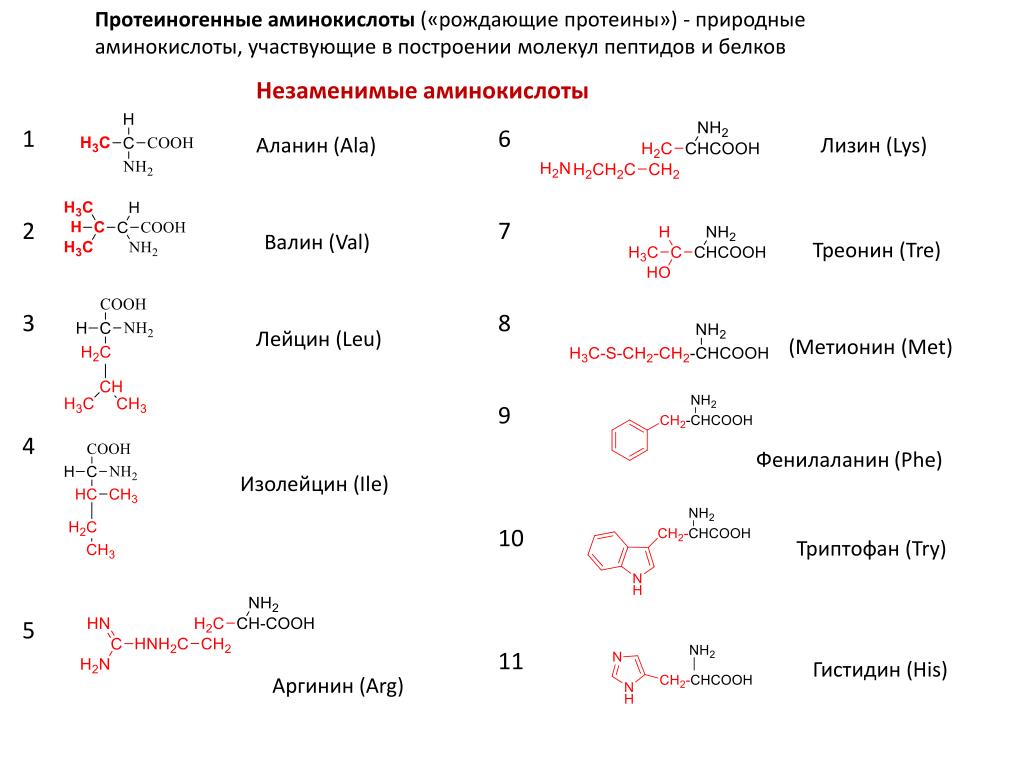 Находятся в группе риска и спортсмены, поддерживающие положительный азотный баланс в организме искусственными средствами (анаболитическими препаратами), и вегетарианцы, и худеющие при помощи диет – в силу того, что они исключают из рациона многие необходимые продукты.
Анализ аминокислот (мочи и плазмы крови) является незаменимым средством оценки достаточности и степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических заболеваний почек, печени, сердечно-сосудистой системы, дыхательных органов и т.д.
Функция основных аминокислот:
Аминокислоты (12 показателей): Аланин, аргинин, аспарагиновая кислота, цитруллин, глутаминовая кислота, глицин, метионин, орнитин, фенилаланин, тирозин, валин, отношение – лейцин/изолейцин.
Аланин-нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота (витамин B5) и коэнзим А (производит энергию, необходимую для любого вида мышечной деятельности).
Находятся в группе риска и спортсмены, поддерживающие положительный азотный баланс в организме искусственными средствами (анаболитическими препаратами), и вегетарианцы, и худеющие при помощи диет – в силу того, что они исключают из рациона многие необходимые продукты.
Анализ аминокислот (мочи и плазмы крови) является незаменимым средством оценки достаточности и степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических заболеваний почек, печени, сердечно-сосудистой системы, дыхательных органов и т.д.
Функция основных аминокислот:
Аминокислоты (12 показателей): Аланин, аргинин, аспарагиновая кислота, цитруллин, глутаминовая кислота, глицин, метионин, орнитин, фенилаланин, тирозин, валин, отношение – лейцин/изолейцин.
Аланин-нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота (витамин B5) и коэнзим А (производит энергию, необходимую для любого вида мышечной деятельности). Аланин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты (защищают организм от опухолевых клеток, сигнализируют о начале синтазе антител). Он способствует детоксикационным процессам в печени (прежде всего обезвреживанию аммиака).
Аргинин — важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аспараги?н- амид аспарагиновой кислоты. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Аспарагиновая кислотаприсутствует в организме в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Участвует в образовании пиримидиновых оснований, мочевины. Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС и др.
Аланин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты (защищают организм от опухолевых клеток, сигнализируют о начале синтазе антител). Он способствует детоксикационным процессам в печени (прежде всего обезвреживанию аммиака).
Аргинин — важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аспараги?н- амид аспарагиновой кислоты. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Аспарагиновая кислотаприсутствует в организме в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Участвует в образовании пиримидиновых оснований, мочевины. Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС и др.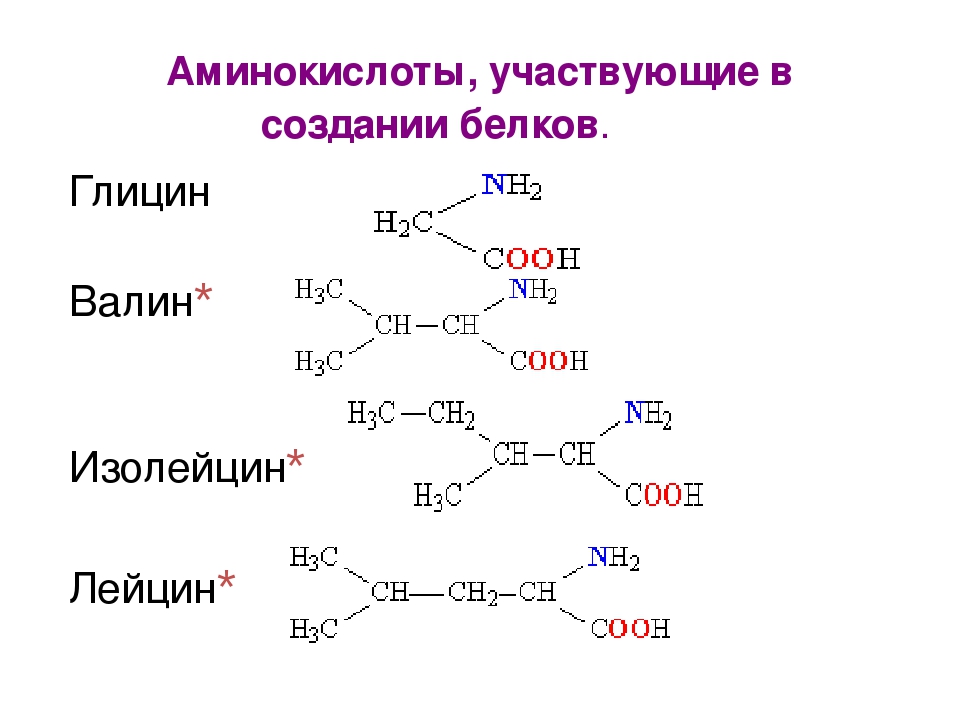 Цитруллин — аминокислота, не входящая в состав белков; вырабатывается печенью в качестве побочного продукта в процессе биосинтеза аргинина и превращения аммиака в мочевину. При паталогически повышенном содержании оказывает токсическое действие. Дети с врожденным недостатком одного из ферментов, служащих для химического расщепления белков в моче (вследствие этого в крови происходит накопление аммиака и аминокислоты цитруллина) плохо развиваются, кроме того, у них ярко выражена задержка умственного развития.
Глутаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер. Глутаминовая кислота может использоваться клетками головного мозга в качестве источника энергии.
Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты — глутамина. Этот процесс — единственный способ обезвреживания аммиака в головном мозге.
Цитруллин — аминокислота, не входящая в состав белков; вырабатывается печенью в качестве побочного продукта в процессе биосинтеза аргинина и превращения аммиака в мочевину. При паталогически повышенном содержании оказывает токсическое действие. Дети с врожденным недостатком одного из ферментов, служащих для химического расщепления белков в моче (вследствие этого в крови происходит накопление аммиака и аминокислоты цитруллина) плохо развиваются, кроме того, у них ярко выражена задержка умственного развития.
Глутаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер. Глутаминовая кислота может использоваться клетками головного мозга в качестве источника энергии.
Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты — глутамина. Этот процесс — единственный способ обезвреживания аммиака в головном мозге. Глицин- замедляет дегенерацию мышечной ткани, так как является источником креатина — вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК.
Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме. Он выполняет функцию тормозного нейромедиатора и таким образом может предотвратить эпилептические судороги.
Метионин– незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и в стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает детоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Орнитин-помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином.
Глицин- замедляет дегенерацию мышечной ткани, так как является источником креатина — вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК.
Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме. Он выполняет функцию тормозного нейромедиатора и таким образом может предотвратить эпилептические судороги.
Метионин– незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и в стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает детоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Орнитин-помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином. Орнитин также необходим для иммунной системы и работы печени, участвуя в детоксикационных процессах и восстановлении печеночных клеток.
Фенилаланин– это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту – тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Фенилаланин используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона.
Тирозин-является предшественником нейромедиаторов норадреналина и дофамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина (он борется со старением и отвечает за здоровый сон) и улучшает функции надпочечников, щитовидной железы и гипофиза.
Орнитин также необходим для иммунной системы и работы печени, участвуя в детоксикационных процессах и восстановлении печеночных клеток.
Фенилаланин– это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту – тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Фенилаланин используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона.
Тирозин-является предшественником нейромедиаторов норадреналина и дофамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина (он борется со старением и отвечает за здоровый сон) и улучшает функции надпочечников, щитовидной железы и гипофиза. Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода.
Валин— незаменимая аминокислота, оказывающая стимулирующее действие. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме. Относится к разветвленным аминокислотам, и это означает, что он может быть использован мышцами в качестве источника энергии. Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Чрезмерно высокий уровень валина может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Изолейцин— одна из незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.
Метаболизм изолейцина происходит в мышечной ткани. Изолейцин — одна из трех разветвленных аминокислот.
Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода.
Валин— незаменимая аминокислота, оказывающая стимулирующее действие. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме. Относится к разветвленным аминокислотам, и это означает, что он может быть использован мышцами в качестве источника энергии. Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Чрезмерно высокий уровень валина может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Изолейцин— одна из незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.
Метаболизм изолейцина происходит в мышечной ткани. Изолейцин — одна из трех разветвленных аминокислот. Изолейцин необходим при многих психических заболеваниях; дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Лейцин— незаменимая аминокислота, относящаяся к трем разветвленным аминокислотам. Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. Избыток лейцина может увеличить количество аммиака в организме.
Дефицит аминокислот ведет к недостаточности всех синтетических процессов в организме, особенно страдают быстрообновляющиеся системы (половая система, гуморальные системы, красный костный мозг и др.).
Наследственные нарушения, реализующиеся изменением концентраций аминокислот и ацилкарнитинов, представляют собой одну из самых многочисленных и гетерогенных групп болезней метаболизма (ФКУ, тирозинемия, гистидинемия, гиперглицинемия и многое другое).
Изолейцин необходим при многих психических заболеваниях; дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Лейцин— незаменимая аминокислота, относящаяся к трем разветвленным аминокислотам. Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. Избыток лейцина может увеличить количество аммиака в организме.
Дефицит аминокислот ведет к недостаточности всех синтетических процессов в организме, особенно страдают быстрообновляющиеся системы (половая система, гуморальные системы, красный костный мозг и др.).
Наследственные нарушения, реализующиеся изменением концентраций аминокислот и ацилкарнитинов, представляют собой одну из самых многочисленных и гетерогенных групп болезней метаболизма (ФКУ, тирозинемия, гистидинемия, гиперглицинемия и многое другое). Значение точной лабораторной диагностики данных заболеваний определяется тем, что часто их различные формы имеют сходную клиническую картину, что усложняет диагностику на клиническом этапе.
Избыточное накопление (вследствие нарушения метаболизма или других причин) многих аминокислот имеет токсический эффект: гомоцистеин, цитруллин, фенилаланин, валин и др.
Значение точной лабораторной диагностики данных заболеваний определяется тем, что часто их различные формы имеют сходную клиническую картину, что усложняет диагностику на клиническом этапе.
Избыточное накопление (вследствие нарушения метаболизма или других причин) многих аминокислот имеет токсический эффект: гомоцистеин, цитруллин, фенилаланин, валин и др.
Подготовка к ЦТ и ЕГЭ по химии
Номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Например:
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита. Пример:
Пример:
Для a-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы Nh3 – триамино и т.д.
Пример:
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
Тривиальные названия:
- Оптическая изомерия
Все a-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде зеркальных антиподов.
Оптическая изомерия природных a-аминокислот играет важную роль в процессах биосинтеза белка.
Свойства аминокислот
Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе
Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе
Химические свойства
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е.являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl = Cl— [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH = H2N–CH2–COO— Na+ + H2O
б) сложные эфиры
H+
H2N–CH2–COOH + C2H5OH = H2N–CH2–COOC2H5 + H2O
в) амиды
H2N–R–COOH + NH3 = H2N–R–CONH2 + H2O
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция для g-, d- e- и т. д. аминокислот), так и принадлежащих разным молекулам (межмолекулярная реакция).
д. аминокислот), так и принадлежащих разным молекулам (межмолекулярная реакция).
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой кислоты, в результате которого образуется e-капролактам – полупродукт для получения капрона.
Межмолекулярное взаимодействие a-аминокислот приводит к образованию пептидов. При взаимодействии двух a-аминокислот образуется дипептид Межмолекулярное взаимодействие трех a-аминокислот приводит к образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Незаменимые есть: ученые заставили клетки давать ценные аминокислоты | Статьи
Специалисты Курчатовского геномного центра создали микроорганизмы, способные производить так называемые незаменимые аминокислоты в большом количестве. Эти вещества не образуются в организме человека и животных, но нормальная жизнедеятельность без них невозможна. Для разработки ученые применили технологию редактирования генома. В 2020 году мировой рынок незаменимых аминокислот достиг $20 млрд. Благодаря достижениям наших исследователей Россия сможет побороться на нем за ведущие позиции.
Для разработки ученые применили технологию редактирования генома. В 2020 году мировой рынок незаменимых аминокислот достиг $20 млрд. Благодаря достижениям наших исследователей Россия сможет побороться на нем за ведущие позиции.
В Курчатовском геномном центре (НИЦ «Курчатовский институт» — ГосНИИгенетика) ведут работы по созданию микроорганизмов, которые смогут в большом количестве производить незаменимые аминокислоты. Особенность этих веществ в том, что организм не может их синтезировать, они поступают в него только с пищей. В сельском хозяйстве это — важнейшие составляющие кормов.
— Если незаменимые аминокислоты содержатся в недостаточном количестве в пище, то у человека нарушается нормальное развитие, а сельскохозяйственные животные медленно набирают вес, потребляя большое количество корма, — пояснил заместитель директора НИЦ «Курчатовский институт» Александр Яненко.
Специалисты уже подготовили инструментарий для направленной модификации продуцентов клеточных метаболитов в различных бактериях, включая коринебактерии, бациллы и другие простейшие организмы. В руках ученых специальные ферменты — «молекулярные ножницы», с помощью которых редактируют геномы для получения нужных штаммов. Кроме этого, чтобы направленно изменять геном (ДНК) клетки, нужно знать ее полные нуклеотидные последовательности, поэтому специалисты Курчатовского института проводят массовое полногеномное секвенирование микроорганизмов (полная расшифровка их генома). Сегодня прочитано уже больше 1 тыс.
В руках ученых специальные ферменты — «молекулярные ножницы», с помощью которых редактируют геномы для получения нужных штаммов. Кроме этого, чтобы направленно изменять геном (ДНК) клетки, нужно знать ее полные нуклеотидные последовательности, поэтому специалисты Курчатовского института проводят массовое полногеномное секвенирование микроорганизмов (полная расшифровка их генома). Сегодня прочитано уже больше 1 тыс.
В обычных условиях в клетках микроорганизма содержится не более 0,2–0,5 г аминокислоты на литр питательной среды. Для промышленного производства нужно, чтобы клетка продуцировала не менее 100 г на 1 л. Такое количество аминокислоты выделяется в среднем за 40–50 ч.
Задача ученых — так изменить метаболизм микроорганизма, чтобы он направил все силы на генерацию нужных веществ. Уже сегодня ученым Курчатовского геномного центра удалось усилить в 100 раз продукцию микроорганизмами лизина, треонина и валина, а в ближайшее время они планируют добиться таких же результатов и для триптофана.
Валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин относятся к незаменимым аминокислотам. Эти вещества не синтезируются клетками человека и животных, поэтому должны обязательно содержаться в нужном количестве в их пище. Незаменимые аминокислоты принимают активное участие в синтезе белков и других важных для организма соединений. Они необходимы для нормального роста и синтеза тканей тела, служат источником энергии в мышечных клетках. Нехватка этих веществ может приводить к быстрой утомляемости, усталости, слабости и иным нарушениям. В природе незаменимые аминокислоты синтезируют микроорганизмы, растения и грибы.
Раньше для получения микроорганизмов с нужными свойствами использовалась генная инженерия: в клетку встраивали чужеродные гены, чтобы получить больше нужной продукции. Но безопасность использования генно-модифицированных организмов вызывает слишком много вопросов, поэтому ученые разработали альтернативный метод геномного редактирования.
При таком подходе для модификации генов микроорганизма ученые используют механизмы, которые в норме существуют в клетке. В природных условиях гены изменяются, теряются или переходят с места на место. Эти процессы не выходят за рамки естественной клеточной изменчивости. То же самое ученые делают и при редактировании генов.
Из тысячи клеточных метаболитов они активируют один, который в результате начинает работать в 100 раз активнее. Клетка препятствует этому сверхсинтезу и стремится исправить дисбаланс. Она отключает синтез этого вещества на уровне взаимодействия белков с ДНК. Поэтому, чтобы «обмануть» клетку, ученые корректируют механизмы ее регуляции, меняя последовательности или даже удаляя некоторые гены. Только так можно получить штамм с нужным уровнем продуктивности.
Не так давно ученые Курчатовского геномного центра проанализировали штаммы, которые были разработаны в 1970–1980-х годах для производства незаменимой аминокислоты валина. Тогда не существовало методов направленного изменения генома.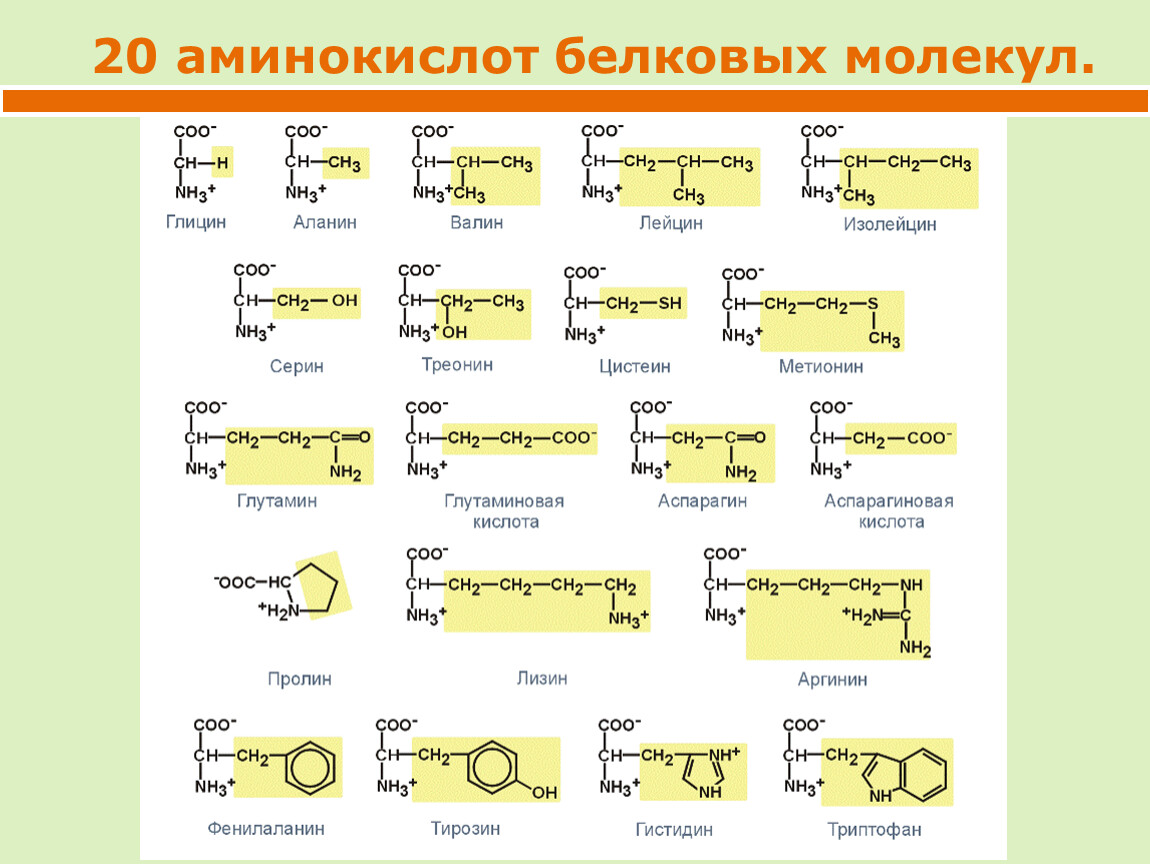 Микроорганизмы просто обрабатывали веществами (мутагенами), которые повышали частоту образования мутаций. Сегодня удалось обнаружить конкретные мутации, отвечающие за выработку валина. Их успешно ввели в геном штамма-суперпродуцента.
Микроорганизмы просто обрабатывали веществами (мутагенами), которые повышали частоту образования мутаций. Сегодня удалось обнаружить конкретные мутации, отвечающие за выработку валина. Их успешно ввели в геном штамма-суперпродуцента.
— В 2020 году мировой рынок незаменимых аминокислот составил около $20 млрд. Благодаря достижениям наших ученых Россия сможет обеспечить незаменимыми аминокислотами собственное животноводство, а также побороться за ведущие позиции на этом рынке, — считает Александр Яненко.
На верном путиПрочесть геномы более 1 тыс. микроорганизмов — уже значительный научный результат, уверен директор научного центра «RASA-Политех» Санкт-Петербургского политехнического университета Петра Великого (вуз — участник проекта повышения конкурентоспособности образования «5-100») Игорь Радченко.
— Обычно генетическая информация многомерна: один и тот же ген может одновременно влиять на несколько, казалось бы, независимых функций организма. Поэтому специалисты из Курчатовского института пошли по верному пути, взяв для модификации одноклеточные микроорганизмы, — отметил эксперт.
Поэтому специалисты из Курчатовского института пошли по верному пути, взяв для модификации одноклеточные микроорганизмы, — отметил эксперт.
На примере единичных клеток легко увидеть результаты редактирования, полагает ученый. Кроме того, в процессе исследования можно отделить клетки, где процесс происходит удачно. Таким образом создается колония отредактированных клеток, которая продолжает делиться и развиваться. И все клетки-потомки несут именно те генетические изменения, которые были заложены изначально, добавил Игорь Радченко.
— Во всем мире проводят работы, направленные на получение эффективных штаммов-продуцентов. Безусловно, применение этих технологий в России имеет огромное значение как для развития отечественной промышленности, так и сельского хозяйства, — сказала доцент Исследовательской школы химических и биомедицинских технологий Томского политехнического университета Александра Першина.
Разработки в данной области довольно быстро коммерциализируются, добавила она.
Всем ли нужен дополнительный коллаген и где его брать?
ЧТО ТАКОЕ КОЛЛАГЕН
Коллаген – это белок, состоящий преимущественно из трех аминокислот: глицина, пролина и гидроксипролина, а также гидроксилизина. Глицин и пролин мы синтезируем сами, а вот лизин должны употреблять с пищей. Это незаменимая аминокислота.
Гидроксипролин и гидроксилизин делают в уже синтезированном протоколагене ферменты гидроксилазы. Для этой реакции нужна аскорбиновая кислота, то есть витамин С. Вне клеток-фибробластов коллагеновые волокна проходят сборку и сочетаются поперечными сшивками, которые обеcпечивают упругость и прочность каркаса.
Коллаген в коже разрушается и заменяется новым. Его образование поддерживают половые гормоны: эстрогены у женщин, тестостерон у мужчин. Коллаген может портиться в результате свободнорадикальных процессов в коже, а также благодаря действию ультрафиолета. Последний процесс называется фотостарением и имеет достаточно длительный эффект.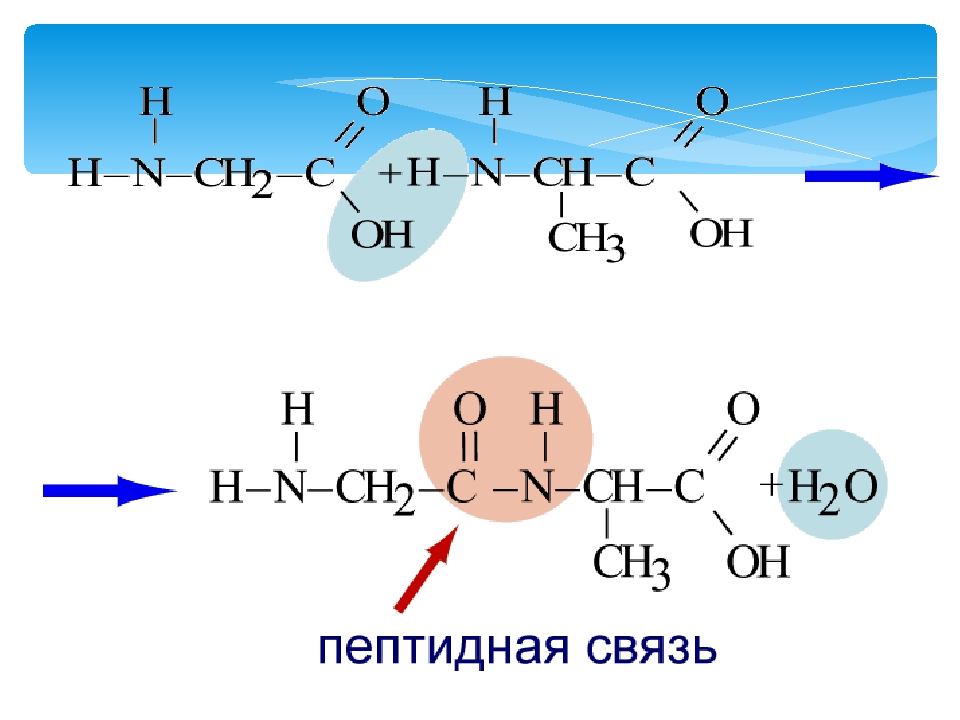 Включаются гены разрушения коллагена, и подавляются гены синтеза.
Включаются гены разрушения коллагена, и подавляются гены синтеза.
Итак, чтобы в коже или других органах был коллаген, нужны незаменимые аминокислоты, витамин С, определенный уровень половых гормонов и отсутствие длительного воздействия ультрафиолета. Незаменимые аминокислоты можно употребить не только в добавках коллагена, а коллаген из крема, даже его пептиды, если они не величиной с 2–3 аминокислоты, в кожу не проникнут. И точно не встроятся.
КАКИЕ СУЩЕСТВУЮТ ДОКАЗАТЕЛЬСТВА ЭФФЕКТИВНОСТИ ПРИМЕНЕНИЯ ДОБАВОК КОЛЛАГЕНА?
При остеоартрите (ОА), когда разрушается внутренняя поверхность суставов, протокол советует местное применение нестероидных противовоспалительных препаратов. О коллагене и других «хондропротекторах» речь не идет. Однако метаанализ исследований, когда люди с ОА принимали коллаген, сообщает, что они какое-то время испытывают меньшую боль, но ничего не восстанавливается. В долгосрочной перспективе добавки совсем не спасают. Сейчас только подтверждено, что никакие добавки неэффективны в качестве лекарства от ОА. Поэтому если вы бегаете, и вам советуют пить коллаген, потому что «стираются колени», не соглашайтесь. Пока у вас нормальный индекс массы тела и здоровый рацион, остеоартрит вам не грозит.
Сейчас только подтверждено, что никакие добавки неэффективны в качестве лекарства от ОА. Поэтому если вы бегаете, и вам советуют пить коллаген, потому что «стираются колени», не соглашайтесь. Пока у вас нормальный индекс массы тела и здоровый рацион, остеоартрит вам не грозит.
Ревматоидный артрит (РА) – хроническое, связанное с воспалением, аутоиммунное заболевание, когда в суставах разрушается хрящ. Протокол лечения РА также не предусматривает применения коллагена. Но уже не первое десятилетие исследуют влияние добавок с коллагеном на состояние пациентов. Некоторые работы показали улучшение состояния суставов и уменьшение боли и отека, но при условии, что у пациентов нет аутоантител к коллагену. То есть не каждый случай РА сопровождается разрушением коллагена.
Заживление ран. Коллаген коров и нильской тилапии – эффективный новейший материал для покрытия ран. Локальное применение коллагеновой сетки активирует работу фибробластов – клеток дермы, которые образуют коллаген и другие компоненты матрикса и участвуют в заживлении ран.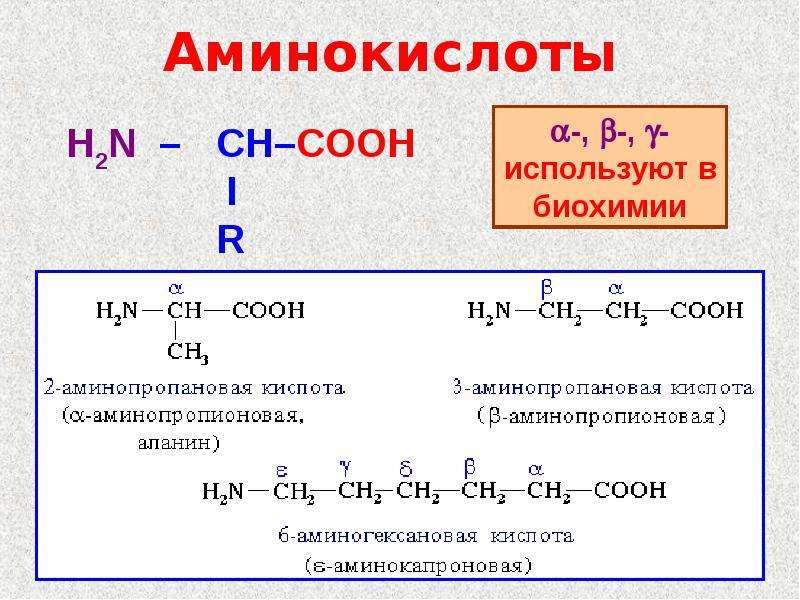 Это не добавки, это – новые материалы и случай, когда коллаген находит применение в медицине.
Это не добавки, это – новые материалы и случай, когда коллаген находит применение в медицине.
Упругость и целостность кожи. Коллаген является источником аминокислот. Войдут ли они в состав нового коллагена, зависит от гормонального фона, наших энергозатрат, пребывания на солнце и потребности кожи в восстановлении. Некоторые исследования действительно показали, что люди, которые на протяжении нескольких месяцев ежедневно употребляли коллаген, имели более упругую кожу, а пролин из пептидов коллагена эффективно доходит до кожи.
Интересную сторону вопроса открывают пептиды коллагена. Его расщепление в кишечнике может быть неполным, и ди-, три- или даже чуть большие пептиды (фрагменты белка из двух, трех или более аминокислот) проникают в кровь. Пептиды могут активировать фибробласты кожи и способствовать образованию ими гиалуроновой кислоты и эластана, а также брать на себя удар свободных радикалов и тем самым защищать кожу от некоторых аспектов фотостарения.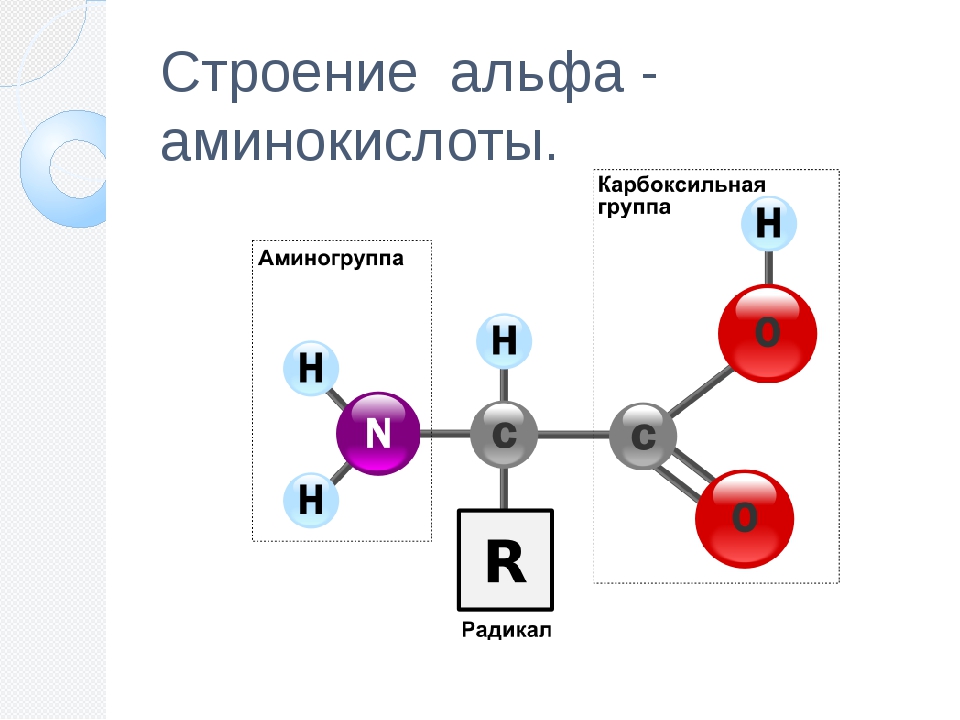
Люди с пролежнями. Рандомизированные исследования, проведенные в нескольких клинических центрах, показали эффективность дополнения рациона больных с пролежнями 10 граммами пептидов коллагена, железом и витамином С.
ГДЕ ВЗЯТЬ КОЛЛАГЕН
Исследования, проведенные еще в 1980-е, доказали, что коллаген успешно расщепляют ферменты нашего желудка и поджелудочной железы. Но дальнейшие работы показали, что если пить частично расщепленный (гидролизованный) коллаген, то уровень аминокислот в крови растет быстрее. В конце концов они все равно попадают в кровоток. Всем известен частично гидролизованный коллаген – желатин. Вы можете его добавлять к фруктовым пюре и делать желе – это соединит витамин С, флавоноиды с аминокислотами коллагена. Коллаген или его аминокислоты есть в ухе и студне, поэтому можете время от времени готовить студенистые блюда. Хотя это все равно не гарантирует, что аминокислоты достанутся фибробластам кожи, а не станут источником энергии или мышцами, например.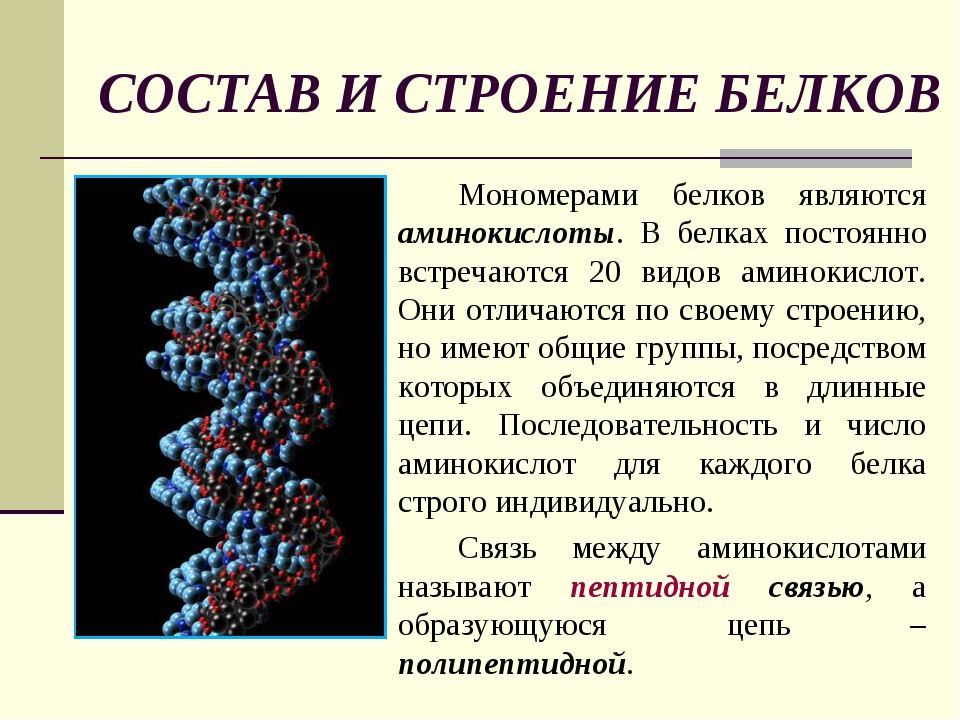
Вы можете пить коллаген или его пептиды. Если не болит желудок и хорошо происходит пищеварение, никто этого не запрещает. В исследованиях на мышиной модели старения фигурируют дозы 400–800 мг/кг. То есть если перевести на людей, лицу весом 60 кг следует ежедневно есть по крайней мере 24 грамма коллагена. Это как большая пачка желатина и половина дневной порции белка – многовато. Людям советуют есть его 5–15 граммов в сутки. В исследованиях на людях преимущественно использовали дозу 3–8 граммов в сутки в течение нескольких месяцев.
Источник
Тест по химии по темам «Аминокислоты», » Белки.» | Методическая разработка по теме:
Вариант 1.
1.Аминокислоты являются амфотерными соединениями, так как они взаимодействуют:
а) с кислотами
б) щелочами
в) спиртами
г) кислотами и щелочами
2.Самые слабые кислотные свойства проявляет кислота:
а) уксусная
б) хлоруксусная
в) аминоуксусная
г) дихлоруксусная
3. Полимерную природу имеют:
Полимерную природу имеют:
а) жиры
б) воски
в) белки
г) аминокислоты
Вариант 2.
1.Аминокислоты проявляют свойства:
а) только кислотные
б) только основные
в) амфотерные
г) свойства не изучены
2.Верным является утверждение, что аминокислоты – это:
а) твёрдые вещества молекулярного строения
б) кристаллические вещества ионного строения
в) жидкости, хорошо растворимые в воде
г) кристаллические вещества с низкими температурами плавления
3.Белками называют природные полимеры, молекулы которых:
а) построены из остатков карбоновых кислот
б) построены из остатков – аминокислот
в) являются сложными эфирами глицерина и высших карбоновых кислот
г) построены из остатков – аминокислот
Вариант 3.
1.Аминокислоты, проявляя амфотерные свойства, взаимодействуют:
а) с кислотами
б) основаниями
в) кислотами и основаниями
г) спиртами
2. При взаимодействии аминокислот со спиртами образуются:
При взаимодействии аминокислот со спиртами образуются:
а) сложные эфиры
б) соли
в) дипептиды
г) простые эфиры
3.В полимерной цепи белков соседние остатки аминокислот связаны друг с другом связью:
а) водородной
б) ионной
в) пептидной
г) дисульфидной
Вариант 4.
1.При взаимодействии аминокислот с щелочами и кислотами образуются:
а) соли
б) сложные эфиры
в) дипептиды
г) полипептиды
2.Верным является утверждение, что аминокислоты – это вещества:
а) кристаллические
б) растворимые в воде
в) с высокими температурами плавления
г) все ответы верны
3.Полимерную природу не имеет:
а) гемоглобин
б) инсулин
в) глицерин
г) капрон
Ответы:
Вариант 1.
1.г
2.в
3.в
Вариант 2.
1.в
2.б
3.б
Вариант 3.
1.в
2.а
3.в
Вариант 4.
1.а
2.г
3.в
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации. Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рис. 1. Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху — синий кружок; внизу — все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.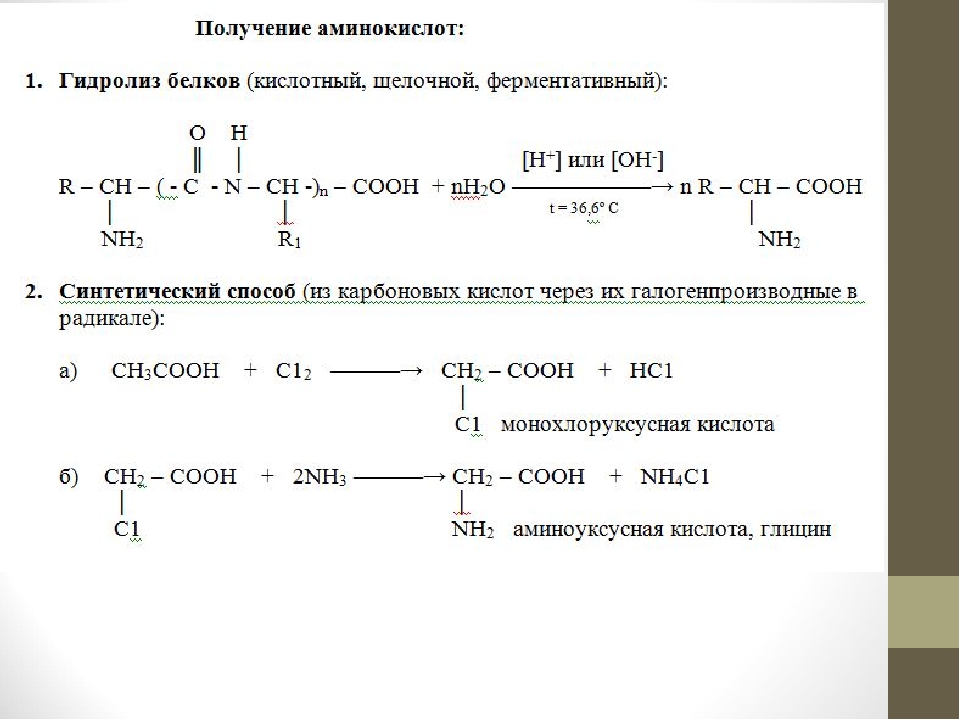
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.
Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизируются тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, которые растворены в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембраны. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, и картина отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота AlaАланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке.Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Аминокислота ArgУ человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован человеческим телом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования в этих областях все еще продолжаются.Аргинин также может быть произведен синтетически, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
Аминокислота AsnВ 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, он был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка.Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Глутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У людей глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Аминокислота GluГлутаминовая кислота была выделена из пшеничного глютена в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычного промежуточного продукта α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты может действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота GlyГлицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной неактивной оптически (без d- или l-стереоизомеров). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
His-аминокислотаГистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого периода времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Иле-аминокислотаИзолейцин был выделен из патоки свекловичного сахара в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он включен.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота LeuЛейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма. Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота LysЛизин был впервые выделен из казеина молочного белка в 1889 году, а его структура выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в функционировании гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете. Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Met аминокислотаМетионин был выделен из казеина молочного белка в 1922 году, а его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Связанный с содержанием серы, метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Аминокислота PheФенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Человеческий организм обычно способен расщеплять фенилаланин на тирозин, однако у людей с наследственным заболеванием фенилкетонурия (PKU), фермент, который выполняет это преобразование, неактивен. Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro аминокислотаВ 1900 году пролин был синтезирован химическим путем. На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота SerСерин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью подавляя фермент.Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота ThrТреонин был выделен из фибрина в 1935 году и синтезирован в том же году. Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота TrpСтруктура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих. В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота TyrВ 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году. Присутствует только в l-стереоизомере в белки млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина.В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет при контакте с воздухом.
Val аминокислотаСтруктура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году.В белке млекопитающих появляется только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным при отсутствии лечения.
Как аминокислоты образуют белок — стенограмма видео и урока
Аминокислотная структура
Независимо от того, содержится ли белок в пище на обеденной тарелке или в вашем теле, он состоит из цепочки аминокислот.Вашему организму необходимы 20 различных аминокислот; некоторые из них вырабатываются в вашем теле, а другие должны поступать с пищей.
Все аминокислоты имеют одинаковую основную структуру. Мы видим центральный атом углерода, который обозначен буквой C, связанный с четырьмя различными компонентами. Мы видим атом водорода, который обозначен этой буквой H. У нас также есть карбоксильная группа, которая здесь COOH; и аминогруппа, которая представляет собой Nh3 с другой стороны.
Итак, у нас есть группа C, некоторые O, H и N в основной структуре аминокислоты, что означает, что наиболее распространенными атомами в аминокислотах являются углерод, кислород, водород и азот, но вы, вероятно, также заметили Группа R.Это представляет собой боковую цепь, и именно боковая цепь отличает 20 аминокислот друг от друга. Однако в этом уроке нас беспокоит то, как разные аминокислоты объединяются в белки. Так что давайте останемся на этом пути.
Источники аминокислот
Мы упоминали, что некоторые аминокислоты вырабатываются вашим организмом, а другие — из вашего рациона. На самом деле мы не думаем о потреблении разных аминокислот. Мы едим белок, который содержится в таких продуктах, как мясо, рыба, яйца, а также в некоторых растительных продуктах, таких как бобы и орехи.
Ваша пищеварительная система принимает эти белковые продукты и расщепляет их на отдельные аминокислоты, которые затем поглощаются клетками вашего тела и собираются в новые белки, подобно тому, как строитель может снести здание, а затем спасти его части. построить новую структуру.
Формирование полипептидов и белков
Внутри ваших клеток отдельные аминокислоты могут связываться вместе, образуя пептидную связь , которая представляет собой просто химическую связь, соединяющую аминокислоты вместе.Более конкретно, пептидные связи соединяют карбоксильную группу одной аминокислоты с аминогруппой другой.
Например, аминокислота под названием глицин может связываться с аминокислотой под названием аланин с образованием дипептида . Приставка «ди» означает два, поэтому дипептид определяется как соединение, состоящее из двух аминокислот. Аминокислоты не могут просто соединиться, взявшись за руки; им действительно нужно от чего-то отказаться, чтобы жить вместе.
В нашем примере с дипептидом глицин отдает атом водорода и атом кислорода, в то время как аланин теряет атом водорода.Вместе они выделяют молекулу под названием h3O, и, держу пари, вы узнаете, что это молекула воды. Эта потеря воды для образования связи называется реакцией синтеза дегидратации . Это большой термин, но его легко запомнить, если вспомнить, что обезвоживание — это потеря воды, а синтез — это наращивание. Итак, белок строится за счет синтеза обезвоживания.
Конечно, простое соединение двух аминокислот все еще далеко от белка. Необходимо соединить больше аминокислот, пока у вас не будет цепочки аминокислот, соединенных пептидными связями, что даст нам полипептид .Полипептиды важны для организма, и их можно найти в таких местах, как гемоглобин крови, несущий кислород.
Белки, ну, они также представляют собой длинные цепочки аминокислот, и есть некоторые споры о различии между маленьким белком и полипептидом, но мы действительно видим, что некоторые более крупные белки могут содержать множество полипептидов, свернутых и свернутых вместе.
Итоги урока
Давайте рассмотрим. Белки — настоящие рабочие лошадки тела, необходимые для строительства конструкций и поддержания жизни.Основными строительными блоками белков являются аминокислот .
Все 20 различных аминокислот, необходимых вашему организму, имеют одинаковую базовую структуру, которая представляет собой центральный атом углерода, присоединенный к атому водорода, карбоксильную группу, аминогруппу и переменную группу R или боковую цепь, которая дает аминогруппу. кислота его уникальность.
Пептидная связь — это химическая связь, которая соединяет аминокислоты вместе, где карбоксильная группа одной аминокислоты связывается с аминогруппой другой.В результате образуется дипептид , который представляет собой простое соединение, состоящее из двух аминокислот. Для образования связи требуется потеря воды, что называется реакцией синтеза дегидратации .
Другие аминокислоты могут соединяться аналогичным образом, пока у вас не будет цепочки аминокислот, соединенных вместе пептидными связями, что приведет к полипептиду . Белки также представляют собой длинные цепи аминокислот, а некоторые более крупные белки могут содержать множество полипептидов, свернутых и свернутых вместе.
Результаты обучения
По завершении этого урока вы должны уметь:
- Определять белки и аминокислоты и назначение каждого из них
- Объясните процесс, приводящий к образованию аминокислот
- Опишите, как аминокислоты приводят к образованию белков
Аминокислоты — это органические соединения, содержащие как аминогруппу, так и карбоксильную группу. Аминокислоты имеют общий вид: , где COOH означает карбоксильную группу, показанную выше.Есть 20 аминокислот, из которых состоят белки живых организмов, различающиеся R-группами. Простейшая из аминокислот, глицин, имеет только H в качестве R-группы. Аминокислоты — это структурные элементы, из которых строятся белки. Когда аминокислоты связываются друг с другом, это происходит в форме амида, образуя соединение, которое называется пептидной связью. Это можно проиллюстрировать на примере двух простейших аминокислот, глицина и аланина. «Аминокислоты используются для синтеза определенных гормонов, других аминокислот, некоторых нейротрансмиттеров (химические вещества, используемые для связи между нейронами) и новых белков.Эти белки играют разнообразную роль в организме, действуя как ферменты, рецепторы на клеточных мембранах, молекулы транспорта кислорода (гемоглобин), структурные компоненты (волосы и ногти), гормоны, антитела и мышечные белки »(Audesirks). Согласно Тиллери и др., Человеческий организм может синтезировать все аминокислоты, необходимые для построения белков, за исключением десяти, называемых «незаменимыми аминокислотами», которые обозначены звездочками на иллюстрациях аминокислот. Адекватная диета должна содержать эти незаменимые аминокислоты.Обычно они поставляются в виде мясных и молочных продуктов, но если они не потребляются, необходимо проявлять осторожность, чтобы обеспечить их достаточное количество. Они могут быть снабжены комбинацией злаков (пшеница, кукуруза, рис и т. Д.) И бобовых (фасоль, арахис и т. Д.). Тиллери указывает, что ряд популярных этнических продуктов включает такую комбинацию, так что в одном блюде можно надеяться получить десять незаменимых аминокислот. Мексиканская кукуруза и фасоль, японский рис и соевые бобы, а также красная каджунская фасоль и рис — примеры таких случайных комбинаций. Аминокислоты могут образовывать как левую, так и правую молекулярную симметрию, но примечательно, что все живое на Земле содержит левовращающие аминокислоты в качестве строительных блоков своих белков. Этот факт делает примечательными аминокислоты, обнаруженные в метеорите Мерчисон, которые представляли собой почти равные смеси левых и правых аминокислот для центральной части. Это равное население само по себе было бы убедительным доказательством своего внеземного происхождения, даже если бы оно не наблюдалось в 1969 году вблизи Мерчисона, Австралия.Есть некоторая загадка, почему в метеорите Мерчисон действительно обнаружено некоторое повышение уровня L-аминокислоты после учета загрязнения, как и в метеорите GRA 95229 из Антарктиды. Wiki: аминокислота | Индекс Биохимические концепции Химические концепции Ссылки Tillery, Enger and Ross Audesirk & Audesirk Matthewshern |
Наука на расстоянии
Наука на расстоянии Наука на расстоянииКонспект лекций
проверка
Используйте этот раздел, чтобы проверить точность ваших лекционных заметок.Убедитесь, что вы записали следующие определения, объяснения и важные концепции в своих заметках.
Физическая структура — Часть третья
Аминокислоты
Аминокислоты — это мономеры, используемые для построения цепей, которые в конечном итоге становятся белками. Существует примерно 20-22 различных распространенных аминокислоты.- Ключевые идеи:
- : все обычные аминокислоты, кроме одной, имеют одинаковую общую структуру.
- четыре различных функциональных или реакционноспособных группы присоединены к центральному атому углерода.
- каждая аминокислота имеет аминогруппу, атом водорода, группу карбоновой кислоты и группу вариабельной боковой цепи, обычно обозначаемую буквой R .
- эта R-группа варьируется от одной аминокислоты к другой; он может быть таким же простым, как атом водорода (чтобы дать аминокислоту глицин ), или таким сложным, как фенольное кольцо (чтобы дать аминокислоту фенилаланин).
- некоторые из этих боковых цепей R-группы являются гидрофильными, а некоторые — гидрофобными.
Полипептиды и пептидная связь
Аминокислоты — это мономеры. Они соединяются в длинные цепочки с помощью химических реакций, которые удаляют воду и создают между ними соединения, называемые пептидными связями- Ключевые идеи:
- при соединении двух аминокислот вместе клетки проводят химическую реакцию между аминогруппой одной аминокислоты и группой карбоновой кислоты второй аминокислоты.
- по мере протекания химической реакции атом азота аминогруппы ковалентно связан непосредственно с атомом углерода группы карбоновой кислоты.
- молекула воды удаляется во время этой реакции, которая называется реакцией конденсации или дегидратационным синтезом .
- Четыре атома азота, водорода, углерода и кислорода, которые связывают две аминокислоты вместе, называются пептидной связью .
- две аминокислоты, связанные вместе, называются дипептидом , а длинная цепь аминокислот называется полипептидом .
Полипептиды и аминокислотные последовательности
Если существует 20 различных общих аминокислот, и любая из них может появиться в любом положении, тогда небольшой полипептид, имеющий только 8 аминокислот по длине, потенциально может иметь 20 x 20 x 20 x 20 x 20 x 20 x 20 x 20. различные возможные последовательности.Это очень большая цифра (20 х 20 х 20 х 20 х 20 — это уже 3,2 миллиона!).- Ключевые идеи:
- полипептиды являются гетерополимерами.
- число возможных последовательностей аминокислот даже в самом маленьком полипептиде очень велико.
- для полипептидов длиной 200-500 аминокислот (общий диапазон для многих белков) возможные последовательности составляют миллионы миллионов.
- не все из этих возможных последовательностей используются клетками (точно так же, как не все комбинации букв образуют слова на языке), но разнообразие полипептидных последовательностей является важным фактором в их роли и свойствах в клетке.
- клетки человека могут содержать от 40 000 до 60 000 различных полипептидов, каждый со своей собственной уникальной последовательностью.
- для функционирования этих макромолекул жизненно важно, чтобы последовательность аминокислот была точно правильной. Всего одна ошибка (одна аминокислота в неправильном месте) может быть фатальной для клетки и для организма.
Структура белков
При растворении в воде полипептиды принимают уникальную форму. В полностью свернутом белке можно наблюдать несколько уровней структуры.- Ключевые идеи:
- линейная последовательность аминокислот вдоль полипептидной цепи представляет собой первичную структуру
- аминокислотные R-группы вдоль полипептидных цепей взаимодействуют друг с другом, образуя правильные и предсказуемые формы; альфа-спираль (катушка), бета-гофрированный лист (зубчатый или зигзагообразный узор) и случайное блуждание или катушка (не повторяющаяся). Эти обычные шаблоны складывания называются вторичной структурой .
- частей полипептидных цепей и их аминокислотных R-групп также взаимодействуют с окружающей водой и окружающей средой.Эти силы изгибаются, скручиваются и придают молекуле более сложные трехмерные формы.
- гидрофильные R-группы сильно взаимодействуют с окружающей водой и помогают сохранять растворимость и суспензию белка в жидкости.
- гидрофобные R-группы чаще всего обнаруживаются глубоко внутри конечного белка, где меньше шансов, что они вступят в контакт с молекулами воды и дестабилизируют белок.
- окончательная форма на этом уровне называется третичной структурой
- некоторые белки представляют собой комплексы из нескольких субъединиц и дополнительных небелковых добавок; это четвертичный уровень структуры .
Роль белков
Белки — это самый универсальный класс биополимеров. Они играют огромное количество разнообразных ролей в клетках и живых организмах.- Ключевые идеи:
- структурный ; в мембранах клеток и во внеклеточных белках, таких как коллаген, белки играют важную роль в поддержании формы организма.
- ядовитый ; Многие организмы, от обычных садовых растений до экзотических змей, производят белковые коктейли, смертельно опасные для других организмов.Эти яды используются, чтобы обезвредить и убить добычу или защитить производителя.
- защитный ; организмы, такие как люди, производят классы белков, которые используются для защиты от вторжения вирусов, бактерий или других вредных агентов; это антитела.
- мессенджеры ; гормоны, которые помогают передавать информацию по телу и координировать метаболические процессы, часто являются белками.
- специалиста ; специально созданные белки выполняют удивительный набор уникальных функций, таких как способность мышц сокращаться.
- химические регуляторы ; ферменты — это белки, регулирующие скорость химических реакций.
Нуклеиновые кислоты I: нуклеотиды
Мономеры нуклеиновых кислот являются наиболее сложными. Цепочки этих мономеров, полинуклеотидов , функционируют как агенты хранения, распределения и передачи информации почти для всех живых существ.- Ключевые идеи:
- нуклеотид является мономером для обоих основных классов полинуклеотидов.
- нуклеотид состоит из 5-углеродного сахара, фосфатной группы и азотистого основания (сложная химическая группа из одного или двух связанных колец из углерода и азота)
- два разных сахара, рибоза и дезоксирибоза, используются в двух основных классах нуклеотидов.
- пять общих азотистых оснований, аденин, гуанин, цитозин, тимин и урацил являются компонентами нуклеотидов.
- теоретически может быть десять различных нуклеотидов, но природа использует только восемь из десяти возможных.
Нуклеиновые кислоты II: РНК
Нуклеотиды соединяются путем образования ковалентных связей между фосфатной группой одного нуклеотида и молекулой сахара второго нуклеотида.- Ключевые идеи:
В этой молекуле используется
- нуклеотида, построенных вокруг сахара рибозы.
- эта молекула называется рибонуклеиновой кислотой или РНК .
- четыре азотистых основания, используемые в РНК, — это аденин, гуанин, цитозин и урацил.
- Молекула РНК представляет собой одну цепь связанных рибонуклеотидных оснований.
Нуклеиновые кислоты III: ДНК
Молекулы ДНК — одни из самых крупных макромолекул. Две полинуклеотидные цепи закручены друг вокруг друга двойной спиралью. Эта молекула играет жизненно важную роль в хранении и использовании информации.- Ключевые идеи:
В этой молекуле используется
- нуклеотида, построенных вокруг сахара дезоксирибозы.
- эта молекула называется дезоксирибонуклеиновой кислотой или ДНК .
- четыре азотистых основания, используемые в ДНК, — это аденин, гуанин, цитозин и тимин.
- две параллельные цепи связанных дезоксирибонуклеиновых кислот закручены друг вокруг друга в виде двойной спирали.
- азотистые основания переходят в центр спирали.
- основание из одной нити попадает в пары с основанием из противоположной нити.
- основание аденина всегда соединяется с основанием тимина, а основание гуанина всегда соединяется с основанием цитозина; часто обозначается как A : T и G : C .
Роли нуклеиновых кислот
Молекулы ДНК и РНК участвуют в хранении и использовании биологической информации в клетках и живых организмах. Генетические сообщения хранятся в виде линейных последовательностей оснований в молекулах ДНК, которые затем копируются в эквивалентные последовательности, как молекулы РНК. Эти молекулы РНК затем переносят информацию в те части клетки, где происходит перевод и интерпретация сообщения. ДНК также является молекулой, которая передается от одной клетки к другой и от одного поколения к другому.- Ключевые идеи:
- генетическая информация хранится в виде последовательности нуклеотидов (как их оснований) по длине молекулы полинуклеотида.
- В большинстве организмов информация хранится в молекулах ДНК и на них, но некоторые вирусы, такие как вирус ВИЧ, используют для этой цели РНК.
- в каждом поколении эти молекулы ДНК точно копируются, а копии содержащейся в них информации передаются следующему поколению.
- клетки передают информацию таким образом во время деления клеток.
- половое размножение включает в себя копирование и передачу молекул ДНК от двух родителей следующему поколению.
- при необходимости информация копируется из молекулы ДНК в форму молекулы РНК, которая затем используется на следующем этапе. ДНК никогда не используется напрямую для этой цели.
- Молекулы РНК несут сообщения от ДНК к следующему этапу трансляции и использования этой информации.
Наука на расстоянии
© 1997, 1998, 1999, 2000, профессор Джон Бламир
Аминокислоты
Встречающиеся в природе аминокислоты имеют общую структуру.Аминокислоты, как следует из названия, имеют две функциональные группы, аминогруппу (–NH 2 ) и карбоксильную группу (–COOH). Эти группы соединены с одним (алифатическим) углеродом. В органической химии углерод, непосредственно связанный с карбоксильной группой, находится в альфа (α) положении, поэтому все аминокислоты в белках состоят из альфа-аминокислот. Боковые цепи, которые отличают одну аминокислоту от другой, прикреплены к альфа-углероду, поэтому структуры часто записываются, как показано на рисунке, где R обозначает одну из 20 боковых цепей:
Аминокислоты, обнаруженные в белках, имеют общая стереохимия . В структуре, показанной на рисунке, аминогруппа всегда находится слева от альфа-углерода. В органической химии эта стереохимия обозначается как L (для levo, означает слева). Таким образом, аминокислоты, содержащиеся в белках, представляют собой L-альфа-аминокислоты. (Биохимики, будучи созданиями привычки, обычно не ссылаются на стереохимию аминокислот в номенклатуре R и S.) Некоторые D-аминокислоты встречаются в природе, но не в клеточных белках. (Буква D происходит от dextro, означает право.) Например, некоторые пептидные антибиотики, такие как бацитрацин, содержат D-аминокислоты.
Карбоксильная и аминогруппа аминокислот могут соответственно отдавать протон воде и принимать протон от воды. Этот обмен происходит одновременно в растворе, так что аминокислоты образуют дважды ионизированные частицы, называемые цвиттерионами (от немецкого zwei, означает два) в растворе. Образование цвиттерионов можно объяснить из принципов кислотно-щелочной химии.Самая сильная кислота, которая может существовать в воде, — это сопряженная кислота воды, ион гидроксония, H 3 O + . Карбоновые кислоты — более сильные кислоты, чем вода, поэтому карбоксильная группа аминокислоты (pK , около 2) отдает протон воде. Точно так же α-аминогруппы (pK a больше 9) являются более сильными основаниями, чем вода, и будут принимать протон из воды. Следовательно, аминокислоты в воде имеют общую структуру:
Боковые цепи аминокислот придают им различные химические свойства и позволяют белкам иметь множество различных структур.Сколько возможно белков? Белковые цепи обычно имеют размер от 100 до 1000 аминокислот в длину. Даже если ограничиться наименьшей длиной цепи, возможных первичных структур будет 20 100 , более 10 130 , то есть 1 со 130 нулями после нее. (Опять же, помните, что количество элементарных частиц во Вселенной оценивается в 10 80 .) Очевидно, что не все эти потенциальные белки существуют в природе. Вместо этого первичные структуры белков связаны друг с другом, и почти все белки имеют гомологов, то есть других белков, имеющих общего предка.
Какие гомологи возможны? В общем, гомологичные белки точно имеют некоторые короткие аминокислотные последовательности. В других случаях различия приводят к замене одной боковой цепи аминокислоты другой химически подобной. Существует шесть классов боковых цепей аминокислот; в пределах группы боковые цепи аминокислот химически подобны. Замена одной боковой цепи аминокислоты на другую в той же группе известна как консервативная замена . Гомологичные белки связаны консервативными аминокислотными заменами, как показано на рисунке.Хотя неконсервативные замены допустимы в некоторых положениях в первичной последовательности белка, общее правило, проиллюстрированное на рисунке, соблюдается при оценке взаимосвязи двух первичных последовательностей белка. (Пунктиром показано, что все три белка имеют одну и ту же аминокислоту в этом положении — это действительно очень гомологичные белки!)
Рисунок 2
Алифатические аминокислоты. Боковые цепи глицина, аланина, валина, лейцина и изолейцина, показанные на рисунке, содержат только насыщенные углерод-углеродные и углерод-водородные связи.Представление о глицине как о содержащем боковую цепь может несколько сбивать с толку, потому что четвертый заместитель на α-углероде представляет собой только один атом водорода. Единственный из 20 аминокислот глицин не является оптически активным; номенклатура D и L не имеет значения. Аланин имеет метильную группу для боковой цепи, валин — 3-углеродную боковую цепь, в то время как лейцин и изолейцин имеют 4-углеродные боковые цепи.
Рисунок 3
Ароматические аминокислоты. Фенилаланин, тирозин и триптофан содержат кольцевые системы. В порядке возрастания сложности фенилаланин имеет бензильную группу, тогда как тирозин представляет собой фенилаланин с добавленной гидроксильной группой в транс-положении относительно метильной группы. У триптофана два кольца, одно из которых содержит атом азота. Азот не ионизируется при биологически значимых значениях pH.
Ионизируемые основные аминокислоты. Гистидин, лизин и аргинин имеют атом азота, который, в отличие от азота триптофана, ионизируется в диапазоне pH, обнаруженном в клетке.Гистидин имеет 5-членное имидазольное кольцо. Один из двух ионов азота имеет pK и около 7,0. Это означает, что при нейтральных значениях pH, обнаруженных в клетках, около половины молекул гистидина будут иметь протонированные боковые цепи (то есть с положительным зарядом), а около половины будут иметь непротонированные и незаряженные боковые цепи. Гистидин часто используется в ферментах для связывания и высвобождения протонов во время ферментативной реакции.
Лизин и аргинин почти полностью ионизируются при значениях pH, обнаруженных в клетке.PK a лизина больше 9; следовательно, он будет протонирован в клетке на> 99%. Боковая цепь аргинина еще более проста; его pK a составляет> 12. Следовательно, эти аминокислоты имеют общий положительный заряд в клетке.
Карбоксиллатсодержащие аминокислоты. Аспарагиновая кислота и аспарагин имеют четыре атома углерода; глутаминовая кислота и глутамин имеют всего пять атомов углерода. Аспарагиновая кислота имеет карбоксилловую кислоту, а аспаргин имеет амидную боковую цепь.Точно так же глутаминовая кислота имеет боковую группу карбоксилловой кислоты, а глутамин имеет амидную группу. Значения pK и карбоксильных групп боковой цепи в аспартате и глутамате составляют около 4,0. Следовательно, эти группы боковых цепей почти полностью ионизируются в нейтральных условиях, характерных для клеток, и имеют отрицательный заряд.
Серин и цистеин можно рассматривать как родственники аланина. Серин — это аланин с гидроксильной (–ОН) группой, а цистеин — это аланин с сульфгидрильной (–SH) группой.
Треонин имеет четыре атома углерода с гидроксильной группой на бета-углероде. Бета-углерод находится рядом с углеродом, содержащим альфа-углерод (у альфа-углерода есть аминогруппа). Присутствие гидроксильной группы в треонине означает, что бета-углерод треонина оптически активен в дополнение к альфа-углероду. Как следует из названия, группа –ОН имеет конфигурацию D или трео по отношению к альфа-углероду. (Другая возможная стереохимия — это эритроцит — подумайте о букве E, чтобы запомнить этот термин.Плечи буквы E указывают в том же направлении.)
Метионин имеет метильную группу на своей сере. В основе метионина на один атом углерода больше, чем у цистеина. (Цистеин с дополнительным углеродом называется гомоцистеином ; гомоцистеин является промежуточным звеном в биосинтезе метионина.)
Пролин — самый необычный среди аминокислот. Он имеет четыре атома углерода, причем альфа-аминогруппа связана не только с альфа-углеродом, но и с последним углеродом боковой цепи.Циклическая боковая цепь означает, что пролин конформационно жесткий. То есть углерод-углеродные связи пролина не вращаются в растворе. Другие аминокислоты более гибкие в растворе.
Пептидная связь. Пептидная связь соединяет карбоксильные и аминогруппы аминокислот. При активации карбоновые кислоты и амины образуют амидов . Аминокислоты являются бифункциональными , причем каждая аминокислота имеет как аминогруппы, так и карбоксильные группы. Пептиды состоят из аминокислот, соединенных «голова к хвосту» амидными связями.Пептиды классифицируются по длине цепи. Олигопептиды короче, чем полипептидов, , хотя не существует определенного перехода между двумя формами. Соединение аминокислот в пептидную связь происходит формально (хотя механизм ее образования более сложен) следующим образом:
Обратите внимание, что две аминокислоты могут образовывать дипептид (пептид, состоящий из двух единиц) любым из двух способов. Например, глицин и аланин могут образовывать глицилаланин (gly-ala) или аланилглицин (ala — gly):
Независимо от того, какое расположение происходит, каждый дипептид будет иметь одну свободную аминогруппу и одну свободную карбоксильную группу.Пептидные последовательности написаны в направлении от амино к карбоксильному концу.
Структура пептидной связи . Структура пептидной связи благоприятствует копланарным атомам N, C и O. Хотя пептидная связь формально является одинарной связью углерод-азот, неспаренные электроны на карбоксильном кислороде и на азоте могут перекрываться через свои пи-орбитали, чтобы сделать трехатомную систему частично двойной по характеру. Система с частично двойной связью затрудняет вращение пептидной связи в растворе.В результате пептидные связи могут существовать в одном из двух конформационных изомеров , с двумя атомами углерода, цис- или транс-друг с другом.
Обычно предпочтение отдается транс-конформации. Пролин — исключительный случай, потому что его пептидная связь не содержит водорода, что затрудняет замену цис- и транс-изомеров один на другой:
Пролин обычно находится в транс-изомере, хотя превращение (изомеризация) между цис- и транс-формами может катализироваться специфическими ферментами.
Аминокислоты — Школа биомедицинских наук Wiki
Из Вики Школы биомедицинских наук
Аминокислоты являются строительными блоками белков — они создают первичную структуру белков. Есть 20 природных аминокислот. Аминокислоты существуют в белках в виде L-оптических изомеров, однако они могут существовать в виде D-изомеров в отдельных примерах, например стенки некоторых бактериальных клеток содержат D-изомеры.Когда две аминокислоты соединяются, они образуют пептидную связь. Эта связь работает как частичная двойная связь, заставляя аминокислоты иметь цис / транс-изомеры. Хотя чаще всего встречается в транс. Все аминокислоты являются амфотерными, что означает, что они могут действовать и как основание, и как кислота благодаря своим амино- и карбоксильным группам соответственно [1] .
Аминокислоты — это мономеры, из которых состоят белки, вступая в реакции конденсации с образованием пептидных связей между собой. Когда аминокислота является частью белка, она называется аминокислотным остатком, у нее такая же боковая цепь, но это альфа-аминокислота, и карбоксильные группы теперь являются частью пептидных связей.Все аминокислоты имеют группу альфа-карбоновой кислоты, группу альфа-амина и атом водорода, связанный с центральным углеродом вместе с четвертой вариабельной группой. Эта группа включает 20 незаменимых аминокислот и обычно позволяет аминокислотам проявлять стериоизомерию для создания оптических изомеров D и L. Единственным исключением из этого правила является простейшая аминокислота глицин, вариабельная группа которой представляет собой другой атом водорода. Это предотвращает стериоизомерию, поскольку нет четырех разных групп, связанных тогда с центральным углеродом — нет хирального центра [2] .
Аминокислоты также можно охарактеризовать как полярные или неполярные, и они определяют функцию аминокислот. В ядре белка содержится 10 неполярных аминокислот и 10 полярных аминокислот. Они выполняют ферментативную роль и могут использоваться для связывания ДНК, металлов и других природных лигандов. Есть незаменимые аминокислоты и заменимые аминокислоты. Незаменимые аминокислоты — это те аминокислоты, которые организм не может синтезировать самостоятельно. Незаменимыми аминокислотами в организме человека являются: гистидин, лейцин, изолейцин, лизин, метионин, валин, фенилаланин, тирозин и триптофан [3] .Эти аминокислоты должны поступать в организм через переваренные белки, которые затем всасываются в кишечнике и транспортируются с кровью туда, где они необходимы [4] . Переваривание клеточных белков также является важным источником аминокислот. Незаменимые аминокислоты могут быть синтезированы из соединений, уже существующих в организме, например, как серин синтезируется из глицина [5] .
Аминокислоты сокращены до трехбуквенного и однобуквенного кодов.Например, глицин имеет трехбуквенный код «Gly» и букву «G» (см. Однобуквенные коды аминокислот).
В таблице ниже перечислены 20 аминокислот, их однобуквенный код, трехбуквенный код, их заряды и полярность боковой цепи:
Все аминокислоты имеют карбоксильный конец (называемый С-концом) и аминный конец (называемый N-концом), но они различаются своими остаточными группами. Аминокислоты связаны ковалентной связью, называемой пептидной связью [6] .Аминокислоты содержат как карбоксильную группу (COOH), так и аминогруппу (NH 2 ). Основная аминокислотная структура:
Изображение: см. Исх. № [7] .
Где (R) — боковая цепь, уникальная для каждой отдельной аминокислоты. Большие аминокислоты образуют жесткую область основной цепи полипептида, в то время как маленькие аминокислоты образуют гибкие области полипептида, позволяя белку складываться в его трехмерную форму. На основе пептида имеется гибкое вращение вокруг пептидной связи, и имеется жесткий плоский пептид, который образован частичной двойной связью.Это то, что позволяет первичной последовательности полипептидов складываться в альфа-спираль, которая представляет собой одну спиральную цепь. Бета-нить — это две нити, скрученные в антипараллельную спираль. Ядро полипептида состоит из гидрофобных аминокислот, таких как фениаланин, тирозин и триптофан [8] . Эти три аминокислоты также являются ароматическими и являются самыми крупными аминокислотами. Другие гидрофобные аминокислоты, но не ароматические: пролин, валин, изолейцин, лейцин и метионин.
Аминокислоты называют хиральными из-за того, что альфа-углерод связан с четырьмя различными группами.Они могут существовать как одно из двух зеркальных отображений, называемых левовращающим L-изомером и правовращающим D-изомером, с присутствием только L-формы аминокислотного изомера в белках [9] .
Аминокислоты в растворе при нейтральном pH существуют преимущественно в виде диполярных ионов или цвиттерионов. В диполярной форме аминогруппа протонирована, а карбоксильная группа депротонирована. Состояние ионизации аминокислоты варьируется в зависимости от pH [10] . Ряд аминокислот, соединенных пептидными связями, образуют полипептидную цепь, и каждая аминокислотная единица в пептиде называется остатком.Две аминокислоты могут подвергаться реакции конденсации с образованием дипептида, сопровождающейся потерей молекулы воды [11] .
Обычные аминокислоты сгруппированы в соответствии с их боковыми цепями [12] . Например, кислотный, основной, незаряженный полярный и неполярный.
Для основных боковых цепей аминокислоты: лизин (K), аргинин (R) и гистидин (H).
Для кислотных боковых цепей аминокислотами являются: аспарагиновая кислота (D) и глутаминовая кислота (E) (образованные присоединением протона к аминокислотам аспартату и глутамату).
Для незаряженных полярных боковых цепей аминокислотами являются: аспарагин (N), глутамин (Q), серин (S), треонин (T) и тирозин (Y).
Для неполярных боковых цепей аминокислоты: аланин (A), валин (V), лейцин (L), изолейцин (I), пролин (P), фенилаланин (F), метионин (M), триптофан. (W), Глицин (G) и Цистеин (C).
Пролин (П)
Пролин также известен как аминокислота. который обычно содержится в белках животного происхождения. Он не важен для питания человека, поскольку может синтезироваться в организме из глутаминовой кислоты [13] .В отличие от других аминокислот, которые трансформируются в полипептиды, пролин может существовать в цис-форме в пептидах. Пролин часто находится в конце α-спирали или в виде витков или петель [14] . Пролин — единственная циклическая аминокислота. Это связано с тем, что пролин имеет нечетную циклическую структуру, когда он образует пептидные связи, он вызывает изгиб в аминокислотной цепи. Следовательно, пролин также известен как разрушитель альфа-спирали (другим разрушителем альфа-спирали является глицин) [15] .
Аминокислоты в переводе
Во время трансляции мРНК аминокислоты связываются с рибосомой, когда она считывает мРНК, и, используя предоставленную информацию, он производит конкретную аминокислотную последовательность, образуя пептидные связи между карбоксильной группой одной аминокислоты и аминогруппой другой посредством реакция конденсации.Это производит полипептидную цепь. Субъединица 30S сначала связывается с мРНК, а субъединица 50S связывается второй с образованием инициаторного комплекса 70S [16] .
Цистеин (С)
Аминокислота цистеин имеет множество применений и играет важную роль в структуре белка. В основном это связано с его тиоловой группой. Тиол (состоящий из атома серы и водорода) очень чувствителен к окислению, что позволяет цистеину образовывать дисульфидные связи с другими молекулами, включая другие цистеины.Полученный продукт двух связанных цистеинов называется цистином. При связывании с другими цистеинами дисульфидная связь значительно увеличивает стабильность белка. Однако, поскольку это реакция окисления, она является исключительной для внеклеточных белков за некоторыми исключениями. Это связано с тем, что внутренняя часть ячейки сильно восстанавливается, что делает дисульфидную связь очень нестабильной.
Ароматические аминокислоты
Ароматические аминокислоты являются самыми крупными аминокислотами и включают: фенилаланин (F), тирозин (Y) и триптофан (W).Все они могут поглощать ультрафиолетовый свет, однако некоторые из них могут поглощать больше, чем другие, тирозин и триптофан поглощают больше, чем фенилаланин, что означает, что триптофан является основной молекулой, которая поглощает свет в белке. Ароматические аминокислоты также гидрофобны, поэтому они расположены в ядре белка, поэтому они не находятся рядом с водой. Люди не могут синтезировать фенилаланин или триптофан, а могут производить тирозин только из фенилаланина. Это означает, что ароматические аминокислоты являются жизненно важным компонентом нашей диеты, поскольку они необходимы нам в определенных белках, но мы не синтезируем их сами.Ароматические аминокислоты содержат ароматическое кольцо [17] . Дефицит фенилаланина может вызвать спутанность сознания, депрессию, недостаток энергии и снижение внимания. Его можно купить в форме таблеток, чтобы восполнить любой дефицит [18] . Неспособность расщепить избыток фенилаланина называется фенилкетонурией. Для борьбы с этим используется диета с низким содержанием фенилаланина, в которой избегают подсластителей аспартама, которые напоминают фенилаланин и могут расщепляться с его образованием.
Список литературы
- ↑ Аминокислоты [Интернет].Биология LibreTexts. 2013 [цитировано 4 декабря 2018 года]. Доступно по адресу: https://bio.libretexts.org/LibreTexts/University_of_California_Davis/BIS_105%3A__Biomolecules_and_Metabolism_%28Murphy%29/Proteins/Amino_Acids#Characteristics
- ↑ Джереми М. Берг, Джон Л. Тимочко, Грегори Дж. Гатто младший, Луберт Страйер, Биохимия, 8-е издание Freeman
- ↑ Берг Дж., Тимочко Дж. И Страйер Л. (2007) Биохимия, 6-е издание, Нью-Йорк: W.H. Фримен и компания, стр. 650.
- ↑ Берг Дж., Тимочко Дж. И Страйер Л.(2007) Биохимия, 6-е издание, Нью-Йорк: W.H. Фримен и компания, стр. 650.
- ↑ Капалка Г. Тревожные расстройства. Пищевые и лечебные травы для детей и подростков. 2010;: 219-258.
- ↑ Alberts, B et al. (2008). Молекулярная биология клетки. 5-е изд. США: Наука о гирляндах. 1268. (стр.59)
- ↑ http://www.nutrientsreview.com/proteins/amino-acids
- ↑ Дж. М. Берг, Дж. Л. Тимочко, Л. Страйер, (2007) Биохимия, 6-е издание, Нью-Йорк: У. Х. Фриман и компания (стр. 27).
- ↑ Берг Дж. Тимочко Дж. Страйер Л., Биохимия, шестое издание (2007, WH Freeman, Нью-Йорк (стр. 27)
- ↑ Дж. М. Берг, Дж. Л. Тимочко, Л. Страйер, (2007) Биохимия, 6-е издание, Нью-Йорк: У. Х. Фриман и компания (стр. 27)
- ↑ http://www.sciencedaily.com/terms/peptide_bond.htm
- ↑ Alberts, B et al. (2008). Молекулярная биология клетки. 5-е изд. США: Наука о гирляндах. (Стр.127) .
- ↑ глутаминовая кислота
- ↑ http://www.biology.arizona.edu/biochemistry/problem_sets/aa/proline.HTML
- ↑ https://www.khanacademy.org/test-prep/mcat/biomolecules/amino-acids-and-proteins1/v/special-cases-histidine-proline-glycine-cysteine
- ↑ Берг Дж., Тимочко Дж., Страйер Л. (2007) Биохимия, шестое издание, Нью-Йорк: У. Х. Фриман и компания (стр. 34)
- ↑ Университет Аризоны. (2003). Ароматические аминокислоты. Доступно: http://www.biology.

